青脆李(Prunus salicina Lindell cv.‘Qingcui’)为核果类蔷薇科植物,酸甜可口,美味多汁,含有丰富的糖、酸、维生素、氨基酸等营养物质[1],是重庆地区重要的经济性鲜食水果之一。但青脆李是典型的呼吸跃变型果实,成熟于高温高湿的夏季,呼吸代谢旺盛,在采后贮藏、流通过程中极易软化并被病原微生物侵染[2-3],带来巨大的经济损失。其中,最为严重的是由美澳型核果链核盘菌[Monilinia fructicola(Winter)Honey]引起的褐腐病[4],M.fructicola通过产生细胞壁降解酶,加速果实软化,为病原菌侵染提供有利条件。目前,使用化学杀菌剂可以有效延缓果实软化,控制李果实采后病害发生[3,5],但由于化学农药广泛使用带来的药物残留、潜在的健康危害和环境污染等问题日益突出,因而迫切需要寻找安全、高效的李果实采后病害控制方法。研究发现,通过外源物质处理可以延缓果实软化,并诱导果实采后抗病性,进而抑制果实采后病害发生、稳定其采后品质[6-11]。
阿拉伯半乳聚糖是从植物细胞壁中获得的一种活性多聚糖,是阿拉伯半乳聚糖蛋白(arabinogalactan proteins, AGPs)的重要组成部分[7]。研究发现,果实细胞壁强度和软化进程与AGPs的特异排列有关[8],另一方面,AGPs在植物-病原体相互作用期间可以建立防止病原菌感染的机械屏障[9],在真菌病害期间AGPs的变化可以证实其参与防御病原体侵袭果实[10]。以上研究说明AGPs可以延缓果实软化、防治真菌侵染果实。实验室前期研究发现,5 g/L AG处理可以延缓青脆李果实软化,提高果实耐贮性[6],但其对青脆李果实采后病害控制效果及作用机理尚不清楚。因此,本实验拟通过研究5 g/L AG处理对采后青脆李果实腐烂率、酚酸含量、抗病相关酶活力及相关基因表达量的影响,初步说明AG处理控制青脆李采后病害发生的效果及其可能的作用机理,为AG在青脆李采后病害防治中的应用提供理论参考。
1 材料与方法
1.1 材料与试剂
青脆李采自重庆市巫山县果园,采后当天送回实验室处理。剔除畸形果、病果、机械损伤果,挑选大小均匀且成熟度一致的青脆李摊平去除田间热,于20 ℃、相对湿度80%~90%条件贮藏。
褐腐病病原菌(M.fructicola)从发病李果实上分离,经纯化、测序后鉴定为美澳型核果链核盘菌(M.fructicola),并置于4 ℃保存。
琼脂粉(生物级)、葡萄糖(分析纯),成都科龙化工试剂厂;阿拉伯半乳聚糖(食品级)、甲醇、乙腈、原儿茶酸、绿原酸、对香豆酸、咖啡酸、丁香酸、芦丁(均为色谱纯),上海源叶生物科技有限公司。
1.2 仪器与设备
SW-CJ-1F超净工作台,苏净集团安泰有限公司;BXM30R立式自动压力蒸汽灭菌锅,重庆思美特科技有限公司;DHP-9082电热恒温培养箱,上海齐欣科学仪器有限公司;DW-HL528型超低温冷冻储存箱,中科美菱低温科技股份有限公司;Avanti TM J-30I高速冷冻离心机,美国Beckman公司;SYNERGYH1MG全自动酶标仪,美国Bio Tek公司;LC-20A高效液相色谱仪,日本岛津公司;B203生物显微镜,重庆奥特光学仪器有限公司。
1.3 实验方法
1.3.1 M.fructicola孢子悬浮液的制备
M.fructicola于马铃薯葡萄糖琼脂(potato dextrose agar, PDA)培养基25 ℃培养7 d,用无菌水在无菌条件下冲洗M.fructicola孢子,过滤得到高浓度孢子悬浮液,使用血球计数板计数,用无菌水将孢子悬浮液浓度稀释至1×105 CFU/mL,现配现用。
1.3.2 AG处理对M.fructicola的离体抑菌效果
培养基配制及离体实验参考令阳等[11]的方法,并略有修改。将AG溶于无菌水配制成质量浓度为100 g/L的母液,在无菌条件下将其稀释成1、10、20、30、40、50 g/L,并在无菌条件下各取10 mL,分别加入到含有90 mL灭菌后未凝固的PDA培养基中,充分摇匀制成AG最终质量浓度为0.1、1、2、3、4、5、10 g/L的培养基,以添加10 mL无菌水的PDA培养基作为对照组。
菌落直径的测定参考ZHANG等[12]的方法,并略有修改。将配制好的含不同质量浓度AG的PDA培养基倒入平板中,待培养基凝固后,在平板中间接种培养7 d且取自M.fructicola菌落边缘直径为6 mm的菌饼。将接种后的平板置于25 ℃恒温培养箱中培养,每天观察菌丝的生长状况,并用十字交叉法测定菌落直径。实验重复3次。
1.3.3 青脆李采后浸泡处理及取样方法
参考曾昌平等[7]的方法,挑选成熟度一致,大小均匀的青脆李果实,将其分为2组,一组在5 g/L AG中浸泡10 min,一组在清水中浸泡10 min,常温下晾干,并于20 ℃、相对湿度80%~90%条件下贮藏。
取样方法:分别于贮藏的第0、1、2、3、6、9、12、15天取去除果皮后的赤道处果肉,液氮处理后放置在-80 ℃条件下,用于后续指标测定。实验重复3次。
1.3.4 AG处理对青脆李采后褐腐病的控制效果
参考MU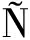 OZ等[13]的方法,并略有修改。将青脆李分成3组,每组10个果实,分组后用75%乙醇擦拭青脆李表面,自然风干后,用1 mL无菌枪头在赤道处打两个等距的孔(深3 mm、直径3 mm)。待表面汁液吸收后,分别向孔中接入10 μL新鲜M.fructicola孢子悬浮液(1×105 CFU/mL)。液体全部吸收后用聚乙烯薄膜进行单果包装,放置在20 ℃、相对湿度80%~90%的环境中。分别记录接种2~5 d时的发病率并用十字交叉法测量病斑直径。实验重复3次。果实发病率的计算如公式(1)所示:
OZ等[13]的方法,并略有修改。将青脆李分成3组,每组10个果实,分组后用75%乙醇擦拭青脆李表面,自然风干后,用1 mL无菌枪头在赤道处打两个等距的孔(深3 mm、直径3 mm)。待表面汁液吸收后,分别向孔中接入10 μL新鲜M.fructicola孢子悬浮液(1×105 CFU/mL)。液体全部吸收后用聚乙烯薄膜进行单果包装,放置在20 ℃、相对湿度80%~90%的环境中。分别记录接种2~5 d时的发病率并用十字交叉法测量病斑直径。实验重复3次。果实发病率的计算如公式(1)所示:
果实发病率![]()
(1)
1.3.5 酚酸含量测定
样品制备参考ZHANG等[14]的方法,并略有修改。取1.5 g青脆李果肉在液氮中研磨成粉末,加入15 mL提取液(体积比为甲醇∶甲酸∶水=95∶4∶1),40 KHz下超声处理10 min后,4 ℃下8 000 r/min离心10 min,提取2次,合并上清液,共30 mL,用旋转蒸发仪蒸干,加1.5 mL甲醇溶解,过0.22 μm的有机滤膜,于-20 ℃条件下保存待测定。
酚酸含量的测定参考陈力维等[15]的方法。使用光电二极管阵列紫外可见光检测器,流动相A、B分别为1%(体积分数)甲酸、乙腈;洗脱梯度为0~5 min 3%~9% B;5~15 min 9%~16% B;15~45 min 16%~50% B;45~55 min 50% B;55~60 min 50%~3% B;60~62 min 3% B;流速为1 mL/min;使用SHIMADZU Shim-pack OIST C18(4.6 mm×250 mm,5 μm)色谱柱,柱温25 ℃;进样量20 μL。根据保留时间和吸收光谱与标准品对照定性,外标法定量。基于鲜重,酚类物质含量用μg/g表示。实验重复3次。
1.3.6 抗病相关酶活力的测定
过氧化物酶(peroxidase, POD)活力测定参考柴秀伟等[16]的方法,以470 nm处吸光值每分钟变化1为一个酶活力单位(U)。多酚氧化酶(polyphenol oxidase, PPO)活力测定参考张菊华等[17]的方法,以410 nm处吸光值每分钟变化1为一个酶活力单位(U)。β-1,3-葡聚糖酶(β-1,3-glucanase, GLU)和几丁质酶(chitinase, CHI)活力测定参考曹建康等[18]的方法。以每克果实每秒钟产生1×10-9葡萄糖为 1个β-1,3-葡聚糖酶活力单位(U),以每克果实每秒钟产生1×10-7 mol N-乙酰葡萄糖胺为1个几丁质酶活力单位(U)。实验重复3次。
1.3.7 相关基因表达量的测定
委托广州基迪奥生物科技有限公司对贮藏0、3、6 d的青脆李果实样品进行转录组测序,使用DESeq2分析组间的差异基因,以|Log2(样本间表达量差异倍数)|>1且P<0.05作为筛选差异基因的标准。
1.4 数据分析
数据统计使用Excel 2019软件,绘图使用Origin 2021软件,方差分析使用SPSS 26.0软件中的Duncan’s多重比较和独立样品t检验,P<0.05表示差异显著。
2 结果与分析
2.1 AG处理对 M.fructicola的控制效果
2.1.1 离体条件下AG对M.fructicola的控制情况
如图1所示,在含有不同质量浓度AG的培养基中,M.fructicola菌落直径均随着培养时间的延长呈上升趋势。同一培养时间,0.1、1、2、3、4、5、10 g/L AG处理组菌落直径与对照组相比均没有显著性差异(P>0.05),对照组与处理组的菌丝形态一致。以上结果说明,AG对褐腐病病原菌无直接抑制和杀灭作用。
a-菌落直径;b-培养5 d时的菌丝生长图片
图1 AG处理对M.fructicola菌落直径的影响
Fig.1 Effect of AG treatment on M.fructicola colony diameter
注:1~8分别表示对照组和0.1、1、2、3、4、5、10 g/L阿拉伯半乳聚糖处理组;对于同一培养时间,不同处理组间字母不同表示差异显著(P<0.05)。
2.1.2 异孔损伤接种条件下AG对M.fructicola的控制情况
异孔损伤接种后,青脆李果实发病率、病斑直径变化情况及自然条件下贮藏时果实腐烂率的结果如图2所示。AG处理可以延缓青脆李病害发生及病斑扩张进度,降低自然条件贮藏下青脆李果实腐烂率。如图2-a所示,损伤接种后病斑直径均随接种时间的延长呈上升趋势,但AG处理可以显著降低病斑直径的扩张速度。接种后第3、4天时,AG处理组病斑直径显著小于对照组(P<0.05)。如图2-b所示,接种后第3、5天时,AG处理组青脆李发病率显著低于对照组(P<0.05)。3 d时,对照组发病率为95%,AG处理组发病率为58.33%,差异显著(P<0.05)。如图2-d所示,自然贮藏条件下,贮藏12~18 d内AG处理组腐烂率显著低于对照组(P<0.05),其中,贮藏12 d时对照组果实腐烂率为处理组的2.13倍。以上结果说明,AG处理可以显著延缓青脆李果实病害的发生,其对青脆李病害的控制可能主要与其对果实的诱导抗病性形成有关。

a-病斑直径;b-发病率;c-青脆李接种M.fructicola后的图片;d-自然贮藏时青脆李腐烂率
图2 AG处理对青脆李采后褐腐病的控制效果
Fig.2 Effect of AG treatment on the control of postharvest brown rot of Qingcui plum
注:A-对照组;B-AG处理组;1~6分别表示接种后0、1、2、3、4、5 d;相同贮藏时间、不同处理组小写字母不同表示差异显著(P<0.05)(下同)。
2.2 AG处理对青脆李果实抗病性的影响
2.2.1 AG处理对青脆李酚酸含量的影响
酚酸类物质是一种普遍存在于高等植物体内的重要次生代谢产物,与果蔬采后抗病性密切相关,酚酸类物质的积累对植物的多种病原菌具有抑制作用[19]。研究发现,通过外源处理可以促进植物次生代谢,积累酚酸类物质从而提高果蔬的抗病性[20-21],减少果蔬采后病害的发生。
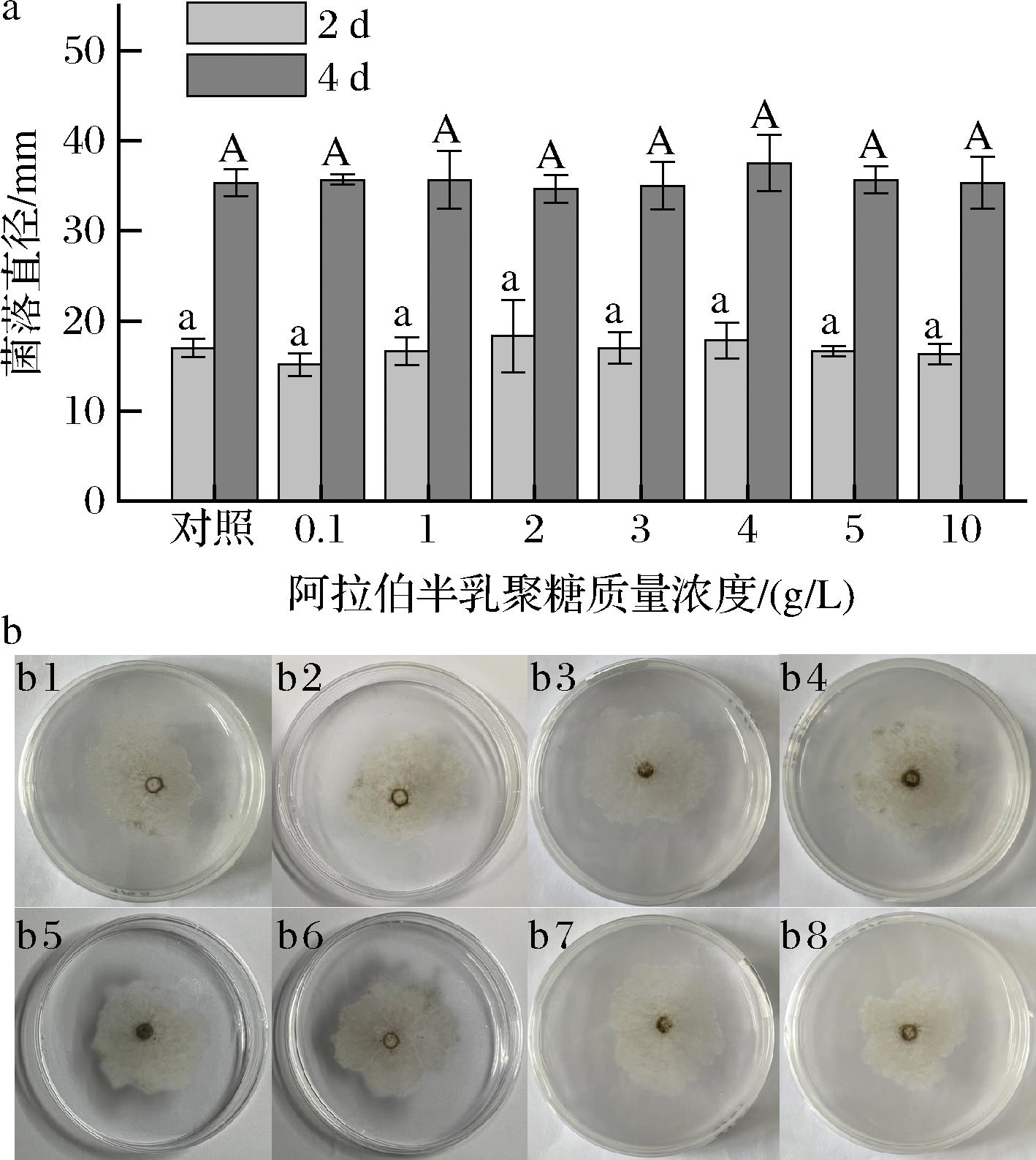
如图3-a所示,在贮藏期内,对照组的原儿茶酸含量总体呈现缓慢上升趋势,AG处理组的原儿茶酸含量总体先上升后下降。AG处理使青脆李的原儿茶酸含量总体上处于较高水平,在贮藏9~15 d时,AG处理组的原儿茶酸含量显著高于对照组(P<0.05),且在贮藏12 d时,AG处理组的原儿茶酸含量是对照组的2.31倍,差异显著(P<0.05)。
a-原儿茶酸质量分数;b-绿原酸质量分数;c-咖啡酸质量分数;d-丁香酸质量分数;e-对香豆酸质量分数;f-芦丁质量分数
图3 AG处理对青脆李酚酸含量的影响
Fig.3 Effect of AG treatment on the content of phenolic acid in Qingcui plum
如图3-b所示,在贮藏期内,绿原酸含量均随贮藏时间的延长呈上升趋势,AG处理使青脆李中绿原酸含量保持在较高水平,在贮藏6~15 d时,AG处理组的绿原酸含量显著高于对照组(P<0.05),在贮藏15 d时,AG处理组的绿原酸含量比对照组高44.86%,差异显著(P<0.05)。
如图3-c所示,在贮藏期内,咖啡酸含量均随贮藏时间的延长呈上升趋势,AG处理使青脆李中咖啡酸含量保持在较高水平,在贮藏1、3、9~12 d时,AG处理组的咖啡酸含量显著高于对照组(P<0.05)。
如图3-d所示,在贮藏期内,对照组丁香酸含量呈上升趋势,而AG处理组丁香酸含量呈现波动上升的趋势。在1~12 d内,AG处理使青脆李中丁香酸含量保持在较高水平,且在1~6、12 d时,AG处理组丁香酸含量显著高于对照组(P<0.05),在3 d时,AG处理组丁香酸含量比对照组高55.95%,差异显著(P<0.05)。
如图3-e所示,在贮藏期内,AG处理组和对照组对香豆酸含量均随贮藏时间的延长呈先上升后下降再上升的趋势。且在1~15 d,AG处理组对香豆酸含量均显著高于对照组(P<0.05),在贮藏3 d时,AG处理组的对香豆酸含量比对照组高24.82%,差异显著(P<0.05)。
如图3-f所示,在贮藏期内,对照组芦丁含量呈上升趋势,AG处理组芦丁含量在0~12 d呈上升趋势,12~15 d呈下降趋势。但AG处理组的芦丁含量在贮藏期内始终高于对照组,在1 d和3~15 d时AG处理组的芦丁含量显著高于对照组(P<0.05),其中贮藏12 d时,AG处理组中芦丁含量是对照组的1.29倍,差异显著(P<0.05)。
以上结果说明,AG处理可以提高果实酚酸含量,AG处理提高青脆李抗病性、延缓采后病害发生可能与其促进果实中酚酸物质积累有关。
2.2.2 AG处理对青脆李POD、PPO活力的影响
POD参与果实中木质素的合成及代谢,是苯丙烷代谢途径中的关键酶,在果实贮藏中起防御作用,同时PPO和POD可以氧化果实中酚类物质,通过产生有毒的醌类物质抑制病原菌的侵染。研究发现,POD、PPO活力的升高是植物抗病性增强的反应[22],果蔬中PPO、POD活力的提高可以促进抗病相关物质的积累,从而降低果实病害的发生[23-24]。
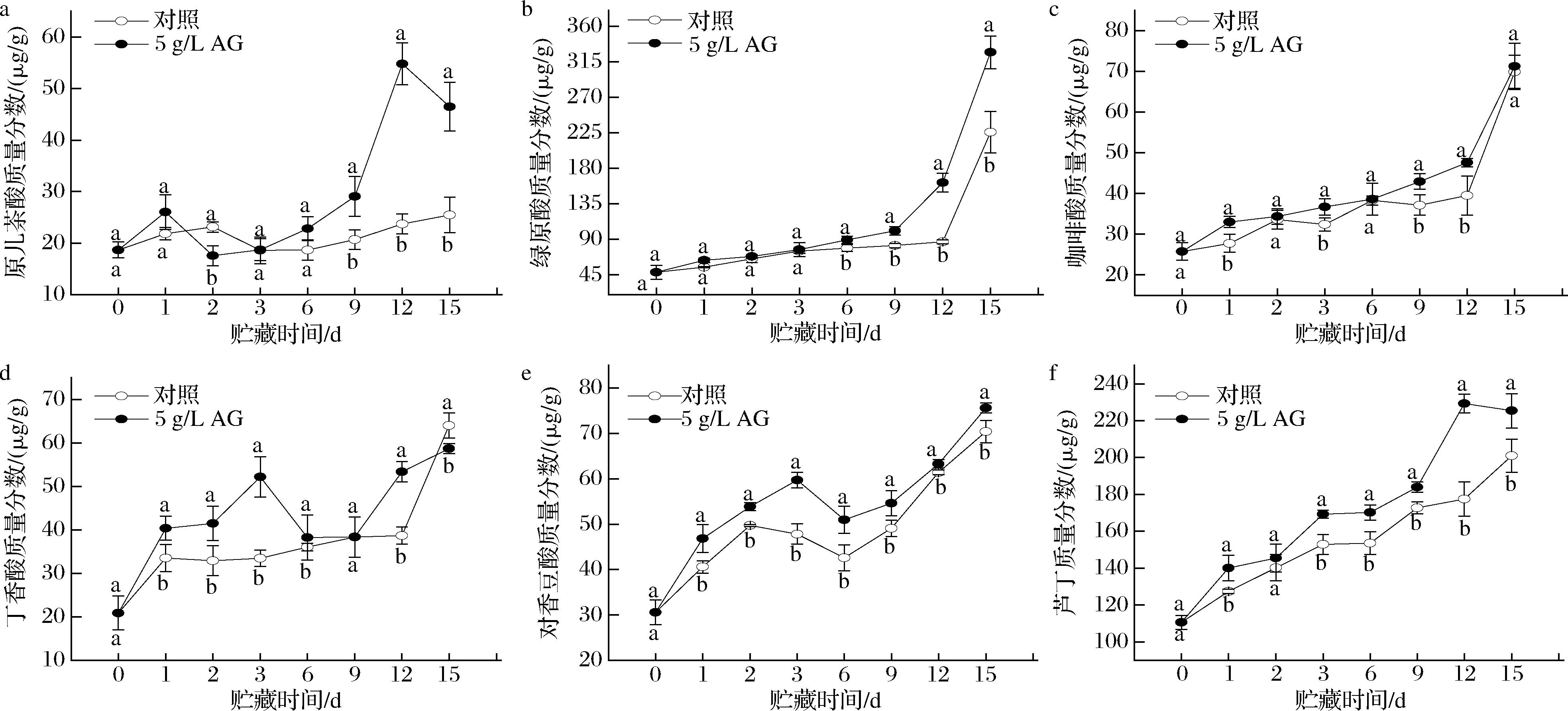
如图4-a所示,在贮藏期内,对照组和AG处理组POD活力均呈现出先上升后下降趋势。与对照组果实比较,AG处理组青脆李的POD活力在1~15 d内均显著高于对照组(P<0.05),其中在贮藏1 d时,处理组POD活力比对照组果实高70.6%,差异显著(P<0.05)。
a-POD活性;b-PPO活力
图4 AG处理对青脆李POD、PPO活性的影响
Fig.4 Effect of AG treatment on POD and PPO activity in Qingcui plum
如图4-b所示,在贮藏期内,对照组PPO活力呈现先下降后上升再下降趋势,AG处理组呈现先上升再下降的趋势。但AG处理组的PPO活力在1~15 d内均显著高于对照组(P<0.05),在贮藏6 d时,AG处理组的PPO活力是对照组的1.26倍,差异显著(P<0.05)。
2.2.3 AG处理对青脆李GLU、CHI活力的影响
CHI、GLU是重要的病程相关蛋白(pathogensis-related proteins, PR蛋白)。CHI、GLU可以分别降解病原菌细胞壁的主要成分—几丁质、β-1,3-葡聚糖,从而抑制病原菌的生长[25]。研究发现,李果实中GLU、CHI活力处于较高水平时可以有效降解M.fructicola的细胞壁,从而降低李果实褐腐病的发生[2,9]。
如图5-a所示,在贮藏期内,对照组和AG处理组GLU活力均呈现先上升后下降的趋势,同时在1~15 d内AG处理组青脆李的GLU活力均显著高于对照组(P<0.05),在贮藏1 d时AG处理组GLU活力为对照组的2.16倍,差异显著(P<0.05)。
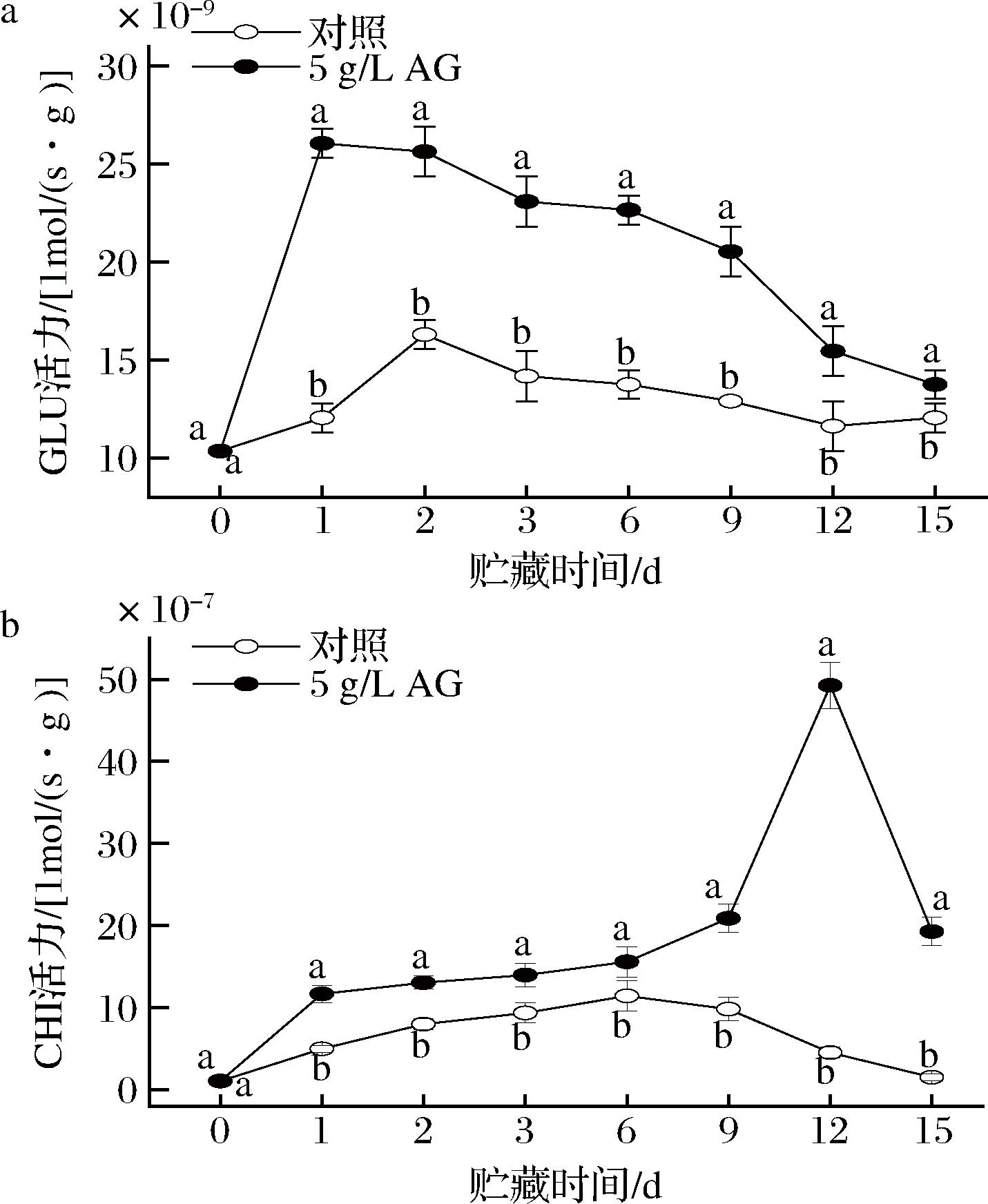
a-GLU活力;b-CHI活力
图5 AG处理对青脆李GLU、CHI活力的影响
Fig.5 Effect of AG treatment on GLU and CHI activity in Qingcui plum
如图5-b所示,在贮藏期内,对照组和AG处理组CHI活力均呈现先上升后下降的趋势,同时在贮藏1~15 d内AG处理组青脆李的CHI活力都显著高于对照组(P<0.05),且在贮藏12 d时AG处理组CHI活力为对照组的10.92倍,差异显著(P<0.05)。
2.2.4 AG处理对青脆李抗病相关基因表达量的影响
AG处理后青脆李抗病物质的积累可能是相关基因调控所致,因此,本研究进一步关注了抗病相关基因表达量的变化情况。如图6-a和图6-b所示,与对照组相比,AG处理组与PPO、CHI活力有关的基因表达量保持在较高水平,表明AG处理能够通过调控相关基因的表达量提升其抗病相关酶活力。病程相关蛋白基因与引起植物体诱导抗病性响应相关,病程相关蛋白1基因(pathogenesis-related gene 1, PR1)是植物系统获得抗性的标志性基因。如图6-c所示,随贮藏时间延长,PR1基因表达量均为先上升后下降趋势,AG处理组基因表达量一直处于较高水平,且6 d时显著高于对照组(P<0.05)。以上结果说明,AG处理通过影响抗病相关基因表达量,进而影响抗病相关物质的积累以及酶的活力,最终提高青脆李抗病性,达到防治病害发生作用。

a-PPO基因表达量;b-CHI基因表达量;c-PR1基因表达量
图6 AG处理对青脆李基因表达量的影响
Fig.6 Effect of AG treatment on the gene expression level of Qingcui plum
3 结论
以上结果表明,AG对M.fructicola的生长没有直接抑制作用,但5 g/L AG处理可以有效提高抗病相关基因表达量,进而调控青脆李抗病相关酶(POD、PPO、GLU、CHI)活力,其中AG处理对GLU、CHI活力的影响更为显著,故AG处理可能主要通过提高GLU、CHI活力来降解M.fructicola的细胞壁;同时促进青脆李酚酸物质的积累,以增强青脆李采后抗病性,抑制M.fructicola所致的采后病害发生。因此,AG处理主要通过诱导果实抗病性产生,提高青脆李果实对褐腐病的控制作用。AG有望成为一种安全、可行性高的采后处理技术。
[1] 林炎娟, 周丹蓉, 叶新福, 等. 李子保鲜技术研究进展[J]. 东南园艺, 2017, 5(1):43-49.LIN Y J, ZHOU D R, YE X F, et al. Research progress of preservation technology of plum[J]. Southeast Horticulture, 2017, 5(1):43-49.
[2] ZHANG J, LIU J, XIE J, et al. Biocontrol efficacy of Pichia Membranaefaciens and Kloeckera apiculata against Monilinia fructicola and their ability to induce phenylpropanoid pathway in plum fruit[J]. Biological Control, 2019, 129:83-91.
[3] 凡先芳, 张婕, 姚世响, 等. 1-MCP和戊唑醇处理对青脆李果实贮藏期病害和品质的影响[J]. 食品科学, 2016, 37(24):292-298.FAN X F, ZHANG J, YAO S X, et al. Effects of 1-MCP and tebuconazole treatments on disease and quality of “qingcui” plum fruits during storage[J]. Food Science, 2016, 37(24):292-298.
[4] 蔡蜨, 李心丹, 邓丽莉, 等. 抗菌肽PAF26对采后李果实褐腐菌的抑菌效果及机理[J]. 食品科学, 2020, 41(23):221-227.CAI D, LI X D, DENG L L, et al. Antibacterial effect and mechanism of antimicrobial peptide PAF26 on Monilinia fructicola in postharvest plums[J]. Food Science, 2020, 41(23):221-227.
[5] 张晓瑜, 张晓宇, 王艳伟, 等. 过氧乙酸对采后李果实褐腐菌抑制作用的研究[J]. 湖北农业科学, 2015, 54(15):3659-3661.ZHANG X Y, ZHANG X Y, WANG Y W, et al. The inhibition effect of peroxyacetic acid against Monilinia fructicola on harvested plum fruit[J]. Hubei Agricultural Sciences, 2015, 54(15):3659-3661.
[6] LIN Y X, LIN Y F, LIN M S, et al. Propyl gallate postharvest treatment improves the storability of longans by regulating the metabolisms of respiratory and disease-resistance substances[J]. Postharvest Biology and Technology, 2023, 206:112556.
[7] 曾昌平, 汪于波, 李佳艳, 等. 阿拉伯半乳聚糖处理对采后青脆李果实贮藏特性的影响[J]. 食品工业科技, 2023, 44(17):383-391.ZENG C P, WANG Y B, LI J Y, et al. Effects of Arabinogalactan treatment on storage characteristic of postharvest qingcui plum[J]. Science and Technology of Food Industry, 2023, 44(17):383-391.
[8] LESZCZUK A, SZCZUKA E, WYDRYCH J, et al. Changes in Arabinogalactan proteins (AGPs) distribution in apple (Malus x domestica) fruit during senescence[J]. Postharvest Biology and Technology, 2018, 138:99-106.
[9] MARERI L, ROMI M, CAI G. Arabinogalactan proteins: Actors or spectators during abiotic and biotic stress in plants?[J]. Plant Biosystems-an International Journal Dealing with All Aspects of Plant Biology, 2019, 153(1):173-185.
[10] LESZCZUK A, PIECZYWEK P M, GRYTA A, et al. Immunocytochemical studies on the distribution of Arabinogalactan proteins (AGPs) as a response to fungal infection in Malus x domestica fruit[J]. Scientific Reports, 2019, 9(1):17428.
[11] 令阳, 邓丽莉, 姚世响, 等. L-半胱氨酸处理对采后李果实褐腐菌的抑制作用[J]. 食品科学, 2019, 40(9):256-261.LING Y, DENG L L, YAO S X, et al. Inhibitory effect of L-cysteine against Monilinia fructicola on postharvest plum fruit[J]. Food Science, 2019, 40(9):256-261.
[12] ZHANG Z Q, QIN G Z, LI B Q, et al. Effect of cinnamic acid for controlling gray mold on table grape and its possible mechanisms of action[J]. Current Microbiology, 2015, 71(3):396-402.
[13] MU OZ A, L
OZ A, L PEZ-GARC
PEZ-GARC A B, MARCOS J F. Comparative study of antimicrobial peptides to control Citrus postharvest decay caused by Penicillium digitatum[J]. Journal of Agricultural and Food Chemistry, 2007, 55(20):8170-8176.
A B, MARCOS J F. Comparative study of antimicrobial peptides to control Citrus postharvest decay caused by Penicillium digitatum[J]. Journal of Agricultural and Food Chemistry, 2007, 55(20):8170-8176.
[14] ZHANG W N, ZHAO X Y, SUN C D, et al. Phenolic composition from different loquat (Eriobotrya japonica Lindl.) cultivars grown in China and their antioxidant properties[J]. Molecules, 2015, 20(1):542-555.
[15] 陈力维, 令阳, 邓丽莉, 等. L-半胱氨酸处理对采后青脆李果实苯丙烷代谢的影响[J]. 农业工程学报, 2020, 36(13):257-263.CHEN L W, LING Y, DENG L L, et al. Effects of L-cysteine treatment on phenylpropanoid metabolism of postharvest “Qingcui” plum fruit[J]. Transactions of the Chinese Society of Agricultural Engineering, 2020, 36(13):257-263.
[16] 柴秀伟, 孔蕊, 李宝军, 等. 一氧化氮对苹果果实愈伤苯丙烷代谢的影响及生理机制分析[J]. 西北植物学报, 2022, 42(4):619-627.CHAI X W, KONG R, LI B J, et al. Effect of nitric oxide on phenylpropanoid metabolism in healing of apple fruit and analysis of its physiological mechanism[J]. Acta Botanica Boreali-Occidentalia Sinica, 2022, 42(4):619-627.
[17] 张菊华, 王伟, 林树花, 等. 丁香、五味子及壳聚糖复合保鲜剂对蓝莓贮藏品质及抗病酶活的影响[J]. 中国食品学报, 2017, 17(12):139-148.ZHANG J H, WANG W, LIN S H, et al. Effect of cloves, Schisandra chinensis and chitosan compound preservative on storage quality and disease-resistant enzyme activity of blueberries[J]. Journal of Chinese Institute of Food Science and Technology, 2017, 17(12):139-148.
[18] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2007.
[19] 高媛, 马帅, 代敏, 等. 果蔬酚酸生物合成及代谢调控研究进展[J]. 食品科学, 2018, 39(9):286-293.GAO Y, MA S, DAI M, et al. Progress in research on the biosynthesis pathway and metabolic regulation of phenolic acids[J]. Food Science, 2018, 39(9):286-293.
[20] 刘业霞, 付玲, 艾希珍, 等. 嫁接对辣椒次生代谢的影响及其与青枯病抗性的关系[J]. 中国农业科学, 2013, 46(14):2963-2969.LIU Y X, FU L, AI X Z, et al. Effect of grafting on secondary metabolism and its relationship with bacterial wilt resistance in pepper[J]. Scientia Agricultura Sinica, 2013, 46(14):2963-2969.
[21] LI Y F, JI N N, ZUO X X, et al. PpMYB308 is involved in Pichia guilliermondii-induced disease resistance against Rhizopus rot by activating the phenylpropanoid pathway in peach fruit[J]. Postharvest Biology and Technology, 2023, 195:112115.
[22] 丁志祥, 姚永红, 敬廷桃, 等. 植物诱导抗病性及其在果蔬上的初步应用概述[J]. 南方农业, 2016, 10(10):70-73.DING Z X, YAO Y H, JING T T, et al. Plant induced disease resistance and its preliminary application in fruits and vegetables [J]. South China Agriculture, 2016, 10(10):70-73.
[23] 郭欣, 林育钊, 林河通, 等. 壳聚糖处理对西番莲果实感病指数、抗病相关酶活性和抗病物质含量的影响[J]. 食品科学, 2021, 42(15):206-212.GUO X, LIN Y Z, LIN H T, et al. Effect of chitosan treatment on disease index, disease resistant-related enzyme activities and disease resistance-related substance contents in Passiflora caerulea L. fruit during storage[J]. Food Science, 2021, 42(15):206-212.
[24] BIN DUAN, REYMICK O O, LIU Z G, et al. Citral enhances disease resistance in postharvest Citrus fruit through inducing jasmonic acid pathway and accumulating phenylpropanoid compounds[J]. Postharvest Biology and Technology, 2024, 207:112633.
[25] 陈燕玲, 岑光莉, 孙婷婷, 等. 植物几丁质酶和β-1, 3-葡聚糖酶及其协同抗病性研究进展[J]. 农业生物技术学报, 2022, 30(7):1394-1411.CHEN Y L, CEN G L, SUN T T, et al. Progress on plant chitinase and β-1, 3-glucanase and their synergistic function in disease resistance[J]. Journal of Agricultural Biotechnology, 2022, 30(7):1394-1411.