松仁是世界上最重要的坚果品种之一,其脂肪和蛋白质含量十分丰富[1],目前,松仁油已经实现了商业化生产[2],然而榨取松仁油后所得的副产物——松仁粕中约30%~40%的蛋白质未被充分利用,导致了资源浪费。据报道,松仁蛋白中球蛋白(11S、7S)和白蛋白(2S)的含量分别占总蛋白质的75%和15%[3],包含18种氨基酸,必需氨基酸约占氨基酸总量的25%,异亮氨酸、苯丙氨酸等必需氨基酸含量均高于国际卫生组织和联合国粮农组织规定的人体必需量标准[4-5]。研究证明,松仁蛋白具有降血糖[6]、抗疲劳以及抗氧化[7]等多种健康益处。但与动物蛋白相比,天然的松仁蛋白乳化性、起泡性等功能特性较差,在食品加工领域的应用受到限制[4]。
多酚和热处理已被证明是改善蛋白质功能特性的有效手段。多酚结合能够诱导蛋白质结构展开,提高分子柔韧性,从而改善其功能特性[8],FU等[9]研究发现,添加槲皮素降低了豌豆蛋白的表面张力和表面疏水性,乳化性和起泡性分别由6.61 m2/g和56.44%提高到7.94 m2/g和84.88%。同样,热处理也是最常见的蛋白质改性和预处理方法之一[10],热处理能促使蛋白质解离、展开和重排,在结构水平上调整蛋白质的构象[11],从而影响其与多酚的结合以及复合物的功能特性。研究表明,在中性pH值下对乳清蛋白预热处理(85 ℃,30 min)会导致其变性并暴露更多疏水氨基酸链,进而增强其与槲皮素之间的结合亲和力,形成结构紧凑且尺寸更小的复合物[12];LI等[13]研究发现预热处理(80 ℃,10 min)后乳清分离蛋白与原花青素复合物的功能特性的变化与pH值相关,在pH 5.0条件下预热处理后复合物的起泡性显著增强,而在pH 7.0条件下起泡稳定性无显著改善。由于pH值可以调节蛋白质的表面电荷和疏水区域,与蛋白质分子展开相关[14],因此蛋白质和多酚的相互作用在很大程度上取决于pH值[15-16]。然而,在不同pH值条件下,对于预热处理前/后松仁蛋白与多酚之间的相互作用以及复合物结构和功能特性的研究尚未见报道。
表没食子儿茶素没食子酸酯(epigallocatechin gallate, EGCG)分子是一种含有8个羟基的四环结构,易与蛋白质相互作用,LIU等[17]对比了4种膳食多酚(EGCG、槲皮素、芹菜素、柚皮素)与乳清分离蛋白(whey protein isolate, WPI)的相互作用,发现与其他3种多酚相比,WPI-EGCG复合物的表面疏水性下降60.64%,抗氧化性提升62.52%,WPI-EGCG复合物的功能特性最好,HAN等[18]研究发现EGCG与WPI相互作用能够改变其二级结构,降低表面疏水性,与非共价复合物相比,共价复合物的乳化性和起泡性分别提高了63%和25.1%。此外,EGCG对人体具有多种健康益处,作为食品添加剂或者营养强化剂在食品工业中具有巨大潜力[15,19]。因此,本研究通过对不同pH值下的松仁蛋白(pine kernel protein, PKP)进行预热处理(85 ℃,10 min),旨在探究预热处理对松仁蛋白与EGCG之间的相互作用的影响以及复合物结构和功能特性的变化情况,以期改善PKP的功能特性,并扩大其在食品加工中的应用范围。
1 材料与方法
1.1 材料与试剂
松仁粕(蛋白质含量33.4%),黑龙江宏泰松果有限公司;表没食子儿茶素没食子酸酯(纯度98%),上海源叶生物科技有限公司;KBr(光谱纯),天津光复科技发展有限公司;大豆油,九三粮油工业集团有限公司;石油醚、氢氧化钠、盐酸、考马斯亮蓝R-250、过硫酸铵、甘氨酸、四甲基乙二胺、醋酸、甲醇、柠檬酸、磷酸二氢钠、磷酸氢二钠、8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid, ANS)、十二烷基硫酸钠等,试剂均为国产分析纯。
1.2 仪器与设备
TDL-40B-W型高速离心机,上海恒勤仪器设备有限公司;YTLG-10A型冷冻干燥机,上海叶拓科技有限公司;FTIR-650型傅里叶变换红外光谱仪,天津港东科技发展股份有限公司;Nicolet iN10型傅里叶变换显微红外光谱仪,美国赛默飞公司;F-7000型荧光分光光度计,日立科学仪器(北京)有限公司;高剪切分散乳化机,上海弗鲁克流体机械制造有限公司;纳米粒径及Zeta电位分析仪,马尔文博纳科技有限公司;BA210-T型光学显微镜,麦克奥迪工业集团有限公司。
1.3 实验方法
1.3.1 松仁蛋白的提取
参考LIU等[20]的方法稍作修改。将松仁粕粉碎后过40目筛,索氏提取后得到脱脂松仁粕(脂肪含量1.83%)。脱脂松仁粕和蒸馏水按照料液比1∶10(g∶mL)的料液比混合,用2 mol/L NaOH溶液调节pH值至9.0,室温下磁力搅拌1 h,4 000 r/min离心15 min,收集上清液。然后用2 mol/L HCl溶液的调节pH值至4.5,室温下磁力搅拌1 h,4 000 r/min离心15 min,收集沉淀重新溶于蒸馏水中,调节pH值至7.0,冷冻干燥,得到PKP。
1.3.2 松仁蛋白与EGCG复合物的制备
将PKP溶解在10 mmol/L的磷酸盐缓冲溶液中,室温下磁力搅拌2 h,4 ℃过夜确保充分水合得到PKP溶液。由于蛋白质和多酚的相互作用在很大程度上取决于pH值,选择pH 3.0、7.0、9.0,代表酸性、中性和碱性环境。用0.2 mol/L的NaOH或HCl溶液调节PKP溶液pH值为3.0、7.0、9.0,室温下放置2 h[13]。
根据预实验以溶解度的变化为依据确定松仁蛋白与EGCG的相互作用配比为20∶1(质量比)。预热处理的条件的选择参考LI等[13]的方法,根据差示热量扫描法测定了PKP的变性温度,确定加热条件85 ℃,10 min,至少可以使蛋白质部分变性并展开其结构。具体操作如下:将同一pH值下的PKP溶液分成2份,一份在85 ℃水浴中保持10 min,取出后冰浴冷却至室温,得到预热处理松仁蛋白(preheating pine kernel protein, HPKP)溶液;另一份不做处理,得到PKP溶液。EGCG溶解在相应pH值的去离子水中,现用现配,按照实验所需浓度与PKP/HPKP溶液混合,得到蛋白质和多酚的混合溶液。混合溶液于4 ℃透析24 h,每隔6 h换一次去离子水,除去未反应的多酚,冷冻干燥得到蛋白质和多酚复合物(PKP-EGCG/HPKP-EGCG),未加入多酚的PKP/HPKP溶液使用相同方法处理后作为对照。
1.3.3 松仁蛋白与EGCG的相互作用表征
1.3.3.1 紫外可见光谱测定
采用1.3.2节的方法制备蛋白质和多酚混合溶液。混合溶液中PKP或HPKP质量浓度为0.5 mg/mL,EGCG质量浓度0.025 mg/mL[15]。在200~400 nm下扫描样品,扫描速度1 nm/s,去离子水作为空白参照[21]。
1.3.3.2 荧光光谱测定
采用1.3.2节的方法制备蛋白质和多酚混合溶液。混合溶液中PKP或HPKP质量浓度恒定为0.5 mg/mL,EGCG浓度为0.00、0.002 18×10-3、0.010 9×10-3、0.021 8×10-3、0.032 7×10-3、0.043 6×10-3 mol/L[15],蛋白质和多酚混合溶液分别在25 ℃(298 K)和37 ℃(315 K)下避光反应2 h。使用荧光分光光度计进行扫描,测量范围300~500 nm,激发波长280 nm,狭缝宽度5.0 nm,扫描速率1 200 nm/min[22]。采用斯特恩-沃尔默(Stern-Volmer)方程和双对数方程进行计算[14],其计算分别如公式(1)和公式(2)所示:
(1)
(2)
式中:F0、F,未添加、添加给定浓度EGCG时溶液的的荧光强度;[Q],淬灭剂EGCG的浓度(0.00、0.002 18×10-3、0.010 9×10-3、0.021 8×10-3、0.032 7×10-3、0.043 6×10-3 mol/L);τ0,不存在淬灭剂时的荧光基团的平均寿命,10-8 s;KSV、Kq、Ka分别为淬灭常数、淬灭速率常数、亲和常数;n为结合位点数。
热力学参数根据范特霍夫方程(Van′t Hoff)方程和方程计算[15],其计算分别如公式(3)和公式(4)所示:
(3)
ΔG=ΔH-TΔS
(4)
式中:ΔG、ΔH和ΔS分别为吉布斯自由能变、焓变和熵变;R,气体摩尔常数,8.314 J/(mol·K);T,实验温度,K。
1.3.4 松仁蛋白与EGCG复合物结构及功能特性的测定
1.3.4.1 SDS-PAGE凝胶电泳
参考CHEN等[23]的方法略作修改。配制质量浓度10 mg/mL的蛋白质及蛋白质多酚混合物溶液,将10 μL样品溶液与上样缓冲液按照体积比1∶1混合,煮沸5 min。上样量10 μL,分离胶和浓缩胶的浓度分别为12%和3%。在80 V电压下电泳10 min,然后改为120 V直至结束。用考马斯亮蓝R-250进行染色,甲醇和醋酸体积比2∶3配制脱色液进行脱色,直至条带清晰。
1.3.4.2 二级结构测定
将冷冻干燥后的PKP和PKP-EGCG/HPKP-EGCG复合物与KBr以质量比为1∶100的比例混合压片,扫描范围400~4 000 cm-1,扫描速率4.0 cm-1,扫描次数32次[24]。
1.3.4.3 粒径和Zeta电位测定
使用10 mmol/L的磷酸盐缓冲溶液溶解冻干后的PKP/HPKP和PKP-EGCG/HPKP-EGCG复合物,稀释至蛋白质量浓度0.5 mg/mL。参考CHENG等[25]的方法稍作改动,利用纳米粒径和Zeta电位分析仪测定样品的粒度分布和Zeta电位,平均粒径用D(4,3)表示。蛋白质的折射率为1.46,水的折射率为1.33。
1.3.4.4 表面疏水性测定
在10 mmol/L的柠檬酸-磷酸盐或磷酸盐缓冲溶液中配制8.0 mmol/L pH 3.0、pH 7.0和pH 9.0的ANS溶液[26],使用与样品相同pH值的缓冲液溶解冻干后的PKP/HPKP和PKP-EGCG/HPKP-EGCG,稀释至蛋白质量浓度0.05、0.10、0.20、0.40、0.80 mg/mL。8.0 mmol/L的ANS溶液与不同浓度的样品溶液以体积比1∶100混匀,避光静置3 min。设置激发波长390 nm,发射波长405 nm,测定溶液的荧光强度。表面疏水性(H0值)表示为荧光强度与蛋白浓度对应曲线的斜率。
1.3.4.5 乳化性和乳化稳定性测定
参考HU等[10]的方法稍作改动,将PKP/HPKP和PKP-EGCG/HPKP-EGCG溶液(蛋白质质量浓度10 mg/mL)15 mL与5 mL大豆油混合,14 000 r/min高速剪切乳化2 min,分别在乳液形成的第0 min和20 min取50 μL乳液,立即与5 mL 1 g/L的十二烷基硫酸钠溶液混合并涡旋,用酶标仪测定500 nm处的吸光度。在乳液形成的第2 min取100 μL乳液与1 mL蒸馏水混合稀释,取20 μL稀释液置于载玻片与盖玻片之间,使用光学显微镜在400倍放大倍率(物镜40×,目镜10×)下观察和拍摄图像。乳化活性指数(emulsification activity index, EAI)和乳化稳定性指数(emulsification stability index, ESI)的计算分别如公式(5)和公式(6)所示:
(5)
(6)
式中:A0和At,乳液在第0 min和20 min的吸光度;N,稀释因子;C,蛋白质质量浓度,10 mg/mL;φ,油相体积分数,0.25;T0,时差,20 min。
1.3.4.6 起泡性和起泡稳定性测定
参考FU等[9]的方法稍作修改,将PKP/HPKP和PKP-EGCG/HPKP-EGCG溶液20 mL使用高剪切均质乳化机进行机械剪切(10 000 r/min,2 min),然后立即倒入50 mL离心管中,记录第2 min和30 min的泡沫体积。为了目视评估发泡性能,使用光学显微镜在400倍放大倍率(物镜40×,目镜10×)下观察拍摄第0 min和60 min的泡沫形态。起泡性和起泡稳定性的计算分别如公式(7)和公式(8)所示:
起泡性![]()
(7)
起泡稳定性![]()
(8)
式中:V0和V30分别为第2 min和30 min的泡沫体积。
1.4 数据处理
所有实验重复3次,数据表示为平均值±标准差。SPSS Statistics 26.0软件进行显著性分析(P<0.05),PeakFit V4.12软件进行去卷积分峰处理,计算二级结构含量,使用Origin 2021对数据绘图。
2 结果与分析
2.1 松仁蛋白与EGCG的相互作用分析
2.1.1 紫外可见光谱分析
通过紫外可见光谱强度和位置的变化,可以评估蛋白质构象以及疏水氨基酸残基微环境的改变[27]。由图1-A可知,在pH 7.0条件下,与PKP相比,HPKP的最大吸收强度(Abmax)增加了24.3%,显著高于pH 3.0(16.0%)和pH 9.0(22.9%)(P<0.05)。Abmax的增加表示疏水基团(Trp和Tyr)的暴露程度提高[28],表明预热处理使PKP结构展开,并且在中性pH值下疏水氨基酸暴露程度更大,这可能是不同pH值下蛋白质的热稳定性差异所致[29]。由图1-B可知,与EGCG结合后,PKP-EGCG/HPKP-EGCG的最大吸收波长(λmax)均从286 nm蓝移至284 nm,说明EGCG与蛋白质内部疏水空间中的氨基酸残基发生相互作用,并且增强了疏水性氨基酸周围微环境的极性,这与CHEN等[30]在没食子酸与蛋清蛋白相互作用观察到的结论一致。λmax的蓝移可能是多酚所带的助色团或发色团与蛋白质相互作用使其多肽链伸展所致[31]。以上结果证实了预热处理使得PKP分子展开并重新排列,导致疏水氨基酸暴露,而EGCG分子中的亲水基团能够与PKP/HPKP内部的疏水性氨基酸结合,增强了蛋白质的亲水性。
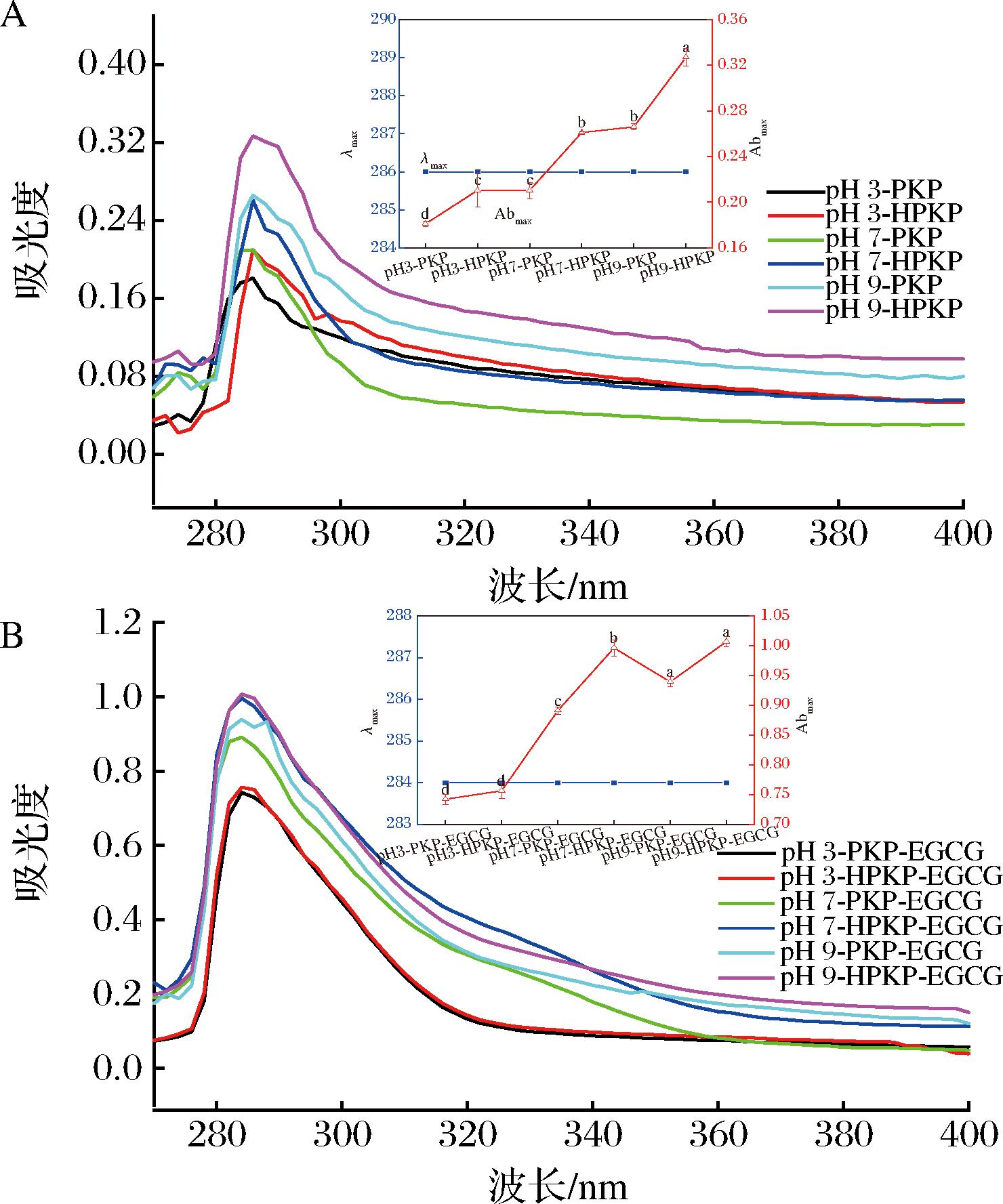
A-PKP/HPKP;B-PKP/HPKP与EGCG复合物
图1 PKP/HPKP及PKP/HPKP与EGCG复合物的紫外可见光谱图
Fig.1 UV-visible spectra of PKP/HPKP and PKP/HPKP complex with EGCG
2.1.2 荧光光谱分析
2.1.2.1 松仁蛋白与EGCG的淬灭机制、结合常数、结合位点数
根据图2-A和图2-B可知,在298 K和310 K条件下,随着EGCG浓度的增加,PKP/HPKP的荧光强度逐渐降低,表明EGCG与PKP/HPKP之间发生相互作用导致Trp和Tyr的荧光淬灭。通过Stern-Volmer方程对淬灭机理进行分析,从图2-C可以看出,在298 K和310 K条件下,EGCG与PKP/HPKP之间的Stern-Volmer方程呈现良好的线性关系(R2>0.90),且如表1所示,KSV随着温度的升高逐渐减小(P<0.05),并且Kq值(KSV=Kqτ0)远高于最大碰撞淬灭常数(2.0×1010 mol/L/s),以上结果说明EGCG对PKP/HPKP的淬灭类型为静态淬灭[32]。对于静态淬灭可以使用双对数方程来计算结合常数(Ka)和结合位点数(n)。Ka和n分别对应公式(2)的截距和斜率,Ka值越大,多酚与蛋白质的结合亲和力越强[15]。由表1可知,n值在1左右,说明PKP/HPKP与EGCG间至少存在1个结合位点,对3种pH条件下的Ka值进行显著性分析可知,PKP/HPKP与EGCG间结合亲和力的强弱顺序为pH 9.0>pH 7.0>pH 3.0(P<0.05),HPKP-EGCG在pH 3.0、7.0、9.0条件下的Ka值分别是PKP-EGCG的2.2、8.3、1.3倍。研究结果表明预热处理能够提高HPKP与EGCG的结合亲和力,且在pH 7.0条件下对结合亲和力提高程度最大,这进一步验证了紫外光谱的实验结果,说明在中性pH值条件下预热处理使得PKP中疏水氨基酸暴露程度更大。
表1 PKP/HPKP与EGCG相互作用的结合常数(Ka)、结合位点数(n)
Table 1 Binding constants (Ka) and binding sites (n) of interactions between PKP/HPKP and EGCG
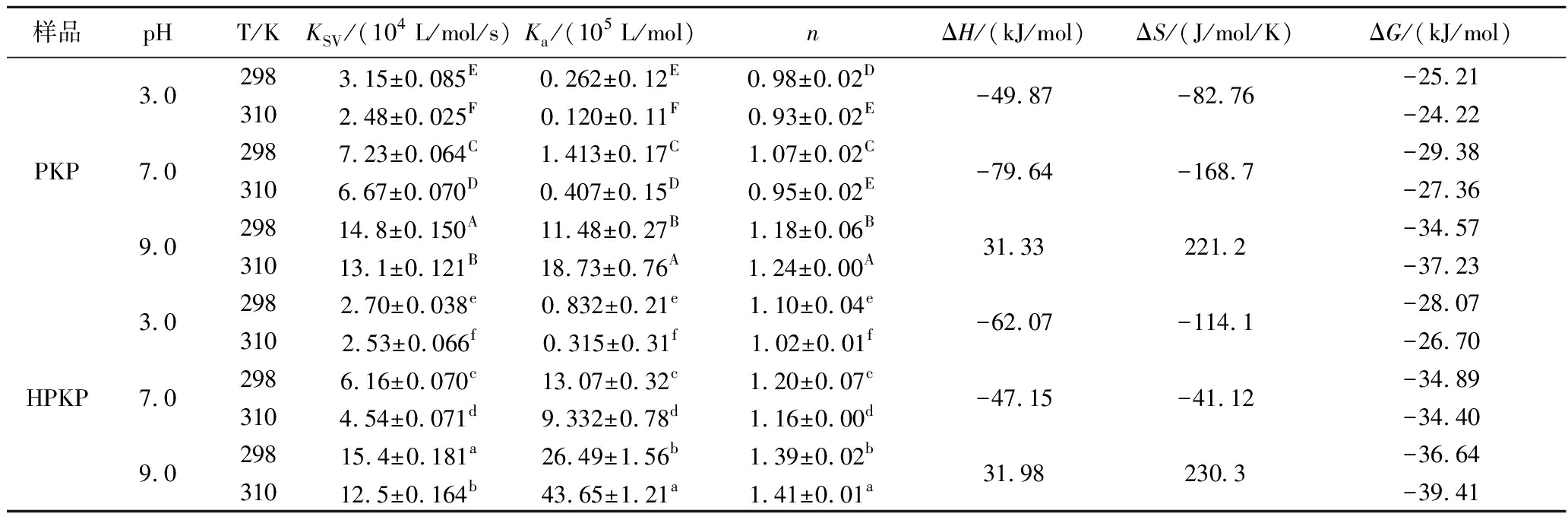
样品pHT/KKSV/(104 L/mol/s)Ka/(105 L/mol)nΔH/(kJ/mol)ΔS/(J/mol/K)ΔG/(kJ/mol)PKP3.07.09.02983.15±0.085E0.262±0.12E0.98±0.02D3102.48±0.025F0.120±0.11F0.93±0.02E2987.23±0.064C1.413±0.17C1.07±0.02C3106.67±0.070D0.407±0.15D0.95±0.02E29814.8±0.150A11.48±0.27B1.18±0.06B31013.1±0.121B18.73±0.76A1.24±0.00A-49.87-82.76-79.64-168.731.33221.2-25.21-24.22-29.38-27.36-34.57-37.23HPKP3.07.09.02982.70±0.038e0.832±0.21e1.10±0.04e3102.53±0.066f0.315±0.31f1.02±0.01f2986.16±0.070c13.07±0.32c1.20±0.07c3104.54±0.071d9.332±0.78d1.16±0.00d29815.4±0.181a26.49±1.56b1.39±0.02b31012.5±0.164b43.65±1.21a1.41±0.01a-62.07-114.1-47.15-41.1231.98230.3-28.07-26.70-34.89-34.40-36.64-39.41
注:字母不同(包括大小写不同)代表同一列数据间差异显著(P<0.05)。
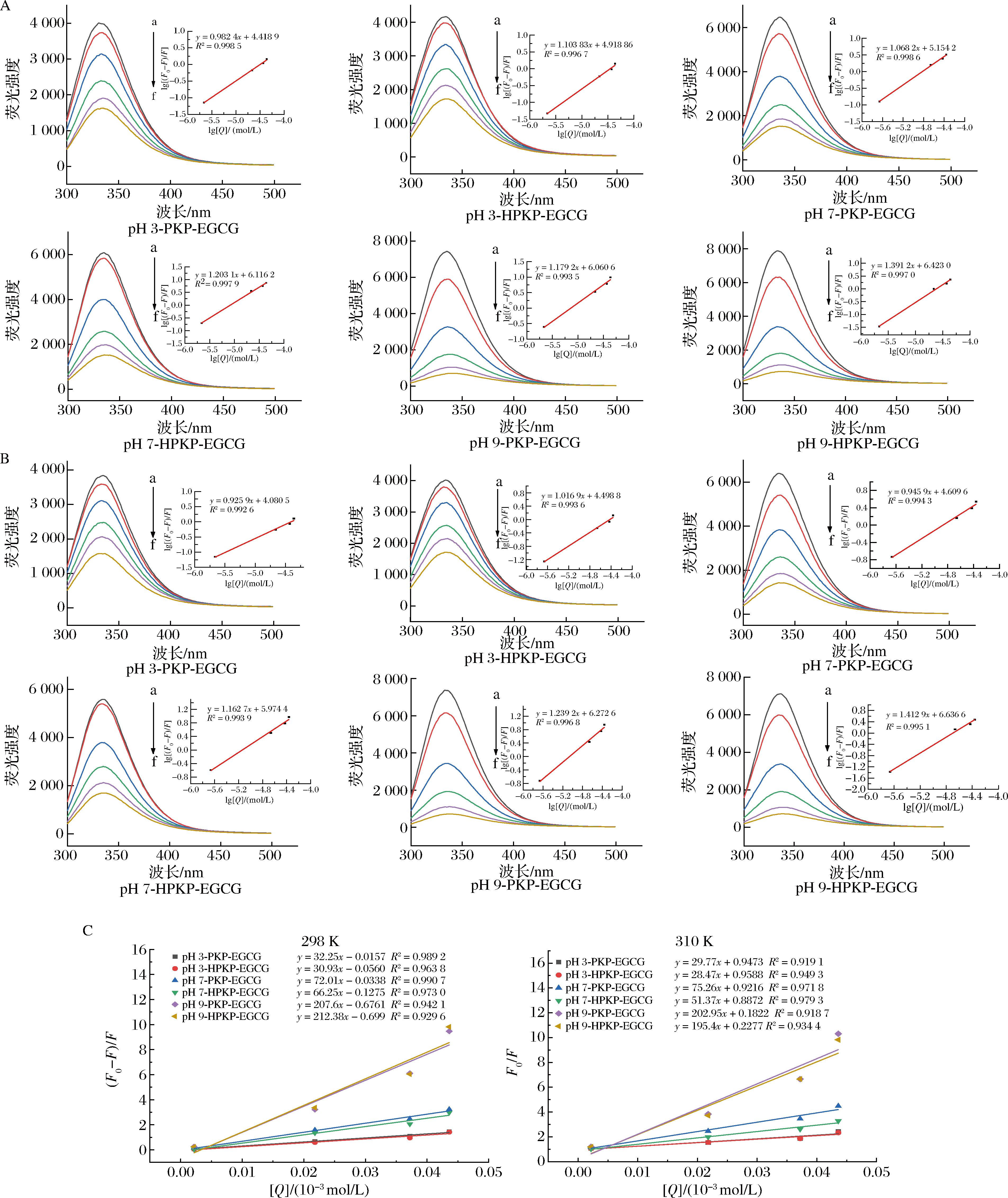
A、B-298 K和310 K时PKP/HPKP与EGCG在pH 3.0、7.0、9.0下的荧光光谱及双对数公式(2)的线性拟合;C-298 K和310 K时PKP/HPKP与EGCG之间符合公式(1)
图2 298 K和310 K时PKP/HPKP与EGCG在pH 3.0、7.0、9.0下的荧光光谱图
Fig.2 Fluorescence spectra of PKP/HPKP and EGCG at 298 K and 310 K at pH 3.0, 7.0, and 9.0
注:a~f依次表示EGCG的浓度为0.00、0.002 18×10-3、0.010 9×10-3、0.021 8×10-3、0.032 7×10-3、0.043 6×10-3 mol/L。
2.1.2.2 松仁蛋白与EGCG的相互作用类型
按照公式(3)和公式(4)计算的ΔG、ΔH和ΔS值如表1所示。3种pH值下ΔG<0,说明EGCG与PKP/HPKP的相互作用是一个自发过程。PKP-EGCG/HPKP-EGCG在pH 3.0和pH 7.0条件下ΔH<0、ΔS<0;pH 9.0条件下ΔH>0、ΔS>0,说明在pH 3.0和pH 7.0条件下,PKP/HPKP与EGCG结合主要依靠氢键和范德华力,pH 9.0条件下主要是疏水相互作用[9]。预热处理并不会改变相同pH值下PKP与EGCG结合的作用力类型。
2.2 松仁蛋白与EGCG复合物的结构及功能特性分析
2.2.1 SDS-PAGE分析
根据图3可知,PKP的分子质量为50~10 kDa,以球蛋白(11S、7S)和白蛋白(2S)为主[1]。预热处理后(图3-B)HPKP在33 kDa处7S蛋白条带减弱,而10 kDa处2S蛋白条带增强,这表明预热处理导致了PKP的降解或变性,并增加了小分子质量蛋白的含量,从而验证了预热处理能够使PKP分子展开重排的结论[23]。与EGCG结合后,在图3-A和图3-B中泳道2和4凝胶顶部的聚集带减弱,49 kDa(7S)和37 kDa(11S)处的条带增强,说明在pH 9.0和pH 7.0条件下EGCG结合导致PKP/HPKP的分子质量减小,形成了更多小分子质量的可溶性聚集体;然而,在泳道5和6中条带减弱甚至消失,可能是因为pH 3.0条件下蛋白质交联形成高分子质量聚集体无法进入凝胶,从而导致条带消失[33]。此外,与EGCG结合后,在pH 3.0条件下(泳道6)观察到凝胶顶部聚集带增强的现象,说明在pH 3.0条件下EGCG结合可能引起PKP/HPKP的聚集和交联。
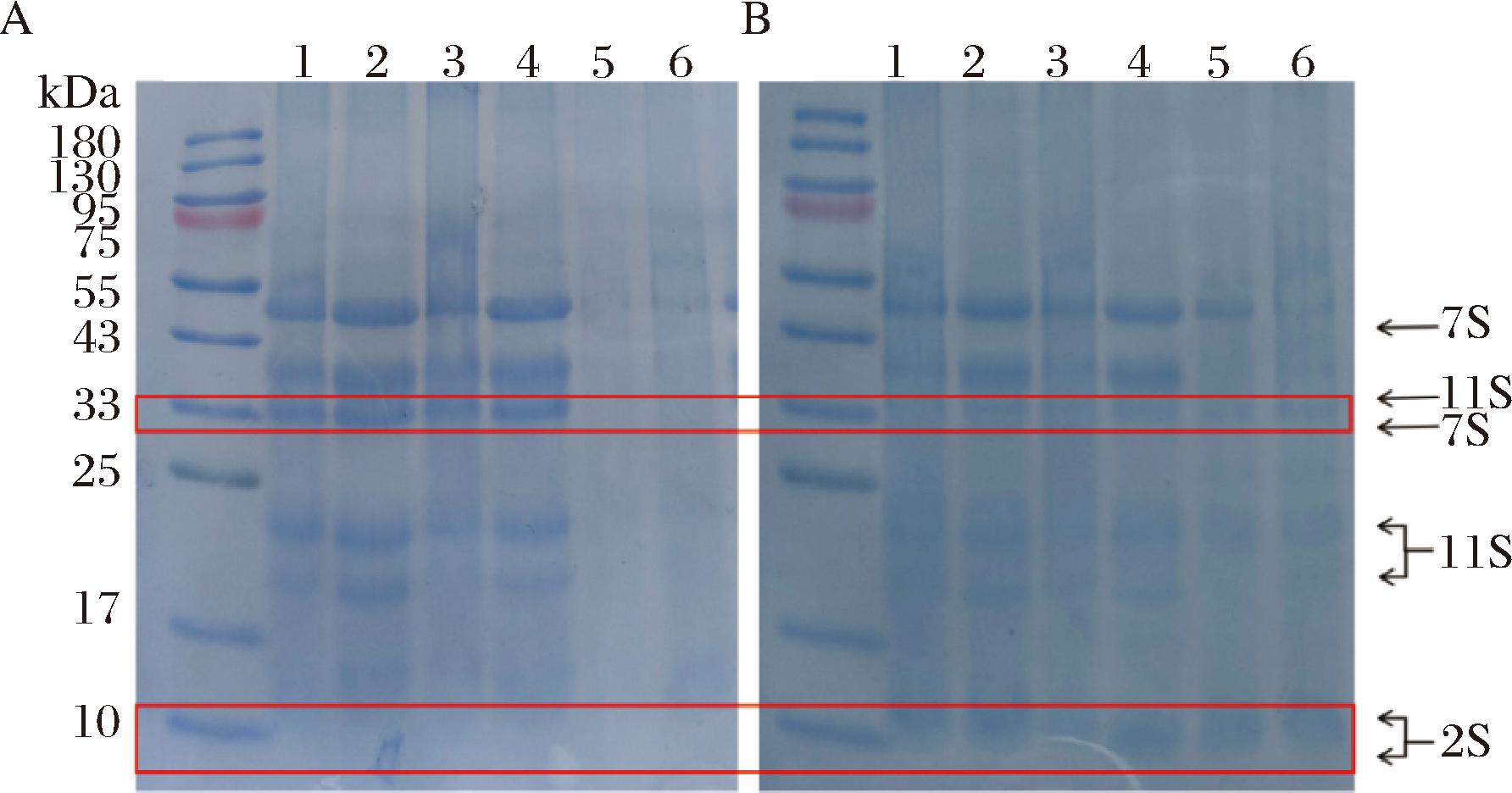
A-PKP/PKP-EGCG;B-HPKP/HPKP-EGCG
图3 PKP/PKP-EGCG和HPKP/HPKP-EGCGSDS-PAGE凝胶电泳图
Fig.3 PKP/PKP-EGCG and HPKP/HPKP-EGCG SDS-PAGE gel electrophoresis
注:泳道1和2分别为pH 9.0条件下松仁蛋白和松仁蛋白-EGCG复合物;泳道3和4分别为pH 7.0条件下松仁蛋白和松仁蛋白-EGCG复合物;泳道5和6分别为pH 3.0条件下松仁蛋白和松仁蛋白-EGCG复合物。
2.2.2 二级结构分析
PKP/HPKP和PKP-EGCG/HPKP-EGCG复合物的红外光谱图和二级结构含量如图4和表2所示。与PKP/HPKP相比,PKP-EGCG/HPKP-EGCG复合物在酰胺Ⅰ带和酰胺Ⅱ带发生了不同程度的位移,这说明EGCG与PKP/HPKP中的氨基酸结合参与了C![]() O、C—N、N—H基团的振动,导致蛋白质的二级结构发生改变[28,34]。预热处理后,HPKP的α-螺旋显著含量降低,无规卷曲含量显著增加(P<0.05);而与EGCG结合后无规卷曲含量进一步增加。在3种pH值下,HPKP-EGCG复合物的无规卷曲含量在各处理组中达到最大值(P<0.05)。无规卷曲含量的增加意味着蛋白质分子柔韧性增强[35]。以上结果表明,在预热处理后,HPKP-EGCG复合物的无规卷曲含量增加以及分子柔韧性增强的情况可能会导致部分功能特性得到提升[9,35]。
O、C—N、N—H基团的振动,导致蛋白质的二级结构发生改变[28,34]。预热处理后,HPKP的α-螺旋显著含量降低,无规卷曲含量显著增加(P<0.05);而与EGCG结合后无规卷曲含量进一步增加。在3种pH值下,HPKP-EGCG复合物的无规卷曲含量在各处理组中达到最大值(P<0.05)。无规卷曲含量的增加意味着蛋白质分子柔韧性增强[35]。以上结果表明,在预热处理后,HPKP-EGCG复合物的无规卷曲含量增加以及分子柔韧性增强的情况可能会导致部分功能特性得到提升[9,35]。
表2 PKP和PKP-EGCG/HPKP-EGCG复合物的二级结构含量 单位:%
Table 2 Secondary structure contents of PKP and PKP-EGCG/HPKP-EGCG complex
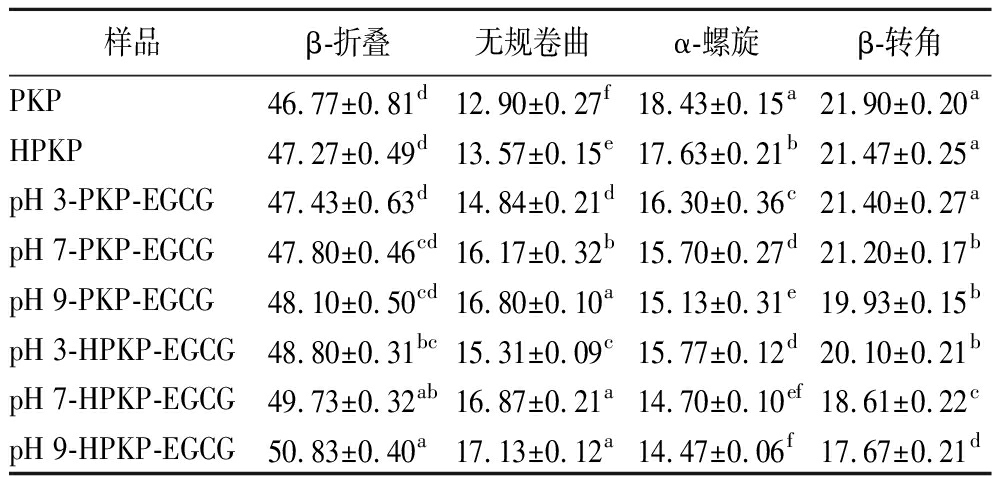
样品β-折叠无规卷曲α-螺旋β-转角PKP46.77±0.81d12.90±0.27f18.43±0.15a21.90±0.20aHPKP47.27±0.49d13.57±0.15e17.63±0.21b21.47±0.25apH 3-PKP-EGCG47.43±0.63d14.84±0.21d16.30±0.36c21.40±0.27apH 7-PKP-EGCG47.80±0.46cd16.17±0.32b15.70±0.27d21.20±0.17bpH 9-PKP-EGCG48.10±0.50cd16.80±0.10a15.13±0.31e19.93±0.15bpH 3-HPKP-EGCG48.80±0.31bc15.31±0.09c15.77±0.12d20.10±0.21bpH 7-HPKP-EGCG49.73±0.32ab16.87±0.21a14.70±0.10ef18.61±0.22cpH 9-HPKP-EGCG50.83±0.40a17.13±0.12a14.47±0.06f17.67±0.21d
注:小写字母不同代表同一列数据间差异显著(P<0.05)。
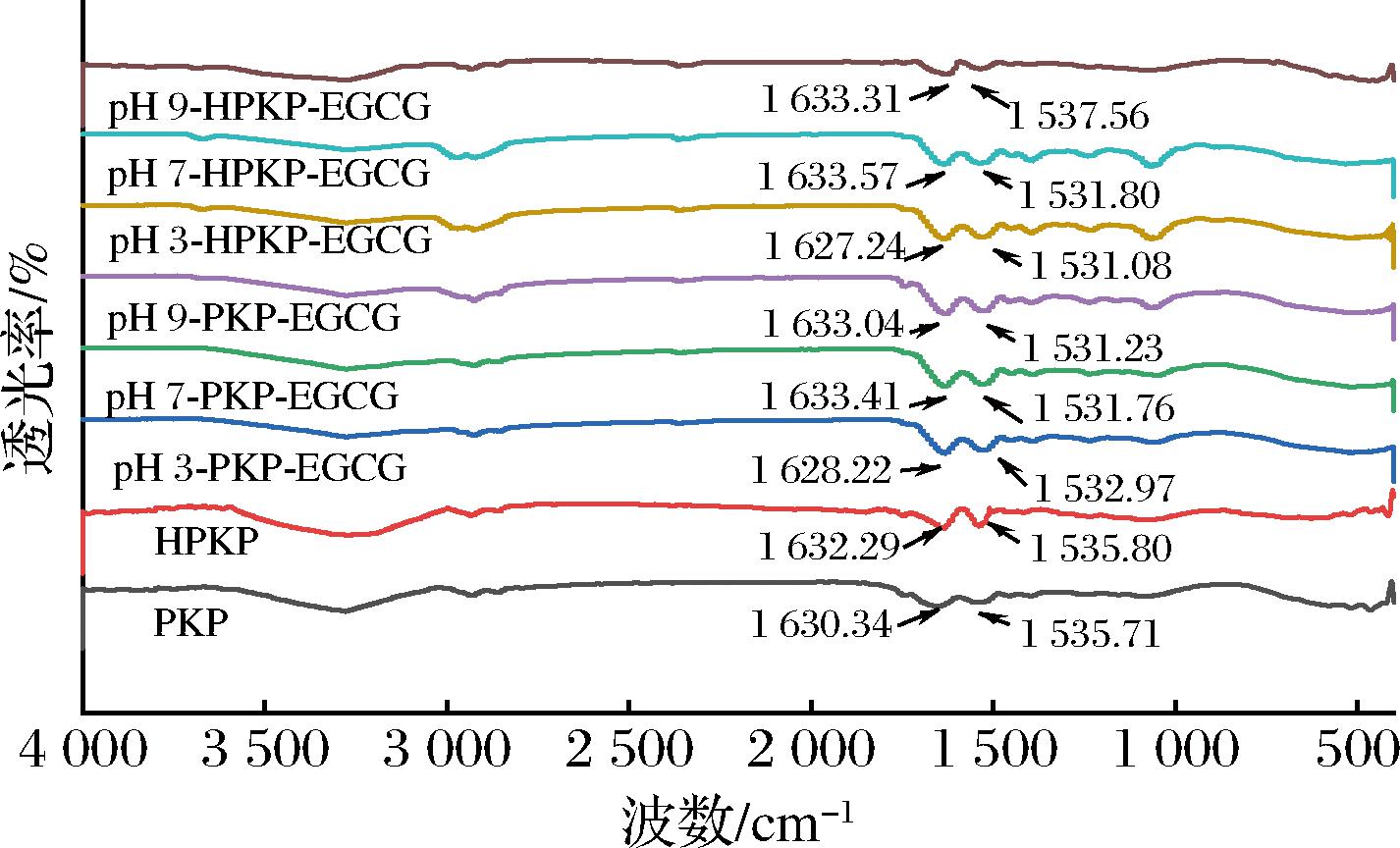
图4 PKP和PKP-EGCG/HPKP-EGCG复合物的红外光谱图
Fig.4 Infrared spectra of PKP and PKP-EGCG/HPKP-EGCG complexes
2.2.3 粒径和Zeta电位分析
粒径和Zeta电位与蛋白质的乳化性和起泡性密切相关。如图5-A~图5-C所示,与PKP相比,HPKP的D(4,3)显著减小(P<0.05),表明预热处理导致PKP中大分子聚集体被破坏,并增加了分子柔韧性。在与EGCG结合后,pH 3.0条件下PKP-EGCG/HPKP-EGCG粒径分布向右移动,D(4,3)增大,而在pH 7.0和pH 9.0条件下粒径分布均向左移动,D(4,3)减小,HPKP-EGCG的平均粒径更小,这一结果与ZHONG等[36]的研究结论吻合。在中性和碱性pH值下,HPKP与EGCG相互作用能够形成结构更紧凑的复合物,这可以通过Zeta电位的变化来解释。如图5-D所示,与pH 3.0相比,PKP/HPKP的Zeta电位绝对值在pH 7.0和pH 9.0条件下较高(P<0.05),颗粒间静电斥力增强,蛋白质分子展开,结构松散[37],预热处理后HPKP的疏水氨基酸暴露,并产生更多小分子质量的可溶性聚集体(2.2.1节),进一步提高了蛋白质的分子柔韧性,因此,EGCG能够进入蛋白质分子内部的疏水区域[12],可能诱导了PKP/HPKP分子展开重排(2.2.2节),将EGCG分子包裹在蛋白质分子中,形成了粒径更小的复合物[11,36]。相反地,在pH 3.0条件下静电斥力减小,PKP结构紧凑且疏水性氨基酸被埋藏在蛋白质内部,因此,尽管酸性条件下预热处理能够增加HPKP与EGCG之间的结合亲和力,但EGCG可能仅是包围在HPKP分子表面,由于EGCG具有多个酚羟基,能够充当蛋白质分子间的交联剂,从而形成大分子聚集体导致粒径增加[38]。以上结果证明,预热处理能够增加PKP与EGCG之间的结合亲和力,然而,在不同pH值条件下,这种增强作用对复合物粒径的影响可能是不同的。在酸性pH条件下,复合物的粒径进一步增大,而在中性和碱性pH条件下,EGCG能够进入蛋白质分子内部,诱导PKP/HPKP展开重排,进一步减小粒径。这些结论和电泳结果一致。此外,较小的粒径有助于蛋白质快速吸附在液滴界面上,从而可能对复合物的功能特性产生影响。

A-pH 3.0时的粒径分布;B-pH 7.0时的粒径分布;C-pH 9.0时的粒径分布;D-Zeta电位
图5 PKP/HPKP以及PKP-EGCG/HPKP-EGCG复合物在pH 3.0、pH 7.0、pH 9.0时的粒径分布和Zeta电位
Fig.5 Particle size distribution and Zeta potential of PKP/HPKP and PKP-EGCG/HPKP-EGCG complexes at pH 3.0, pH 7.0, and pH 9.0
注:字母不同代表数据间差异显著(P<0.05)(下同)。
2.2.4 表面疏水性分析
表面疏水性反映了蛋白质表面疏水区域的暴露程度,与蛋白质的界面行为密切相关。由图6可知,在3种pH条件下,HPKP相较与PKP呈现出更高的H0值(P<0.05),这表明预热处理破坏了PKP分子内部的疏水相互作用,导致其局部展开并暴露出疏水空间[11],此结论与紫外光谱和荧光光谱结果一致。与EGCG结合后,在pH 3.0、pH 7.0、pH 9.0条件下,PKP-EGCG(HPKP-EGCG)H0值分别降低7.98%(19.76%)、23.75%(36.24%)、36.92%(43.12%)。这可能是因为EGCG能够与PKP/HPKP的疏水区域发生结合,从而减少ANS探针和疏水氨基酸残基的结合;同时,H0值的降低程度可能与PKP/HPKP和EGCG之间的结合亲和力强弱相关[9],由于EGCG具有多个羟基官能团,可以引入额外的羟基,在蛋白质中形成亲水环境[14],因此结合亲和力越强,H0值的降低程度越大。以上结果再次证明,预热处理促使PKP展开重排,暴露疏水性氨基酸,增加与EGCG的结合亲和力,pH 9.0条件下的结合亲和力最强。由于结合亲和力增加,HPKP-EGCG复合物的H0值进一步降低,这很可能改变复合物的功能特性。
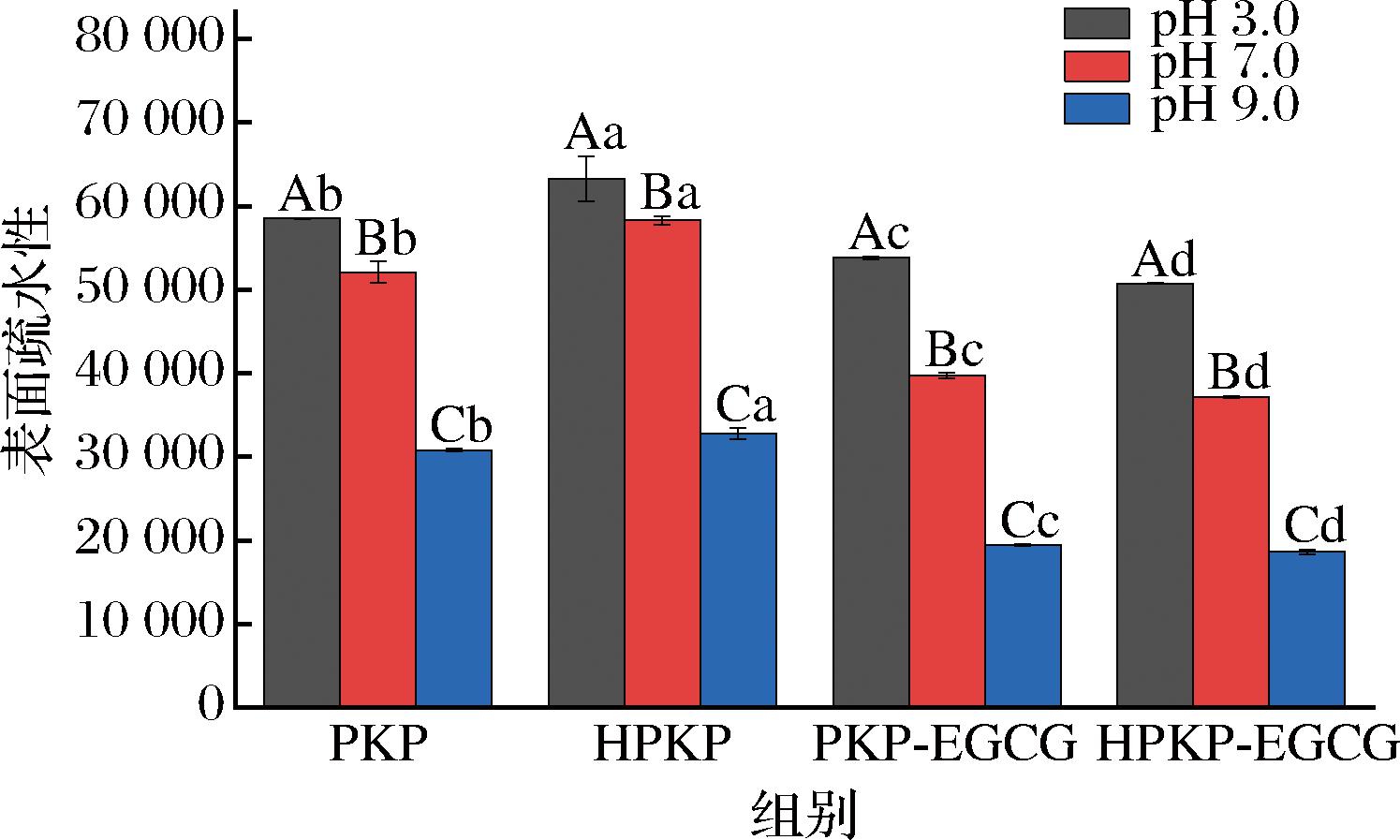
图6 PKP/HPKP以及PKP-EGCG/HPKP-EGCG复合物的表面疏水性
Fig.6 Surface hydrophobicity of PKP/HPKP and PKP-EGCG/HPKP-EGCG complexes
2.2.5 乳化性及乳化稳定性分析
EAI反映蛋白质迁移和吸附到油水界面形成乳液的能力,ESI反映乳液在分散体中抵抗分离的能力[39]。如图7-A所示,与PKP相比,HPKP的EAI显著增加(P<0.05);与EGCG结合后,在3种pH条件下,PKP-EGCG(HPKP-EGCG)复合物的EAI分别增加13.37%(26.63%)、18.84%(27.95%)、19.24%(29.78%),这种变化与表面疏水性降低一致。在pH 9.0条件下,HPKP-EGCG复合物的EAI达到最大值(11.71±0.31) m2/g,相比于单独的HPKP和PKP-EGCG复合物分别提高18.72%和8.84%,与商业大豆分离蛋白(soy protein isolate, SPI)的EAI[(12.2±0.1) m2/g]相当,但低于芝麻分离蛋白[(16.8±0.2) m2/g][40]。PKP的乳化特性改善的原因可能是:一方面预热处理促使PKP从紧密结构变为松散结构,分子柔韧性提高,另一方面预热处理后疏水氨基酸暴露,HPKP与EGCG的结合亲和力增加,复合物的表面疏水性降低,进一步提高了蛋白质的结构柔韧性,更有利于在O/W界面的吸附和展开[41]。ESI的变化与蛋白质的表面电荷有关[42],如图7-B所示,在pH 3.0条件下,PKP-EGCG/HPKP-EGCG复合物的Zeta电位绝对值降低,导致颗粒之间的静电斥力减弱,从而使ESI降低;而在pH 7.0和pH 9.0条件下,Zeta电位绝对值升高,增加了颗粒表面的净电荷,能更牢固地保持油水界面[42],因此ESI增加。此外,HPKP-EGCG的ESI在pH 7.0、(101.34±1.25) min和pH 9.0、(103.6±1.76) min条件下无显著差异(P>0.05)。据报道,SPI乳液稳定10 min后的ESI为(30.9±0.8) min[1]。
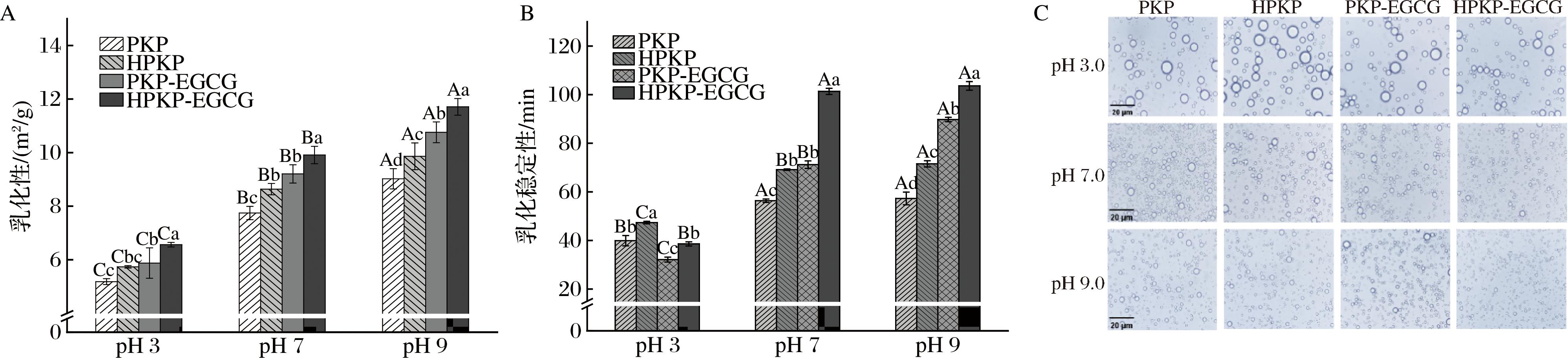
A-乳化性;B-乳化稳定性;C-乳液分布
图7 PKP/HPKP以及PKP-EGCG/HPKP-EGCG复合物的乳化性、乳化稳定性和乳液分布
Fig.7 Emulsification, emulsion stability, and emulsion distribution of PKP/HPKP and PKP-EGCG/HPKP-EGCG complexes
预热处理对不同pH值下PKP/HPKP和PKP-EGCG/HPKP-EGCG复合物乳液分布的影响如图7-C所示。与PKP/PKP-EGCG相比,经预热处理后HPKP/HPKP-EGCG复合物表现出更小的液滴尺寸和更均匀的液滴分布,在pH 9.0条件下,HPKP-EGCG复合物稳定的乳液液滴尺寸最小。以上结果说明预热处理提高了HPKP和HPKP-EGCG复合物的乳化能力,这与其乳化性和乳化稳定性结果一致。
2.2.6 起泡性及起泡稳定性分析
如图8-A所示,与PKP相比,HPKP的起泡性显著增加(P<0.05);与EGCG结合后,HPKP-EGCG复合物的起泡性在pH 9.0时达到最大值(137.20±1.2)%,远高于SPI(98.7%)[43]。显然,预热处理提升了HPKP的分子柔韧性,并增强了其与EGCG之间的结合亲和力,HPKP-EGCG复合物分子柔韧性进一步提高,表面疏水性进一步降低,这对泡沫形成非常有利[44]。同时,从图8-C也可以观察到,在相同pH值条件下,与PKP/HPKP相比,PKP-EGCG/HPKP-EGCG复合物的泡沫体积更小,数量更多,在pH 9.0条件下泡沫体积最小且60 min后不易聚集、合并或者消失。
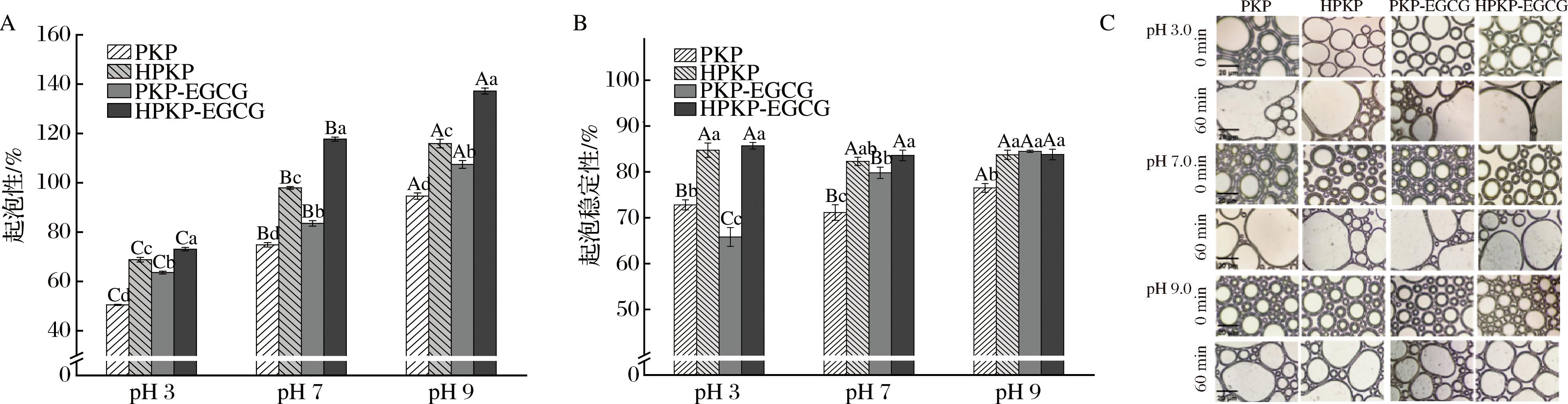
A-起泡性;B-起泡稳定性;C-泡沫微观结构
图8 PKP/HPKP以及PKP-EGCG/HPKP-EGCG复合物的起泡性、起泡稳定性和泡沫微观结构
Fig.8 Foaming properties, foaming stability, and foam microstructure of PKP/HPKP and PKP-EGCG/HPKP-EGCG complexes
由图8-B可知,与PKP相比,PKP-EGCG复合物在pH 3.0条件下起泡稳定性降低,而在pH 7.0、pH 9.0条件下起泡稳定性升高(P<0.05)。HPKP和HPKP-EGCG复合物在3种pH值条件下起泡稳定性在83.6%~85.75%且无显著性差异(P>0.05),但均高于SPI(76.92±1.2)%的起泡稳定性[1]。CAO等[45]研究发现,预热处理和EGCG均能提高中性pH值条件下乳清分离蛋白的起泡稳定性,然而,对于预热处理后的乳清分离蛋白,EGCG并没有显著提高其起泡稳定性,这与本研究结果一致。起泡稳定性改善可能是由于预热处理和EGCG的加入使Zeta-电位绝对值升高,平均粒径减小,小粒径蛋白出现并不可逆地吸附在空气-水界面从而提高起泡稳定性[13]。此外,加入EGCG还改善了溶解度,促使蛋白质分子可以更有效地扩散到空气-水界面中[18],从而同样提高了起泡稳定性。
3 结论
本文探讨了在不同pH值条件下预热处理对松仁蛋白与EGCG之间的相互作用以及复合物的结构和功能特性的影响。
a)预热处理导致PKP中的大分子聚集体被破坏,使粒径减小,无规卷曲含量增加,从而提高了分子柔韧性以及与EGCG之间的结合亲和力。在中性pH值条件下,经预热处理的HPKP展开效果最佳,并且其与EGCG之间的结合亲和力显著提高;而在碱性pH值条件下,HPKP与EGCG之间则由于共价相互作用产生最强的结合亲和力。
b)EGCG对PKP/HPKP的淬灭类型为静态淬灭,结合位点数约为1,表明存在1个结合位点,在pH 3.0和pH 7.0条件下主要是氢键和范德华力,pH 9.0条件下主要是疏水相互作用。预热处理不会改变相同pH值下的相互作用力类型。
c)与PKP-EGCG复合物相比,HPKP-EGCG复合物的无规卷曲含量进一步增加,表面疏水性降低,从而增强了疏水氨基酸周围微环境的极性。在pH 7.0和pH 9.0条件下形成了分子质量更小的复合物,改善了功能特性,其中,在pH 9.0条件下,HPKP-EGCG复合物具有类似商业SPI的乳化能力,其起泡能力远高于商业SPI;在pH 7.0条件下的乳化稳定性与pH 9.0 无显著性差异。而在pH 3.0条件下,EGCG可能仅包围在HPKP分子表面并充当蛋白质分子间的交联剂,形成大分子聚集体导致粒径增加,从而降低了乳化稳定性。
研究结果表明,预热处理促使PKP的结构改变并能够增强其与EGCG之间的结合亲和力,从而改善蛋白质的功能特性。在匹配食品体系pH值的条件下获得具有优良功能特性的蛋白质-多酚复合物,有望使松仁蛋白在食品工业中广泛应用成为现实。
[1] BENZITOUNE N, KADRI N, ADOUANE M, et al.Pine nuts (Pinus pinea L.) as a potential novel plant-based source of functional protein isolates:Optimization of alkali extraction conditions, evaluation of functional properties, and biochemical characterization[J].Journal of Food Processing and Preservation, 2022, 46(4):e16471.
[2] BHANDARI C, AGNIHOTR N.Pine nut oil supplementation alleviates the obesogenic effects in high-fat diet induced obese rats:A comparative study between epididymal and retroperitoneal adipose tissue[J].Nutrition Research, 2022, 106:85-100.
[3] NASRI N, TRIKI S.Les protéines de réserve du pin pignon (Pinus pinea L.)[J].Comptes Rendus Biologies, 2007, 330(5):402-409.
[4] WANG J R, WANG X M, WANG W Q, et al.Functionalization of pine kernel protein by pH-shifting combined with ultrasound treatments:Further improvement with increasing acidity[J].International Journal of Biological Macromolecules, 2023, 248:125884.
[5] 王慧飞. 松仁蛋白饮料专用稳定剂的优选及其产品稳定性的研究[D].长春:吉林农业大学, 2003.WANG H F.Research on the optimization of special stabilizer for pine nut protein beverage and its product stability[D].Changchun:Jilin Agricultural University, 2003.
[6] LIU D D, REGENSTEIN J M, DIAO Y, et al.Antidiabetic effects of water-soluble Korean pine nut protein on type 2 diabetic mice[J].Biomedicine &Pharmacotherapy, 2019, 117:108989.
[7] 郑元元, 井晶, 王振宇, 等.红松松仁蛋白肽的分离纯化及体外抗氧化和体内抗疲劳作用[J].食品科学, 2019, 40(1):143-148. ZHENG Y Y, JING J, WANG Z Y, et al.Isolation, purification and in vitro antioxidant and in vivo antifatigue activity of a peptide derived from pine nut kernels (Pinus koraiensis sieb.et zucc.)[J].Food Science, 2019, 40(1):143-148.
[8] WU T Y, LIN L, ZHANG X Y, et al.Covalent modification of soy protein hydrolysates by EGCG:Improves the emulsifying and antioxidant properties[J].Food Research International, 2023, 164:112317.
[9] FU M, GENG Q, CHEN J, et al.Pea protein-quercetin glycoside complexes:Interaction, foaming and emulsifying properties[J].Journal of Molecular Liquids, 2023, 386:122487.
[10] HU J Y, YU B, YUAN C, et al.Influence of heat treatment before and/or after high-pressure homogenization on the structure and emulsification properties of soybean protein isolate[J].International Journal of Biological Macromolecules, 2023, 253:127411.
[11] NGUI S P, NYOBE C E, BAKWO BASSOGOG C B, et al.Influence of pH and temperature on the physicochemical and functional properties of Bambara bean protein isolate[J].Heliyon, 2021, 7(8):e07824.
[12] JI W, YANG F M, YANG M.Effect of change in pH, heat and ultrasound pre-treatments on binding interactions between quercetin and whey protein concentrate[J].Food Chemistry, 2022, 384:132508.
[13] LI N, GIRARD A L.Impact of pH and temperature on whey protein-proanthocyanidin interactions and foaming properties[J].Food Hydrocolloids, 2023, 134:108100.
[14] SUN J, LIU T M, ZHANG F, et al.Tea polyphenols on emulsifying and antioxidant properties of egg white protein at acidic and neutral pH conditions[J].LWT, 2022, 153:112537.
[15] YANG Y X, WANG Q M, LEI L, et al.Molecular interaction of soybean glycinin and β-conglycinin with (-)-epigallocatechin gallate induced by pH changes[J].Food Hydrocolloids, 2020, 108:106010.
[16] WANG Q M, TANG Y W, YANG Y X, et al.The interaction mechanisms, and structural changes of the interaction between zein and ferulic acid under different pH conditions[J].Food Hydrocolloids, 2022, 124:107251.
[17] LIU X J, SONG Q B, LI X, et al.Effects of different dietary polyphenols on conformational changes and functional properties of protein-polyphenol covalent complexes[J].Food Chemistry, 2021, 361:130071.
[18] HAN X E, LIANG Z Q, TIAN S F, et al.Epigallocatechin gallate (EGCG) modification of structural and functional properties of whey protein isolate[J].Food Research International, 2022, 158:111534.
[19] KAO Y H, CHANG H H, LEE M J, et al.Tea, obesity, and diabetes[J].Molecular Nutrition &Food Research, 2006, 50(2):188-210.
[20] LIU W C, ADELINA N M, ZHANG L G, et al.Effects of roasting treatment on functional properties and structure of proteins in grafted Korean pine[J].Journal of Food Processing and Preservation, 2022, 46(10):e16810.
[21] 皇甫云鹏, 包怡红, 赵鑫磊, 等.大豆分离蛋白-单宁酸-多糖三元复合物的功能特性及结构表征[J].食品科学技术学报, 2022, 40(6):37-51.HUANGFU Y P, BAO Y H, ZHAO X, L et al.Functional properties and structural characterization of soybean protein isolate-tannic acid-polysaccharide ternary conjugates[J].Journal of Food Science and Technology, 2022, 40(6):37-51.
[22] DAI T T, CHEN J, MCCLEMENTS D J, et al.Protein-polyphenol interactions enhance the antioxidant capacity of phenolics:Analysis of rice glutelin-procyanidin dimer interactions[J].Food &Function, 2019, 10(2):765-774.
[23] CHEN J X, HE J J, ZHAO Z H, et al.Effect of heat treatment on the physical stability, interfacial composition and protein-lipid co-oxidation of whey protein isolate-stabilised O/W emulsions[J].Food Research International, 2023, 172:113126.
[24] ZHOU X X, CHEN T, LIN H H, et al.Physicochemical properties and microstructure of surimi treated with egg white modified by tea polyphenols[J].Food Hydrocolloids, 2019, 90:82-89.
[25] CHENG J J, DUDU O E, ZHANG J, et al.Impact of binding interaction modes between whey protein concentrate and quercetin on protein structural and functional characteristics[J].Food Hydrocolloids, 2023, 142:108787.
[26] ALIZADEH-PASDAR N, LI-CHAN E C.Comparison of protein surface hydrophobicity measured at various pH values using three different fluorescent probes[J].Journal of Agricultural and Food Chemistry, 2000, 48(2):328-334.
[27] HAN S, CUI F Z, MCCLEMENTS D J, et al.Structural characterization and evaluation of interfacial properties of pea protein isolate-EGCG molecular complexes[J].Foods, 2022, 11(18):2895.
[28] ZHENG Y M, CHEN B Y, HUANG X X, et al.Ultrasound-assisted free radical modification on the structural and functional properties of ovalbumin-epigallocatechin gallate (EGCG) conjugates[J].Ultrasonics Sonochemistry, 2023, 95:106396.
[29] ZHOU B B, TOBIN J T, DRUSCH S, et al.Dynamic adsorption and interfacial rheology of whey protein isolate at oil-water interfaces:Effects of protein concentration, pH and heat treatment[J].Food Hydrocolloids, 2021, 116:106640.
[30] CHEN Y X, MA M H.Foam and conformational changes of egg white as affected by ultrasonic pretreatment and phenolic binding at neutral pH[J].Food Hydrocolloids, 2020, 102:105568.
[31] 任红涛, 石奇磊, 李静, 等.花生致敏蛋白Ara h1与咖啡酸互作对其抗原性的影响[J].农业工程学报, 2022, 38(8):288-296.REN H T, SHI Q L, LI J, et al.Effects of interaction between peanut allergenic protein Ara h1 and caffeic acid on its antigenicity[J].Transactions of the Chinese Society of Agricultural Engineering, 2022, 38(8):288-296.
[32] WANG Y, ZHANG J, ZHANG L F.Study on the mechanism of non-covalent interaction between rose anthocyanin extracts and whey protein isolate under different pH conditions[J].Food Chemistry, 2022, 384:132492.
[33] LI A J, GUO Z H, WANG Z R, et al.Effect of multiple-frequency ultrasound-assisted transglutaminase dual modification on the structural, functional characteristics and application of Qingke protein[J].Ultrasonics Sonochemistry, 2023, 94:106317.
[34] 张雯, 赵玉红.多酚对平欧榛仁分离蛋白凝胶特性及体外消化特性的影响[J].食品科学技术学报, 2023, 41(4):38-53.ZHANG W, ZHAO Y H.Effect of polyphenols on gel properties and in vitro digestive properties of hazelnut (Corylus heterophylla×Avellana) protein isolate[J].Journal of Food Science and Technology, 2023, 41(4):38-53.
[35] ZHANG Y P, YANG R J, ZHANG W N, et al.Structural characterization and physicochemical properties of protein extracted from soybean meal assisted by steam flash-explosion with dilute acid soaking[J].Food Chemistry, 2017, 219:48-53.
[36] ZHONG M M, SUN Y F, SUN Y D, et al.Soy lipophilic protein self-assembled by pH-shift combined with heat treatment:Structure, hydrophobic resveratrol encapsulation, emulsification, and digestion[J].Food Chemistry, 2022, 394:133514.
[37] ASQUITH T N, BUTLER L G.Interactions of condensed tannins with selected proteins[J].Phytochemistry, 1986, 25(7):1591-1593.
[38] 黄国, 张江江, 田泽鹏, 等.EGCG与大豆7S/11S蛋白互作对乳液稳定性的影响[J].中国食品学报, 2022, 22(12):82-93.HUANG G, ZHANG J J, TIAN Z P, et al.Effect of EGCG and soy 7S/11S proteins interaction on emulsion stability[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(12):82-93.
[39] LIU C, WANG X S, MA H, et al.Functional properties of protein isolates from soybeans stored under various conditions[J].Food Chemistry, 2008, 111(1):29-37.
[40] ACHOURI A, NAIL V, BOYE J I.Sesame protein isolate:Fractionation, secondary structure and functional properties[J].Food Research International, 2012, 46(1):360-369.
[41] KEERATI-U-RAI M, MIRIANI M, IAMETTI S, et al.Structural changes of soy proteins at the oil-water interface studied by fluorescence spectroscopy[J].Colloids and Surfaces B:Biointerfaces, 2012, 93:41-48.
[42] PHAM L B, WANG B, ZISU B, et al.Complexation between flaxseed protein isolate and phenolic compounds:Effects on interfacial, emulsifying and antioxidant properties of emulsions[J].Food Hydrocolloids, 2019, 94:20-29.
[43] WANG R, WANG L H, WEN Q H, et al.Combination of pulsed electric field and pH shifting improves the solubility, emulsifying, foaming of commercial soy protein isolate[J].Food Hydrocolloids, 2023, 134:108049.
[44] LI Y, LIU X Y, YIN F W, et al.Characterization of oyster water-soluble protein-EGCG conjugate and its antioxidant effects on linolic acid in emulsion system[J].Food Bioscience, 2023, 51:102215.
[45] CAO Y Y, XIONG Y L, CAO Y G, et al.Interfacial properties of whey protein foams as influenced by preheating and phenolic binding at neutral pH[J].Food Hydrocolloids, 2018, 82:379-387.