螺旋霉素 (spiramycin, SPI) 和替米考星 (tilmicosin, TIM) 均为分子中含有一个16元环的大环内酯类抗生素 (图1)。螺旋霉素的作用对象包括革兰阳性菌、部分革兰阴性菌、立克次体和大型病毒,用作兽药时主要治疗家畜呼吸道感染和弓形虫病[1]。替米考星的作用对象为革兰氏阳性菌、部分革兰阴性菌、支原体和螺旋体,作为兽用抗生素用于治疗家畜肺炎、禽支原体病及乳腺炎[2]。由于这2种抗生素抗菌谱广,副作用小,因此在实际生产中广泛应用[3]。而使用不当会导致其在环境和人体富集[4],引发细菌耐药性增强,从而增加治疗感染的难度,据统计,2019年有495万人的死亡与感染耐药细菌有关,耐药基因的存在已成为人口死亡的主要原因之一[5]。同年,世界卫生组织发布报告提醒人们警惕抗生素在兽药中被滥用可能导致耐药性基因在动物和人类之间传播,其中,包括螺旋霉素和替米考星在内的大环内酯类抗生素被定义为“最高优先级、至关重要的抗菌药物”[6]。此外,螺旋霉素和替米考星都有一定的心脏毒性,有研究表明,暴露在过量的螺旋霉素下可能会诱发室性心动过速,导致心脏骤停[7]。另一项调查研究了3 168份人体接触替米考星的报告,结果显示该抗生素会造成人体恶心、头晕、酸痛、麻痹、血压异常、心脏功能紊乱,甚至死亡[8]。
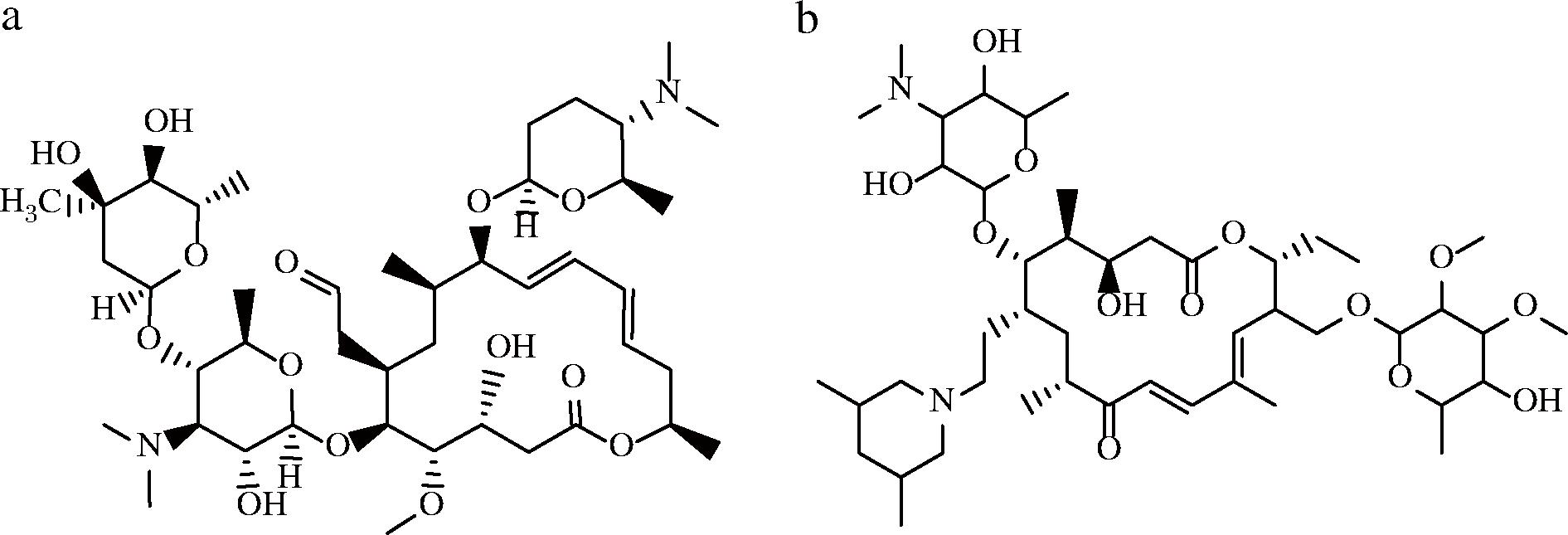
a-螺旋霉素;b-替米考星
图1 分子结构式
Fig.1 The molecular structures
鉴于抗生素滥用带来的严重后果,中国 (GB 31650—2019 《食品中兽药最大残留限量》)、欧盟[9]、日本[10]等都对食品中螺旋霉素和替米考星残留制定了严格的限量标准,欧盟更是早在1999年就禁止螺旋霉素在饲料中添加,我国也于2020年正式进入了全面禁抗时代。目前,抗生素的监管任务依旧严峻,统计2020年市场监督管理局抽检情况,有6批次禽肉中替米考星超标。有研究在2021年通过对30份婴幼儿配方奶粉进行检测,发现其中有7个样本同时含有螺旋霉素和替米考星残留[11],因此,加强对螺旋霉素和替米考星的监管是有必要的。
目前对这2种抗生素的检测,实验室方法主要有HPLC[12]、HPLC-MS/MS[11]、薄层色谱法 (thin-layer chromatography, TLC)[13]、紫外分光光度法 (ultraviolet and visible spectrophotometry, UV-Vis)[14];快检方法主要有表面增强拉曼光谱法 (surface-enhanced Raman spectrometry, SERS)[15]、胶体金免疫层析法(gold immunechromatographic assay, GICA)[16]、酶联免疫法 (enzyme linked immunosorbent assay, ELISA)[17-18]。实验室方法普遍存在样品前处理复杂、专业要求高、仪器设备依赖性强等问题,快检方法通常难以达到要求的灵敏度。
面对多抗生素连用的现状和高灵敏检测的现实需要,建立高效灵敏的快检方法成为亟需解决的问题。而SERS结合免疫层析方法具有高灵敏度、操作简单、可用于现场检测等优点,可以有效弥补螺旋霉素和替米考星在传统快检方法上的缺陷,以实现检测方法的更新迭代。
本研究基于Au4-MBA@Ag增强基底,首次建立了高灵敏同时检测牛奶中螺旋霉素和替米考星的SERS结合免疫层析方法,既有效监管了抗生素滥用情况又提高了检测效率。
1 材料与方法
1.1 材料与试剂
螺旋霉素 (90%)、4-巯基苯甲酸 (4-mercaptobenzoic acid, 4-MBA, 99 %)、抗坏血酸 (99%)、聚乙烯吡咯烷酮 (polyvinyl pyrrolidone, PVP),上海阿拉丁生化科技股份有限公司;替米考星 (99%),上海麦克林生化科技股份有限公司;氯金酸 (99%)、硝酸银 (silver nitrate, AgNO3, 分析纯),国药集团化学试剂有限公司;牛血清白蛋白 (bovine serum albumin, BSA, 99%),南京森贝伽生物科技有限公司;螺旋霉素抗体 (SPI-mAb)、替米考星抗体 (TIM-mAb)、螺旋霉素抗原 (SPI-BSA)、替米考星抗原 (TIM-BSA),苏州鸿信生物技术有限公司;羊抗鼠二抗 (羊抗鼠IgG),中杉金桥生物技术有限公司;聚氯乙烯 (polyvinyl chloride, PVC) 底板、吸水垫、样品垫,上海杰一生物技术有限公司;硝酸纤维素膜 (nitrocellulose membrane, NC膜),长沙博优生物科技有限公司。
1.2 仪器与设备
Milli-Q超纯水制备机,美国Millipore公司;ZNCL-GS磁力加热油浴锅,上海越众仪器设备有限公司;FI-FO785E60X-W便携式光纤探头拉曼光谱仪,北京卓立汉光仪器有限公司;FEI Tecnai G2 F30场发射透射电镜,美国FEI公司;UV-1800紫外分光光度计,日本岛津公司;XYZ-3000型喷金-点膜仪,美国Bio-Dot公司。
1.3 SERS结合免疫层析方法的建立
1.3.1 金核银壳纳米粒子表面电场模拟
由于SERS的增强效果主要来源于电场增强,本研究利用COMSOL分别建立金、金核银壳、核壳存在间隙的金核银壳纳米球模型,模拟一个平面光波由Z轴入射到金属纳米球表面时的表面电场分布,指导合成具有强SERS响应的纳米粒子。其中入射激光波长为785 nm,金和银的折射率来自软件内置材料库,水域宽度为波长的一半,并设置用于吸收散射的完美匹配层。
1.3.2 金核银壳纳米粒子的合成与优化
参考经典的柠檬酸三钠还原法制备金溶胶[19]。取100 mL超纯水在120 ℃,565 r/min条件下加热至沸腾,一次性加入1 mL质量分数为1%氯金酸溶液,再次沸腾后,一次性加入1.5 mL质量分数为1%柠檬酸三钠溶液,120 ℃搅拌15 min后冷却至室温,得到金种子溶胶,即AuNPs。
采用种子介导生长法制备金核银壳纳米粒子[20]。向10 mL AuNPs中加入10 μL 1 mmol/L 4-MBA溶液,室温下搅拌3 h得到Au4-MBA溶液,再加入2 mL 0.1 mol/L抗坏血酸溶液,混合均匀后,滴加适量1 mmol/L AgNO3溶液,充分反应后,4 ℃,10 000 r/min离心10 min,去上清液,超纯水复溶至10 mL,得到间隙嵌有拉曼信号分子4-MBA的金核银壳纳米粒子,即Au4-MBA@AgNPs。
为优化银壳厚度,在10 mL Au4-MBA溶液中分别逐滴加入1、1.5、2、2.5、3、3.5、4 mL 1 mmol/L AgNO3溶液,反应完全后,得到银壳厚度不同的纳米粒子。
1.3.3 拉曼免疫探针的制备
参考前人研究[21],取1 mL Au4-MBA@AgNPs溶液,加入0.1 mol/L K2CO3溶液调节pH值至9,再加入SPI-mAb,继续搅拌3.5 h,加入0.1 mol/L促凝剂,搅拌30 min,再加入20 μL 5 % BSA溶液,搅拌30 min,4 ℃封闭过夜。4 ℃,10 000 r/min离心10 min,沉淀用0.01 mol/L磷酸盐缓冲液 (pH=7.4) 重悬至100 μL,得到螺旋霉素拉曼免疫探针。
以相同的方法制备替米考星拉曼免疫探针,唯一不同之处在于,调节Au4-MBA@AgNPs溶液的pH后,加入适量TIM-mAb。
1.3.4 免疫层析试纸条的组装
用碳酸钠-碳酸氢钠缓冲液 (0.01 mol/L, pH=9.6) 稀释SPI-BSA、TIM-BSA和羊抗鼠IgG,并分别将它们喷涂在硝酸纤维素(nitrocellulose membrane,NC)膜上构成检测线T1、检测线T2和质控线C;干燥后,将NC膜粘贴到PVC底板上,吸水垫和样品垫分别粘贴在靠近C线和T2线的一端。组装好的试纸条切割成宽约4 mm,装入有干燥剂的密封袋中,室温保存。
1.3.5 层析实验与拉曼光谱采集
取200 μL待测液于酶标孔中,加入螺旋霉素和替米考星拉曼免疫探针,将试纸条样品垫一端插入其中,溶液在毛细管作用下依次流过NC膜的T2线、T1线和C线,探针分别与T线上的抗原和C线上的抗体结合,开始显色,约15 min层析过程结束。用便携式拉曼光谱仪采集T1和T2线上的拉曼信号,激发波长为785 nm,激光功率为40 mW,积分时间为4 s,每根试纸条均匀采集10个点取平均值进行数据分析。
1.3.6 实际样品加标回收实验
根据文献[22]方法对牛奶进行预处理,将螺旋霉素和替米考星标准溶液加入当地超市购入的牛奶并在4 ℃,10 000 r/min离心10 min,将质量分数为1% PVP溶液与0.01 mol/L磷酸盐吐温缓冲液 (phosphate buffered saline with Tween 20, PBST, pH=7.4) 等体积混合配制成PVP-PBST缓冲液,取1 mL上清液用PVP-PBST缓冲液稀释10倍,配成最终理论质量浓度为0.01、0.1、1 ng/mL的牛奶加标溶液,各浓度取200 μL进行免疫层析分析,重复3次。
1.4 交叉反应率考察
选取红霉素、竹桃霉素、克拉霉素和罗红霉素,连同螺旋霉素和替米考星分别配制成0、0.001、0.01、0.1、1、10 ng/mL 6个质量浓度的标准溶液,使用上述制备的试纸条进行免疫层析实验,采集试纸条T1线上的拉曼光谱,计算相应的半抑制浓度 (half maximal inhibitory concentration, IC50),评估该方法检测螺旋霉素的特异性,交叉反应率 (cross-reactivity, CR) 的计算见公式(1);采集试纸条T2线上的拉曼光谱,计算相应的IC50,评估该方法检测替米考星的特异性,交叉反应率的计算见公式(2):
(1)
(2)
1.5 分析方法重现性考察
选取0、0.1、1 ng/mL 3个质量浓度进行免疫层析实验,随机采集T1和T2线上10个点的拉曼光谱,记录它们在1 074 cm-1处的信号强度并计算相对标准偏差(relative standard deviation, RSD)。
1.6 数据统计与分析
实验数据以3次平行实验测定数据的平均值±标准偏差表示,采用Excel软件进行数据处理,OriginPro 2021软件进行数据分析与作图。
2 结果与分析
2.1 SERS结合免疫层析反应试剂条的设计
本方法基于抗原和抗体之间竞争反应的原理[21],以拉曼活性基底标记的特异性抗体作为灵敏的拉曼探针,通过液相流动,待测液中的目标分子作为抗原与固定在固相载体上的包被抗原共同竞争拉曼探针上的特异性抗体,当目标分子首先与特异性抗体反应并占据有限的结合位点后,测试线上的包被抗原将不能或少量捕获拉曼探针。过量或未被测试线捕获的拉曼探针会被质控线上固定的IgG捕获。待测液中的目标分子越多,测试线上显示的SERS响应越弱。测试线处的SERS强度与样品中目标分子的浓度成反比。
根据上述原理,设计了如图2所示的免疫层析试纸。层析时,待测液带着螺旋霉素拉曼免疫探针和替米考星拉曼免疫探针在毛细管作用下向吸水垫方向流动,存在以下4种情况:
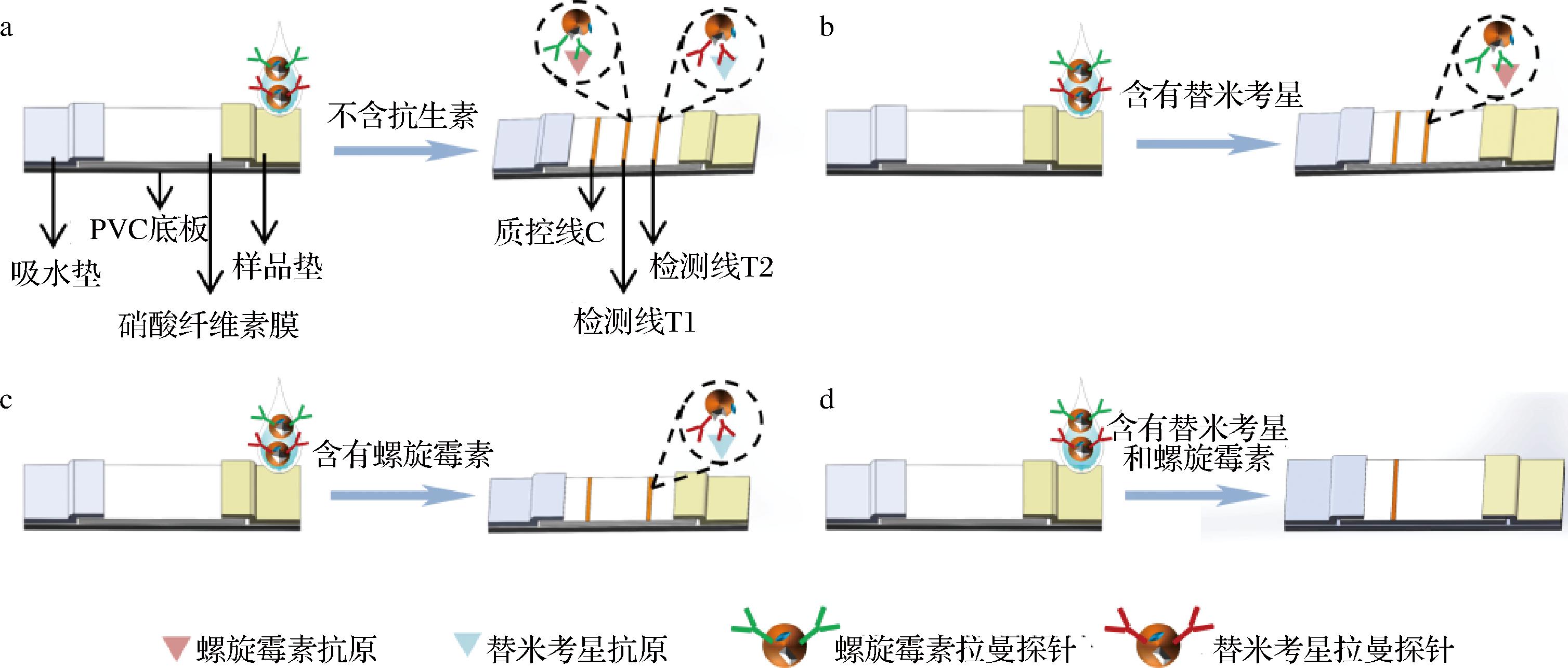
a-样品不含螺旋霉素和替米考星;b-样品只含有替米考星;c-样品只含有螺旋霉素;d-样品含有螺旋霉素和替米考星
图2 SERS结合免疫层析同时检测螺旋霉素和替米考星的设计
Fig.2 The design of SERS-ICA for simultaneous detection of spiramycin and tilmicosin
a)样品中不含螺旋霉素和替米考星(图2-a)。2种探针分别被T1、T2线上固定的抗原捕获,过量的探针继续向前流动,经过C线时,被C线上的抗体捕获,此时C线、T1线T2线均为橙黄色;
b)样品中含有替米考星,不含螺旋霉素(图2-b)。替米考星拉曼免疫探针优先与样品中的替米考星结合,溶液经过T2线时,没有探针被T2线上的抗原捕获,此时C线和T1线为橙黄色,T2线不显色;
c)样品中含有螺旋霉素,不含替米考星(图2-c)。螺旋霉素拉曼免疫探针优先与样品中的螺旋霉素结合,溶液经过T1线时,探针上的螺旋霉素抗体没有空余位点与包被抗原结合,此时C线和T2线为橙黄色,T1线不显色;
d)样品中含有螺旋霉素和替米考星(图2-d)。螺旋霉素拉曼免疫探针和替米考星拉曼免疫探针分别优先与样品中的螺旋霉素和替米考星结合,随着层析的进行,没有探针与T线上的抗原结合,此时C线为橙黄色,T1线和T2线不显色。
无论哪种情况,C线均会呈现橙黄色,通过观察C线显色确定试纸条的有效性,分别采集T1线和T2线上的拉曼信号可以对样品中螺旋霉素和替米考星进行定量分析。
2.2 金核银壳纳米粒子的表面电场分布
对比金、金核银壳和带有间隙的金核银壳纳米粒子的表面电场,图3表明带有间隙的金核银壳纳米粒子有着更强的表面电场,改变核壳间隙分别为2、4、6、8 nm (图3-c~图3-f),其表面电场在间隙为2 nm时表现出最大值,因此,由仿真模拟可知合成核壳间隙为2 nm金核银壳纳米粒子可以达到最佳的SERS增强效果。
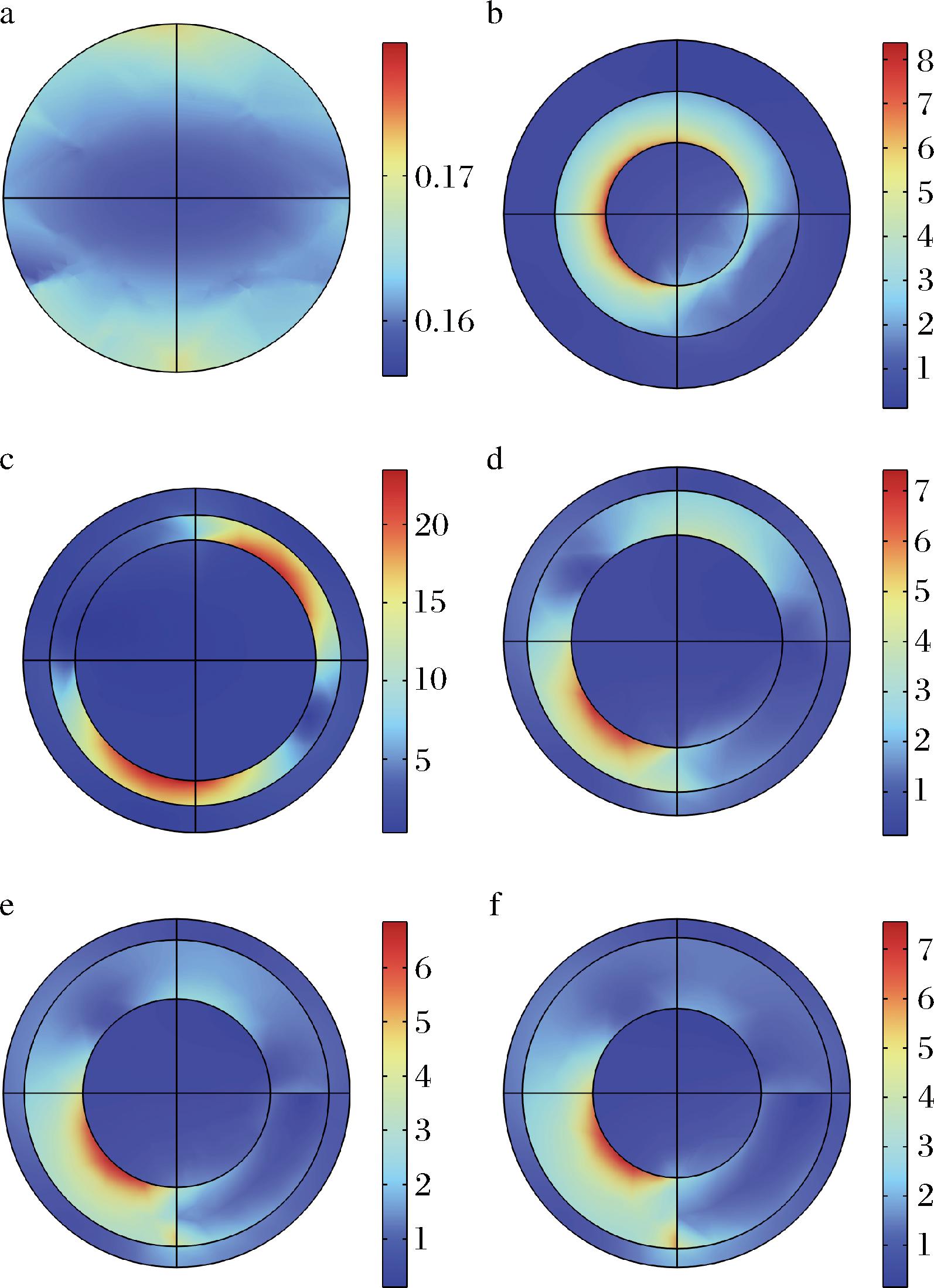
a-AuNPs电场强度;b-Au@AgNPs电场强度;c~f-核壳间隙分别为2、4、6、8 nm的Au@AgNPs电场强度
图3 纳米粒子表面电场模拟
Fig.3 Simulation of the electric field on the surface of nanoparticles
2.3 金核银壳纳米粒子的优化与表征
合成的金纳米粒子为球形(图4-a),尺寸分布在(19.2±2.5) nm(图4-b),在524 nm处存在强紫外吸收峰(图4-f),表明该粒子具有尺寸较小,形状规则,分布均匀的特点,适合作为种子溶液,进行下一步银壳生长实验。

a-AuNPs透射电镜图;b-纳米粒子粒径分布图;c-Au4-MBA@AgNPs颜色变化;d-Au4-MBA@AgNPs表面增强拉曼光谱图;e-Au4-MBA@AgNPs透射电镜图;f-纳米粒子紫外光谱图
图4 纳米粒子特性表征图
Fig.4 Characteristics of nanoparticles
随着AgNO3体积的增大,纳米材料从红色逐渐变为黄色,透明度轻微降低(图4-c),颜色的变化表明金属银已经生长在了金纳米粒子的表面[23]。
将每种纳米粒子经过紫外可见光谱和拉曼光谱扫描,AgNO3刚加入时,524 nm处金的吸收峰逐渐蓝移,并在400 nm左右出现银的特征吸收峰,这是由于银比金有更强的等离子体吸收和更短的等离子体共振波长[24],蓝移的出现表明已经有部分银包裹在金纳米粒子表面[25],形成了金核银壳的纳米结构。当添加量达到3 mL时,金的特征吸收峰完全消失,继续加入AgNO3,由于纳米粒子粒径变大,未被电子占据的分子轨道能级和被电子占据的分子轨道能级之间能隙宽度变小,银的吸收峰出现红移[26]。此时银壳过厚,金在紫外可见光谱下的信号被完全覆盖(图4-f)。
随着AgNO3添加量的增多,SERS信号先增大后降低(图4-d),一方面银具有更高的SERS活性,另一方面金核和银壳的耦合效应可以加大电磁增强,在核壳间隙产生大量的“热点”,4-MBA作为拉曼报告分子通过硫键牢固的镶嵌在金和银之间,使SERS信号得到进一步增强,并且处于间隙中的4-MBA不易受到外界环境的干扰,能够提供稳定强烈的SERS信号[24]。但当银壳过厚时,激光在银壳中的光路增加,部分激光还未照射到4-MBA时就已经被散射了,4-MBA产生的SERS信号也会被银壳屏蔽[27]。此外,银壳过厚时也会破坏纳米粒子的稳定性[27]。因此,以AgNO3添加量为2.5 mL时,制备金核银壳纳米粒子作为拉曼免疫探针的基底材料。该纳米粒子为球形(图4-e),粒径在(23.4±3.0) nm范围内(图4-b),紫外吸收峰出现在396 nm和494 nm处(图4-f),分布均匀。以上结果表明,已成功制备同时具有金的稳定性和银的灵敏度的金核银壳纳米粒子。
2.4 拉曼免疫层析体系的优化
对拉曼免疫体系进行优化(图5),以抑制率(B0/B0.1)为评价指标,B0和B0.1分别是待测物质量浓度为0 ng/mL和0.1 ng/mL时T线上采集的光谱在1 074 cm-1处的拉曼强度,抑制率越大,竞争抑制越明显,检测的灵敏度越高。

a-螺旋霉素抗体量;b-替米考星抗体量;c-螺旋霉素检测中促凝剂种类;d-替米考星检测中促凝剂种类;e-螺旋霉素检测中Na2SO4体积;f-替米考星检测中Na2SO4体积;g-螺旋霉素抗原浓度;h-替米考星抗原浓度;i-螺旋霉素探针体积;j-替米考星探针体积
图5 拉曼免疫层析体系优化
Fig.5 Optimization of Raman immunochromatographic system
2.4.1 抗体添加量
抗体主要是通过静电相互作用连接在金纳米粒子的表面,影响纳米粒子的表面电荷,过高的表面电势会阻碍探针在T线上聚集,过低的表面电势又会减弱胶体的稳定性,因此,使抗体与金纳米粒子有合适的耦合比,可以提高检测的灵敏度[28]。当螺旋霉素抗体和替米考星抗体添加量分别为6 μg(图5-a)和8 μg(图5-b)时,抑制率达到最大。抗体添加过少时,拉曼免疫探针不足导致抑制率下降;抗体添加过多时,离心后,探针溶液中还存在游离抗体,影响竞争抑制反应。此外,过多的抗体在纳米粒子表面结合可能会产生空间位阻,影响抗体与探针的特异性识别或是造成抗体的脱落[29]。
2.4.2 促凝剂种类和添加量
电解质的加入会改变金属胶体的表面电荷和介电常数,诱导纳米粒子聚集,从而产生大量“热点”,还能保护生物大分子,防止其与金属之间发生强烈的化学反应而变性[30]。在制备螺旋霉素和替米考星拉曼免疫探针过程中,以Na2SO4为促凝剂(图5-c、图5-d),添加量分别为18 μL(图5-e)和20 μL(图5-f)时,抑制率最大。这可能是由于不同的电解质对体系的影响不同,比如卤素离子会影响抗原抗体特异性结合的活性,有些离子则会促进探针与待测物的结合[28]。适量的Na2SO4能降低金核银壳纳米粒子的Zeta电位,缩短粒子之间的距离,引发适当的聚集,使SERS信号增强[31]。
2.4.3 包被抗原浓度
螺旋霉素和替米考星抗原质量浓度分别为0.8 mg/mL(图5-g)和1 mg/mL(图5-h)时抑制率达到最大。随着抗原浓度的增加,T线上聚集的探针逐渐达到饱和,再增加抗原的浓度,探针表面的抗体与T线上包被抗原的多价相互作用强于与样品中游离抗原的单价结合[32],导致抑制率降低。
2.4.4 探针添加量
螺旋霉素和替米考星拉曼免疫探针添加量分别为3 μL(图5-i)和2 μL(图5-j)时,抑制率达到最大。随着探针量的增加,T线上捕获的探针达到饱和,继续增加探针量,样品溶液被稀释,此时浓度对抑制率的影响占主导地位。
2.5 标准曲线的建立
将螺旋霉素和替米考星标准溶液用PVP-PBST缓冲液分别稀释至10、1、0.1、0.01、0.001、0.000 1 ng/mL,相同浓度1∶1(体积比)混合,取200 μL各浓度标准溶液和200 μL缓冲液作为待测液,根据上述最优条件,进行免疫层析实验,C线均显色(图6-a),说明试纸条有效。
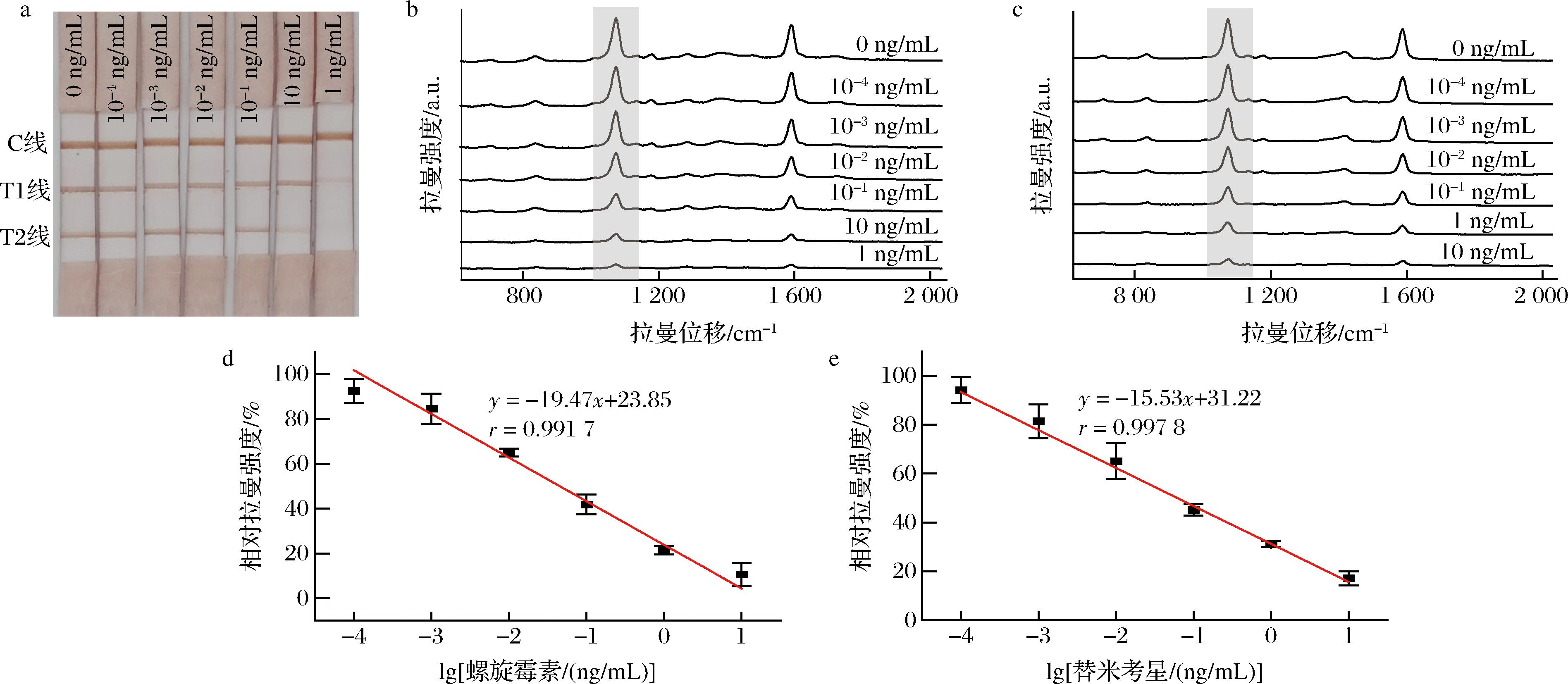
a-层析完成后的试纸条照片;b-T1线的拉曼光谱图;c-T2线的拉曼光谱图;d-螺旋霉素标准曲线图;e-替米考星的标准曲线图
图6 不同浓度螺旋霉素和替米考星下完成免疫层析的结果
Fig.6 Results of immunochromatography at different concentrations of SPI and TIM
采集T1线(图6-b)和T2线(图6-c)的拉曼光谱,所有谱图在1 074 cm-1处显示出强拉曼峰,且浓度越大信号越低。分别以螺旋霉素和替米考星标准溶液的质量浓度的对数值为横坐标,T1线和T2线的相对拉曼强度(B/B0×100%)为纵坐标,绘制螺旋霉素标准曲线和替米考星标准曲线,B和B0分别为各浓度和0 ng/mL时T1或T2线在1 074 cm-1处的峰强。以IC50值评价方法的灵敏度,该值越小表明灵敏度越高[21]。以平均空白样品测试线值减去3倍空白标准偏差对应的浓度作为最低检测限(limit of detection, LOD)[33]。根据拟合计算,该方法检测螺旋霉素的定量方程为y=-19.47x+23.85,r=0.991 7,IC50为0.047 ng/mL,LOD为0.57 pg/mL(图6-d)。该方法检测替米考星的方程为y=-15.53x+31.22,r=0.997 8,IC50为0.075 ng/mL,LOD为0.25 pg/mL(图6-e)。
2.6 牛奶中的回收率
该方法主要通过抗原抗体特异性结合实现信号的采集,因此,受食品基质干扰小,简单的预处理就可以得到较高的回收率。如表1所示,牛奶中螺旋霉素和替米考星的回收率分别为92.6%~103.8%和92.5%~97.5%,RSD分别为1.4%~7.4%和3.4%~8.3%;符合GB 27404—2008《实验室质量控制规范 食品理化检测》附录1中对回收率的要求。
表1 SERS结合免疫层析同时检测加标牛奶中的螺旋霉素和替米考星
Table 1 SERS-ICA for the simultaneous detection of spiramycin and tilmicosin in spiked milk
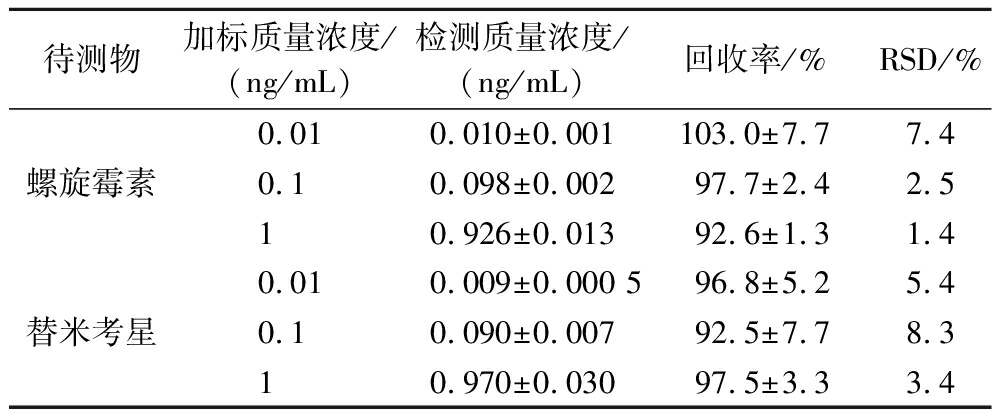
待测物加标质量浓度/(ng/mL)检测质量浓度/(ng/mL)回收率/%RSD/%0.010.010±0.001103.0±7.77.4螺旋霉素0.10.098±0.00297.7±2.42.510.926±0.01392.6±1.31.40.010.009±0.000 596.8±5.25.4替米考星0.10.090±0.00792.5±7.78.310.970±0.03097.5±3.33.4
与国家标准GB/T 20762—2006《畜禽肉中林可霉素、竹桃霉素、红霉素、替米考星、泰乐菌素、克林霉素、螺旋霉素、吉它霉素、交沙霉素残留量的测定 液相色谱-串联质谱法》中采用的方法相比,该方法无需净化过程,减少了复杂预处理造成的待测物损失,当待测物质量浓度高于线性范围(10-4~10 ng/mL)时,T线颜色消失,用PVP-PBST缓冲液将处理液稀释至T线可显色的浓度即可计算其含量。
2.7 分析方法特异性
如表2所示,测定的类似物与螺旋霉素和替米考星均无交叉反应,交叉反应率<0.01%。尽管这些物质都属于大环内酯类抗生素,但在化学结构上仍有自身的特异性,无法和类似物的抗体结合,这表明将来可以深入研究同时检测6种大环内酯类抗生素的SERS结合免疫层析方法。
表2 SERS结合免疫层析测定与其他化合物的交叉反应率
Table 2 The cross-reactivity values of the SERS-ICA with the tested compounds

抗生素CR螺旋霉素/%CR替米考星/%螺旋霉素100<0.01替米考星<0.01100红霉素 <0.01<0.01竹桃霉素<0.01<0.01克拉霉素<0.01<0.01罗红霉素<0.01<0.01
2.8 分析方法稳定性
如图7所示,螺旋霉素从小到大3个浓度的相对标准偏差分别为5.34%、6.76%和4.01%,替米考星的相对标准偏差分别为6.56%、5.29%、3.81%,表明该方法重现性良好。
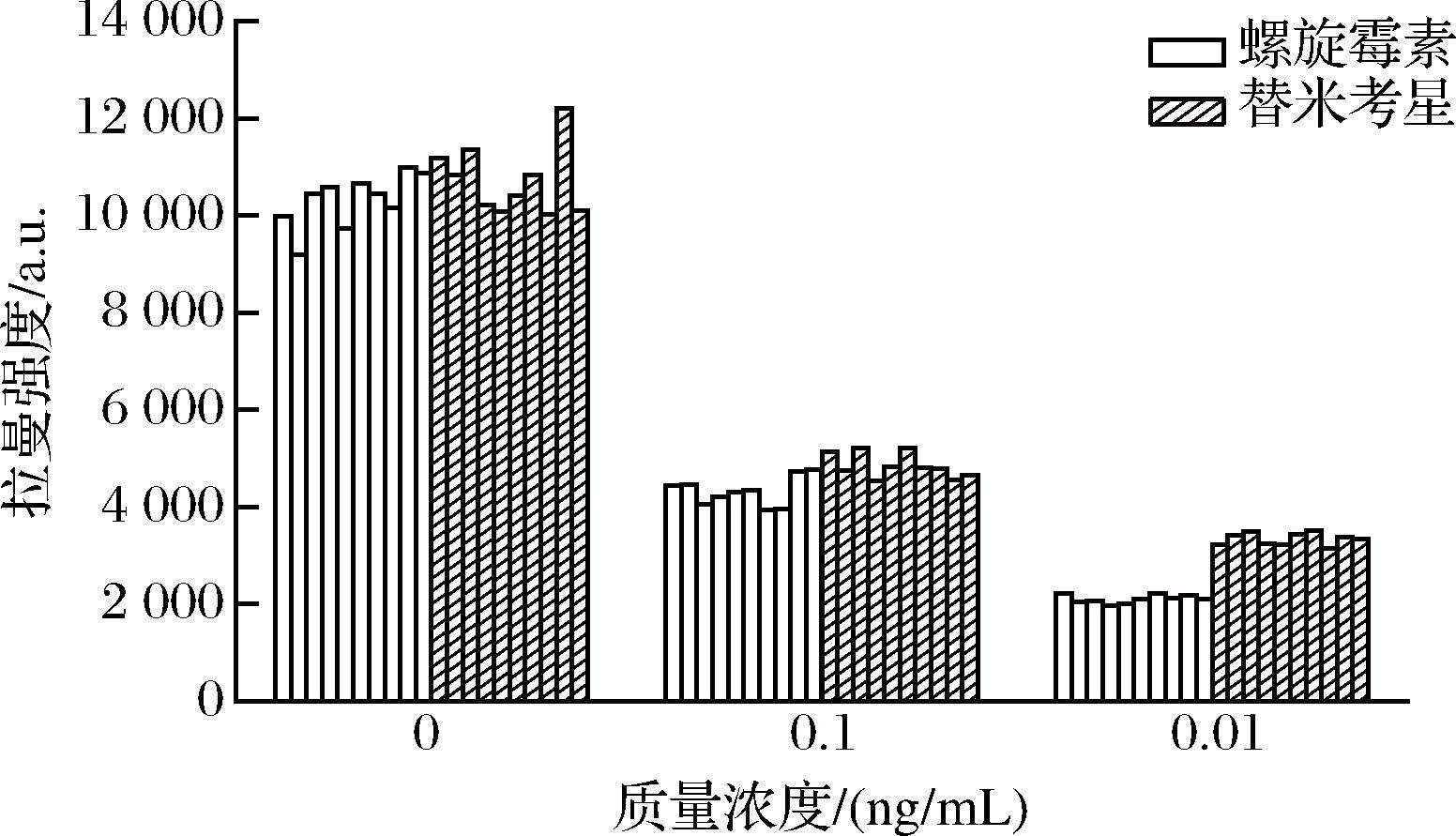
图7 不同浓度螺旋霉素和替米考星存在时试纸条分别采集10个点在1 074 cm-1处的SERS强度
Fig.7 The SERS intensities at 1 074 cm-1 from 10 different spots of test lines on trips at different concentrations of spiramycin and tilmicosin
2.9 方法比较
比较常用的快检方法在螺旋霉素和替米考星中的应用(表3),表面增强拉曼光谱法的检测限高于GB 31650—2019《食品中兽药最大残留限量》中替米考星在畜禽肉(100 μg/kg)和牛奶(50 μg/kg)中的最大残留限量。其他方法虽然满足国标要求,但酶联免疫法需要较长的检测时间;胶体金法仅能通过颜色判断待测物含量是否超过了cut-off值,无法准确定量;而本方法最低的检测限可满足多种场景下检测需求,良好的灵敏度减少了假性结果的概率,较短的检测时间适合现场检测。
表3 螺旋霉素和替米考星快速检测方法比较
Table 3 Comparison of rapid test methods for spiramycin and tilmicosin
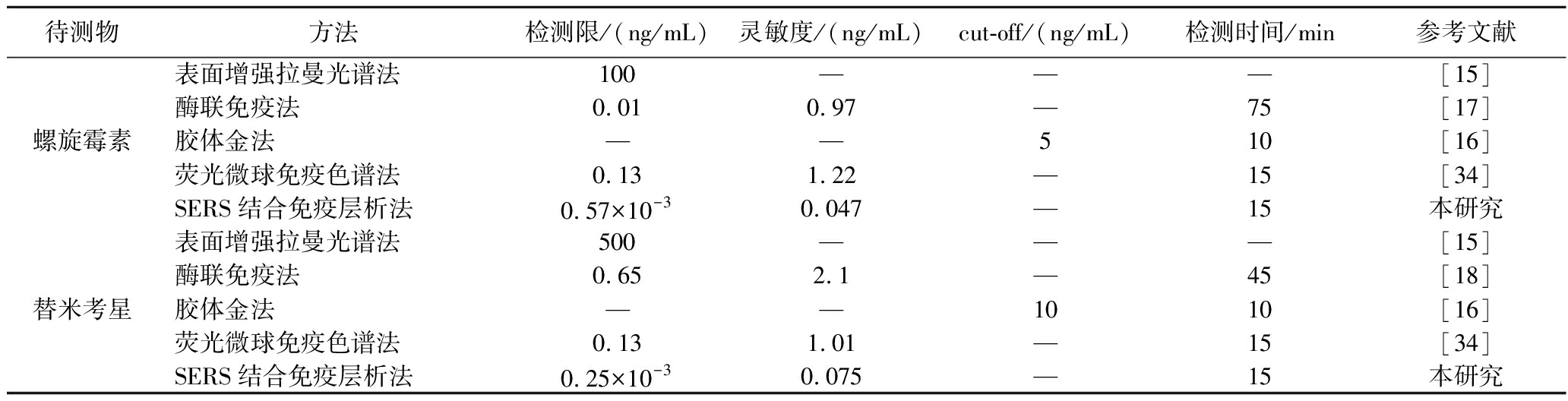
待测物方法检测限/(ng/mL)灵敏度/(ng/mL)cut-off/(ng/mL)检测时间/min参考文献表面增强拉曼光谱法100———[15]酶联免疫法0.010.97—75[17]螺旋霉素胶体金法——510[16]荧光微球免疫色谱法0.131.22—15[34]SERS结合免疫层析法0.57×10-30.047—15本研究表面增强拉曼光谱法500———[15]酶联免疫法0.652.1—45[18]替米考星胶体金法——1010[16]荧光微球免疫色谱法0.131.01—15[34]SERS结合免疫层析法0.25×10-30.075—15本研究
注:—表示无。
3 结论
本研究建立了一种用于同时检测螺旋霉素和替米考星的SERS结合免疫层析方法,对螺旋霉素和替米考星的检测灵敏度分别为0.047 ng/mL和0.075 ng/mL,检测限分别为0.57 pg/mL和0.25 pg/mL,并在牛奶中获得了较高的回收率。该方法通过开发高性能SERS材料改善了GICA的灵敏度,并且提高了检测通量,降低了检测成本,为螺旋霉素和替米考星的现场筛查提供了有力工具,也为将来更多组分抗生素的高灵敏检测提供了新的思路。
[1] ALTAN F, YESILMEN ALP S.Antimicrobial susceptibility testing of Arcobacter butzleri and Arcobacter cryaerophilus isolated from buffalo milk with subclinical mastitis:A different approach[J].Journal of the Hellenic Veterinary Medical Society, 2022, 73(2):4227-4234.
[2] XIONG J, ZHU Q, YANG S, et al.Comparison of pharmacokinetics of tilmicosin in healthy pigs and pigs experimentally infected with Actinobacillus pleuropneumoniae[J].New Zealand Veterinary Journal, 2019, 67(5):257-263.
[3] ZHANG Q Q, YING G G, PAN C G, et al.Comprehensive evaluation of antibiotics emission and fate in the river basins of China:Source analysis, multimedia modeling, and linkage to bacterial resistance[J].Environmental Science &Technology, 2015, 49(11):6772-6782.
[4] GAO J, ZHU M M, HUANG H, et al.Advances, challenges and promises of carbon dots[J].Inorganic Chemistry Frontiers, 2017, 4(12):1963-1986.
[5] COLLABORATORS A R.Global burden of bacterial antimicrobial resistance in 2019:A systematic analysis[J].The Lancet, 2022, 399(10325):629-655.
[6] World Health Organization.WHO list of critically important antimicrobials for human medicine (WHO CIA list)[R].World Health Organization, 2019.
[7] LEKE A Z, DOLK H, LOANE M, et al.Macrolide and lincosamide antibiotic exposure in the first trimester of pregnancy and risk of congenital anomaly:A European case-control study[J].Reproductive Toxicology, 2021, 100:101-108.
[8] VEENHUIZEN M F, WRIGHT T J, MCMANUS R F, et al.Analysis of reports of human exposure to Micotil 300 (tilmicosin injection)[J].Journal of the American Veterinary Medical Association, 2006, 229(11):1737-1742.
[9] Official Journal of the European Union.Commission regulation (EU) No.37/2010 on pharmacologically active substances and their classification regarding maximumresidue limits in foodstuffs of animal origin[S].Brussels:European Commission, 2009.
[10] The Japan Food Chemical Research Foundation.Maximum residue limits (MRLs) list of agricultural chemicals in foods[EB/OL].https://db.ffcr.or.jp/front/,2023-03-28.
[11] PEREIRA B F M, PEREIRA M U, FERREIRA R G, et al.Dietary exposure assessment to macrolide antimicrobial residues through infant formulas marketed in Brazil[J].Food Additives &Contaminants:Part A, 2021, 38(10):1672-1688.
[12] SALEH H, ELHENAWEE M, HUSSIEN E M, et al.Validation of HPLC-UV multi-residue method for the simultaneous determination of tetracycline, oxytetracycline, spiramycin and neospiramycin in raw milk[J].Food Analytical Methods, 2021, 14(1):36-43.
[13] ![]() A, KRZEK J, GADEK M.Simultaneous identification and quantitative determination of azithromycin, clarithromycin, roxithromycin, spiramycin and troleandomycin by thin-layer chromatography and densitometry[J].Acta Chromatographica, 2014, 26(4):657-670.
A, KRZEK J, GADEK M.Simultaneous identification and quantitative determination of azithromycin, clarithromycin, roxithromycin, spiramycin and troleandomycin by thin-layer chromatography and densitometry[J].Acta Chromatographica, 2014, 26(4):657-670.
[14] THANH XUAN D, HOANG V D.Application of Fourier transform-based algorithms to resolve spectral overlapping for UV spectrophotometric co-assay of spiramycin and metronidazole in tablets[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2022, 277:121253.
[15] 洪茜. 基于表面增强拉曼光谱的鸭肉中大环内酯类抗生素残留检测研究[D].南昌:江西农业大学, 2015.HONG Q. Detection of macrolide antibiotic residues in duck meat based on surface enhanced Raman spectroscopy[D]. Nanchang: Jiangxi Agricultural University, 2015.
[16] LI X M, WEN K, CHEN Y Q, et al.Multiplex immunogold chromatographic assay for simultaneous determination of macrolide antibiotics in raw milk[J].Food Analytical Methods, 2015, 8(9):2368-2375.
[17] JIANG W X, ZHANG H Y, LI X M, et al.Monoclonal antibody production and the development of an indirect competitive enzyme-linked immunosorbent assay for screening spiramycin in milk[J].Journal of Agricultural and Food Chemistry, 2013, 61(46):10925-10931.
[18] SONG Y H, SONG S S, LIU L Q, et al.Simultaneous detection of tylosin and tilmicosin in honey using a novel immunoassay and immunochromatographic strip based on an innovative hapten[J].Food and Agricultural Immunology, 2016, 27(3):314-328.
[19] FRENS G.Controlled nucleation for the regulation of the particle size in monodisperse gold suspensions[J].Nature Physical Science, 1973, 241:20-22.
[20] WU X C, YIN L M, GAO S P, et al.Core-satellite nanoassembly system with aptamer-conjugated Au@ Ag nanoparticles for SERS detection of patulin in apples[J].Food Control, 2024, 159:110293.
[21] HUANG W, GUO E H, LI J G, et al.Quantitative and ultrasensitive detection of brombuterol by a surface-enhanced Raman scattering (SERS)-based lateral flow immunochromatographic assay (FLIA) using AgMBA@Au-Ab as an immunoprobe[J].The Analyst, 2021, 146(1):296-304.
[22] SHI Q Q, HUANG J, SUN Y N, et al.A SERS-based multiple immuno-nanoprobe for ultrasensitive detection of neomycin and quinolone antibiotics via a lateral flow assay[J].Mikrochimica Acta, 2018, 185(2):84.
[23] ZHANG Y X, WU G, WEI J T, et al.Rapid and sensitive detection of rotavirus by surface-enhanced Raman scattering immunochromatography[J].Mikrochimica Acta, 2021, 188(1):3.
[24] ZHOU X X, CHEN S H, PAN Y, et al.High-performance Au@Ag nanorods substrate for SERS detection of malachite green in aquatic products[J].Biosensors, 2023, 13(8):766.
[25] DENG D D, YANG H, LIU C, et al.Ultrasensitive detection of Sudan I in food samples by a quantitative immunochromatographic assay[J].Food Chemistry, 2019, 277:595-603.
[26] BI S Y, YUAN Y, ZHANG F M, et al.A sensitive surface-enhanced Raman spectroscopy detection for gentamicin and tobramycin using γ-Al2O3-modified silver nanoparticles coated with bovine serum albumin as substrate[J].Talanta, 2023, 260:124635.
[27] CHEN Y K, YANG S X, SHI X R, et al.Au@ 4-MBA@ Ag NPs labeled SERS lateral flow immunoassay for ultrasensitive and quantitative detection of Salmonella enteritidis[J].Microchemical Journal, 2023, 193:109134.
[28] LIU Z W, CHEN J Y, ZHAO S J, et al.Immunochromatographic assays based on three kinds of nanoparticles for the rapid and highly sensitive detection of tylosin and tilmicosin in eggs[J].Mikrochimica Acta, 2021, 189(1):42.
[29] YANG J Y, PAN M F, LIU K X, et al.Core-shell AuNRs@Ag-enhanced and magnetic separation-assisted SERS immunosensing platform for amantadine detection in animal-derived foods[J].Sensors and Actuators B:Chemical, 2021, 349:130783.
[30] XU L J, LEI Z C, LI J X, et al.Label-free surface-enhanced Raman spectroscopy detection of DNA with single-base sensitivity[J].Journal of the American Chemical Society, 2015, 137(15):5149-5154.
[31] HU R, ZHANG K N, WANG W, et al.Quantitative and sensitive analysis of polystyrene nanoplastics down to 50 nm by surface-enhanced Raman spectroscopy in water[J].Journal of Hazardous Materials, 2022, 429:128388.
[32] HENDRICKSON O D, ZVEREVA E A, ZHERDEV A V, et al.Development of a double immunochromatographic test system for simultaneous determination of lincomycin and tylosin antibiotics in foodstuffs[J].Food Chemistry, 2020, 318:126510.
[33] WANG Z H, LI H, LI C L, et al.Development and application of a quantitative fluorescence-based immunochromatographic assay for fumonisin B1 in maize[J].Journal of Agricultural and Food Chemistry, 2014, 62(27):6294-6298.
[34] LI X M, SHEN J Z, WANG Q, et al.Multi-residue fluorescent microspheres immunochromatographic assay for simultaneous determination of macrolides in raw milk[J].Analytical and Bioanalytical Chemistry, 2015, 407(30):9125-9133.