食用植物酵素是以可用于食品加工的植物为主要原料,由微生物发酵制得的含有特定生物活性成分可供人类食用的酵素产品[1]。酵素可消除自由基、降低胆固醇,能够预防与心血管、肥胖有关的疾病,具有保护和修复肝脏、美白和抗肿瘤等功效[2-5]。目前市场上植物酵素产品种类很多,根据原料类型主要包括果蔬酵素(以苹果、梨、蓝莓、火龙果、胡萝卜、西蓝花等为原料)、谷物酵素(以糙米、玉米、燕麦仁、黄豆、黑豆等为原料)和药食同源酵素(以黄芪、三七等为原料)等[6]。食用植物酵素产品能够预防与肥胖有关的疾病,满足人们对绿色、营养、美容功效的需求,故深受消费者喜爱[7]。已有国内外学者针对酵素定义、分类、制作工艺、酵素发酵过程中的菌株、酵素制作的原材料以及不同酵素的基本功效等相关研究进展进行了分析[8-9],但关于食用植物酵素中真菌毒素的相关检测方法研究相对较少。由于真菌毒素分布广泛,酵素产品发酵过程中,若条件控制不好,有可能会混入产毒的菌株,造成真菌毒素污染。
真菌毒素具有多种毒性作用,包括神经毒性、器官毒性、致突变、致癌、致畸等,并可能影响免疫系统和生殖系统,引起生长阻滞等,且真菌毒素具有较高的稳定性,难以完全去除,给人类的健康造成潜在危害[10-12]。文献报道中常见的真菌毒素检测方法主要包括薄层色谱法[13]、液相色谱法[14]、气相色谱法[15]、免疫法[16]及液相色谱串联质谱法[17-18]等,本研究基于液相色谱串联质谱法具有无需衍生化、定性定量准确、检测灵敏、通量高、抗干扰等特点[19],结合分散固相萃取(QuEChERS)前处理操作简单、适用范围广、速度快等特点[20],建立食用植物酵素中多种真菌毒素污染物的检验方法,对食用植物酵素中33种真菌毒素进行检测,以填补检测标准上的不足,为食用植物酵素类产品的风险监管提供技术支撑。
1 材料与方法
1.1 材料与试剂
乙腈(HPLC)、甲醇(HPLC)、甲酸(MS级)、0.2 μm PTFE微孔滤膜,美国Thermo Fisher公司;乙酸铵(HPLC),Aladdin公司;QuEChERS试剂盒:5982-4921(25 mg C18,150 mg MgSO4),美国Agilent Technologies公司;64503(25 mg PSA,150 mg MgSO4),Dikma Technologies公司;186004832(25 mg C18, 25 mg PSA,150 mg MgSO4),美国Waters公司;0.2 μm PTFE微孔滤膜,美国Thermo Fisher公司。
标准品:T-2毒素、赭曲霉毒素A、杂色曲霉毒素、柄曲霉素、交链孢霉单甲基醚、桔青霉素、镰刀菌酸、白僵菌素、恩镰孢菌素A1、恩镰孢菌素A、恩镰孢菌素B1、α-玉米赤霉醇、恩镰孢菌素B、3-乙酰脱氧雪腐镰刀菌烯醇、15-乙酰脱氧雪腐镰刀菌烯醇、黄曲霉毒素4种混标(B1、G1、B2、G2)、脱氧雪腐镰刀菌烯醇、玉米赤霉酮、玉米赤霉烯酮、HT-2毒素、伏马菌素B3、α-玉米赤霉烯醇、黄曲霉毒素M1、伏马菌素B1、藤毒素、伏马菌素B2、β-玉米赤霉烯醇、β-玉米赤霉醇、交链孢酚、细交链孢菌酮酸 (100 μg/mL)标准品,天津阿尔塔科技有限公司;阴性食用植物酵素样品(未检出各目标化合物的食用植物酵素样品),北京同仁堂兴安保健科技有限责任公司。
1.2 仪器与设备
Waters ACQUITYTM超高效液相色谱仪TQ-S质谱仪、ACQUITY HSS T3色谱柱(2.1 mm×100 mm,1.8 μm)、ACQUITY UPLC C18色谱柱(2.1 mm×100 mm,1.7 μm),美国Waters公司;均质机,德国IKA公司;BT25S万分之一电子天平,德国Sartorius公司;纯水机,德国Millipore公司;75004250 X1R高速冷冻离心机、micro17R小型冷冻离心机、涡旋混合器,美国Thermo Fisher公司。
1.3 标准溶液配制
精密吸取各类液体标准品,用乙腈定容至10 mL,配制成含T-2毒素0.5 μg/mL,含柄曲霉素、杂色曲霉毒素、赭曲霉毒素A、白僵菌素、恩镰孢菌素A、恩镰孢菌素B、恩镰孢菌素A1、恩镰孢菌素B1、玉米赤霉烯酮、α-玉米赤霉烯醇、玉米赤霉酮、β-玉米赤霉烯醇、β-玉米赤霉醇、α-玉米赤霉醇0.1 μg/mL,含交链孢霉单甲基醚、藤毒素、交链孢酚、细交链孢菌酮酸0.2 μg/mL,含黄曲霉毒素B1、黄曲霉毒素G2、黄曲霉毒素B2、黄曲霉毒素G1 0.003 μg/mL,含黄曲霉毒素M1 0.002 μg/mL,含镰刀菌酸、15-乙酰脱氧雪腐镰刀菌烯醇、脱氧雪腐镰刀菌烯醇、HT-2毒素、3-乙酰脱氧雪腐镰刀菌烯醇1 μg/mL,含伏马菌素B1 0.6 μg/mL,伏马菌素B2、伏马菌素B3 0.3 μg/mL,含桔青霉素0.03 μg/mL的混合标准溶液,避光、-18 ℃ 下保存。
吸取混合标准溶液2.5 mL,于50 mL玻璃容量瓶中,用乙腈定容至刻度线,配制成混合标准使用液,摇匀,备用。
分别吸取混合标准溶液0.01、0.02、0.05、0.08、0.1、0.2 mL,用阴性基质试样溶液配制至1 mL,作为混合标准溶液系列工作液。
1.4 样品前处理
准确称取2 g试样(精确至0.01 g)置于25 mL玻璃具塞全刻度试管,用溶剂[V(乙腈)∶V(水)∶V(甲酸)=79∶20∶1]定容至20 mL,振荡提取20 min,冷却至室温后,10 000 r/min离心10 min,取10 mL提取液用QuEChERS管净化,振摇60 s后离心,取上清液于玻璃氮吹管中,氮吹浓缩至近干,用1 mL 80%(体积分数)乙腈水溶液复溶,过0.2 μm PTFE微孔滤膜后供超高效液相色谱-串联质谱仪分析测定。
阴性基质试样溶液:准确称取6个2 g (精确至0.01 g)的同一阴性食用植物酵素样品,按1.4节方法处理,得到阴性基质试样溶液,备用。
1.5 仪器条件
1.5.1 色谱条件
色谱柱:ACQUITY UPLC C18(2.1 mm×100 mm,1.7 μm);柱温:(30±2) ℃;流速:0.3 mL/min;进样体积:10 μL;流动相:A为乙腈、B为0.1%(体积分数)甲酸水溶液,梯度洗脱程序:0~0.5 min:10% A;0.5~2.5 min:10%~40% A;2.5~3.5 min:40% A;3.5~4 min:40%~60% A;4~7 min:60%~80% A;7~8 min:80%~90% A;8~10.5 min:90% A;10.5~11 min:90%~50% A;12~13 min:50%~10% A;13~15 min:10% A。
1.5.2 质谱条件
离子源:ESI±,离子源温度:150 ℃,锥孔电压:35 V,毛细管电压:3.1 kV,脱溶剂气温度:350 ℃,脱溶剂气流速:650 L/h,锥孔气流速:150 L/h,碰撞气流速:0.17 mL/min,其他质谱条件参数见表1。
表1 33种真菌毒素质谱参数
Table 1 Mass parameters of 33 mycotoxins
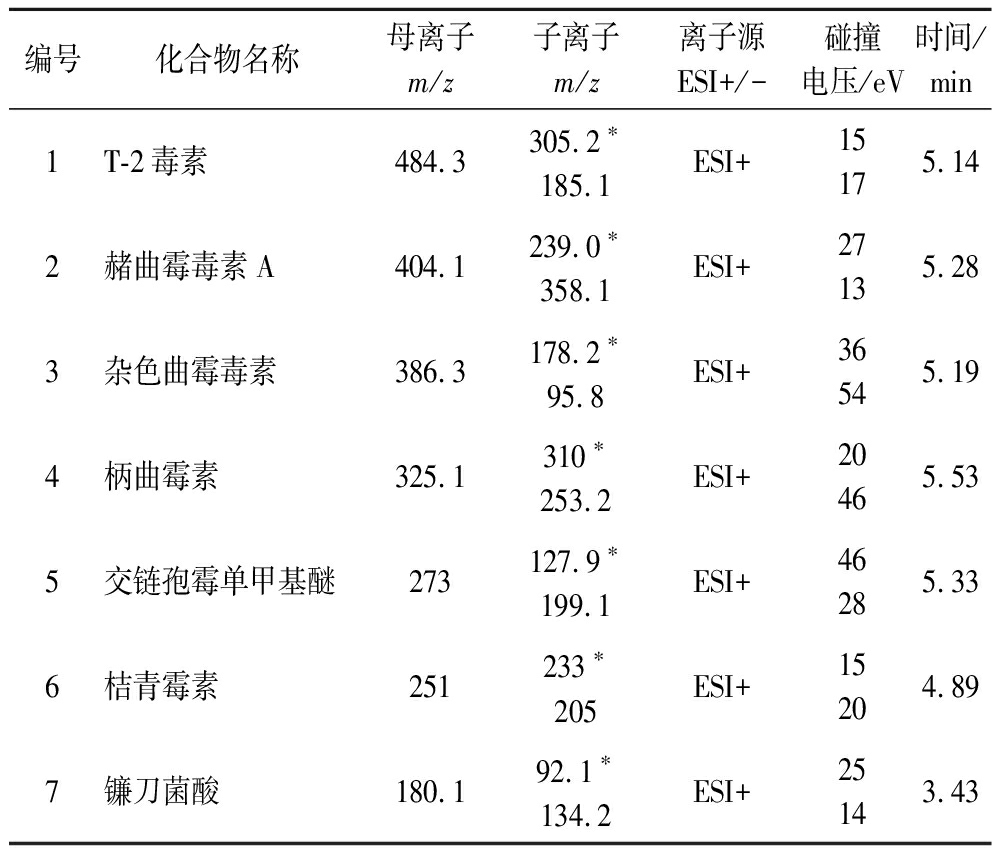
编号化合物名称母离子m/z子离子m/z离子源ESI+/-碰撞电压/eV时间/min1T-2毒素484.3305.2∗185.1ESI+15175.142赭曲霉毒素A404.1239.0∗358.1ESI+27135.283杂色曲霉毒素386.3178.2∗95.8ESI+36545.194柄曲霉素325.1310∗253.2ESI+20465.535交链孢霉单甲基醚273127.9∗199.1ESI+46285.336桔青霉素251233∗205ESI+15204.897镰刀菌酸180.192.1∗134.2ESI+25143.43
续表1

编号化合物名称母离子m/z子离子m/z离子源ESI+/-碰撞电压/eV时间/min8白僵菌素784.6244.2∗134.2ESI+28988.379恩镰孢菌素A682.6210.2∗100.2ESI+24549.5310恩镰孢菌素A1668.6210.3∗100.2ESI+28549.1511恩镰孢菌素B640.6196.2∗86.2ESI+24548.2912恩镰孢菌素B1654.6196.2∗100.2ESI+28548.76133-乙酰脱氧雪腐镰刀菌烯醇339.2231.2∗203.1ESI+13133.591415-乙酰脱氧雪腐镰刀菌烯醇339.1231.1∗137.1ESI+793.5515脱氧雪腐镰刀菌烯醇297.2249.1∗203.2ESI+11182.2516HT-2毒素442.1215.2∗263.2ESI+12124.6117黄曲霉毒素G2331.1285.0∗245.1ESI+25253.8818黄曲霉毒素G1329.1243.1∗311.1ESI+25254.0519黄曲霉毒素M1328.9273.0∗229.0ESI+22403.6820黄曲霉毒素B2313.2285.2∗241.1ESI+30244.2621黄曲霉毒素B1313.1285.0∗241.1ESI+20354.2522伏马菌素B1722.5334.4∗352.4ESI+40323.5623伏马菌素B2706.5336.4∗354.2ESI+40324.2924伏马菌素B3706.3336.4354.2ESI+40324.1325藤毒素415.1312.1∗326.9ESI+20224.6026β-玉米赤霉醇321.1277.2∗303.2ESI-20204.7027α-玉米赤霉醇321.1277.2∗303.2ESI-20204.9028α-玉米赤霉烯醇319.1275.1∗301.1ESI-22224.7029β-玉米赤霉烯醇319.1275.1∗301.1ESI-22224.9630玉米赤霉酮319.1275.1∗161.0ESI-22225.3031玉米赤霉烯酮317.1174.9∗131ESI-28225.3532交链孢酚256.9146.9∗184.9ESI-30244.4333细交链孢菌酮酸196.1139.1∗112.1ESI-20254.3
注:*为定量离子。
2 结果与分析
2.1 质谱条件优化
分别在ESI正、负模式下全扫描以确定各目标化合物电离方式及母离子、子离子,通过进一步优化碰撞能量、锥孔电压等质谱参数,最终确定33种真菌毒素的电离方式、母离子、定性离子和定量离子参数。
2.2 色谱条件优化
选择2款色谱柱比较33种真菌毒素的分离效果,在相同的梯度洗脱条件下,混合标准溶液系列工作液中目标化合物在C18色谱柱分离效果明显优于T3色谱柱,且离子响应大多优于T3,以3种伏马菌素为例的对比图如图1所示。故本实验选择ACQUITY UPLC C18 色谱柱。对比甲醇和乙腈对目标化合物的分离效果,结果显示,在相同液相方法下乙腈比甲醇对多数目标化合物的峰形及分离效果更佳,因此有机相选择乙腈。对比水、0.1%甲酸水溶液与5 mmol/L乙酸铵溶液对目标化合物的影响,结果表明,加入甲酸后,多数目标化合物的峰形明显改善,且在0.1%甲酸水/乙腈作为流动相的体系中,同分异构体伏马菌素FB2和伏马菌素FB3的峰得到完全分离。综合考虑,选用0.1%甲酸水/乙腈作为流动相。
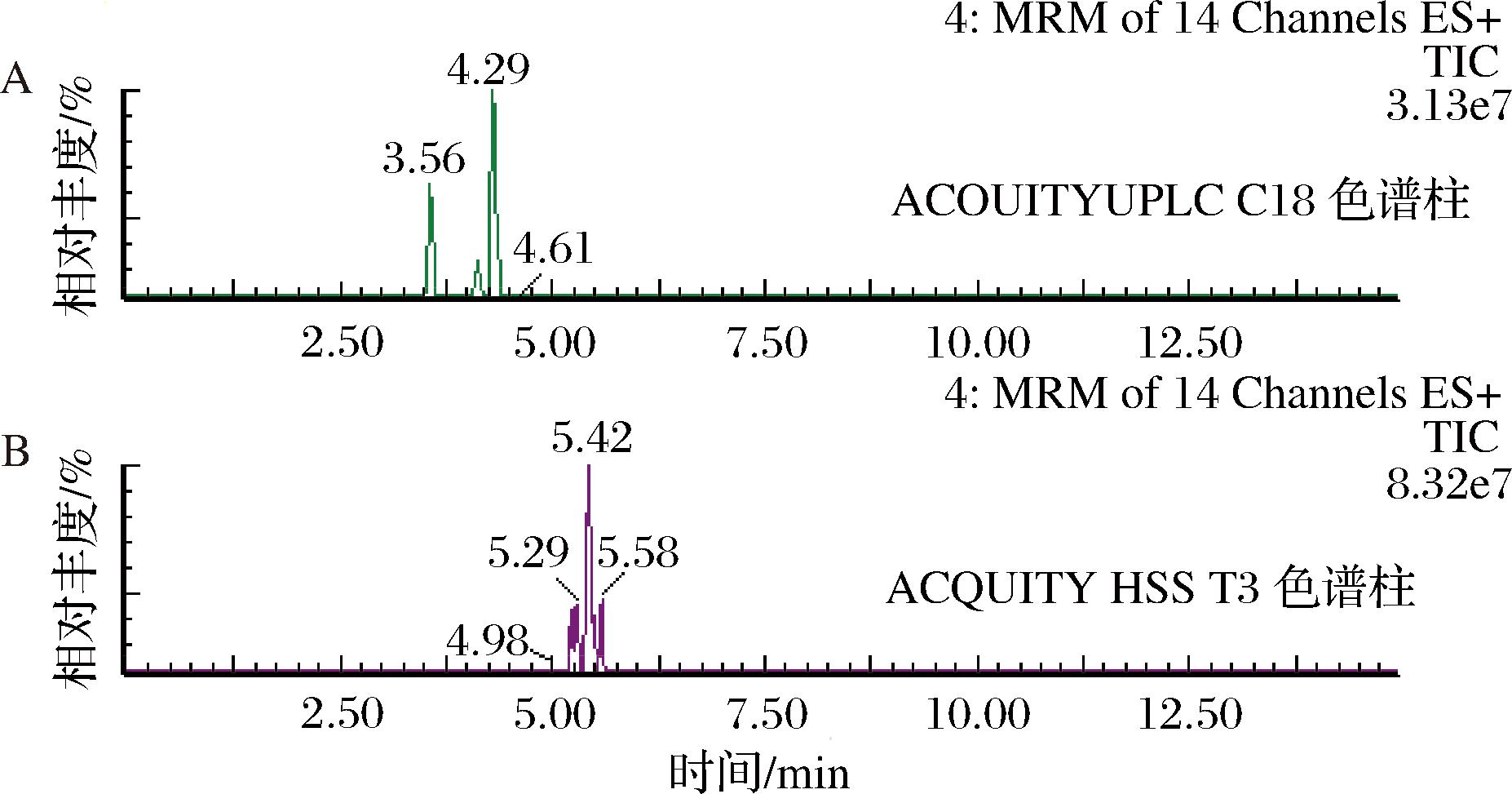
A-ACOUITYUPLC C18色谱柱;B-ACQUITY HSS T3色谱柱
图1 不同色谱柱条件下3种伏马菌素离子谱图
Fig.1 Ion chromatograms of three fumonisins under different chromatographic column conditions
2.3 色谱条件优化
2.3.1 定容液的选择
对比10%乙腈水~100%乙腈作为定容液的分离效果(每间隔10%乙腈为一个实验梯度)。结果表明,80%乙腈水作为定容液时,33种真菌毒素峰型更尖锐,柱保留和分离效果良好,且回收率为60%~120%数量最多。33种真菌毒素的回收率分别在 3个范围数量分布情况如图2所示。
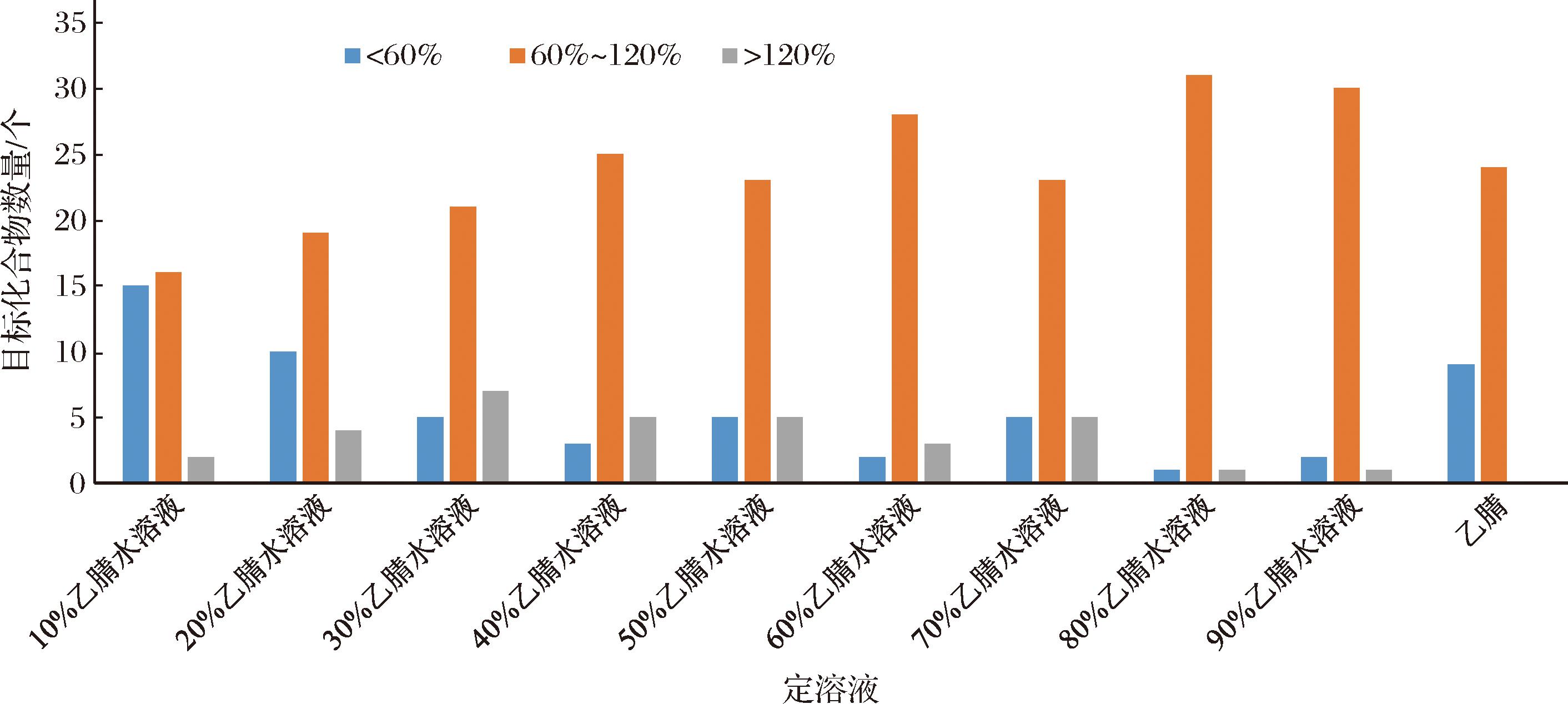
图2 不同定容液条件下33种真菌毒素回收率数量分布图
Fig.2 The recovery rate distribution of 33 kinds of mycotoxins under different constant volume liquid conditions
2.3.2 提取溶液的选择
对比10%乙腈水~100%乙腈作为提取溶液(每间隔10%乙腈为一个实验梯度)。结果表明,80%乙腈水作为提取溶液时,回收率为60%~120%真菌毒素数量最多。目标化合物回收率范围的数量分布图详见图3。进一步对比80%乙腈水(含0.1%甲酸)溶液与80%乙腈水的提取效果,发现加入0.1%甲酸后可进一步提高提取效率,故本实验选择80%乙腈水(含0.1%甲酸)作为提取溶液。
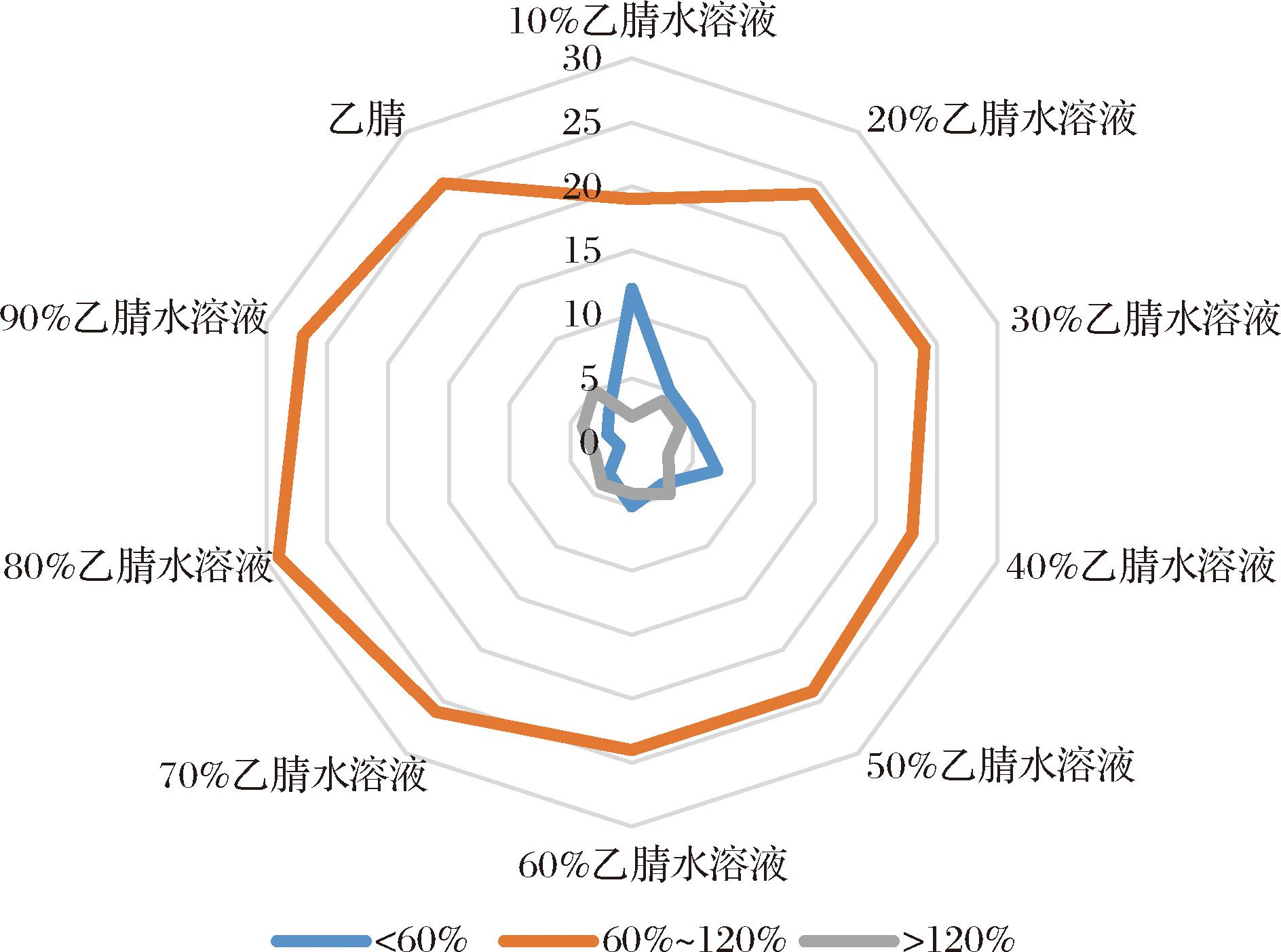
图3 不同提取溶液条件下33种真菌毒素回收率数量分布图
Fig.3 The recovery rate distribution of 33 kinds of mycotoxins under different extraction solution conditions
2.3.3 净化管的选择
本实验采用基质效应=(基质匹配标准曲线的斜率/溶剂标准曲线的斜率)×100%的计算方法,对33种目标化合物的基质效应进行评价。当基质效应为80%~120%时,表明基质效应可忽略;反之则应考虑其影响[21]。33种真菌毒素在样品中的基质效应分布情况如图4所示,多种目标化合物受到较大的基质效应影响。为降低基质效应的影响,本实验比较了3种QuEChERS管对33种真菌毒素的净化效果,回收率对比图详见图5。64503 QuEChERS管对白僵菌素、恩镰孢菌素A、恩镰孢菌素B等目标化合物净化效果不理想;186004832 QuEChERS管对伏马菌素等目标化合物净化效果不理想;5982-4921管净化后33种真菌毒素回收率范围为63.5%~119.8%。故本实验选用5982-4921 QuEChERS管对提取液进行净化,净化后基质效应有明显改善。
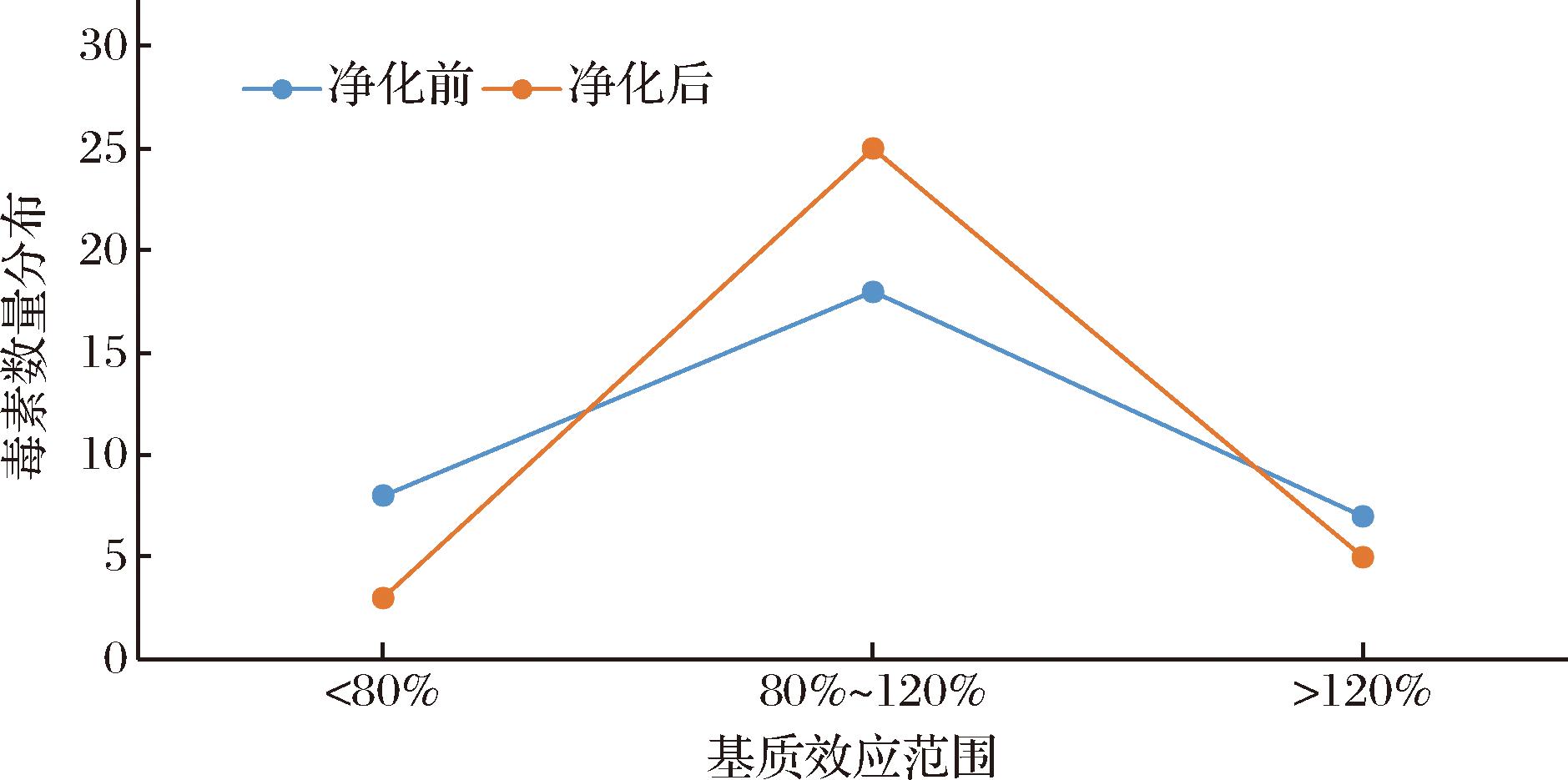
图4 净化前、净化后样品中33种真菌毒素基质效应分布图
Fig.4 Matrix effect distribution of 33 mycotoxins in samples before and after purification
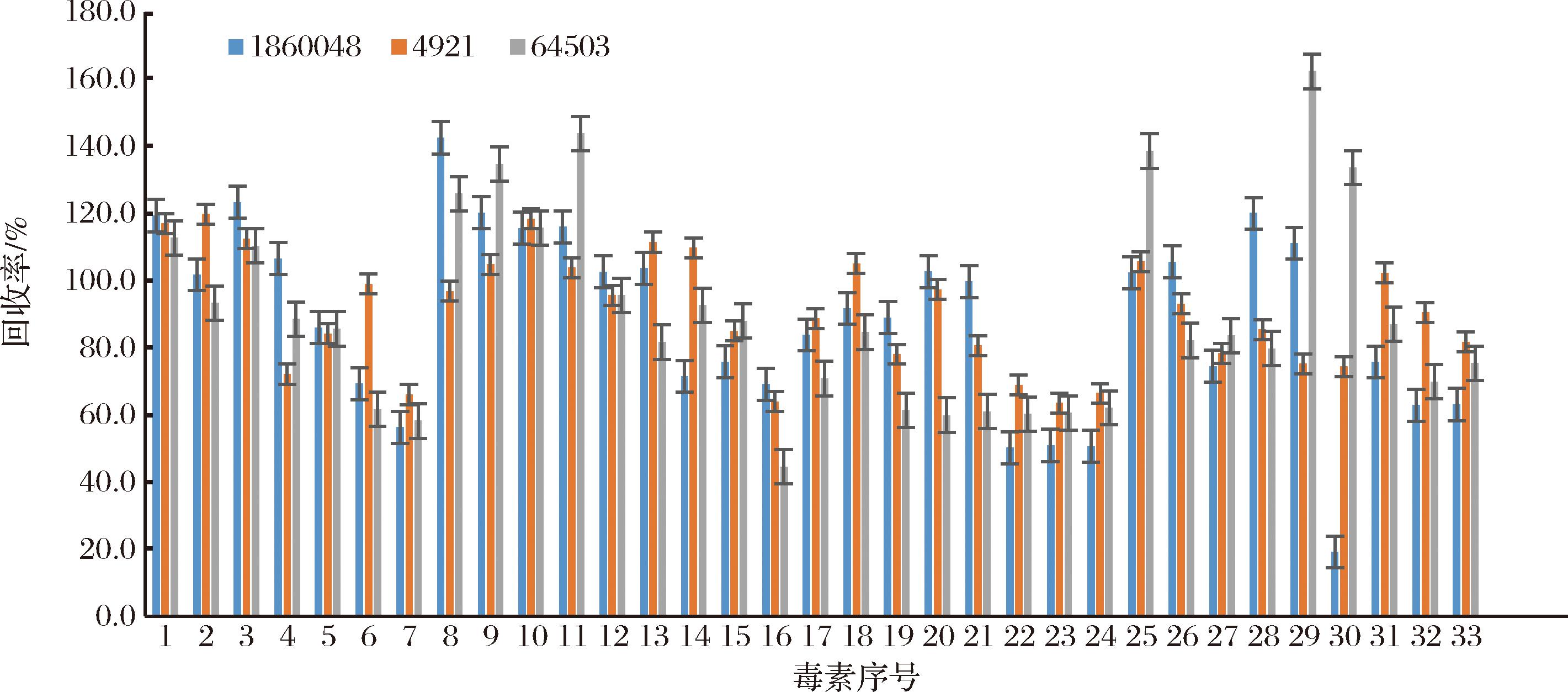
图5 不同净化管条件下33种真菌毒素回收率情况分布图
Fig.5 The recovery rate distribution of 33 kinds of mycotoxins under different purification tube conditions
2.3.4 振荡提取时间的选择
称取6个2.0 g的阴性食用植物酵素样品置于25 mL玻璃具塞全刻度试管,各加入混合标准溶液0.1 mL,加入溶剂[V(乙腈)∶V(水)∶V(甲酸)=79∶20∶1]定容至20 mL,涡旋混匀后,分别振荡提取10~60 min(间隔10 min为1个实验梯度),冷却至室温后,10 000 r/min离心10 min,取10 mL上清液于氮气下浓缩至近干,用1 mL定容溶液复溶,超高效液相色谱-串联质谱仪分析测定。提取实验回收率分布情况不同振荡提取时间如图6所示。如图6所示,在振荡提取时间为20 min时,目标化合物回收率相对较高,进一步延长超声提取的时间,无法显著提升目标化合物回收率,多数目标化合物含量会趋于稳定或降低,故本实验选择20 min作为振荡提取时间。
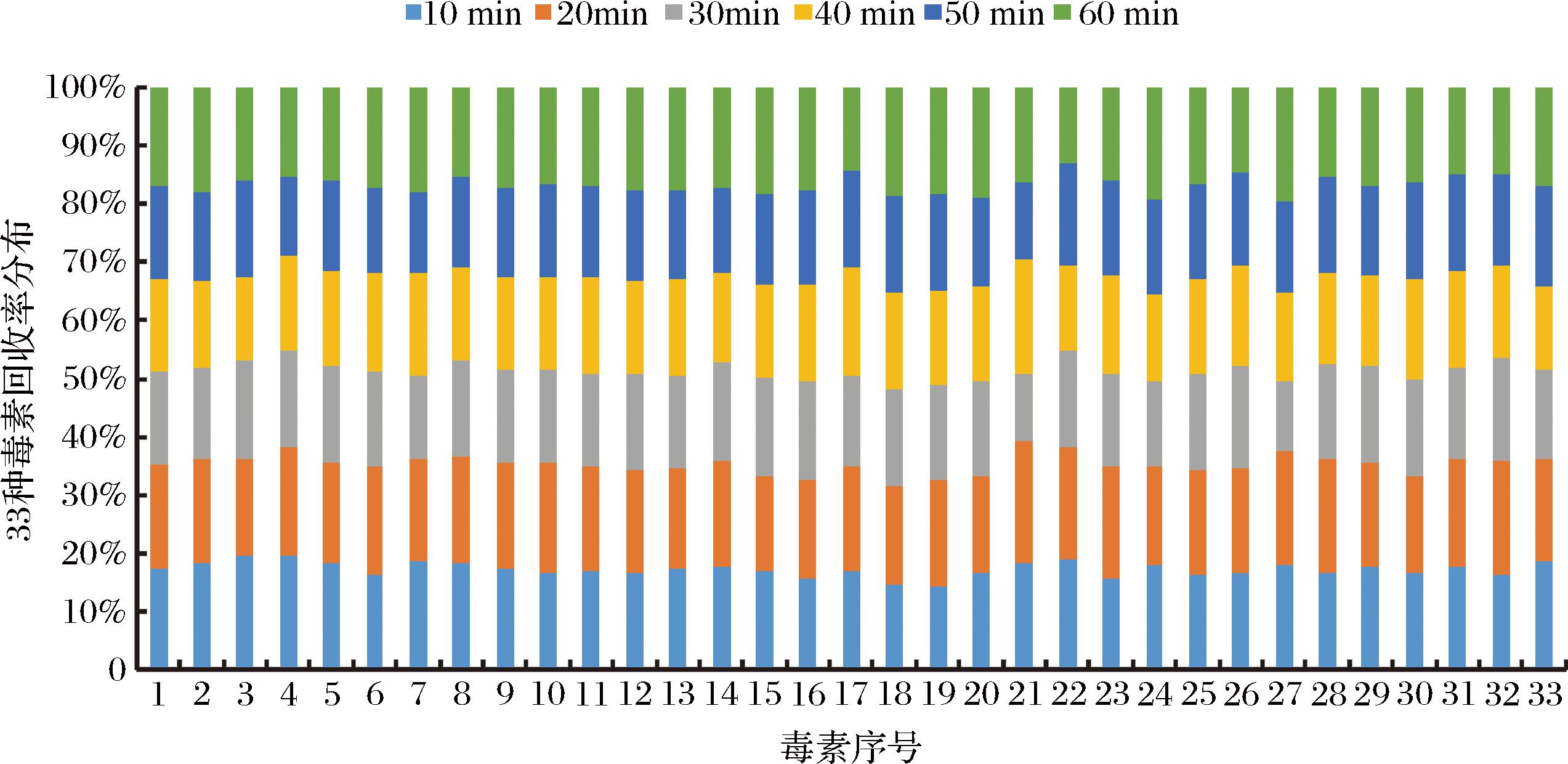
图6 不同振荡提取时间条件下33种真菌毒素回收率占比分布图
Fig.6 The recovery ratio distribution of 33 kinds of mycotoxins under different shaking extraction time conditions
2.4 方法学实验
2.4.1 检出限、定量限与线性范围
取混合标准溶液系列工作液,在多反应监测模式下,进行UPLC-MS/MS分析,得到标准曲线回归方程。当S/N≥3时,对应的质量浓度即为检出限(limit of detection,LOD);当S/N≥10时,对应的质量浓度即为定量限(limit of quantification, LOQ),具体结果如表2所示。结果表明,线性范围内33种目标化合物线性关系良好,决定系数(R2)均大于0.980。
表2 33种真菌毒素的线性范围、标准曲线方程、决定系数、检出限、定量限、回收率和精密度(n=8)
Table 2 Linear ranges, linear equation, correlation coefficient, LOD, LOQ, spiked recoveries, and RSD of 33 mycotoxins (n=8)
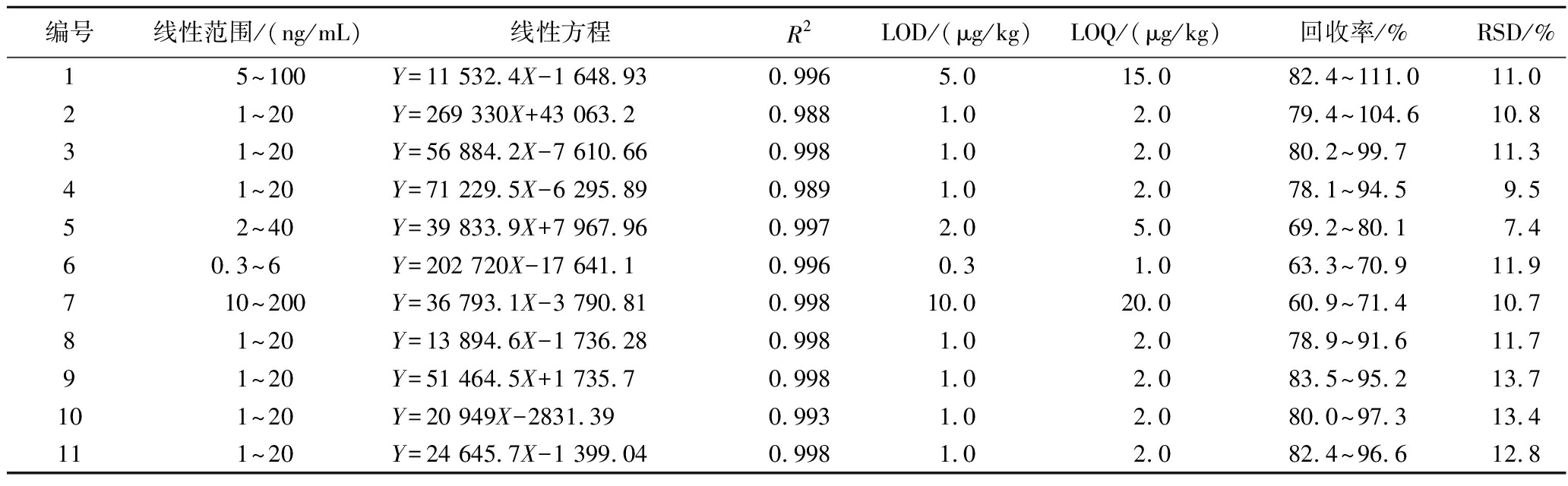
编号线性范围/(ng/mL)线性方程R2LOD/(μg/kg)LOQ/(μg/kg)回收率/%RSD/%1 5~100Y=11 532.4X-1 648.930.9965.015.082.4~111.011.02 1~20Y=269 330X+43 063.20.9881.02.079.4~104.610.83 1~20Y=56 884.2X-7 610.660.9981.02.080.2~99.711.34 1~20Y=71 229.5X-6 295.890.9891.02.078.1~94.59.55 2~40Y=39 833.9X+7 967.960.9972.05.069.2~80.17.460.3~6 Y=202 720X-17 641.10.9960.31.063.3~70.911.97 10~200Y=36 793.1X-3 790.810.99810.020.060.9~71.410.78 1~20Y=13 894.6X-1 736.280.9981.02.078.9~91.611.79 1~20Y=51 464.5X+1 735.70.9981.02.083.5~95.213.710 1~20Y=20 949X-2831.390.9931.02.080.0~97.313.411 1~20Y=24 645.7X-1 399.040.9981.02.082.4~96.612.8
续表2

编号线性范围/(ng/mL)线性方程R2LOD/(μg/kg)LOQ/(μg/kg)回收率/%RSD/%121~20Y=19 542.2X-136.790.9981.02.086.3~103.512.41310~200Y=20 028.6X + 870.2380.98210.020.067.6~77.410.41410~200Y=20 721.3X + 6 844.550.98810.020.065.8~78.97.91510~200Y=3 180.67X -98.779 60.99210.020.069.2~75.98.21610~200Y=1 804.84X+ 399.5110.98410.020.099.7~119.414.1170.03~0.6 Y=950.624X-441.0410.9820.030.170.2~76.910.3180.03~0.6 Y=5 142.32X-55.385 20.9960.030.167.5~78.011.7190.02~0.4 Y=3 189.27X+1 716.780.9840.010.0261.2~69.711.4200.03~0.6 Y=1 434.46X+508.8790.9810.030.168.3~75.912.6210.03~0.6 Y=6 183.74X+1 369.10.9920.030.165.4~80.711.922 6~120Y=105 329X-1 182.060.9936.020.084.6~92.310.3233~60Y=49.263X-0.683 130.9973.010.078.9~83.614.9243~60Y=26.419 5X+0.354 330.9993.010.070.8~87.310.7252~40 Y=126 603X+ 4 713.170.9962.05.075.9~90.19.5261~20Y=1 278.91X+ 74.924 80.9851.02.090.3~118.66.9271~20Y=1 890.96X-185.080.9951.02.085.7~100.37.8281~20Y=1 028.03X-310.3240.9871.02.088.5~106.410.3291~20Y=1 810.68X+161.8910.9801.02.080.9~99.98.6301~20Y=5 369.37X-1 277.680.9801.02.079.8~100.510.8311~20Y=5 014.38X-356.0720.9951.02.0104.0~117.99.6322~40Y=199.214 X+ 41.221 40.9812.05.073.8~100.37.0332~40Y=547.417X+63.112 30.9962.05.068.3~79.514.2
2.5 实际样品检测
随机在商场、超市等流通环节抽取10份市售的食用植物酵素样品,应用本方法针对可能存在的交链孢霉单甲基醚、桔青霉素、镰刀菌酸、白僵菌素等33种真菌毒素开展实验检测,33种目标化合物的检测结果均未达到定量限,10份市售的食用植物酵素样品均未检出相关毒素。
3 结论与讨论
本实验基于液相色谱串联质谱法结合QuEChERS前处理,针对食用植物酵素中可能存在的真菌毒素,建立了食用植物酵素中33种真菌毒素的分析测定方法。通过优化前处理条件及仪器条件对目标化合物实现了良好的提取和富集。该方法操作简单、检测通量高、定性定量准确,可为食用植物酵素类产品的风险监管和质量安全评估提供技术支撑。
[1] 工业和信息化部. QB/T 5324—2018 酵素产品分类导则[S].北京:中国轻工业出版社, 2018.The Ministry of Industry and Information Technology.QB/T 5324—2018, guidelines for classification of enzyme products [S].Beijing:China Light Industry Press, 2018.
[2] 张瑞雪, 马勇, 刘宇, 等.果蔬酵素对黑色素生成的影响[J].食品工业, 2019, 40(5):220-223.ZHANG R X, MA Y, LIU Y, et al.Effects of fruit and vegetable enzymes on melanogenesis[J].The Food Industry, 2019, 40(5):220-223.
[3] 朱政, 周常义, 曾磊, 等.酵素产品的研究进展及问题探究[J].中国酿造, 2019, 38(3):10-13.ZHU Z, ZHOU C Y, ZENG L, et al.Research progress and problems exploring of ferment products[J].China Brewing, 2019, 38(3):10-13.
[4] 郭红莲, 邢紫娟, 余巧银, 等.天然枸杞酵素发酵的代谢产物分析[J].食品研究与开发, 2018, 39(5):48-55.GUO H L, XING Z J, YU Q Y, et al.Analysis of metabolites produced by ferment of natural Lycium barbarum L[J].Food Research and Development, 2018, 39(5):48-55.
[5] 沈燕飞, 聂小华, 孟祥河, 等.酵素食品加工微生物与功能特性研究进展[J].浙江农业科学,2019, 60(1):112-116.SHEN Y F, NIE X H, MENG X H, et al.Review in microorganism and function of fermented plant extract[J].Journal of Zhejiang Agricultural Sciences, 2019, 60(1):112-116.
[6] XIAO X W, LI S Y, ZHOU X B, et al.The anti-obesogenic effects and underpinning mechanisms of fermented plant-based foods:A review[J].Trends in Food Science &Technology, 2023, 136:1-10.
[7] 赵金凤, 曲佳乐, 皮子凤, 等.植物酵素润肠通便保健功能研究[J].食品与发酵科技, 2012, 48(3):54-56.ZHAO J F, QU J L, PI Z F, et al.Study on the health care function of relieving constipation of plant enzyme[J].Food and Fermentation Technology, 2012, 48(3):54-56.
[8] 张红艳, 韩姗姗, 冉淦侨, 等.食用酵素的营养功效及研究进展[J].食品与发酵科技, 2021.57(1):107-110.ZHANG H Y, HAN S S, RAN G Q, et al.Nutritional efficacy and research progress of edible enzymes[J].Food and Fermentation Sciences &Technology, 2021, 57(1):107-110.
[9] 饶智, 陈彦坤, 刘斌, 等.“药食同源”植物酵素研究进展[J].食品与发酵工业, 2020, 46(9):290-294.RAO Z, CHEN Y K, LIU B, et al.Research progress on “herb -food homology” plant Jiaosu[J].Food and Fermentation Industries, 2020, 46(9):290-294.
[10] OSTRY V, MALIR F, TOMAN J, et al.Mycotoxins as human carcinogens-the IARC Monographs classification[J].Mycotoxin Research, 2017, 33(1):65-73.
[11] 戴海蓉, 梁思慧, 王春民, 等.同时检测食品中多种类真菌毒素的研究进展[J].中国食品学报, 2022, 22(8):398-415.DAI H R, LIANG S H, WANG C M, et al.Research progress on simultaneous detection of multiple mycotoxins in food[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(8):398-415.
[12] 马帅, 李安, 潘立刚.真菌毒素脱毒技术研究进展[J].食品工业科技, 2024, 45(5):377-383.MA S, LI A, PAN L G.Research progress in the detoxification technology of mycotoxins[J].Science and Technology of Food Industry, 2024, 45(5):377-383.
[13] BEYENE A M, DU X W, E SCHRUNK D, et al.High-performance liquid chromatography and Enzyme-Linked Immunosorbent Assay techniques for detection and quantification of aflatoxin B1 in feed samples:A comparative study[J].BMC Research Notes, 2019, 12(1):492.
[14] 刘坚, 孙婷琳, 秦时聪, 等.高效液相色谱同步检测小麦中脱氧雪腐镰刀菌烯醇和玉米赤霉烯酮的方法研究[J].食品科技, 2024, 49(2):329-333.LIU J, SUN T L, QIN S C, et al.Simultaneous determination of deoxynivalenol and zearalenone in wheat by high performance liquid chromatography[J].Food Science and Technology, 2024, 49(2):329-333.
[15] 杨琳, 张宇昊, 马良.高效液相色谱法同时检测粮谷中的黄曲霉毒素和赭曲霉毒素[J].食品科学, 2010, 31(24):250-254.YANG L,ZHANG Y H,MA L.Simultaneous determination of aflatoxins and ochratoxin A in cereal grains by high performance liquid chromatography[J].Food Science, 2010, 31(24):250-254.
[16] 周颖琴, 熊瑛, 吴愫青.酶联免疫吸附法测定药食同源中药饮片中黄曲霉毒素的研究[J].现代食品, 2022, 28(18):163-168.ZHOU Y Q, XIONG Y, WU S Q.Study on the determination of aflatoxin in traditional Chinese medicine slices with the homology of medicine and food by enzyme linked immunosorbent assay[J].Modern Food, 2022, 28(18):163-168.
[17] 张丹, 刘柏林, 赵紫微, 等.PRiME HLB 柱净化-超高效液相色谱-串联质谱法快速测定果蔬制品中5 种新型真菌毒素[J].分析化学, 2023, 51(8):1343-1357.ZHANG D, LIU B L, ZHAO Z W, et al.Rapid determination of five kinds of emerging mycotoxins in fruit and vegetable products by PRiME HLB purification coupled with ultra performance liquid chromatographytandem mass spectrometry[J].Chinese Journal of Analytical Chemistry, 2023, 51(8):1343-1357.
[18] 吴琴燕, 张文文, 梁红芳, 等.QuEChERS-UPLC-MS/MS法检测粮食中的黄曲霉毒素[J].粮油食品科技, 2024, 32(2):145-150.WU Q Y, ZHANG W W, LIANG H F, et al.Determination of aflatoxins in grains by QuEChERS-UPLC-MS/MS[J].Science and Technology of Cereals, Oils and Foods, 2024, 32(2):145-150.
[19] 牛灿杰, 叶素丹, 胡玉霞, 等.谷物及制品中真菌毒素前处理及检测技术研究进展[J].食品与机械, 2023, 39(5):203-210;240.NIU C J, YE S D, HU Y X, et al.Research progress in detection technologies of mycotoxins in cereals and cereal-based products[J].Food and Machinery, 2023, 39(5):203-210;240.
[20] 高云慨, 陈小妹, 陈春泉, 等.咖啡中3种赭曲霉毒素QuEChERS-UPLC-MS/MS检测方法[J].食品与机械, 2023, 39(11):91-97.GAO Y K, CHEN X M, CHEN C Q, et al.Establishment of QuEChERS-UPLC-MS/MS method to determine three kinds of ochratoxins in coffee[J].Food &Machinery, 2023, 39(11):91-97.
[21] 邵瑞婷, 丁学妍, 姜洁.超高效液相色谱-串联质谱法测定调节三高类保健食品中59种非法添加药物[J].食品科学, 2024,45(9):232-242.SHAO R T, DING X Y, JIANG J.Determination of 59 illegal addition of drugsin three kinds of regulated health food by ultra-high performance liquid chromatography-tandem mass spectrometry[J].Food Science, 2024,45(9):232-242.