食品安全对于保障公众健康、维护社会稳定、促进经济发展等方面具有重要意义,国家高度重视食品安全问题[1]。因此,应该加强食品检测技术的研究和开发,不断提高食品检测的准确性和效率,确保食品的安全性和质量。存在于食品中的霉菌毒素会分解食品中的营养成分,导致食品变质、营养价值下降,甚至产生有害物质等问题,严重危害人体健康,所以食品中的霉菌毒素检测一直是一个重要的话题。常用于检测霉菌毒素的传统仪器检测方法有免疫化学检测法、色谱法、荧光检测法等各自在特定的检测领域具有显著优势,但同时存在一些共同的缺点,如设备成本高、操作复杂、干扰因素多、适用范围的局限、实时性差等[2]。所以仍需要寻找能够现场、快速、低成本且具有高灵敏度的新型材料检测方法。
DNA水凝胶是一种由DNA分子自组装形成的介于流体和固体之间的亲水材料,它结合了DNA的生物相容性、可设计性和水凝胶的柔软性、吸水性等特点。DNA水凝胶的结构在检测中具有多方面的优势,包括三维网络结构、可编程性和特异性、信号放大能力、生物相容性和可降解性、机械性能和稳定性以及多样化的检测策略等。基于其形成过程中交联键的类型,可以分为物理交联法和化学交联法。形成的物理水凝胶具有较好的生物相容性和可降解性,且能够通过改变外部条件实现凝胶与溶液状态的可逆转换。形成的化学水凝胶结构稳定,不易受外界环境影响,具有较好的机械强度和耐久性。随着对DNA水凝胶研究的不断深入,利用DNA水凝胶的优异特性提高检测食品中霉菌毒素的灵敏度、速度、操作的简易程度以及定量检测逐渐成为研究热点。目前纯DNA水凝胶具有较差的机械性能和低尺寸稳定性,且会造成不可避免的累积误差,限制了纯DNA水凝胶的应用,关于纯DNA水凝胶应用在食品中霉菌毒素的检测还有待进一步研究,而复合DNA水凝胶的应用更为广泛[3-4]。复合DNA水凝胶的研究相较于传统方法,在合成策略、功能性设计以及在食品中霉菌毒素检测的应用等方面均展现出一定的优势。在合成策略方面,复合DNA水凝胶引入了聚合物、纳米粒子等多种组分,通过化学键或物理作用形成较复杂的网络结构,这种多组分交联提高了水凝胶的机械性能和稳定性[5-6]。在功能性设计方面,复合DNA水凝胶具有高度的灵活性和多样性,可根据具体需求不断优化,主要方向有响应性设计、生物传感设计以及智能化设计[7]。在霉菌毒素的检测应用方面,复合DNA水凝胶与微流控技术、信号放大技术、生物传感技术的结合,为霉菌毒素的检测提供了新的平台,可实现对霉菌毒素的高灵敏度、高特异性检测,为食品安全检测提供了有力工具。
本文综述了复合DNA水凝胶的物理和化学合成方法,根据复合DNA水凝胶的合成材料不同,分类介绍了聚合物复合和纳米粒子复合的DNA水凝胶,评述了复合DNA水凝胶在检测食品中霉菌毒素的研究进展,并讨论了复合DNA水凝胶在检测食品中霉菌毒素研究方面的挑战以及未来的应用前景。
1 用于食品中霉菌毒素检测的复合DNA水凝胶的分类
复合DNA水凝胶是DNA水凝胶中除了纯DNA水凝胶以外的另一大分支,该类水凝胶与聚丙烯酰胺、纳米粒子等物质相结合,在食品安全检测等方面有更广泛的应用。将聚合物链上的DNA分子作为相互作用节点交联而形成的复合DNA水凝胶为聚合物-DNA水凝胶。ZHENG等[8]将丙烯酰胺、磷酸缓冲溶液与DNA链混合、干燥、脱气后加入乙二胺四乙酸、过硫酸铵,经离心纯化得到聚合物,置于金属浴中多次孵育后混合辣根过氧化物酶,再次置于金属浴孵育操作,得到嵌入辣根过氧化物酶的DNA水凝胶,这种聚合物-DNA水凝胶在黄曲霉毒素检测方面具有极高的亲和力与特异性。DNA链中结合金属纳米颗粒等纳米粒子的纳米粒子-复合DNA水凝胶是复合DNA水凝胶的另一个类别。TANG等[9]将1-乙基-(3-二甲氨基丙基)碳二亚胺盐酸盐、N-羟基琥珀酰亚胺与透明质酸钠盐混合,待透明质酸钠盐活化后分别加入2种DNA链中,将二者混合并加入铂纳米颗粒,经振荡、孵育、搅拌操作后加入聚乙烯亚胺孵育,得到铂纳米颗粒-DNA水凝胶,可应用于检测花生中的黄曲霉毒素B1。
聚合物-DNA水凝胶通常通过将DNA嫁接到聚合物链上,并通过DNA杂交或超分子相互作用连接聚合物链来制备[10],而纳米粒子-DNA水凝胶则是通过DNA与纳米粒子以包封、掺杂等方式形成,因为含有磁性纳米颗粒、量子点等纳米粒子而获得了理想的光学、磁性和电子特性[5]。二者在合成方式上的差异不明显,具有更多的通性,如通过改变DNA与聚合物或纳米粒子浓度的比例调节水凝胶的机械性能等,为复合DNA水凝胶在食品安全检测的应用提供了新思路[11]。
2 复合DNA水凝胶的制备方法
复合DNA水凝胶的合成是复合DNA水凝胶研究中重要的一环。NAGAHARA等[12]在1996年将DNA链修饰成聚丙烯酰胺网络并作为交联点合成了复合DNA水凝胶,但是其中的聚合物分散不均匀,导致复合DNA水凝胶网络中的网眼大小不一,其小网眼导致复合DNA水凝胶的渗透性差。CHENG等[13]将多条DNA单链混合在缓冲液中,加热冷却形成Y形DNA,向其中加入盐酸与缓冲溶液调整pH,同时加入修饰的金纳米颗粒,得到含有金纳米颗粒的复合DNA水凝胶,该水凝胶网络固定,具有优异的渗透性。随着复合DNA水凝胶的研究不断深入,通过对于合成DNA水凝胶的作用力的区别,可将合成方法分为物理交联法和化学交联法。这2种方法合成的DNA水凝胶在稳定性、合成条件上有所不同,下面将从这2种方法讲述复合DNA水凝胶的制备。
2.1 物理交联法
利用氢键或范德华力非共价键力和DNA链等作用相互交联而形成DNA水凝胶的方法被称为物理交联法。其通常需要使用Y形DNA(Y-DNA)与连接体DNA(L-DNA),利用L-DNA具有的2个识别位点,将其中一个用于构造符合实验需要的适配体,再通过L-DNA与Y-DNA的交联或滚环扩增等手段制备复合DNA水凝胶[14-15]。物理交联较于化学交联,可以不引入外来物质,减少对体系稳定性的影响,对温度、pH等因素敏感,具有一定的优势[16]。有研究表明,先使用化学物质合成了杂交体或聚合物链,然后借助DNA酶或紫外红外等物理作用与DNA片段混合、孵育形成DNA水凝胶,在检测微藻囊毒素、T-2毒素、链霉素等方面有着十分重要的作用[17-19]。CHEN等[20]将多种DNA链混合在缓冲液中,加热冷却形成DNA支架,用相同的方法制备DNA连接剂溶液后将混合转移到光子晶体模板中,使用紫外光聚合,形成光子晶体-DNA水凝胶,对于黄曲霉毒素B1的检测具有极高的灵敏度与可观测度。LI等[21]使用DNA连接酶将游离cDNA与2个线性挂锁探针的末端交联,形成2个环状 DNA,在DNA聚合酶作用下,以circ-DNA为模板启动滚环扩增,产生2个超长单链DNA,这些超长单链DNA可以通过物理纠缠缠入水凝胶中,并通过互补片段的杂交交联到水凝胶中,如图1所示。这种双重交联机制增强了DNA水凝胶的稳定性和机械强度,促进了信号分子的有效捕获,在检测牛奶中的卡纳霉素时体现了极强的特异性。
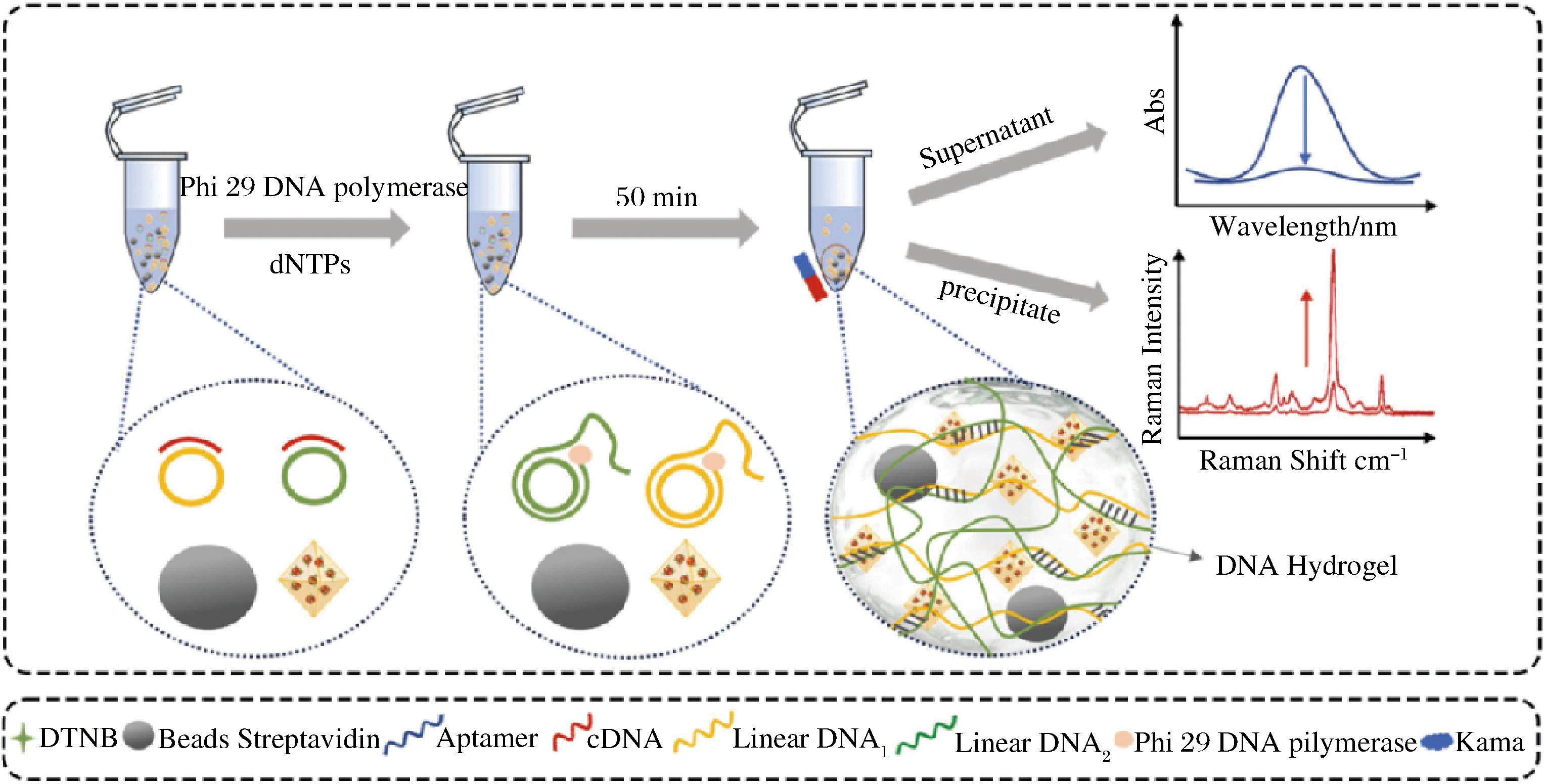
图1 滚环扩增一种DNA水凝胶用于食品方面的检测[21]
Fig.1 Rolling circle amplification of DNA hydrogel for food safety detection
2.2 化学交联法
利用化学键制备复合DNA水凝胶的方法是化学交联法。化学交联法常使用DNA链组装X形DNA(X-DNA)作为DNA水凝胶的主体,并将各种化学物质作为交联剂,借助交联剂、连接酶等物质发生缩聚、加聚等多种反应,使X-DNA共聚形成DNA水凝胶[22]。化学交联合成的水凝胶性质稳定,具有较高的机械强度、稳定性和形状记忆性能,在应用中不会轻易变形,但制备时间较长,合成方法较为复杂,如图2所示。SUN等[23]将特定的DNA片段与丙烯酰胺混合后鼓泡,加入引发剂并再次鼓泡,在多个温度下孵育,过滤干燥,加入金属有机框架材料后连续振荡,经孵育离心洗涤得到DNA水凝胶,应用于玉米与小麦中检测伏马菌素,具有良好的选择性。LU等[24]将丙烯酸铁矿、缓冲液、乙二胺四乙酸等物质按比例混合加水,与DNA溶液一起加入孔板在低温下冷冻凝胶,洗涤除去引发剂、游离DNA后得到可用于检测黄曲霉毒素B1的DNA水凝胶。
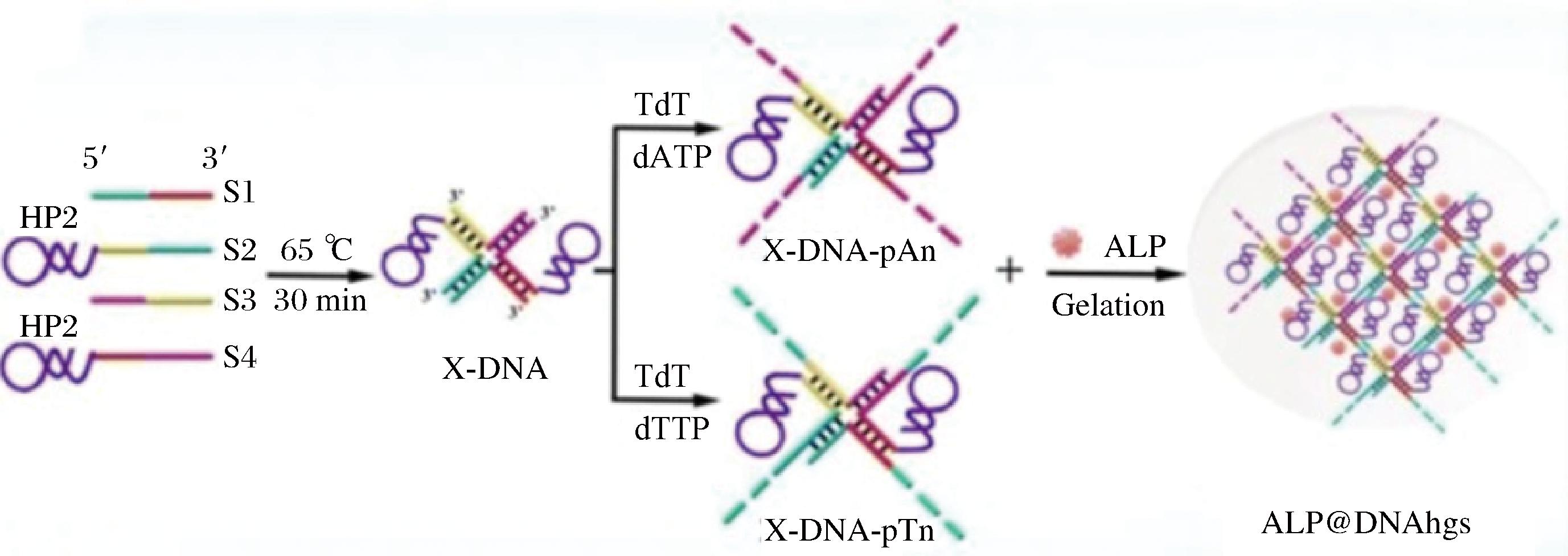
图2 化学交联法形成碱性磷酸酶包被的DNA水凝胶[16]
Fig.2 Chemical crosslinking method to form alkaline phosphatase-coated DNA hydrogels
注:ALP为碱性磷酸酶。
DNA水凝胶通常是DNA链的多次交联形成的,分子间的化学键、氢键、范德华力都可以作为交联的动力,根据其交联力的不同合成DNA水凝胶的要求和方法也会有所不同,合成的DNA水凝胶也会体现不同的性质(表1)。
表1 物理交联法与化学交联法合成DNA水凝胶的对比
Table 1 Comparison of physical and chemical cross-linking methods for synthesizing DNA hydrogels

物理交联法化学交联法交联作用力范德华力、氢键等共价键作用条件温和部分极端是否需要交联剂否是产物稳定性不稳定,可转化为溶液稳定常见方法冻融交联、离子交联自由基聚合交联、氧化交联
3 复合DNA水凝胶在检测食品中霉菌毒素的应用
具有不同官能团的化学键合二氧化硅、聚合物基吸附剂和碳基材料是检查霉菌毒素的常用材料,但这些材料的应用存在可重用性有限,稳定性有限,使用繁琐、成本较高等缺陷,对于检验人员技术要求也十分高,不适用于现场快速和大量的样品筛选[25]。相较于传统方法材料,三维聚合物网络结构的DNA水凝胶具有比表面积大、生物相容性好、易于功能化的特点,还具有精准的分子识别能力、可调的多功能性和方便的可编程性等优点,这些特点和优点可以为检测食品中霉菌毒素技术的开发提供新思路[26-27]。根据复合DNA水凝胶在样品的快速检测方面具有响应时间短、操作简便、灵敏度高等优势,可见其在检测食品中的霉菌毒素方面有较好的前景。
3.1 黄曲霉毒素
黄曲霉毒素 (aflatoxin, AFT) 是黄曲霉和寄生曲霉在生长过程中产生、分泌的次级代谢产物。黄曲霉毒素作为霉菌毒素中毒性最大、对人类健康危害极为显著的一类,其中黄曲霉毒素B1(aflatoxin B1,AFB1)最为常见,且其毒性和致癌性均居首位[28]。近年来,研究人员持续关注AFB1的检测。MA等[29]使用AFB1适体及其2条短互补DNA链作为交联剂合成了用于检测AFB1的DNA水凝胶。其原理是在引入AFB1后,AFB1适体与AFB1结合可破坏水凝胶并释放AuNPs,上清液从无色明显变为红色,颜色的变化有利于视觉检测是否含有AFB1。ZHAO等[30]利用便携式pH计具有操作简便,成本低,易于获得的特点,首先调查了利用pH计作为读数来开发AFB1便携式传感器的适用性,然后通过对AFB1响应的适体交联的水凝胶的组合,实现对AFB1的特异性检测,具体过程如图3所示。所提出的便携式设备已成功应用于食品样品中的AFB1测定,结果令人满意。ZHENG等[8]以DNA水凝胶作为生物传感器底物,AFB1适配体作为识别元件,又使用酶联信号放大策略构建了一个响应AFB1的适配体交联的水凝胶传感器,将其用在花生油样品中证实了其可行性,且该水凝胶传感器表现出出色的灵敏度。LU等[24]制备了一种含有丙烯酸酯修饰的滚环扩增产物的DNA冷冻凝胶,该水凝胶具有分层孔隙结构,可提高水凝胶生物传感器的反应速率。结果显示,其检出限较低(1 nmol/L),检测范围宽(5~100 nmol/L),准确度和精密度令人满意。通过与智能手机传感平台集成,创建了一种便携式设备,可在45 min内快速现场测量目标。ARAN等[31]设计了一种黄曲霉毒素M1适配体官能化的DNA水凝胶,当FAM标记的黄曲霉毒素M1适配体与BHQ1标记的DNA链-2杂交形成水凝胶网络中的双链DNA时,通过测量淬灭荧光信号的回收率,使用形式化的适配体功能化DNA水凝胶检测黄曲霉毒素M1。该检测平台成功应用于水溶液和牛奶中氯霉素和黄曲霉毒素M1的同时检测。CHEN等[20]将杂化链式反应引入由DNA水凝胶和聚丙烯酰胺水凝胶互穿形成的光子晶体(PhCs)-DNA水凝胶中,实验结果表明,AFB1浓度越高,PhCs-DNA水凝胶的体积膨胀越明显。只有在AFB1存在下,水凝胶的体积才会显著膨胀,而其他干扰物质几乎不会引起水凝胶体积的变化,可见其水凝胶对AFB1有较好的特异性。可视化检测、特异性检测、快速现场检测、信号放大等特点,是复合DNA水凝胶在检测黄曲霉素的应用中的优势,为食品安全保障提供有力支持。
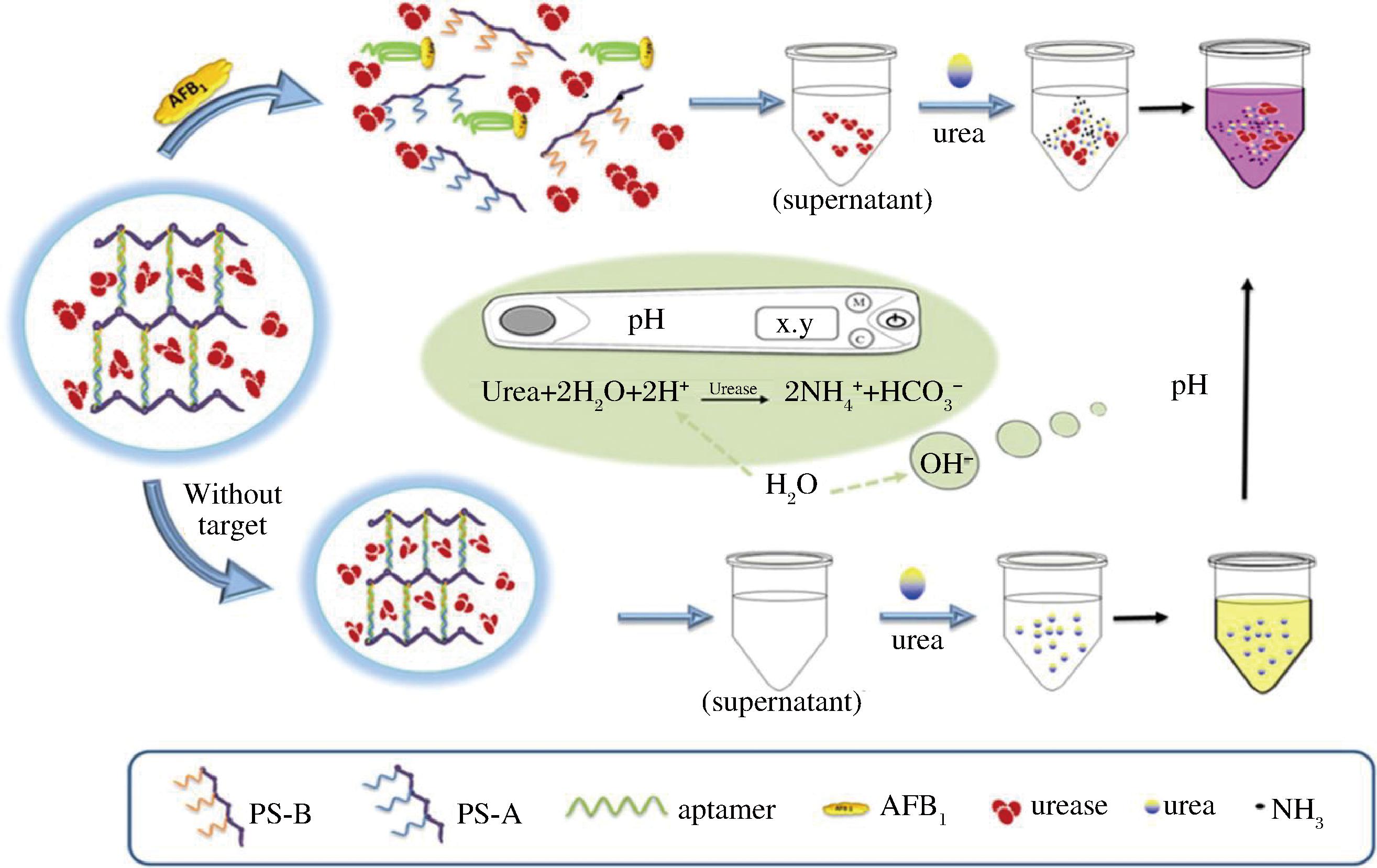
图3 一种DNA水凝胶用于检测AFB1的具体过程[30]
Fig.3 The specific process of using a DNA hydrogel to detect AFB1
3.2 赭曲霉毒素A
赭曲霉毒素A(ochratoxin A, OTA)是由赭曲霉及青霉菌等产毒菌株侵染粮食、食品、饲料及其他农副产品后所产生的一种有毒代谢产物,对人类及动物健康造成了很大的威胁,它可以导致受试动物的肾萎缩、胎儿畸形、流产及死亡,并具有高度的致癌性[32]。因其具有的高危害性,人们越来越关注OTA在粮食中的检测。目前,许多研究人员利用水凝胶材料作为传感器的传感元件,用于灵敏地检测OTA。TANG等[33]提出一种柔性光电化学生物传感器,对OTA进行灵敏检测。该传感器利用芬顿反应介导的聚苯胺原位形成和DNA水凝胶的高负载能力,有效提高了该传感器的分析性能,得到的线性范围为0.000 1~0.1 ng/mL,检出限为0.05 pg/mL,表现出立竿见影的效果。FAN等[34]将通过结合靶向响应性血红素包封和铜纳米团簇(CuNCs)功能化的DNA水凝胶这一新型的双模式传感策略,用于OTA的荧光和比色检测。如图4所示,这种基于双模式的检测利用不同的信号实现互补优势,可以显著提高检测的可靠性和准确性,有助于霉菌毒素的现场检测。HAO等[35]开发了一种基于滚环扩增产品自组装的敏感荧光DNA水凝胶适体传感器,是利用将适体、互补序列和靶标的竞争性结合模式整合到DNA水凝胶中以进行OTA检测,检出限为0.01 ng/mL,可用于啤酒中OTA的检测,且表现出良好的特异性和稳定性。HAO等[36]又进一步提出了一种新的视觉检测模式,检测限为0.005 ng/mL,是原来的2倍,大大提高了实验结果的准确性和可信度。可见,DNA水凝胶适配体传感器在食品中OTA检测方面显示出潜在应用前景,这些传感器通过材料创新、传感机制优化、多功能集成等方法,展现出较高灵敏度和出色的生物相容性,显著提高了检测OTA的准确性和可靠性,为食品现场快速检测提供了新的技术方案。

图4 一种荧光CuNCs功能化DNA水凝胶合成及作用机理[34]
Fig.4 Synthesis and mechanism of a fluorescent CuNCs-functionalized DNA hydrogel
3.3 T-2毒素
T-2毒素是一种剧毒霉菌毒素,主要由镰刀菌属产生,它经常存在于受污染的谷物产品中,如小麦、玉米和大豆。这种毒素不仅容易产生,且剧毒、抗降解,其免疫毒性作用会导致人类和动物的生殖中断[37-38]。因此,为了消费者的健康,市场应当加强对T-2毒素的检查和监管,但目前在开发用于检测T-2毒素的新型传感器方面仍是一个巨大挑战。SUN等[39]报道了一种基于DNA水凝胶和蚀刻金纳米棒(AuNRs)的新型高灵敏度检测T-2毒素的方法。该方法具有较低的检出限(0.87 pg/mL)、较低的定量限(2.90 pg/mL)和较宽的检测范围(0.01~10 000 ng/mL)。此外,该方法已应用于咖啡、玉米和大豆的检测,效果良好,值得进一步推广。XUE等[18]开发了一种检测T-2毒素的新型系统,该系统以线性透明质酸为骨架,DNA/适配体杂化物和聚乙烯亚胺为交联剂,制备了嵌入PtNPs和T-2毒素响应的双交联水凝胶。其原理是适配体可以特异性地与靶标结合,导致水凝胶的网状结构崩解,导致PtNP的释放,从而催化H2O2转化为O2和H2O。由于O2的溶解度低,反映单元的内部和外部环境之间存在压差,导致毛细管内的红色水柱高度增加,其过程如图5所示。带有颜色的水柱高度的明显变化有利于可视性反映样品中有无T-2毒素,该系统已用于检测玉米和大麦茶中的T-2毒素,效果显著,相信在未来会产生更好成效。传统的检测方法常受限于其依赖于颜色变化所带来的准确度问题,并且需依赖主观判断。相较之下,利用DNA水凝胶诱导毛细管水柱高度发生变化,能够直接且客观地反映刻度上的浓度数据,这种方法有效规避了颜色反应法可能带来的不便和误判风险。
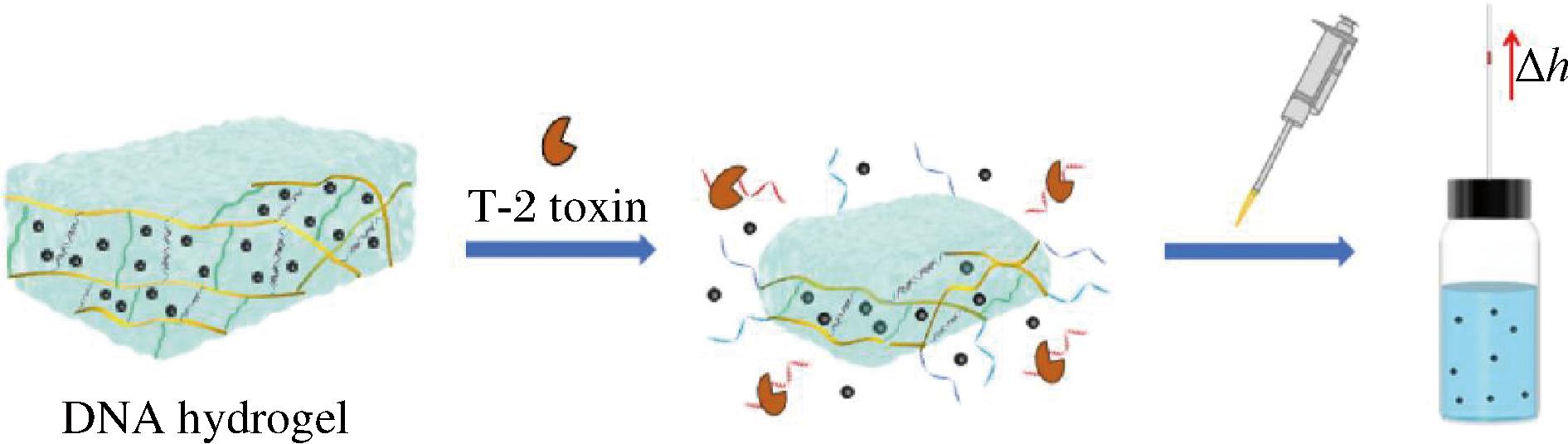
图5 一种基于DNA水凝胶的水柱高度作为读数的T-2毒素定量便携式生物传感器原理[18]
Fig.5 A portable biosensor for T-2 toxin quantification based on the height of the water column as a reading of DNA hydrogel
3.4 伏马菌素
伏马菌素(fumonisin,FB)是由串珠镰刀菌产生的水溶性代谢产物,是多氢醇和丙三羧酸的双酯化合物,对热很稳定,不易被蒸煮破坏,在多数粮食加工处理过程均比较稳定,与其他毒素存在联合作用,存在于食品中对人和动物健康构成潜在威胁,需要引起足够的重视和采取相应的预防措施[40]。到目前为止,发现的FB有FA1、FA2、FB1等11种,其中FB1是其主要组分。FB1主要污染玉米和小麦等粮食,且在世界范围内普遍存在。SUN等[23]开发了一种新型DNA水凝胶适配传感器,用于基于DNA水凝胶包被的卟啉封装金属有机框架(metal organic framework,MOF)快速精确地检测FB1,如图6所示。寡核苷酸序列中包含的FB1适配体使水凝胶能够特异性地响应系统中的FB1分子,导致DNA水凝胶涂层的分解和MOF的发现。因此,在与有机底物一起孵育后,比色信号与系统中FB1的含量成正比。适配传感器可准确、灵敏地定量FB1,并且具有出色的易用性。它还展示了卓越的分析性能,线性范围为 0.05~100 ng/mL,检出限为 0.024 ng/mL。该策略可以作为开发针对食品安全危害的多种适体传感器的模型,更好地维护食品安全。该团队[41]进一步巧妙地将DNA四面体和DNA水凝胶构建的DNA纳米结构与基于金属有机框架的纳米酶(MOFzyme)相结合,组装了一种灵敏、精密的FB1测定比色适配传感器。结合DNA四面体的结构特性、双金属MOFzyme的催化能力以及基于EDC反应的DNA水凝胶的刺激响应性,构建的适配体传感器在识别FB1方面表现出令人满意的性能。通过优化DNA水凝胶的结构和功能,提升传感器的性能,实现对FB的特异性识别和信号放大,从而提高检测的准确性和灵敏度,其有易于操作的技术优势为霉菌毒素的实际监测提供了新的解决方案。
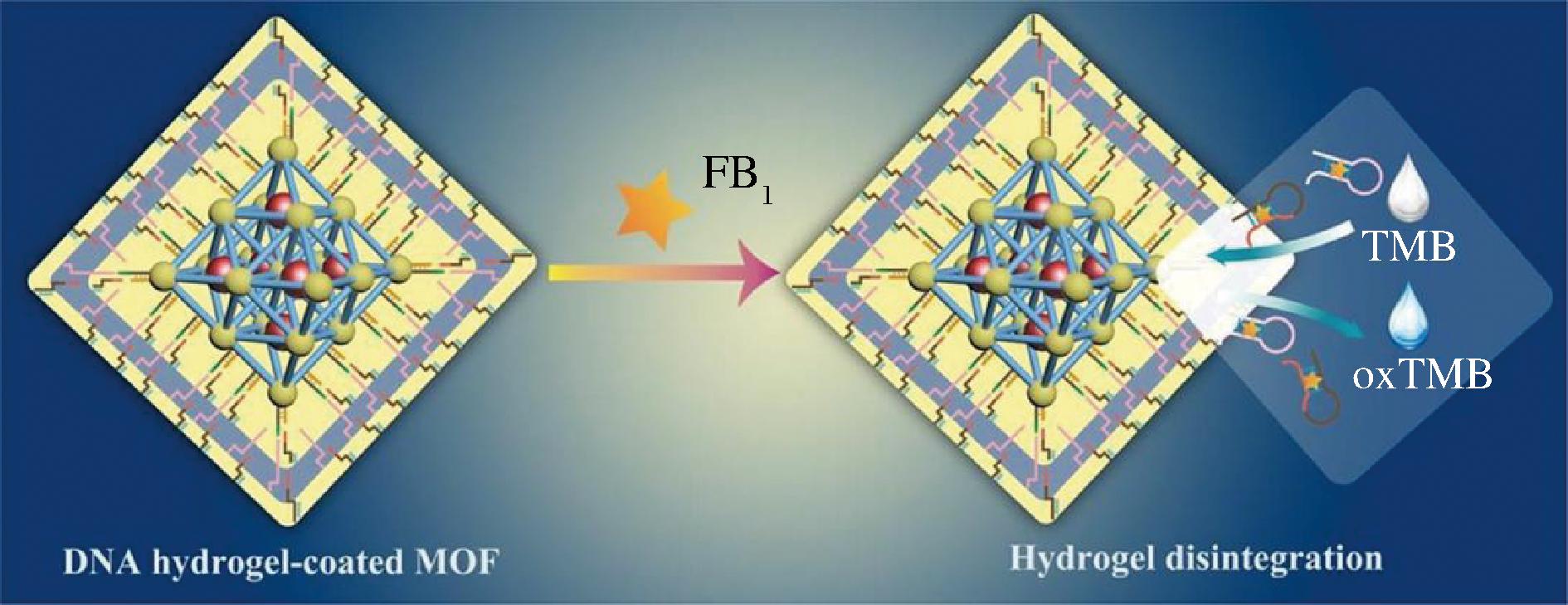
图6 一种新型DNA水凝胶适配传感器的作用机理[23]
Fig.6 Mechanism of action of a novel DNA hydrogel adaptation sensor
3.5 玉米赤霉烯酮
玉米赤霉烯酮(zearalenone,ZEN)又名F-2毒素,主要存在于易受到真菌污染的玉米、小麦、高粱、大米等谷物中[42]。ZEN侵染作物主要发生在作物的耕作、收获、运输和贮存期间,在温度适中而湿度较高的环境中滋生镰刀菌,由镰刀菌产毒所致。ZEN具有生殖发育毒性和免疫毒性,与肿瘤发生也有一定联系,被国际癌症研究中心归类为3类致癌物,严重危害动物和人体健康[43]。SUN等[44]通过结合MOFzyme和透明质酸-DNA水凝胶,开发了一种设计优良的比色适体传感器。主要通过部分氧化Ce-Zr双金属MOF获得具有优异氧化酶活力的双金属MOFzyme,再通过杂化链式反应将刺激响应的透明质酸-DNA水凝胶沉积在双金属MOFzyme表面。依靠集成在水凝胶结构中的 ZEN特异性适体,通过引入ZEN分子可以特异性地触发水凝胶网络的解体和封装的 MOFzyme 的伴随暴露,具体构造和应用过程如图7所示。此外,水凝胶崩解的幅度与 ZEN 的量呈正相关,通过它可以顺利实现 ZEN 的量化。得益于精致的设计、双金属 MOFzyme 令人满意的催化性能和稳定性以及 DNA 水凝胶吸引人的刺激响应性,所开发的适体传感器表现出卓越的分析性能和易用性。在最佳条件下,适体传感器的线性范围为0.001~200 ng/mL,检测限为0.8 pg/mL。适体传感器成功应用于玉米和大豆样品中ZEN的定量检测,回收率为94.0%~109.0%。张鸿鹏等[45]开发了一种基于适配体交联的DNA水凝胶用于检测ZEN,使用修饰有荧光基团的ZEN适配体作为水凝胶的交联剂和识别元件,通过对荧光强度变化的检测和分析,可完成对ZEN的定性和定量分析。利用MOFzyme和适配体交联DNA水凝胶开发出高灵敏度、高特异性的传感器,不仅可推动生物传感器技术的发展,也为食品安全检测提供新的解决方案,通过材料创新和分子识别元件的结合,能够实现对更多目标分析物的有效检测。
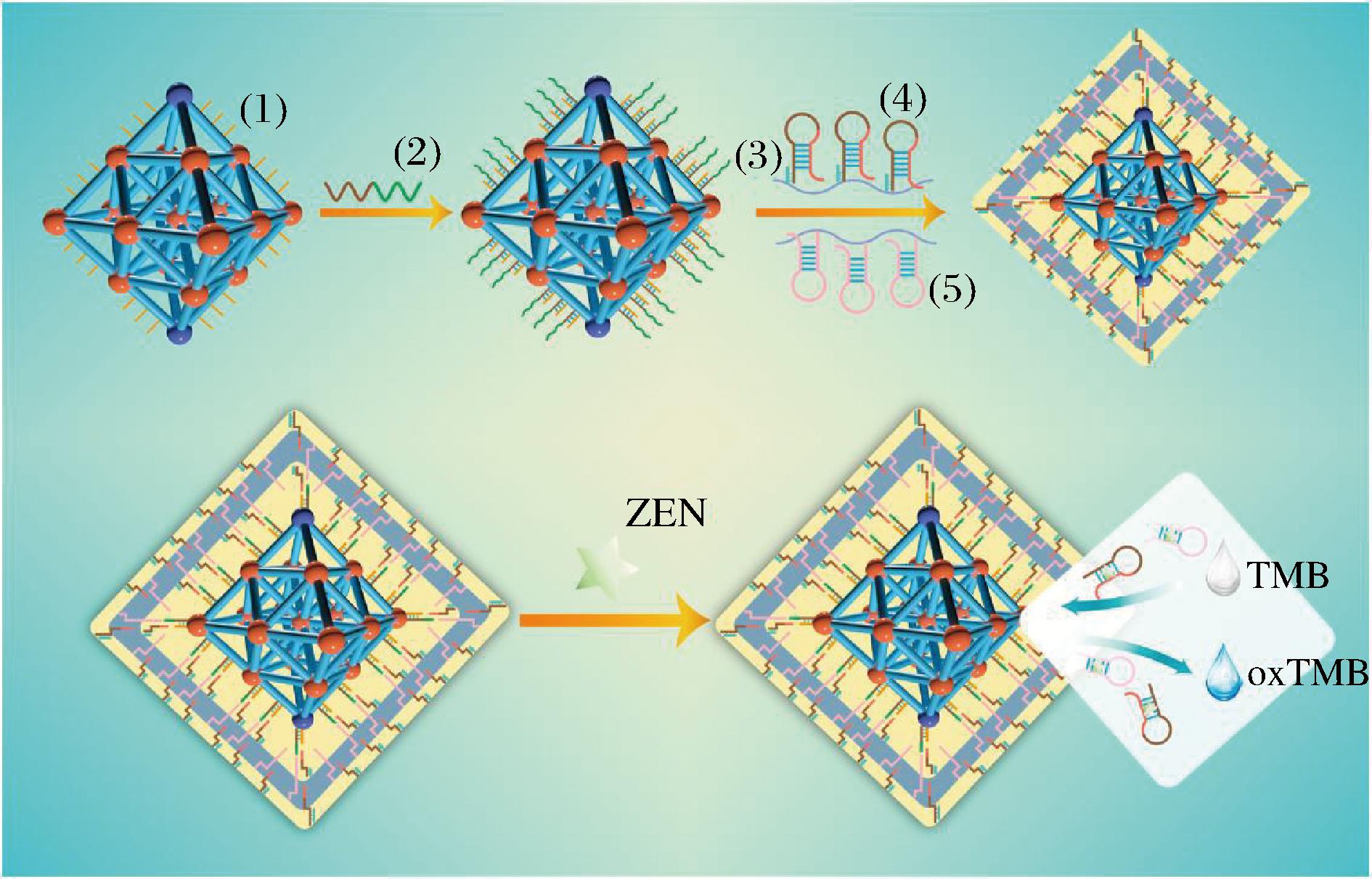
图7 基于双金属MOFzyme和透明质酸-DNA水凝胶开发的适配体传感器的构造和应用示意图[44]
Fig.7 Construction and application diagram of aptamer sensor based on bimetallic MOFzyme and hyaluronic acid-DNA hydrogel
基于复合DNA水凝胶的检测方法是一种可以实现各种霉菌毒素现场视觉检测的技术,并在检测精度上有所提升,表2中汇总了目前基于复合DNA水凝胶应用于食品中霉菌毒素的检测方法,不难发现其相较于传统的检测方法具有一定的优势。复合DNA水凝胶的原材料价格不断波动,再结合设备投入、人工成本以及能耗成本等因素,使得复合DNA水凝胶的生产成本相对较高,但其高效性和准确性使其在食品安全检测领域具有卓越的经济效益,通过提高检测效率、降低误判率,企业能够节省大量的时间和成本,提高市场竞争力。复合DNA水凝胶制备过程简单且形式多样[46],主要体现在材料选择多样,易获取且操作安全;制备步骤明确且相对简单;制备方法多样,选择性较多。但要将复合DNA水凝胶从实验室研究推向规模化生产,还面临着一系列挑战和问题:a)复合DNA水凝胶制备成本较高,为了获得更好的性能,往往需要通过化学修饰并与不同的基团结合,将增加开发成本,如何提高生产效率、降低开发成本十分重要。b)复合DNA水凝胶的制备过程涉及多个步骤和参数调节,如温度、pH值、离子强度等。这些参数的微小变化都可能影响水凝胶的性能和质量,在大规模生产中如何实现对这些参数的精确控制和稳定重复,是确保产品质量的关键。c)不同批次之间的产品质量一致性也是规模化生产必须考虑的问题。如何优化生产工艺,减少批次间的差异,确保产品质量的稳定性和可靠性,是企业在生产管理中需要解决的重要问题。d)食品中的复杂基质(如蛋白质、脂质、糖类等)可能会对DNA水凝胶的检测性能产生干扰,降低检测的灵敏度和特异性。如何减少杂质和副产物的生成,是保证产品质量和安全性的重要环节。
表2 复合DNA水凝胶检测食品中霉菌毒素的应用
Table 2 Application of composite DNA hydrogels for the detection of mycotoxins in foods
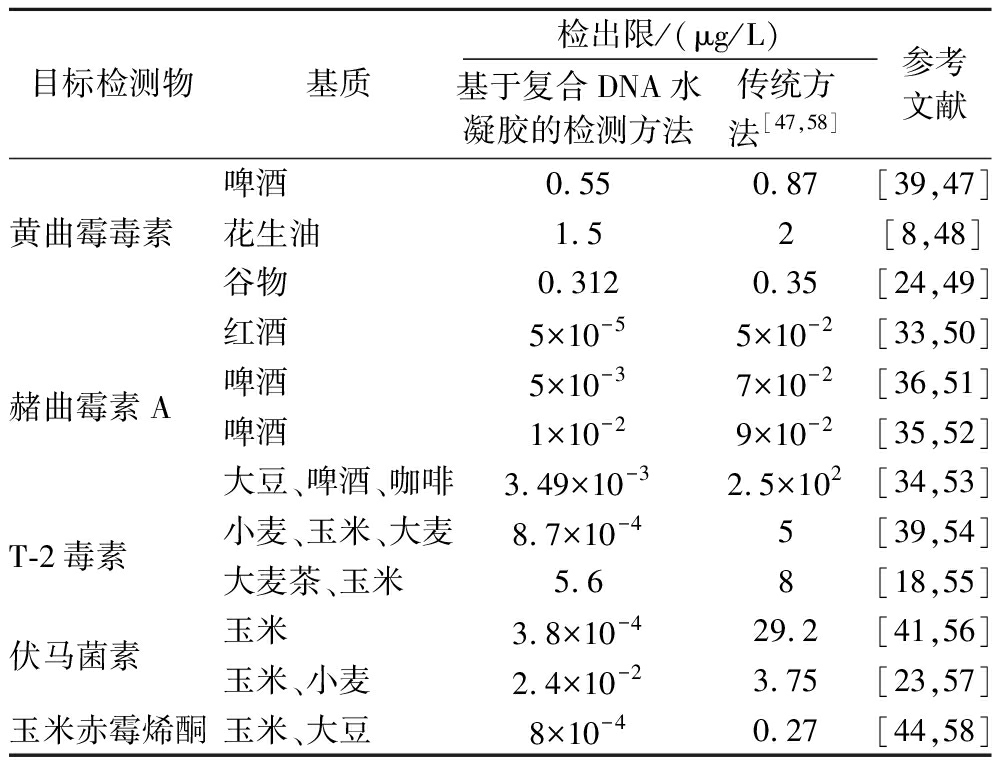
目标检测物基质检出限/(μg/L)基于复合DNA水凝胶的检测方法传统方法[47,58]参考文献啤酒0.55 0.87[39,47]黄曲霉毒素花生油1.5 2[8,48]谷物0.3120.35[24,49]红酒5×10-55×10-2[33,50]赭曲霉素A啤酒5×10-37×10-2[36,51]啤酒1×10-29×10-2[35,52]大豆、啤酒、咖啡3.49×10-32.5×102[34,53]T-2毒素小麦、玉米、大麦8.7×10-45 [39,54]大麦茶、玉米5.68 [18,55]伏马菌素玉米3.8×10-429.2 [41,56]玉米、小麦2.4×10-23.75[23,57]玉米赤霉烯酮玉米、大豆8×10-40.27[44,58]
4 结论与展望
本文简要介绍了复合DNA水凝胶的分类和制备方法,综述了近年来复合DNA水凝胶在检测食品中霉菌毒素的应用。复合DNA水凝胶的除了应用在食品中霉菌毒素的检测以及食品中其他有害物质的安全检测外,在药物递送、生物传感、细胞培养和人工组织等领域也展现出广阔的应用前景[59-63],为提升其发展潜力,未来可从探索合成技术、提升材料稳定性等方面做出努力:a)在保证良好性能的同时,探索低成本、高效率的复合DNA水凝胶合成技术。b)引入新型交联技术,如物理交联与化学交联结合、利用DNA自组装等,提高复合DNA水凝胶在复杂食品基质中的稳定性,以及在高温、高湿、酸碱等恶劣环境条件下的耐受性。c)通过制备多种复合DNA水凝胶,探索其检测霉菌毒素的检测机制,为食品中霉菌毒素的污染问题提供更先进的解决方案。
[1] KING T, COLE M, FARBER J M, et al. Food safety for food security: Relationship between global megatrends and developments in food safety[J]. Trends in Food Science &Technology, 2017, 68:160-175.
[2] WANG B, SHEN F, HE X M, et al. Simultaneous detection of Aspergillus moulds and aflatoxin B1 contamination in rice by laser induced fluorescence spectroscopy[J]. Food Control, 2023, 145:109485.
[3] 边亚兰, 李光华, 高志贤, 等. 适配体功能化的DNA水凝胶的制备及其在食品安全小分子快速检测中的应用[J]. 食品安全质量检测学报, 2023, 14(6):17-23.BIAN Y L, LI G H, GAO Z X, et al. Preparation of aptamer functionalized DNA hydrogel and its application in the rapid detection of small molecules in food safety[J]. Journal of Food Safety &Quality, 2023, 14(6):17-23.
[4] UZUMCU A T, GUNEY O, OKAY O. Nanocomposite DNA hydrogels with temperature sensitivity[J]. Polymer, 2016, 100:169-178.
[5] LI F, TANG J P, GENG J H, et al. Polymeric DNA hydrogel: Design, synthesis and applications[J]. Progress in Polymer Science, 2019, 98:101163.
[6] EBRAHIMI A, RAVAN H, KHAJOUEI S. DNA nanotechnology and bioassay development[J]. TrAC Trends in Analytical Chemistry, 2019, 114:126-142.
[7] KHAJOUEI S, RAVAN H, EBRAHIMI A. DNA hydrogel-empowered biosensing[J]. Advances in Colloid and Interface Science, 2020, 275:102060.
[8] ZHENG M Y, LIU H M, YE J, et al. Target-responsive aptamer-cross-linked hydrogel sensors for the visual quantitative detection of aflatoxin B1 using exonuclease I-Triggered target cyclic amplification[J]. Food Chemistry: X, 2022, 15:100395.
[9] TANG L Y, HUANG Y Y, LIN C Y, et al. Highly sensitive and selective aflatoxin B1 biosensor based on Exonuclease I-catalyzed target recycling amplification and targeted response aptamer-crosslinked hydrogel using electronic balances as a readout[J]. Talanta, 2020, 214:120862.
[10] LI Z Y, DAVIDSON-ROZENFELD G, V ZQUEZ-GONZ
ZQUEZ-GONZ LEZ M, et al. Multi-triggered supramolecular DNA/bipyridinium dithienylethene hydrogels driven by light, redox, and chemical stimuli for shape-memory and self-healing applications[J]. Journal of the American Chemical Society, 2018, 140(50):17691-17701.
LEZ M, et al. Multi-triggered supramolecular DNA/bipyridinium dithienylethene hydrogels driven by light, redox, and chemical stimuli for shape-memory and self-healing applications[J]. Journal of the American Chemical Society, 2018, 140(50):17691-17701.
[11] WANG H Y, WANG X Y, LAI K Q, et al. Stimulus-responsive DNA hydrogel biosensors for food safety detection[J]. Biosensors, 2023, 13(3):320.
[12] NAGAHARA S, MATSUDA T. Hydrogel formation via hybridization of oligonucleotides derivatized in water-soluble vinyl polymers[J]. Polymer Gels and Networks, 1996, 4(2):111-127.
[13] CHENG E J, XING Y Z, CHEN P, et al. A pH-triggered, fast-responding DNA hydrogel[J]. Angewandte Chemie, 2009, 121(41):7796-7799.
[14] ZHANG L, LEI J P, LIU L, et al. Self-assembled DNA hydrogel as switchable material for aptamer-based fluorescent detection of protein[J]. Analytical Chemistry, 2013, 85(22):11077-11082.
[15] LEE J B, PENG S M, YANG D Y, et al. A mechanical metamaterial made from a DNA hydrogel[J]. Nature Nanotechnology, 2012, 7(12):816-820.
[16] XU N, MA N N, YANG X T, et al. Preparation of intelligent DNA hydrogel and its applications in biosensing[J]. European Polymer Journal, 2020, 137:109951.
[17] WU P, LI S, YE X S, et al. Cu/Au/Pt trimetallic nanoparticles coated with DNA hydrogel as target-responsive and signal-amplification material for sensitive detection of microcystin-LR[J]. Analytica Chimica Acta, 2020, 1134:96-105.
[18] XUE M X, CAI S X, DENG Y, et al. Portable T-2 toxin biosensor based on target-responsive DNA hydrogel using water column height as readout[J]. Talanta, 2024, 276:126203.
[19] WANG X M, CHEN C, WATERHOUSE G I N, et al. Ultra-sensitive detection of streptomycin in foods using a novel SERS switch sensor fabricated by AuNRs array and DNA hydrogel embedded with DNAzyme[J]. Food Chemistry, 2022, 393:133413.
[20] CHEN Q S, WU L F, ZHAO F, et al. Construction of hybridization chain reaction induced optical signal directed change of photonic crystals-DNA hydrogel sensor and its visual determination for aflatoxin B1[J]. Food Chemistry, 2023, 418:135891.
[21] LI G H, PANG W, BIAN Y L, et al. A surface-enhanced Raman scattering and colorimetric dual-mode aptasensor for ultrasensitive detection of kanamycin based on DNA hydrogel network fishing the MIL-101@AuNP nanohybrids[J]. Sensors and Actuators B: Chemical, 2024, 414:135937.
[22] UM S H, LEE J B, PARK N, et al. Enzyme-catalysed assembly of DNA hydrogel[J]. Nature Materials, 2006, 5(10):797-801.
[23] SUN Y H, LYU Y, ZHANG Y, et al. A stimuli-responsive colorimetric aptasensor based on the DNA hydrogel-coated MOF for fumonisin B1 determination in food samples[J]. Food Chemistry, 2023, 403:134242.
[24] LU J, YANG X F, XIAO J X, et al. DNA-functionalized cryogel based colorimetric biosensor for sensitive on-site detection of aflatoxin B1 in food samples[J]. Talanta, 2024, 275:126122.
[25] YANG Y, LI G L, WU D, et al. Recent advances on toxicity and determination methods of mycotoxins in foodstuffs[J]. Trends in Food Science &Technology, 2020, 96:233-252.
[26] 张琦, 孙锐, 张瑜, 等. DNA杂化水凝胶的构建及性能[J]. 高等学校化学学报, 2023, 44(4):242-248.ZHANG Q, SUN R, ZHANG Y, et al. Construction and properties of DNA hybrid hydrogels[J]. Chemical Journal of Chinese Universities, 2023, 44(4):242-248.
[27] 徐若萱, 何金兴. 水凝胶基纳米复合材料在食品有害物电化学检测中的应用研究进展[J]. 粮油食品科技, 2023, 31(6):113-118.XU R X, HE J X. Research progress of hydrogels-based materials and their application for electrochemical sensing of hazardous substances in foods[J]. Science and Technology of Cereals, Oils and Foods, 2023, 31(6):113-118.
[28] 何翠霞. 高效液相色谱在黄曲霉素检测中的应用[J]. 食品安全导刊, 2016(18):116.HE C X. Application of high performance liquid chromatography in detection of aflatoxin[J]. China Food Safety Magazine, 2016(18):116.
[29] MA Y L, MAO Y, HUANG D, et al. Portable visual quantitative detection of aflatoxin B1 using a target-responsive hydrogel and a distance-readout microfluidic chip[J]. Lab on a Chip, 2016, 16(16):3097-3104.
[30] ZHAO M M, WANG P L, GUO Y J, et al. Detection of aflatoxin B1 in food samples based on target-responsive aptamer-cross-linked hydrogel using a handheld pH meter as readout[J]. Talanta, 2018, 176:34-39.
[31] ARAN G C, BAYRAÇ C. Simultaneous dual-sensing platform based on aptamer-functionalized DNA hydrogels for visual and fluorescence detection of chloramphenicol and aflatoxin M1[J]. Bioconjugate Chemistry, 2023, 34(5):922-933.
[32] 高翔, 李梅, 张立实. 赭曲霉毒素A的毒性研究进展[J]. 国外医学(卫生学分册), 2005(1):51-55.GAO X, LI M, ZHANG L S. Research progress on toxicity of ochratoxin A[J]. Journal of Environmental Hygiene, 2005(1):51-55.
[33] TANG J, LIU L P, WANG H Y, et al. In situ generated PANI promoted flexible photoelectrochemical biosensor for ochratoxin A based on GOx-stuffed DNA hydrogel as enhancer[J]. Mikrochimica Acta, 2023, 190(3):106.
[34] FAN P F, LI Q J, ZHANG Z D, et al. A G-quadruplex-assisted target-responsive dual-mode aptasensor based on copper nanoclusters synthesized in situ in a DNA hydrogel for ultrasensitive detection of ochratoxin A[J]. Talanta, 2024, 270:125550.
[35] HAO L L, WANG W, SHEN X Q, et al. A fluorescent DNA hydrogel aptasensor based on the self-assembly of rolling circle amplification products for sensitive detection of ochratoxin A[J]. Journal of Agricultural and Food Chemistry, 2020, 68(1):369-375.
[36] HAO L L, LIU X T, XU S J, et al. A novel aptasensor based on DNA hydrogel for sensitive visual detection of ochratoxin A[J]. Mikrochimica Acta, 2021, 188(11):395.
[37] WU Q H, QIN Z H, KUCA K, et al. An update on T-2 toxin and its modified forms: Metabolism, immunotoxicity mechanism, and human exposure assessment[J]. Archives of Toxicology, 2020, 94(11):3645-3669.
[38] YANG X, LIU P L, CUI Y L, et al. Review of the reproductive toxicity of T-2 toxin[J]. Journal of Agricultural and Food Chemistry, 2020, 68(3):727-734.
[39] SUN Y F, LI S, CHEN R P, et al. Ultrasensitive and rapid detection of T-2 toxin using a target-responsive DNA hydrogel[J]. Sensors and Actuators B: Chemical, 2020, 311:127912.
[40] 王少康. 伏马菌素污染情况及其毒性研究进展[J]. 环境与职业医学, 2003, 20(2):129-131;133.WANG S K. Progress in study on the fumonisin contamination status in foods and the toxicity of fumonisin[J]. Journal of Labour Medicine, 2003, 20(2):129-131;133.
[41] SUN Y H, QI S, DONG X Z, et al. Colorimetric aptasensor for fumonisin B1 detection based on the DNA tetrahedra-functionalized magnetic beads and DNA hydrogel-coated bimetallic MOFzyme[J]. Journal of Hazardous Materials, 2023, 443:130252.
[42] JING S Y, LIU C M, ZHENG J, et al. Toxicity of zearalenone and its nutritional intervention by natural products[J]. Food &Function, 2022, 13(20):10374-10400.
[43] ROGOWSKA A, POMASTOWSKI P, SAGANDYKOVA G, et al. Zearalenone and its metabolites: Effect on human health, metabolism and neutralisation methods[J]. Toxicon, 2019, 162:46-56.
[44] SUN Y H, QI S, DONG X Z, et al. Colorimetric aptasensor targeting zearalenone developed based on the hyaluronic Acid-DNA hydrogel and bimetallic MOFzyme[J]. Biosensors and Bioelectronics, 2022, 212:114366.
[45] 张鸿鹏, 谢刚, 李可敬, 等. 刺激响应型DNA水凝胶的设计合成及其在食品安全领域的研究进展[J]. 食品与发酵工业, 2024, 50(11):360-366.ZHANG H P, XIE G, LI K J, et al. Design and synthesis of stimulus responsive DNA hydrogel and its research progress in the field of food safety[J]. Food and Fermentation Industries, 2024, 50(11):360-366.
[46] JIAN X T, FENG X Y, LUO Y N, et al. Development, preparation, and biomedical applications of DNA-based hydrogels[J]. Frontiers in Bioengineering and Biotechnology, 2021, 9:661409.
[47] ZHAO Y M, HE B S, LI D Y, et al. Nanobody and CuS nanoflower-Au-based lateral flow immunoassay strip to enhance the detection of aflatoxin B1[J]. Foods, 2024, 13(12):1845.
[48] SUN X L, ZHAO X L, TANG J, et al. Development of an immunochromatographic assay for detection of aflatoxin B1 in foods[J]. Food Control, 2006, 17(4):256-262.
[49] KARAMI-OSBOO R, MIRABOLFATHI M. A novel dispersive nanomagnetic particle solid-phase extraction method to determine aflatoxins in nut and cereal samples[J]. Food Analytical Methods, 2017, 10(12):4086-4093.
[50] ZHANG M Y, YAN L Z, HUANG Q, et al. Highly sensitive simultaneous detection of major ochratoxins by an immunochromatographic assay[J]. Food Control, 2018, 84:215-220.
[51] ZHOU J M, YANG Q B, LIANG C, et al. Detection of ochratoxin A by quantum dots-based fluorescent immunochromatographic assay[J]. Analytical and Bioanalytical Chemistry, 2021, 413(1):183-192.
[52] OLIA A E A, MOHADESI A, FEIZY J. A fabric phase sorptive extraction protocol combined with liquid chromatography-fluorescence detection for the determination of ochratoxin in food samples[J]. Food Analytical Methods, 2023, 16(5):974-984.
[53] BADALI A, JAVADI A, AFSHAR MOGADDAM M R, et al. Dispersive solid phase extraction-dispersive liquid-liquid microextraction of mycotoxins from milk samples and investigating their decontamination using microwave irradiations[J]. Microchemical Journal, 2023, 190:108645.
[54] VISCONTI A, LATTANZIO V M T, PASCALE M, et al. Analysis of T-2 and HT-2 toxins in cereal grains by immunoaffinity clean-up and liquid chromatography with fluorescence detection[J]. Journal of Chromatography A, 2005, 1075(1-2):151-158.
[55] PASCALE M, PANZARINI G, VISCONTI A. Determination of HT-2 and T-2 toxins in oats and wheat by ultra-performance liquid chromatography with photodiode array detection[J]. Talanta, 2012, 89:231-236.
[56] KALTNER F, RAMPL C, RYCHLIK M, et al. Development and validation of a cost-effective HPLC-FLD method for routine analysis of fumonisins B1 and B2 in corn and corn products[J]. Food Analytical Methods, 2017, 10(5):1349-1358.
[57] DENG M, LI W Q, CHEN Y B, et al. Detection of fumonisin B1 by aptamer-functionalized magnetic beads and ultra-performance liquid chromatography[J]. Microchemical Journal, 2022, 178:107346.
[58] CHEN C C, YU X Z, HAN D G, et al. Non-CTAB synthesized gold nanorods-based immunochromatographic assay for dual color and on-site detection of aflatoxins and zearalenones in maize[J]. Food Control, 2020, 118:107418.
[59] ZHANG Y, YANG W G, SU M L, et al. A reagent-based label free electrochemiluminescence biosensor for ultrasensitive quantification of low-abundant chloramphenicol[J]. Microchemical Journal, 2024, 198:110124.
[60] MO F L, JIANG K, ZHAO D, et al. DNA hydrogel-based gene editing and drug delivery systems[J]. Advanced Drug Delivery Reviews, 2021, 168: 79-98.
[61] VÖLLMECKE K, AFROZ R, BIERBACH S, et al. Hydrogel-based biosensors[J]. Gels, 2022, 8(12): 768.
[62] WU J Y, LIYARITA B R, ZHU H S, et al. Self-assembly of dendritic DNA into a hydrogel: Application in three-dimensional cell culture[J]. ACS Applied Materials &Interfaces, 2021, 13(42):49705-49712.
[63] WEI Y H, WANG K Z, LUO S H, et al. Programmable DNA hydrogels as artificial extracellular matrix[J]. Small, 2022, 18(36): e2107640.