尿酸在肝脏、肌肉和脂肪组织中产生,是嘌呤代谢的终产物,正常情况下,大约75%的尿酸通过肾脏排泄。尿酸的生成、肾脏排泄和肠道吸收之间的动态平衡对维持生理状态至关重要[1]。然而,这种动态平衡一旦被打破,就可能导致高尿酸血症(hyperuricemia, HUA)。在正常嘌呤饮食下,若非同日2次空腹血尿酸水平超过420 μmol/L,则被定义为HUA。研究显示,HUA与痛风、肥胖、糖代谢紊乱、慢性肾病、代谢综合症及非酒精性脂肪肝等多种疾病的发生和发展密切相关[2-3]。中国成年人的HUA患病率约为14%,且呈现年轻化趋势,使其成为仅次于糖尿病的第二大代谢性疾病[3],对人类健康构成重大威胁。目前,临床上治疗HUA的常用药物包括别嘌呤醇、非布司他、苯溴马隆、丙磺舒及聚乙二醇化尿酸特异性酶等[4-5]。然而,这些药物的靶点主要在肾脏,会增加肾脏负担并引起肾损伤,部分患者可能对上述药物产生过敏反应、肝脏损伤以及多发性关节炎等不良反应,长期使用还可能伴随着药物耐受性和合规性的问题[6]。
因此,研究人员将注意力放在天然的、副作用小的、具有降尿酸作用的植物性功能化合物。藤茶(Ampelopsis grossedentata) 有着悠久使用历史和多样的药理功效, 是中国长江流域以南地区广泛分布的显齿蛇葡萄的嫩茎叶[7-8],又名霉茶、龙须茶、甘露茶、客家白茶等。藤茶富含多糖、甾体类、萜类、挥发油类、多酚类等化合物,其促健康作用已受到国内外研究者的广泛关注。藤茶不仅可用于治疗咳嗽、发烧等小疾,还显示出保护肝脏、神经保护、降血糖、抗氧化、抗炎、抗肿瘤等多方面的功效[9-10]。研究发现, 藤茶能够通过抑制黄嘌呤氧化酶(xanthine oxidase,XOD) 的活性来减少尿酸的生成[11],在改善HUA的临床应用上具有极大的潜力。本文综述了藤茶降尿酸的有效成分及其潜在其作用机制,提供对藤茶治疗HUA研究的全面分析,旨在清晰揭示藤茶在HUA治疗中的作用机制。
1 高尿酸血症
1.1 发病机制
1.1.1 尿酸过量生成
人体内约67%的血清尿酸是内源产生的,膳食摄入的嘌呤代谢占约33%。尽管内源性嘌呤约占总嘌呤来源的80%,但膳食来源的嘌呤也是影响健康的一个重要因素。高嘌呤饮食,尤其是摄入过量富含嘌呤的动物肉类、海鲜、某些奶制品以及发酵酒精饮料,均会增加HUA的发生风险[12]。尿酸生成的关键酶包括黄嘌呤氧化还原酶(xanthine oxidoreductase,XOR)和腺苷脱氨酶(adenosine deaminase,ADA)。XOR是一种钼黄蛋白酶,以2种形式存在,分别是黄嘌呤脱氢酶和黄嘌呤氧化酶。两者都有将嘌呤代谢成尿酸的能力,但XOD还原氧分子的活性更高,在嘌呤代谢中扮演关键角色[13]。ADA是核苷酸分解代谢中的关键酶,它负责将腺苷转化为肌苷,再经嘌呤核苷酸磷酸化酶(purine nucleoside phosphorylase, PNP)将肌苷转化为次黄嘌呤,并最终氧化成尿酸。XOD蛋白在人体多个组织中表达,尤其是肝脏和小肠[14],这些组织中XOD活性的增加是导致HUA的主要原因之一。
1.1.2 尿酸排泄不足
尿酸排泄不足,尤其是肾脏尿酸排泄不足,是HUA发生的主要原因,占比约90%[15]。在正常情况下,超过70%的尿酸盐通过肾脏排泄,仅有5%~10%通过尿液排出。尿酸排泄主要依赖于肾近端小管中尿酸盐的转运[16],涉及多种转运蛋白,包括尿酸盐重吸收转运蛋白URAT1、GLUT9和OAT4,分别由SLC22A12、SLC2A9、SLC22A11基因编码,负责肾脏中尿酸的重吸收。有机阴离子转运蛋白OAT1、OAT3则由SLC22A6和SLC22A8基因编码,负责尿酸的分泌,且目前已经在基因敲除小鼠证实了这2种基因的敲除会减少尿酸盐的分泌[17]。另外,钠依赖性磷酸转运蛋白参与尿酸盐分泌到肾小管管腔中,ATP结合盒亚家族G成员2(ABCG2)以ATP依赖性的方式介导尿酸的排泄,阴离子转运体多药耐药蛋白4(ABCC4)是尿酸从顶膜排泄的主要途经[18],此外,辅助蛋白PDZ结构域蛋白1(PDZK1)可以与ABCG2、URAT1、OAT1、OAT3等尿酸盐转运蛋白共同作用,促进尿酸排泄。当肾功能障碍、肾小管对尿酸的重吸收增加时,可导致尿酸排泄不足,从而使血尿酸水平上升,最终可能造成HUA[19]。
1.1.3 其他影响因素
HUA的形成受到各种代谢途径的影响,尤其是糖脂代谢的紊乱,这些因素共同导致血清尿酸水平的升高[20-21]。异常的脂代谢,特别是甘油三酯水平升高,会间接影响嘌呤合成,进一步促进尿酸的产生[22]。此外,个体对某些特定药物的敏感性,如抗结核药物吡嗪酰胺、烟酸和低剂量阿司匹林(每日一次性摄入60~300 mg)等,也可能影响尿酸的正常代谢[23],这些代谢途径与药物响应的复杂相互作用揭示了HUA形成的多层次机制。
1.2 治疗现状
目前,治疗HUA的临床药物主要包括抑制尿酸生成类药物、促进尿酸排泄药物、促进尿酸分解的尿酸酶等[24]。
1.2.1 尿酸生成抑制途径
在尿酸生成抑制途径方面,已批准使用的代表性临床药物包括别嘌呤醇、非布司他和托匹司他。别嘌呤醇作为XOR的竞争性抑制剂,能够有效减少嘌呤向尿酸的代谢,同时减少活性氧的产生。然而,由于其代谢产物主要通过肾脏排泄,在肾功能不全患者中需要降低剂量使用,且有引发严重的皮肤不良反应的风险。非布司他是一种非嘌呤、非竞争性的XOR抑制剂,相较于别嘌呤醇,在降低尿酸生成和药物耐受性具有优势,同时还具备较强的肾保护作用[25]。然而,非布司他可能导致肝功能异常和不良心血管事件等多种不良反应。托匹司他,作为XOR的非竞争性抑制剂,目前仅日本批准用于痛风和HUA的治疗。临床试验表明,托匹司他能剂量依赖性地降低血清尿酸水平[26-27],其效果不亚于别嘌呤醇[28],可能对心血管和肾脏带来益处。
1.2.2 尿酸排泄促进途径
促进尿酸排泄的药物作用于肾脏,涉及尿酸盐的重吸收、排泄和分泌转运过程。苯溴马隆是一种非选择性尿酸排泄剂,通过抑制URAT1实现干扰尿酸重吸收,具有较低的肝毒性。丙磺舒则通过抑制URAT1、OAT1、GLUT9等蛋白来降低尿酸,是一种非特异性尿酸排泄剂,耐受性良好但可能引发尿路结石和药物相互作用,其药效有限。相较之下,雷西纳德和多替诺雷是选择性尿酸重吸收抑制剂,其中多替诺雷在临床试验种表现出可剂量依赖性降低尿酸,且对肾功能不全患者的疗效不受影响。遗憾的是,这两种药物均已停产[24,29]。
1.2.3 尿酸分解酶
尿酸分解酶药物包括拉布立酶和聚乙二醇化尿酸特异性酶,均已获批准使用。拉布立酶通常用于治疗恶性肿瘤和肿瘤溶解综合征中的HUA,虽然耐受性良好,但因治疗成本高和给药途径限制而非首选药物。聚乙二醇化尿酸特异性酶则被推荐用于治疗常规降尿酸无效的痛风患者[30],但需要通过静脉注射,治疗步骤繁琐且成本高,可能引起过敏反应。
1.2.4 新药研发
尽管现有药物在降低尿酸水平方面取得了显著效果,但由于某些因素限制,其在临床应用种的普及度有限。因此,研发新的降尿酸药物成为当前研究的热点(表1),旨在寻找更有效、安全的治疗方案[24]。同时,天然来源的植物性功能化合物,由于其对XOD的抑制作用,改善尿酸排泄等多重作用,且几乎无副作用,被认为具有潜在的应用价值[23]。
表1 已开展临床试验的新药[24]
Table 1 New drugs for which clinical trials have been conducted[24]
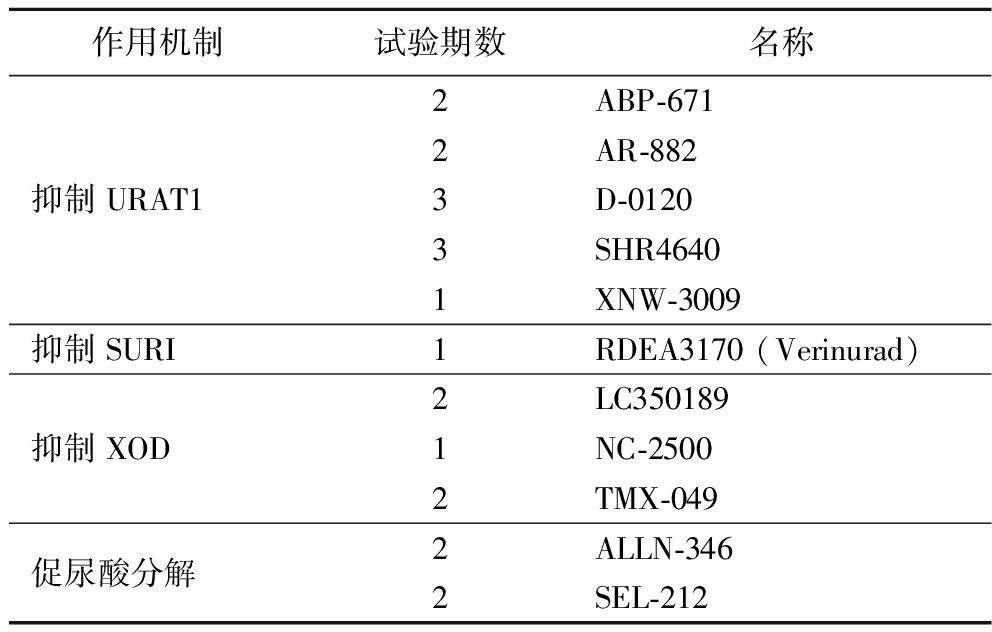
作用机制试验期数名称2ABP-6712AR-882抑制URAT13D-01203SHR46401XNW-3009抑制SURI1RDEA3170 (Verinurad)2LC350189抑制XOD1NC-25002TMX-049促尿酸分解2ALLN-3462SEL-212
2 藤茶降尿酸作用研究进展
藤茶,作为一种药食两用的植物,因含有丰富的生物活性化合物而备受瞩目,特别是黄酮类化合,占其总活性成分的约45%[8]。多项研究以藤茶为研究对象分离并鉴定出多种黄酮类化合物,如二氢杨梅素、杨梅素、槲皮素、橙皮素、山奈酚、芦丁、芹菜素、藤茶素、木犀草素、柚皮素等[31],这些化合物已证实具有包括保护肝脏、神经、降血糖、抗氧化、抗炎、抗肿瘤、抑菌等多种药理活性[10,32]。
2.1 藤茶提取物
近年来,研究者通过水萃取、醇萃取等方法获得藤茶提取物,并利用体内外实验模型进行研究,旨在筛选出具有降尿酸作用的生物活性化合物(表2)。分子对接技术,作为研究食品生物活性化合物与蛋白质分子相互作用的高效方法,已广泛应用于该领域[33]。李佳川等[34]研究结果显示,藤茶提取物的主要活性成分,包括二氢杨梅素、杨梅素、槲皮素、藤茶素等,与尿酸相关的靶点蛋白 (URAT1、GLUT9、ABCG2、XOD、ADA) 结合得分高、稳定性好,表现出通过干预尿酸合酶和尿酸转运蛋白的活性来降低尿酸水平的潜力。此外,藤茶水提物中的活性成分,如芹菜素、橙皮素等,与ABCG2和XOD蛋白的结合也显示稳定,可能是治疗HUA的有效成分[32,35]。在体外尿酸酶抑制剂体系模型中,藤茶水提物对ADA、PNP、XOD的半抑制浓度分别表现出明显的抑制效果,对酶活的抑制也在细胞模型中得到体现。在缺乏尿酸酶的人肾皮质近曲小管上皮细胞 (HK-2) 模型中[36],藤茶水提物通过抑制HK-2细胞中URAT1和GLUT9蛋白表达和细胞上清液XOD活性,从而降低尿酸生成[32]。
表2 藤茶提取物降尿酸相关研究
Table 2 Study on Ampelopsis grossedentata Extract Related to Uric Acid Lowering
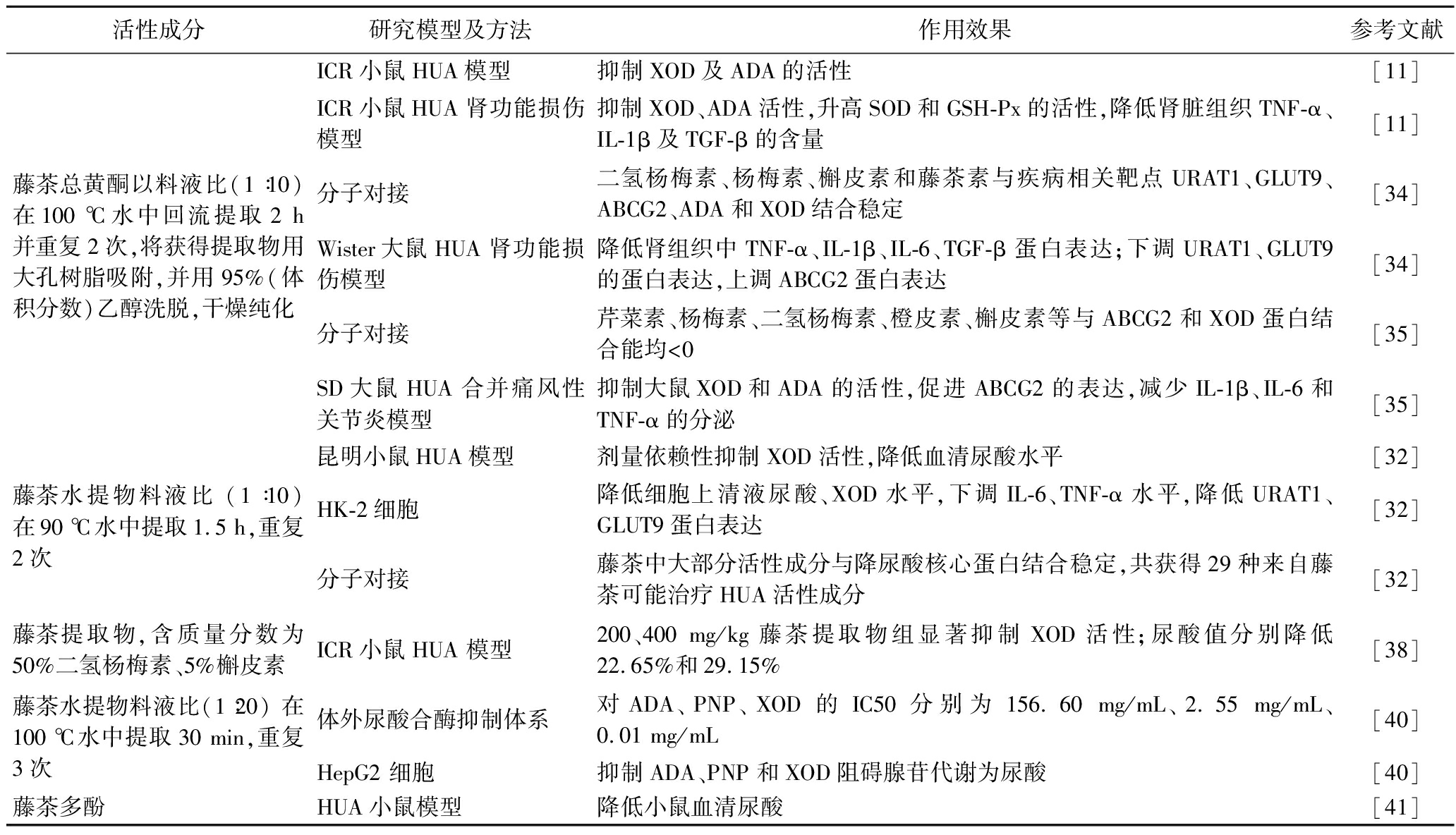
活性成分研究模型及方法作用效果参考文献藤茶总黄酮以料液比(1∶10) 在100 ℃水中回流提取2 h并重复2次,将获得提取物用大孔树脂吸附,并用95%(体积分数)乙醇洗脱,干燥纯化ICR小鼠HUA模型抑制XOD及ADA的活性[11]ICR小鼠HUA肾功能损伤模型抑制XOD、ADA活性,升高SOD和GSH-Px的活性,降低肾脏组织TNF-α、IL-1β及TGF-β的含量[11]分子对接二氢杨梅素、杨梅素、槲皮素和藤茶素与疾病相关靶点URAT1、GLUT9、ABCG2、ADA和XOD结合稳定[34]Wister大鼠HUA肾功能损伤模型降低肾组织中TNF-α、IL-1β、IL-6、TGF-β蛋白表达;下调URAT1、GLUT9的蛋白表达,上调ABCG2蛋白表达[34]分子对接芹菜素、杨梅素、二氢杨梅素、橙皮素、槲皮素等与ABCG2和XOD蛋白结合能均<0[35]SD大鼠HUA合并痛风性关节炎模型抑制大鼠XOD和ADA的活性,促进ABCG2的表达,减少IL-1β、IL-6和TNF-α的分泌[35]藤茶水提物料液比 (1∶10) 在90 ℃水中提取1.5 h,重复2次昆明小鼠HUA模型剂量依赖性抑制XOD活性,降低血清尿酸水平[32]HK-2细胞降低细胞上清液尿酸、XOD水平,下调IL-6、TNF-α水平,降低URAT1、GLUT9蛋白表达[32]分子对接藤茶中大部分活性成分与降尿酸核心蛋白结合稳定,共获得29种来自藤茶可能治疗HUA活性成分[32]藤茶提取物,含质量分数为50%二氢杨梅素、5%槲皮素ICR小鼠HUA 模型200、400 mg/kg藤茶提取物组显著抑制XOD活性;尿酸值分别降低22.65%和29.15%[38]藤茶水提物料液比(1∶20) 在100 ℃水中提取30 min,重复3次体外尿酸合酶抑制体系对ADA、PNP、XOD的IC50分别为156.60 mg/mL、2.55 mg/mL、0.01 mg/mL [40]HepG2 细胞抑制ADA、PNP和XOD阻碍腺苷代谢为尿酸[40]藤茶多酚HUA小鼠模型降低小鼠血清尿酸[41]
使用高尿酸模型大鼠和小鼠作为实验动物,是评估天然植物提取物及单体化合物降低尿酸水平有效性的常见方法。研究表明,藤茶提取物摄入能有效抑制模型动物体内XOD活性,从而减少尿酸生成。此外,藤茶提取物还通过降低URAT1和GLUT9转运蛋白的表达,阻碍尿酸盐的重吸收,并通过上调ABCG2的表达促进尿酸盐的排泄,从而提高尿酸转运速率,最终协同降低尿酸水平[11,32,34-35,37-38]。
尽管关于藤茶摄入对人体的影响的研究还相对有限,但在 2018 年进行的一项随机、安慰剂对照交叉研究中,38 名男性参与了试验。结果显示,尽管藤茶提取物摄入组与安慰剂组在餐后尿酸水平上没有显示出统计学上的差异,但藤茶提取物组显著增加了受试者体内尿酸的排泄,这表明藤茶提取物摄入有助于促进尿酸排泄,从而抑制餐后尿酸水平的升高[39]。
2.2 藤茶中有降尿酸作用的黄酮类单体的研究
藤茶含有复杂的生物活性化合物,其提取物表现出积极降尿酸作用,但是具体哪些活性成分负责其药理作用尚未明确。目前,尽管有大量的文献研究其它天然植物中降尿酸作用的活性成分,这些成分在藤茶中也有所发现。基于这些黄酮类化合物在藤茶中的存在,为藤茶黄酮类单体化合物降尿酸研究提供思路。
黄酮类化合物通过多种机制发挥作用,包括抑制尿酸合酶以减少尿酸生成、调节尿酸盐转运蛋白 (URAT1、GLUT9、ABCG2、OAT1、OAT2、OAT3) 改善尿酸的重吸收和排泄,以及通过降低肾脏促炎症细胞因子水平来发挥作用(表3)。在众多活性成分中,二氢杨梅素作为藤茶黄酮的主要活性成分,据报道可以降低HUA小鼠体内尿酸、尿酸氮、肌酐水平[42]。同时,花旗松素通过抑制XOD活性表现出抗HUA作用[43]。槲皮素,一种广泛存在的黄酮类化合物,通过降低肝脏和血清中XOD活性,降低肾脏和肠道GLUT9表达,并增加ABCG2的表达,以剂量依赖性方式降低HUA小鼠的尿酸水平[44-46]。异鼠李素,作为一种槲皮素的3-O-甲基化代谢物,无论在体内还是在体外都显示出抑制XOD活性的能力[44,47]。芹菜素,作为一种天然类黄酮,广泛存在于多种植物中,不仅抑制体内XOD活性,还能抑制URAT1和GLUT9的蛋白表达,促进ABCG2、OAT1的表达,进而促进尿酸排泄,可通过抑制磷酸化激酶2/磷酸信号转导和转录激活因子 3信号 (JAK2/STAT3) 通路来改善尿酸代谢[48-49]。与芹菜素类似,木犀草素抑制XOD活性,能逆转与HUA小鼠尿酸转相关蛋白的失调,促进尿酸排泄[50-51]。柚皮素和橙皮素,作为从柑橘类化合物中分离出来的活性成分,展现出抑制XOD活性的能力,柚皮素通过抑制PI3K/AKT信号通路降低GLUT9的表达,并通过增加PDZK1的方式增强ABCG2的表达[52],橙皮素降低XOD表达,上调了OAT1、OAT3的表达[53],这2种成分均能促进HUA小鼠体内尿酸排泄。
表3 黄酮类单体降尿酸研究
Table 3 Studies on uric acid lowering by flavonoid monomers

活性成分结构动物模型剂量作用效果参考文献二氢杨梅素昆明小鼠HUA模型0.188、0.376、0.752 g/kg显著降低小鼠体内尿酸水平[42]花旗松素AML12肝细胞25、50、100 μmol/L时间、剂量依赖性抑制细胞尿酸产生[43]ICR小鼠HUA 模型100、300 mg/kg抑制XOD活性和降低体内尿酸水平[43]槲皮素AML12肝细胞3、10、30 μmol/L剂量依赖抑制细胞尿酸产生[44]ICR小鼠HUA 模型100、300 mg/kg300 mg/kg抑制肝脏XOD和降低体内尿酸水平[44]ICR小鼠HUA模型100 mmol/kg降低体内尿酸[45]尿酸酶基因敲除小鼠100、200、400 mg/kg高剂量处理肾脏和肠道GLUT9表达降低,肾脏和肠道ABCG2表达升高[46]异鼠李素AML12肝细胞3、10、30 μmol/L剂量依赖抑制细胞尿酸产生[44]ICR小鼠HUA 模型100、300 mg/kg300 mg/kg抑制肝脏XOD和降低体内尿酸水平[44]昆明小鼠HUA模型50、100、150 mg/ kg抑制血清和肝脏XOD活性和降低体内尿酸水平[47]芹菜素昆明小鼠HUA肾病模型50、100 mg/kg抑制URAT1和GLUT蛋白表达促进尿酸排泄[48]昆明小鼠HUA模型25、50、100 mg/kg抑制XOD活性和URAT1、GLUT表达,促进OAT1表达;抑制JAK2/STAT3通路改善尿酸代谢[49]木犀草素昆明小鼠HUA肾病模型10、20 mg/ kg下调肾脏URAT1表达[50]昆明小鼠HUA模型10、30、90 mg/kg抑制肝脏和血清XOD活性,调节ABCG2、OAT3、OAT1的表达[51]柚皮素昆明小鼠HUA模型10、50 mg/kg抑制PI3K/AKT信号通路降低GLUT9表达,增加PDZK1来增强ABCG2表达[52]HK-2细胞10、20、40 μmol/L剂量依赖性抑制 GLUT9 和 URAT1 的表达,上调PDZK1蛋白表达来增加ABCG2表达[52]橙皮素ICR小鼠HUA模型5、10 mg/kg抑制XOD活性,抑制XOD蛋白表达,上调OAT1、OAT3[53]
3 藤茶降尿酸作用未来展望
3.1 通过微生物降尿酸
除肾脏外,肠道也在尿酸的排泄中扮演重要角色,贡献约25%~35% 的尿酸排泄量[54]。肠道微生物在肠道微环境中扮演着重要角色,不仅在宿主代谢、免疫调节和维持内部环境稳态发挥作用,还被认为是治疗HUA的新靶点[55-56]。肠道菌群通过多种方式影响尿酸的代谢,通过促进嘌呤和尿酸的分解代谢、调节尿酸转运蛋白对尿酸的吸收和排泄、生成有助于尿酸排泄的代谢产物,以及调节肠道免疫功能[55,57]。动物试验表明,多种天然植物提取物通过影响肠道微生物可能对HUA有积极影响。尽管藤茶含有丰富的活性物质,但其通过调节肠道微生物改善HUA尚未详尽研究。回顾现有文献,本文试图为藤茶在HUA治疗中的潜在作用机制有更深入和清晰的认识。
在人体内复杂生态系统中,肠道菌群扮演着核心角色,其中厚壁菌门、拟杆菌门、放线菌门和变形菌门的细菌是人体内主要的细菌群体。乳酸菌的功能尤为突出,它们不仅减少肠道对嘌呤的吸收,还合成相关尿酸酶来促进尿酸分解。研究指出,普雷沃氏菌和拟杆菌门的存在与血清尿酸、肌酐和尿酸氮的水平呈正相关,且肝脏中XOD基因表达与拟杆菌属的活性成正比。山蜡梅作为一种功能性绿茶和药用植物,MENG等[58]研究发现,山蜡梅乙醇提取物中黄酮含量高达76.11%,以槲皮素和山奈酚为主。山蜡梅提取物不仅通过抑制尿酸合酶、调节GLUT9、URAT1、ABCG2、OAT1等蛋白表达有效缓解HUA。还可以恢复HUA小鼠的肠道菌群紊乱,通过增加乳酸杆菌等有益菌来减少肠道对嘌呤的吸收,改善了尿酸代谢的紊乱。以山奈酚为主要成分的藏红花黄酮提取物调节与宿主代谢相关肠道菌群发挥有效的抗HUA作用[59]。在另一项研究中,6种茶水提物可以明显缓解HUA,抑制XOD活性、上调ABCG2表达,此外还可以上调乳酸杆菌来促进尿酸的分解,并通过降低拟杆菌的相对丰度来抑制尿酸合成[60]。
3.2 调节胰岛素抵抗降尿酸
胰岛素抵抗会增加尿酸的产生和减少尿酸的排泄,降低胰岛素抵抗可以降低血清尿酸水平[61]。大量研究已证实黄酮类化合物可有效改善胰岛素敏感性,间接降低尿酸水平。持续摄入木犀草素4周可恢复链脲佐菌素诱导的糖尿病小鼠的胰岛素抵抗、血脂异常、高尿酸血症和肾炎细胞浸润[62]。类似地,二氢杨梅素和槲皮素也被证明可通过调节特定肠道菌群来调节胰岛素抵抗[63]。上述黄酮类化合物不仅可以直接改善HUA,还可以通过调节胰岛素抵抗降低宿主尿酸水平的潜在可能性。
4 总结
尽管藤茶在西方国家地普及度有限,近年来关于其对抗HUA的研究却在不断增加。本文综述了藤茶降低尿酸水平的作用机制:a)抑制XOD、PNP、ADA的酶活减少尿酸的生成;b)抑制URAT1和GLUT9表达,上调ABCG2蛋白表达,从而提高尿酸转运速率,最终协同降低尿酸水平;c)潜在的通过调节肠道菌群和胰岛素抵抗发挥降尿酸作用。尽管已取得初步成果,但藤茶的活性成分及其与HUA治疗的具体关联仍需要进一步研究。目前,关于藤茶的大多数研究集中在其混合提取物上,这些提取物涉及多个生物靶点和作用路径。未来研究可在前人的基础上,依据藤茶中各生物活性化合物的含量比例,探究它们复配对HUA治疗效果的综合影响。此外,考虑到HUA与多种代谢性疾病的关联,未来研究应深入探索藤茶调节HUA的具体机制,寻求新的治疗策略。这可能包括对藤茶在体内作用机制的深入研究,以及其与现有HUA治疗药物或干预措施的潜在协同效应。研究者还应考虑探讨不同剂量和治疗时长下藤茶对HUA患者的治疗效果,及其长期安全性和耐受性。总的来说,未来的研究应致力于全面揭示藤茶对HUA调节作用的内在机理及其在临床上的应用潜力,旨在为HUA患者提供更为有效和安全的治疗方案。
[1] BORGHI C, DOMIENIK-KAR OWICZ J, TYKARSKI A, et al. Expert consensus for the diagnosis and treatment of patient with hyperuricemia and high cardiovascular risk: 2021 update[J]. Cardiology Journal, 2021, 28(1):1-14.
OWICZ J, TYKARSKI A, et al. Expert consensus for the diagnosis and treatment of patient with hyperuricemia and high cardiovascular risk: 2021 update[J]. Cardiology Journal, 2021, 28(1):1-14.
[2] VARELDZIS R, PEREZ A, REISIN E. Hyperuricemia: An intriguing connection to metabolic syndrome, diabetes, kidney disease, and hypertension[J]. Current Hypertension Reports, 2024, 26(6):237-245.
[3] 中国民族卫生协会重症代谢疾病分会, 高尿酸血症相关疾病诊疗多学科共识专家组. 中国高尿酸血症相关疾病诊疗多学科专家共识(2023年版)[J]. 中国实用内科杂志, 2023, 43(6):461-480. Severe Metabolic Disease Branch of China National Health Association,Multidisciplinary consensus expert group on the diagnosis and treatment of hyperuricemia-related diseases. China multi-disciplinary expert consensus on diagnosis and treatment of hyperuricemia and related diseases(2023 edition) [J]. Chinese Journal of Practical Internal Medicine, 2023, 43(6):461-480.
[4] GUO X L, GAO Y Y, YANG Y X, et al. Amelioration effects of α-viniferin on hyperuricemia and hyperuricemia-induced kidney injury in mice[J]. Phytomedicine, 2023, 116:154868.
[5] MEHMOOD A, ZHAO L, WANG C T, et al. Management of hyperuricemia through dietary polyphenols as a natural medicament: A comprehensive review[J]. Critical Reviews in Food Science and Nutrition, 2019, 59(9):1433-1455.
[6] ISHIKAWA T, MAEDA T, HASHIMOTO T, et al. Long-term safety and effectiveness of the xanthine oxidoreductase inhibitor, topiroxostat in Japanese hyperuricemic patients with or without gout: A 54-week open-label, multicenter, post-marketing observational study[J]. Clinical Drug Investigation, 2020, 40(9):847-859.
[7] 张红忠, 雷林, 罗正江, 等. 初探藤茶的文献研究[J]. 贵州农机化, 2018(3):53-55, 61.ZHANG H Z, LEI L, LUO Z J, et al. An Initial Exploration of Literature on Ampelopsis Grossedentat[J]. Guizhou Agricultural Mechaniation, 2018(3):53-55, 61.
[8] 李佳川, 李思颖, 王优, 等. 藤茶化学成分、药理作用及质量标志物(Q-marker)预测分析[J]. 西南民族大学学报(自然科学版), 2021, 47(3):254-266.LI J C, LI S Y, WANG Y, et al. Predictive analysis on chemical composition, pharmacological effects and quality marker (Q-marker) of Ampelopsis grossedentata[J]. Journal of Southwest Minzu University (Natural Science Edition), 2021, 47(3):254-266.
[9] 赵春草, 曾佳. 藤茶的药理作用和安全性研究新进展[J]. 中国药房, 2023, 34(3):380-384.ZHAO C C, ZENG J. Recent advances on pharmacological effect and safety of Ampelopsis grossedentata[J]. China Pharmacy, 2023, 34(3):380-384.
[10] KOU X J, CHEN N. Pharmacological potential of ampelopsin in Rattan tea[J]. Food Science and Human Wellness, 2012, 1(1):14-18.
[11] 马二秀, 李思颖, 程雪瑶, 等. 藤茶总黄酮抗高尿酸血症及肾功能保护作用研究[J]. 中药药理与临床, 2021, 37(3):80-85.MA E X, LI S Y, CHENG X Y, et al. Protective effect of total flavonoids from Ampelopsis grossedentata on renal function and anti-hyperuricemia effect[J]. Pharmacology and Clinics of Chinese Materia Medica, 2021, 37(3):80-85.
[12] FENG S M, WU S J, XIE F, et al. Natural compounds lower uric acid levels and hyperuricemia: Molecular mechanisms and prospective[J]. Trends in Food Science &Technology, 2022, 123:87-102.
[13] GALBUSERA C, ORTH P, FEDIDA D, et al. Superoxide radical production by allopurinol and xanthine oxidase[J]. Biochemical Pharmacology, 2006, 71(12):1747-1752.
[14] YU D H, DU J N, HE P, et al. Identification of natural xanthine oxidase inhibitors: Virtual screening, anti-xanthine oxidase activity, and interaction mechanism[J]. International Journal of Biological Macromolecules, 2024, 259:129286.
[15] RAGAB G, ELSHAHALY M, BARDIN T. Gout: An old disease in new perspective-A review[J]. Journal of Advanced Research, 2017, 8(5):495-511.
[16] LIPKOWITZ M S. Regulation of uric acid excretion by the kidney[J]. Current Rheumatology Reports, 2012, 14(2):179-188.
[17] ERALY S A, VALLON V, RIEG T, et al. Multiple organic anion transporters contribute to net renal excretion of uric acid[J]. Physiological Genomics, 2008, 33(2):180-192.
[18] NIGAM S K, BHATNAGAR V. The systems biology of uric acid transporters: The role of remote sensing and signaling[J]. Current Opinion in Nephrology and Hypertension, 2018, 27(4):305-313.
[19] YANG B D, XIN M L, LIANG S F, et al. New insight into the management of renal excretion and hyperuricemia: Potential therapeutic strategies with natural bioactive compounds[J]. Frontiers in Pharmacology, 2022, 13:1026246.
[20] TSUSHIMA Y, NISHIZAWA H, TOCHINO Y, et al. Uric acid secretion from adipose tissue and its increase in obesity[J]. Journal of Biological Chemistry, 2013, 288(38):27138-27149.
[21] BALDWIN W, MCRAE S, MAREK G, et al. Hyperuricemia as a mediator of the proinflammatory endocrine imbalance in the adipose tissue in a murine model of the metabolic syndrome[J]. Diabetes, 2011, 60(4):1258-1269.
[22] NI Q, LU X M, CHEN C C, et al. Risk factors for the development of hyperuricemia: A STROBE-compliant cross-sectional and longitudinal study[J]. Medicine, 2019, 98(42): e17597.
[23] BEN SALEM C, SLIM R, FATHALLAH N, et al. Drug-induced hyperuricaemia and gout[J]. Rheumatology, 2017, 56(5):679-688.
[24] JENKINS C, HWANG J H, KOPP J B, et al. Review of urate-lowering therapeutics: From the past to the future[J]. Frontiers in Pharmacology, 2022, 13:925219.
[25] ZHANG X, WAN D P, YANG G S, et al. Febuxostat is superior to allopurinol in delaying the progression of renal impairment in patients with chronic kidney disease and hyperuricemia[J]. International Urology and Nephrology, 2019, 51(12):2273-2283.
[26] HOSOYA T, SASAKI T, OHASHI T. Clinical efficacy and safety of topiroxostat in Japanese hyperuricemic patients with or without gout: A randomized, double-blinded, controlled phase 2b study[J]. Clinical Rheumatology, 2017, 36(3):649-656.
[27] HOSOYA T, SASAKI T, HASHIMOTO H, et al. Clinical efficacy and safety of topiroxostat in Japanese male hyperuricemic patients with or without gout: An exploratory, phase 2a, multicentre, randomized, double-blind, placebo-controlled study[J]. Journal of Clinical Pharmacy and Therapeutics, 2016, 41(3):298-305.
[28] HOSOYA T, OGAWA Y, HASHIMOTO H, et al. Comparison of topiroxostat and allopurinol in Japanese hyperuricemic patients with or without gout: A phase 3, multicentre, randomized, double-blind, double-dummy, active-controlled, parallel-group study[J]. Journal of Clinical Pharmacy and Therapeutics, 2016, 41(3):290-297.
[29] KURIYAMA S. Dotinurad: A novel selective urate reabsorption inhibitor as a future therapeutic option for hyperuricemia[J]. Clinical and Experimental Nephrology, 2020, 24(Suppl 1):1-5.
[30] FITZGERALD J D, DALBETH N, MIKULS T, et al. 2020 American college of rheumatology guideline for the management of gout[J]. Arthritis &Rheumatology, 2020, 72(6):879-895.
[31] 杨冰慧, 李兵, 马金龙, 等. 药用植物藤茶的研究进展[J]. 大连民族大学学报, 2023, 25(3):199-203.YANG B H, LI B, MA J L, et al. Research progress of medicinal plant vine tea[J]. Journal of Dalian Minzu University, 2023, 25(3):199-203.
[32] ZHOU Q X, ZHOU Q, ZHANG P, et al. Integrating multi-level interactive network and in vivo/vitro studies to explore the protective mechanism of Ampelopsis grossedentata in hyperuricemia[J]. Fitoterapia, 2024, 172:105718.
[33] 孙冰, 赵彦巧, 冯子瑞, 等. 分子对接技术在食品领域的研究进展[J]. 粮食与油脂, 2023, 36(12):17-21.SUN B, ZHAO Y Q, FENG Z R, et al. Research progress of molecular docking technology in food field[J]. Cereals &Oils, 2023, 36(12):17-21.
[34] 李佳川, 李思颖. 基于分子对接技术的藤茶总黄酮对高尿酸血症肾功能损伤保护机制研究[J]. 中草药, 2021, 52(3):727-735.LI J C, LI S Y. Protective effect and mechanism of total flavonoids from Ampelopsis grossedentata on renal function injury of hyperuricemia based on molecular docking technology[J]. Acupuncture Research, 2021, 52(3):727-735.
[35] 任凌志, 李思颖, 宋琴, 等. 基于分子对接技术的结果研究藤茶总黄酮抗痛风性关节炎的作用机制[J]. 中药药理与临床, 2022, 38(3):96-101.REN L Z, LI S Y, SONG Q, et al. Mechanism of total flavonoids from Ampelopsis grossedentata against gouty arthritis based on molecular docking technology[J]. Pharmacology and Clinics of Chinese Materia Medica, 2022, 38(3):96-101.
[36] HOU C L, LIU D, WANG M, et al. Novel xanthine oxidase-based cell model using HK-2 cell for screening antihyperuricemic functional compounds[J]. Free Radical Biology and Medicine, 2019, 136:135-145.
[37] 王元. 藤茶提取物抗高尿酸血症及肾功能保护作用机制研究[D]. 成都: 西南民族大学, 2020.WANG Y. Study on the mechanism of anti-hyperuricemia and renal function protection of vine tea extract. Chengdu: Southwest University for Nationalities, 2020.
[38] 吴淑慧, 於洪建, 於天, 等. 藤茶提取物的降尿酸作用研究[J]. 食品工业科技, 2021, 42(18):350-355.WU S H, YU H J, YU T, et al. Study on anti-hyperuricemia effect of Ampelopsis grossedentata extracts[J]. Science and Technology of Food Industry, 2021, 42(18):350-355.
[39] SHIMIZU Y, SAKURADA T, MATSUOKA S, et al. Vine tea (Ampelopsis grossedentata) extract suppresses postprandial uric acid levels via both inhibition of xanthine oxidase and facilitation of uric acid excretion[J]. Current Developments in Nutrition, 2020, 4: nzaa045_107.
[40] ZHANG Z X, MO R M, LIU D B, et al. Research on the efficacy of ganpu vine tea in inhibiting uric acid production[J]. Metabolites, 2023, 13(6):704.
[41] LI X L, LI B Y, MENG X Y, et al. Integrating network pharmacology and experimental validation to reveal the mechanism of vine grape tea polyphenols on hyperuricemia-induced renal injury in mice[J]. Journal of Medicinal Food, 2024, 27(4):312-329.
[42] 李广枝, 卢忠英, 徐敬友, 等. 藤茶二氢杨梅素对小鼠高尿酸血症模型的降尿酸作用[J]. 山地农业生物学报, 2014, 33(4):40-42.LI G Z, LU Z Y, XU J Y, et al. Effect of dihydromyricetin from Ampelopsis grossedentata on reducing serum uric acid in hyperuricemia model mice[J]. Journal of Mountain Agriculture and Biology, 2014, 33(4):40-42.
[43] ADACHI S I, NIHEI K I, ISHIHARA Y, et al. Anti-hyperuricemic effect of taxifolin in cultured hepatocytes and model mice[J]. Cytotechnology, 2017, 69(2):329-336.
[44] ADACHI S I, KONDO S, SATO Y, et al. Anti-hyperuricemic effect of isorhamnetin in cultured hepatocytes and model mice: Structure-activity relationships of methylquercetins as inhibitors of uric acid production[J]. Cytotechnology, 2019, 71(1):181-192.
[45] TUNG Y T, LIN L C, LIU Y L, et al. Antioxidative phytochemicals from Rhododendron oldhamii Maxim. leaf extracts reduce serum uric acid levels in potassium oxonate-induced hyperuricemic mice[J]. BMC Complementary and Alternative Medicine, 2015, 15:423.
[46] 陈海青, 周璇, 王秀秀. 槲皮素治疗高尿酸血症的机制研究[J]. 光明中医, 2019, 34(9):1340-1344.CHEN H Q, ZHOU X, WANG X X. Mechanistic study of quercetin in the treatment of hyperuricemia [J]. Guangming Journal of Chinese Medicine, 2019, 34(9):1340-1344.
[47] WANG F Q, ZHAO X, SU X, et al. Isorhamnetin, the xanthine oxidase inhibitor from Sophora japonica, ameliorates uric acid levels and renal function in hyperuricemic mice[J]. Food &Function, 2021, 12(24):12503-12512.
[48] LI Y M, ZHAO Z A, LUO J, et al. Apigenin ameliorates hyperuricemic nephropathy by inhibiting URAT1 and GLUT9 and relieving renal fibrosis via the Wnt/β-catenin pathway[J]. Phytomedicine, 2021, 87:153585.
[49] LIU T Y, GAO H M, ZHANG Y Y, et al. Apigenin ameliorates hyperuricemia and renal injury through regulation of uric acid metabolism and JAK2/STAT3 signaling pathway[J]. Pharmaceuticals, 2022, 15(11):1442.
[50] 严采馨, 田锦鸿, 李璐, 等. 木犀草素通过抑制URAT1与调节Nrf2/HO-1通路改善尿酸诱导的肾脏损伤[J]. 生命科学研究, 2022, 26(2):103-110.YAN C X, TIAN J H, LI L, et al. Luteolin alleviates hyperuricemic nephropathy by inhibiting URAT1 and regulating Nrf2/HO-1 pathway[J]. Life Science Research, 2022, 26(2):103-110.
[51] 余惠凡, 黄林生, 韩俊祥, 等. 木犀草素对高尿酸血症小鼠降尿酸作用及其机制研究[J]. 时珍国医国药, 2021, 32(5):1071-1074.YU H F, HUANG L S, HAN J X, et al. Luteolin on uric acid-lowering in hyperuricemia mice and its mechanism [J]. Lishizhen Medicine and Materia Medica Research, 2021, 32(5):1071-1074.
[52] YANG B D, XIN M L, LIANG S F, et al. Naringenin ameliorates hyperuricemia by regulating renal uric acid excretion via the PI3K/AKT signaling pathway and renal inflammation through the NF-κB signaling pathway[J]. Journal of Agricultural and Food Chemistry, 2023, 71(3):1434-1446.
[53] AN M F, SHEN C, ZHANG S S, et al. Anti-hyperuricemia effect of hesperetin is mediated by inhibiting the activity of xanthine oxidase and promoting excretion of uric acid[J]. Frontiers in Pharmacology, 2023, 14:1128699.
[54] DE OLIVEIRA E P, BURINI R C. High plasma uric acid concentration: Causes and consequences[J]. Diabetology &Metabolic Syndrome, 2012, 4:12.
[55] WANG J, CHEN Y, ZHONG H, et al. The gut microbiota as a target to control hyperuricemia pathogenesis: Potential mechanisms and therapeutic strategies[J]. Critical Reviews in Food Science and Nutrition, 2022, 62(14):3979-3989.
[56] PAN L B, HAN P, MA S R, et al. Abnormal metabolism of gut microbiota reveals the possible molecular mechanism of nephropathy induced by hyperuricemia[J]. Acta Pharmaceutica Sinica B, 2020, 10(2):249-261.
[57] YIN H, LIU N, CHEN J. The role of the intestine in the development of hyperuricemia[J]. Frontiers in Immunology, 2022, 13:845684.
[58] MENG W Y, CHEN L L, OUYANG K H, et al. Chimonanthus nitens Oliv. leaves flavonoids alleviate hyperuricemia by regulating uric acid metabolism and intestinal homeostasis in mice[J]. Food Science and Human Wellness, 2023, 12(6):2440-2450.
[59] CHEN N, WANG R, LI H, et al. Flavonoid extract of saffron by-product alleviates hyperuricemia via inhibiting xanthine oxidase and modulating gut microbiota[J]. Phytotherapy Research, 2022, 36(12):4604-4619.
[60] WU D, CHEN R H, LI Q H, et al. Tea (Camellia sinensis) ameliorates hyperuricemia via uric acid metabolic pathways and gut microbiota[J]. Nutrients, 2022, 14(13):2666.
[61] YU W, XIE D, YAMAMOTO T, et al. Mechanistic insights of soluble uric acid-induced insulin resistance: Insulin signaling and beyond[J]. Reviews in Endocrine &Metabolic Disorders, 2023, 24(2):327-343.
[62] CHEN L Y, TIAN G W, TANG W D, et al. Protective effect of luteolin on streptozotocin-induced diabetic renal damage in mice via the regulation of RIP140/NF-кB pathway and insulin signalling pathway[J]. Journal of Functional Foods, 2016, 22:93-100.
[63] 童庆. 二氢杨梅素通过调节肠道菌群结构防治肥胖及胰岛素抵抗的作用机制研究[D]. 武汉: 华中科技大学, 2018.TONG Q. Dihydromyricetin improves obesity and insulin resistance by modulating the composition of gut microbiota. Wuhan: Huazhong University of Science and Technology, 2018.