高尿酸血症(hyperuricemia,HUA)是指血清尿酸浓度异常升高的病理状态[1]。尿酸是嘌呤代谢的最终产物,来源于饮食摄入或体内细胞代谢过程中嘌呤物质的分解。正常情况下,尿酸通过肾脏排泄,保持体内平衡。然而,若尿酸的合成速度超过肾脏的排泄能力,或肾脏无法有效排泄尿酸,就会导致血清尿酸水平升高,并最终发展为HUA。根据临床标准,男性血清尿酸超过7.0 mg/dL(约420 μmol/L),女性超过6.0 mg/dL(约357 μmol/L),即可诊断为HUA。
益生菌在消化系统中定植,能够通过分泌有益物质和调节肠道菌群,促进人体健康。越来越多的证据表明,益生菌在改善代谢紊乱方面起着重要作用,尤其是在作为功能性食品时被广泛应用。益生菌能够调节肠道微生物组成和促进短链脂肪酸(short-chain fatty acids,SCFAs)的生成,这一作用已得到广泛关注和研究。已有研究证实,罗伊氏粘液乳杆菌PA-3[2]、短乳杆菌DM9218[3]、干酪乳酪杆菌ZM15[4]和植物乳植杆菌GKM3[5]等益生菌对缓解HUA具有积极效果。除此之外,益生菌还通过促进肠道SCFAs的生成,间接发挥对尿酸代谢的调节作用。研究显示,丁酸盐通过抑制组蛋白脱乙酰酶的活性,减轻尿酸钠晶体诱导的细胞因子产生,并通过激活G蛋白偶联受体信号通路,有助于改善高脂饮食引起的尿酸代谢紊乱[6]。进一步研究发现,痛风患者肠道内有益菌群如梭菌和普氏粪杆菌的减少导致丁酸盐合成的降低[7]。此外,发酵粘液乳杆菌JL-3的发酵处理能够减轻HUA小鼠肠道内拟杆菌的丰度增加,并显著提高乙酸和丁酸的浓度[8]。鼠李糖乳酪杆菌R31、鼠李糖乳酪杆菌R28-1及罗伊氏粘液乳杆菌L20M3通过增强产生SCFAs的肠道细菌丰度,显著增加乙酸和丙酸的浓度改善小鼠的HUA,表明SCFAs可能对HUA治疗具有潜在价值[9]。
尽管益生菌在HUA治疗中展现了可观的潜力,但这一研究领域仍处于初步阶段。由于益生菌种类繁多,各自的作用机制有所不同,因此需要进一步深入研究其遗传背景和差异。本文通过比较基因组学分析,探讨罗伊氏粘液乳杆菌(Limosilactobacillus reuteri)在缓解HUA中的潜在机制,重点关注菌株代谢功能基因与生理指标和SCFAs变化之间的关系,为HUA的治疗提供新的理论依据。
1 材料与方法
1.1 材料与试剂
苏木精-伊红,南京雨露实验器材有限公司;琼脂糖、黄嘌呤氧化酶(xanthine oxidase,XOD)活性检测试剂盒,北京索莱宝科技有限公司;氧嗪酸钾、次黄嘌呤、别嘌呤醇,上海阿拉丁有限公司;粪便基因提取试剂盒,MP biochemical生物医疗公司;胶回收试剂盒,杭州倍沃医学科技有限公司;多聚甲醛、石蜡、MRS培养基成分,国药集团化学试剂有限公司。
1.2 仪器与设备
BS480全自动生化分析仪,深圳迈瑞生物医疗电子股份有限公司;Multiskan SkyHigh酶标仪、Trace 1300气质联用仪,赛默飞世尔科技公司;SCIENTZ-48组织破碎仪,宁波新芝生物科技股份有限公司;C1000 TouchTM基因扩增仪,美国Bio-Rad公司;Nano Photometer超微量分光光度计,德国Implen公司;DYCP-31DN水平核酸电泳仪,北京六一生物科技有限公司;Qubit荧光定量仪,美国Life Invitrogen公司;MiSeq高通量测序平台,美国Illumina公司。
1.3 实验方法
1.3.1 菌悬液制备
实验所用菌株均保藏于江南大学食品学院食品生物技术中心,菌株按照朱广素等[10]的方法准备菌悬液进行下一步动物实验。按2%接种量将罗伊氏粘液乳杆菌接种于MRS培养基,在37 ℃条件下培养至对数期,离心取菌体沉淀,用生理盐水重悬备用。
1.3.2 动物实验
实验使用24只5周龄(24~28 g)昆明小鼠,购自北京维通利华有限公司,饲养在江南大学实验动物中心SPF级屏障环境,饲养环境湿度(50±10)%、12 h/12 h昼夜循环、温度为(23±2) ℃。动物实验方案严格按照江南大学实验伦理委员会批准的方案执行(伦理编号:JN.No20240630k0960820[339]),整个动物实验过程遵循实验动物伦理福利3R原则,实验动物管理和使用符合法规要求。
HUA小鼠模型参考前人的方法[11],通过腹腔注射200 mg/kg的氧嗪酸钾及灌胃500 mg/kg的次黄嘌呤诱导小鼠HUA,具体实验流程见图1。实验开始前,经过1周的适应性饲养,将小鼠随机分别为正常对照组、HUA模型组、罗伊氏粘液乳杆菌干预组(FQ56组和2M15组)。实验周期为4周,FQ56组或2M15组小鼠前2周灌胃109 CFU的罗伊氏粘液乳杆菌,其他组小鼠则灌胃生理盐水作为对照溶剂;除正常对照组外,最后2周其他组小鼠均腹腔注射200 mg/kg的氧嗪酸钾,并灌胃500 mg/kg的次黄嘌呤。实验结束前1 d,收集小鼠粪便并贮存于-80 ℃。实验结束时,收集小鼠的血液、肝脏和肾脏等样品。血液静置于室温2 h后,3 500 r/min离心15 min,取上清液为血清,贮存于-80 ℃以备后续使用。
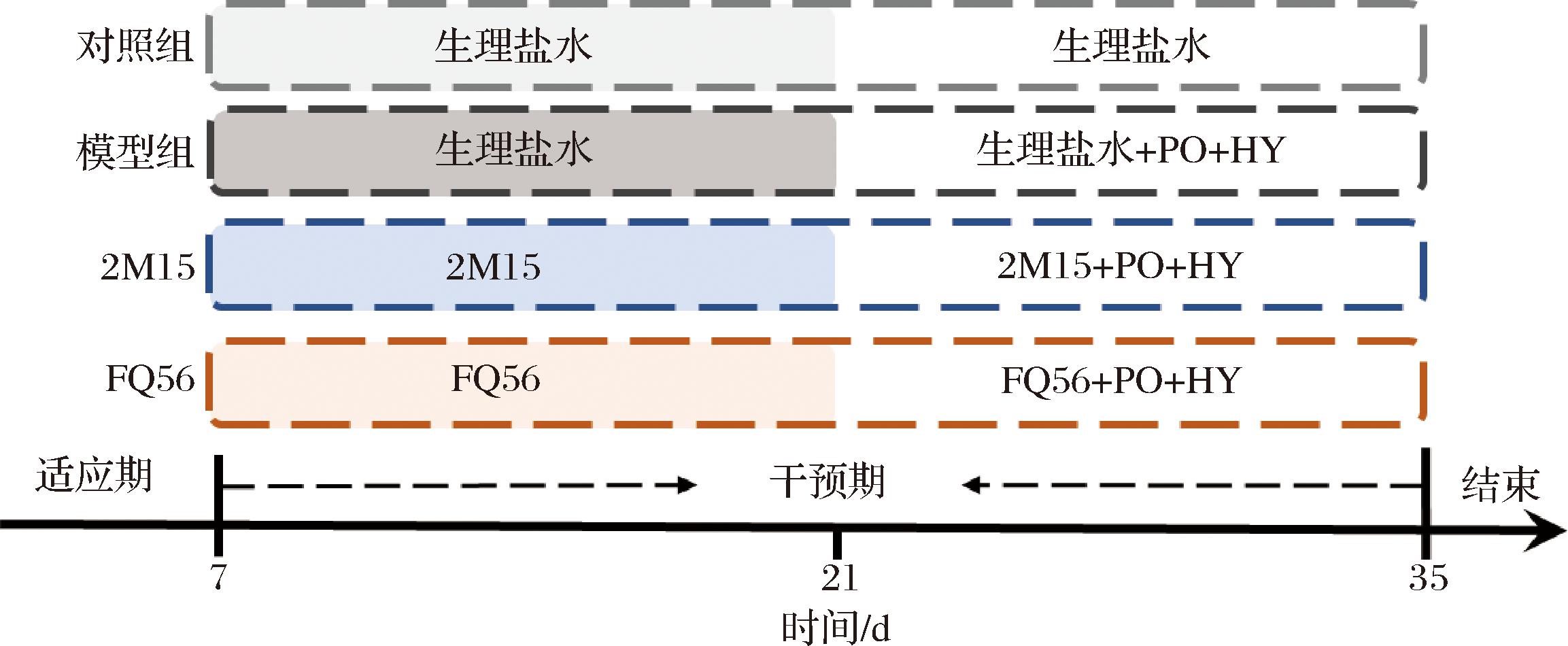
2M15-罗伊氏粘液乳杆菌2M15;FQ56-罗伊氏粘液乳杆菌FQ56;PO-氧嗪酸钾(potassium oxonate);HY-次黄嘌呤(hypoxanthine)。
图1 动物实验流程
Fig.1 The procedure of animal experiment
1.3.3 血清尿酸、肌酐测定
按照试剂盒说明书采用BS480迈瑞全自动生化分析仪测定小鼠血清中尿酸和肌酐的浓度。在动物实验的当天早晨,首先称量小鼠的体重。解剖过程中,取出小鼠的双肾并称重,随后计算肾重与体重的比值,作为肾重指数。
1.3.4 血清和肝脏中XOD活性测定
取0.05 g肝脏组织,加入0.5 mL XOD提取液,在高通量组织破碎仪中彻底破碎。随后,采用8 000×g的离心条件,离心10 min,收集上清液并保存。接着,根据XOD试剂盒的说明,测定小鼠血清及肝脏匀浆中XOD的活性。
1.3.5 肾脏组织病理观察
使用40 g/L多聚甲醛对组织进行固定后,进行脱水处理,并用石蜡包埋。随后,切取5 μm厚的组织切片,置于载玻片上,并采用苏木精-伊红染色法进行染色。显微镜观察组织病理情况,最终放大倍数为200倍。
1.3.6 粪便16S rRNA菌群测定
首先,使用FastDNA Spin Kit for Feces试剂盒根据操作手册提取粪便样本中的总微生物DNA。随后,利用PCR扩增16S rRNA基因的V3~V4区域。PCR产物经1.5%琼脂糖凝胶电泳分离后,筛选出目标条带并进行切割。接着,使用胶回收试剂盒按照说明进行纯化并构建测序文库。最终,通过Illumina Miseq平台进行高通量测序,并采用Qiime 2软件对16S rRNA测序数据进行质量控制、拼接及注释。
1.3.7 粪便SCFAs浓度测定
参考王琳琳[12]的方法采用气质联用仪进行小鼠粪便SCFAs的检测。将样品进行冷冻干燥并称重后,加入内标物2-乙基丁酸,并将其浸泡在500 μL饱和氯化钠溶液中。利用组织破碎仪对样品进行充分破碎。接下来,加入40 μL 9%(体积分数)硫酸并彻底振荡混合。然后,加入1 mL无水乙醚进行SCFAs的萃取。将乙醚相转移至含有0.25 g无水硫酸钠的离心管中,用以去除水分。最后,通过12 000 r/min离心15 min,收集上清液并进行GC-MS分析。
1.3.8 比较基因组
乳酸菌的草图测序由美吉生物(上海,中国)完成。所有基因根据COG(Cluster of Orthologous Groups of proteins,http://www.ncbi.nlm.nih.gov/COG)进行功能组分类。预测基因随后在多个公共数据库中进行了注释,包括非冗余数据库(Non-Redundant Database,NR)、KEGG数据库(http://www.genome.jp/kegg)、CAZy数据库(http://www.cazy.org)和eggNOG-mapper数据库(https://github.com/eggnogdb/eggnog-mapper)。多糖代谢与SCFAs合成能力预测基于iLABdb数据库(An Integrated Lactic Acid Bacteria Database),在网站提交乳酸菌的基因组信息,基于dbCAN进行糖苷水解酶注释并预测[13]。
1.4 数据处理
数据以“平均值±标准差”形式呈现。首先,使用Shapiro-Wilk检验评估数据的正态性。对于符合正态分布的数据,采用非配对t检验或单因素方差分析(One-Way ANOVA),并通过Dunnett’s检验进行事后比较,以确定组间差异的显著性。对于不符合正态分布的数据,则使用Mann-Whitney U检验或Kruskal-Wallis非参数检验,结合Dunnett’s检验进行差异显著性分析。统计学差异定义为P<0.05。
2 结果与分析
2.1 罗伊氏粘液乳杆菌对HUA小鼠生理指标的影响
HUA是指血清尿酸水平超过正常值的一种疾病,因此,首先对小鼠血清中的尿酸浓度进行了测定。氧嗪酸钾是尿酸酶的抑制剂,抑制了小鼠体内尿酸的分解;次黄嘌呤作为尿酸的前体,使得尿酸产生加剧。氧嗪酸钾和次黄嘌呤的共同作用引起小鼠“尿酸产生过剩”型HUA[2],使得大量尿酸积累在血液中,引起血清尿酸浓度升高。氧嗪酸钾和次黄嘌呤处理组的小鼠血清尿酸浓度显著升高[模型组尿酸浓度为(294.2±59.7) μmol/L,图2-A],表明本实验采用的造模方法能够引起小鼠HUA症状。罗伊氏粘液乳杆菌FQ56的干预使得HUA小鼠的血清尿酸浓度显著降低[(192.8±68.3) μmol/L,P<0.05],趋近于正常水平。然而,罗伊氏粘液乳杆菌2M15组血清尿酸浓度与模型组没有显著差异(P>0.05)。此外,血清肌酐和肾重指数是评估肾脏健康的重要指标,模型组的血清肌酐浓度(图2-B)和肾重指数(图2-C)显著高于空白组(P<0.05),罗伊氏粘液乳杆菌FQ56干预能显著降低HUA小鼠的血清肌酐浓度与肾重指数,而罗伊氏粘液乳杆菌2M15组与模型组没有显著差异。这一结果与血清尿酸浓度相一致,表明罗伊氏粘液乳杆菌FQ56能有效降低小鼠尿酸水平,缓解HUA造成的小鼠肾损伤。
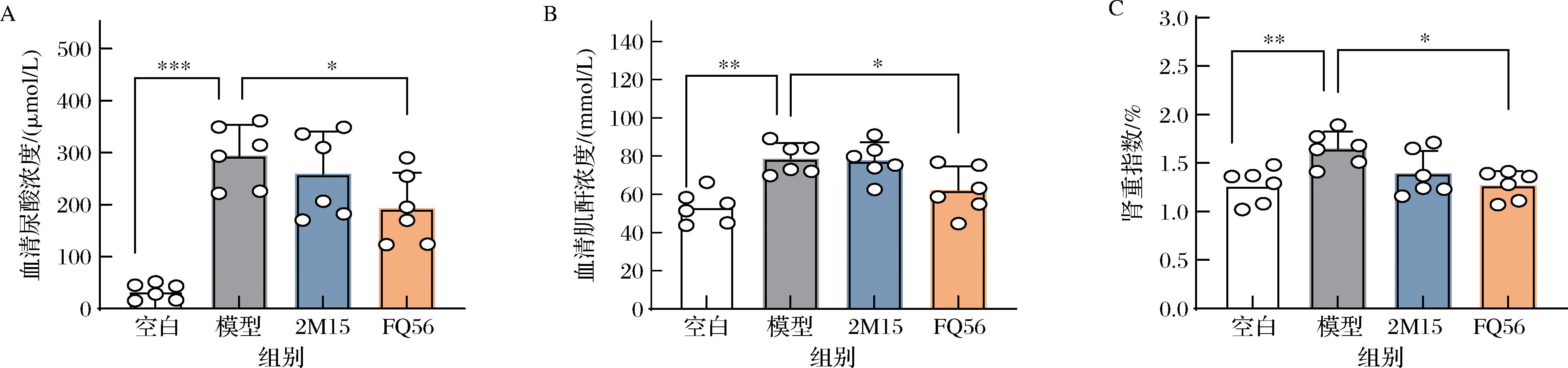
A-血清尿酸浓度;B-血清肌酐浓度;C-肾重指数
图2 罗伊氏粘液乳杆菌对高尿酸血症小鼠生理指标的影响
Fig.2 The effect of L.reuteri on physiological indicators of HUA mice
注:*表示P<0.05;**表示P<0.01;***表示P<0.001(下同)。
2.2 罗伊氏粘液乳杆菌对HUA小鼠肾脏组织损伤的影响
肾功能损害是HUA除痛风外最常见的并发症。血清尿酸水平升高会促使尿酸大量通过肾脏排泄,进而加重肾脏的负担。由于尿酸的溶解度较低,部分尿酸可能在肾脏内沉积,最终可能导致肾功能的逐渐衰退[14]。因此,本研究进一步通过肾脏病理学检查评估小鼠的肾脏损伤情况。病理学结果显示,与空白组相比(图3-A),模型组小鼠的肾小管出现肿胀且排列紊乱,近端肾小管出现扩张及玻璃样变,鲍氏囊扩张,且肾小球呈现明显的萎缩(图3-B)。这些变化提示,HUA小鼠在肾脏病理和功能上均出现了损伤,这与先前的研究结果一致[15]。与模型组相比,在罗伊氏粘液乳杆菌FQ56干预后,小鼠的肾脏组织得到了显著改善。主要表现为肾小管的规则性扩张有所恢复,肾小球萎缩程度减轻,形态接近空白组,胞质空泡显著缩小,肾小管的管型及玻璃样变消失等(图3-D)。肾脏病理切片的结果进一步证实,高尿酸模型小鼠出现了肾脏的器质性损伤,而罗伊氏粘液乳杆菌FQ56对由氧嗪酸钾引起的小鼠肾脏损伤发挥了保护作用,显著改善了HUA小鼠的肾脏病理状态。
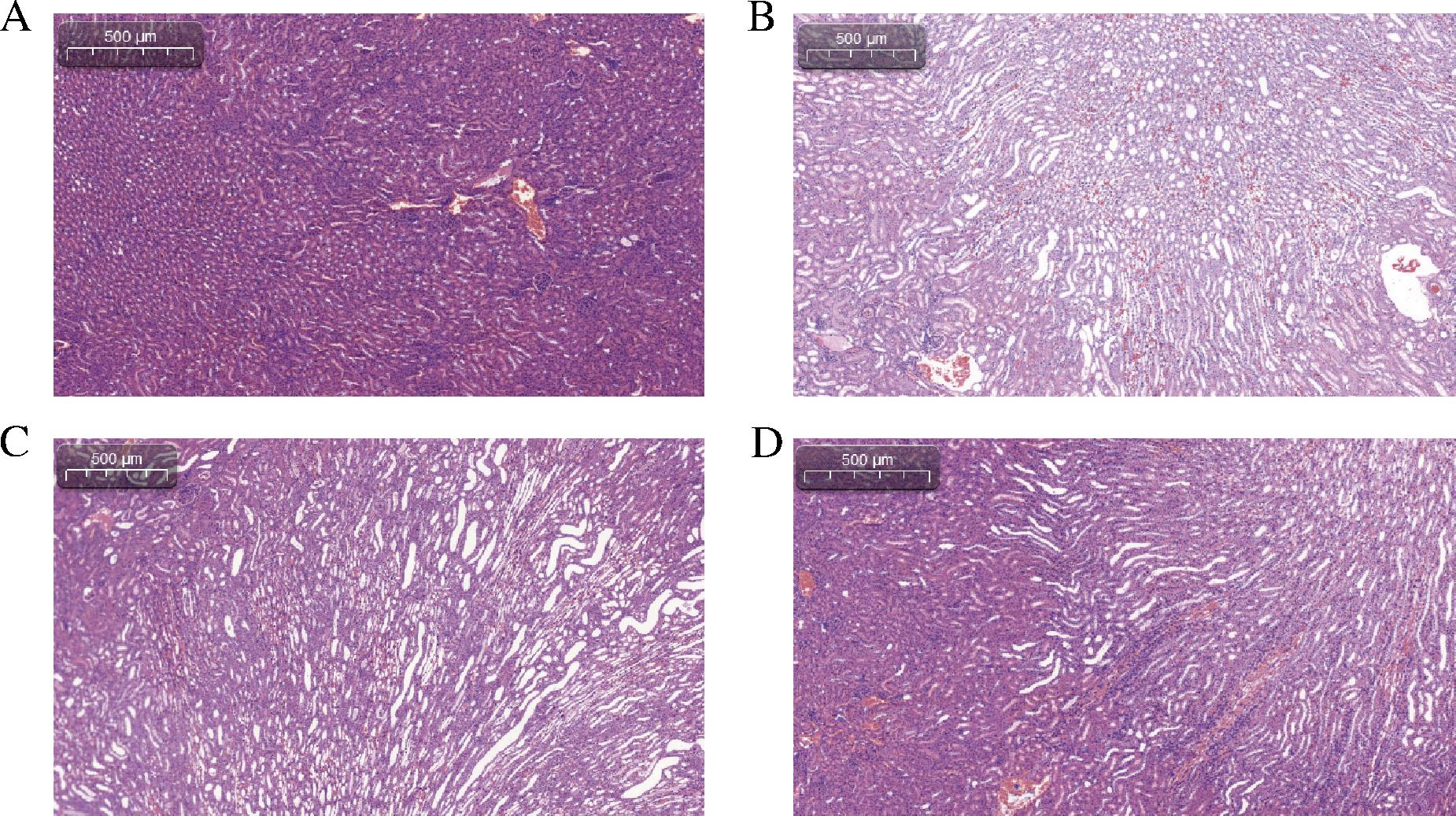
A-空白组肾脏病理;B-模型组肾脏病理;C-2M15组肾脏病理;D-FQ56组肾脏病理
图3 罗伊氏粘液乳杆菌对高尿酸血症小鼠肾脏病理损伤的影响
Fig.3 The effect of L.reuteri on renal pathological damage in hyperuricemia mice
2.3 罗伊氏粘液乳杆菌对HUA小鼠XOD活性的影响
XOD在嘌呤代谢中发挥重要作用,它负责将次黄嘌呤转化为黄嘌呤,并进一步将黄嘌呤转化为尿酸。因此,XOD的活性与血清尿酸浓度的升高密切相关,是HUA和痛风治疗的主要靶点。大多数用于治疗这些疾病的药物都是XOD抑制剂[16]。本研究对各组小鼠的血清及肝脏中XOD的活性进行了测定,结果如图4所示。

A-肝脏XOD活性;B-血清XOD活性
图4 罗伊氏粘液乳杆菌对高尿酸血症小鼠黄嘌呤氧化酶活性的影响
Fig.4 The effect of L.reuteri on the activity of xanthine oxidase in mice
与空白组相比,模型组小鼠肝脏中XOD的活性显著升高[(17.24±1.97) U/g,P<0.05],这一变化与血清尿酸浓度的升高一致。与模型组相比,经过罗伊氏粘液乳杆菌FQ56干预后,HUA小鼠肝脏中XOD的活性显著下降[(13.18±1.74) U/g,P<0.05]。在血清中,模型组与空白组的小鼠XOD活性没有显著差异,但罗伊氏粘液乳杆菌FQ56组小鼠血清中的XOD活性显著低于模型组[(9.92±2.18) U/L,P<0.05]。然而,罗伊氏粘液乳杆菌2M15组的小鼠肝脏和血清中XOD的活性与模型组相比未见明显改善。这些结果表明,罗伊氏粘液乳杆菌FQ56能够显著降低XOD的活性,进而有效抑制氧嗪酸钾引起的HUA小鼠肝脏中XOD活性的升高。由此推测,罗伊氏粘液乳杆菌FQ56可能通过抑制XOD的活性,减少尿酸的生成,从而缓解小鼠的HUA。
2.4 罗伊氏粘液乳杆菌对HUA小鼠肠道菌群的影响
越来越多的证据表明,肠道微生物群在尿酸代谢及HUA的发生和发展中起着重要作用,肠道菌群失衡被认为是多种代谢性疾病的根本原因,诸如HUA和痛风等[17]。罗伊氏粘液乳杆菌对HUA小鼠肠道菌群的影响如图5-A所示,主成分分析(principal component analysis,PCA)结果表明各组小鼠的肠道菌群结构存在显著差异(P=0.036),但α多样性指数(包括Shannon、Chao1、Evenness及Faith-PD等指标)在各组间没有显著差异(图5-B)。已有研究指出,HUA患者的肠道菌群与正常人群存在明显不同,包括肠道菌群多样性的下降及肠道病原菌(如拟杆菌属、红孢菌属和厌氧菌科等)丰度的增加[18]。然而,鲜有研究关注HUA患者与SCFAs合成相关菌群的变化。
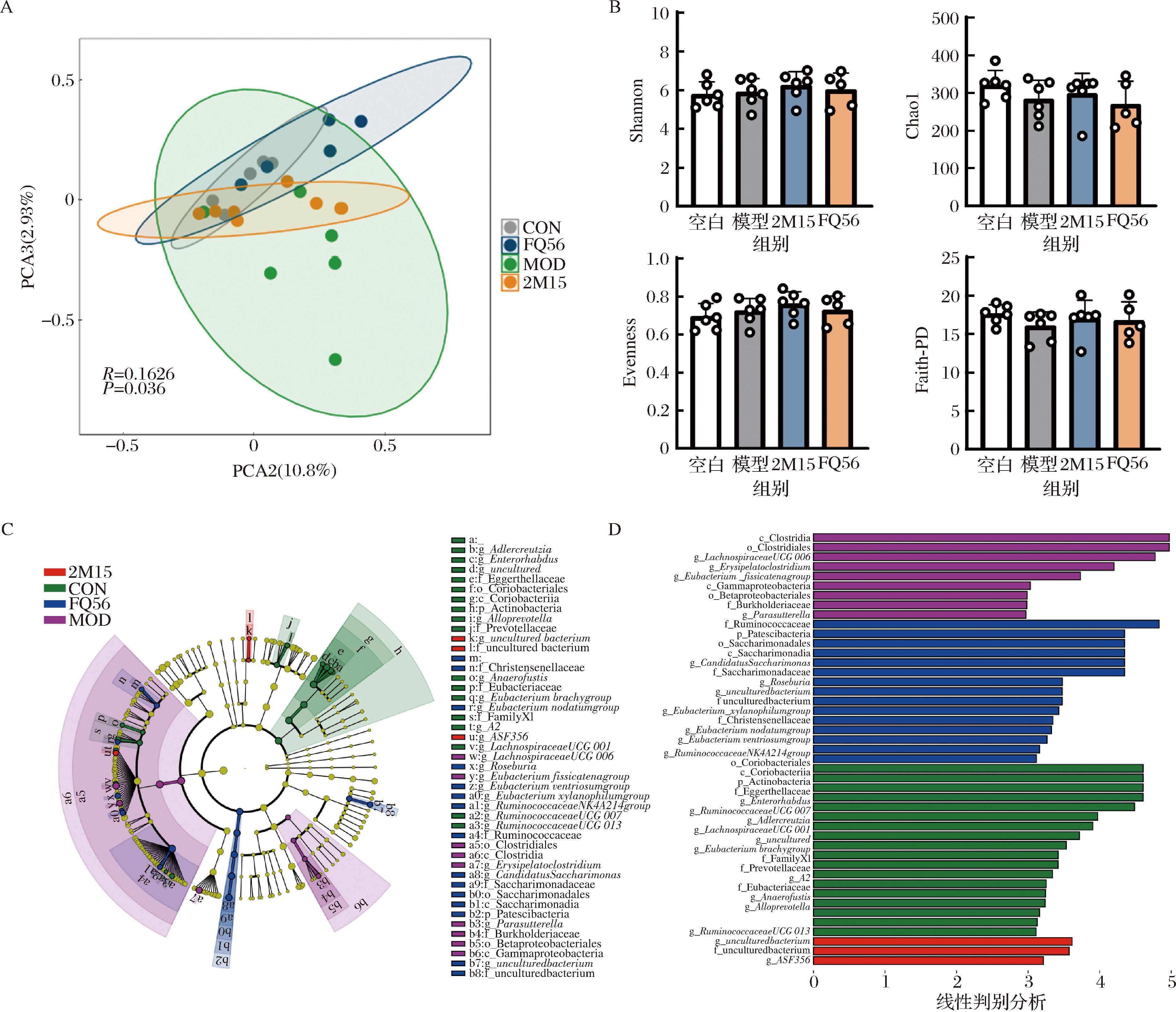
A-PCA分析;B-α多样性分析;C-LEfSe分析;D-线性判别分析
图5 罗伊氏粘液乳杆菌对高尿酸血症小鼠肠道菌群的影响
Fig.5 The effect of L.reuteri on gut microbiota in mice with hyperuricemia
肠道菌群紊乱可能破坏肠道屏障功能,增加肠道内毒素浓度,诱发炎症反应,进而可能间接影响XOD的活性,从而加剧HUA或痛风的发生。在本研究中,图5-C的LEfSe分析和图5-D的线性判别分析结果显示,模型组Clostridia、Clostridiales、Lachnospiraceae UCG_006、Erysipelatoclostridium以及Fissicatena group属的相对丰度显著升高,而Clostridium sp.ASF356则在罗伊氏粘液乳杆菌2M15组中显著富集。此外,罗伊氏粘液乳杆菌FQ56显著增加了Ruminococcaceae、Patescibacteria、Roseburia及Eubacterium_xylanophilum group的相对丰度。Roseburia是肠道共生菌,主要以产生SCFAs如乙酸、丙酸和丁酸为特征,通常占健康肠道菌群总量的2%~31%[19]。Eubacterium属于厚壁菌门下的真杆菌科,其中Eubacterium_xylanophilum group为重要的SCFAs生产菌,能降解多糖和纤维并产生丁酸[20]。
肠道菌群分析表明,罗伊氏粘液乳杆菌FQ56能够有效调节HUA小鼠肠道菌群的结构变化,促进产SCFAs菌群丰度的升高,显示出良好的提升结肠SCFAs浓度的潜力。
2.5 罗伊氏粘液乳杆菌对HUA小鼠SCFAs水平的影响
SCFAs是一种肠道微生物的重要代谢物,主要包括乙酸、丙酸、丁酸、异丁酸、戊酸及异戊酸,它们调控着人体代谢、免疫等重要过程。本研究对HUA小鼠的6种SCFAs水平进行了分析,结果如图6所示。与空白组相比,模型组小鼠体内的SCFAs水平呈现不同程度降低,这与现有的研究结论保持一致[21]。而经过罗伊氏粘液乳杆菌FQ56组干预,小鼠体内的乙酸、丁酸和戊酸显著提升并恢复至正常水平(P<0.05)。本研究中,罗伊氏粘液乳杆菌FQ56对HUA小鼠粪便中SCFAs水平的提升与其上调SCFAs产生菌丰度的结果具有很好的一致性。之前的研究证实了,小鼠血尿酸水平与XOD活性呈强正相关性,XOD活性与SCFAs及总SCFAs含量表现出较强负相关性,并且SCFAs干预能够降低HUA小鼠的尿酸水平和XOD活性[12]。

A-乙酸;B-丙酸;C-丁酸;D-异丁酸;E-异戊酸;F-戊酸
图6 罗伊氏粘液乳杆菌对小鼠粪便中短链脂肪酸含量的影响
Fig.6 The effect of L.reuteri on fecal short-chain fatty acids of mice
因此猜测罗伊氏粘液乳杆菌FQ56对HUA的缓解、XOD活性的抑制与其对SCFAs的调节有关。罗伊氏粘液乳杆菌FQ56可能通过调节肠道SCFAs的生成,进而抑制XOD的活性并减少尿酸的产生,达到缓解小鼠HUA的效果。
2.6 罗伊氏粘液乳杆菌基因组学比较
基于以上实验结果,发现罗伊氏粘液乳杆菌2M15和FQ56的尿酸调节能力存在菌株水平变化。具体来说,与对照菌株2M15相比,菌株FQ56表现出降低血清尿酸水平和缓解肾损伤的能力,然而同种菌株之间存在的对于降尿酸功能的差异机制仍不明确。菌株基因可以决定或分层益生菌菌株的关键功能特征,这些菌株在分类上相同或遗传上高度接近。先前的一些研究也表明,单个基因或基因簇可以影响体内益生菌菌株的细胞表面组成或代谢物谱,并与特定的生理功能相关[22]。因此,本实验基于比较罗伊氏粘液乳杆菌2M15和FQ56的基因差异寻找它们在降尿酸功能差异上的机制。
图7-A显示了罗伊氏粘液乳杆菌FQ56和2M15的基因组圈图,罗伊氏粘液乳杆菌FQ56和2M15分别具有59和224个Scaffold,3 907 450和1 959 681个碱基,GC比例分别为34.89%和38.71%。图7-B展示了罗伊氏粘液乳杆菌(FQ56组和2M15组)的COG功能注释分析结果。从图7中可以观察到,2个组的功能类别分布具有一定差异。在2M15组中,信号转导代谢占据了较大比例(6%),而细胞周期控制、细胞分裂、染色体分配和脂质转运与代谢分别占4%和7%。这些结果表明,罗伊氏粘液乳杆菌2M15组可能在代谢途径和细胞分裂过程中具有较为活跃的表现。与2M15组相比,FQ56组的信号转导代谢比例较高,达到7%,但其在细胞周期控制、脂质转运和能量生产与转化方面的比例较2M15组低。特别是碳水化合物转运和代谢这一功能类别在FQ56组占据较高比例(11%),而在2M15组中相对较低,这可能意味着FQ56组在碳水化合物代谢相关的生物学过程上具有更强的活性。此外,图7-B中还显示了2个组在氨基酸转运与代谢和转录等方面的差异,说明这2个功能类别在2组中均占有一定的比重,可能与细胞生长及代谢相关。

A-基因组圈图;B-COG功能注释分析
图7 罗伊氏粘液乳杆菌的比较基因组学分析
Fig.7 Comparative genome of L.reuteri
2.7 罗伊氏粘液乳杆菌多糖水解及SCFAs生成能力预测
糖苷水解酶是一类催化糖苷键断裂的酶,能够以内切或外切的方式分解包括单糖苷、寡糖、多糖、皂甙及糖蛋白等在内的各种含糖化合物。这些酶在生物体内发挥重要作用,参与多种生物学过程[23]。比较基因组分析结果(图8-A)显示,罗伊氏粘液乳杆菌2M15和FQ56的糖苷水解酶基因数目分别为62和145个,其中GH1家族的差异最大。FQ56拥有20个GH1家族糖苷水解酶,而2M15则不含此家族的糖苷水解酶。GH1家族包括多个重要酶,如β-葡萄糖苷酶、β-半乳糖苷酶和β-木糖苷酶等,广泛存在于微生物中(例如肠道菌群),并在碳源分解、能量和代谢中间提供产物,以及肠道内微生物相互作用中发挥重要作用[24]。根据多糖水解及SCFAs生成能力的预测(图8-B),FQ56首先通过水解复杂糖类(如淀粉、纤维素和果胶)生成单糖,进入糖类代谢途径。单糖进一步转化为丙酮酸,并通过多种代谢反应生成不同的中间产物,而丙酮酸可以进一步生成醋酸、丁酸、丙酸等SCFAs[25]。FQ56特有的基因特性有助于其在宿主肠道中的适应和定植,并对HUA小鼠的肠道微生物群进行功能调节。FQ56对多糖(如淀粉、纤维素、木聚糖等)的利用不仅能调节肠道产SCFAs菌的丰度,还能直接促进SCFAs的生成,最终通过作用于XOD改善尿酸水平。

A-基因组分析;B-多糖水解及SCFAs生成能力预测
图8 罗伊氏粘液乳杆菌多糖水解及短链脂肪酸生成能力预测
Fig.8 Prediction of polysaccharide hydrolysis and SCFAs production ability of L.reuteri
3 结论
本研究通过动物实验比较了罗伊氏粘液乳杆菌2M15与FQ56对HUA小鼠的影响。结果表明,罗伊氏粘液乳杆菌FQ56显著降低了小鼠血清中的尿酸浓度,抑制了肝脏和血清中XOD的活性,并减轻了由HUA引发的肾脏损伤。罗伊氏粘液乳杆菌FQ56对HUA的缓解作用可能通过调节小鼠的肠道微生物组成来实现,尤其是增强了如Roseburia和Eubacterium_xylanophilum等产SCFAs菌群的丰度,从而促进SCFAs的生成并抑制XOD活性。此外,基于比较基因组学分析,发现罗伊氏粘液乳杆菌FQ56基因组中富含糖苷水解酶基因,特别是GH1家族的糖苷水解酶基因,这些基因可能促进肠道内多糖的水解,进而调节肠道菌群结构和SCFAs的浓度。然而,目前该研究对于罗伊氏粘液乳杆菌FQ56功能基因的探究局限于比较基因组水平,后续研究需要通过基因编辑手段沉默或过表达罗伊氏粘液乳杆菌FQ56的GH1家族糖苷水解酶基因,进一步在动物水平验证该家族基因的降尿酸功能。该研究为益生菌在HUA治疗中的应用提供了新的理论依据,并为未来基于益生菌的临床治疗策略奠定了基础。
[1] TIMSANS J, PALOM KI A, KAUPPI M.Gout and hyperuricemia:A narrative review of their comorbidities and clinical implications[J].Journal of Clinical Medicine, 2024, 13(24):7616.
KI A, KAUPPI M.Gout and hyperuricemia:A narrative review of their comorbidities and clinical implications[J].Journal of Clinical Medicine, 2024, 13(24):7616.
[2] YAMANAKA H, TANIGUCHI A, TSUBOI H, et al.Hypouricaemic effects of yoghurt containing Lactobacillus gasseri PA-3 in patients with hyperuricaemia and/or gout:A randomised, double-blind, placebo-controlled study[J].Modern Rheumatology, 2019, 29(1):146-150.
[3] WANG H N, MEI L, DENG Y, et al.Lactobacillus brevis DM9218 ameliorates fructose-induced hyperuricemia through inosine degradation and manipulation of intestinal dysbiosis[J].Nutrition, 2019, 62:63-73.
[4] 金方, 杨虹.降血尿酸益生菌株的筛选和降血尿酸机理的探索[J].微生物学通报, 2018, 45(8):1757-1769.JIN F, YANG H.Isolation of hypouricemic probiotics and exploration their effects on hyperuricemic rats[J].Microbiology China, 2018, 45(8):1757-1769.
[5] HSU C L, HOU Y H, WANG C S, et al.Antiobesity and uric acid-lowering effect of Lactobacillus plantarum GKM3 in high-fat-diet-induced obese rats[J].Journal of the American College of Nutrition, 2019, 38(7):623-632.
[6] ADEYANJU O A, BADEJOGBIN O C, AREOLA D E, et al.Sodium butyrate arrests pancreato-hepatic synchronous uric acid and lipid dysmetabolism in high fat diet fed Wistar rats[J].Biomedicine &Pharmacotherapy, 2021, 133:110994.
[7] GUO Z, ZHANG J C, WANG Z L, et al.Intestinal microbiota distinguish gout patients from healthy humans[J].Scientific Reports, 2016, 6:20602.
[8] WU Y, YE Z, FENG P Y, et al.Limosilactobacillus fermentum JL-3 isolated from “Jiangshui” ameliorates hyperuricemia by degrading uric acid[J].Gut Microbes, 2021, 13(1):1897211.
[9] NI C X, LI X, WANG L L, et al.Lactic acid bacteria strains relieve hyperuricaemia by suppressing xanthine oxidase activity via a short-chain fatty acid-dependent mechanism[J].Food &Function, 2021, 12(15):7054-7067.
[10] 朱广素, 王刚, 王园园, 等.三株植物乳杆菌对代谢综合征大鼠肠道菌群的影响[J].食品与发酵工业, 2018, 44(9):53-60.ZHU G S, WANG G, WANG Y Y, et al.Effects of three Lactobacillus plantarum strains on gut microbiota in metabolic syndrome rats[J].Food and Fermentation Industries, 2018, 44(9):53-60.
[11] QIN Z Z, WANG S B, LIN Y H, et al.Antihyperuricemic effect of mangiferin aglycon derivative J99745 by inhibiting xanthine oxidase activity and urate transporter 1 expression in mice[J].Acta Pharmaceutica Sinica B, 2018, 8(2):306-315.
[12] 王琳琳. 双歧杆菌对便秘的影响及其作用机理研究 [D].无锡:江南大学, 2017.WANG L L.Study of the effects and mechanisms of bifidobacteria on constipation alleviation [D].Wuxi:Jiangnan University, 2017.
[13] 林麟, 杜如冰, 吴群, 等.基于比较基因组学解析耐酸乳杆菌G10的多碳源利用特征[J].微生物学通报, 2022, 49(8):3279-3292.LIN L, DU R B, WU Q, et al.Comparative genomics-based analysis of Lactobacillus acetotolerans G10, a strain using multiple carbon sources[J].Microbiology China, 2022, 49(8):3279-3292.
[14] ANAIZI N.The impact of uric acid on human health:Beyond gout and kidney stones[J].Ibnosina Journal of Medicine and Biomedical Sciences, 2023, 15(3):110-116.
[15] TANIGUCHI T, OMURA K, MOTOKI K, et al.Hypouricemic agents reduce indoxyl sulfate excretion by inhibiting the renal transporters OAT1/3 and ABCG2[J].Scientific Reports, 2021, 11:7232.
[16] KURAJOH M, FUKUMOTO S, EMOTO M, et al.Independent association of plasma xanthine oxidoreductase activity with serum uric acid level based on stable isotope-labeled xanthine and liquid chromatography/triple quadrupole mass spectrometry:MedCity21 health examination registry[J].Clinical Chemistry and Laboratory Medicine, 2020, 58(5):780-786.
[17] WANG J, CHEN Y, ZHONG H, et al.The gut microbiota as a target to control hyperuricemia pathogenesis:Potential mechanisms and therapeutic strategies[J].Critical Reviews in Food Science and Nutrition, 2022, 62(14):3979-3989.
[18] YIN H, LIU N, CHEN J.The role of the intestine in the development of hyperuricemia[J].Frontiers in Immunology, 2022, 13:845684.
[19] LIU H C, NIE C X, HU X Z, et al.Highland barley β-glucan supplementation attenuated hepatic lipid accumulation in Western diet-induced non-alcoholic fatty liver disease mice by modulating gut microbiota[J].Food &Function, 2024, 15(3):1250-1264.
[20] SCHWIERTZ A, LEHMANN U, JACOBASCH G, et al.Influence of resistant starch on the SCFA production and cell counts of butyrate-producing Eubacterium spp.in the human intestine[J].Journal of Applied Microbiology, 2002, 93(1):157-162.
[21] YU K H, SEE L C, HUANG Y C, et al.Dietary factors associated with hyperuricemia in adults[J].Seminars in Arthritis and Rheumatism, 2008, 37(4):243-250.
[22] 伍亚龙, 杨恺, 史梅莓, 等.全基因组测序揭示两株泡菜源植物乳杆菌基因型差异和潜在益生特性[J].微生物学报, 2023, 63(7):2880-2898.WU Y L, YANG K, SHI M M, et al.Whole-genome sequencing reveals genotypic differences and potential probiotic properties of two Paocai-derived Lactiplantibacillus plantarum strains[J].Acta Microbiologica Sinica, 2023, 63(7):2880-2898.
[23] 郁惠蕾, 许建和, 林国强.糖苷水解酶在糖苷合成中的应用概况[J].有机化学, 2006, 26(8):1052-1058.YU H L, XU J H, LIN G Q.Application of glycosidase to glycoside synthesis[J].Chinese Journal of Organic Chemistry, 2006, 26(8):1052-1058.
[24] 刘颖, 董盼盼, 孙丽芳, 等.嗜冷德沃斯氏菌来源GH1家族β-葡萄糖苷酶Bgl59的原核表达及酶学性质分析[J].微生物学报, 2024, 64 (8):2955-2966.LIU Y, DONG P P, SUN L F, et al.Prokaryotic expression and characterization of the GH1 β-glucosidase Bgl59 from Devosia psychrophila[J].Acta Microbiologica Sinica, 2024, 64 (8):2955-2966.
[25] 孙红, 柴丽娟, 方冠宇, 等.窖泥中梭菌和互营球菌交互作用对生长和短链脂肪酸代谢的影响[J].食品与发酵工业, 2022, 48(15):24-32.SUN H, CHAI L J, FANG G Y, et al.Effect of co-culture of Clostridium strains and Novisyntrophococcus fermenticellae, isolated from pit mud, on growth and short-chain fatty acid metabolism[J].Food and Fermentation Industries, 2022, 48(15):24-32.