黄酒作为我国特有的传统发酵酒,有着数千年的悠久历史,其以稻米、黍米、小米、玉米、小麦、水等为主要原料[1],经加曲和/或部分酶制剂、酵母等糖化发酵剂酿制而成。黄酒富含蛋白质、氨基酸、多酚、肽类、多糖、维生素、γ-氨基丁酸、类黑精及矿物质等健康活性物质,具有良好的保健养生功能[2]。其中,糖类来源于原料淀粉水解,以及生产过程中未完全发酵的残糖和糊精,是黄酒的主要成分之一[3]。目前,黄酒的研究多集中在理化特性[4]、风味感知[5]、抗氧化[6]、缓解酒精肝[7]等方面。随着健康饮食观念的日益普及,食品的健康属性受到越来越多的关注,尤其是血糖生成指数(glycemic index,GI)这一关键指标,更是成为消费者选择的重点考量因素。因此,作为富含多种营养成分的传统饮品,黄酒的GI值自然成为了人们关注的焦点。
GI值,由JENKINS等[8]在1981年提出,用来衡量碳水化合物摄入对人体餐后血糖的真实影响,它反映了某种食物与葡萄糖或白面包相比升高血糖的速度和能力,是目前衡量每克碳水化合物血糖生成潜力的重要指标[9]。现代营养学认为,GI是一个比糖类化学分类更有用的营养学概念,揭示了食物和健康之间的新关系。一般而言,GI值大于70的食物为高食物血糖生成指数食物,GI值小于55的食物为低食物血糖生成指数食物。国际标准化组织(International Organization for Standardization,ISO)在2010年就发布了标准化的、统一的食品体内GI值测定方法[10],虽然这种人体体内血糖测试能够最大程度地准确反映食物GI值的变化,但是体内方法在时间和成本方面存在劣势,并且容易引发伦理道德方面的争议。因此,使用体外模型预测食物的血糖反应被认为是一种潜在有用的途径,因为它们不仅成本更低、耗时更少,而且具有良好的重复性,更重要的是不存在伦理问题方面的限制[11-12]。
目前,研究者们开发了很多体外消化模型,从单一静态系统到多室动态系统[13-18],并广泛用于替代人体研究各种食物的体内血糖反应。但需要指出的是,静态模型通常保持恒定的胃pH值3.0,并且它仅限于提供终点评估,而没有考虑可能的结构变化,包括但不限于pH变化,胃排空(gastric emptying,GE)、酶和消化液的分泌以及蠕动等,因此仅仅使用静态模型描述血糖的动态变化是不够的。而动态模型虽然能够准确模拟由于进餐引起的胃分泌过程,也更贴近体内的真实状况[19],但这些计算机化的动态模型非常复杂、耗时,需要大量的酶以及设备,在普通实验室条件下应用面临极大挑战。MULET-CABERO等[20]提出的INFOGEST半动态体外消化方案缩小了静态和动态体外消化方法之间在准确度上的差距,该方案基于成人生理状况,胃相模拟了动态分泌和排空,同时设计原理简单易懂,可在各种实验室中使用,对各种食物进行更贴合真实体内消化情形的体外模拟消化,从而得出更准确的消化参数。
因此,本研究首先是构建一个适用于黄酒这一特定食品的半动态体外消化模型,使用此模型设计并完成一系列不同甜型黄酒的体外消化实验。通过绘制详尽的消化曲线,准确捕捉不同甜型黄酒在胃肠道中的消化行为和速度差异,从而为深入探究黄酒的消化特性提供科学依据。在此基础上,进一步运用数学分析方法对消化实验结果进行细致的处理,以此推导出能够反映黄酒消化特性的各项消化参数,结合不同甜型黄酒在体内的真实GI,采用了主成分分析(principal component analysis,PCA)、偏最小二乘回归(partial least squares regression,PLSR)和Lasso回归等多种统计分析方法,从中找出与黄酒GI相关的关键变量,最终建立基于半动态体外消化参数的黄酒GI预测模型并进行客观验证。
1 材料与方法
1.1 材料与试剂
α-淀粉酶(10070,50 U/mg)、胃蛋白酶(P7000,250 U/mg)、猪胰腺胰酶(P7545,200 U/mg),西格玛奥德里奇(上海)贸易有限公司;胆盐(48305),德国达姆施塔特默克集团;葡萄糖含量测定试剂盒(己糖激酶法),南京建成生物工程研究所;不同甜型的黄酒样品购自无锡当地市场;其他化学试剂均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
智航血糖仪,罗氏诊断产品(上海)有限公司;FiveEasy Plus pH计,瑞士梅特勒-托利多集团;CR22 N冷冻离心机,日本Hitachi 公司;Varioskan Flash全自动酶标仪,赛默飞世尔科技(中国)有限公司;DSHZ-300A水浴恒温振荡器,太仓市强文实验设备有限公司;恒流泵HL-2 N,上海青浦沪西仪器厂;ME204TE分析天平,瑞士METTLER TOLEDO公司;K9840自动凯氏定氮仪,海能仪器有限公司。
1.3 实验方法
1.3.1 黄酒的基本理化指标
1.3.1.1 黄酒pH测定
使用pH计测定每款黄酒的pH值,重复3次。
1.3.1.2 黄酒酒精度测定
参照GB/T 13662—2018《黄酒》中的仪器法测定黄酒的酒精度。
1.3.1.3 黄酒蛋白质含量测定
参照GB 5009.5—2025《食品安全国家标准 食品中蛋白质的测定》中的凯氏定氮法测定黄酒的蛋白质含量。
1.3.1.4 黄酒还原糖含量测定
参照3,5-二硝基水杨酸法[21]测定黄酒中还原糖的含量。
1.3.1.5 黄酒葡萄糖含量测定
参照己糖激酶法[22]测定黄酒中葡萄糖的含量。
1.3.1.6 黄酒碳水化合物含量测定
参考田洪芸等[23]的方法并略微修改测定黄酒中碳水化合物的含量,按公式(1)计算:
碳水化合物含量/(g/L)=固形物含量(g/L)-蛋白质含量(g/L)-脂肪含量(g/L)
(1)
式中:参照GB/T 13662—2018《黄酒》中的重量法测定黄酒中固形物含量,参照GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》中的索氏抽提法测定黄酒中脂肪的含量。
1.3.2 黄酒的半动态体外消化
1.3.2.1 半动态体外模拟消化液的配制
参考JIN等[24]的方法并略微修改进行模拟消化液的制备。模拟唾液(simulated salivary fluid,SSF)、模拟胃液(simulated gastric fluid,SGF)和模拟肠液(simulated intestinal fluid,SIF)由相应的电解质模拟唾液(eSSF)、电解质模拟胃液(eSGF)、电解质模拟肠液(eSIF)、酶和水组成。电解质储备液的具体组成如表1所示,酶配制在相应的消化液电解质储备液中,最终的SSF中含150 U/mL α-淀粉酶,SGF中含4 000 U/mL胃蛋白酶,SIF中含200 U/mL胰酶和20 mmol/L胆盐。为了避免产生沉淀,CaCl2·2H2O不直接添加在电解质储备溶液中,而是单独制备,在模拟消化液和食物的最终混合物中进行添加,最终模拟消化液SSF、SGF、SIF中Ca2+浓度分别为1.5、0.15、0.6 mmol/L。需要注意的是,不同于INFOGEST标准化静态体外消化方法[25],半动态体外消化制备的eSGF的pH值不用调节至2,而是在配制最终的模拟消化液时,通过添加盐酸调节SGF的pH,添加盐酸的体积需要确保胃消化阶段完成后的体系pH值维持在2。实验过程中pH的调节使用NaOH(1 mol/L)和HCl(6 mol/L)。
表1 模拟消化液电解质储备液(400 mL)
Table 1 Electrolyte reserve solution of simulated digestive solution (400 mL)
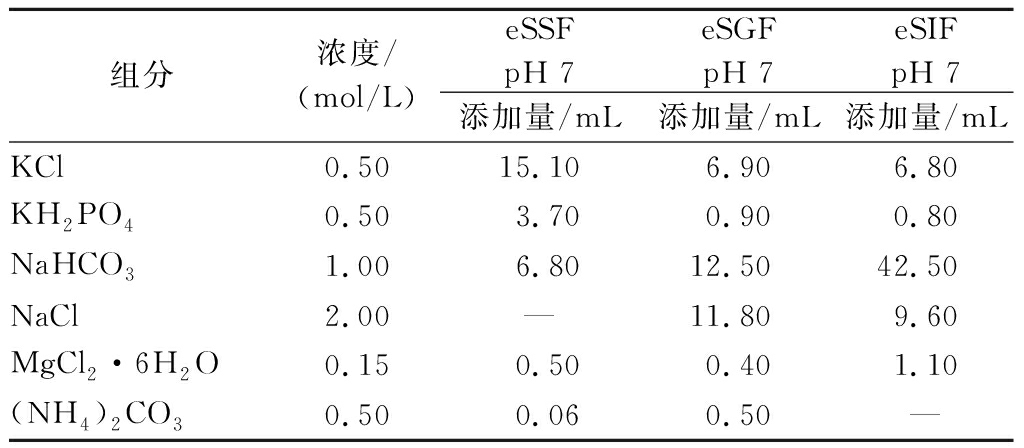
组分浓度/(mol/L)eSSFpH 7eSGFpH 7eSIFpH 7添加量/mL添加量/mL添加量/mLKCl0.5015.106.906.80KH2PO40.503.700.900.80NaHCO31.006.8012.5042.50NaCl2.00—11.809.60MgCl2·6H2O0.150.500.401.10(NH4)2CO30.500.060.50—
注:为了添加其他溶液[如CaCl2·2H2O、酶]以及调节pH,电解质储备溶液是1.25倍浓缩液,即400 mL电解质储备溶液可配制500 mL模拟消化液;—表示无数据。
1.3.2.2 黄酒的半动态体外消化
半动态体外消化根据MULET-CABERO等[20]的方法略微修改后进行,分为口腔消化阶段、胃消化阶段和肠消化阶段3部分。
口腔消化阶段将黄酒样品与SSF在离心管中按黄酒样品干重与SSF体积1∶1(g∶mL)混合,37 ℃水浴反应2 min。
胃消化阶段开始时在胃反应容器中添加容器体积10%的SGF(调整pH值达到2),将样品加入容器后,剩余90% SGF通过蠕动泵(速率根据消化时间和样品量确定)恒定速率输送,整个胃消化阶段在37 ℃水浴振荡,胃消化完成后调节pH值至7。半动态体外消化模型引入GE概念,胃阶段消化时间不同于体外静态消化模型的固定时间,而是基于人体食用考虑的500 mL样品所含热量(kcal/mL)计算得出。简单来说,按500 mL样品中脂质、蛋白质和碳水化合物的组成并应用标准Atwater系数(1 g脂质产生9 kcal,1 g蛋白质产生4 kcal,1 g碳水化合物产生4 kcal)计算出热量,再以2 kcal/min的速率排空500 mL样品的时间。本研究所使用消化模型的GE以逐步的方式进行,分3部分从容器底部取出选定的等分试样分步进入肠期,因此每种样品每次GE的时间为该样品胃阶段总消化时间的1/3。口腔消化阶段处理后的样品与SGF的最终体积比为1∶1。
肠消化阶段根据胃消化阶段GE取出的等分试样加入等体积的模拟肠液,调节pH值至7,37 ℃水浴振荡,反应120 min。所有黄酒样品和模拟消化液在消化前预热至37 ℃,不同时间点取出的消化物先调节pH值至7,然后100 ℃加热10 min灭酶活力,存于-20 ℃冰箱用于后续分析。
1.3.2.3 消化物分析
所有消化物的还原糖含量和葡萄糖含量检测方法同1.3.1.4节和1.3.1.5节。通过非线性最小二乘法(nonlinear least squares,NLLS)和斜率对数(loss of signal,LOS)图结合单一级动力学模型(saturation kinetics model,SK)模型[26-27]数学拟合消化实验数据,绘制不同甜型黄酒的消化曲线,并推导消化参数。
1.3.3 黄酒的体内GI值测定
依据国际标准ISO 26642:2010[10]和中国行业标准WS/T 652—2019《食物血糖生成指数测定方法》评估黄酒体内GI值。实验方案由江南大学医学伦理委员会审核后通过(批准编号:JNU202409RB003)。黄酒体内GI值测试的方法是招募10~12名健康志愿者,先测定空腹血糖,然后摄入含一定量可用碳水化合物(10 g或20 g)的黄酒后,分别于餐后15、30、45、60、90、120 min通过指尖采血测量血糖浓度,并绘制血糖增幅与消化时间的关系曲线,即血糖应答曲线。使用黄酒2 h内血糖应答增量曲线下面积(incremental area under the curve,IAUC)与参考食物(葡萄糖)血糖应答曲线下面积的比值来计算黄酒的GI值。
1.4 数据处理
使用SPSS 27软件分析数据,结果以“平均值±标准差”表示,并进行单变量均值方差分析、肯德尔等级相关系数分析和PCA,使用Duncan多重极差检验比较多个平均值,显著性水平为P<0.05。使用Python3.12进行NLLS和LOS绘制并进行SK模型数学拟合以及计算曲线下面积(area under the curve,AUC)。使用SIMCA-P 14.1进行PLSR,使用Rstudio1.4进行基于机器学习的Lasso回归和岭回归。使用Origin 2022进行绘图。
2 结果与分析
2.1 黄酒的基本理化指标
表2列出了本研究所用到的所有黄酒的基本理化指标。4种酒样的碳水化合物含量为39.90~206.63 g/L,蛋白质含量为11.65~17.00 g/L,pH值都在4左右。指标都符合国标中对黄酒的理化要求,可以作为预测黄酒血糖生成指数的样品。
表2 不同甜型黄酒样品的基本理化指标
Table 2 Basic physical and chemical indexes of Huangjiu with different sugar contents

基本指标黄酒A黄酒B黄酒C黄酒DpH4.09±0.02b4.18±0.02a4.07±0.01b4.01±0.01c酒精度/%vol16.80±0.28a12.30±0.33c15.30±0.18b10.20±0.21d蛋白质/(g/L)17.00±2.21a14.11±1.32b13.92±0.98b11.65±1.64c还原糖/(g/L)169.64±5.31a64.65±1.08b47.01±1.69c28.51±1.67d葡萄糖/(g/L)105.56±5.15a49.22±1.83b34.86±1.31c20.91±1.07d碳水化合物/(g/L)206.63±6.93a97.80±3.17b70.40±3.23c39.90±1.57d
注:同行数据标不同字母表示差异显著(P<0.05)(表3同)。
2.2 黄酒的半动态体外消化
2.2.1 半动态体外消化不同阶段的拟合分析
不同甜型黄酒在体外口腔消化前后的还原糖和葡萄糖变化情况如图1-A和图1-B所示。NLLS作为基本的非线性优化方法,广泛应用于非线性函数模型的参数估计中[28]。
运用NLLS对不同甜型黄酒胃消化阶段的不同时间点测得的还原糖和葡萄糖含量进行拟合,得到的拟合曲线如图1-C和图1-D所示。类似的,运用NLLS对不同甜型黄酒肠消化阶段的不同时间点测得的还原糖和葡萄糖含量进行拟合,得到的拟合曲线如图1-E和图1-F所示。
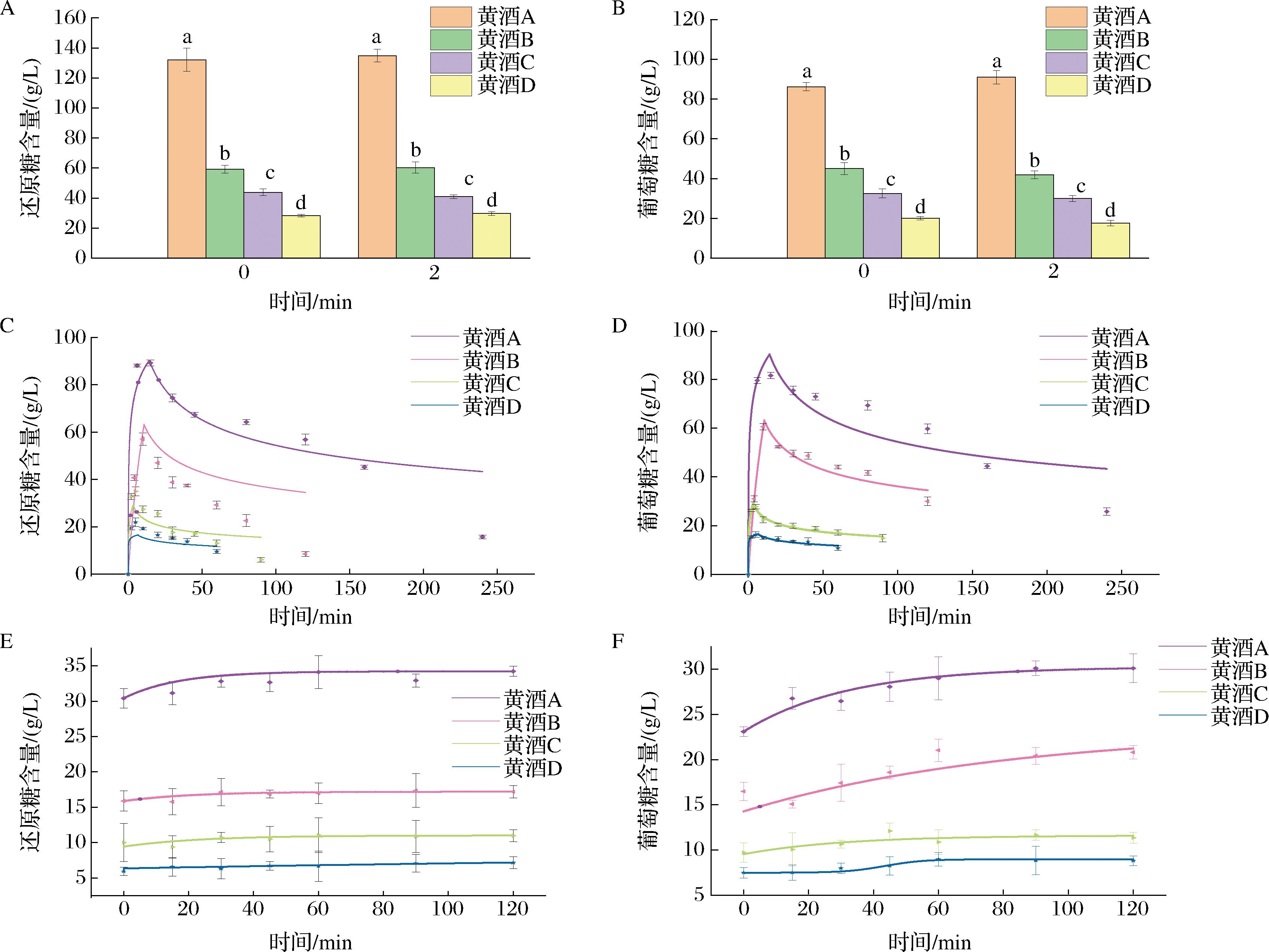
A-口腔消化阶段还原糖含量;B-口腔消化阶段葡萄糖含量;C-胃消化阶段还原糖含量;D-胃消化阶段葡萄糖含量;E-肠消化阶段还原糖含量;F-肠消化阶段葡萄糖含量
图1 不同甜型黄酒半动态体外消化拟合
Fig.1 Semi-dynamic in vitro digestion fitting of Huangjiu with different sugar contents
注:图A与图B中不同小写字母表示差异显著(P<0.05)。
由图1-A可知,黄酒在经过口腔消化后还原糖含量无明显变化,这与董传志等[29]的研究结果类似。由图1-B可知,黄酒A的葡萄糖含量在口腔消化后有略微上升,而其余几种黄酒经过口腔消化后的葡萄糖含量反而略有下降,钱敏等[30]研究发现甜型黄酒中的麦芽糖、异麦芽糖等糖组分含量远高于其他甜型黄酒,这可能是造成葡萄糖含量变化差异的原因之一。
在胃消化阶段,不同甜型黄酒的还原糖(图1-C)和葡萄糖(图1-D)含量都呈现出先上升后下降的趋势,这与健康成人的餐后血糖变化曲线类似[31]。此外,不同甜型黄酒的胃阶段消化曲线峰值不同。这可能是因为不同甜型黄酒的糖含量存在显著差异,不过不同黄酒饮后的血糖达峰时间也不相同,达峰时间:C≈D
由图1-E和图1-F可知,在肠消化阶段,消化液的还原糖含量无明显变化,而葡萄糖含量有一定增加,这可能是因为肠消化阶段添加的胰酶含有可以将双糖、寡糖等进一步分解成葡萄糖的辅助酶。
2.2.2 半动态体外消化参数的拟合结果
有研究指出[15,32],可以通过AUC预测碳水化合物食品的GI值,并且GE是人体对碳水化合物血糖反应的关键决定因素[33]。因此,通过拟合的胃阶段消化曲线计算不同GE时间的还原糖含量消化曲线下面积(area under the digestion curve of reducing sugar,AUR)和葡萄糖含量消化曲线下面积(area under the digestion curve of reducing sugar,AUG)以及它们与单次胃排空时间(gastric emptying time,GET)的比值(表3),作为预测黄酒GI值的参数。除此之外,对于肠消化阶段,除了计算肠阶段消化曲线的AUR和AUG,还使用LOS图和SK拟合并计算还原糖含量消化速率常数KR和葡萄糖含量消化速率常数KG以及肠消化完全后的最终还原糖浓度CR∞和最终葡萄糖浓度CG∞(表3)。由表3可知,不同黄酒的消化速率常数K没有低于0.01,因此可以认为通过LOS图和SK模型计算出的CR∞和CG∞是相对可靠的[34],能作为预测黄酒GI值的体外消化参数。
表3 不同甜型黄酒拟合得到的体外消化参数
Table 3 In vitro digestion parameters of Huangjiu with different sugar contents
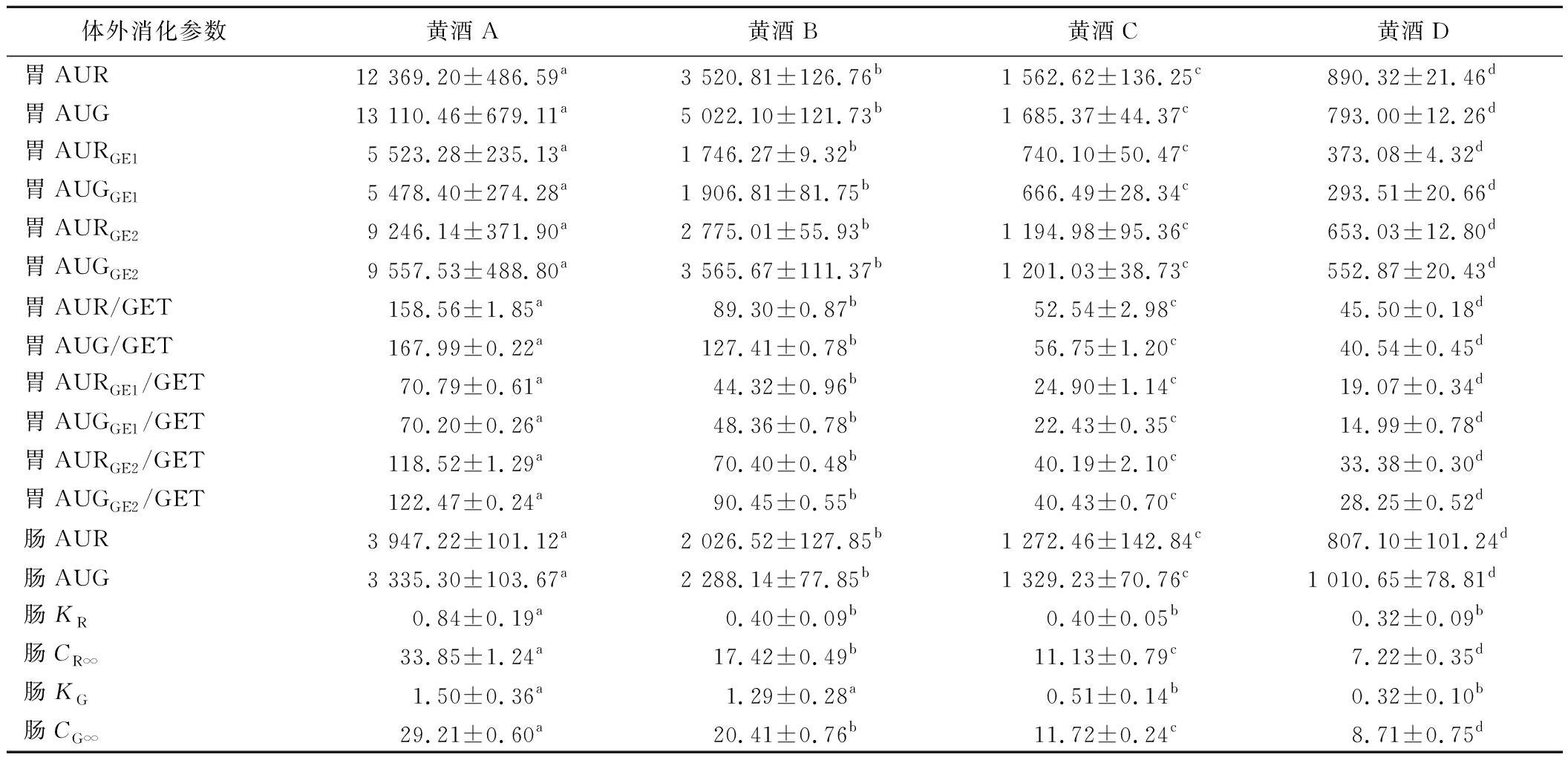
体外消化参数黄酒A黄酒B黄酒C黄酒D胃AUR12 369.20±486.59a3 520.81±126.76b1 562.62±136.25c890.32±21.46d胃AUG13 110.46±679.11a5 022.10±121.73b1 685.37±44.37c793.00±12.26d胃AURGE15 523.28±235.13a1 746.27±9.32b740.10±50.47c373.08±4.32d胃AUGGE15 478.40±274.28a1 906.81±81.75b666.49±28.34c293.51±20.66d胃AURGE29 246.14±371.90a2 775.01±55.93b1 194.98±95.36c653.03±12.80d胃AUGGE29 557.53±488.80a3 565.67±111.37b1 201.03±38.73c552.87±20.43d胃AUR/GET158.56±1.85a89.30±0.87b52.54±2.98c45.50±0.18d胃AUG/GET167.99±0.22a127.41±0.78b56.75±1.20c40.54±0.45d胃AURGE1/GET70.79±0.61a44.32±0.96b24.90±1.14c19.07±0.34d胃AUGGE1/GET70.20±0.26a48.36±0.78b22.43±0.35c14.99±0.78d胃AURGE2/GET118.52±1.29a70.40±0.48b40.19±2.10c33.38±0.30d胃AUGGE2/GET122.47±0.24a90.45±0.55b40.43±0.70c28.25±0.52d肠AUR3 947.22±101.12a2 026.52±127.85b1 272.46±142.84c807.10±101.24d肠AUG3 335.30±103.67a2 288.14±77.85b1 329.23±70.76c1 010.65±78.81d肠KR0.84±0.19a0.40±0.09b0.40±0.05b0.32±0.09b肠CR∞33.85±1.24a17.42±0.49b11.13±0.79c7.22±0.35d肠KG1.50±0.36a1.29±0.28a0.51±0.14b0.32±0.10b肠CG∞29.21±0.60a20.41±0.76b11.72±0.24c8.71±0.75d
2.3 黄酒的体内血糖
参照WS/T 652—2019《食物血糖生成指数测定方法》进行黄酒体内血糖的测定实验,黄酒与参考食物(葡萄糖)的血糖应答增量曲线如图2-A和图2-B所示。
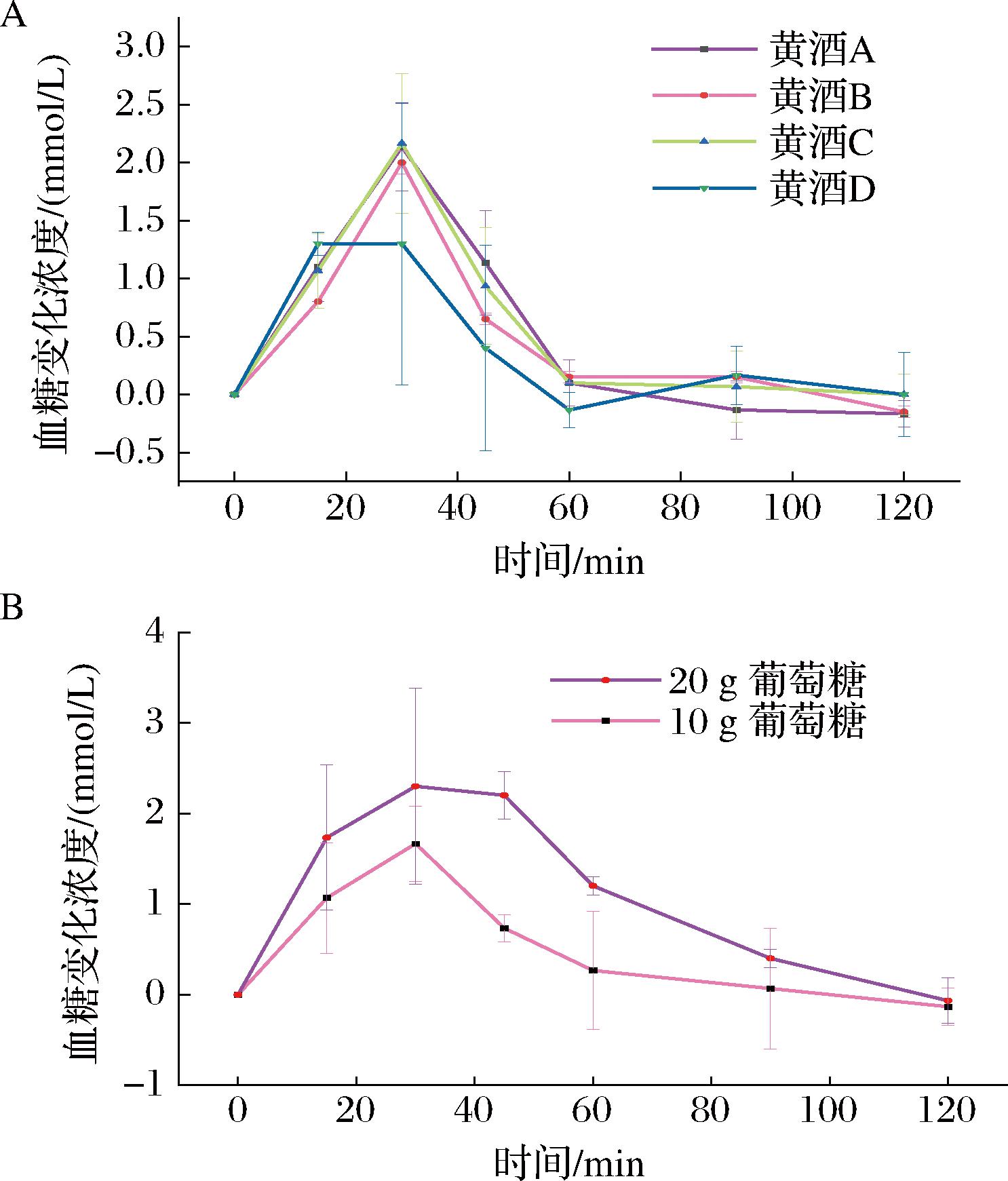
A-不同甜型黄酒;B-参考食物(葡萄糖)
图2 不同甜型黄酒和参考食物(葡萄糖)体内血糖应答增量曲线(n=10)
Fig.2 In vivo blood glucose response increment curve of Huangjiu with different sugar contents and reference food (glucose) (n=10)
从图2-A中不难发现,不同甜型黄酒在饮后造成的血糖应答不同,血糖到达峰值的时间也有区别,有研究指出不同甜型黄酒中的碳水化合物组分有显著差异[30],而碳水化合物的来源和数量会影响正常受试者的餐后血糖[35]。使用公式(2)和公式(3)计算不同甜型黄酒的体内GI值,得到4种黄酒A、B、C和D的GI值分别为87.94、79.46、74.21和68.37。
(2)
(3)
式中:GIn为受试者个体得出的黄酒GI值;At为待测食物IAUC值;![]() 为同一个体测得的至少2次参考食物IAUC平均值;GI为黄酒的GI值;∑GIn为由每个受试者个体得出的GI值之和;n为最终纳入待测食物GI值计算的受试者个体数。
为同一个体测得的至少2次参考食物IAUC平均值;GI为黄酒的GI值;∑GIn为由每个受试者个体得出的GI值之和;n为最终纳入待测食物GI值计算的受试者个体数。
2.4 体外消化参数与黄酒GI值之间的肯德尔等级相关系数
对体外消化参数进行Shapiro-Wilk检验,结果呈现显著性(P<0.05),消化参数偏离正态分布,使用肯德尔等级相关系数[36]进行黄酒半动态体外消化参数和黄酒GI值的相关性分析,结果如表4所示。
表4 体外消化参数与体内GI值的肯德尔等级相关系数分析
Table 4 Kendall’s tau correlation coefficient analysis of in vitro digestion parameters and in vivo GI values
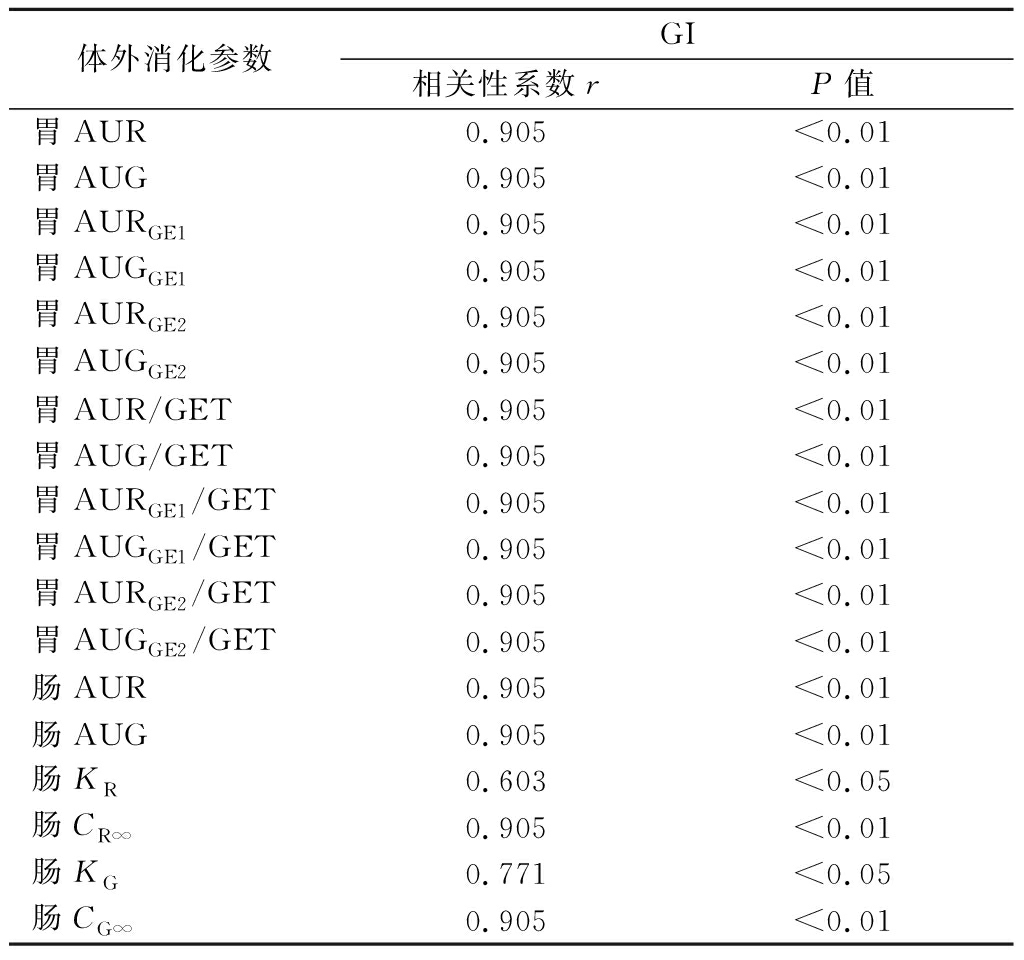
体外消化参数GI相关性系数rP值胃AUR0.905<0.01胃AUG0.905<0.01胃AURGE10.905<0.01胃AUGGE10.905<0.01胃AURGE20.905<0.01胃AUGGE20.905<0.01胃AUR/GET0.905<0.01胃AUG/GET0.905<0.01胃AURGE1/GET0.905<0.01胃AUGGE1/GET0.905<0.01胃AURGE2/GET0.905<0.01胃AUGGE2/GET0.905<0.01肠AUR0.905<0.01肠AUG0.905<0.01肠KR0.603<0.05肠CR∞0.905<0.01肠KG0.771<0.05肠CG∞0.905<0.01
从相关性分析结果中可以看出肠KR和肠KG相关性系数r较低,在后续的拟合中不使用这2个消化参数。其余的体外消化参数通过肯德尔等级相关系数分析可看出皆和GI值呈正相关,并且都具有极显著性(P<0.01),但是从相关性分析结果中无法判断哪些消化参数更适合用于GI值的预测模型,需要进一步处理和分析。
2.5 使用主成分分析对体外消化参数进行降维处理
PCA是一种多变量统计分析方法,通过找到数据中最重要的特征,将高维数据转换为低维数据[37]。每个主成分的方差即特征值,表示对应成分能够描述原有信息的多少。体外消化参数经过主成分分析后得到多个主成分,其中主成分1和主成分2的累积贡献率达到99.76%,涵盖了16个体外消化参数的大部分关键信息,具有良好的代表性。为更好解释指标与因子之间的关系,将所有提取的主成分因子进行旋转处理,得到黄酒体外消化参数主成分载荷矩阵(表5),这样可以使1个变量在较少的几个因子上有较高的载荷,其载荷值绝对值的大小反映了各变量在主成分中的重要程度,载荷绝对值越大其相关程度也越高。由表5可筛选出在主成分1中贡献率较大的体外消化参数有胃AUR、胃AURGE1、胃AUGGE1、胃AURGE2,在主成分2中贡献率较大的胃AUG/GET、胃AUGGE1/GET和胃AUGGE2/GET。因此,对基于PCA降维处理后得到的这7个黄酒体外消化参数进行进一步回归分析,构建黄酒的GI预测模型。
表5 不同甜型黄酒体外消化参数主成分载荷矩阵
Table 5 Principal component load matrix of in vitro digestion parameters of Huangjiu with different sugar contents
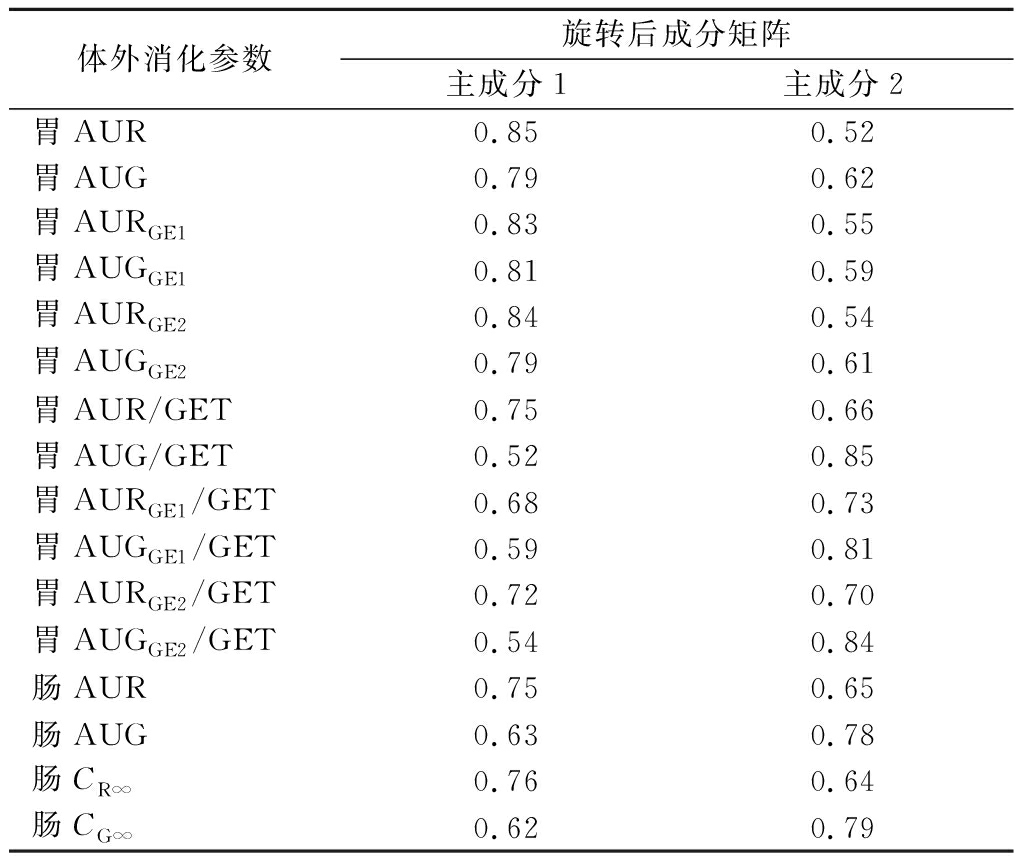
体外消化参数旋转后成分矩阵主成分1主成分2胃AUR0.850.52胃AUG0.790.62胃AURGE10.830.55胃AUGGE10.810.59胃AURGE20.840.54胃AUGGE20.790.61胃AUR/GET0.750.66胃AUG/GET0.520.85胃AURGE1/GET0.680.73胃AUGGE1/GET0.590.81胃AURGE2/GET0.720.70胃AUGGE2/GET0.540.84肠AUR0.750.65肠AUG0.630.78肠CR∞0.760.64肠CG∞0.620.79
注:旋转方法:最大方差法。
2.6 基于体外消化参数的黄酒GI预测模型
使用多个自变量进行线性回归,如果其中的某些自变量彼此高度相关,会出现多重共线性问题,这将导致回归系数计算不准确等问题,使多元线性回归模型的可靠性大幅降低。检测多重共线性的一种方法是使用方差膨胀因子(variance inflation factor,VIF),一般认为VIF值高于10表明具有严重的多重共线性。PCA处理后体外消化参数的VIF值如表6所示,结果表明消化参数间存在强相关性,有较严重的多重共线性。
表6 PCA处理后的体外消化参数的共线性诊断
Table 6 Collinearity diagnosis of in vitro digestion parameters after PCA treatment

体外消化参数VIF胃AUR13.38胃AURGE117.53胃AUGGE125.00胃AURGE215.19胃AUG/GET84.08胃AUGGE1/GET1.00胃AUGGE2/GET285.58
Lasso回归[38]是一种正则化技术,通过引入L1正则化项来压缩回归系数的方法,它不仅能够有效处理多重共线性问题,还能实现特征选择,将不重要的特征系数缩减至零,从而使模型更为简单且有效防止过拟合。岭回归[39]同样是一种正则化技术,是一种带有L2正则化的线性回归模型,通过在损失函数中添加一个L2范数的正则化项来解决多重共线性问题,这种方法能够稳定回归系数的估计,减少模型的复杂度,从而降低过拟合的风险。岭回归不强调特征选择,而是倾向于赋予所有变量较小的系数以最大化保留原始信息。PLSR[40]是在普通多元回归的基础上融合了PCA、典型相关分析的思想,旨在构建新的潜变量来最大化解释因变量变异的能力。这种方法通过降维技术来减少输入变量的数量,并构建一组新的潜变量,这些潜变量与响应变量之间的关系较强,这不仅适用于解决多重共线性问题,还能同时处理多个响应变量。由于各体外消化参数均与GI值有强相关性,且存在多重共线性(表6),这使得传统的线性回归模型不再适用。因此,采用Lasso回归、岭回归和PLSR等方法来建立黄酒的GI预测模型。
对于Lasso回归而言,通过10折交叉验证(图3-A)确定最佳变量为2个,最佳变量为胃AURGE1和胃AUGGE1/GET。岭回归中,通过岭路径图(图3-B)确定各个自变量的标准化回归系数趋于稳定时的最小K值为0.200,保留所有变量。对于PLSR而言,随着模型组件个数的增加,R2X、R2Y和Q2均逐渐增加,交叉验证确定最佳组件变量个数为1,最佳变量为胃AUGGE1/GET。
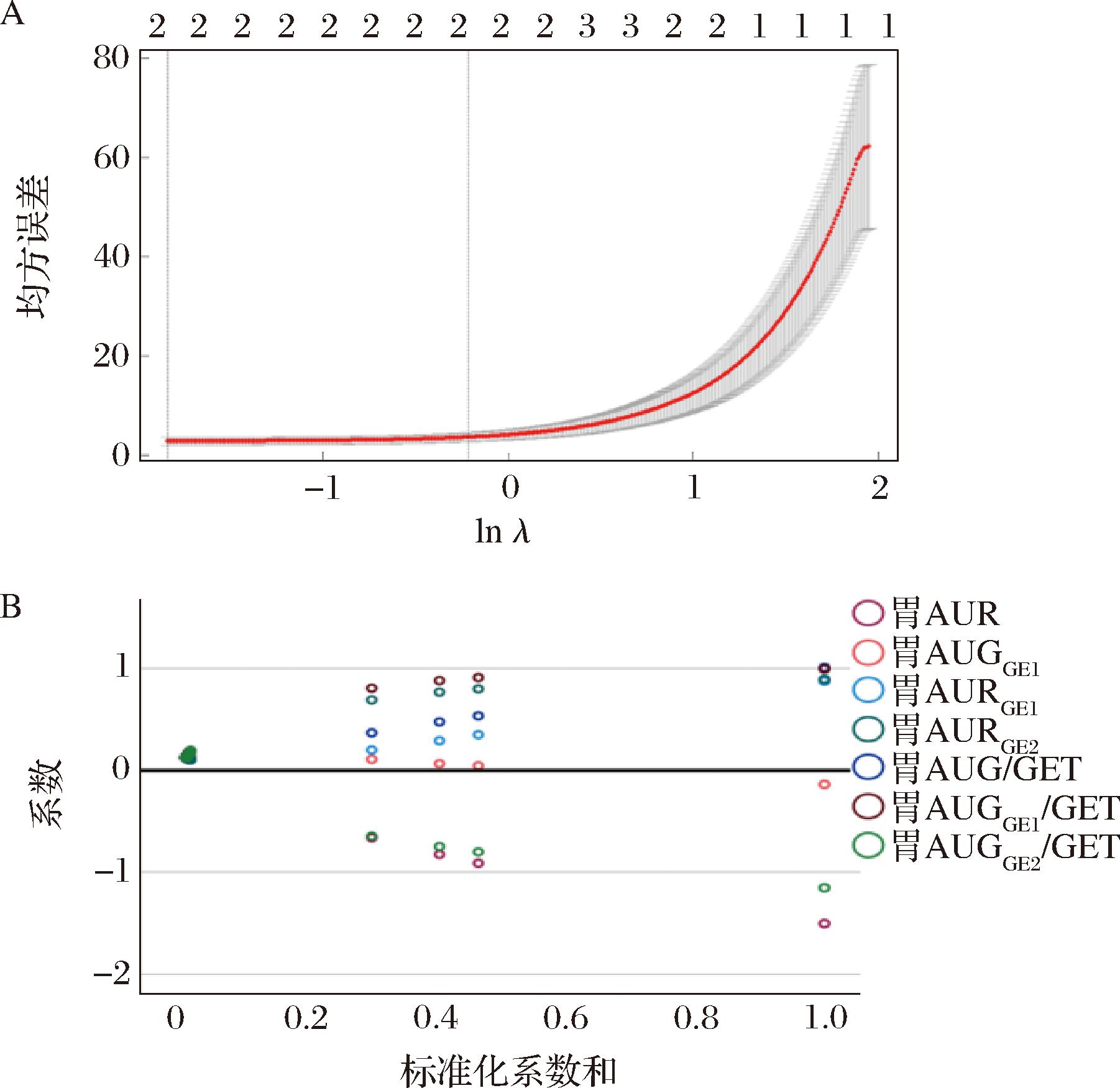
A-Lasso回归系数选择图;B-岭回归岭迹图
图3 正则化模型系数路径分析
Fig.3 Analysis of coefficient path in regularization model
评价回归模型性能的参数[41]主要有决定系数(coefficient of determination,R2)、均方误差(mean square error,MSE)、平均误差等。R2是衡量统计模型与数据拟合程度的指标,其值越接近于1表示模型性能越好;MSE则是衡量预测值与实际值之间差异的平均平方值,MSE值越小,表明模型的预测误差越小,预测精度越高。基于体外消化参数的黄酒GI预测模型参数如表7所示。
表7 基于体外消化参数的黄酒GI预测模型参数
Table 7 Parameters of GI prediction model of Huangjiu based on in vitro digestion parameters
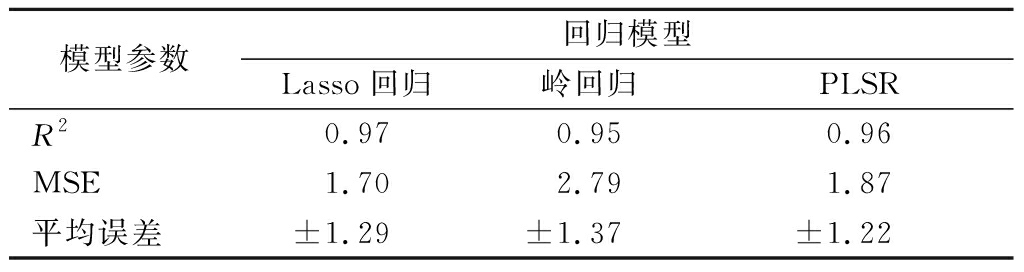
模型参数回归模型Lasso回归岭回归PLSRR20.970.950.96MSE1.702.791.87平均误差±1.29±1.37±1.22
由表7可知,PLSR和Lasso模型准确度高于岭回归,而两者之间性能差距不大,即具有接近的R2,以及相对较低的MSE和平均误差,但PLSR模型只使用1个变量构建回归模型,对于黄酒GI的预测更为简便。因此,使用PLSR的结果构建方程,预测方程为GI=0.323X+64.898(R2=0.964),其中X表示黄酒体外消化胃阶段第一次GE时AUG和单次GET的比值。此外,通过市售黄酒E和黄酒F对方程进行了验证,基于半动态体外消化参数和预测方程估算的GI值分别为70.943和68.893,与2种黄酒的实际GI值误差率小于10%(表8)。
表8 黄酒E和F的基本信息和体外消化参数
Table 8 Basic information and in vitro digestion parameters of Huangjiu E and F

样品碳水化合物/(g/L)蛋白质/(g/L)GIAUGGE1AUGGE1/GET预测GIE53.99±3.68a11.17±1.39a78.75430.42±29.48a18.71±1.26a70.94±0.42aF40.16±3.46b13.48±1.07b73.40247.34±25.12b12.37±1.24b68.89±0.61b
注:同列数据标不同字母表示差异显著(P<0.05)。
3 结论
本研究以4种不同甜型黄酒进行GI预测模型构建,以2种黄酒进行了模型验证,提供了一种基于体外半动态消化结合PLSR的GI预测模型。尽管样本量和实验方案存在局限性,但依然取得了一些具有启发性的成果,为后续更深入研究提供了一个基础框架。未来,为进一步提升研究的可靠性与全面性,可考虑扩大样本范围,涵盖更多不同产地、原料及酿造工艺的黄酒,以此增强模型的普适性。同时,优化实验方案,引入更先进的检测技术与分析方法,更精准地把控消化过程中的变量,减少误差。基于此,有望构建出更为完善、准确的黄酒体外半动态消化GI预测模型。本研究对于黄酒行业建立统一的血糖响应健康评价标准具有一定指导意义,有利于推动黄酒产业的健康发展。
[1] 王春艳, 邓洲, 武思雨, 等.红谷黄酒发酵过程中细菌群落结构分析及其对高级醇的影响[J].中国酿造, 2022, 41(6):112-116.WANG C Y, DENG Z, WU S Y, et al.Bacterial community structure and its effects on higher alcohols during red millet Huangjiu fermentation process[J].China Brewing, 2022, 41 (6):112-116.
[2] 朱斌, 骆佳琪, 关斌, 等.传统黄酒的风味成分及品质控制研究进展[J].中国酿造, 2024, 43(9):9-13.ZHU B, LUO J Q, GUAN B, et al.Research progress on flavor components and quality control of traditional Huangjiu[J].China Brewing, 2024, 43 (9):9-13.
[3] 吴云霞, 李冬琴, 耿敬章, 等.黄酒功能因子及功能性黄酒研究进展[J].食品研究与开发, 2022, 43(4):219-224.WU Y X, LI D Q, GENG J Z, et al.Research progress of functional factors of Huangjiu and functional Huangjiu[J].Food Research and Development, 2022, 43 (4):219-224.
[4] 谷晓东,刘怡琳,席晓丽,等.基于高通量测序技术对6种黄酒酒曲中微生物多样性的研究[J].食品工业科技,2022,43(16):148-157.GU X D, LIU Y L, XI X L, et al.Microbial diversity in six kinds of Huangjiu koji based on high-throughput sequencing techniques[J].Science and Technology of Food Industry, 2022,43 (16):148-157.
[5] GAO Y R, WANG Y P, CUI F, et al.The formation, influencing factors, efficacy, and analytical techniques of flavor substances in Huangjiu[J].Journal of Food Composition and Analysis, 2024, 135:106585.
[6] ZHENG X Q, CHI H, MA S, et al.Identification of novel α-glucosidase inhibitory peptides in rice wine and their antioxidant activities using in silico and in vitro analyses[J].LWT, 2023, 178:114629.
[7] YANG Y, ZHOU Z L, LIU Y F, et al.Non-alcoholic components in Huangjiu as potential factors regulating the intestinal barrier and gut microbiota in mouse model of alcoholic liver injury[J].Foods, 2022, 11(11):1537.
[8] JENKINS D J, WOLEVER T M, TAYLOR R H, et al.Glycemic index of foods:A physiological basis for carbohydrate exchange[J].The American Journal of Clinical Nutrition, 1981, 34(3):362-366.
[9] ATKINSON F S, BRAND-MILLER J C, FOSTER-POWELL K, et al.International tables of glycemic index and glycemic load values 2021:A systematic review[J].The American Journal of Clinical Nutrition, 2021, 114(5):1625-1632.
[10] STANDARDIZATION I O F.Food Products--Determination of the Glycaemic Index (GI) and Recommendation for Food Classification[M].ISO, 2010.
[11] BRODKORB A, EGGER L, ALMINGER M, et al.INFOGEST static in vitro simulation of gastrointestinal food digestion[J].Nature Protocols, 2019, 14(4):991-1014.
[12] LI C, YU W W, WU P, et al.Current in vitro digestion systems for understanding food digestion in human upper gastrointestinal tract[J].Trends in Food Science &Technology, 2020, 96:114-126.
[13] ENGLYST H N, VEENSTRA J, HUDSON G J.Measurement of rapidly available glucose (RAG) in plant foods:A potential in vitro predictor of the glycaemic response[J].The British Journal of Nutrition, 1996, 75(3):327-337.
[14] BELLMANN S, MINEKUS M, SANDERS P, et al.Human glycemic response curves after intake of carbohydrate foods are accurately predicted by combining in vitro gastrointestinal digestion with in silico kinetic modeling[J].Clinical Nutrition Experimental, 2018, 17:8-22.
[15] ZOU W, BUTARDO V M, TOUTOUNJI M, et al.Harnessing particle disintegration of cooked rice grains for predicting glycaemic index[J].Carbohydrate Polymers, 2020, 248:116789.
[16] PRIYADARSHINI S R, ARUNKUMAR E, MOSES J A, et al.Predicting human glucose response curve using an engineered small intestine system in combination with mathematical modeling[J].Journal of Food Engineering, 2021, 293:110395.
[17] LI Y W, XU R, XIU H N, et al.Effect of cinnamon on starch hydrolysis of rice pudding:Comparing static and dynamic in vitro digestion models[J].Food Research International, 2022, 161:111813.
[18] PENG X G, LIU H S, LI X Y, et al.Predicting the glycemic index of biscuits using static in vitro digestion protocols[J].Foods, 2023, 12(2):404.
[19] LIN J, LIU C Y, BAI R, et al.The application of in-vitro static digestive models simulating the digestion system of infants and young children for the development of accessory food:Current status and future perspective[J].Trends in Food Science &Technology, 2024, 143:104306.
[20] MULET-CABERO A I, EGGER L, PORTMANN R, et al.A standardised semi-dynamic in vitro digestion method suitable for food-an international consensus[J].Food &Function, 2020, 11(2):1702-1720.
[21] 袁钰洁,梁梓华,侯思文,等.酵母混菌强化发酵提高麦曲黄酒的风味品质[J].中国食品学报,2024,24(12):178-192.YUAN Y J, LIANG Z H, HOU S W, et al.Improving the brewing flavor quality of maiqu Huangjiu by enhanced fermentation with yeast mixed-culture[J].Journal of Chinese Institute of Food Science and Technology, 2024, 24(12):178-192.
[22] 高红波,杨艳娥,钟其顶,等.己糖激酶法测定葡萄酒中葡萄糖的含量[J].酿酒科技,2010(12):84-86.GAO H B, YANG Y E, ZHONG Q D, et al.Determination of glucose content in grape wine by hexokinase[J].Liquor-Making Science &Technology, 2010 (12):84-86.
[23] 田洪芸, 张海红, 尹正, 等.糖醇压片糖果中能量和碳水化合物检测方法研究[J].食品研究与开发, 2020, 41(12):176-180.TIAN H Y, ZHANG H H, YIN Z, et al.Study on determination of energy and carbohydrate in sugar and alcohol tablets[J].Food Research and Development, 2020, 41 (12):176-180.
[24] JIN Y Y, WILDE P J, LI C P, et al.Impact of food viscosity on in vitro gastric emptying using dynamic and semi-dynamic models[J].Food Hydrocolloids, 2023, 137:108410.
[25] MINEKUS M, ALMINGER M, ALVITO P, et al.A standardised static in vitro digestion method suitable for food-an international consensus[J].Food &Function, 2014, 5(6):1113-1124.
[26] YU W W, ZHOU X L, LI C.Application of first-order kinetics modeling to reveal the nature of starch digestion characteristics[J].Food &Function, 2021, 12(15):6652-6663.
[27] ZHOU X L, WANG C R, YUE S K, et al.Mutual interactions between α-amylase and amyloglucosidase in the digestion of starch with distinct chain-length distributions at a fully gelatinized state[J].Food &Function, 2022, 13(6):3453-3464.
[28] 王珂, 刘国林, 付政庆, 等.基于Moore-Penrose广义逆及立体矩阵的可分离非线性最小二乘解算方法[J].测绘学报, 2022, 51(3):340-350.WANG K, LIU G L, FU Z Q, et al.A separable nonlinear least squares solution method based on Moore-Penrose generalized inverse and solid matrix[J].Acta Geodaetica et Cartographica Sinica, 2022, 51 (3):340-350.
[29] 董传志, 龙慧, 李明洁, 等.不同浓度银耳多糖的体外模拟消化特性比较[J].现代食品科技, 2023, 39(5):183-189.DONG C Z, LONG H, LI M J, et al.Comparison of in vitro simulated digestive properties of Tremella polysaccharides at different concentrations[J].Modern Food Science and Technology, 2023, 39 (5):183-189.
[30] 钱敏, 阮凤喜, 赵文红, 等.基于GC-TOF-MS解析不同甜型广东客家黄酒代谢组分[J].中国酿造, 2022, 41(4):222-228.QIAN M, RUAN F X, ZHAO W H, et al.Analysis of metabolic components in Guangdong Hakka Huangjiu with different sweet types based on GC-TOF-MS[J].China Brewing, 2022, 41 (4):222-228.
[31] RÖHLING M, MARTIN T, WONNEMANN M, et al.Determination of postprandial glycemic responses by continuous glucose monitoring in a real-world setting[J].Nutrients, 2019, 11(10):2305.
[32] WANG H B, PENG X G, ZHANG K J, et al.A more general approach for predicting the glycemic index (GI) values of commercial noodles[J].Journal of Food Composition and Analysis, 2023, 119:105226.
[33] XIANG C J, SUN Y X, LUO Y, et al.Gastric emptying of a glucose drink is predictive of the glycaemic response to oral glucose and mixed meals, but unrelated to antecedent glycaemic control, in type 2 diabetes[J].Nutrition &Diabetes, 2024, 14:13.
[34] EDWARDS C H, COCHETEL N, SETTERFIELD L, et al.A single-enzyme system for starch digestibility screening and its relevance to understanding and predicting the glycaemic index of food products[J].Food &Function, 2019, 10(8):4751-4760.
[35] WOLEVER T M, BOLOGNESI C.Source and amount of carbohydrate affect postprandial glucose and insulin in normal subjects[J].The Journal of Nutrition, 1996, 126(11):2798-2806.
[36] ALEXEI S.On correlation coefficients[J].arXiv - STAT - Statistics Theory, 2024, 2405:16469
[37] 朱翠玲, 季圣阳, 刘彦君, 等.不同用途稻米品质指标体系构建与特征性指标筛选[J].食品工业科技, 2025, 46(4):258-269.ZHU C L, JI S Y, LIU Y J, et al.Construction of quality index system and screening of characteristic index of rice for different uses[J].Science and Technology of Food Industry, 2025, 46(4):258-269.
[38] ZOU H.The adaptive lasso and its oracle properties[J].Journal of the American Statistical Association, 2006, 101(476):1418-1429.
[39] HOERL A E, KENNARD R W.Ridge regression:Biased estimation for nonorthogonal problems[J].Technometrics, 1970, 12(1):55-67.
[40] HELLAND I S.Partial least squares regression and statistical models[J].Scandinavian Journal of Statistics, 1990,17(2):97-114.
[41] KHAN M A, KHAN R, ALGARNI F, et al.Performance evaluation of regression models for COVID-19:A statistical and predictive perspective[J].Ain Shams Engineering Journal, 2022, 13(2):101574.