人血清白蛋白(human serum albumin,HSA)在体内主要承担内源性和外源性化合物的运输与储存功能[1]。各种配体与HSA的相互作用已被广泛研究,例如生物利用度、分布和代谢过程[2]。目前,紫外-可见光吸收法、荧光光谱法、红外光谱法和分子对接法等常被用于研究蛋白质与小分子间的相互作用。这些技术能够提供配体结合特性、热力学参数、蛋白质构象变化及HSA结合位点确定等多方面的信息。色氨酸(tryptophan,Trp)是血清素(serotonin,5-HT)合成的直接前体物质,膳食补充后可以增加中枢5-HT的含量,具有改善情绪和提高食欲的作用[3]。苏有健[4]的研究表明在日粮中补充Trp后,仔猪血清和下丘脑中的5-HT水平都得到显著提高,随后,有学者提出建议,将Trp作为一种改善精神健康的饮食补充剂[5]。然而血液中90%的Trp以与HSA结合的形式存在,仅有少量游离Trp可跨过血脑屏障进入大脑。弓烨弘[6]发现可利用运动引起血浆游离脂肪酸水平升高,增加游离脂肪酸与Trp竞争HSA上的结合位点,提高血浆游离Trp浓度和Trp进入大脑的速率[7]。因此提升血浆游离Trp浓度是增加大脑5-HT含量的关键前提。
近年来,精神疾病的发病率呈现出递增的趋势。5-HT是啮齿类动物大脑神经系统中一种关键的抑制性神经递质。目前,大脑5-HT合成异常已成为精神类问题诊断和治疗的关键靶点,此外,临床上用于治疗精神类疾病的药物大多通过提升突触间隙中的5-HT水平来发挥其疗效,因此研究如何促进大脑5-HT合成对预防和改善精神类问题具有重要意义。5-HT是通过Trp的羟基化和脱羧2个反应步骤合成的[8]。由于5-HT不能通过血脑屏障,因此增加血浆游离Trp跨过血脑屏障进入大脑的速率是促进5-HT合成的关键[9]。朱西平[10]发现,低聚γ-谷氨酰色氨酸肽(oligo-γ-[Glu]n-Trp,OEW)可以增加血浆游离Trp浓度,并促进5-HT的合成,但其合成机制尚不明确。在解淀粉芽孢杆菌所产生的L-谷氨酰胺酶的催化下,以谷氨酰胺和Trp为原料,定向合成了OEW(合成率79.05%),包括γ-Glu-Trp(EW,占OEW总量36.96%)、γ-[Glu]2-Trp(EEW,占OEW总量27.05%)、γ-[Glu]3-Trp(EEEW,占OEW总量22.77%)和γ-[Glu]4-Trp(EEEEW,占OEW总量13.22%)[11-12]。针对OEW促进脑5-HT合成机制的关键问题,本文拟借助分子对接技术研究OEW中的4种单体肽及其Trp与HSA的结合能力,通过实验验证OEW中的4种单体肽及其Trp与HSA的结合作用力、结合距离、结合位点进一步探索OEW改善抑郁的效果优于Trp的原因。因此,本文利用分子对接和多光谱技术探究Trp、OEW中的4种单体肽与HSA相互作用的机理,以期为OEW促进大脑5-HT合成的实际应用奠定理论基础。
1 材料与方法
1.1 材料与试剂
Trp(纯度 98%),河北吉捷生物科技有限公司;0.05 mol/L Tris-HCl缓冲液,上海麦克林生化科技股份有限公司;HSA(纯度96%~99%),上海源叶生物科技有限公司;OEW 4种肽单体,南京杰肽生物科技有限公司;Trp和HSA储备液在4 ℃下避光保存。
98%),河北吉捷生物科技有限公司;0.05 mol/L Tris-HCl缓冲液,上海麦克林生化科技股份有限公司;HSA(纯度96%~99%),上海源叶生物科技有限公司;OEW 4种肽单体,南京杰肽生物科技有限公司;Trp和HSA储备液在4 ℃下避光保存。
1.2 仪器与设备
RF5301PC荧光分光光度计、UVmini-1280紫外可见分光光度计、IRPrestige-21傅立叶变换红外光谱仪,日本岛津公司。
1.3 实验方法
1.3.1 样品溶液的制备
Trp、OEW中的4种单体肽溶液和储备液的配制:Trp、OEW中的4种单体肽溶解于水中,配制成1.0×10-3 mol/L储备液。再稀释至1.0×10-4 mol/L。HSA储备液:HSA用0.05 mol/L Tris-HCl配制成1.0×10-4 mol/L储备液。Trp和HSA储备液在4 ℃的条件下保存,避免光照。其他试剂均为分析纯,实验用水为二次蒸馏水。
1.3.2 荧光光谱测量
参考王浩林[13]、申炳俊等[14]方法,并作适当修改。在8个10 mL的离心管中,加入0、12、24、40、80、120、200、280 μL的Trp、EW、EEW、EEEW、EEEEW溶液(1.0×10-5 mol/L),加入40 μL的HSA(1.0×10-5 mol/L),Tris-HCl缓冲液定容至4 mL,从而获得HSA与Trp、EW、EEW、EEEW、EEEEW浓度比分别为1∶0、1∶0.3、1∶0.6、1∶1、1∶2、1∶3、1∶5和1∶7的溶液。在第9个10 mL的离心管中,加入40 μL的Trp、EW、EEW、EEEW、EEEEW溶液(1.0×10-5 mol/L),作为未添加蛋白的空白对照组。在充分混匀后,将混合液置于恒温水浴中静置30 min,以促进相互作用。设置激发波长(λex):280 nm,发射波长(λem):290~410 nm,激发狭缝宽:10 nm,发射狭缝宽:5 nm。
同步荧光光谱的制备过程与前述一致,Δλ设为15 nm和60 nm,发射波长为285~335 nm和310~370 nm,以研究不同化合物对HSA构象的影响。
1.3.3 紫外吸收光谱
参考王浩林[13]、申炳俊等[14]方法,并作适当修改。为了确保实验的准确性,分别量取0、12、24、36、48、60、72、84 μL的Trp、EW、EEW、EEEW、EEEEW储备液(1.0×10-3 mol/L),将溶液均匀分配至8个10 mL的离心管中。接着,向各离心管中添加120 μL的HSA储备液(1.0×10-4 mol/L),Tris-HCl缓冲液定容,至总体积至4 mL,得到HSA与Trp、EW、EEW、EEEW、EEEEW的浓度比分别为1∶0、1∶1、1∶2、1∶3、1∶4、1∶5、1∶6和1∶7的混合液。在第9个10 mL的离心管中,加入12 μL的Trp、EW、EEW、EEEW、EEEEW溶液(1.0×10-3 mol/L)作为未添加蛋白的空白对照组,用Tris-HCl缓冲液定容至4 mL。在20 ℃的室温下静置30 min,以确保反应完全。最后,以相应浓度的Trp、EW、EEW、EEEW、EEEEW溶液作为参比,进行光谱分析,吸收波长在200~400 nm测量,以研究其光学性质。
1.3.4 红外光谱
采用溶剂溶解成膜方法[15]。取冻干后的HSA及Trp、EW、EEW、EEEW、EEEEW与HSA的复合物(1 mg)进行1∶1(质量比)混合,pH值至7.4(Trp、EW、EEW、EEEW、EEEEW溶液1.0×10-4 mol/L、HSA溶液1.0×10-6 mol/L)。将烘干后的KBr装入玛瑙研钵碾磨粉末状,压片机压片,用棉签蘸取溶液涂在KBr薄片上,扫描波长为1 000~3 000 nm。使用Origin软件进行分析。
1.3.5 分子对接
本研究采用AutoDock Vina分子对接软件对EW、EEW、EEEW、EEEEW、Trp这5种小分子与HSA进行分子对接,第一步需要从Brookhaven蛋白质数据库中(RCSB)下载HSA的晶体结构文件(ID:1H9Z)[16]。随后,根据相关数据提供的信息,使用ChemDraw 2D软件绘制Trp和OEW中的4种肽单体的平面图,并通过ChemDraw 3D软件将其转换成3D结构。在获得初级复合物结构之后,首先,利用AutoDockTools(ADT)工具对主蛋白酶和小分子进行预处理,然后设定对接盒子以执行对接运算[17],选择整个蛋白作为潜在的结合位点,使用盲对接方法。使用Lamarckian遗传算法执行了100次独立的对接实验,从中筛选出接触次数最多的分组,并在该分组内选择结合能最低的构象进行深入分析,评估其合理性。最后,运用PyMOL软件对选定的结构进行可视化分析[18]。5种分子都以类似的结合方式成功地依次与蛋白对接,并生成相应的评估分值。
1.4 数据处理
本文运用软件Excel和Origin 2024计算光谱实验数据及画图,获得EW、EEW、EEEW、EEEEW和Trp这5种小分子和HSA相互作用的机理、结合常数、热力学参数及相互作用前后HSA二级结构的变化。
2 结果与分析
2.1 荧光光谱分析
荧光光谱可测试配体小分子和受体蛋白的结合亲和力和结合作用力。HSA的荧光性质与其结构内的Trp、酪氨酸、苯丙氨酸残基密切相关。其中,Trp占据着至关重要的地位,是HSA内源性荧光的主要组成部分。HSA浓度不变,改变Trp、EW、EEW、EEEW、EEEEW浓度,在模拟人体生理条件下,得到Trp、EW、EEW、EEEW、EEEEW与HSA相互作用的荧光谱图。由图1可知,随药物浓度的增加,HSA的荧光强度逐渐增强,这表示Trp、EW、EEW、EEEW、EEEEW与HSA发生了相互作用,有发荧光的超分子化合物生成使荧光峰强度增强。Trp-HSA的最大发射峰从338.6 nm轻微红移到349.8 nm;EW-HSA的最大发射峰从311 nm轻微红移到314 nm;EEW-HSA的最大发射峰从311 nm轻微红移到313 nm;EEEW-HSA的最大发射峰从311 nm轻微红移到314.6 nm;EEEEW-HSA的最大发射峰从311 nm红移到314.1 nm。光谱的变化表明,Trp、EW、EEW、EEEW、EEEEW与HSA发生相互作用,诱导氨基酸残基周围微环境发生改变[19],导致疏水性降低但极性增加。相比而言,EW、EEW极性增加少,蛋白质空间构象比较稳定。
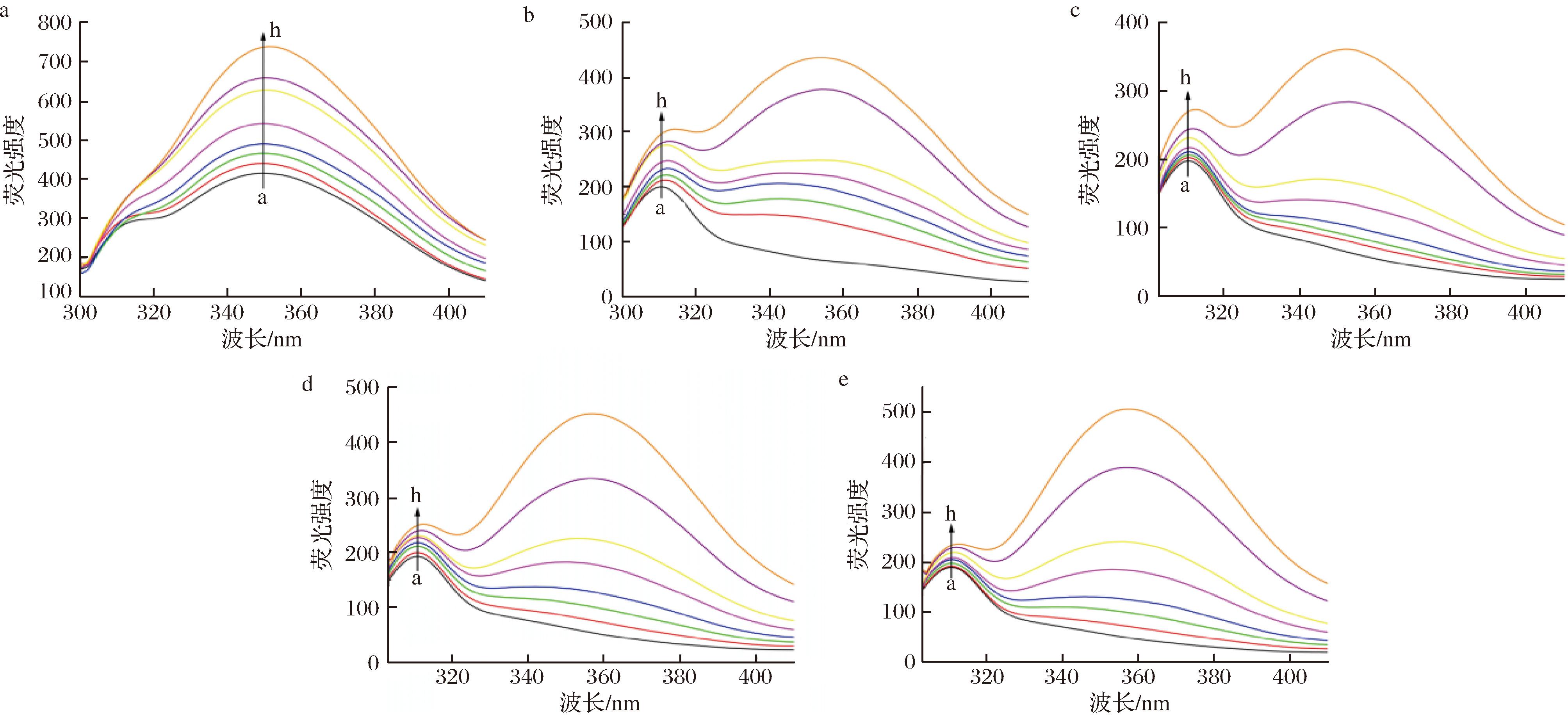
a-Trp-HSA;b-EW-HSA;c-EEW-HSA;d-EEEW-HSA;e-EEEW-HSA
图1 Trp、OEW浓度对HSA内源荧光光谱影响
Fig.1 The influence of Trp and OEW concentrations on the intrinsic fluorescence spectrum of HAS
注:CHSA=1.0×10-5 mol/L,CTrp、COEW从a~h分别为:0,0.3×10-5、0.6×10-5、1.0×10-5、2.0×10-5、3.0×10-5、5.0×10-5、7.0×10-5 mol/L。
2.2 相互作用机制分析
2.2.1 荧光加强效应
当特定配体与生物大分子共同存在时,能够观察到显著的荧光敏化增强现象。这一规律可以通过公式(1)进行描述[20]:
(1)
式中:ΔF为荧光强度变化量;Q为配体的浓度,mol/L;K为结合常数,L/mol。
可采用荧光增强理论公式(1)来研究Trp、EW、EEW、EEEW、EEEEW对HSA的增强作用[21]。利用实验数据绘制出的图呈现出良好的线性上升趋势,如图2所示。这一结果进一步证实了荧光增强理论在处理Trp、EW、EEW、EEEW、EEEEW与HSA相互作用时的适用性和准确性。结果表明,Trp、EW、EEW、EEEW、EEEEW与HSA体系的结合常数随着温度的升高而变化,其中EW-HSA和EEW-HSA之间的温度差异很强,结合常数大于Trp-HSA。
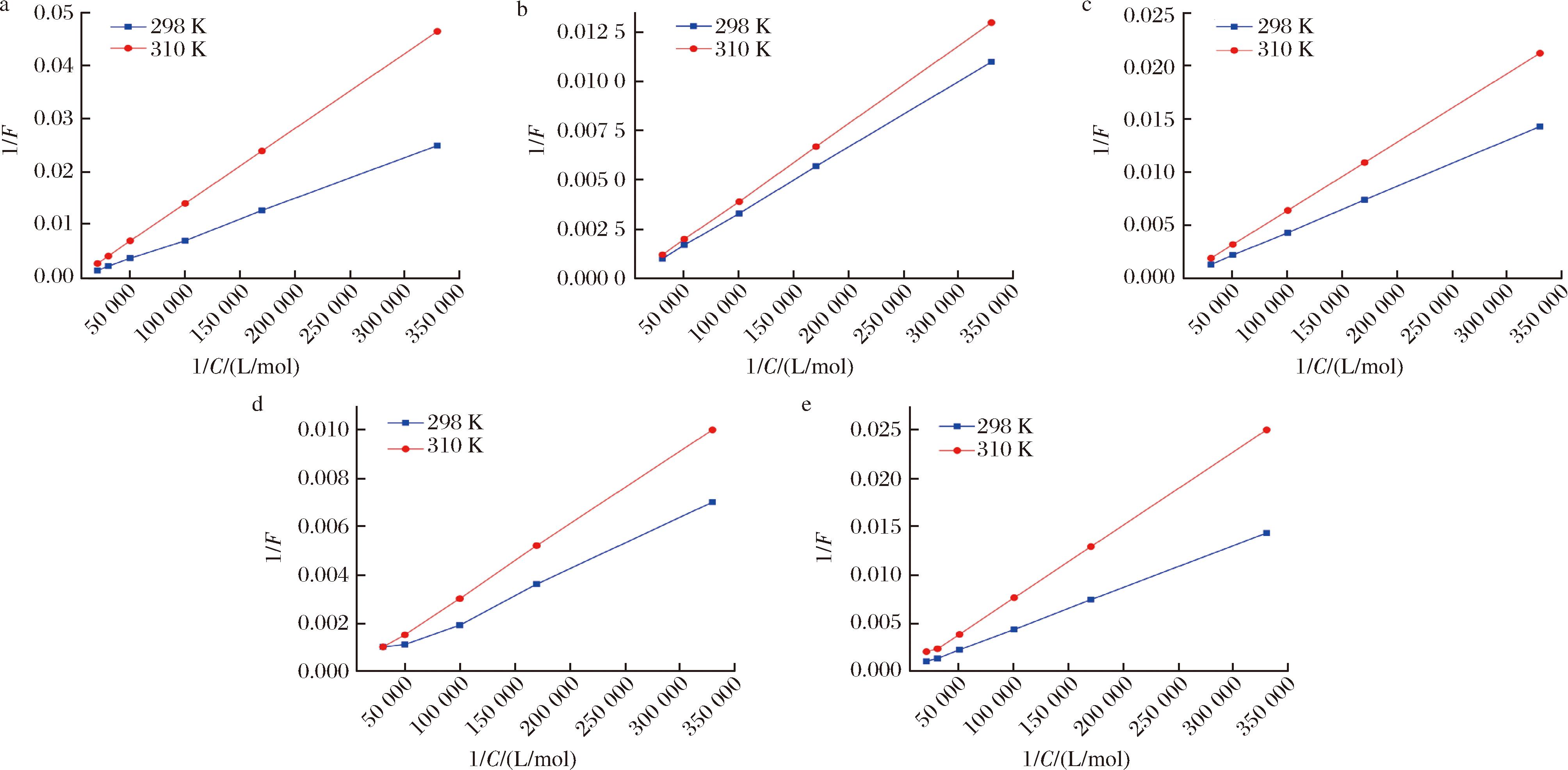
a-Trp-HSA;b-EW-HSA;c-EEW-HSA;d-EEEW-HSA;e-EEEW-HSA
图2 不同温度下Trp、OEW和HSA相互作用的1/F-1/C图
Fig.2 The 1/F-1/C plots of the interaction between Trp, OEW, and HSA at different temperatures
2.2.2 热力学参数和主要作用力
通过比较反应前后的热力学参数的数值及正负性,可以判断Trp、EW、EEW、EEEW、EEEEW与HSA之间的相互作用力类型[22]。Trp-HSA、EW-HSA、EEW-HSA、EEEW-HSA、EEEEW-HSA体系的热力学参数仅与Trp、EW、EEW、EEEW、EEEEW及HSA的相互作用有关。根据Van’t Hoff定律,计算如公式(2)~公式(3)所示[23]:
ΔG=-RTlnK=ΔH-TΔS
(2)
(3)
式中:ΔG为Gibbs自由能,kJ/mol;R为摩尔气体常数,8.314 J/(mol·K);T为绝对温度, K;ΔH为热力学参数焓变,kJ/mol;ΔS为热力学参数熵变,J/(mol·K)。
通过计算得到了Trp、EW、EEW、EEEW、EEEEW与HSA之间的ΔH、ΔS和ΔG值,结果见表1。其中,ΔG<0表明反应自发进行。结合ΔH和ΔS的结果,可以确定,Trp-HSA和EEW-HSA之间的主要作用力是疏水作用力,EW-HSA、EEEW-HSA和EEEEW-HSA之间的主要作用力为氢键。
表1 Trp-HSA、OEW-HSA体系在不同温度下的解离常数、结合位点数及热力学参数
Table 1 The dissociation constants,number of binding sites and thermodynamic parameters of Trp-HSA and OEW-HSA systems at different temperatures
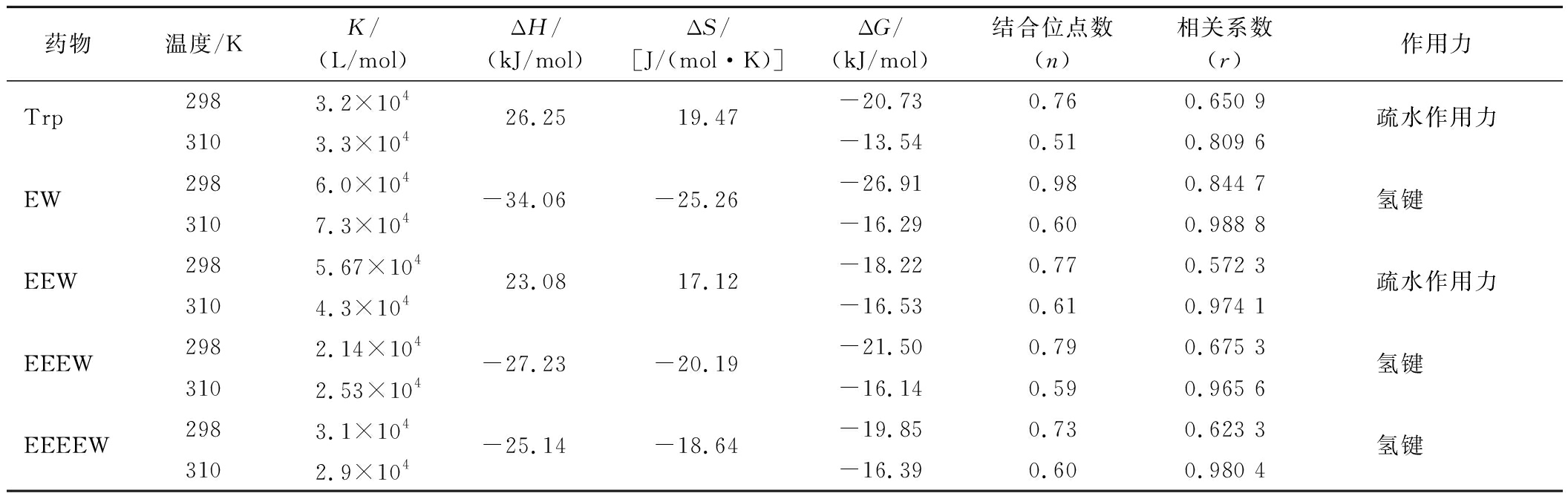
药物温度/KK/(L/mol)ΔH/(kJ/mol)ΔS/[J/(mol·K)]ΔG/(kJ/mol)结合位点数(n)相关系数(r)作用力Trp2983.2×10426.2519.47-20.730.760.650 9疏水作用力3103.3×104-13.540.510.809 6EW2986.0×104-34.06-25.26-26.910.980.844 7氢键 3107.3×104-16.290.600.988 8EEW2985.67×10423.0817.12-18.220.770.572 3疏水作用力3104.3×104-16.530.610.974 1EEEW2982.14×104-27.23-20.19-21.500.790.675 3氢键 3102.53×104-16.140.590.965 6EEEEW2983.1×104-25.14-18.64-19.850.730.623 3氢键 3102.9×104-16.390.600.980 4
2.3 Trp对HSA构象影响分析
2.3.1 紫外吸收光谱分析
紫外吸收光谱是一种有效的探究生物体内的分子相互作用机制的辅助工具,用于研究药物小分子对蛋白质二级结构的影响。为了更加准确地体现出不同浓度Trp、EW、EEW、EEEW、EEEEW对HSA紫外吸收光谱影响,以相应浓度Trp、EW、EEW、EEEW、EEEEW溶液为参比液,扫描Trp-HSA、EW-HSA、EEW-HSA、EEEW-HSA、EEEEW-HSA体系的紫外光谱分析结果见图3(曲线a~h)。随着Trp、EW、EEW、EEEW和EEEEW浓度的增加,HSA在278 nm处的光吸收值逐步增强。
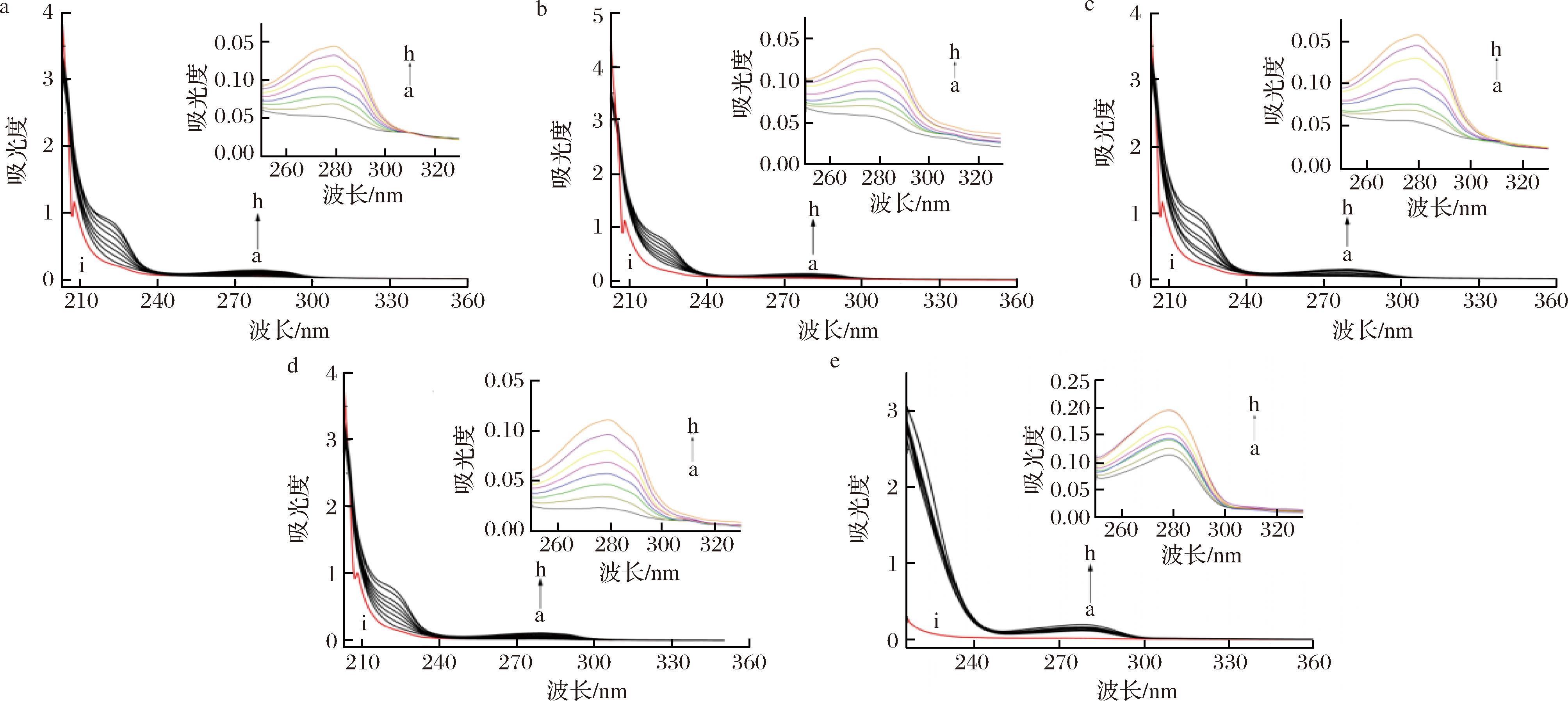
a-Trp-HSA;b-EW-HSA;c-EEW-HSA;d-EEEW-HSA;e-EEEW-HSA
图3 Trp、OEW浓度对HSA紫外吸收光谱的影响
Fig.3 The effect of Trp and OEW concentrations on the UV absorption spectrum of HSA
注:CHSA=1.0×10-4 mol/L,CTrp、COEW从a~h分别为:0、1.0×10-3、2.0×10-3、3.0×10-3、4.0×10-3、5.0×10-3、6.0×10-3、7.0×10-3 mol/L。
Trp使HSA的吸光度增加了12%,并伴随着2 nm 的蓝移;EW使HSA的吸光度增加了8%,并伴随着4 nm的蓝移;EEW使HSA的吸光度增加了7%,蓝移6 nm;EEEW使HSA的吸光度增加了9%,蓝移3 nm;EEEEW使HSA的吸光度增加了8%,蓝移2 nm,说明EW、EEW疏水性增加多,极性降低,蛋白质构象比Trp更稳定,这与上述荧光光谱的结论一致。
2.3.2 同步荧光光谱分析
同步荧光光谱法可用于检测蛋白质发光基团的构象变化。其中Δλ=15 nm和Δλ=60 nm表示酪氨酸残基和Trp残基的光谱特征[24]。光谱特征的简单性和较窄的谱带,使得光谱重叠的情况很少发生,可精确地检测出最大发射波长及强度的变化。Trp-HSA、EW-HSA、EEW-HSA、EEEW-HSA、EEEEW-HSA体系的分析结果如图4所示(曲线a~h),其中,Trp红移2 nm和5 nm;EW红移2 nm和4 nm;EEW红移1 nm和10 nm;EEEW红移1 nm和10 nm;EEEEW红移2 nm和11 nm,发射波长红移和波动的范围说明对接的结合位点更接近Trp残基,同时改变了氨酸残基周围的构象和分子环境,使极性增强,疏水性减小,从而影响蛋白质的空间结构。
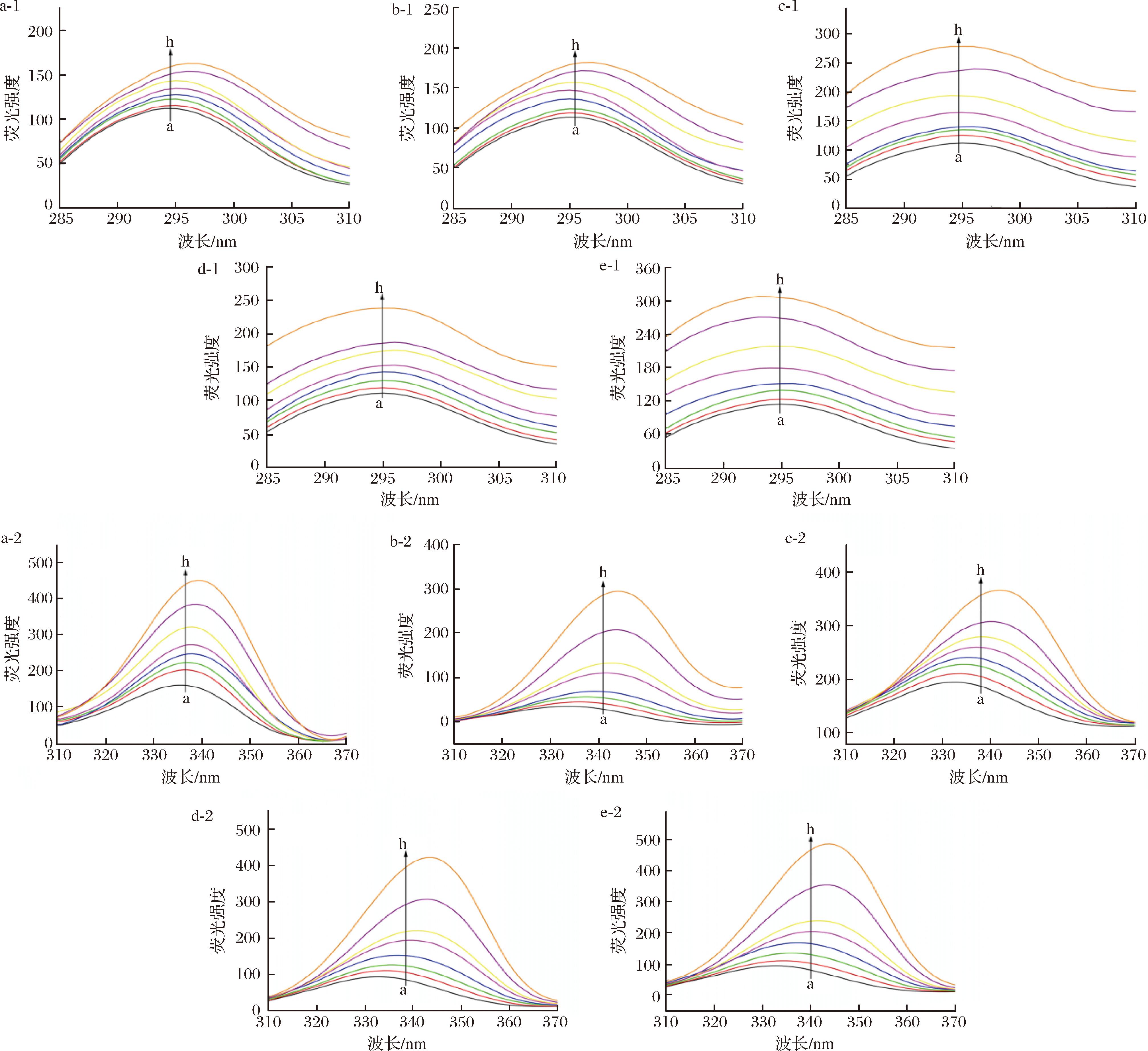
a-1~e-1-Δλ=15 nm时,Trp-HAS、EW-HAS、EEW-HAS、EEEW-HAS、EEEW-HSA;a-2~e-2-Δλ=60 nm时,Trp-HAS、EW-HAS、EEW-HAS、EEEW-HAS、EEEW-HSA
图4 Trp、OEW浓度对HSA Δλ=15 nm和Δλ=60 nm同步荧光光谱的影响
Fig.4 The effect of Trp and OEW concentrations on the synchronous fluorescence spectra of HSA at Δλ=15 nm and Δλ=60 nm
注:CHSA=1.0×10-5 mol/L,CTrp、COEW从a~h分别为:0、0.3×10-5、0.6×10-5、1.0×10-5、2.0×10-5、3.0×10-5、5.0×10-5、7.0×10-5 mol/L。
2.3.3 红外光谱分析
为深入探究Trp、EW、EEW、EEEW、EEEEW对HSA的影响,本实验对酰胺Ⅰ带(1 600~1 700 cm-1)处的Trp-HSA、EW-HSA、EEW-HSA、EEEW-HSA、EEEEW-HSA复合物的光谱进行了细致分析,结果如图5所示,HSA在1 600~1 700 cm-1和3 000~3 500 cm-1区域呈现出2个特征吸收峰。其中,前者主要由C![]() O引起的伸缩振动产生,被称为酰胺Ⅰ带。研究发现,蛋白质的二级结构对酰胺Ⅰ带的红外光谱具有较高的敏感性,因此酰胺Ⅰ带的红外光谱分析常被用于研究蛋白质的结构。Trp、EW、EEW、EEEW、EEEEW与HSA结合后,酰胺Ⅰ带的特征峰出现了不同程度的位移,可推测HSA的二级结构发生改变。研究结果显示,配体小分子与HSA的结合使HSA二级结构重排,这与荧光实验结果相吻合。Trp使得HSA的酰胺Ⅰ带由1 639.8 cm-1移动至1 637.2 cm-1;EW、EEW、EEEW、EEEEW使得HSA的酰胺Ⅰ带移动至1 637.5、1 637.3、1 635.0、1 637.4 cm-1。其中,EW的变化最小,说明EW有助于稳定HSA的蛋白空间构象。
O引起的伸缩振动产生,被称为酰胺Ⅰ带。研究发现,蛋白质的二级结构对酰胺Ⅰ带的红外光谱具有较高的敏感性,因此酰胺Ⅰ带的红外光谱分析常被用于研究蛋白质的结构。Trp、EW、EEW、EEEW、EEEEW与HSA结合后,酰胺Ⅰ带的特征峰出现了不同程度的位移,可推测HSA的二级结构发生改变。研究结果显示,配体小分子与HSA的结合使HSA二级结构重排,这与荧光实验结果相吻合。Trp使得HSA的酰胺Ⅰ带由1 639.8 cm-1移动至1 637.2 cm-1;EW、EEW、EEEW、EEEEW使得HSA的酰胺Ⅰ带移动至1 637.5、1 637.3、1 635.0、1 637.4 cm-1。其中,EW的变化最小,说明EW有助于稳定HSA的蛋白空间构象。
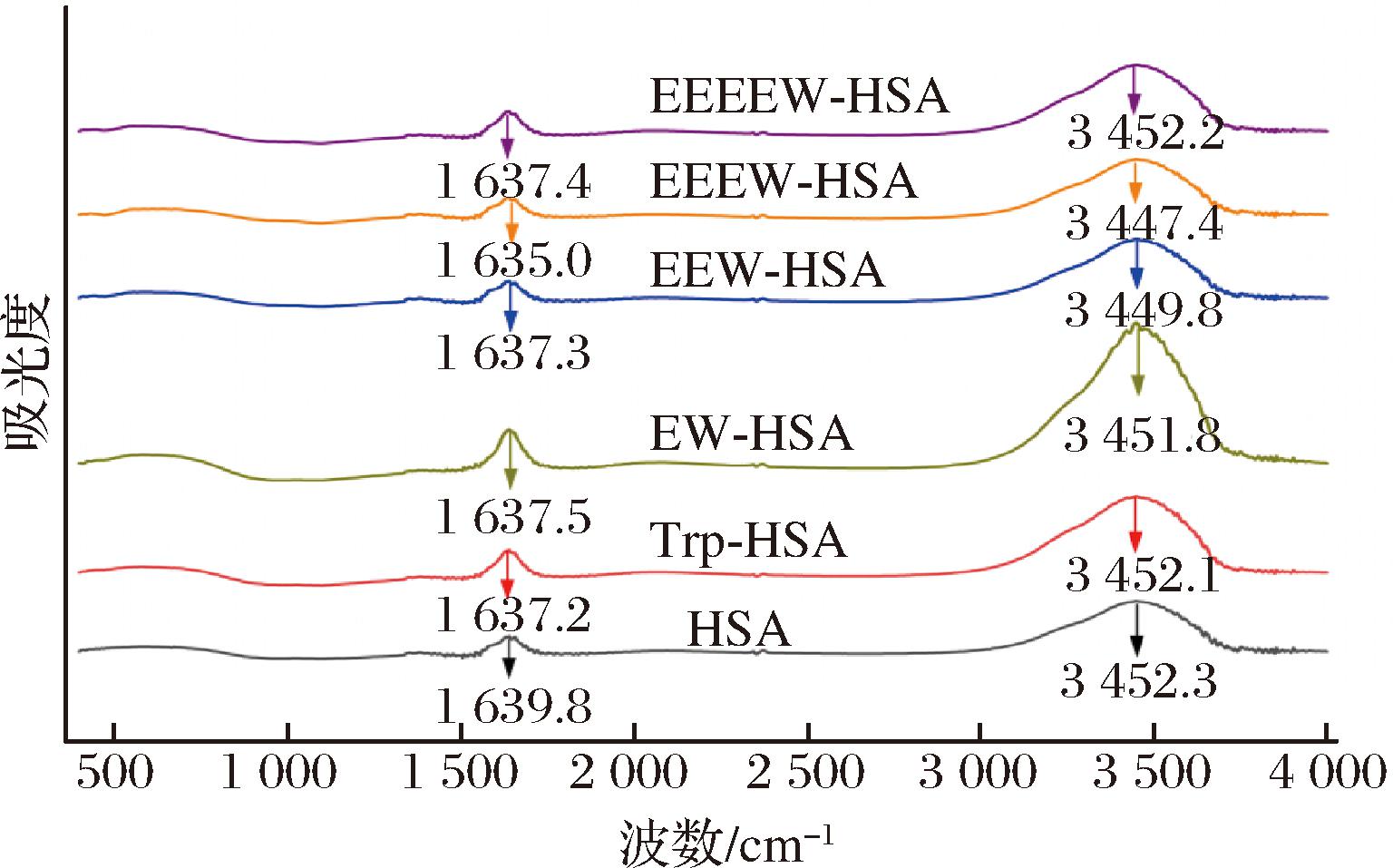
图5 HSA、Trp-HSA、OEW-HSA体系红外光谱图
Fig.5 The infrared spectra of HSA, Trp-HSA, and OEW-HSA systems
2.4 分子对接模拟分析
分子对接技术被用来预测受体蛋白和配体小分子的结合位置及非共价相互作用。经过100次运行后,选取最低结合能进行分析。如图6所示,分子对接结果表明Trp、EW、EEW结合在HSA的亚结构域IB的结合口袋内,EEEW、EEEEW结合在HSA的亚结构域IB、IIB、IIA、IIIA的结合口袋内。Trp、EW、EEW、EEEW、EEEEW与HSA的最大-CDOCKER_INTERACTION_ENERGY结果如表2所示,其中EW-HSA和EEW-HSA的打分值均低于Trp-HSA,所以EW-HSA和EEW-HSA的结构比Trp-HSA更稳定。
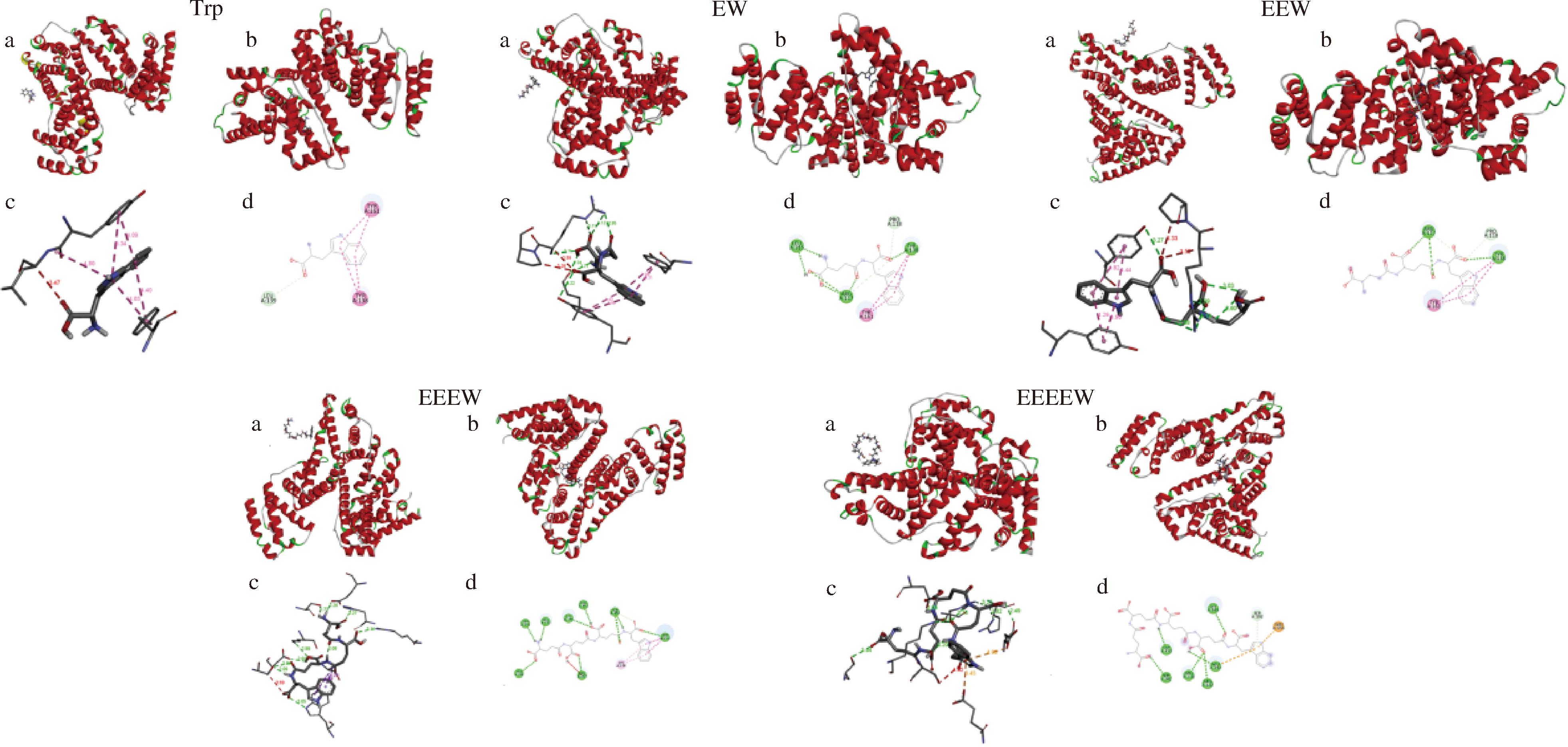
图6 Trp-HSA、OEW-HSA相互作用的分子对接图
Fig.6 Molecular docking diagram of interaction between Trp-HSA and OEW-HSA
注:a:相互作用前3D构象图;b:相互作用后3D构象图;c:相互作用3D示意图;d:相互作用2D示意图。
表2 Trp-HSA、OEW-HSA体系分子对接结果打分值 单位:kJ/mol
Table 2 Scoring values of molecular docking results for the Trp-HSA and OEW-HSA systems

组别Trp-HSAEW-HSAEEW-HSAEEEW-HSAEEEEW-HSA实验1-7.0-8.4-8.3-8.1-6.1实验1-8.0-8.7-8.6-7.7-7.1
2D和3D示意图均清晰地展示了Trp已嵌入HSA的活性位点,并通过与氨基酸残基的相互作用稳定其构象,这些关键残基包括Leu139、Tyr138和Tyr161。同样,EW也嵌入HSA的活性位点,并与Leu115、Tyr138、Arg117、Pro118和Tyr161等残基相互作用。EEW则通过与Tyr161、Arg117、Pro118和Tyr138残基的相互作用嵌入HSA活性位点。EEEW嵌入HSA的活性位点,与His288、Ser192、Glu153、Lys195、Asp451、Arg257、Ser454、Lys199和Trp214等残基形成相互作用位点。EEEEW嵌入HSA的活性位点,与Asp451、Ser202、Arg218、Arg222、Glu292、Lys195、Glu153和Ser192等残基构成相互作用位点。
通过比较结合前后的结构,可以推断出Trp、EW、EEW、EEEW和EEEEW与HSA相互作用后,均引发了不同程度的构象变化。结合ZHAO等[25]的研究及对分子对接结果的分析,可以得出结论:Trp主要通过疏水作用力与HSA结合形成稳定复合物;EW、EEW及EEEW主要通过氢键和疏水作用力与HSA结合形成稳定复合物;EEEEW则主要通过氢键和静电作用力与HSA结合形成稳定复合物,该结论与热力学分析结果一致。其中Trp与HSA形成了4条疏水作用力,EW与HSA形成了4条疏水作用力和6条氢键,EEW与HSA形成了4条疏水作用力和3条氢键,EEEW与HSA形成了4条疏水作用力和9条氢键还有1条不利于结合的作用力,EEEEW与HSA形成了2条静电作用力和6条氢键,基于以上分析结果,不难发现在对接复合物中,EW、EEW与HSA的相互作用都优于Trp与HSA的相互作用,该结果与表2的打分结果是一致的。
3 结论
通过分析分子对接的结果,发现EW、EEW这2种小分子与HSA的相互作用均优于Trp与HSA之间的相互作用。并且本文通过荧光光谱、紫外吸收光谱、红外光谱研究了OEW抑制Trp与HSA结合的潜在机制。主要发现如下:ΔG<0的热力学参数表明反应自发进行;ΔH和ΔS共同确定Trp-HSA和EEW-HSA之间的主要作用力是疏水作用力,EW-HSA、EEEW-HSA和EEEEW-HSA之间的主要作用力为氢键。同步荧光光谱和紫外吸收光谱的结果显示,OEW和Trp的加入改变了HSA的构象,Trp残基周围的构象和分子环境发生变化,结合位点更接近Trp残基。红外光谱的结果进一步说明OEW-HSA的结合导致了HSA的二级结构发生了变化,其中EW更有助于稳定HSA的蛋白构象。因此可以得出结论,OEW改善抑郁的效果优于Trp的可能原因是OEW中EW、EEW 2种单体肽与HSA的结合效果优于Trp与HSA的结合效果,导致EW、EEW优先与HSA结合,挤占了HSA的结合位点从而使Trp与HSA结合的数量变少,使大部分的Trp以游离态的形式存在,进而增加了5-HT的含量。研究结果为OEW作为药物或膳食补充剂改善抑郁症、焦虑和失眠提供了理论基础。
[1] YU L, HUA Z L, LUO X Y, et al. Systematic interaction of plasma albumin with the efficacy of chemotherapeutic drugs[J]. Biochimica et Biophysica Acta (BBA)-Reviews on Cancer, 2022, 1877(1):188655.
[2] STIELOW M, ![]() N, et al. The bioavailability of drugs: The current state of knowledge[J]. Molecules, 2023, 28(24):8038.
N, et al. The bioavailability of drugs: The current state of knowledge[J]. Molecules, 2023, 28(24):8038.
[3] WEBB J, MENZI H, PAIN B F, et al. Managing ammonia emissions from livestock production in Europe[J]. Environmental Pollution, 2005, 135(3):399-406.
[4] 苏有健. 在低蛋白日粮中添加色氨酸对仔猪生产性能和下丘脑5-羟色胺水平的影响[D]. 北京: 中国农业大学, 2005.SU Y J. Effects of lower protein diets supplemented with tryptophanon performance and hypothalamic 5-hydroxytryptamineconcentration for piglets[D]. Beijing: China Agricultural University, 2005.
[5] LI M Y, KWOK M K, FONG S S M, et al. Effects of tryptophan, serotonin, and kynurenine on ischemic heart diseases and its risk factors: A Mendelian Randomization study[J]. European Journal of Clinical Nutrition, 2020, 74(4):613-621.
[6] 弓烨弘. 色氨酸及代谢物抑制β-淀粉样蛋白聚集的分子动力学研究——对运动延缓阿尔茨海默病的机理初探[D]. 上海: 上海体育学院, 2021.GONG Y H. Molecular dynamics study of tryptophan and its derivatives to inhibit β-amyloid aggregation: A preliminary study on the mechanism of exercise delaying Alzheimer’s disease[D]. Shanghai: Shanghai University of Sport, 2021.
[7] AL-SHARMAN A, KHALIL H, EL-SALEM K, et al. The effects of aerobic exercise on sleep quality measures and sleep-related biomarkers in individuals with Multiple Sclerosis: A pilot randomised controlled trial. Neuro Rehabilitation, 2019, 45(1):107-115.
[8] ZHU X P, SUN-WATERHOUSE D, CUI C. A red pomegranate fruit extract-based formula ameliorates anxiety/depression-like behaviors via enhancing serotonin (5-HT) synthesis in C57BL/6 male mice[J]. Food Science and Human Wellness, 2021, 10(3):289-296.
[9] DAWKINS P D, MCARTHUR J N, SMITH M H. The effect of sodium salicylate on the binding of long-chain fatty acids to plasma proteins[J]. Journal of Pharmacy and Pharmacology, 1970, 22(6):405-410.
[10] 朱西平. 抗焦虑性抑郁症肽的制备及其作用机制[D]. 广州: 华南理工大学, 2020.ZHU X P. Preparation and mechanism of anti-anxious depression peptide[D]. Guangzhou: South China University of Technology, 2020.
[11] ZHU X P, SUN-WATERHOUSE D, TAO Q, et al. The enhanced serotonin (5-HT) synthesis and anti-oxidative roles of Trp oligopeptide in combating anxious depression C57BL/6 mice[J]. Journal of Functional Foods, 2020, 67:103859.
[12] 朱西平, 崔春, 王炜, 等. γ-[Glu](1≤n≤4)-Trp改善斑马鱼焦虑样行为及五羟色胺合成的作用机制[J]. 现代食品科技, 2022, 38(6): 28-36.ZHU X P, CUI C, WANG W, et al. Mechanism of γ-[Glu](1≤n≤4)-Trp to improve anxious-like behavior and serotonin synthesis in zebrafish model[J]. Modern Food Science and Technology, 2022, 38(6): 28-36.
[13] 王浩林. 适配体调控COF纳米催化放大-SERS/RRS/Abs分子光谱法检测某些污染物[D]. 桂林: 广西师范大学, 2022.WANG H L. Aptamer-regulated COF nanocatalytic amplification-SERS/RRS/Abs spectral method for some pollutants[D]. Guilin: Guangxi Normal University, 2022.
[14] 申炳俊, 柳婷婷. 光谱法和分子对接技术研究胡桃醌与人血清白蛋白的相互作用[J]. 分析化学, 2020, 48(10): 1383-1391.SHEN B J, LIU T T. Spectroscopy and molecular docking technique for investigation of interaction between juglone and human serum albumin[J]. Chinese Journal of Analytical Chemistry, 2020, 48(10): 1383-1391.
[15] SCHWAIGHOFER A, LENDL B. Infrared spectroscopy for Structure Analysis of Protein Inclusion Bodies[M]. Inclusion Bodies. New York, NY: Springer US, 2023:209-223.
[16] 杨晶, 李莉, 梁健丹, 等. 氨基硫脲芳基钌配合物与人血清白蛋白的相互作用机制研究[J]. 光谱学与光谱分析, 2023, 43(9): 2761-2767.YANG J, LI L, LIANG J D, et al. Study on the interaction mechanism between thiosemicarbazide aryl ruthenium complexes and human serum albumin[J]. Spectroscopy and Spectral Analysis, 2023, 43(9): 2761-2767.
[17] 门通. 新型冠状病毒主蛋白酶与其潜在抑制剂相互作用的分子动力学模拟[D]. 长春: 吉林大学, 2021.MEN T. Molecular dynamics simulation of the interaction between the novel coronavirus main protease and its potential inhibitors[D]. Changchun: Jilin University, 2021.
[18] 张孟丽, 杨树德, 刘宇, 等. 茯苓酸与人血清白蛋白相互作用的荧光光谱及分子对接研究[J]. 药物分析杂志, 2020, 40(12): 2141-2148.ZHANG M L, YANG S D, LIU Y, et al. Probing the interaction between pachymic acid and human serum albumin by fluorescence spectroscopy and molecular docking[J]. Chinese Journal of Pharmaceutical Analysis, 2020, 40(12): 2141-2148.
[19] 潘亚惠. 阿折地平复合物的制备及与人血清白蛋白的相互作用研究[D]. 石家庄: 河北医科大学, 2017.PAN Y H. Screening complex based on azelnidipine and study on its interaction with human serum albumin[D]. Shijiazhuang: Hebei Medical University, 2017.
[20] LIU R Q, WU L Y, FENG H J, et al. The study on the interactions of two 1, 2, 3-triazoles with several biological macromolecules by multiple spectroscopic methodologies and molecular docking[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2020, 243:118795.
[21] 杨曼曼, 席小莉, 柴晓波, 等. 核酸与抗癌药物的作用和广义荧光猝灭方程[J]. 分子科学学报, 2014, 30(6): 448-454.YANG M M, XI X L, CHAI X B, et al. Interactions of nucleic acid with anticancer drugs and generalized fluorescence quenching equation[J]. Journal of Molecular Science, 2014, 30(6): 448-454.
[22] GALANO-FRUTOS J J, SANCHO J. Energy, water, and protein folding: A molecular dynamics-based quantitative inventory of molecular interactions and forces that make proteins stable[J]. Protein Science, 2024, 33(2): e4905.
[23] GRIESSEN R, DAM B. Simple accurate verification of enthalpy-entropy compensation and isoequilibrium relationship[J]. ChemPhysChem, 2021, 22(17):1774-1784.
[24] YU Y, GONG Q T, LU W F, et al. Aggregation-induced emission probes for specific turn-on quantification of bovine serum albumin[J]. ACS Applied Bio Materials, 2020, 3(8):5193-5201.
[25] ZHAO J, YU N, ZHAO X M, et al. 3D-QSAR, molecular docking, and molecular dynamics analysis of dihydrodiazaindolone derivatives as PARP-1 inhibitors[J]. Journal of Molecular Modeling, 2023, 29(5):131.