扩展青霉(Penicillium expansum)是一种采后水果病原真菌,广泛存在苹果、葡萄、梨、橘子等温带水果及制品中,主要引起苹果青霉病。P.expansum生长初期的菌落呈青绿色斑点状,外缘呈放射状,为白色绒毛状菌丝体。繁殖方式为无性繁殖,菌丝直接分化形成分生孢子梗,成熟脱落分化为分生孢子,分生孢子可以长期存在,依靠空气传播并附着在水果表皮和伤口表面。P.expansum作为腐生营养型真菌,在侵染苹果初期以芽管方式直接进入果实伤口,感病果实表面呈棕褐色并逐渐覆盖大量青绿色孢子,最后导致果实组织软化和腐烂变质,并散发出特殊霉味[1]。除在采后贮藏和运输过程中造成果实腐烂变质外,还能产生具有致畸、致癌作用的棒曲霉素(patulin,PAT)[2-3],引发各种细胞毒性和免疫毒性,对人类健康造成严重危害[4]。
乙酸盐转运家族蛋白(acetate uptake transporter family,AceTr)作为乙酸盐摄取和分泌的重要载体,摄取有利碳源,可为菌体的生长发育提供能量,广泛存在于各种细菌、古生菌和真菌中[5]。这些小分子蛋白最初在解脂耶氏酵母(Yarrowia lipolytica)中被发现,随后在大肠杆菌(Escherichia coli)、酿酒酵母(Saccharomyces cerevisiae)和构巢曲霉(Aspergillus nidulans)等生物中也被报道[6-7]。AceTr主要通过摄取和转运乙酸/乙酸盐作为有利碳源,在菌体生长和次生代谢中发挥着重要作用。AcpA(acetate permease A)是AceTr的一员,影响丝状真菌A.nidulans中乙酸渗透酶活性。ROBELLET等[8]发现敲除AcpA后,A.nidulans出现受损式生长,在低乙酸盐浓度下,突变菌株的分生孢子几乎完全丧失对乙酸盐的摄取;但在敲除或过表达AceTr中AlcS后,突变菌株表型并未观察到明显变化[9]。此外,该家族成员还包括酿酒酵母S.cerevisiae中Ady2和大肠杆菌E.coli中YaaH和ActP。ZHANG等[10]使用DNA微阵列来表征酵母细胞从葡萄糖到乙酸条件转变的转录适应,结果发现Ady2的敲除不仅破坏了乙酸盐的主动转运,而且减少了酵母细胞内乙酸的积累,影响酵母的生长和发酵。S -PESSOA等[11]发现乙酸作为唯一碳源和能源时,同时敲除乙酸盐转运蛋白YaaH与ActP两个基因后,大肠杆菌乙酸转运功能被完全破坏。由此可见,AceTr在真菌的生长发育和介导乙酸盐摄取中发挥重要作用。
-PESSOA等[11]发现乙酸作为唯一碳源和能源时,同时敲除乙酸盐转运蛋白YaaH与ActP两个基因后,大肠杆菌乙酸转运功能被完全破坏。由此可见,AceTr在真菌的生长发育和介导乙酸盐摄取中发挥重要作用。
乙酸盐在PAT的合成中发挥着关键作用,PAT生物合成途径涉及15个基因PatA、PatB、PatC、PatD、PatE、PatF、PatG、PatH、PatI、PatJ、PatK、PatL、PatM、PatN和PatO,其中PatA编码1个乙酸盐转运蛋白[12-13]。反应起始于一分子乙酰辅酶A和三分子丙二酰辅酶A缩合,乙酰辅酶A是由乙酸盐催化产生的,作为底物进入毒素合成途径,经一系列反应生成PAT前体分子(E-ascladiol),最终由PatE编码的GMC氧化还原酶催化E-ascladiol合成PAT[14-17]。乙酸作为碳源生成乙酰辅酶A有2条途径:由乙酰辅酶A合成酶(acyl-CoA synthetase,ACS)和乙酸激酶(Pta-AckA)分别催化生成,ACS途径在低浓度下起作用,Pta-AckA途径在高浓度下起作用。荨麻青霉(Penicillium urticae)中PAT由乙酸盐衍生而来,作为芳香族聚酮(6-甲基水杨酸)到细胞外的最终产物[16]。同样地,FORRESTER等[18]发现乙酸盐、6-甲基水杨酸、间-甲酚、间羟基苯甲醇、间羟基苯甲醛和龙胆醛等代谢物共存时,PAT更容易生成。综上所述,乙酸盐转运蛋白的结构决定其生物学功能,乙酸盐的摄取在菌体生长和PAT合成中发挥重要作用。然而,P.expansum中乙酸盐转运的蛋白PepatA对丝状真菌的生长发育和次级代谢产物PAT合成途径的影响及机制尚不清楚。
本研究采用同源重组构建PepatA缺失和回复突变株,并对突变菌株生长、孢子发生、致病性和毒素积累进行分析;其次运用分子对接结合点突变寻找和证实PepatA与底物结合的关键位点,进一步完善乙酸盐转运蛋白PepatA的转运机制,为青霉病及毒素防控提供潜在靶点。
1 材料与方法
1.1 实验材料
1.1.1 菌株与质粒
P.expansum T01、大肠杆菌DH5α、农杆菌EHA105菌液为本课题组保存。富士苹果在中国甘肃兰州购买,为商业成熟期的果实。质粒载体:pCHPH(含hph抗性基因),pCNEO-eGFP。
1.1.2 材料与培养基
DP424试剂盒,上海生工生物有限公司;PrimeScriptTM RT reagent Kit with gDNA Erasers试剂盒、Green® Premix Ex TaqTM Ⅱ试剂盒,TaKaRA公司。
LB液体培养基(g/L):蛋白胨10、氯化钠10、酵母提取物5。
CY液体培养基(g/L):酵母提取物5、七水合硫酸锌0.1、磷酸氢二钾1、蔗糖5.2;查氏浓缩液10 mL/L,五水合硫酸铜0.05,用浓盐酸调pH值至5.2左右。
CYA(Czapek yeast exatract)固体培养基(g/L):酵母提取物5、七水合硫酸锌0.1、磷酸氢二钾1、蔗糖5.2、查氏浓缩液10 mL/L、五水合硫酸铜0.05,琼脂15。
1.2 仪器与设备
BM200光学显微镜,南京江南永新光学有限公司;BPMJ-250F霉菌培养箱,上海一恒科学仪器有限公司;L96+PCR仪,杭州朗基科学仪器有限公司;Alphalmager 凝胶成像仪,美国ProteinSimple公司;IS-RDV1立式恒温振荡器,CRYSTAL公司。
1.3 实验方法
1.3.1 缺失突变株和回复突变株的构建
通过同源重组原理,在敲除载体pCHPH上hph潮霉素抗性表达盒前端和后端插入PepatA上下同源臂1 kb片段,在回复载体pCNEO-eGFP上eGFP前端插入PepatA目的基因片段,参考重组快速克隆试剂盒ClonExpressⅡC112原理,制备线性化载体并进行重组。将经农杆菌转化后的突变载体质粒的菌液和P.expansum共培养,用潮霉素(250 μg/mL)筛选缺失突变株,用G418(250 μg/mL)筛选回复突变株[19],并通过多重引物进行PCR鉴定,引物序列见表1。
表1 转化子验证的引物序列
Table 1 The sequences of transformants screening of the primers
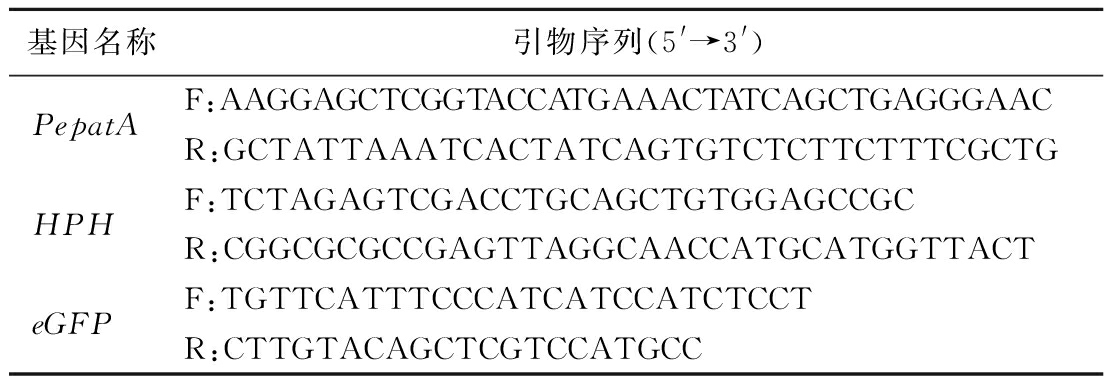
基因名称引物序列(5'→3')PepatAF:AAGGAGCTCGGTACCATGAAACTATCAGCTGAGGGAACR:GCTATTAAATCACTATCAGTGTCTCTTCTTTCGCTGHPHF:TCTAGAGTCGACCTGCAGCTGTGGAGCCGCR:CGGCGCGCCGAGTTAGGCAACCATGCATGGTTACTeGFPF:TGTTCATTTCCCATCATCCATCTCCTR:CTTGTACAGCTCGTCCATGCC
1.3.2 表型分析
将PepatA缺失、回复突变和野生型菌株的孢子悬浮液(10 μL,1×106个/mL)接种于CYA培养基,黑暗条件下25 ℃培养7 d。分别在3、5、7 d后观察菌落形态并记录菌落直径变化;用洁净的涂布棒刮取平板上培养7 d的孢子,血细胞计数板对孢子悬浮液计数,计算产孢量;将无菌盖玻片斜插在固体CYA培养基上,分别将滴加各菌株的孢子悬浮液置于盖玻片与培养基交联处,25 ℃黑暗环境下培养48 h,分别在12、36、48 h观察并记录菌丝形态特征;在直径为1 cm的琼脂圆片上分别接种各菌株的孢子悬浮液,黑暗环境下25 ℃培养12 h,观察统计不同时间点孢子萌发率和芽管长度,芽管长度用显微镜的目镜测微尺进行测定,计数200个孢子,统计芽管长度大于相应芽孢直径的孢子,按照公式(1)计算孢子萌发率:
孢子萌发率![]()
(1)
1.3.3 致病性和产毒能力
选用大小均一且无明显伤口的红富士苹果,使用无菌打孔器在果实赤道处打孔,分别接种PepatA缺失、回复突变株和野生型菌株的孢子悬浮液,在黑暗环境下25 ℃放置7 d,拍照记录3、5、7 d的苹果病斑形态,并通过图像处理软件(ImageJ)测定苹果病斑扩展面积。
在CY液体培养基中分别接种各菌株的孢子悬浮液,黑暗条件下25 ℃培养,取3、5、7 d培养液1.5 mL,经0.22 μm滤膜过滤备用;取7 d的果实腐烂组织研磨,采用乙酸乙酯萃取法提取苹果腐烂组织中的PAT,收集于棕色液相进样瓶中备用;参考ZHAO等[20]的方法采用HPLC进行测定,PAT含量以μg/mL表示,测定条件如下:流动相为10%(体积分数)乙腈,流速为1 mL/min,检测波长为276 nm。
1.3.4 RNA提取
将PepatA缺失、回复突变株和野生型菌株分别接种于CY液体培养基,25 ℃避光培养4 d后收集菌丝体用于RNA提取;采用DP424试剂盒提取样品RNA,实验操作参考产品说明书;采用PrimeScriptTM RT reagent Kit with gDNA Erasers试剂盒进行cDNA反转录;分别以cDNA为模板,采用Green®Premix Ex TaqTM Ⅱ试剂盒进行RT-qPCR样本检测。根据相关基因的序列,Primer 3.0设计基因表达检测引物,引物序列见表2,Beta-tubulin被用作内参基因,使用2-ΔΔCT公式计算基因转录水平的表达。
表2 RT-qPCR检测的引物序列
Table 2 The primer sequences used for real-time PCR of genes

类型基因名称引物序列(5'→3')孢子发生相关基因LaeABrlAWetAF:AAAGGCCGGTGCATTGATCR:TTGGAGGCTTTGGTGAGCATF:CGTGACCCCTCCTTCTTCTGR:TCGGTGTGGAGTAGAAGGAGTGTF:CATCGCCGAATATTGCAATGR:GGGCTGGAGTTGGTCAAGGTPAT合成途径相关基因PatAPatBPatCPatDPatGPatHPatIPatKPatMPatNBeta-tubulinF:AAAGGCCGGTGCATTGATCR:TTGGAGGCTTTGGTGAGCATF:GCCAGGCTATGCGATTGAGTR:GCTGGAACCCTGTCCATTGTF:TCCACCTGCGAATATCCCTTAR:CATCGCCAGTGCCATTTTCF:ATGAGATTCGTCTGCGCAAAGR:CTACCCAAGCGGGATGAGATTF:CGGCCGTCTTGAAGGAAATR:CTTGCCGTAGCGGGTGAATAF:CATTTATCGGCGGTGTTCTGAR:GATCAACGCTTGCACGATAGCF:GCAAACTCATTCCGCAAGGAR:TTTGGTCGATCGGGACTGTTF:GACGCTGGGCTACTGGATTGR:TCGTGCGTGAGGCCAGTATF:ACCCACAGCTGCACATGGAR:AGCGAGAAGAGGCGGAAGAF:CGTTCGATGTCGCTAGCAAAR:GGCGATAATCACGTCAATTCGF:CTCCAGCTCGAGCGTATGAACR:GGCTCCAAATCGACGAGAAC
1.3.5 分子对接
采用SWISS-MODEL对PepatA蛋白进行同源建模,结合Ramachandra plot和ProSA对构建的高级结构进行质量评估和结构确认;参考袁志美等[21]的方法,通过AutoDock进行PepatA蛋白和底物小分子(间-甲酚)半柔性模拟对接;对PepatA及配体间-甲酚进行去水、加氢、加Root、去电荷等处理,优化后的3D结构导入AutoDock-1.5.6,运行Autogrid生成受体网格,通过配体扩张法来生成活性位点网格,以间-甲酚为中心点,运行AutoDock计算结合力;筛选出复合物结合能最低的结果,导入PyMoL进行可视化分析间-甲酚与PepatA之间的氢键作用,Discovry Studio 4.5软件对分子间相互作用进行分析。
1.3.6 点突变菌株的构建
扩增pCNEO-eGFP质粒模板,按照QuickMutationTM基因定点突变试剂盒说明进行PCR反应,PCR反应体系中加入1 μL DpnI,混匀后在PCR仪中37 ℃孵育5 min;DpnI消化反应完毕后的产物直接进行转化,参考回复突变株的转化和共培养方法,将Hyg、G418和Carben抗性筛选出的突变菌株标记为PatA-F35A突变菌株。
1.4 数据分析
以上测定至少重复3次,统计学处理采用方差分析(ANOVA)与LSD或Tukey比较(P<0.05),数据以“平均值±标准差”报告,利用GraphPad Prism 8.0.2软件制图。
2 结果与分析
2.1 PepatA缺失及回复突变菌株的构建和鉴定
利用同源重组结合农杆菌介导转化P.expansum构建PepatA缺失和回复突变菌株,以多重引物进行PCR鉴定(图1-a)。PepatAF/PepatAR引物能在野生型菌株中扩增出PepatA基因片段(1 379 bp),而在PepatA缺失菌株中不能扩增出来。其次,当载体上连有目的基因PepatA的编码区时,用eGFPF/eGFPR引物进行PCR扩增鉴定PepatA回复菌株,能在回复突变株中扩增出一条750 bp大小的条带,但在野生型菌株中无法扩增(图1-b)。此外,经转录水平进一步检测PepatA的表达确定缺失和回复突变菌株构建成功(图1-c)。
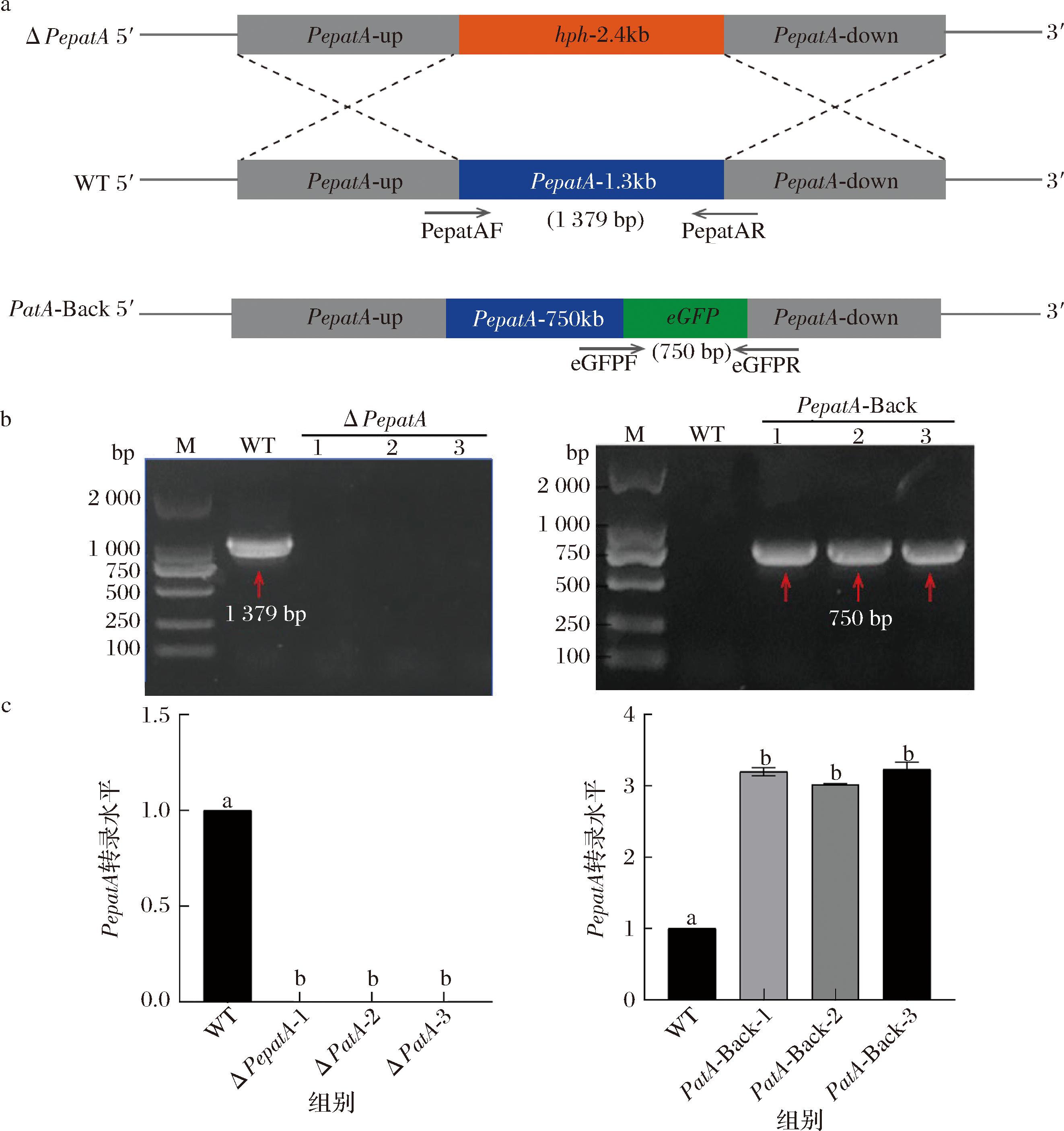
ΔPepatA:PepatA缺失菌株;WT:野生型菌株;PepatA-Back:PepatA回复菌株;M:Maker;GFP-F/eGFP-R:载体上跨PepatA目的基因和绿色荧光蛋白表达片段的鉴定引物。
a-阳性转化子验证的引物位置示意图;b-PepatA缺失和回复突变株菌液PCR鉴定;c-缺失和回复突变株中PepatA转录水平的表达
图1 PepatA缺失及回复菌株的构建和鉴定
Fig.1 Construction and identification of PepatA deletion and complementary strains
注:不同字母代表显著性差异(P<0.05)(下同)。
2.2 PepatA缺失及回复突变菌株的表型分析
将PepatA缺失、回复和野生型菌株的分生孢子分别接种于CYA培养基中25 ℃避光培养7 d,观察菌落形态和生长情况。结果显示,PepatA缺失、回复突变菌株的菌落形态与野生型的基本一致,无明显差别;与野生型相比,PepatA缺失菌株的菌落直径明显减小,孢子萌发率和芽管长度均显著下降;PepatA回复菌株的菌落直径、萌发率和芽管长度无显著差异(图2)。结果表明将PepatA缺失后,P.expansum的孢子在一定程度上萌发滞后。
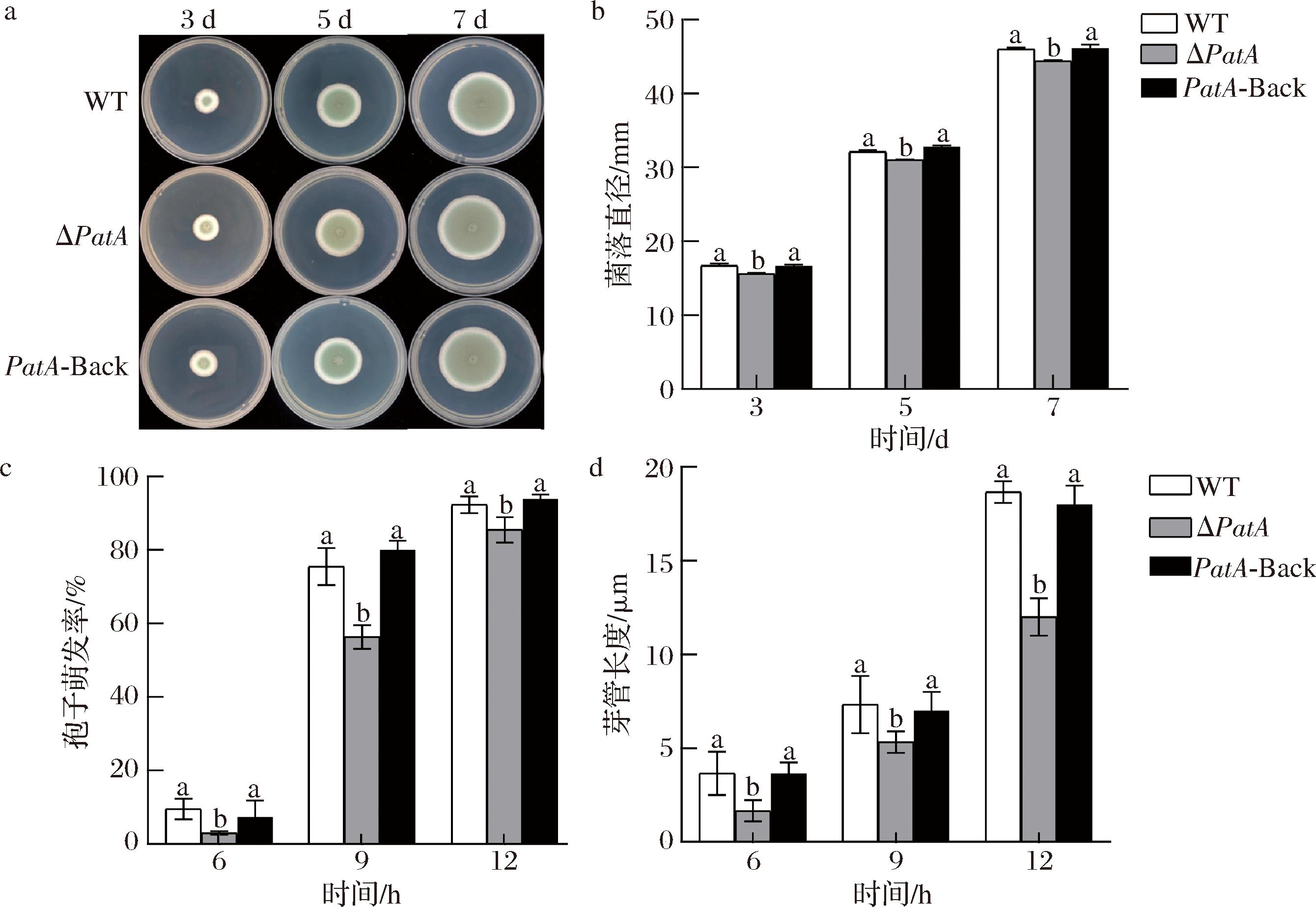
a-菌落形态;b-菌落直径;c-孢子萌发率;d-芽管长度
图2 PepatA对P.expansum的生长表型的影响
Fig.2 Effect of PepatA on the growth phenotype of P.expansum
2.3 乙酸盐转运蛋白PepatA对孢子发生的影响
为探究乙酸转运蛋白PepatA是否影响分生孢子发生,将PepatA缺失、回复突变和WT菌株接种于CYA培养基中避光培养7 d后统计产孢量。结果显示,野生型菌株、PepatA缺失菌株和回复突变株产孢量分别为8.4×108、4.4×108、8.4×108个,与野生型相比,PepatA缺失菌株的产孢量显著下降,回复菌株产孢量无显著差异(图3-a)。显微镜下动态观察孢子发生过程,结果见图3-b,12 h时,PepatA突变菌株相较野生型菌株的菌丝体稀疏且分支少;36 h时,野生型菌株中已出现部分扫帚状孢子梗且顶端分布少量串珠状分生孢子,而PepatA缺失菌株菌丝持续延伸并密集性地出现分支节点,但尚未出现孢子梗;48 h,PepatA缺失菌株涌现出少量孢子梗,孢子梗顶端清晰可见长链串珠状的分生孢子,而野生型菌株的分生孢子大量密集于分生孢子梗上,部分孢子已经脱落;回复菌株与野生型菌株基本一致,无明显差别,该结果与A.nidulans中缺失乙酸盐转运蛋白AcpA后,显著降低菌体生长,导致菌丝密度较低和孢子稀疏的现象类似[22]。进一步检测发现PepatA缺失后,孢子相关基因[23-25]的表达均显著下降(图3-c)。结果表明PepatA影响孢子相关基因的表达,间接参与调控P.expansum的无性分生孢子的形成和繁殖,导致孢子萌发滞后。此外,乙酸盐作为碳源被摄取及利用,影响细菌和真菌生长发育,并参与一些代谢反应。本研究选用葡萄糖和乙酸分别作为基础培养基的唯一碳源,选取最适质量浓度为10 mg/mL,如图3-d所示,野生型菌株的产孢量均显著高于PepatA缺失菌株的产孢量;其中乙酸条件下的野生型和PepatA缺失菌株的产孢量分别为葡萄糖条件下的1.34和2.14倍。以上结果表明,PepatA可正向调控P.expansum的孢子发生,还影响碳源的利用,同时乙酸作为唯一碳源时更有利于其产孢。

a-产孢量;b-菌丝显微结构;c-孢子发生相关基因的转录水平表达;d-不同碳源条件下的产孢量
图3 PepatA对P.expansum的孢子发生的影响
Fig.3 Effect of PepatA on the sporulation of P.expansum
注:*代表显著性差异(P<0.05)。
2.4 PepatA对P.expansum致病及产毒的影响
将PepatA缺失、回复突变及野生型菌株分别损伤接种苹果,在3、5、7 d观察记录苹果病斑扩展情况。结果如图4-a所示,接种5、7 d后,PepatA缺失菌株侵染苹果的病斑扩展面积与野生型相比明显减小,回复缺失菌株与野生型基本一致;野生型菌株病斑颜色呈黑褐色,PepatA缺失和回复菌株的腐烂组织颜色较浅。在P.expansum自身生长过程中,分泌的次级代谢产物主要为PAT,其具有潜在的细胞和动物毒性,存在致畸性、致癌性和免疫毒性。PAT广泛存在于苹果、梨等多种水果和制品中,威胁人类健康。本研究通过检测PepatA缺失、PatA-回复及野生型菌株接种于苹果组织及CY培养基中PAT含量发现,与野生型相比,PepatA缺失和PatA-回复菌株中苹果组织内的PAT含量均降低,分别为野生型的10%和57%;在离体CYA培养基中,PepatA缺失菌株PAT的积累也显著降低,3、5、7 d的毒素含量分别为野生型的34%、38%和33%,PepatA回复菌株毒素积累显著增加,但未达到野生型水平(图4-b)。在PAT生物合成途径中,PatK是PAT基因簇的关键基因,编码6-甲基水杨酸合酶,参与PAT合成第一步反应,PatM、PatC编码转运蛋白,PatG编码脱羧酶,参与6-甲基水杨酸到间-甲酚的脱羧过程,PatH、PatI编码细胞色素P450,分别负责将间-甲酚羟基化为间羟基苄醇和将间羟基苄醇羟基化为庚二醇,PatB、PatD编码GMC氧化还原酶家族蛋白,该酶可催化PAT途径的最后一步[26-27]。因此,本文进一步检测了PAT合成相关途径基因的表达,结果见图4-c,PatB、PatC、PatD、PatG、PatH、PatI、PatK、PatM和PatN的表达均有所下调,其中,编码6-甲基水杨酸合酶和6-甲基水杨酸脱羧酶的PatK和PatG的表达显著降低;PatA-Back突变菌株中大多数毒素合成相关基因恢复至野生型水平或高于野生型表达水平。比较PAT基因合成簇中2种转运蛋白的表达水平,发现PatA缺失菌株中,编码MFS转运蛋白的PatC和编码ABC转运蛋白的PatM一定程度的低表达,可能存在相互影响。综上所述,PepatA影响P.expansum的致病性,还正向参与调控P.expansum次级代谢产物PAT的合成。
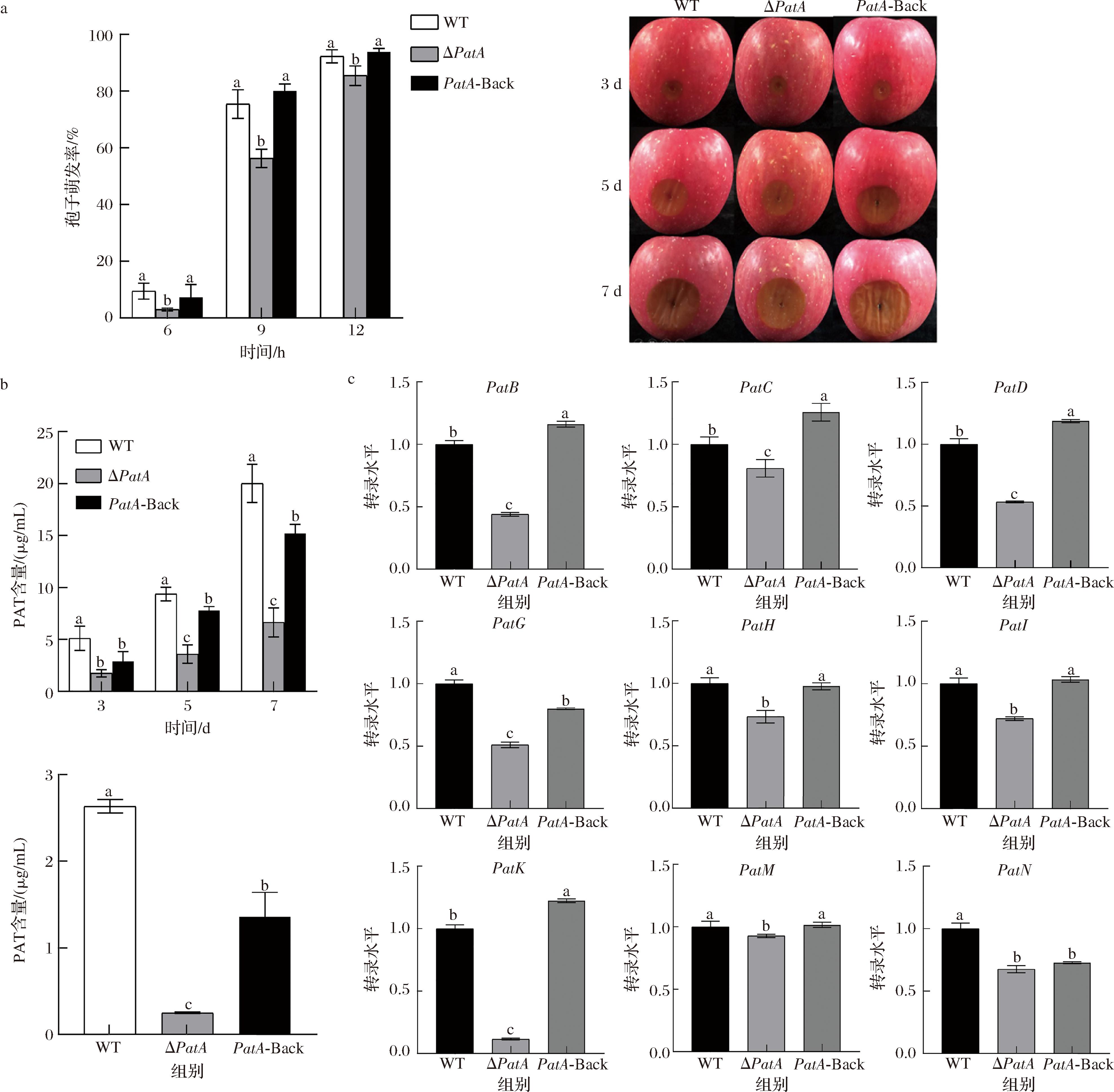
a-孢子萌发率和病斑形态;b-苹果组织及培养基中PAT含量;c-PAT合成相关基因的转录水平表达
图4 PepatA对P.expansum的致病性及产毒能力的影响
Fig.4 Effect of PepatA on the pathogenicity and virulence production capacity of P.expansum
2.5 PepatA与底物间-甲酚作用的关键位点确定及验证
乙酸盐转运蛋白含多个底物结合位点,主要通过氢键相互作用、σ键和π键等方式,其中氢键作用尤为重要,对接稳定性最强[28]。PepatA与m-Cresol的分子对接模拟结果显示,PepatA的对接位点为保守序列“NP(X)PLGL(XX)F”的Phe53,形成了1个传统氢键,且为序列中高度保守的氨基酸残基。基于PepatA蛋白与底物分子间-甲酚进行分子对接结果(图5-a),间-甲酚与PepatA蛋白中的Phe53形成1个由N、O、F等高电负性原子作为氢键受体的经典氢键,与Ala56形成1个π-π堆积键,与Phe57形成1个pi-σ键,与Phe113、Tyr178和Leu60形成了3个pi-烷基键,其中蛋白的主要活性位点有Phe53、Phe113、Tyr178和Leu60,对接能量值为-6.89 kJ/mol。对乙酸盐转运蛋白PepatA和YaaH蛋白进行DNAMEN 多重比对[11,29],结果见图5-b,PepatA蛋白中Phe53(F53)正好与YaaH蛋白3个保守疏水残基FLY收缩位点中Phe17(F17)对应。

a-PepatA与间-甲酚作用的分子对接结果;b-PepatA和YaaH蛋白结合及序列比对;c-菌落直径、菌落形态和PAT含量
图5 PepatA与底物间-甲酚作用的关健位点确定及验证
Fig.5 Determination and validation of the guiding site for the interaction of PepatA with the substrate m-cresol
为探究PepatA的活性位点对其产毒功能的影响,筛选出第53位苯丙氨酸(Phe53)为PepatA的主要活性位点,通过构建PatA-F53A突变菌株,观察菌落表型和PAT积累含量的变化,初步验证Phe53的重要性,结果见图5-c,PatA-F53A突变菌株的菌落形态及菌落直径与野生型菌株相比基本一致,无明显差异,而SUN等[30]对AceTr的研究表明,对其氨基酸残基F98和L219点突变后,可使细胞能够在乳酸和琥珀酸上生长;离体条件下培养至3、5、7 d时,PatA-F53A突变菌株菌液中的PAT含量分别下降至野生型的63%、73%、71%,毒素含量显著降低。以上结果表明,PepatA蛋白中的F53A确实是与间-甲酚相互作用的关键位点,能显著降低P.expansum中PAT含量。但相比PepatA基因的全敲,PatA-F53A突变菌体的PAT含量下降幅度显著低于PepatA缺失菌株,推测F53A的突变拓宽了蛋白收缩位点的孔径,改变了与底物的结合特异性,但可能存在其他作用位点影响其产毒作用,后续将进一步探索Phe113及其他活性作用位点对其产毒作用影响。
3 结论
本研究对PepatA参与的生物学过程进行了研究,发现PepatA对P.expansum菌株的菌丝体生长、孢子的形成和萌发以及次级代谢产物PAT的合成等过程具有重要作用,但对P.expansum的致病性无影响。此外,通过分子对接发现PepatA的多个活性位点,参与乙酸盐转运和PAT合成途径,但对PepatA如何调控P.expansum生长发育及次级代谢的代谢网络仍有待进一步研究。
[1] JURICK W M, VICO I, GASKINS V L, et al.Purification and biochemical characterization of polygalacturonase produced by Penicillium expansum during postharvest decay of ‘Anjou’ pear[J].Phytopathology, 2010, 100(1):42-48.
[2] PUEL O, GALTIER P, OSWALD I P.Biosynthesis and toxicological effects of patulin[J].Toxins, 2010, 2(4):613-631.
[3] 宗元元, 李博强, 秦国政, 等.棒曲霉素对果品质量安全的危害及其研究进展[J].中国农业科技导报, 2013, 15(4):36-41.ZONG Y Y, LI B Q, QIN G Z, et al.Toxicity of patulin on fruit quality and its research progress[J].Journal of Agricultural Science and Technology, 2013, 15(4):36-41.
[4] ABRAHAM N, CHAN E T S, ZHOU T, et al.Microbial detoxification of mycotoxins in food[J].Frontiers in Microbiology, 2022, 13:957148.
[5] BARKAI-GOLAN R, PASTER N.Mouldy fruits and vegetables as a source of mycotoxins:Part 1[J].World Mycotoxin Journal, 2008, 1(2):147-159.
[6] KUJAU M, WEBER H, BARTH G.Characterization of mutants of the yeast Yarrowia lipolytica defective in acetyl-coenzyme a synthetase[J].Yeast, 1992, 8(3):193-203.
[7] AUGSTEIN A, BARTH K, GENTSCH M, et al.Characterization, localization and functional analysis of Gpr1p, a protein affecting sensitivity to acetic acid in the yeast Yarrowia lipolytica[J].Microbiology, 2003, 149(Pt 3):589-600.
[8] ROBELLET X, FLIPPHI M, PÉGOT S, et al.AcpA, a member of the GPR1/FUN34/YaaH membrane protein family, is essential for acetate permease activity in the hyphal fungus Aspergillus nidulans[J].The Biochemical Journal, 2008, 412(3):485-493.
[9] FLIPPHI M, ROBELLET X, DEQUIER E, et al.Functional analysis of alcS, a gene of the alc cluster in Aspergillus nidulans[J].Fungal Genetics and Biology, 2006, 43(4):247-260.
[10] ZHANG M M, ZHANG K Y, MEHMOOD M A, et al.Deletion of acetate transporter gene ADY2 improved tolerance of Saccharomyces cerevisiae against multiple stresses and enhanced ethanol production in the presence of acetic acid[J].Bioresource Technology, 2017, 245:1461-1468.
[11] S -PESSOA J, PAIVA S, RIBAS D, et al.SATP (YaaH), a succinate-acetate transporter protein in Escherichia coli[J].The Biochemical Journal, 2013, 454(3):585-595.
-PESSOA J, PAIVA S, RIBAS D, et al.SATP (YaaH), a succinate-acetate transporter protein in Escherichia coli[J].The Biochemical Journal, 2013, 454(3):585-595.
[12] MOAKE M M, PADILLA-ZAKOUR O I, WOROBO R W.Comprehensive review of patulin control methods in foods[J].Comprehensive Reviews in Food Science and Food Safety, 2005, 4(1):8-21.
[13] 李博强, 陈勇, 徐小迪, 等.棒曲霉素的生物合成、调控机制及其控制技术研究进展[J].食品安全质量检测学报, 2017, 8(9):3283-3288.LI B Q, CHEN Y, XU X D, et al.Research progress on biosynthesis, regulating mechanisms and control technologies of patulin[J].Journal of Food Safety &Quality, 2017, 8(9):3283-3288.
[14] LI B Q, CHEN Y, ZONG Y Y, et al.Dissection of patulin biosynthesis, spatial control and regulation mechanism in Penicillium expansum[J].Environmental Microbiology, 2019, 21(3):1124-1139.
[15] SNINI S P, TADRIST S, LAFFITTE J, et al.The gene PatG involved in the biosynthesis pathway of patulin, a food-borne mycotoxin, encodes a 6-methylsalicylic acid decarboxylase[J].International Journal of Food Microbiology, 2014, 171:77-83.
[16] NEWAY J, GAUCHER G M.Intrinsic limitations on the continued production of the antibiotic patulin by Penicillium urticae[J].Canadian Journal of Microbiology, 1981, 27(2):206-215.
[17] SEKIGUCHI J, SHIMAMOTO T, YAMADA Y, et al.Patulin biosynthesis:Enzymatic and nonenzymatic transformations of the mycotoxin (E)-ascladiol[J].Applied and Environmental Microbiology, 1983, 45(6):1939-1942.
[18] FORRESTER P I, GAUCHER G M.Conversion of 6-methylsalicylic acid into patulin by Penicillium urticae[J].Biochemistry, 1972, 11(6):1102-1107.
[19] CHEN Y, LI B Q, XU X D, et al.The pH-responsive PacC transcription factor plays pivotal roles in virulence and patulin biosynthesis in Penicillium expansum[J].Environmental Microbiology, 2018, 20(11):4063-4078.
[20] ZHAO L N, HU Y Z, LIANG L Y, et al.WSC1 regulates the growth, development, patulin production, and pathogenicity of Penicillium expansum infecting pear fruits[J].Journal of Agricultural and Food Chemistry, 2024, 72(2):1025-1034.
[21] 袁志美, 欧刚卫, 周阳, 等.pmMsrA的生物信息学及底物对接分析[J].生物技术, 2017, 27(6):569-575;551.YUAN Z M, OU G W, ZHOU Y, et al.Bioinformatics and substrate docking analysis of pmMsrA[J].Biotechnology, 2017, 27(6):569-575;551.
[22] GENTSCH M, KUSCHEL M, SCHLEGEL S, et al.Mutations at different sites in members of the Gpr1/Fun34/YaaH protein family cause hypersensitivity to acetic acid in Saccharomyces cerevisiae as well as in Yarrowia lipolytica[J].FEMS Yeast Research, 2007, 7(3):380-390.
[23] TAO L, YU J H.AbaA and WetA govern distinct stages of Aspergillus fumigatus development[J].Microbiology, 2011, 157(Pt 2):313-326.
[24] WANG M S, SUN X P, ZHU C Y, et al.PdbrlA, PdabaA and PdwetA control distinct stages of conidiogenesis in Penicillium digitatum[J].Research in Microbiology, 2015, 166(1):56-65.
[25] QIN Y Q, BAO L F, GAO M R, et al.Penicillium decumbens BrlA extensively regulates secondary metabolism and functionally associates with the expression of cellulase genes[J].Applied Microbiology and Biotechnology, 2013, 97(24):10453-10467.
[26] BARAD S, SIONOV E, PRUSKY D.Role of patulin in post-harvest diseases[J].Fungal Biology Reviews, 2016, 30(1):24-32.
[27] SASAKI C, TAMURA S, TOHSE R, et al.Isolation and identification of an angiotensin Ⅰ-converting enzyme inhibitory peptide from pearl oyster (Pinctada fucata) shell protein hydrolysate[J].Process Biochemistry, 2019, 77:137-142.
[28] QIU B, XIA B Q, ZHOU Q T, et al.Succinate-acetate permease from Citrobacter koseri is an anion channel that unidirectionally translocates acetate[J].Cell Research, 2018, 28(6):644-654.
[29] ![]() T, ALVES J, AZEVEDO-SILVA J, et al.New insights into the acetate uptake transporter (AceTr) family:Unveiling amino acid residues critical for specificity and activity[J].Computational and Structural Biotechnology Journal, 2021, 19:4412-4425.
T, ALVES J, AZEVEDO-SILVA J, et al.New insights into the acetate uptake transporter (AceTr) family:Unveiling amino acid residues critical for specificity and activity[J].Computational and Structural Biotechnology Journal, 2021, 19:4412-4425.
[30] SUN P C, LI J L, ZHANG X L, et al.Crystal structure of the bacterial acetate transporter SatP reveals that it forms a hexameric channel[J].Journal of Biological Chemistry, 2018, 293(50):19492-19500.