快节奏、大压力、高摄入和少运动的现代生活方式,导致亚健康人群激增,我国亚健康人群比例已超过70%,由其诱发的慢性病成为社会严重的负担[1]。世界卫生组织明确指出,膳食是仅次于遗传而影响人类健康的第二大因素。加强非医疗健康干预、优化膳食结构、改善亚健康状态成为“健康中国”国家战略的重要任务。淀粉是全球饮食中最丰富的营养素,主要由葡萄糖以易消化的α-1,4键连接而成[2],引入α-1,2/α-1,3/α-1,6等抗消化键型可改变淀粉结构,降低热量的同时赋予其潜在益生功能[3]。目前α-1,2/α-1,6-葡聚糖的合成已有较多报道,而有关α-1,3-葡聚糖合成的研究较少[4-5]。
酶法催化制备α-1,3-葡聚糖有着广阔的前景。1996年,KONISHI等[6]发现了一种来源于Acremonium sp.S4G13的4,3-α-葡萄糖基转移酶,利用其转糖苷反应,以麦芽糖为底物制备出聚合度≤3的α-1,3-葡聚糖。2003年,KOBAYASHI等[7]从Paecilomyces lilacinus中分离鉴定了一种新型α-葡萄糖苷酶,用于生产α-1,3-葡聚糖,产率可达16%。2004年,YAMAMOTO等[8]发现了Acremonium implicatum来源的α-1,3-葡萄糖苷酶,该酶具有合成α-1,3-葡聚糖和α-1,4-葡聚糖的转糖基活性,以麦芽糖为底物合成了8种转糖基化产物。2019年,MA等[9]将Aspergillus niger来源的α-1,3-葡萄糖苷酶用于高水平生产α-1,3葡聚糖,产率达到24%。以上葡萄糖基转移酶均存在产率低、产物α-1,3-键型低的不足。2016年,PUANGLEK等[10]利用Streptococcus salivarius ATCC 25975来源的葡聚糖蔗糖酶合成α-1,3-葡聚糖,通过一锅水基反应合成了仅以α-1,3-键连接的不溶性葡聚糖,但葡聚糖蔗糖酶需以蔗糖为底物,一半糖基被浪费,合成效率低。
糖苷磷酸化酶是参与合成与分解糖基键的3种主要酶之一,由于其反应具有可逆性和高度的特异性,利用其逆磷酸解反应,以单磷酸化糖基为供体可制备低聚糖[11]。反应过程中供体可为糖苷键合成提供能量,因此转化率高;单磷酸化糖基供体可由游离磷酸获得,原料低廉。2012年,NIHIRA等[12]从Clostridium phytofermentans中发现了一种新型的α-1,3-葡萄糖苷磷酸化酶Cphy1874,以1-磷酸-葡萄糖为供体,葡萄糖为受体可合成黑曲霉二糖,但产物中含有少量曲二糖;2013年,该团队又发现了相同来源的2种新型α-1,3-葡萄糖苷磷酸化酶CpNP3313和CpNP3314[13],其中CpNP3313性质与Cphy1874相似,CpNP3314可合成聚合度≤4的α-1,3-葡聚糖。2022年,BI等[14]发现了一种来源于Anaerosporobacter mobilis的新型α-1,3-葡萄糖苷磷酸化酶AmNP,通过与麦芽糖磷酸化酶的偶联反应制备黑曲霉二糖,产率达到66.3%。以上4种已有报道的α-1,3-葡萄糖苷磷酸化酶普遍存在产物聚合度不高的问题,因此亟需挖掘鉴定合成产物聚合度高且转化率高的新型α-1,3葡聚糖磷酸化酶,并开展其食品级发酵制备研究。
本研究将实验室挖掘获得的类芽孢杆菌(Paenibacillus sp.) HMSSN-139来源的α-1,3-葡聚糖磷酸化酶基因在大肠杆菌(Escherichia coli BL21)和枯草芽孢杆菌(Bacillus subtilis)中进行重组表达,并利用其与麦芽糖磷酸化酶偶联催化制备α-1,3-葡聚糖,以探究其在工业生产中的可能。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
Paenibacillus sp.HMSSN-139来源的α-1,3-葡聚糖磷酸化酶(Psp13GP)基因由安升达(苏州)科技有限公司合成,并连接至实验室保藏的pET-24a(+)和PUB110质粒载体上。菌株E.coli BL21(DE3)和B.subtilis WS9由实验室保藏用于基因表达。
1.1.2 试剂
葡萄糖、果糖、半乳糖、麦芽糖标品,上海麦克林生化科技有限公司;曲二糖、黑曲霉二糖标品,上海惠诚生物科技有限公司;其他化学试剂,国药集团化学试剂(上海)有限公司。
1.1.3 培养基
LB培养基和TB培养基配制参照姚动邦[15]。
发酵培养基(g/L):碳源 10.00,氮源 10.00,磷酸氢二钠 12.00,磷酸二氢钾 3.00,七水合硫酸镁 1.00。
1.2 仪器与设备
Waters2695高效液相色谱系统,沃特世科技(上海)有限公司;HypersilTM APS-2(NH2)色谱柱,赛默飞世尔科技(中国)有限公司;ShodexTM AsahipakTM NH2P50-4E色谱柱,力森诺科科学仪器(上海)有限公司;5452R台式高速离心机,德国艾本德公司;Scientz-650E超声波细胞粉碎机,宁波新芝生物科技股份有限公司;DKB-501A超级恒温水槽,上海森信实验仪器有限公司。
1.3 实验方法
1.3.1 α-1,3-葡聚糖酶重组蛋白的表达
将pET-24a(+)-Psp13GP化学转化至E.coli BL21(DE3)中,涂布在LB(含有30 mg/mL卡那霉素)平板上,在37 ℃恒温培养箱中培养8~12 h,挑取平板上大小合适的菌落接种在LB培养基(含有30 mg/mL卡那霉素)中,37 ℃,200 r/min条件下培养8~12 h,保存菌种并进行酶切验证。从甘油管中按2‰(体积分数)的接种量接种至LB培养基(含有30 mg/mL卡那霉素)中,37 ℃,200 r/min条件下培养8~10 h,获得种子液。从种子液中按5%(体积分数)的接种量接种至LB培养基(含有30 mg/mL卡那霉素)中,37 ℃,200 r/min条件下培养2 h,然后转至25 ℃培养24 h。
将PUB110-Psp13GP的重组质粒电击转化至B.subtilis WS9中,涂布在LB(含有30 mg/mL卡那霉素)平板上,在37 ℃恒温培养箱中培养8~12 h,挑取平板上大小合适的菌落接种在LB培养基(含有30 mg/mL卡那霉素)中,37 ℃,200 r/min条件下培养8~12 h,保存菌种并进行酶切验证。从甘油管中按2‰(体积分数)的接种量接种至LB培养基(含有30 mg/mL卡那霉素)中,37 ℃、200 r/min条件下培养8~10 h,获得种子液。从种子液中按5%(体积分数)的接种量接种至LB培养基(含有30 mg/mL卡那霉素)中,37 ℃,200 r/min条件下培养2 h,然后转至33 ℃培养48 h。
将摇瓶发酵获得的菌液使用去离子水稀释至合适浓度,使用分光光度计对600 nm波长处的吸光度进行测定,菌体浓度(OD600)为测得的吸光度与稀释倍数的乘积。取合适体积菌体12 000 r/min离心1 min,用1 mL 3-N-吗啉丙磺酸(3-morpholinopropanesulfonic acid, MOPS)-氢氧化钠(MOPS-NaOH)缓冲液重悬,使最终OD600值为5。使用超声破壁机破碎,12 000 r/min离心1 min,得到的上清液即为粗酶液。将发酵上清液,粗酶液及破壁沉淀与5×蛋白上样缓冲液混匀,100 ℃加热10 min,根据说明书配制SDS-PAGE蛋白胶进行蛋白凝胶电泳。
1.3.2 逆磷酸解(合成)活性的测定
反应体系中,含有终浓度20 mmol/L的麦芽糖,终浓度20 mmol/L的β-1-磷酸葡萄糖,终浓度25 mmol/L的MOPS-NaOH缓冲液及等量的酶液,在37 ℃下准确反应10 min后立即煮沸10 min终止反应。在上述条件下,1逆磷酸解酶活力单位定义为每分钟生成1 μmol 无机磷所需的酶量,即每分钟消耗1 μmol麦芽糖所需的酶量。
采用高效液相色谱法对消耗的麦芽糖进行测定,检测条件为:Waters 2695型液相色谱系统,检测器为示差检测器,色谱柱为HypersilTM APS-2(NH2);流动相为75%(体积分数)乙腈;流速为0.8 mL/min;柱温为40 ℃。
1.3.3 重组酶受体特异性测定
选取葡萄糖、果糖、半乳糖、麦芽糖、黑曲霉二糖、曲二糖、异麦芽糖、麦芽糊精DE15-20、右旋糖苷T40为受体底物。反应体系中,含有终浓度20 mmol/L的单糖、双糖受体底物或终质量浓度10 g/L的多糖受体底物,终浓度20 mmol/L磷酸盐溶液,终浓度25 mmol/L MOPS-NaOH缓冲液及等量的酶液,测定酶活力方法同1.3.2节。
1.3.4 重组酶制备α-1,3-葡聚糖
参考NIHIRA等[16]采用的“一锅酶”法制备α-1,3-葡聚糖。使用20 mmol/L MOPS-NaOH(pH 7.0)缓冲液配制200 g/L的麦芽糖为底物,加入终质量浓度为0.2 mg/mL的LbMP酶液和终质量浓度为0.2 mg/mL的Psp13GP酶液,设置磷酸盐浓度分别为20、50 mmol/L的2组,在37 ℃、150 r/min的水浴摇床中反应。
采用高效液相色谱法对生成的产物进行测定,检测条件为:Waters 2695型液相色谱系统,检测器为示差检测器,色谱柱为HypersilTM APS-2(NH2);流动相为75%(体积分数)乙腈;流速为0.8 mL/min;柱温为40 ℃;Waters 2695型液相色谱系统,检测器为示差检测器,色谱柱为ShodexTM AsahipakTM NH2P50 4E;流动相为75%(体积分数)乙腈;流速为0.8 mL/min;柱温为35 ℃。
1.4 数据统计与分析
本研究数据使用Origin 2021进行分析绘图。
2 结果与分析
2.1 Psp13GP在E.coli中的表达
将获得的重组菌E.coli BL21(DE3)/pET-24a(+)-Psp13GP进行摇瓶发酵,对发酵上清液、破壁上清液、破壁沉淀进行SDS-PAGE分析,Psp13GP的理论分子质量为88.08 kDa。如图1所示,在理论分子质量附近有清晰的条带,其表达大部分位于泳道2的破壁上清液中,且测得酶活力为7.70 U/mL,Psp13GP在E.coli BL21(DE3)中成功重组表达且为胞内酶。
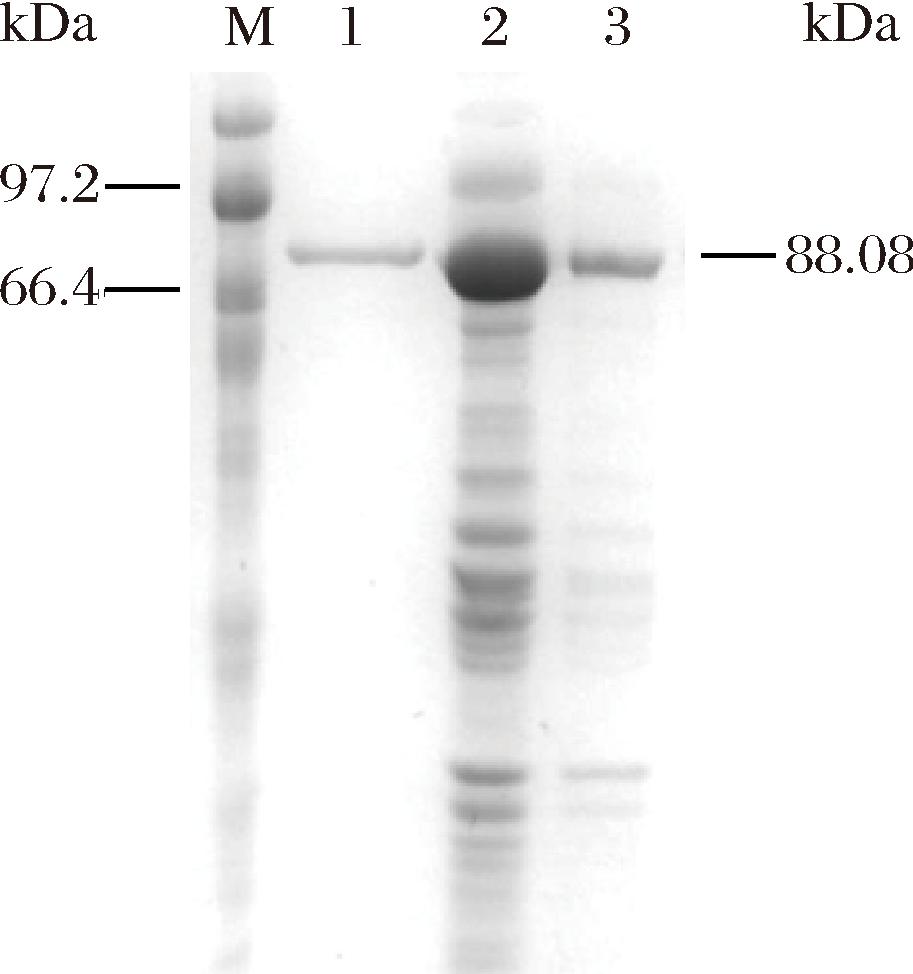
M-蛋白标准品;1-发酵上清液;2-破壁上清液;3-破壁沉淀。
图1 E.coli BL21(DE3)/pET-24a(+)-Psp13GP的SDS-PAGE分析
Fig.1 SDS-PAGE analysis of E.coli BL21(DE3)/pET-24a(+)-Psp13GP
2.2 Psp13GP在Bacillus subtilis中的表达
将获得的重组菌B.subtilis WS9/PUB110-Psp13GP进行摇瓶发酵,对发酵上清液、破壁上清液、破壁沉淀进行SDS-PAGE分析。如图2所示,在泳道2的破壁上清液中有清晰条带,测得酶活力为1.57 U/mL,Psp13GP在B.subtilis WS9中成功重组表达。
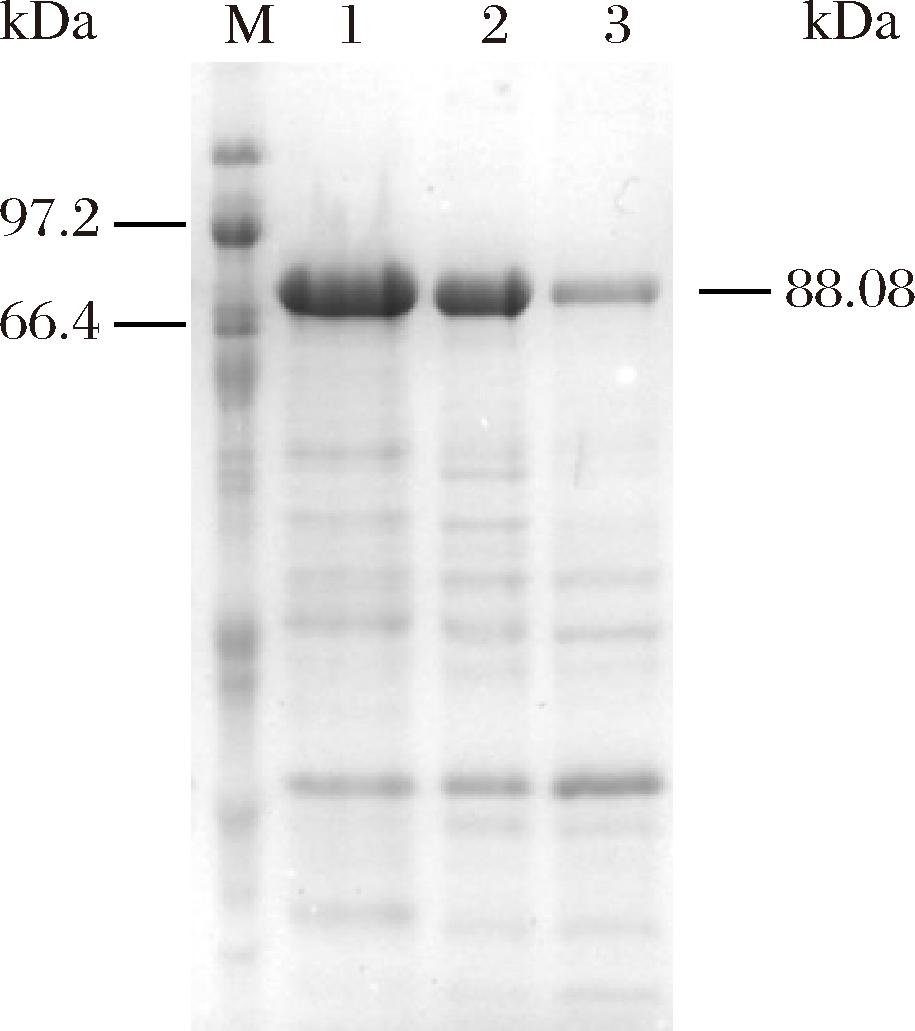
M-蛋白标准品;1-发酵上清液;2-破壁上清液;3-破壁沉淀。
图2 B.subtilis WS9/PUB110-Psp13GP的SDS-PAGE分析
Fig.2 SDS-PAGE analysis of B.subtilis WS9/PUB110-Psp13GP
2.3 Psp13GP偶联催化制备α-1,3-葡聚糖
选取短乳杆菌(Lactobacillus brevis)来源的麦芽糖磷酸化酶LbMP与Psp13GP偶联催化制备α-1,3-葡聚糖。因反应体系涉及2个酶,考虑到2个酶的性质,将反应条件设置为37 ℃,pH 7.0,底物麦芽糖质量浓度200 g/L,加酶量0.2 mg/mL,并设置磷酸盐浓度20 mmol/L和50 mmol/L的2组。
结果如图3所示,当磷酸盐终浓度为20 mmol/L时,α-1,3-葡聚糖最终产率为62.02%(图3-A);当磷酸盐浓度为50 mmol/L时,α-1,3-葡聚糖最终产率为59.91%(图3-B);在低磷酸盐浓度条件下α-1,3-葡聚糖产率较高,且反应72 h时,α-1,3-葡聚糖产率均高于50%,此后反应主要为各组分之间的转化(图3-C~图3-D)。如图3-E~图3-F所示,反应过程中无黑曲霉二糖生成,产物为以麦芽糖为基础以α-1,3糖苷键链接的葡聚糖。
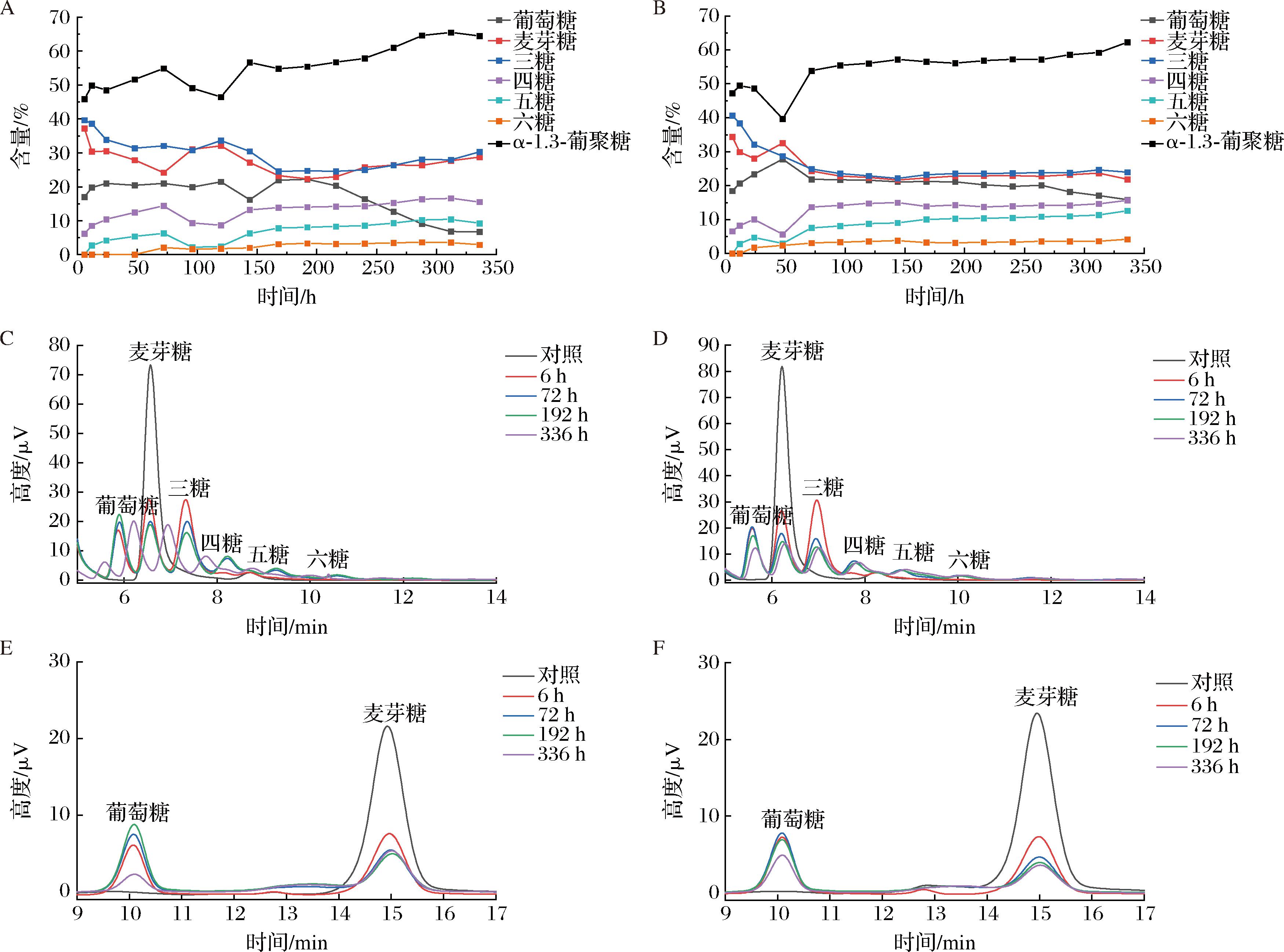
A-磷酸盐终浓度20 mmol/L组糖含量变化;B-磷酸盐终浓度50 mmol/L组糖含量变化;C-磷酸盐终浓度20 mmol/L组不同时间样品HypersilTM APS-2(NH2)色谱柱检测图;D-磷酸盐终浓度50 mmol/L组不同时间样品HypersilTM APS-2(NH2)色谱柱检测图;E-磷酸盐终浓度20 mmol/L组不同时间样品ShodexTMAsahipakTM NH2P50 4E色谱柱检测图;F-磷酸盐终浓度50 mmol/L组不同时间样品ShodexTMAsahipakTM NH2P50 4E色谱柱检测图
图3 偶联催化结果图
Fig.3 Results of coupling-catalyzed preparation
2.4 Psp13GP摇瓶水平发酵优化
实验初期使用的E.coli BL21(DE3)不属于食品安全菌株,为了使Psp13GP可以应用于食品工业,本研究将Psp13GP在食品安全菌株B.subtilis WS9中进行表达,但其存在蛋白表达量较低的问题。为此本研究筛选出了更强的启动子,并对培养基进行了优化,以提高重组蛋白的表达和分泌水平。
2.4.1 启动子优化
选取不同的启动子PamyQ’、PSoDA、PSpovG、PFusA和Pnpre替换原启动子PamyE得到重组菌株B.subtilis WS9 P1-5,其中PamyQ’参考王逸凡[17]的研究进行扩增,摇获得瓶发酵结果如图4和图5所示。其中含启动子PamyQ’的重组菌酶活力达到2.35 U/mL,是含原启动子PamyE的重组菌酶活力的1.50倍。
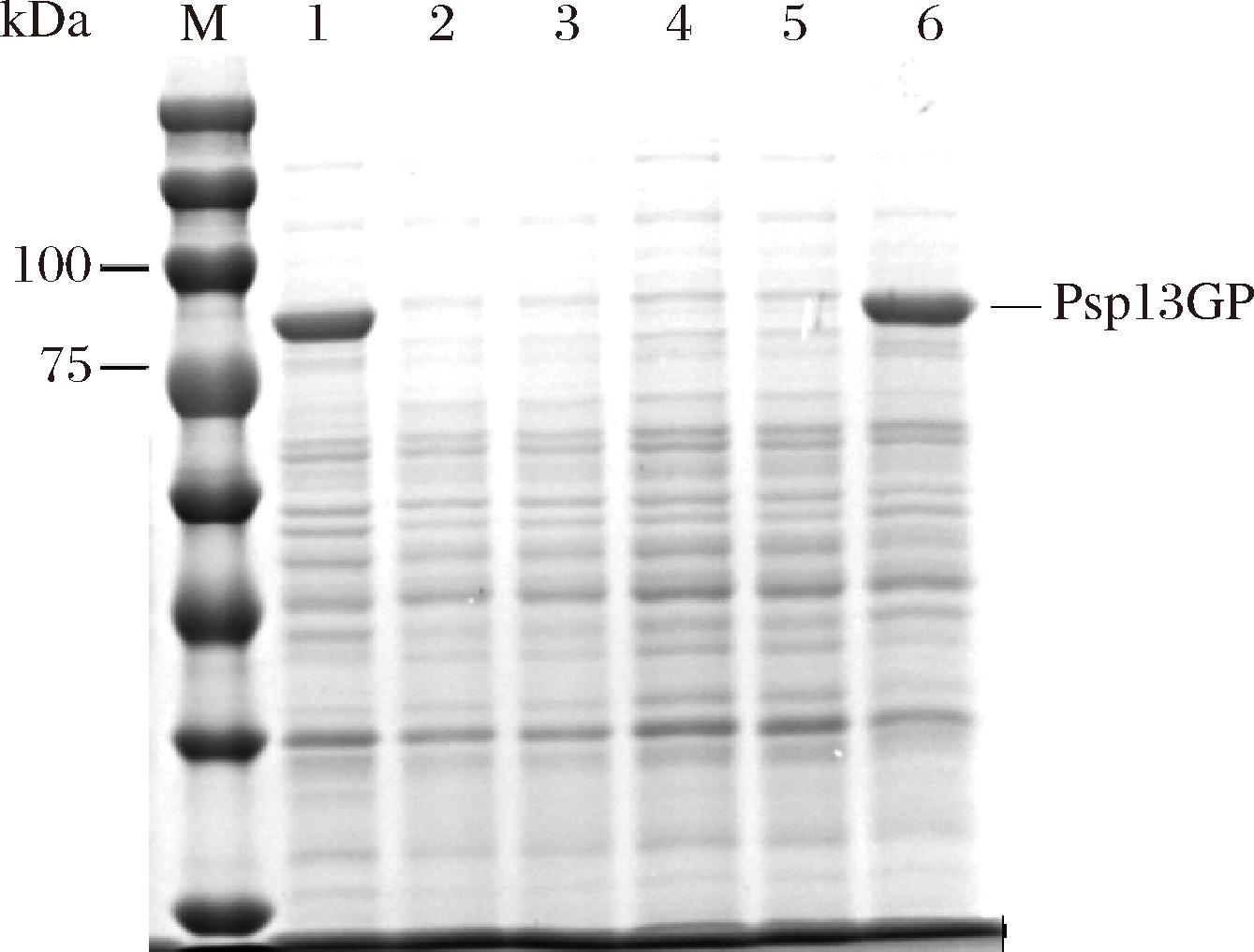
M-蛋白标准品;1-重组菌B.subtilis WS9/PUB110-Psp13GP发酵上清液;2-6-重组菌B.subtilis WS9 P1、B.subtilis WS9 P2、B.subtilis WS9 P3、B.subtilis WS9 P4、B.subtilis WS9 P5发酵上清液。
图4 含不同单启动子重组菌的摇瓶发酵SDS-PAGE分析
Fig.4 SDS-PAGE analysis of shake flask fermentation of recombinant strains with different single promoter
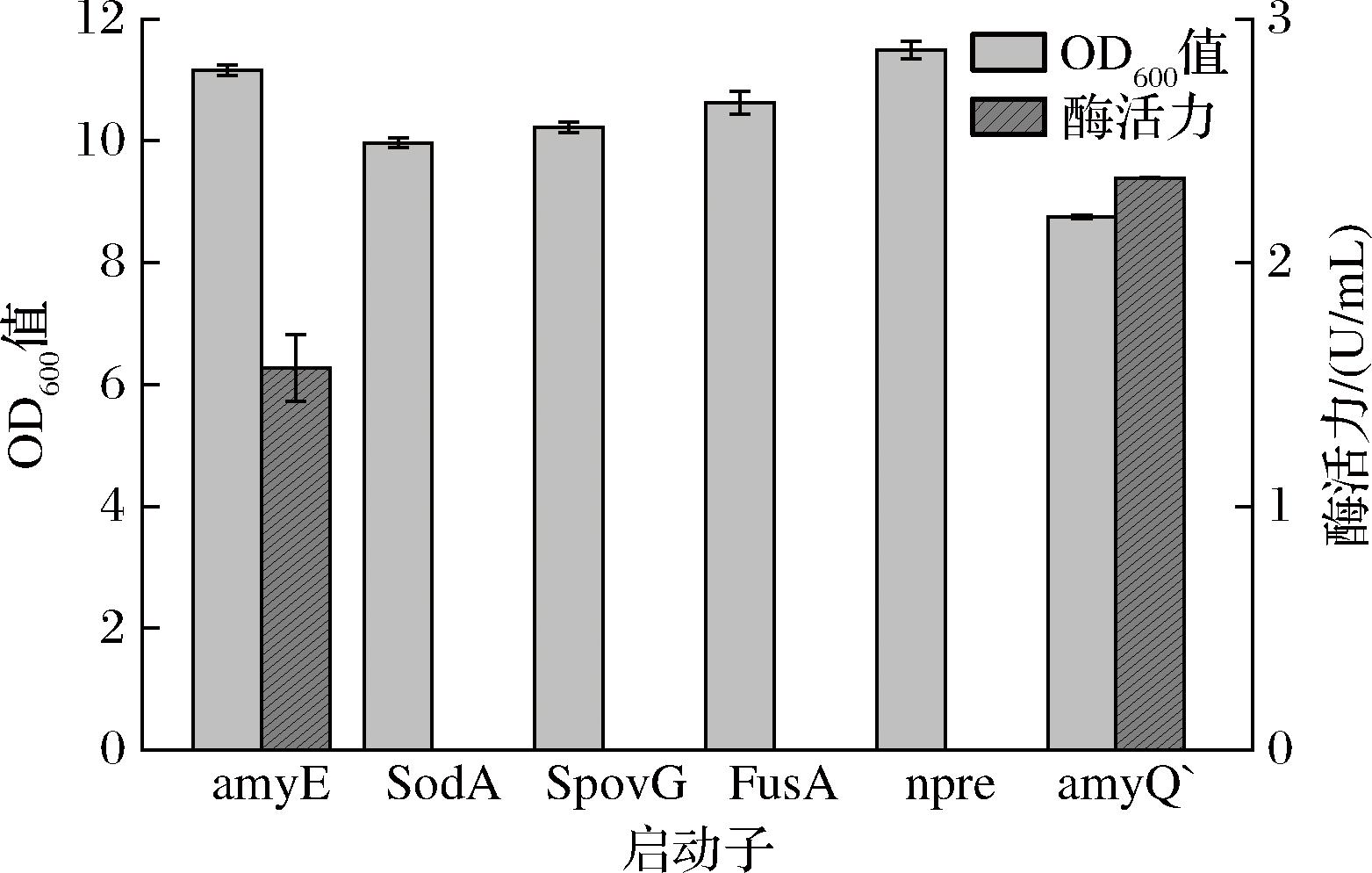
图5 含不同单启动子重组菌的摇瓶发酵情况酶活力及生长情况
Fig.5 Shake flask fermentation and growth of recombinant strain with different single promoter
2.4.2 培养基优化
首先选取10种常用的工业氮源(骨蛋白胨、大豆蛋白胨、牛肉蛋白胨、鱼粉蛋白胨、酵母浸粉、酵母浸膏、牛肉浸膏、玉米浆、豆粕粉、棉籽粉)参照发酵培养基配方进行替换,将重组菌B.subtilis WS9 P1进行摇瓶发酵,生长情况与胞内酶活力如图6所示。当以大豆蛋白胨为单一氮源时,重组菌酶活力最高达到5.56 U/mL;其次为以骨蛋白胨为单一氮源,重组菌酶活力为3.02 U/mL;以玉米浆、豆粕粉和棉籽粉为单一有机氮源时菌浓较高但酶活力低,推测可能因为培养基中存在不溶物对测量产生影响。
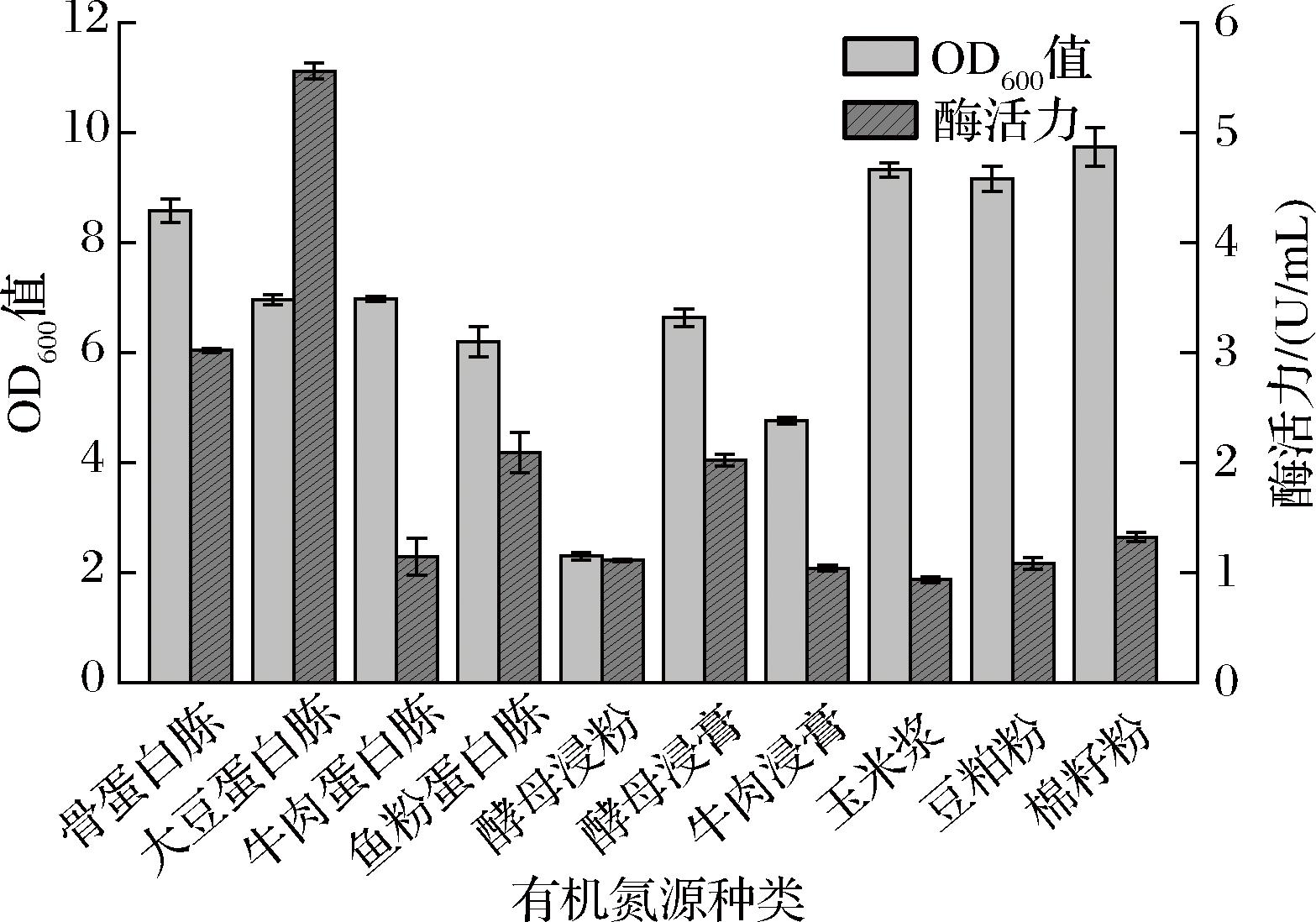
图6 单一氮源种类对重组菌生长和产酶的影响
Fig.6 Effect of single nitrogen source on the growth and enzyme production of recombinant strain
根据单一氮源种类优化结果,选取大豆蛋白胨和骨蛋白胨以质量浓度为10、20、30、40 g/L进行单一氮源浓度优化,生长情况与胞内酶活力如图7所示。当以大豆蛋白胨作为单一氮源,质量浓度10 g/L时重组菌酶活力最高,为5.38 U/mL;以骨蛋白胨作为单一氮源,质量浓度10 g/L时重组酶活力最高,为3.11 U/mL。
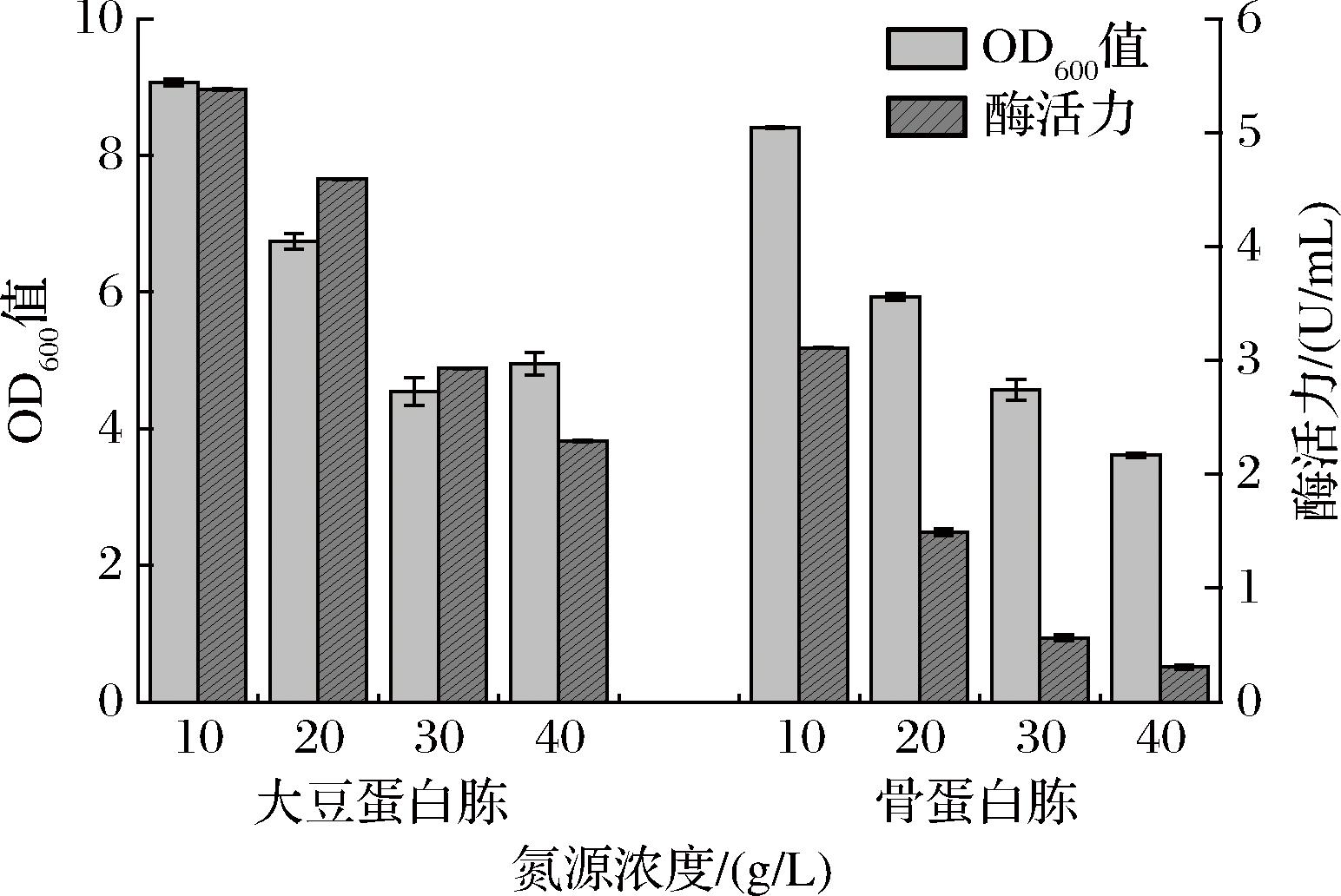
图7 单一有机氮源浓度对重组菌生长和产酶的影响
Fig.7 Effect of single organic nitrogen concentration on the growth and enzyme production of recombinant strain
根据单一有机氮源种类及浓度优化结果,选取大豆蛋白胨和骨蛋白胨分别以质量浓度10、12.5、15、17.5 g/L组合进行复合氮源优化,生长情况与胞内酶活力如图8所示。当大豆蛋白胨质量浓度为10 g/L、骨蛋白胨质量浓度为15 g/L时,重组菌酶活力最高为2.22 U/mL,低于两者作为单一氮源时的最高酶活力,因此选取10 g/L大豆蛋白胨作为氮源进行后续培养基优化。
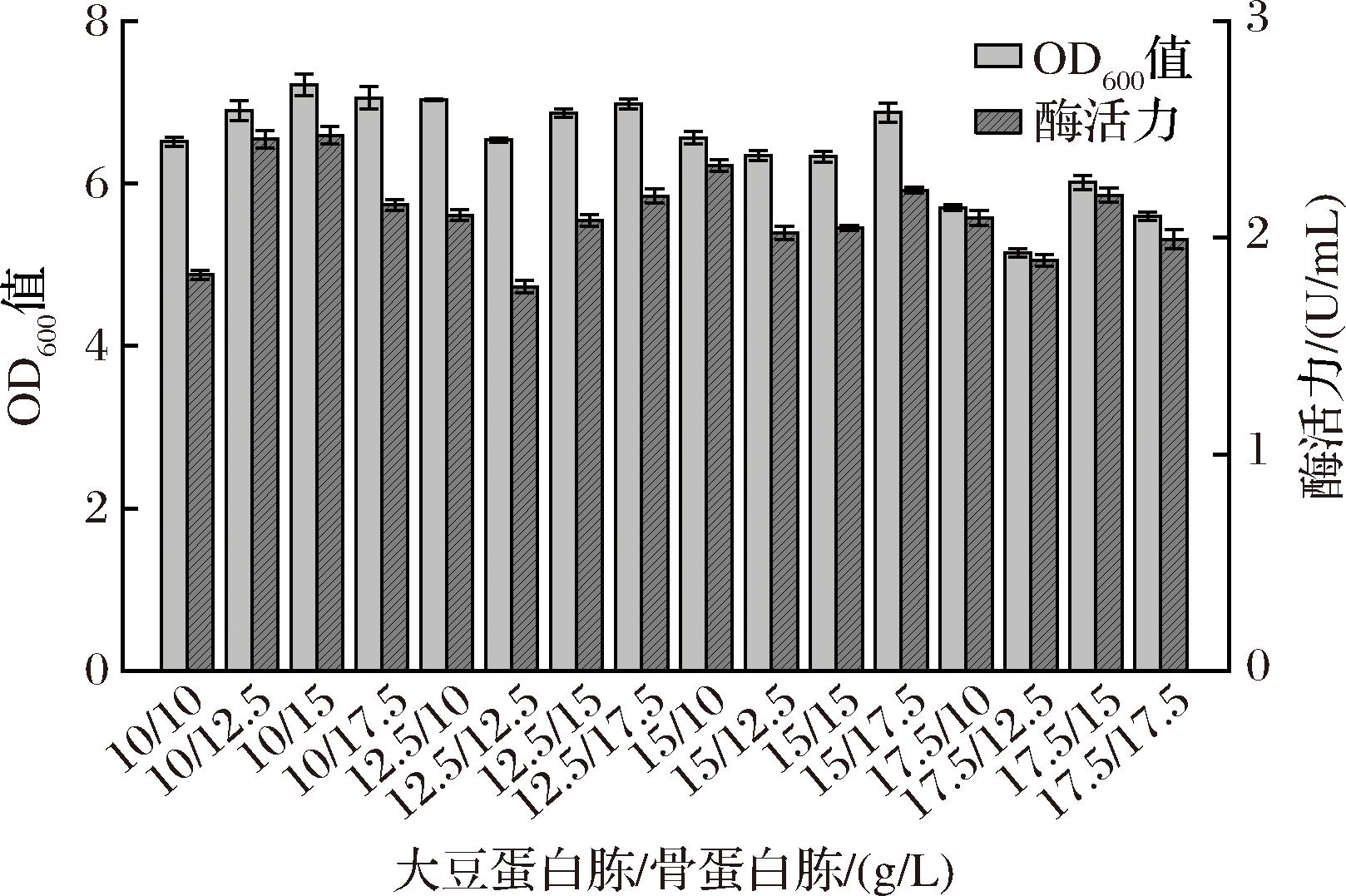
图8 复合氮源对重组菌生长和产酶的影响
Fig.8 Effect of composite nitrogen concentration on the growth and enzyme production of recombinant strain
选取甘油、葡萄糖和蔗糖作为碳源进行优化,探究碳源种类和浓度对重组菌生长和产酶的影响,结果如图9所示。当以10 g/L甘油作为碳源时,重组菌酶活力最高,为5.41 U/mL。由此得到最优培养基中氮源为10 g/L大豆蛋白胨,碳源为10 g/L甘油,酶活力达到优化前的2.30倍。

图9 碳源种类和浓度对重组菌生长和产酶的影响
Fig.9 Effects of carbon source types and concentrations on the growth and enzyme production of recombinant strain
3 结论与讨论
本研究将Paenibacillus sp.HMSSN-139来源的α-1,3-葡聚糖磷酸化酶Psp13GP在E.coli BL21(DE3)与B.subtilis WS9中进行重组表达,并测定了其逆磷酸解反应的受体特异性,发现其偏好以α-1,4糖苷键连接的糖为逆磷酸解反应受体,以单糖为受体没有逆磷酸解活性,以多糖为受体有逆磷酸解活性,与目前已有报道的α-1,3-葡萄糖磷酸化酶(黑曲霉二糖磷酸化酶)有较大差异,可以用于高聚合度α-1,3-葡聚糖的生产。使用Psp13GP与麦芽糖磷酸化酶LbMP偶联催化制备α-1,3-葡聚糖。以200 g/L麦芽糖为底物,在pH 7.0、37 ℃、磷酸盐终浓度20 mmol/L及加酶量均为0.2 mg/mL条件下,可生成聚合度3~6的α-1,3-葡聚糖,聚合度高于目前已有报道的α-1,3-葡萄糖磷酸化酶(黑曲霉二糖磷酸化酶)制备出的黑曲霉二糖(α-1,3-葡二糖);反应72 h转化率>50%,312 h转化率最高达到62.90%。
为将Psp13GP应用于食品工业,本研究将其在B.subtilis WS9中进行重组表达,但表达量较低,因此筛选出比初始启动子PamyE更强的启动子PamyQ,将酶活力提高至2.35 U/mL,是初始重组菌酶活力的1.50倍。考虑到进一步提高重组菌生产Psp13GP的能力,本研究对摇瓶发酵培养基进行了碳氮源优化,确定了最优配比为氮源10 g/L大豆蛋白胨,碳源10 g/L甘油,重组菌酶活力提高至5.41 U/mL,达到优化前的2.30倍,可以为后续3 L罐发酵提供参考。综上所述,本研究获得了一种可以用于生产较高聚合度α-1,3-葡聚糖的α-1,3-葡聚糖磷酸化酶Psp13GP,为工业化生产α-1,3-葡聚糖提供了新的可能。
[1] 王雪娇, 李杰, 何青鋆, 等. 亚健康人群身心状况评测技术的研究进展[J]. 北京生物医学工程, 2021, 40(2): 209-213. WANG X J, LI J, HE QY, et al. Research progress on evaluation technique of physical and mental status for sub-healthy population.[J]. Beijing Biomedical Engineering, 2021, 40(2): 209-213.
[2] WANG Z G, WANG S L, XU Q H, et al. Synthesis and functions of resistant starch[J]. Advances in Nutrition, 2023, 14(5):1131-1144.
[3] WEI B B, WANG L, CHEN S, et al. Differentiated digestion resistance and physicochemical properties of linear and α-1, 2/α-1, 3 branched isomaltodextrins prepared by 4, 6-α-glucanotransferase and branching sucrases[J]. Food Research International, 2023, 171:113043.
[4] YANG W K, SU L Q, WANG L, et al. Alpha-glucanotransferase from the glycoside hydrolase family synthesizes α(1-6)-linked products from starch: Features and synthesis pathways of the products[J]. Trends in Food Science &Technology, 2022, 128:160-172.
[5] RAO D M, HUO R T, YAN Z F, et al. Multiple approaches of loop region modification for thermostability improvement of 4, 6-α-glucanotransferase from Limosilactobacillus fermentum NCC 3057[J]. International Journal of Biological Macromolecules, 2023, 233:123536.
[6] KONISHI Y, SHINDO K. Production of nigerose, nigerosyl glucose, and nigerosyl maltose by Acremonium sp. S4G13[J]. Bioscience, Biotechnology, and Biochemistry, 1997, 61(3):439-442.
[7] KOBAYASHI I, TOKUDA M, HASHIMOTO H, et al. Purification and characterization of a new type of α-glucosidase from Paecilomyces lilacinus that has transglucosylation activity to produce α-1, 3- and α-1, 2-linked[J]. Bioscience, Biotechnology, and Biochemistry, 2003, 67(1):29-35.
[8] YAMAMOTO T, UNNO T, WATANABE Y, et al. Purification and characterization of Acremonium implicatum α-glucosidase having regioselectivity for α-1, 3-glucosidic linkage[J]. Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics, 2004, 1700(2):189-198.
[9] MA M, OKUYAMA M, TAGAMI T, et al. Novel α-1, 3/α-1, 4-glucosidase from Aspergillus niger exhibits unique transglucosylation to generate high levels of nigerose and kojibiose[J]. Journal of Agricultural and Food Chemistry, 2019, 67(12):3380-3388.
[10] PUANGLEK S, KIMURA S, ENOMOTO-ROGERS Y, et al. In vitro synthesis of linear α-1, 3-glucan and chemical modification to ester derivatives exhibiting outstanding thermal properties[J]. Scientific Reports, 2016, 6:30479.
[11] 李国玮, 游淳. 二糖磷酸化酶及其在体外合成生物学中的应用[J]. 食品与发酵工业, 2020, 46(21): 284-291. LI GW, YOU C. Disacphosphorylase and its application in vitro synthetic biology[J]. Food and Fermentation industries, 2020,46(21): 284-291.
[12] NIHIRA T, NAKAI H, CHIKU K, et al. Discovery of nigerose phosphorylase from Clostridium phytofermentans[J]. Applied Microbiology and Biotechnology, 2012, 93(4):1513-1522.
[13] NIHIRA T, NISHIMOTO M, NAKAI H, et al. Characterization of two α-1, 3-glucoside phosphorylases from Clostridium phytofermentans[J]. Journal of Applied Glycoscience, 2014, 61(2):59-66.
[14] BI R, WU J, SU L Q, et al. Efficient synthesis of nigerose by a novel nigerose phosphorylase from Anaerosporobacter mobilis[J]. Systems Microbiology and Biomanufacturing, 2023, 3(3):498-508.
[15] 姚动邦. Bacillus stearothermophilus α-淀粉酶在芽孢杆菌中高效胞外表达的研究[D].无锡:江南大学, 2021.YAO DB. High-efficient extracellular expression of Bacillus stearothermophilus α-amylase in genus of Bacillus[D]. Wuxi: Jiangnan University, 2021.
[16] NIHIRA T, MIYAJIMA F, CHIKU K, et al. One pot enzymatic production of nigerose from common sugar resources employing nigerose phosphorylase[J]. Journal of Applied Glycoscience, 2014, 61(3):75-80.
[17] 王逸凡. Clostridium cellulolyticum H10 D-阿洛酮糖3-差向异构酶的分子改造、表达优化及稳定性研究[D].无锡:江南大学, 2021.WANG,Y F. Molecular modification, expression optimization and stability study on D-psicose 3-epimerase from Clostridium cellulolyticum H10[D]. Wuxi: Jiangnan University, 2021.