黄酒以酒体柔软、香气淡雅、营养丰富而著称,被誉为世界三大古酒之一。在黄酒发酵过程中,麦曲不仅作为富含多种微生物和酶的发酵剂,而且作为原料为微生物提供营养,并改善黄酒的色、香、味。麦曲,主要分为生麦曲和熟麦曲[1]。传统生麦曲采用开放式培养,可以富集各种微生物,产生大量的酶和风味物质,赋予黄酒独特的风味[2]。熟麦曲是一种普遍应用于机械化生产的麦曲。虽然酶活力很高,但酿造出来的黄酒风味相对单一。目前机械化生产的黄酒除添加生麦曲外,还加入少量的熟麦曲,以保证发酵黄酒的质量。黄曲霉SU-16是一种功能菌株,已广泛应用于麦曲的机械化生产[3]。虽然对黄曲霉SU-16的富集培养能够保证麦曲的质量,但会导致黄酒的醇厚风味和口感不足。因此,选择具有特定功能的多菌种发酵麦曲,对提高黄酒品质具有重要意义。
近年来,使用培养依赖性和非培养依赖性的方法分析接种小麦曲中的功能微生物得到了广泛的研究[4]。LIU等[5]使用单分子实时DNA测序技术从小麦曲中鉴定出77个菌种,通过培养依赖法分离出30个菌种,并以极高的精度阐明了其中的主要功能微生物,这对黄酒生产和质量控制具有重要意义。MAD等[1]接种Saccharopolyspora发酵生麦曲,不仅提高了生麦曲的糖化和液化力,而且降低了黄酒中苦味氨基酸的含量。虽然纯种发酵可以提高麦曲品质的稳定性,但酿造出来的黄酒味道可能相对单一。针对纯种发酵技术造成的麦曲和发酵饮料品质不足的问题,大量研究试图通过利用多菌种共发酵技术解决这一问题。YU等[6]选取了3株菌株制备熟麦曲,使熟麦曲中淀粉酶、纤维素酶和酸性蛋白酶活力得到提高,同时黄酒的酒精和游离氨基酸含量也得到了显著的提高。目前,虽然对麦曲的微生物群落结构及核心微生物已有了大量的研究,但关于功能微生物在这方面的深入应用研究还很缺乏。
阿魏酸(ferulic acid,FA)已被证明具有一系列有益特性,包括抗氧化、抗病毒、抗炎和血管增强作用[7]。黄酒中的FA含量约为0.57~3.98 mg/L,主要来源于麦曲和原料[8]。例如,糯米中包含多酚和氨基酸等活性化合物[9]。结合形式的FA在麦麸中含量丰富[10]。毛健等[11]从麦曲中筛选出1株分泌阿魏酸酯酶的假单胞菌并应用于强化麦曲和黄酒的制备,可使黄酒中的FA含量达到7.62 mg/L。虽然FA被广泛地研究和应用,但对酒中FA的研究仅集中在追踪其含量的动态变化上,而对提高黄酒中FA含量以及FA转化产生的挥发性化合物对黄酒风味的贡献研究却很少。因此,本研究的主要目的是优化接种草酸青霉菌M1816制备块曲的工艺条件,提高块曲的糖化和液化力;研究假单胞菌A-4H和草酸青霉菌M1816制备的强化块曲产阿魏酸酯酶的能力以及探讨强化块曲对黄酒FA及风味的影响。
1 材料与方法
1.1 材料与试剂
菌株:草酸青霉菌M1816(资源平台号:RWBL Y1906 SHL)及酿酒酵母HJ(资源平台号:RWBL M1816 WRG)于本实验室菌株库保存。
试剂:2-辛醇、无水乙醇、氢氧化钠、色谱级甲醇、色谱级乙腈、乙酸、盐酸,国药集团化学试剂有限公司;福林酚试剂,上海泰坦科技股份有限公司;小麦、麸皮,无锡农贸市场;传统生麦曲(RWQ)、熟麦曲(CWQ),浙江绍兴古越龙山公司。
1.2 仪器与设备
Varioskan Flash全自动酶标仪、Trace1300 ISO气相色谱-质谱联用仪,赛默飞世尔科技(中国)有限公司;SHB-B95循环水式多用真空泵、DLSB低温冷却液循环泵、CR21 N落地式低温高速离心机,日本工机控股株式会社;FE20 pH计,梅特勒-托利多仪器有限公司;ZXGP-B2080电热恒温水浴锅,上海智城分析仪器制造有限公司;总酸和氨基酸态氮自动滴定仪,配置雷磁SCH-01型自动样品进样器、ZDJ-5B自动滴定仪,上海仪电科学仪器股份有限公司;1100高效液相色谱仪,美国安捷伦公司。
1.3 实验方法
1.3.1 块曲的制作工艺流程及工艺参数优化
真菌孢子悬浮液的制备:将草酸青霉菌M1816接种于PDA固体培养基上,28 ℃培养60 h后,使用接种环将草酸青霉菌M1816的孢子转移到新的PDA固体培养基上。28 ℃培养60 h后,用8.5 g/L的无菌NaCl溶液刮去孢子并重悬孢子。用计数板将孢子浓度调整为106个/mL[12]。
块曲的制作流程:在实验室进行手工块曲的制作,其工艺流程如图1所示,工艺控制参数参考周志立等[13]的方法并根据预实验略有修改[14]。按照表1所述参数在培养箱中对块曲进行发酵。
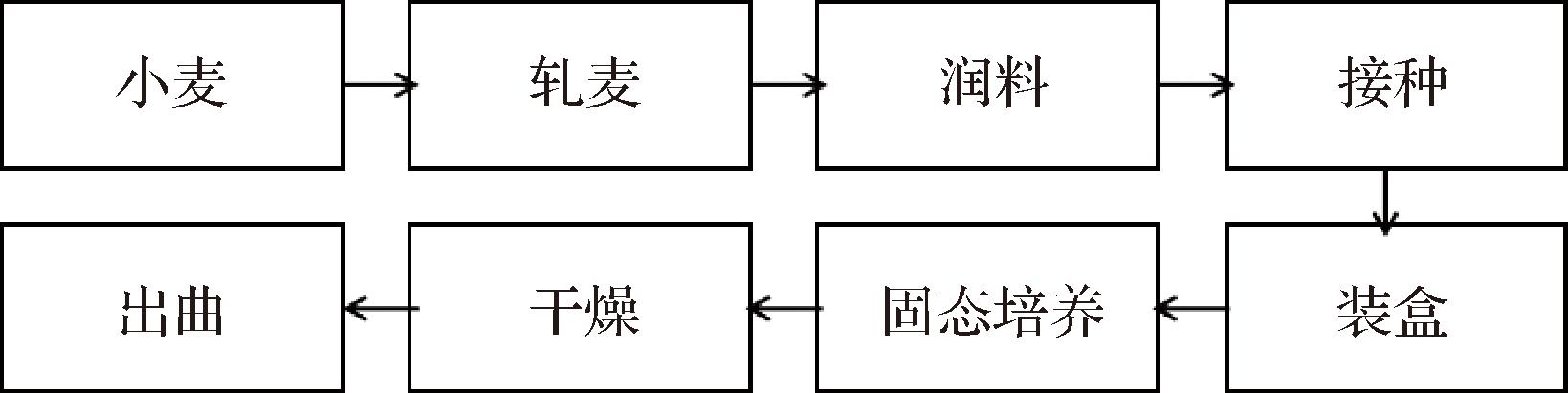
图1 块曲的制作流程
Fig.1 The manufacturing process of block Qu
表1 块曲生产的控制参数
Table 1 Control parameters of the production of block Qu
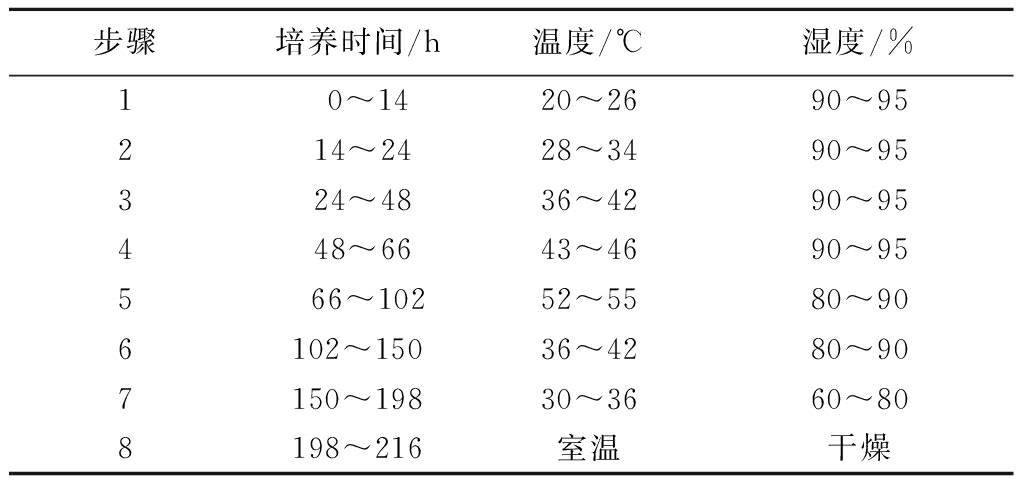
步骤培养时间/h温度/℃湿度/%1 0~1420~2690~952 14~2428~3490~953 24~4836~4290~954 48~6643~4690~955 66~10252~5580~906102~15036~4280~907150~19830~3660~808198~216室温干燥
块曲接种工艺的优化:为获得块曲的最佳接种工艺,采用麸皮添加量[(3%、5%、7%、9%、11%)、草酸青霉菌M1816接种量(4%、6%、8%、10%、12%)、润料水温(50、60、70、80、90 ℃)和总含水量(34%、36%、38%、40%、42%)]4个因素进行块曲的制作,通过测定糖化力和液化力来评价最佳接种工艺参数。
在单因素试验的基础上,采用麸皮添加量(7%、9%、11%)、接种量(4%、6%、8%)和总含水量(34%、36%、38%)3个自变量进行Box-Behnken设计,并采用响应面法进行优化。设计了四因素三水平的响应面试验,各试验因素水平见表2。
表2 测定糖化力和液化力的Box-Behnken试验因素和水平
Table 2 Factor and level of the Box-Behnken experiment for determining glucoamylase and amylase activities

因素水平-101麸皮添加量/%7911接种量/%468水分含量/%343638
1.3.2 块曲酶活力的测定
糖化力和液化力按前人研究方法测定[5]。简单地说,研磨后的5 g块曲用100 mL醋酸-醋酸钠缓冲液(pH=4.6 0.1 mol/L)在40 ℃下提取1 h,然后在4 ℃下10 000 r/min离心10 min,取上清液得到粗酶液,测定酶活力。采用高效液相色谱法,Athena C18-WP(250 mm×4.6 mm,5 μm),柱温32 ℃,流动相A:1%(体积分数)乙酸水;流动相B:纯乙腈,流速1 mL/min,检测波长320 nm测定FA及其他酚酸化合物的含量。纤维素酶和木聚糖酶活力的测定参照ZHANG等[8]的方法。
1.3.3 菌株的筛选与鉴定
筛选培养基组成:阿魏酸酯酶固体筛选培养基(g/L):NaCl 0.3,(NH4)2SO4 1.3,K2HPO4 0.3,MgSO4·7H2O 0.3,琼脂18,115 ℃灭菌20 min,冷却后加入15 mL阿魏酸乙酯[10% (体积分数)溶于N,N-二甲基甲酰胺],摇匀。阿魏酸酯酶液体筛选培养基:在固体筛选培养基的基础上不添加琼脂。
初筛:将麦曲粉碎后,准确称取10.0 g,加入90 mL灭菌后的LB液体培养基,28 ℃培养4 h。将富集菌液摇匀,加无菌水梯度稀释。在固体筛选培养基中分别加入103、104、105 3种稀释浓度(各200 μL)的富集菌液进行涂布,在30 ℃恒温培养箱中培养5 d,观察固体筛选培养基是否产生水解透明圈。
复筛:将上述能够产生水解透明圈的菌株接种于LB液体培养基中,37 ℃孵育48 h,调整菌液OD600值至0.8,接种量为4%,接种于96深孔板中,37 ℃,600 r/min孵育36 h。96孔板内容物:阿魏酸酯酶液体筛选培养基。
菌株的鉴定:筛选菌株的DNA采用十六烷基三甲基溴化铵法提取[15]。细菌通用引物27F/1492R(27F:5′- agagtttgatcctggctag-3′;利用1492R:5′- tacggttaccttgttacgtt -3′)扩增筛选菌株的16S rRNA基因,利用MEGA11软件生成系统发育树。
1.3.4 菌种共培养对块曲阿魏酸酯酶活力的影响
在块曲制备过程中加入不同比例的草酸青霉菌M1816孢子悬浮液和筛选菌株的次级种子液,总接种量为6%(经上述工艺优化的接种量)。草酸青霉菌M1816的浓度为106个/mL,细菌种子液浓度106 CFU/mL,其他条件不变。
1.3.5 实验室模拟黄酒发酵条件
按照刘娅等[16]的方法制备大米糖化溶液,黄酒发酵剂。其中,黄酒配料表在刘娅等[16]的基础上略有修改,修改后的黄酒配料如表3所示。
表3黄酒配料表
Table 3 Ingredients list of Huangjiu
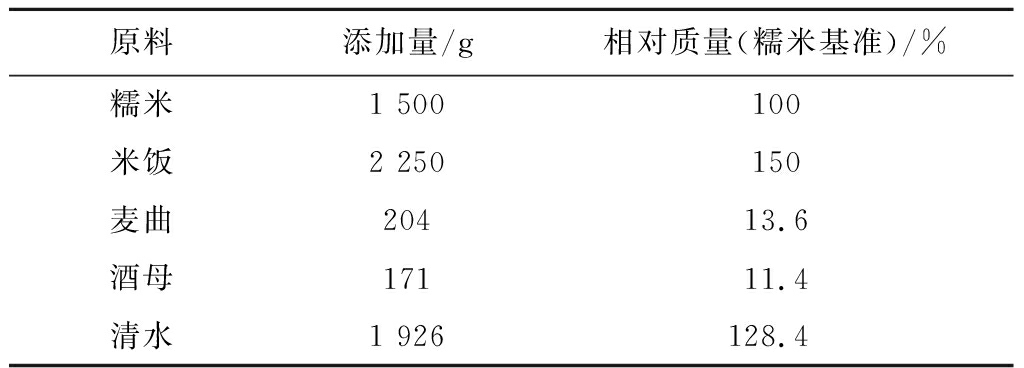
原料添加量/g相对质量(糯米基准)/%糯米1 500100米饭2 250150麦曲20413.6酒母17111.4清水1 926128.4
1.3.6 黄酒理化指标及风味的测定
酸度和氨基态氮的含量使用滴定法测定[17]。用蒸馏法测定黄酒中酒精含量,还原糖的测定采用二硝基水杨酸法[18]。采用HPLC测定黄酒中有机酸的含量以及采用柱前衍生化法及HPLC测定游离氨基酸的含量[19]。采用顶空固相微萃取法(head space solid-phase micro extraction,HS-SPME)提取黄酒中的挥发性成分,随后采用GC-MS进行分析[1]。
1.3.7 统计与分析
采用SPSS软件(v25.0)和Origin 2023,64 Bit进行统计分析。采用瑞典Umetricus公司的SIMCA 13.0软件对风味化合物数据进行主成分分析(principal components analysis,PCA)、正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)和重要变量性投影(variable importance in projection,VIP)鉴定。
2 结果与分析
2.1 不同发酵参数对块曲糖化力和液化力的影响
在传统发酵食品研究中,温度和湿度是最常用的控制参数。参考相关文献[13],基于恒温恒湿通风制曲工艺进行模拟,根据预实验结果,采用表1的控制参数进行发酵。在工艺上,采用控温控湿发酵,可以实现特定指标的工艺控制。在时间上,块曲的发酵时间约为8~10 d,相较于传统曲、机制曲的发酵时间略有缩短[20]。
开放式的发酵环境对麦曲中微生物的种类和数量影响很大。麸皮中的各种营养物质有助于微生物的生长。随着麸皮添加量的增加,块曲的糖化力和液化力显著提高(P<0.05),在添加9%麸皮制备块曲的糖化力和液化力比添加3%麸皮的块曲分别提高了1.52倍和2.11倍(图2-a)。曹振华等[21]发现添加2%~8%的麸皮有助于提高泸州大曲的液化力和发酵力。添加11%麸皮制作块曲,培养后块曲表面出现明显的开裂现象,对块曲质量产生负面影响。接种量对微生物生长和酶产量有重要影响。YU等[6]在研究接种量对麦曲液化力的影响时发现,过高的接种量可能会导致麦曲内真菌生长速度加快,而有限的原料养分可能会阻碍微生物酶的分泌,在这项研究中同样发现过高的接种量会导致块曲的液化力下降。当接种量为6%时,糖化力为(1 467.94±121.71) U/g,液化力为(1.64±0.11) U/g(图2-b)。当接种量超过8%时,块曲的糖化和液化力均显著下降。在70 ℃和80 ℃的润料水温下,块曲的糖化、液化力达到最高水平,且两者之间无显著差异(P>0.05),因此,制备块曲的润料水温设定在70~80 ℃(图2-c)。水是微生物生长的必要因素之一,直接关系到酶的产生、块曲发酵的温度和高温发酵的持续时间[22]。MA等[23]的研究认为水分是影响浓香型大曲微生物数量和群落演替的关键因素。随着总含水量的增加,糖化力总体呈下降趋势,当总含水量为36%时,糖化力达到最大值,为(1 447.64±124.31) U/g。然而,随着总含水量的增加,液化力呈上升趋势(图2-d)。

a-麸皮添加量;b-接种量;c-润料水温;d-总含水量
图2 不同发酵参数对块曲酶活力的影响
Fig.2 Effects of different fermentation parameters on the enzyme activity of block Qu
注:不同小写字母表示差异显著(P<0.05)(图5与图7-a同)。
2.2 发酵条件的优化与验证
单因素试验结果表明,麸皮添加量、接种量和总含水量对块曲糖化、液化力有显著影响,采用Box-Behnken设计和响应面法相结合的方法确定了最佳工艺参数。相关系数(R2)分别为0.977 5和0.991 9,表明回归模型对糖化力和液化力的预测是可靠的。根据响应面设计实验及结果(图3-a),通过对响应函数Yi的多元回归分析和拟合,发现如下二阶多项式方程可以充分描述酶的活力:
Y1/(U/g)=1 433.38+51.17A-44.24B-78.71C-21.95AB-11.40AC+42.27BC-120.45A2-112.18B2-144.33C2
Y2/(U/g)=1.65+0.072 1A-0.108 2B-0.169 3C-0.076 7AB+0.005 1AC-0.037 5BC-0.090 9A2-0.205 5B2-0.324 0C2
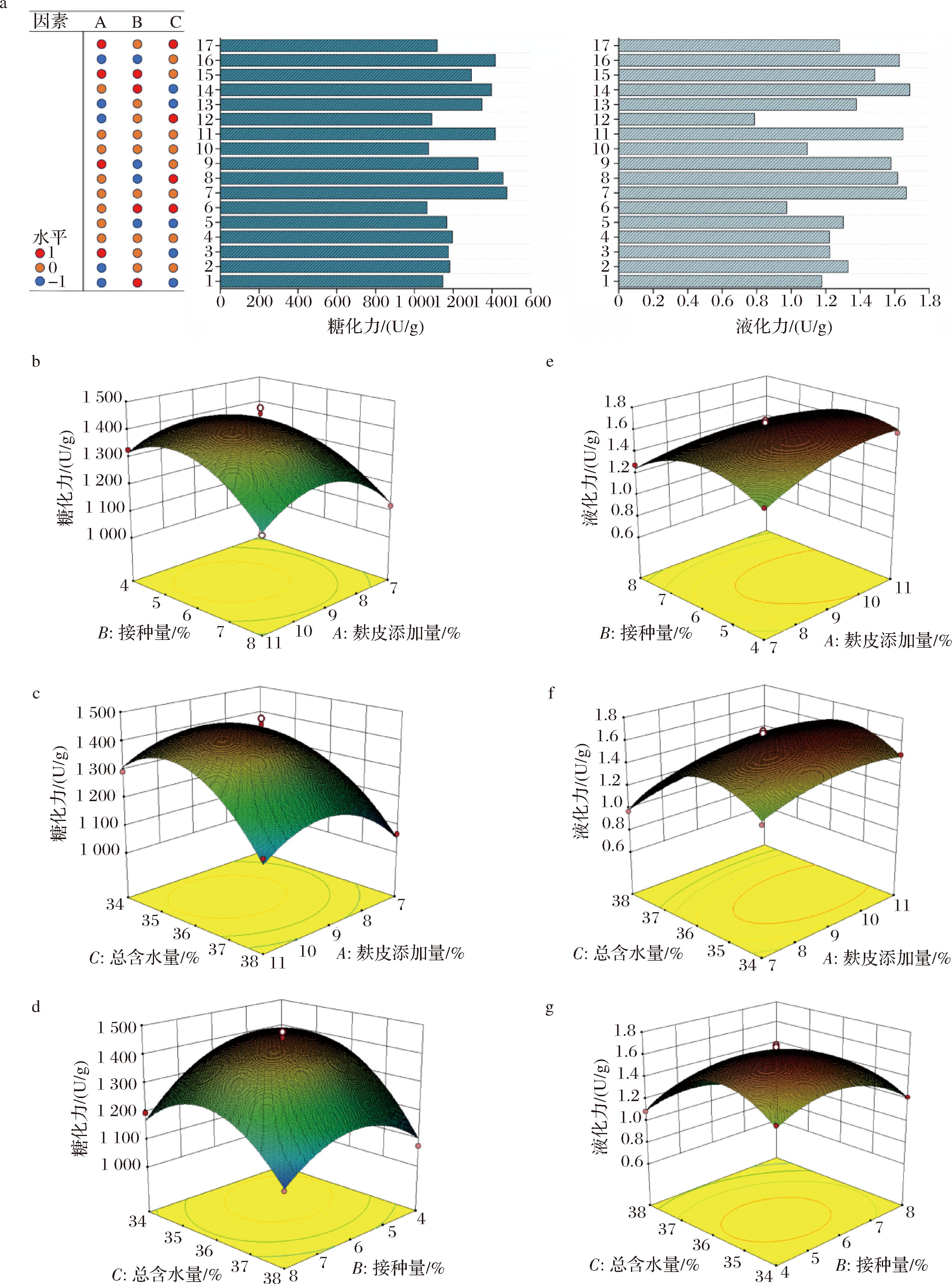
a-Plackett-Burman试验组合设计及结果;b~g-麸皮添加量、接种量、总含水量对块曲糖化、液化力的等高线图
图3 Box-Behnken试验设计结合响应面对块曲糖化、液化力的优化
Fig.3 Box-Behnken test design combined with response surface optimization of glucoamylase and amylase activities of block Qu
式中:Y1为糖化力;Y2表示液化力,A为麸皮添加量,%;B为接种量,%;C为总含水量,%。
P值(PY1=0.496 6,PY2=0.215 3)与模型(PY1<0.000 1,PY2<0.000 1)缺乏拟合,说明实际对应的糖化力与液化力与模型拟合较好(表4)。在回归方程中,Y1的一级项A、B、C和二级项A2、B2、C2对糖化力有显著影响(P<0.05)。回归方程中Y2的一级项B、C和二级项B2、C2对液化力有极显著影响(P<0.000 1),说明与麸皮添加量相比,总含水量和接种量是影响麦曲液化力的关键因素。通过三维响应面图(图3-b~图3-g)展示了不同独立制备参数组合下块曲的糖化和液化力。曲线轮廓表明麸皮添加量、总含水量和接种量之间存在显著的相互作用。从图3-d中可以看出,总含水量和接种量对应的三维响应面曲率随着因子的变化而快速变化,说明这2个因子的交互作用对糖化力有显著影响。
表4 中心复合实验设计实验结果的方差分析
Table 4 Analysis of variance of the experimental results of the central composite experimental design
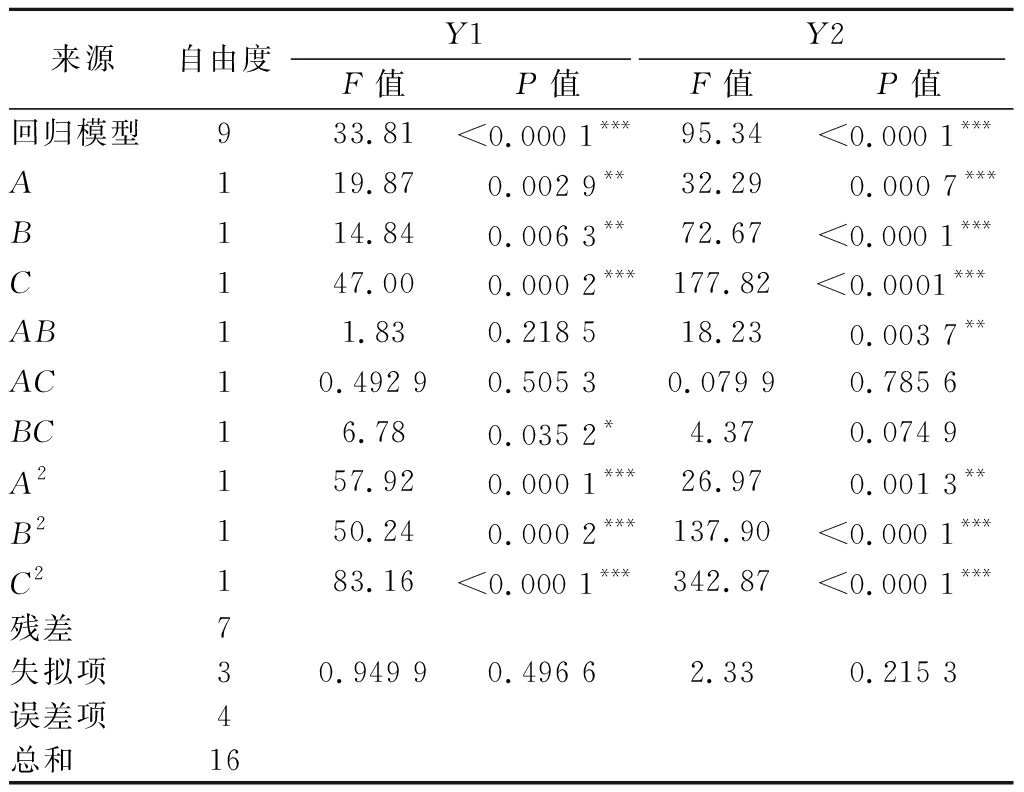
来源自由度Y1Y2F值P值F值P值回归模型933.81<0.000 1***95.34<0.000 1***A119.870.002 9**32.290.000 7***B114.840.006 3**72.67<0.000 1***C147.000.000 2***177.82<0.0001***AB11.830.218 518.230.003 7**AC10.492 90.505 30.079 90.785 6BC16.780.035 2*4.370.074 9A2157.920.000 1***26.970.001 3**B2150.240.000 2***137.90<0.000 1***C2183.16<0.000 1***342.87<0.000 1***残差7失拟项30.949 90.496 62.330.215 3误差项4总和16
注:*0.01<P<0.05;** 0.001<P<0.01;*** P<0.001。
2.3 最佳工艺条件验证
在麸皮添加量为9.6%、接种量为5.7%、总含水量为35.4%的条件下,预测糖化力和液化力分别为1 454.06 U/g和1.69 U/g。根据实际操作条件,将麸皮添加量、接种量和总含水量分别调整为9.5%、6%和35.5%。在调整后的工艺条件下,糖化力为(1 521.24±32.28) U/g,液化力为(1.71±0.03) U/g。糖化力和液化力分别比优化前提高了43%和56%。
2.4 产阿魏酸酯酶菌株的筛选和鉴定
在固体筛选培养基上筛选57株菌株,将产生水解透明圈的菌株接种于液体筛选培养基上36 h,测定FA含量。当以阿魏酸乙酯作为唯一的碳源时,菌株A-4H与其他菌株相比具有优异的产阿魏酸酯酶的能力,36 h后可产生(153.79±2.36) mg/L FA(图4-a)。此外,菌株A-10、S-b、M-6和A-1 h也具有较好的产阿魏酸酯酶能力。
序列经NCBI数据库比对,细菌A-4H属于假单胞菌(图4-b)。

a-57株菌产FA能力;b-菌株A-4H系统发育树的构建
图4 产FA菌株的筛选及鉴定
Fig.4 Screening and identification of FA-producing strain
2.5 菌株共培养对块曲阿魏酸酯酶活力的影响
根据之前的研究对草酸青霉菌M1816进行了全基因组测序,并对其功能基因进行了深入分析[8]。结果表明,该菌株还具有降解阿魏酸酯的能力,从而产生FA。通过上述研究,将草酸青霉菌M1816应用于块曲的制备,优化工艺条件提高了块曲的糖化力和液化力。为进一步提高块曲的阿魏酸酯酶活力,采用阿魏酸酯酶产量较高的菌株(A-4H、A-10、S-b、M-6、A-1H)作为生物强化剂制备块曲,研究强化块曲的阿魏酸酯酶活力、糖化力和液化力的变化。
首先,将草酸青霉菌与筛选菌株的接种体积比调整为2∶1(总接种量为6%)制备块曲,由图5-a可知,块曲糖化和液化力均有一定程度的降低。与只接种草酸青霉菌M1816(对照组)制备的块曲相比,MM-6、MA-10和MS-b的糖化和液化力显著降低,MA-4H和MA-1H 3组间的液化力无显著差异(P>0.05)。然而,MA-4H和MA-10的阿魏酸酯酶活力显著高于对照组。因此,选择菌株A-4H作为生物强化剂和草酸青霉菌M1816制备块曲,并对接种比例进行优化。
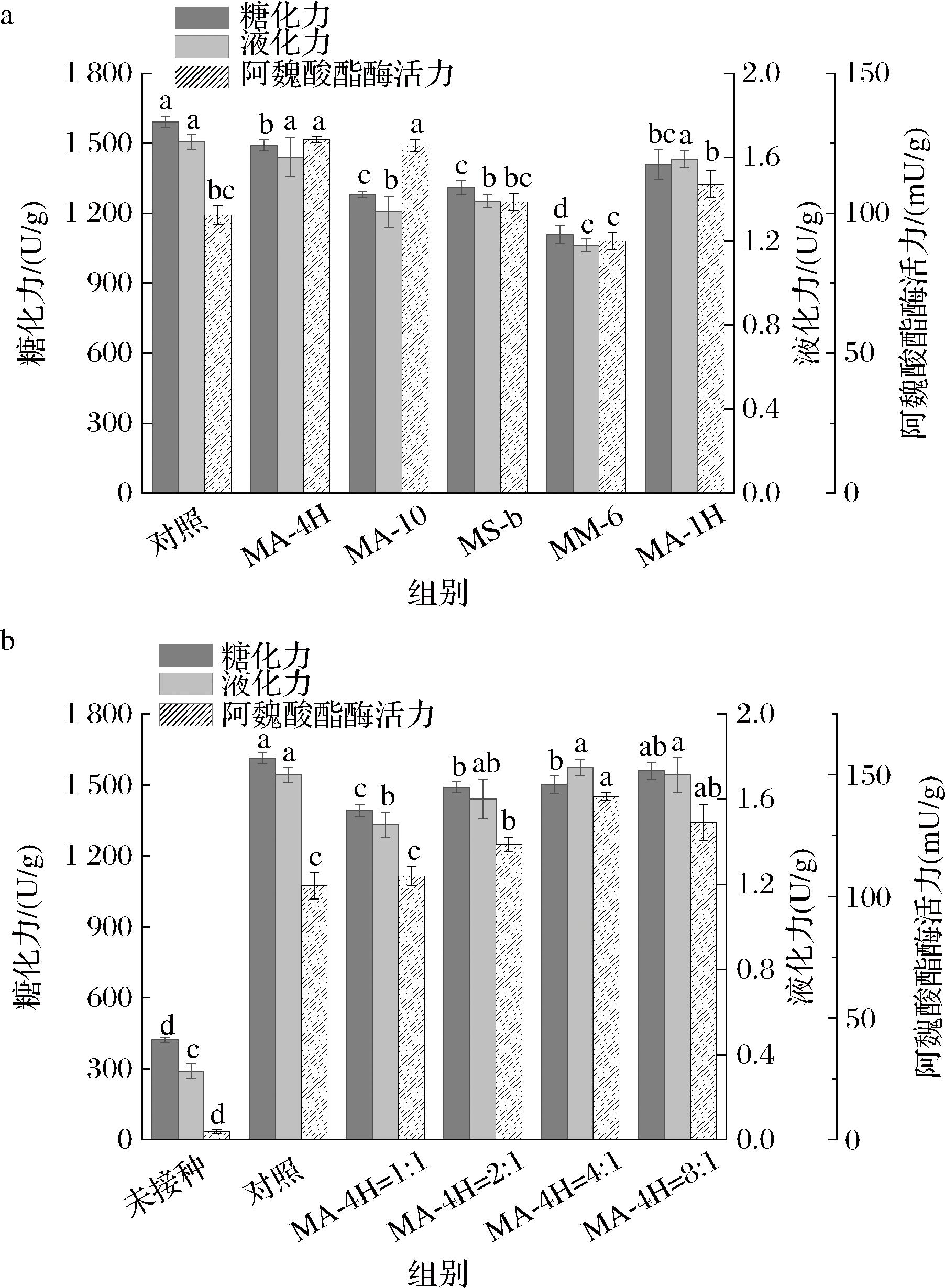
a-不同菌株作为强化剂对块曲酶活力的影响;b-草酸青霉菌M1816与假单胞菌A-4H接种比例的优化
图5 微生物强化对块曲酶活性质的影响
Fig.5 Effect of microbial fortification on the enzyme activity of block Qu
由图5-b可以观察到随着A-4H接种比例的增加,块曲的糖化液化力随之降低,阿魏酸酯酶活力先升高后降低。当接种比例为4∶1时,阿魏酸酯酶活力为(141.08±1.59) mU/g比Control组提高了36%。此外,未接种微生物的块曲也具有一定的糖化液化力,可能是周围环境或原料中的微生物也具有分泌这些酶的能力[24]。随后,黄酒发酵实验采用M1816:A-4H接种比例为4∶1制备的块曲。
2.6 黄酒理化指标的测定
为了分析强化块曲及传统麦曲对发酵黄酒的影响,检测了麦曲及发酵黄酒的理化指标。强化块曲(Group)是经工艺优化且接种比例为M1816:A-4H=4∶1的块曲。对照块曲(Control)是经工艺优化只接种M1816的块曲。首先,测定了用于黄酒发酵的4种麦曲的水分含量及酶活力如表5所示。在发酵结束后,手工块曲的水分含量与传统熟麦曲的水分含量无显著差异(P>0.05),约13%,而RWQ水分含量最低约12.4%。RWQ、Group和Control的糖化力显著高于CWQ,而CWQ的液化力显著高于其他3种麦曲。
表5 麦曲的酶活力比较
Table 5 Comparison of enzyme activity of wheat Qu
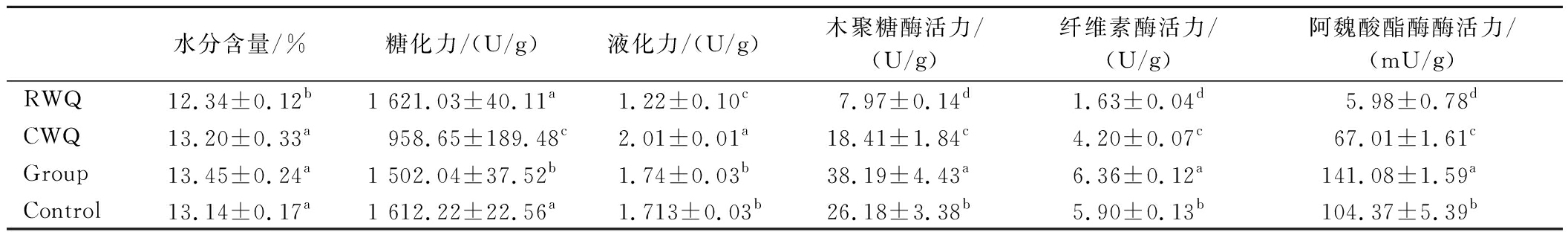
水分含量/%糖化力/(U/g)液化力/(U/g)木聚糖酶活力/(U/g)纤维素酶活力/(U/g)阿魏酸酯酶酶活力/(mU/g)RWQ12.34±0.12b1 621.03±40.11a1.22±0.10c7.97±0.14d1.63±0.04d5.98±0.78dCWQ13.20±0.33a958.65±189.48c2.01±0.01a18.41±1.84c4.20±0.07c67.01±1.61cGroup13.45±0.24a1 502.04±37.52b1.74±0.03b38.19±4.43a6.36±0.12a141.08±1.59aControl13.14±0.17a1 612.22±22.56a1.713±0.03b26.18±3.38b5.90±0.13b104.37±5.39b
注:数值表示为“平均值±标准差”(n=3);同一列不同字母表示差异有统计学意义(P<0.05)(表6同)。
此外,Group的阿魏酸酯酶活力为141 mU/g,约为RWQ的24倍,CWQ的2.1倍,Control的1.4倍。麦皮和麦麸中含有大量的FA并通过醚键和酯键与纤维素、半纤维素和木质素交联[25]。测定了4种麦曲的纤维素酶和木聚糖酶活力。结果显示,Group的纤维素酶和木聚糖酶活力显著高于Control(P<0.05)。这可能因为假单胞菌A-4H表现出分泌这些酶的能力,或者这2种菌株的共发酵提高了酶的产量。这也解释了在随后的黄酒发酵试验中,两组间FA含量差异显著的原因。
4种麦曲酿造黄酒的酒精度、酸度、氨基态氮及还原糖的含量如表6所示。糖是酒精发酵的重要底物。CWQ还原糖最低,约为5~7 g/L,但酸度最高。这种现象可能是在黄酒发酵的早期阶段,由于CWQ的液化力最高,产生了更多的单糖,然后酵母利用这些单糖产生游离酸[26]。此外,CWQ的酒精含量最高,约为17%vol。研究表明,液化力与发酵酒的酒精含量呈正相关。Group和Control的酒精含量约16%,两组间差异不显著(P>0.05)。黄酒中的氨基态氮主要来源于大米中的蛋白质水解和酵母的自溶,也是评价黄酒品质的重要指标。氨基态氮含量以Control最高,其次为Group和CWQ,RWQ最低。
表6 麦曲发酵黄酒的基本理化指标
Table 6 Basic physical and chemical indexes of Huangjiu fermented with wheat Qu

酒精度/%vol酸度/(g/L)氨基态氮/(g/L)还原糖/(g/L)RWQ13.83±0.20c4.83±0.23c0.38±0.01c7.39±0.36bCWQ17.00±0.21a7.41±0.18a0.41±0.03b5.46±0.90cGroup15.90±0.20b6.10±0.52b0.42±0.01b9.81±1.44aControl16.03±0.34b6.52±0.46b0.46±0.02a6.76±0.85bc
黄酒发酵过程中FA的动态变化如图6-a所示。4组黄酒发酵过程中FA含量的变化趋势大致相同,均呈现先快速增加后下降最后趋于稳定的趋势,这与ZHANG等[8]研究的结果一致。黄酒发酵早期FA含量的快速增加可能是参与发酵过程的微生物产酶作用导致小麦和麸皮细胞壁的降解,这导致酚类化合物的快速释放,或者产生乙醇和其他化合物又导致酚类化合物的持续溶解。发酵后期FA浓度呈逐渐下降趋势,随后趋于稳定,这种现象可能归因于酚类化合物与次级代谢物(包括蛋白质和多糖)的聚合[27]。在发酵第5天,Group的FA含量最高,为(29.36±1.11) mg/L,发酵结束时为(23.17±0.80) mg/L。发酵第20天,Group的FA含量分别是RWQ、CWQ和Control的31.31倍、2.81倍和1.64倍。结果表明,强化块曲能够有效提高黄酒中FA的含量。
氨基酸不仅赋予黄酒甜、咸、苦、辣的口感,而且是黄酒中众多风味化合物的前体。由图6-b可以发现黄酒CWQ的游离氨基酸含量高于其他3种麦曲酿造的黄酒。YU等[6]同样发现,由熟麦曲酿造黄酒的游离氨基酸含量高于生麦曲酿造的黄酒,多菌种接种的麦曲高于单菌种接种的麦曲。Group比Control产生更多的丙氨酸和精氨酸,增强了黄酒的鲜味和甜味。有机酸对黄酒的味道、颜色和风味起着重要的决定作用[28]。如图6-c所示,在4组黄酒中,乳酸是含量最高的有机酸,其次是柠檬酸,这可能是由同一酵母菌发酵黄酒引起的。Group有机酸含量约为RWQ的1.47倍。黄酒中有机酸含量的差异可能是由麦曲中不同功能菌株引起的。此外,微生物在发酵过程中对低分子质量糖的消耗有助于黄酒中有机酸含量的增加[29]。低分子质量酚类化合物不仅影响黄酒的味道,而且还具有健康益处。![]() 等[30]发现酚酸,如香豆酸、原儿茶酸、香草酸和丁香酸,是最有可能具有抗血压特性的候选物质。此外,有研究表明,对香豆酸、咖啡酸、没食子酸和原儿茶酸在葡萄酒中具有涩味和微苦的诱导作用[31]。如图6-d所示,本研究中强化块曲能够有效提高黄酒中FA含量,并可能在微生物作用下转化为其他酚酸。
等[30]发现酚酸,如香豆酸、原儿茶酸、香草酸和丁香酸,是最有可能具有抗血压特性的候选物质。此外,有研究表明,对香豆酸、咖啡酸、没食子酸和原儿茶酸在葡萄酒中具有涩味和微苦的诱导作用[31]。如图6-d所示,本研究中强化块曲能够有效提高黄酒中FA含量,并可能在微生物作用下转化为其他酚酸。

a-发酵过程中FA含量的动态变化曲线;b-氨基酸含量;c-有机酸含量;d-酚酸含量
图6 黄酒氨基酸、酚酸、有机酸含量测定
Fig.6 Determination of amino acids, organic acids, and phenolic acids in Huangjiu
注:Ser:丝氨酸;Gly:甘氨酸;Ala:丙氨酸;Asp:天冬氨酸;Glu:谷氨酸;Thr:苏氨酸;Arg:精氨酸;Lys:赖氨酸;Val:缬氨酸;Phe:苯丙氨酸;Ile:异亮氨酸;Leu:亮氨酸;Pro:脯氨酸;Met:蛋氨酸;His:组氨酸;Tyr:酪氨酸;Cys:半胱氨酸。
2.7 黄酒挥发性香气成分的多元统计分析
强化块曲及传统麦曲酿造黄酒的挥发性风味物质的相对含量如图7-a和图7-b所示。黄酒RWQ、CWQ、Group及Control总挥发性物质相对含量分别为256.15、197.42、257.27、209.80 mg/L。其中,RWQ挥发性酯类物质、酸、呋喃和吡喃类化合物相对含量高于其他组,CWQ中的挥发性醇、醛酮类、酚类物质相对含量高于其他组,Group中的挥发性酯类、酸类物质相对含量较高。含氮化合物在4组黄酒中的相对含量差异不显著(P>0.05)。
对检测到的挥发性物质进行PCA,结果如图7-c所示。可以发现样本点在组间是分散的,而组内样本是独立聚类的,可以说明强化块曲与传统麦曲酿造黄酒的挥发性风味物质具有差异性。如图7-d所示,根据VIP>1,通过OPLS-DA统计方法得到16种差异风味化合物,包括9种酯类、3种醇类、3种酚类和1种吡嗪。亚油酸乙酯、丁酸苯乙酯及辛酸乙酯的相对含量在RWQ中较高,这些物质通常被描述为具有芳香、玫瑰香、葡萄酒香气[32]。正辛醇、对羟基苯乙醇、己酸乙酯及四甲基吡嗪在CWQ中的相对含量较高,这些物质通常被描述为具有柑橘香、芳香、果香、坚果香。Group中4-乙烯基愈创木酚、香兰素、乙酸乙酯及丁二酸二乙酯的相对含量较高,这些物质通常被描述为具有丁香、香草香、果香[18]。异丁醇在Control中的相对含量较高,通常被描述为具有辛辣刺激的味道。

a、b-挥发性风味物质的相对含量;c-PCA;d-基于OPLS-DA计算的VIP得分图
图7 黄酒挥发性物质的多元统计分析
Fig.7 Multivariate statistical analysis of volatile substances in Huangjiu
3 结论
本研究利用功能菌株研制出一种强化块曲并探讨了对黄酒FA及风味的影响。单因素试验和响应面分析结果表明,通过接种草酸青霉菌M1816并优化工艺条件后的块曲其糖化力和液化力分别提高了43%和56%。随后,优化草酸青霉菌M1816和假单胞菌A-4H制备强化块曲的接种比例可以显著提高强化块曲的阿魏酸酯酶活力和木聚糖酶活力。酿酒实验表明,强化块曲不仅显著提高了黄酒中FA含量,而且对黄酒中丙氨酸、精氨酸、乳酸、香兰素、4-乙烯基愈创木酚、乙酸乙酯、丁二酸二乙酯等功能性和风味物质的含量也产生了有利的影响。本研究为利用功能菌株进行生物强化以提高麦曲和黄酒的品质提供了方向,为今后麦曲的工业化生产奠定了基础。
总的来说,强化块曲具有较不错的发酵性能。本研究着重分析了新型块曲制备的工艺条件和酿造黄酒的理化和风味,而对微生物群落结构没有进行研究,后续可以根据微生物与块曲的理化、酿造黄酒的风味进行相关研究。
[1] MA D L, LIU S P, LIU H P, et al.Developing an innovative raw wheat Qu inoculated with Saccharopolyspora and its application in Huangjiu[J].Journal of the Science of Food and Agriculture, 2022, 102(15):7301-7312.
[2] PENG Q, ZHENG H J, YU H F, et al.Environmental factors drive the succession of microbial community structure during wheat Qu fermentation[J].Food Bioscience, 2023, 56:103169.
[3] SUN H L, LIU S P, ZHANG J, et al.Safety evaluation and comparative genomics analysis of the industrial strain Aspergillus flavus SU-16 used for Huangjiu brewing[J].International Journal of Food Microbiology, 2022, 380:109859.
[4] PENG Q, ZHENG H J, MENG K, et al.Quantitative study on core bacteria producing flavor substances in Huangjiu (Chinese yellow rice wine)[J].LWT, 2022, 168:113900.
[5] LIU S P, HU J, XU Y Z, et al.Combined use of single molecule real-time DNA sequencing technology and culture-dependent methods to analyze the functional microorganisms in inoculated raw wheat Qu[J].Food Research International, 2020, 132:109062.
[6] YU P B, DU J, CAO C L, et al.Development of a novel multi‐strain wheat Qu with high enzyme activities for Huangjiu fermentation[J].Journal of the Science of Food and Agriculture, 2021, 101(11):4808-4817.
[7] CHIM C, DIZON E I, HURTADA W A, et al.Total phenolic content and antioxidant activity of rice wine from waxy pigmented and non-pigmented rice varieties produced by traditional and multi-parallel fermentation[J].Food Research, 2019, 4(1):199-206.
[8] ZHANG J, LIU S P, SUN H L, et al.Enzyme production potential of Penicillium oxalicum M1816 and its application in ferulic acid production[J].Foods, 2021, 10(11):2577.
[9] XIONG Q Q, ZHANG J, SHI Q, et al.The key metabolites associated with nutritional components in purple glutinous rice[J].Food Research International, 2022, 160:111686.
[10] DUAN X L, DAI Y W, ZHANG T.Characterization of feruloyl esterase from Bacillus pumilus SK52.001 and its application in ferulic acid production from de-starched wheat bran[J].Foods, 2021, 10(6):1229.
[11] 毛健, 王宗敏, 张晶,等.一株产阿魏酸酯酶的假单胞菌及其应用.中国:CN201910312493.5[P].2020-08-04.MAO J, WANG Z M, ZHANG J, et al.A strain of ferulate esterase producing Pseudomonas and its application.China:CN201910312493.5[P].2020-08-04.
[12] OGHAZ N A, HATAMZADEH S, RAHNAMA K, et al.Adjustment and quantification of UV-visible spectrophotometry analysis:An accurate and rapid method for estimating Cladosporium spp.spore concentration in a water suspension[J].World Journal of Microbiology and Biotechnology, 2022, 38(10):183.
[13] 周志立, 刘双平, 徐岳正,等.仿草包曲在黄酒发酵中的应用及其对黄酒风味的影响[J].食品科学技术学报, 2021,39(5):135-144.ZHOU Z L, LIU S P, XU Y Z, et al.Application of imitated caobao Koji in Huangjiu fermentation and its influence on Huangjiu flavor[J].Journal of Food Science and Technology, 2021,39(5):135-144.
[14] 毛青钟. 黄酒机制生麦曲与传统生麦曲的比较探讨[J].中国酿造, 2005, 24(5):42-44.MAO Q Z.Compared discussion between the machine-making and traditional raw wheat Koji in rice wine brewing[J].China Brewing, 2005, 24(5):42-44.
[15] MOSHER J J, BERNBERG E L, SHEVCHENKO O, et al.Efficacy of a 3rd generation high-throughput sequencing platform for analyses of 16S rRNA genes from environmental samples[J].Journal of Microbiological Methods, 2013, 95(2):175-181.
[16] 刘娅, 刘双平, 刘甜甜,等.低产杂醇高产酯酵母菌株的选育和共酵对黄酒品质的影响及机制分析[J].食品科学技术学报, 2024, 42(4):31-44.LIU Y, LIU S P, LIU T T, et al.Breeding of yeast strains with low fusel alcohol yield and high ester yield and effect of co-fermentation on Huangjiu quality and its mechanism analysis[J].Journal of Food Science and Technology, 2024, 42(4):31-44.
[17] WEI X L, LIU S P, YU J S, et al.Innovation Chinese rice wine brewing technology by bi-acidification to exclude rice soaking process[J].Journal of Bioscience and Bioengineering, 2017, 123(4):460-465.
[18] ZHU Y, LIU S P, MA D L, et al.Stabilization of jiuyao quality for huangjiu brewing by fortifying functional strains based on core microbial community analysis[J].Food Bioscience, 2023, 52:102370.
[19] KONG Y, ZHANG L L, SUN Y, et al.Determination of the free amino acid, organic acid, and nucleotide in commercial vinegars[J].Journal of Food Science, 2017, 82(5):1116-1123.
[20] 毛青钟,俞关松.三种生麦曲的性能和应用研究[J].酿酒, 2016, 43(6):66-73.MAO Q Z, YU G S.Three kinds of raw wheat Qu performance and experimental research[J].Liquor Making, 2016, 43(6):66-73.
[21] 曹振华, 沈才洪, 王小军,等.麸皮添加量对泸型大曲质量的影响[J].酿酒科技, 2016(4):21-24.CAO Z H, WANG X J, et al.Effects of the adding level of wheat bran on the quality of Luzhou Daqu[J].Liquor-Making Science &Technology, 2016(4):21-24.
[22] LEI Y, CAI W C, WANG Y R, et al.Elucidating the physicochemical parameters, bacterial community structure, and correlation characteristics of medium-high temperature Daqu[J].Food Bioscience, 2024, 58:103679.
[23] MA S Y, LUO H B, ZHAO D, et al.Environmental factors and interactions among microorganisms drive microbial community succession during fermentation of Nongxiangxing Daqu[J].Bioresource Technology, 2022, 345:126549.
[24] ZHANG L L, XIONG S J, DU T H, et al.Effects of microbial succession on the dynamics of flavor metabolites and physicochemical properties during soy sauce Koji making[J].Food Bioscience, 2023, 53:102636.
[25] WU H L, LI H L, XUE Y, et al.High efficiency co-production of ferulic acid and xylooligosaccharides from wheat bran by recombinant xylanase and feruloyl esterase[J].Biochemical Engineering Journal, 2017, 120:41-48.
[26] CHEN L H, LI D N, REN L X, et al.Effects of simultaneous and sequential cofermentation of Wickerhamomyces anomalus and Saccharomyces cerevisiae on physicochemical and flavor properties of rice wine[J].Food Science &Nutrition, 2021, 9(1):71-86.
[27] CHEN X D, SONG C, ZHAO J, et al.Effect of a new fermentation strain combination on the fermentation process and quality of highland barley yellow wine[J].Foods,2024, 13(14):2193.
[28] QIAN M, RUAN F X, ZHAO W H, et al.The dynamics of physicochemical properties, microbial community, and flavor metabolites during the fermentation of semi-dry Hakka rice wine and traditional sweet rice wine[J].Food Chemistry, 2023, 416:135844.
[29] GONZALO-DIAGO A, DIZY M, FERN NDEZ-ZURBANO P.Effect of low molecular weight phenols on the in-mouth sensory perception of high molecular weight phenols by analyzing reconstituted wines[J].Food Chemistry, 2025, 463:141422.
NDEZ-ZURBANO P.Effect of low molecular weight phenols on the in-mouth sensory perception of high molecular weight phenols by analyzing reconstituted wines[J].Food Chemistry, 2025, 463:141422.
[30] ![]() H, HONKE J, TOPOLSKA J, et al.ACE inhibitory properties and phenolics profile of fermented flours and of baked and digested biscuits from buckwheat[J].Foods, 2020, 9(7):847.
H, HONKE J, TOPOLSKA J, et al.ACE inhibitory properties and phenolics profile of fermented flours and of baked and digested biscuits from buckwheat[J].Foods, 2020, 9(7):847.
[31] PAISSONI M A, MOTTA G, GIACOSA S, et al.Mouthfeel subqualities in wines:A current insight on sensory descriptors and physical-chemical markers[J].Comprehensive Reviews in Food Science and Food Safety, 2023, 22(4):3328-3365.
[32] LIN X, WANG Q K, HU X P, et al.Evaluation of different Saccharomyces cerevisiae strains on the profile of volatile compounds in pineapple wine[J].Journal of Food Science and Technology, 2018, 55(10):4119-4130.