抑郁症,也称抑郁性障碍,是由各种原因引起的以抑郁为主要症状的一组心境障碍或情感性障碍,主要病理表现特征为显著而长期的心境消沉、认知功能损伤、思维迟钝和意志活动下降等[1]。大多数抑郁症患者都有自杀倾向,其中15%~20%的患者死于自杀,抑郁症已成为人类第二大杀手,预计其将在2030年成为全球疾病负担第一位的疾病[2]。抑郁症是一个威胁公众健康的难题,目前迫切需要新的治疗干预措施来预防或对抗抑郁症。
抑郁症发病机理极为复杂,研究表明产生抑郁的主要因素包括神经递质释放障碍、下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal,HPA)轴亢奋和免疫调节障碍等[3]。目前临床上治疗抑郁症的主流策略包括选择性五羟色胺(5-hydroxy tryptamine,5-HT)再摄取抑制剂、去甲肾上腺素与特定5-HT再摄取抑制剂和三环类抗抑郁药等。但这些药物除了存在起效时间长,易出现耐受性以及恶心、食欲减退等胃肠道与勃起功能障碍等不良反应外,更对40%患者无效[4]。因此,除了传统抗抑郁药物的使用,从植物中寻找安全、高效的天然产物来改善和防治抑郁症已成为社会需求和研究热点。在众多潜在的植物资源中,海洋藻类作为一类独特的植物资源,其丰富的化学成分和多样的生物活性使其成为潜在的抗抑郁药物来源[5]。羊栖菜(Sargassum fusiforme)是一种广泛分布于我国浙江沿海地区的褐藻,具有药食两用的特性,其富含多种生物活性物质,其中多酚类物质尤为突出。羊栖菜多酚是一类以间苯三酚为基本结构单元的次级代谢产物,其分子结构中的酚羟基能够作为氢供体参与氧化过程,抑制自由基的产生,并与金属离子络合,从而发挥抗氧化与神经保护作用[6-7]。尽管已有研究表明羊栖菜多酚具有显著的抗炎和抗氧化作用[8],但其在抗抑郁领域的研究仍较为有限,尤其是其对抑郁症相关的HPA轴功能及神经递质调节的具体作用尚不明确。
基于此,本研究以羊栖菜多酚提取物(Sargassum fusiforme polyphenol extract,SFP)为研究对象,使用慢性不可预知温和应激(chronic unpredictable mild stress,CUMS)的方法构建小鼠抑郁模型,通过行为学实验、炎症因子和神经递质水平分析,系统地评估了SFP对抑郁行为的干预作用,并基于HPA轴功能调控初步解析SFP的干预途径。研究结果为羊栖菜多酚提取物的抗抑郁作用提供了科学依据,也为海洋藻类资源在功能性食品和健康产业中的高值化开发利用提供了新方向。
1 材料与方法
1.1 材料与试剂
羊栖菜,西安维特生物科技有限责任公司;无水碳酸钠、没食子酸、硫酸、苯酚、葡萄糖、三氯化铁、蔗糖,国药集团化学试剂有限公司;XDA-7大孔树脂、氟西汀(Fluoxetine)、牛血清白蛋白、考马斯亮蓝G250染料试剂,上海源叶生物科技有限公司;岩藻甾醇,上海笛柏生物科技有限公司;磷酸,上海阿拉丁生化科技股份有限公司;无水乙醇、乙酸乙酯、福林酚,上海泰坦科技股份有限公司;促肾上腺皮质激素释放激素(corticotropin releasing hormone,CRH)、促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)、皮质酮(corticosterone,CORT)、TNF-α、IL-1β、IL-6、IL-10、脂多糖(Lipopolysaccharide,LPS)、5-HT、多巴胺(dopamine,DA)、脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)ELISA试剂盒,四川维克奇生物科技有限公司;生理盐水,四川科伦药业股份有限公司。
1.2 仪器与设备
KQ-500VDE双频数控超声波清洗器,昆山市超声仪器有限公司;SHB-B95循环水式多用真空泵、DLSB低温冷却液循环泵、R-1020旋转蒸发仪,杭州庚雨仪器有限公司;Varioskan Flash全自动酶标仪,赛默飞世尔科技(中国)有限公司;CR22N冷冻离心机,日本Hitachi公司;SCIENTZ-48高通量组织研磨器,宁波新芝生物科技股份有限公司;行为学实验设备,诺达思(北京)信息技术有限责任公司;EthoVision XT 11.5动物运动轨迹跟踪系统,荷兰Noldus公司;PANNORAMIC DESK/MIDI/250/1000全景切片扫描仪,匈牙利3DHISTECH公司。
1.3 实验方法
1.3.1 SFP的制备
参照WANG等[9]和王艳英[10]的方法并略作修改。将羊栖菜粉碎后过80目筛,得到羊栖菜干粉。将羊栖菜干粉加入体积分数为40%乙醇溶液超声辅助浸提[料液比1∶30(g∶mL);70 ℃、60 min],3 500 r/min离心15 min后取上清液真空减压去除乙醇,获得羊栖菜多酚粗提液,用等体积乙酸乙酯萃取3次,取有机相真空减压去除乙酸乙酯,将羊栖菜多酚提取液用双蒸水稀释至3 mg/mL,上样流速为1 BV/h,用体积分数为60%的乙醇洗脱,真空减压去除乙醇并冷冻干燥获得SFP[采用福林酚比色法[11]测得总酚含量为(131.17±1.88) mg/g;采用苯酚硫酸法[12]测得总糖含量为(130.67±5.45) mg/g;采用考马斯亮蓝法[12]测得蛋白质含量(56.38±4.82) mg/g;采用磷硫铁显色法[13]测得甾醇含量为(72.46±1.29) mg/g]。
1.3.2 动物分组与给药
60只5周龄C57BL/6 J雄性小鼠,随机分为6组,每组10只。参考文献[14-15]设置灌胃剂量:空白对照组(Control)、模型组(CUMS)、阳性药物对照组[氟西汀,10 mg/(kg·d)]、SFP低剂量组[low-dose,SFPL,62.5 mg/(kg·d)]、SFP中剂量组[medium-dose,SFPM,125 mg/(kg·d)]、SFP高剂量组[high-dose,SFPH,250 mg/(kg·d)]。适应性饲养1周后,除空白组外,其余5组小鼠采用CUMS造模[16],第5周对所有小鼠进行行为学实验。行为学实验结束24 h后,解剖小鼠并收集脑组织样本。动物程序由江南大学动物管理和使用委员会批准(伦理编号JN.No20240630c0721006[355])。
1.3.3 行为学实验
正式开始之前,将小鼠提前转移至行为学实验室至少30 min,并且要求测试室周围安静,行为学测试参考MASOUDI等[17]的方法从压力最小的测试开始。
1.3.3.1 蔗糖偏好实验(sucrose preference test,SPT)
在CUMS应激结束后,对各组小鼠进行SPT,记录消耗的蔗糖溶液与纯水的体积,分析蔗糖溶液的消耗量及占比。
1.3.3.2 旷场实验(open field test,OFT)
将小鼠放入旷场中心后,观测6 min内小鼠的活动情况,分析小鼠在旷场中心区域停留的时间及占比。
1.3.3.3 高架十字迷宫实验(elevated plus maze,EPM)
将小鼠从中央格面向开放臂放入迷宫,记录6 min内的活动情况,分析小鼠在开放臂停留的时间及占比。
1.3.3.4 悬尾实验(tail suspension test,TST)
将小鼠尾部后1/3处用胶带固定,悬挂于支架上,观测6 min内的活动情况,分析小鼠静止和活跃的时间及占比。
1.3.4 生化指标检测
按照ELISA试剂盒说明书要求检测血清中ACTH、CORT、IL-1β、TNF-α、IL-6、IL-10和LPS的含量;下丘脑中CRH的含量;海马中5-HT、DA和BDNF的含量。
1.3.5 海马组织病理检测
小鼠全脑完整采集后,存放于4%(体积分数)多聚甲醛溶液中。随后,对固定好的脑组织进行石蜡包埋并切片,切好的脑组织切片依次进行苏木精-伊红(hematoxylin and eosin,H&E)染色和尼氏(Nissl)染色,染色完毕后的切片在光学显微镜下观察。利用Case Viewer图像分析软件观察小鼠海马组织的病变情况,并使用Image-Pro Plus 6.0分析软件计算神经元数量和神经元密度。
1.4 数据处理
实验数据以“平均值±标准差”表示,使用SPSS 25.0软件进行统计学分析,样本比较采用单因素方差分析One-way ANOVA,然后进一步用Duncan多重比较法进行显著性分析,P<0.05表示数据具有显著性差异。使用GraphPad Prism 9.5软件进行绘图。
2 结果与分析
2.1 SFP对CUMS小鼠体重的影响
以氟西汀为阳性对照,SFP为干预组,观察SFP对CUMS小鼠体重的影响。各组小鼠体重变化如图1所示。造模前各组小鼠之间体质量基本一致。造模5周后,与Control组小鼠相比,CUMS组小鼠体重显著降低(P<0.05),这可能是因为CUMS诱发小鼠情绪低落从而摄食减少,生理机能运行缓慢导致小鼠在生长期体重增长慢于对照组,XIA等[18]对小鼠进行CUMS处理也观察到类似现象;各给药组体重均呈上升趋势,其中氟西汀、SFPM和SFPH组体重显著高于CUMS组(P<0.05),且接近Control组,表明SFP干预后可以在一定程度上抵抗CUMS诱导建模引起的小鼠生长停滞。目前,很多研究也表明补充多酚可有效改善抑郁症患者的健康状况[7,19]。
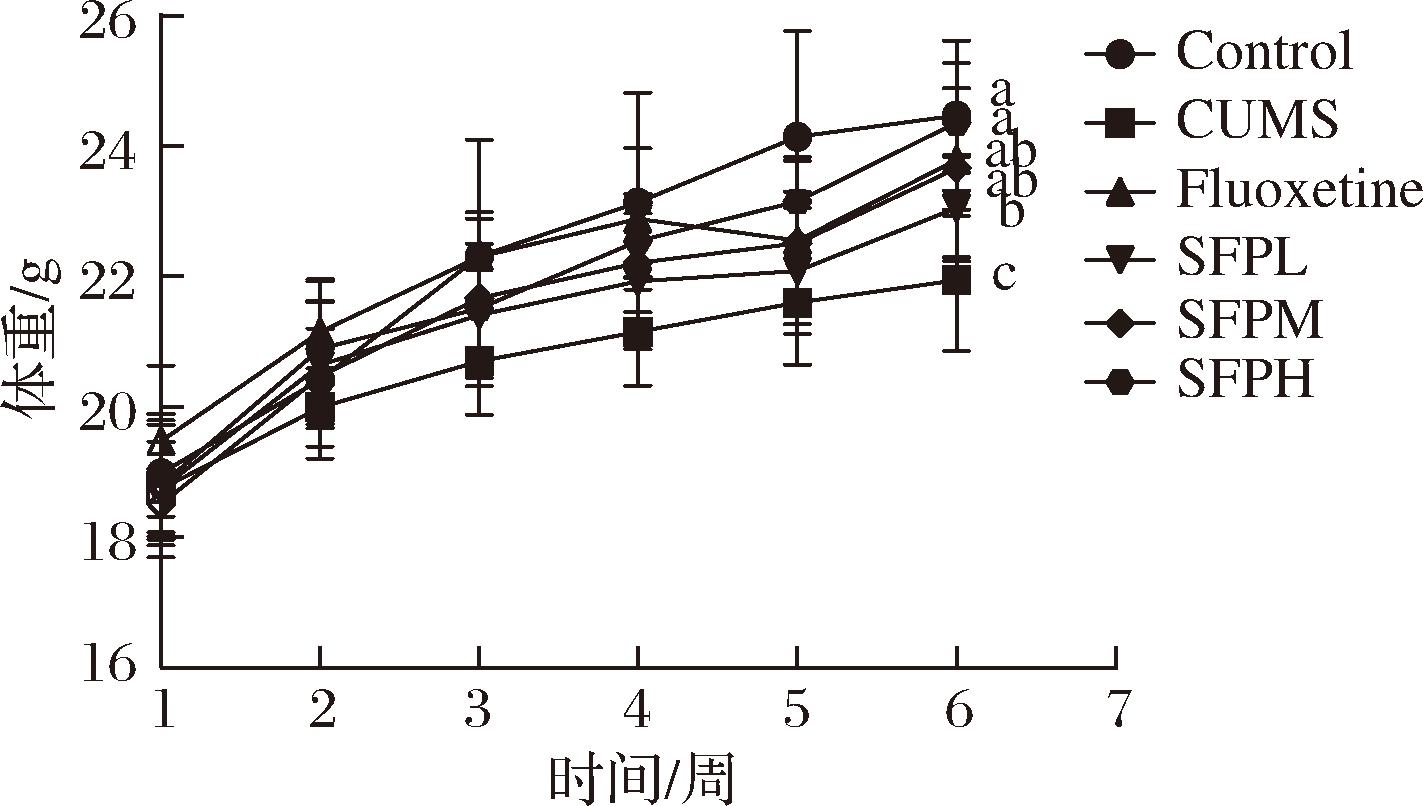
图1 SFP对CUMS小鼠体重的影响
Fig.1 Effect of SFP on body weight of CUMS mice
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.2 SFP对CUMS小鼠行为学的影响
利用啮齿类动物对新异环境的探索性和对强光、开阔地的厌恶所形成的矛盾冲突心理,采用EPM和OFT评价其焦虑样行为[20]。小鼠EPM和OFT结果分别如图2-a和图2-d所示。

a-EPM;b-EPM热图;c-SPT;d-OFT;e-OFT热图;f-TST
图2 SFP对CUMS小鼠行为学的影响
Fig.2 Effect of SFP on the behavior of CUMS mice
与Control组相比,CUMS组小鼠在十字迷宫开臂停留时间和旷场实验中心区域的停留时间占比显著下降(P<0.05),此外,图2-b和图2-e的轨迹图也显示CUMS造模减弱了小鼠在开臂和旷场中心区域的活动,表明CUMS组小鼠自主活动能力降低,探索兴趣减退,对新环境的好奇程度降低,呈现“抑郁样”行为;与CUMS组相比,各给药组小鼠在上述2项指标上均有一定的改善作用,其中SFPH组小鼠在开臂停留时间和旷场中心区域停留时间占比显著增加(P<0.05),接近Control组,表明SFP对焦虑行为具有一定的缓解作用。采用TST和SPT分别用于评价行为绝望和快感缺失[21]。与Control组相比,CUMS组小鼠在SPT实验中糖水摄入量显著减少(P<0.05,图2-c),TST中保持静止时间占比显著增加(P<0.05,图2-f);与CUMS组相比,各给药组在2项指标上都有一定程度改善,其中SFPH组小鼠糖水摄入量显著增加(P<0.05),静止时间占比显著降低(P<0.05),且接近Control组水平,说明SFP可以缓解应激造成的快感缺乏症状和绝望行为。综合行为学检测结果可知,5周的慢性应激能够诱导小鼠出现一系列类似抑郁症的行为障碍,小鼠摄入SFP后,抑郁行为得到了缓解且呈现剂量依赖性,说明SFP具有改善抑郁行为的作用。
2.3 SFP对CUMS小鼠神经递质的影响
5-HT和DA是重要的单胺类神经递质,海马区中单胺类神经递质的缺乏会直接导致抑郁样行为的出现[22]。小鼠海马中神经递质含量如图3所示。

a-海马体中5-HT水平;b-海马体中DA水平;c-海马体中BDNF水平
图3 SFP对CUMS小鼠神经递质的影响
Fig.3 Effect of SFP on neurotransmitters of CUMS mice
与Control组相比,CUMS组小鼠海马区5-HT和DA含量分别下降了36%和46%(P<0.05);与CUMS组相比,经氟西汀干预后,5-HT和DA含量分别增加了32%和12%(P<0.05);各剂量SFP干预后均能改善CUMS小鼠脑中5-HT和DA的分泌量,其中SFPH组小鼠海马区5-HT和DA含量比CUMS组分别增加了35%和30%(P<0.05)。BDNF是海马中分布最广泛的神经营养因子,可促进大脑神经元的再生、发育和生长,从而促进神经的兴奋,调节身体的情绪状态[23]。BDNF的缺乏与抑郁症发病风险高度相关,抑郁症患者BDNF浓度显著降低,部分患者伴随有海马体萎缩等症状,而使用抗抑郁药物后可逆转BDNF浓度下降的现象[24]。小鼠海马中BDNF含量如图3-c所示,CUMS模型组小鼠海马体中BDNF含量与Control组相比降低了35%(P<0.05);各给药干预组对BDNF分泌量均有改善效果,其中氟西汀和SFPH组小鼠脑中BDNF含量比CUMS组分别增加了34%和33%(P<0.05)。
综上,经过5周的慢性应激,CUMS组小鼠海马体中5-HT、DA和BDNF含量相比Control组显著降低(P<0.05)。前期研究也发现抑郁患者脑内5-HT和DA等神经递质显著缺失,且神经递质含量越低,症状越严重[25]。摄入SFP缓解了神经递质减少的现象,且呈现剂量依赖性,提示SFP对抑郁小鼠脑区神经递质缺陷具有改善作用。
2.4 SFP对CUMS小鼠HPA轴中各激素的影响
HPA轴是神经内分泌系统的重要组成部分,参与控制应激反应的调节,在抑郁症等应激相关精神疾病的发病机制中起关键作用[26]。SFP对CUMS小鼠HPA轴中各激素含量的影响如图4所示。
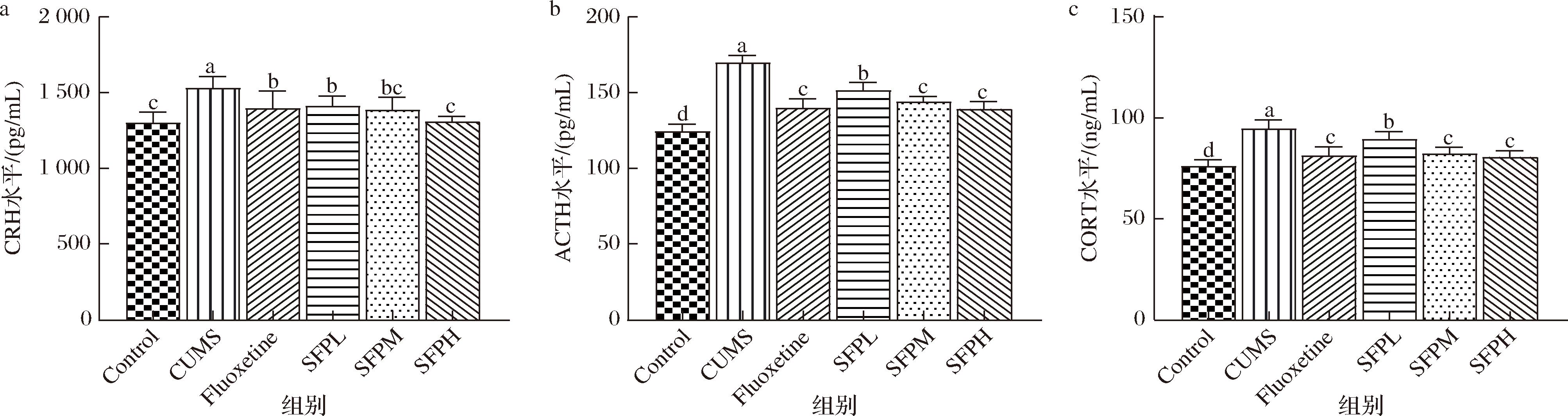
a-下丘脑CRH水平;b-血清ACTH水平;c-血清CORT水平
图4 SFP对CUMS小鼠HPA轴的影响
Fig.4 Effect of SFP on HPA axis of CUMS mice
与Control组相比,CUMS组小鼠下丘脑中CRH含量以及血清中ACTH和CORT含量显著上升(P<0.05),分别升高了17%、37%和25%;与CUMS组相比,经氟西汀干预后,HPA轴中3种激素含量分别下降9%、18%和14%,且与CUMS组具有显著性差异(P<0.05);与CUMS组相比,各剂量SFP干预后均能改善CUMS小鼠HPA轴激素含量升高的状况,其中SFPH组HPA轴中3种激素含量分别下降14%、18%和15%(P<0.05),且更接近氟西汀组水平。
综合HPA轴中关键生物因子浓度变化,CUMS组HPA轴相关激素含量与Control组相比均显著升高(P<0.05)。研究发现,抑郁症患者血清中ACTH和CORT激素等水平升高,且患者情绪的严重程度与HPA轴功能障碍程度呈正相关,随着抑郁症状的缓解,HPA轴功能也会逐渐恢复正常[27]。这可能是因为当机体遭受压力应激时,环境压力信号刺激下丘脑CRH持续分泌使HPA轴负反馈机制失调,ACTH、CORT等激素持续升高,从而引发机体免疫、神经、内分泌等系统调节异常[28]。摄入SFP缓解了小鼠HPA轴亢奋,且效果呈剂量依赖性,说明SFP可以一定程度上预防应激诱导的HPA轴过度激活。SHEN等[29]和MACHU等[30]对羊栖菜等褐藻进行表征,发现其具有4-羟基苯甲酸、没食子酸和阿魏酸等酚酸类物质。研究表明,CUMS小鼠经过没食子酸干预后其皮质酮含量显著降低[31]。此外,阿魏酸可以通过增加GR蛋白表达显著降低血清中ACTH和CORT的浓度[32]。SFP中这些物质可能在调节小鼠HPA轴亢奋发挥了重要作用。
2.5 SFP对CUMS小鼠细胞因子的影响
炎症是抑郁症发生的原因之一,并且炎症因子水平与抑郁程度呈正相关[33]。在众多的炎症因子中,TNF-α、IL-1β和IL-6被认为是引起抑郁症的关键因子[34],能够直接或者间接引发抑郁样行为。SFP对CUMS小鼠炎症水平的影响如图5所示。

a-血清IL-1β水平;b-血清IL-6水平;c-血清TNF-α水平;d-血清IL-10水平;e-血清LPS水平
图5 SFP对CUMS小鼠炎症水平的影响
Fig.5 Effect of SFP on inflammation levels of CUMS mice
与Control组相比,CUMS小鼠血清中炎症因子IL-1β、IL-6和TNF-α浓度水平分别增加了32%、31%和21%(P<0.05);与CUMS组相比,经氟西汀干预后,小鼠血清中IL-1β、IL-6和TNF-α水平分别下降了21%、17%和16%,且与CUMS组相比具有显著性差异(P<0.05);各剂量SFP干预后缓解了这一情况,其中SFPH组干预后IL-1β、IL-6和TNF-α水平分别下降了20%、16%和15%,且与CUMS组相比具有显著性差异(P<0.05)。
IL-10是一种抗炎细胞因子,可以抑制促炎细胞因子(如TNF-α、IL-6和IL-1β)的产生,同时能促进B细胞存活、增殖和抗体生成[35]。小鼠血清中IL-10检测结果如图5-d所示。建模5周后,与Control相比,CUMS组小鼠血清IL-10水平下降了43%(P<0.05);与CUMS组相比,经氟西汀干预后,小鼠血清中IL-10水平增加了61%,且与CUMS组相比具有显著性差异(P<0.05);与CUMS组相比,各剂量SFP干预后逆转了这一情况,其中SFPH组干预后IL-10水平提高了59%,与CUMS组具有显著差异(P<0.05)。
LPS是革兰氏阴性菌细胞壁上的组成成分。研究表明[36],LPS能够与TLR4受体结合,经由NF-κB通路引起IL-1β、IL-6和TNF-α等炎症因子的释放,进而引起机体炎症反应。此外,也有文献表明直接向体内注射LPS会导致抑郁样行为发生[37]。小鼠血清中LPS检测结果如图5-e所示。经过CUMS刺激后,CUMS组小鼠血清中LPS水平相比较Control组增加了29%,且与Control组相比具有显著性差异(P<0.05);与CUMS组相比,经氟西汀干预后,小鼠血清中LPS水平下降了17%,且与CUMS组相比具有显著性差异(P<0.05);经过各剂量SFP干预后缓解了这一情况,其中SFPH组较CUMS组下降了16%,且与CUMS组相比具有显著性差异(P<0.05)。
综上所述,CUMS诱导建模会导致炎症水平上升,表现为IL-1β、IL-6、TNF-α和LPS水平增多,IL-10分泌量减少,该结果与ZHU等[38]研究结果一致。研究表明,细胞因子会抑制HPA轴负反馈机制,导致皮质醇过度分泌,并破坏5-HT等神经递质的合成和信号转导,从而引发抑郁样行为[33],该结果与前文小鼠海马神经递质和HPA轴亢奋的结果相一致。经过SFP干预后可有效抑制促炎因子的表达,同时SFP可有效促进抗炎因子的表达,从而减轻小鼠的炎症反应。
2.6 SFP对CUMS小鼠海马组织的影响
对小鼠海马组织进行HE染色,结果如图6-a所示。Control组CA3区的锥体细胞和齿状回(dentate gyrus,DG)区的颗粒细胞形态规则,排列整齐密集;与Control组相比,CUMS组小鼠的海马组织出现损伤,表现为CA3区的锥体细胞数量减少、排列不规则(蓝色箭头),部分锥体细胞皱缩深染(红色箭头),DG区较多颗粒细胞皱缩深染(黑色箭头);与CUMS组小鼠相比,给药干预组的海马损伤得到了改善,其中氟西汀和SFPH组接近于Control组,CA3区锥体细胞和DG区颗粒细胞形态规则,排列整齐密集。
海马的Nissl染色结果及DG区神经元数量如图6-b~图6-d所示。Control组神经元排列整齐密集,表现出较多的神经元数量和较高的神经元密度;与Control组相比,CUMS组神经元排列松散,海马DG区神经元数量显著下降了14%(P<0.05);经过给药组干预后,神经元数量上升,且与CUMS组相比具有显著性差异(P<0.05),其中氟西汀和SFPH组干预后,神经元数量比CUMS组分别增加了16%和26%。CHEN等[39]的研究表明,抑郁症和精神分裂患者海马区域神经元和神经胶质细胞的总体积和总数较对照组减少了约20%~35%。ZHAO等[40]也观察到CUMS小鼠海马神经元形态异常和数量减少的现象。小鼠摄入SFP后,海马神经元的损伤得到了改善且呈现剂量依赖性,提示SFP具有保护海马神经元和改善抑郁症状的作用。这一结果与之前观察到的行为学和生化指标的改善相一致,进一步证实了SFP在治疗抑郁症中的潜在价值。

a-海马组织HE染色;b-海马组织Nissl染色;c-海马DG区神经元数量;d-海马DG区神经元密度
图6 SFP对CUMS小鼠海马组织的影响
Fig.6 Effect of SFP on hippocampus of CUMS mice
3 结论
本研究聚焦于海洋藻类资源中的羊栖菜,其多酚提取物SFP作为酚类、多糖和蛋白质的复合物,在本研究中表现出对CUMS小鼠抑郁症状的缓解作用。同时,SFP能够调节神经递质水平,缓解HPA轴的亢奋状态,减轻炎症反应,从而修复受损的海马神经元。这些发现为SFP的抗抑郁功效提供了科学依据,并为海洋藻类资源应用于抑郁症非药物治疗研究提供了新方向。然而,目前研究仅局限于小鼠模型,未来可以结合人体临床试验,进一步探究其安全性和有效性,同时明确SFP中各成分在抗抑郁过程中的协同机制。
[1] MUTTONI S, ARDISSINO M, JOHN C.Classical psychedelics for the treatment of depression and anxiety:A systematic review[J].Journal of Affective Disorders, 2019, 258:11-24.
[2] WANG L, LI X X, CHEN X, et al.Antidepressant-like effects of low- and high-molecular weight FGF-2 on chronic unpredictable mild stress mice[J].Frontiers in Molecular Neuroscience, 2018, 11:377.
[3] LI Z Z, RUAN M H, CHEN J, et al.Major depressive disorder:Advances in neuroscience research and translational applications[J].Neuroscience Bulletin, 2021, 37(6):863-880.
[4] CUI L L, LI S, WANG S M, et al.Major depressive disorder:Hypothesis, mechanism, prevention and treatment[J].Signal Transduction and Targeted Therapy, 2024, 9:30.
[5] JANNAT K, BALAKRISHNAN R, HAN J H, et al.The neuropharmacological evaluation of seaweed:A potential therapeutic source[J].Cells, 2023, 12(22):2652.
[6] MATANJUN P, MOHAMED S, MUSTAPHA N M, et al.Antioxidant activities and phenolics content of eight species of seaweeds from north Borneo[J].Journal of Applied Phycology, 2008, 20(4):367-373.
[7] WINIARSKA-MIECZAN A, ![]() M, JACHIMOWICZ-ROGOWSKA K, et al.Anti-inflammatory, antioxidant, and neuroprotective effects of polyphenols:Polyphenols as an element of diet therapy in depressive disorders[J].International Journal of Molecular Sciences, 2023, 24(3):2258.
M, JACHIMOWICZ-ROGOWSKA K, et al.Anti-inflammatory, antioxidant, and neuroprotective effects of polyphenols:Polyphenols as an element of diet therapy in depressive disorders[J].International Journal of Molecular Sciences, 2023, 24(3):2258.
[8] 黄平, 洪静霞, 米杰, 等.羊栖菜多酚通过核转录因子-κB/丝裂原活化蛋白激酶通路缓解脂多糖诱导的RAW264.7细胞炎症反应[J].食品科学, 2022, 43(23):141-148.HUANG P, HONG J X, MI J, et al.Polyphenols extracted from Hizikia fusiformis relieves lipopolysaccharide-induced inflammation in RAW264.7 cells via the nuclear factor-κB/mitogen-activated protein kinase signaling pathways[J].Food Science, 2022, 43(23):141-148.
[9] WANG C, ALI I, WANG D J, et al.Polyphenols separated from Enteromorpha clathrata by one-dimensional coupled with inner-recycling high-speed counter-current chromatography and their antioxidant activities[J].European Food Research and Technology, 2021, 247(7):1791-1802.
[10] 王艳英, 田周萍, 康臆玲, 等.羊栖菜多酚的制备及抗氧化活性研究[J].福建师范大学学报(自然科学版), 2023, 39(3):63-9;77.WANG Y Y, TIAN Z P, KANG Y L, et al.Antioxidant activity and preparation of polyphenols from Sargassum fusiforme[J].Journal of Fujian Normal University (Natural Science Edition), 2023, 39(3):63-69;77.
[11] CHE H X, ZHANG R, WANG X Y, et al.Ultrasound-assisted extraction of polyphenols from Phyllanthi Fructus:Comprehensive insights from extraction optimization and antioxidant activity[J].Ultrasonics Sonochemistry, 2024, 111:107083.
[12] 陈芊如, 龚鹏飞, 杨波, 等.不同分子量羊栖菜多糖对烟草抗旱性和土壤微生物的影响[J].江苏农业科学, 2024, 52(16):141-148.CHEN Q R, GONG P F, YANG B, et al.Effects of different molecular weights of Sargassum fusiforme polysaccharides on drought resistance and soil microorganisms of tobacco[J].Jiangsu Agricultural Sciences, 2024, 52(16):141-148.
[13] 张培育, 陈震, 刘淇, 等.中药海藻中总植物甾醇的含量测定[J].中国海洋药物, 2016, 35(4):76-78.ZHANG P Y, CHEN Z, LIU Q, et al.Determination of total phytosterols in marine TCM Sargassum[J].Chinese Journal of Marine Drugs, 2016, 52(16):76-78.
[14] SONG X J, WANG W H, DING S S, et al.Puerarin ameliorates depression-like behaviors of with chronic unpredictable mild stress mice by remodeling their gut microbiota[J].Journal of Affective Disorders, 2021, 290:353-363.
[15] XIE Y S, WU Z L, QIAN Q F, et al.Apple polyphenol extract ameliorates sugary-diet-induced depression-like behaviors in male C57BL/6 mice by inhibiting the inflammation of the gut-brain axis[J].Food &Function, 2024, 15(6):2939-2959.
[16] LIANG F Y, LIU S Z, ZHANG H, et al.Effects of chronic unpredictable mild stress on gut sensation and function in male mice[J].Stress, 2024, 27:2374768.
[17] MASOUDI M, GOODARZI M, RAHMANI M A, et al.Vitamin C improved anxiety and depression like behavior induced by chronic unpredictable mild stress in adolescent rats by influencing on oxidative stress balance, neurotransmitter systems, and inflammatory response[J].Nutritional Neuroscience, 2025, 28(4):503-512.
[18] XIA C X, GAO A X, ZHU Y, et al.Flavonoids from Seabuckthorn (Hippophae rhamnoides L.) restore CUMS-induced depressive disorder and regulate the gut microbiota in mice[J].Food &Function, 2023, 14(16):7426-7438.
[19] MOKHTARI T.Targeting autophagy and neuroinflammation pathways with plant-derived natural compounds as potential antidepressant agents[J].Phytotherapy Research, 2022, 36(9):3470-3489.
[20] YU H, TANG M-H, ZENG Z Y, et al.Suppressive effects of gelsemine on anxiety-like behaviors induced by chronic unpredictable mild stress in mice[J].Brain Sciences, 2022, 12(2):191.
[21] MARKOV D D.Sucrose preference test as a measure of anhedonic behavior in a chronic unpredictable mild stress model of depression:Outstanding issues[J].Brain Sciences, 2022, 12(10):1287.
[22] NEDIC ERJAVEC G, SAGUD M, NIKOLAC PERKOVIC M, et al.Depression:Biological markers and treatment[J].Progress in Neuro-Psychopharmacology and Biological Psychiatry, 2021, 105:110139.
[23] LI X L, LIU H, LIU S H, et al.Intranasal administration of brain-derived neurotrophic factor rescues depressive-like phenotypes in chronic unpredictable mild stress mice[J].Neuropsychiatric Disease and Treatment, 2022, 18:1885-1894.
[24] SZAROWICZ C A, STEECE-COLLIER K, CAULFIELD M E.New frontiers in neurodegeneration and regeneration associated with brain-derived neurotrophic factor and the rs6265 single nucleotide polymorphism[J].International Journal of Molecular Sciences, 2022, 23(14):8011.
[25] ZHAO T Y, LIU T, WANG L, et al.Dysfunction of neurotransmitter metabolism is associated with the severity of depression in first-diagnosed, drug-naïve depressed patients[J].Journal of Affective Disorders, 2024, 349:332-341.
[26] KIM C Y, KO K, CHOI S H, et al.Effects of saffron extract (Affron®) with 100 mg/kg and 200 mg/kg on hypothalamic-pituitary-adrenal axis and stress resilience in chronic mild stress-induced depression in wistar rats[J].Nutrients, 2023, 15(23):4855.
[27] BRAND S R, BRENNAN P A, NEWPORT D J, et al.The impact of maternal childhood abuse on maternal and infant HPA axis function in the postpartum period[J].Psychoneuroendocrinology, 2010, 35(5):686-693.
[28] BÜRGIN D, KIND N, SCHRÖDER M, et al.The stress of caring:Resilience and HPA-axis activity in hair samples of youth residential caregivers[J].Frontiers in Psychiatry, 2020, 11:556486.
[29] SHEN P, GU Y, ZHANG C X, et al.Metabolomic approach for characterization of polyphenolic compounds in Laminaria japonica, Undaria pinnatifida, Sargassum fusiforme and Ascophyllum nodosum[J].Foods, 2021, 10(1):192.
[30] MACHU L, MISURCOVA L, VAVA AMBROZOVA J, et al.Phenolic content and antioxidant capacity in algal food products[J].Molecules, 2015, 20(1):1118-1133.
[31] BHUIA M S, RAHAMAN M M, ISLAM T, et al.Neurobiological effects of Gallic acid:Current perspectives[J].Chinese Medicine, 2023, 18(1):27.
[32] ZHENG X X, CHENG Y, CHEN Y W, et al.Ferulic acid improves depressive-like behavior in prenatally-stressed offspring rats via anti-inflammatory activity and HPA axis[J].International Journal of Molecular Sciences, 2019, 20(3):493.
[33] MALIK S, SINGH R, ARORA G, et al.Biomarkers of major depressive disorder:Knowing is half the battle[J].Clinical Psychopharmacology and Neuroscience, 2021, 19(1):12-25.
[34] PETRALIA M C, MAZZON E, FAGONE P, et al.The cytokine network in the pathogenesis of major depressive disorder.Close to translation?[J].Autoimmunity Reviews, 2020, 19(5):102504.
[35] OG ODEK E.Changes in the serum levels of cytokines:IL-1β, IL-4, IL-8 and IL-10 in depression with and without posttraumatic stress disorder[J].Brain Sciences, 2022, 12(3):387.
ODEK E.Changes in the serum levels of cytokines:IL-1β, IL-4, IL-8 and IL-10 in depression with and without posttraumatic stress disorder[J].Brain Sciences, 2022, 12(3):387.
[36] ALI T, RAHMAN S U, HAO Q, et al.Melatonin prevents neuroinflammation and relieves depression by attenuating autophagy impairment through FOXO3a regulation[J].Journal of Pineal Research, 2020, 69(2):e12667.
[37] WU L, ZHANG T, CHEN K, et al.Rapid antidepressant-like effect of Fructus Aurantii depends on cAMP-response element binding protein/Brain-derived neurotrophic facto by mediating synaptic transmission[J].Phytotherapy Research, 2021, 35(1):404-414.
[38] ZHU X P, SUN-WATERHOUSE D, CUI C.A red pomegranate fruit extract-based formula ameliorates anxiety/depression-like behaviors via enhancing serotonin (5-HT) synthesis in C57BL/6 male mice[J].Food Science and Human Wellness, 2021, 10(3):289-296.
[39] CHEN F H, BERTELSEN A B, HOLM I E, et al.Hippocampal volume and cell number in depression, schizophrenia, and suicide subjects[J].Brain Research, 2020, 1727:146546.
[40] ZHAO L, REN H C, GU S N, et al.rTMS ameliorated depressive-like behaviors by restoring HPA axis balance and prohibiting hippocampal neuron apoptosis in a rat model of depression[J].Psychiatry Research, 2018, 269:126-133.