抗性淀粉(resistant starch, RS)是一类难以被胃和小肠消化吸收的淀粉,在结盲肠发酵生成短链脂肪酸(short-chain fatty acid, SCFA),后者能促进肠道内有益菌群的生长和繁殖、降低肠道内pH、保护肠道屏障、减轻肠道炎症、维持肠道免疫平衡[1],被认为是目前治疗溃疡性结肠炎(ulcerative colitis, UC)的理想食疗原料。UC是一种常见炎症性肠病,以腹痛、腹泻、黏液脓血便为主要临床表现,常累及结肠和直肠,被世界卫生组织(World Health Organization, WHO)列为现代难治病之一[2]。近年来,随着生活节奏的加快和饮食结构的改变,我国UC发病人数逐年增加,2025年将达到150万人[3]。免疫功能失衡和菌群失调导致的肠道内环境平衡破坏是诱发其发病的主要原因之一[4-6]。目前临床上针对UC治疗的主要策略是采用糖皮质激素、免疫抑制剂和抗生素类药物,虽然能有效缓解症状,但长时间使用会增加机体罹患间质性肾炎、胰腺炎、白细胞减少症、淋巴瘤、皮疹、关节痛等的风险[7]。因此亟需寻找安全且有效的新疗法。饮食干预中的抗性淀粉被证实能通过优化肠道菌群结构、促进有益代谢产物生成、调控宿主免疫应答和炎症反应来维护肠道健康、缓解UC症状[8],为UC绿色替代疗法提供了思路。
山药来源于薯蓣科植物薯蓣(Dioscorea polystachya Turczaninow)的干燥根茎,其味甘,性平,归脾、肺、肾经,具有补脾养胃等功效,早在东汉时期的《神农本草经》中,就被列为“上品”[9]。鉴于其既是传统食品又是中药材的特性,山药于2002年被列入药食同源中药材目录,成为了首批被纳入国家药食同源目录的农产品。山药富含淀粉,是仅次于谷物和木薯的全球第三大碳水化合物,其淀粉含量占根茎总生物量的20%~60%,是制备抗性淀粉的理想原料[10]。研究显示,经普鲁兰酶脱支链的山药抗性淀粉体通过外发酵后显著提高短链脂肪酸含量、降低结肠pH等途径促进乳酸杆菌等有益菌的生长[11];这些细菌的发酵副产物,如双歧杆菌产生的乳酸、琥珀酸和甲酸以及黏杆菌产生的乙酸,为产丁酸生产菌粪杆菌属提供了营养[12]。此外,肠道细菌对丙酸和其他化合物的代谢也有助于丁酸的产生[13]。由此可见,山药抗性淀粉的生理药理活性与防止UC的核心功效高度吻合。基于此,本研究拟采用普鲁兰酶和耐高温α-淀粉酶提取法从新鲜山药中制备抗性淀粉,并基于短链脂肪酸-肠道屏障-免疫平衡途径研究山药抗性淀粉对UC的保护作用和作用机制,旨在为山药抗性淀粉防治溃疡性结肠炎功能食品开发提供支撑。
1 材料与方法
1.1 材料与试剂
C57BL/6 J小鼠,6周龄,购自北京维通利华实验动物技术有限公司(许可证编号:SCXK(京)2021-0006)。小鼠置于IVC饲养笼饲养,自由饮水饮食,环境温度为24~26 ℃,相对湿度为50%~60%,保证12 h昼夜循环的光照。本实验遵循程序符合山东中医药大学动物伦理与福利委员会批准,批号:SDUTCM20240327002。
葡聚糖硫酸钠(dextran sulfate sodium, DSS),MP Biomedical公司;普鲁兰酶、耐高温α-淀粉酶、糖化酶,北京索莱宝科技有限公司;IL-6、IL-10、TNF-α、IL-17 ELISA试剂盒,江苏酶免生物科技有限公司;PCR试剂,宝日医生物技术(北京)有限公司。
1.2 仪器与设备
ECLIPSE Ci-S偏光显微镜,日本尼康公司;Leica DM500光学显微镜,徕卡显微系统有限公司;CF*96 Touch实时荧光定量PCR仪,BIO-RAD公司。
1.3 实验方法
1.3.1 双酶法制备山药抗性及含量测定
将新鲜山药切片烘干,粉碎后加NaOH溶液(pH 10.5)浸提,下层沉淀用蒸馏水洗涤至澄清后离心,将白色沉淀烘干、粉碎后分散至磷酸盐缓冲液(pH 5.5),沸水浴糊化20 min后加入耐高温α-淀粉酶(10 U/g)搅拌15 min。再加入普鲁兰酶(16 U/g)脱支处理,58 ℃恒温水浴中孵育8 h,4 ℃冰箱12 h,3 000 r/min离心10 min,收集沉淀,烘干,粉碎,过200目筛。
采用体外消化实验测定抗性淀粉含量。根据ENGLYST等[14]的报道并改进。100.00 mg抗性淀粉中加入1.65 mL醋酸钠缓冲溶液(pH 5.2),37 ℃恒温水浴振动器中以200 r/min的转速振荡10 min,加入1.65 mL 10 mg/L的胃蛋白酶溶液反应30 min;最后加入0.835 mL胰酶和葡萄糖苷酶混合液并于0、20、120 min时,准确吸取0.150 mL反应液,加入1.5 mL 乙醇灭活酶,采用葡萄糖含量检测试剂盒测定葡萄糖含量,平行测定3次。
1.3.2 抗性淀粉制备条件的正交试验设计
在单因素试验的基础上,以淀粉乳添加量(A)、普鲁兰酶添加量(B)、耐高温α-淀粉酶添加量(C)、老化时间(D)为考察因素,以山药RS含量为指标设计正交试验,因素水平见表1。
表1 正交试验因素水平表
Table 1 Orthogonal experiment factor level table
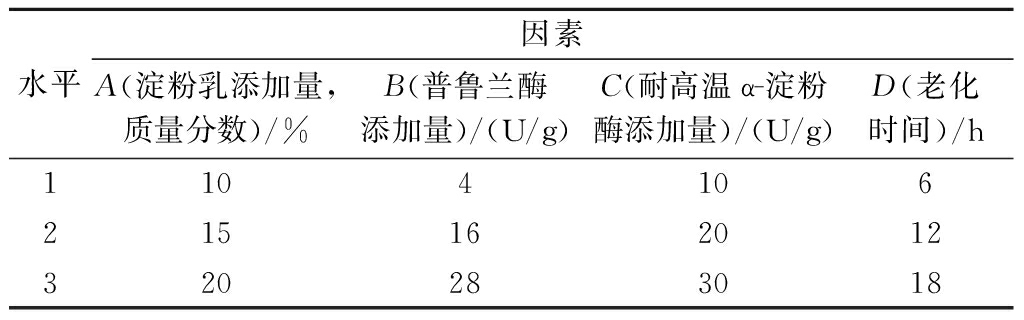
水平因素A(淀粉乳添加量,质量分数)/%B(普鲁兰酶添加量)/(U/g)C(耐高温α-淀粉酶添加量)/(U/g)D(老化时间)/h1104106215162012320283018
1.3.3 淀粉-碘复合物吸收光谱分析
称取待测样品,用无水乙醇润湿,然后加入KOH溶液混匀。随后,加入蒸馏水10 mL,用0.1 mol/L的HCl溶液将混合液的pH值调节至6.0~7.0,定容至50 mL,取10 mL样品液于容量瓶中,加入80 mL蒸馏水和2 mL碘液(I2 2 mg/mL和KI 20 mg/mL),定容至100 mL,溶液以4 000 r/min速度离心10 min,用紫外分光光度计进行波长扫描,波长扫描范围400~800 nm。
1.3.4 显微镜下形貌观察
称取3.00 g淀粉样品,分别分散于2.5 mL去离子水、1 mL 50%(质量分数)甘油/甘油醋酸中,分散均匀,分别置于光学显微镜和偏光镜下镜检,观察并拍摄样品形貌照片。
1.3.5 动物分组及模型的建立
6周龄雌性C57BL/6小鼠,分为6组,每组10只。小鼠置于IVC饲养笼饲养,自由饮水饮食。动物的护理和使用程序已获得山东中医药大学动物伦理与福利委员会的批准。动物实验设计如图1所示,适应性喂养3 d后,预防给药7 d。空白对照组(CON组)、模型组(MOD组)和阳性药组(POS组)小鼠喂食普通对照饲料,山药抗性淀粉低(RS-L组)、中(RS-M组)、高(RS-H组)剂量组分别喂食定制的特殊饲料。造模7 d,对照组饮用蒸馏水,实验组自由饮25 g/L DSS溶液,阳性药组灌胃400 mg/kg美沙拉嗪溶液。实验第1天定为d1,每天观察小鼠体重变化及一般状态。第8天摘眼球取血,分离结肠组织,记录小鼠的体重,并按表2进行疾病活动指数(disease activity index, DAI)评分。
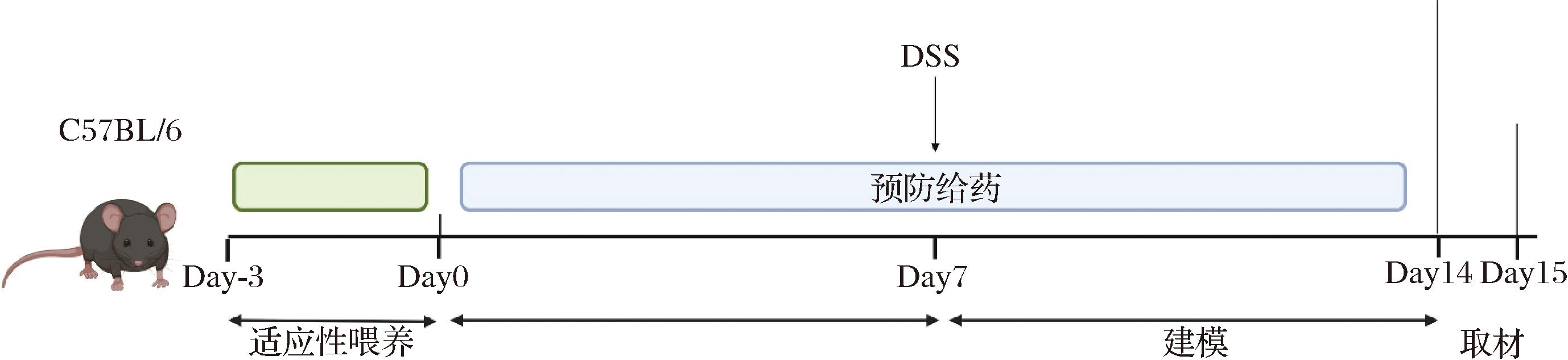
图1 动物实验方案
Fig.1 Animal experimental design
表2 DAI评分表标准
Table 2 DAI scoring standards

评分体重减少粪便形态血便情况0<1%松软无隐血11%~5%松软但有形无隐血26%~10%松散有隐血311%~15%非常松散、潮湿粪便可见血迹4>15%腹泻,液体状黏附于肛门直肠出血
1.3.6 组织病理分析
取小鼠结肠组织固定于4%多聚甲醛固定液中,用于后续的包埋、苏木精伊红(hematoxylin-eosin, HE)染色和免疫荧光染色。
1.3.7 短链脂肪酸的含量测定
1.3.7.1 样品前处理
称取100 mg粪便,加入0.5 mL蒸馏水,振荡后静置20 min,10 000 r/min低温离心,将上清液经0.22 μm滤膜过滤,重复2次,将上清液合并,加入硫酸液和乙醚,振荡5 min,低温离心10 min,4 ℃冰箱内静置20 min。取上层溶液加入2-乙基丁酸混匀,备用。
1.3.7.2 色谱条件
色谱柱为FFAP强极性色谱柱(30 m×0.32 mm,0.25 m);分流比为5∶1,进样量为2 μL,流速1 mL/min;进样口温度为280 ℃,离子源温度为300 ℃;载气为氮气;检测器为氢火焰离子化检测器;升温程序:起始温度设定为135 ℃,保持5 min;再以3 ℃/min升温至170 ℃,保持2 min;最后以200 ℃后运行3 min。
1.3.8 酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测
将一定量的结肠组织剪碎置于研磨管中,按质量(g)∶体积(mL)=1∶9的比例加PBS匀浆。离心取上清液进行测定。
1.3.9 qRT-PCR
使用Vazyme试剂盒提取结肠组织mRNA,利用逆转录试剂盒将mRNA逆转录成cDNA,以β-actin为内参,通过公式2-ΔΔCt计算目的基因的表达水平。引物序列:Foxp3(forward 5′-AAGAATGCCATCCGCCACAAC 3′ and reverse 5′-TCATCTACGGTCCACACTGCTC -3′);ROR-γt(forward 5′-CCCGAGATGCTGTCAAGTTTGG3′ and reverse 5′-TTCCTGTTGCTGCTGCTGTTG -3′)。
1.4 数据处理
实验数据用“平均值±标准差”表示。数据经Excel初步整理后,采用SPSS软件(版本26.0)进行统计分析,单因素方差分析(ANOVA)进行统计学检验,GraphPad Prism 9.0作图。
2 结果与分析
2.1 山药抗性淀粉制备工艺优化
山药抗性淀粉制备工艺优化结果见表3。影响山药抗性淀粉含量因素排序顺序为:淀粉乳添加量>耐高温α-淀粉酶添加量>普鲁兰酶添加量>老化时间。RS最高得率为39.02%,对应的制备工艺为:淀粉乳添加量20%(质量分数),普鲁兰酶添加量16 U/g,耐高温α-淀粉酶添加量20 U/g,老化时间18 h。
表3 L9(34) 正交试验设计及结果
Table 3 L9(34) orthogonal experimental design and results
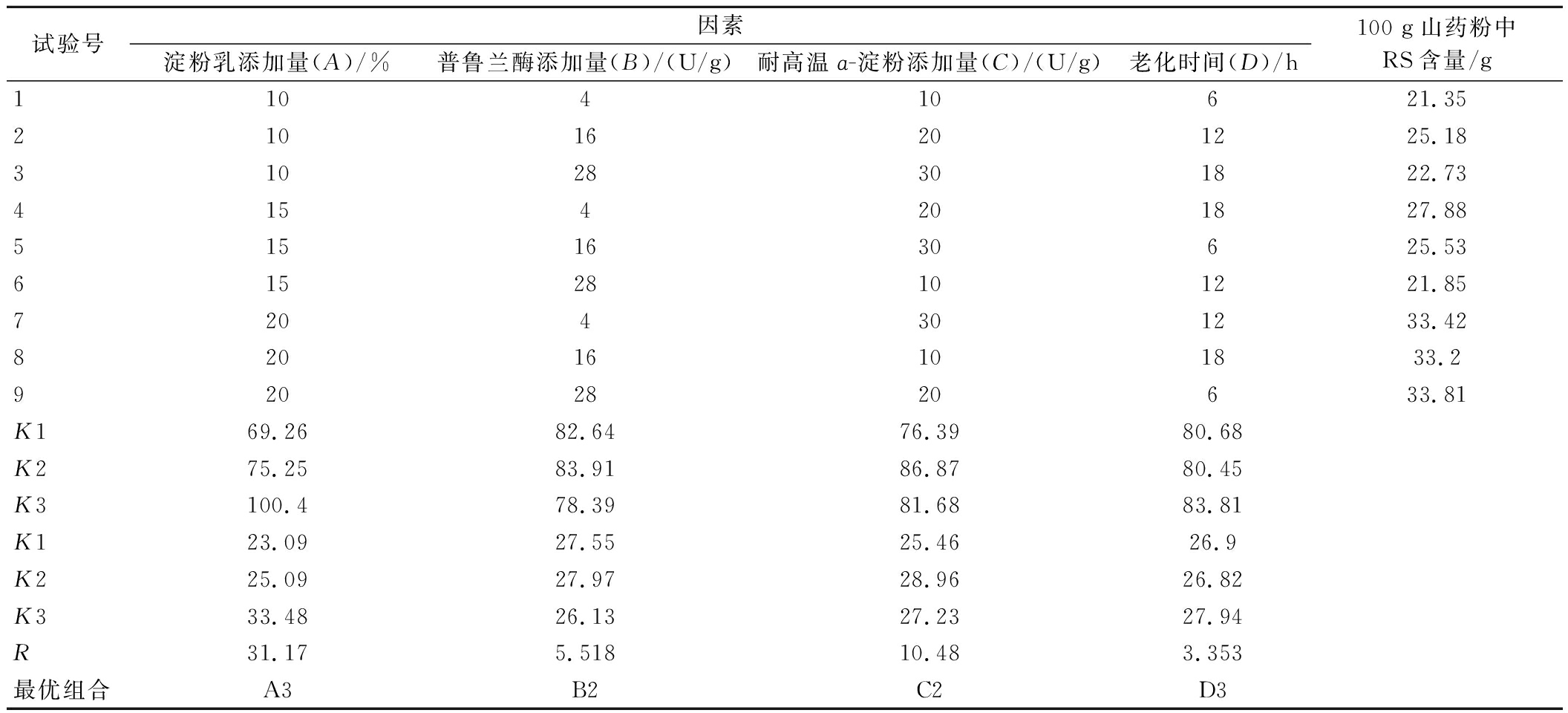
试验号因素淀粉乳添加量(A)/%普鲁兰酶添加量(B)/(U/g)耐高温ɑ-淀粉添加量(C)/(U/g)老化时间(D)/h100 g山药粉中RS含量/g110410621.3521016201225.1831028301822.734154201827.885151630625.5361528101221.857204301233.4282016101833.29202820633.81K169.2682.6476.3980.68K275.2583.9186.8780.45K3100.478.3981.6883.81K123.0927.5525.4626.9K225.0927.9728.9626.82K333.4826.1327.2327.94R31.175.51810.483.353最优组合A3B2C2D3
2.2 抗性淀粉碘结合曲线
碘与直链淀粉结合形成蓝色络合物的最大吸收峰为600~640 nm,与支链淀粉结合形成紫红色复合物最大吸收峰为520~560 nm;吸收峰的位置和强度反映碘-碳化学键信息,可用于直/支链淀粉比例及分子质量大小的鉴别。山药抗性淀粉碘吸收曲线见图2,其最大吸收峰为585 nm,表明以直链为主;最大吸收峰较淀粉碘曲线左移,表明在提取过程中直链淀粉和支链淀粉的比例发生了变化。
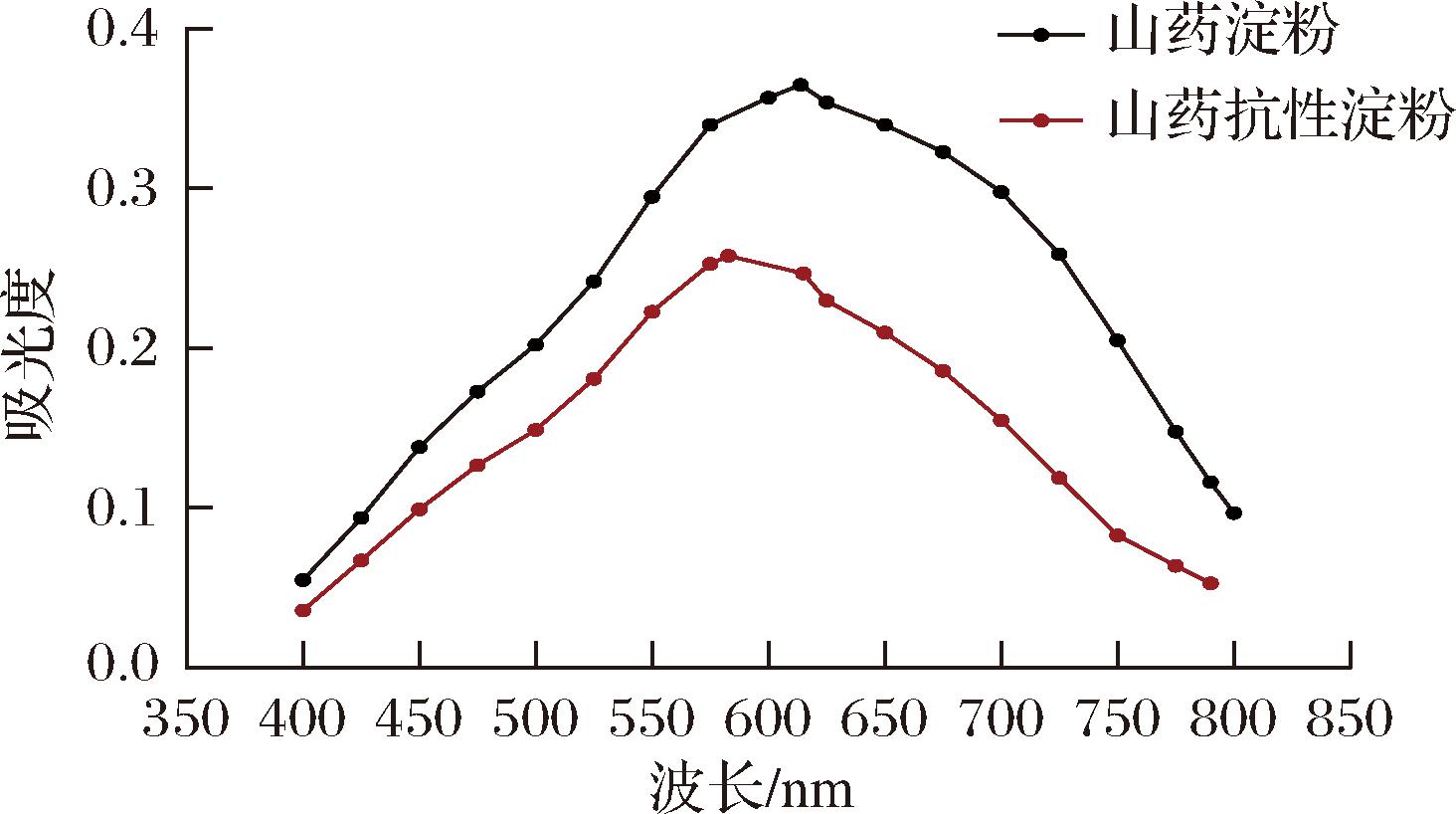
图2 山药淀粉和山药抗性淀粉的淀粉碘吸收曲线图
Fig.2 Starch iodine uptake profiles of yam starch and yam resistant starch
2.3 镜检结果
由图3可知,光镜下山药粉与山药淀粉多为卵形或椭圆形;而抗性淀粉则呈球形或不规则卵形,大小不一,有少许复粒,较淀粉颗粒小。偏光镜下山药粉和山药淀粉具有典型双折射“马耳他十字”特征,偏光十字交叉点偏向一端,呈X型交叉;抗性淀粉颗粒较小,偏光十字不甚明显,十字交叉点位于中心。表明淀粉链的氢键在高温高压环境下受水分影响易被打开,导致淀粉重组形成致密新颗粒。
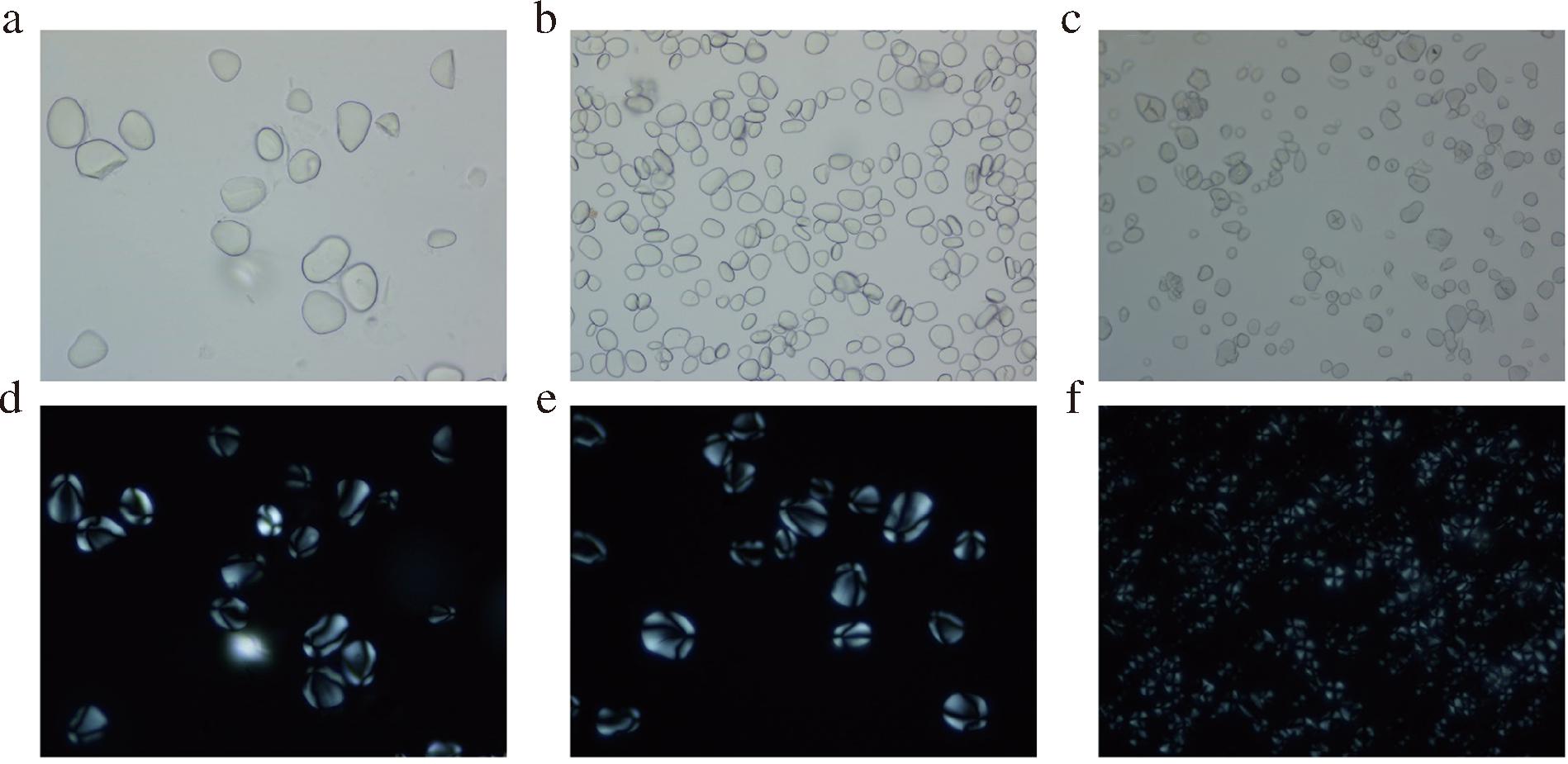
a~c分别为山药粉、山药淀粉和山药抗性淀粉的光学显微镜图;d~f分别为山药粉、山药淀粉和山药抗性淀粉的双折射模式图
图3 样品光学显微镜图及双折射模式图(400×)
Fig.3 Optical microscope diagram and birefringence pattern of the sample (400×)
注:a,b,c为光学显微镜下观察;d,e,f为偏光显微镜下观察。
2.4 山药抗性淀粉对UC小鼠症状的影响
如图4所示,模型组小鼠表现为体重减轻、腹泻、血便。与对照组相比,模型组小鼠DAI评分显著增加(P<0.000 1)、结肠长度显著缩短(P<0.001)。与模型组相比(图5-A和图5-B),山药抗性淀粉低剂量组和山药抗性淀粉中剂量组能够显著减轻DSS诱导的小鼠结肠长度的缩短(P<0.05),山药抗性淀粉高剂量组能够极显著减轻DSS诱导的小鼠结肠长度的缩短(P<0.01)。山药抗性淀粉低中、高剂量组均显著降低了小鼠的DAI评分(P<0.000 1)。
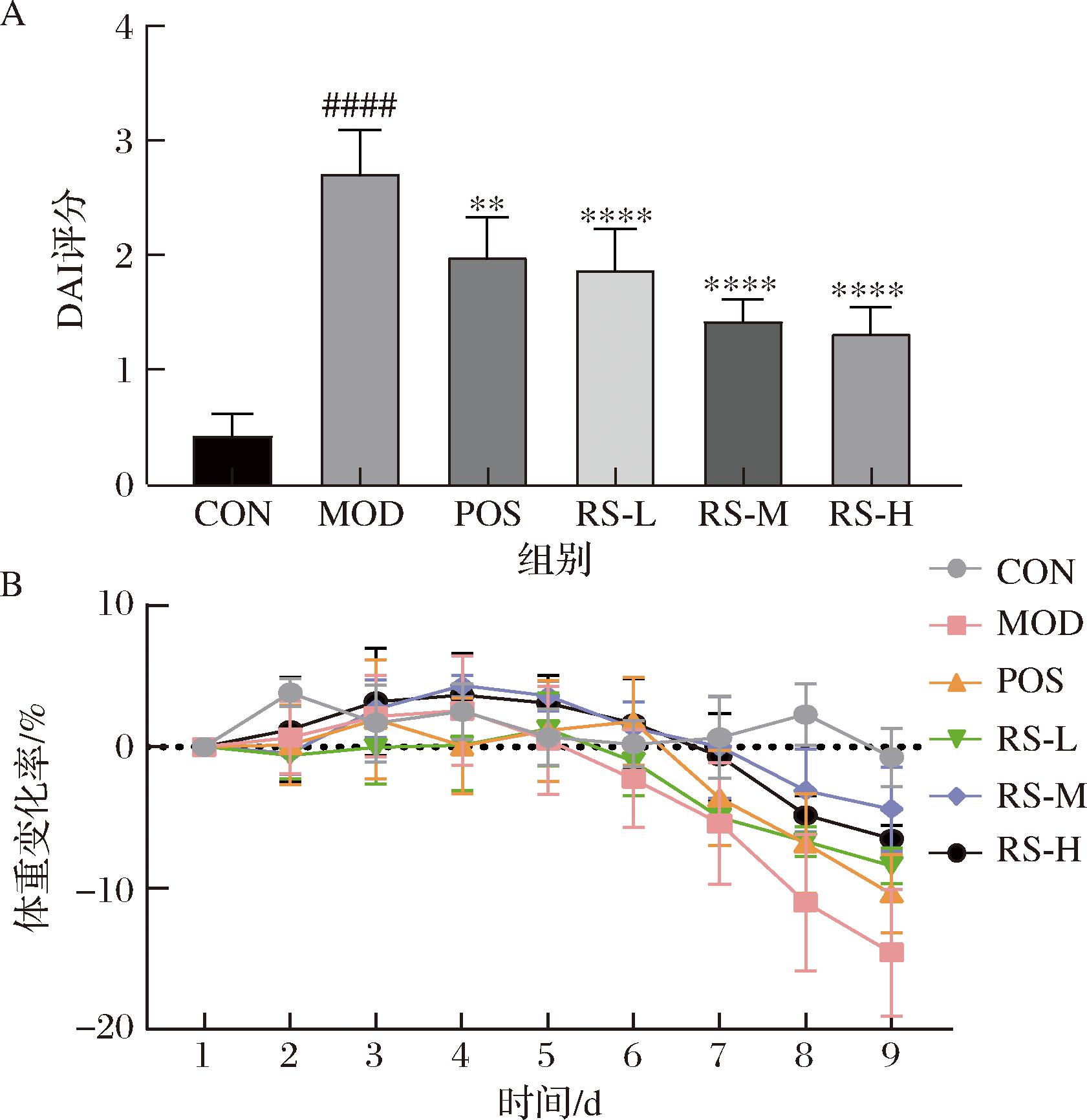
A-疾病活动指数;B-体重变化
图4 山药抗性淀粉对溃疡性结肠炎小鼠体重的影响
Fig.4 Effect of yam resistant starch on body weight in mice with ulcerative colitis
注:与CON组相比,####P<0.000 1;与DSS组相比,**P<0.01,****P<0.000 1。
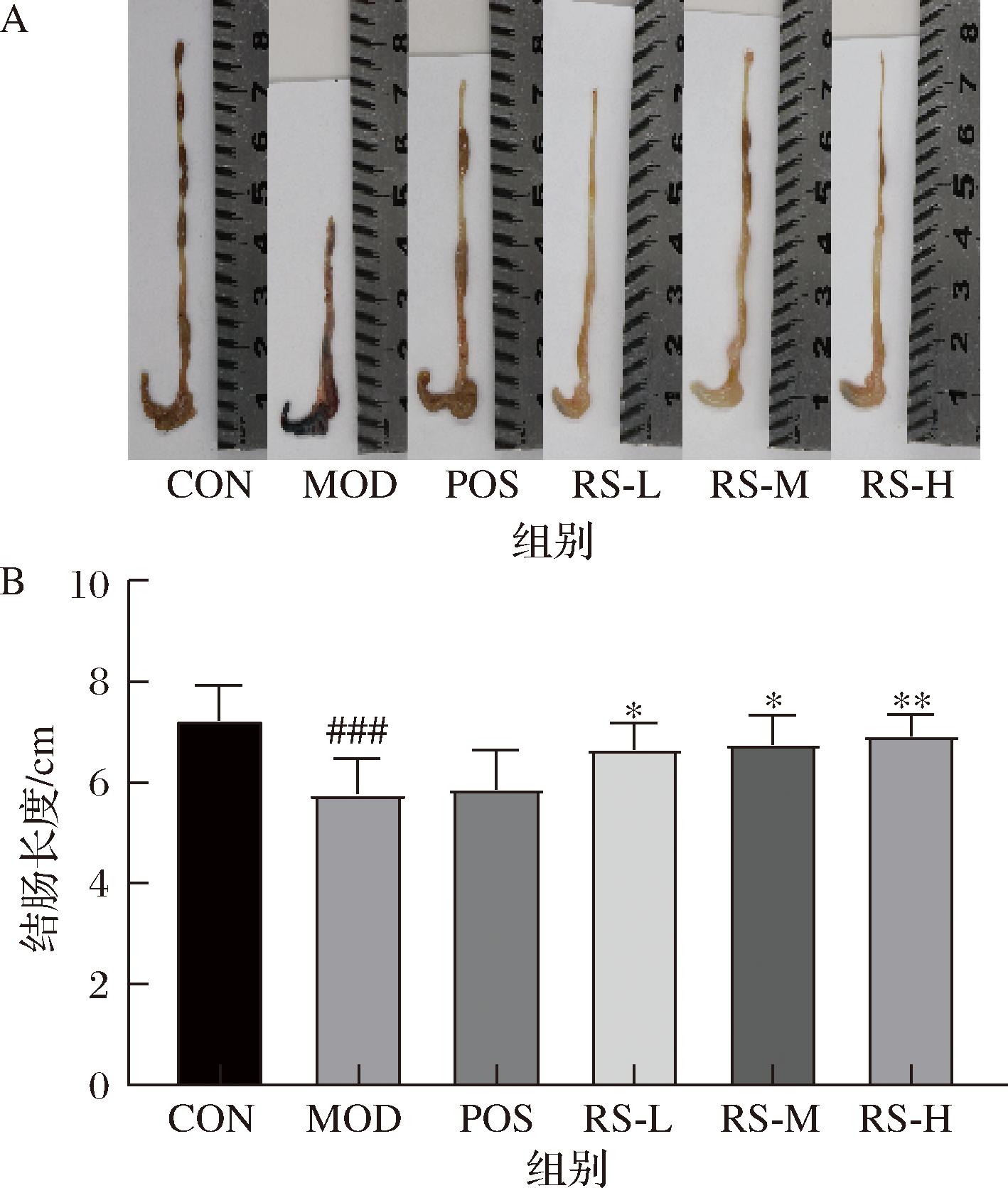
A-结肠组织;B-结肠长度
图5 山药抗性淀粉对溃疡性结肠炎小鼠结肠的影响
Fig.5 Effect of yam resistant starch on colon in mice with ulcerative colitis
注:与CON组相比,###P<0.001;与DSS组相比,*P<0.05,**P<0.01。
2.5 山药抗性淀粉对UC小鼠病理组织的影响
对小鼠结肠组织进行HE染色,以评价山药抗性淀粉对UC小鼠结肠的影响。如图6所示,模型组小鼠的隐窝明显受损,结肠内大量炎症细胞浸润,黏膜损伤严重。山药抗性淀粉高剂量组小鼠结肠黏膜上皮结构完整,炎症细胞浸润程度低,隐窝病灶范围较小,与模型组组织学评分相比下降了19.23%(P<0.001)。山药抗性淀粉显著减少了UC小鼠结肠组织损伤,保护肠道上皮细胞,减轻小鼠炎症程度,维持肠黏膜完整性。

A-结肠组织病理学评分;B-结肠HE染色,100×
图6 山药抗性淀粉对溃疡性结肠炎小鼠结肠病理的影响
Fig.6 Effect of yam resistant starch on colon pathology in mice with ulcerative colitis
注:与CON组相比,####P<0.000 1;与DSS组相比,**P<0.01,***P<0.001。
2.6 山药抗性淀粉促进结肠组织ZO-1蛋白、MUC2蛋白表达
通过对小鼠结肠组织ZO-1蛋白和MUC2蛋白进行免疫荧光染色和荧光面积计算,以评价山药粉对DSS诱导的UC小鼠结肠肠道紧密连接蛋白和黏蛋白的影响。与对照组相比,模型组ZO-1蛋白、MUC2蛋白表达显著降低(P<0.000 1),表明模型组小鼠肠道紧密连接蛋白被破坏,黏蛋白分泌黏液减少,肠道屏障受损;与模型组相比,山药抗性淀粉中、高剂量组ZO-1表达升高(P<0.01),山药抗性淀粉低剂量组MUC2表达升高(P<0.01),山药抗性淀粉中、高剂量组MUC2表达显著升高(P<0.000 1)(图7),山药抗性淀粉能保护结肠炎小鼠的肠道屏障。

A-ZO-1(红色荧光)的免疫荧光染色,200×;B-MUC2(绿色荧光)的免疫荧光染色,200×;C-ZO-1 免疫荧光蛋白的面积密度;D-MUC2免疫荧光蛋白的面积密度
图7 山药抗性淀粉对溃疡性结肠炎小鼠结肠ZO-1和MUC2蛋白表达的影响
Fig.7 Effect of yam resistant starch on ZO-1 and MUC2 protein expression of colonic tissues in mice with ulcerative colitis
注:与CON组相比####P<0.000 1;与DSS组相比*P<0.05,**P<0.01,****P<0.000 1。
2.7 山药抗性淀粉对结肠组织中的细胞因子的影响
如图8所示,检测小鼠结肠组织的炎症因子TNF-α、IL-6和IL-17以及抗炎细胞因子IL-10的浓度水平。与对照组相比,模型组的IL-10浓度显著降低(P<0.000 1),TNF-α、IL-6和IL-17水平显著升高(P<0.000 1)。与模型组相比,山药抗性淀粉中、高剂量组的IL-10浓度显著升高(P<0.000 1),TNF-α、IL-6和IL-17水平均显著降低(P<0.000 1)。因此,山药抗性淀粉可以通过降低促炎因子的水平缓解UC。
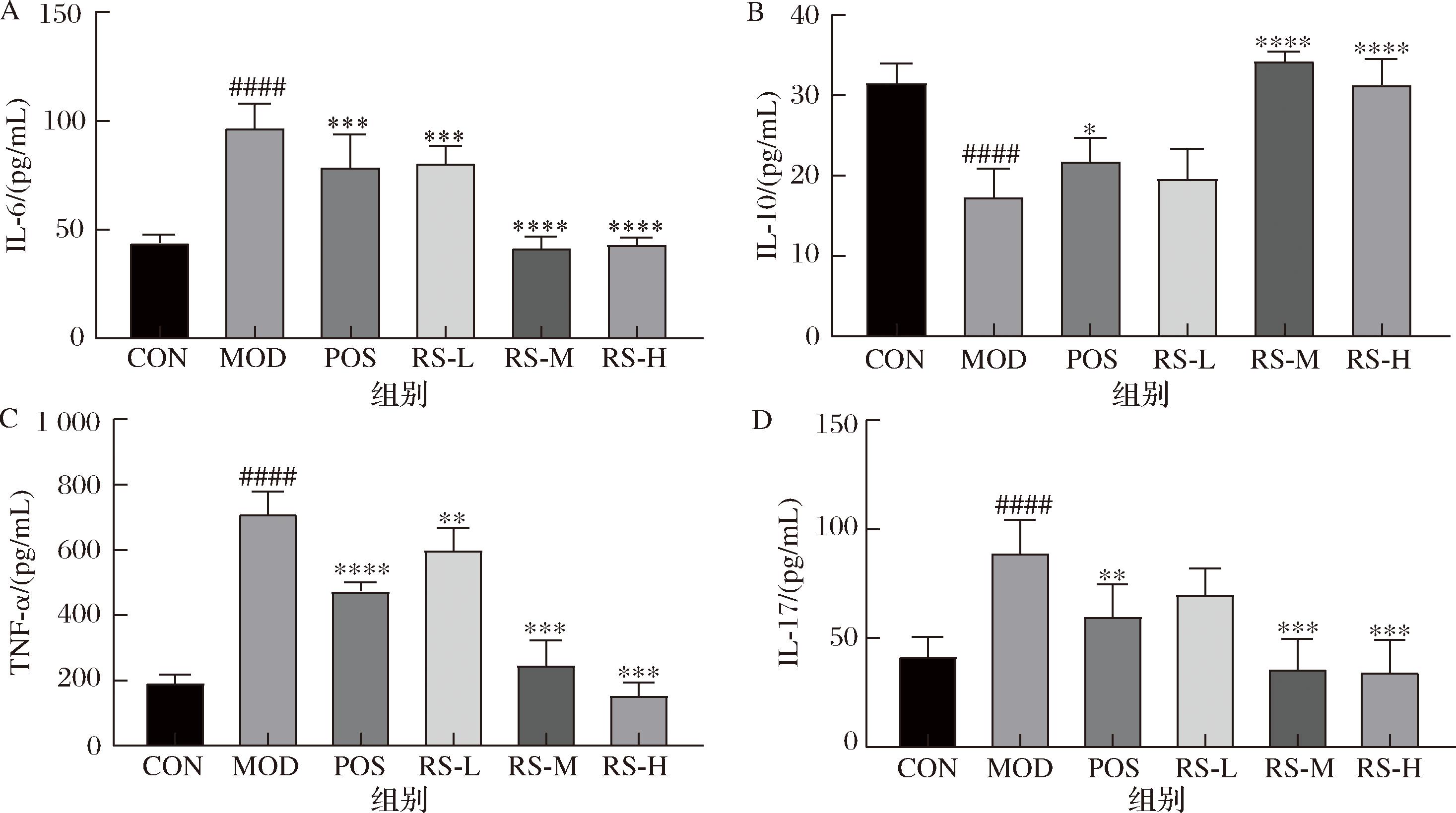
A-IL-6;B-IL-10;C-TNF-α;D-IL-17
图8 山药抗性淀粉对溃疡性结肠炎小鼠结肠组织中炎症因子的影响
Fig.8 Effect of yam resistant starch on inflammatory factors of colonic tissues in mice with ulcerative colitis
注:与CON组相比####P<0.000 1;与DSS组相比*P<0.05, **P<0.01,***P<0.001,****P<0.000 1。
2.8 山药抗性淀粉对结肠组织中ROR-γt和Foxp3 mRNA表达的影响
图9结果表明,模型组小鼠结肠中ROR-γt的表达量明显高于对照组(P<0.001),而Foxp3的表达量明显低于对照组(P<0.05)。山药抗性淀粉低、中、高剂量组结肠中Foxp3的表达均显著增加(P<0.000 1)。山药抗性淀粉低、中、高剂量组结肠中ROR-γt的表达明显低于模型组(P<0.000 1)(图9)。ROR-γt是Th17细胞特异性表达的转录因子,可调节Th17细胞分泌促炎因子。Foxp3是一种特异性表达于Treg细胞核的转录因子,能调节Treg细胞分泌抗炎因子,RORγt/Foxp3的表达与Th17/Treg免疫稳态密切相关。山药抗性淀粉可能通过调节Th17/Treg平衡对溃疡性结肠炎进行保护。
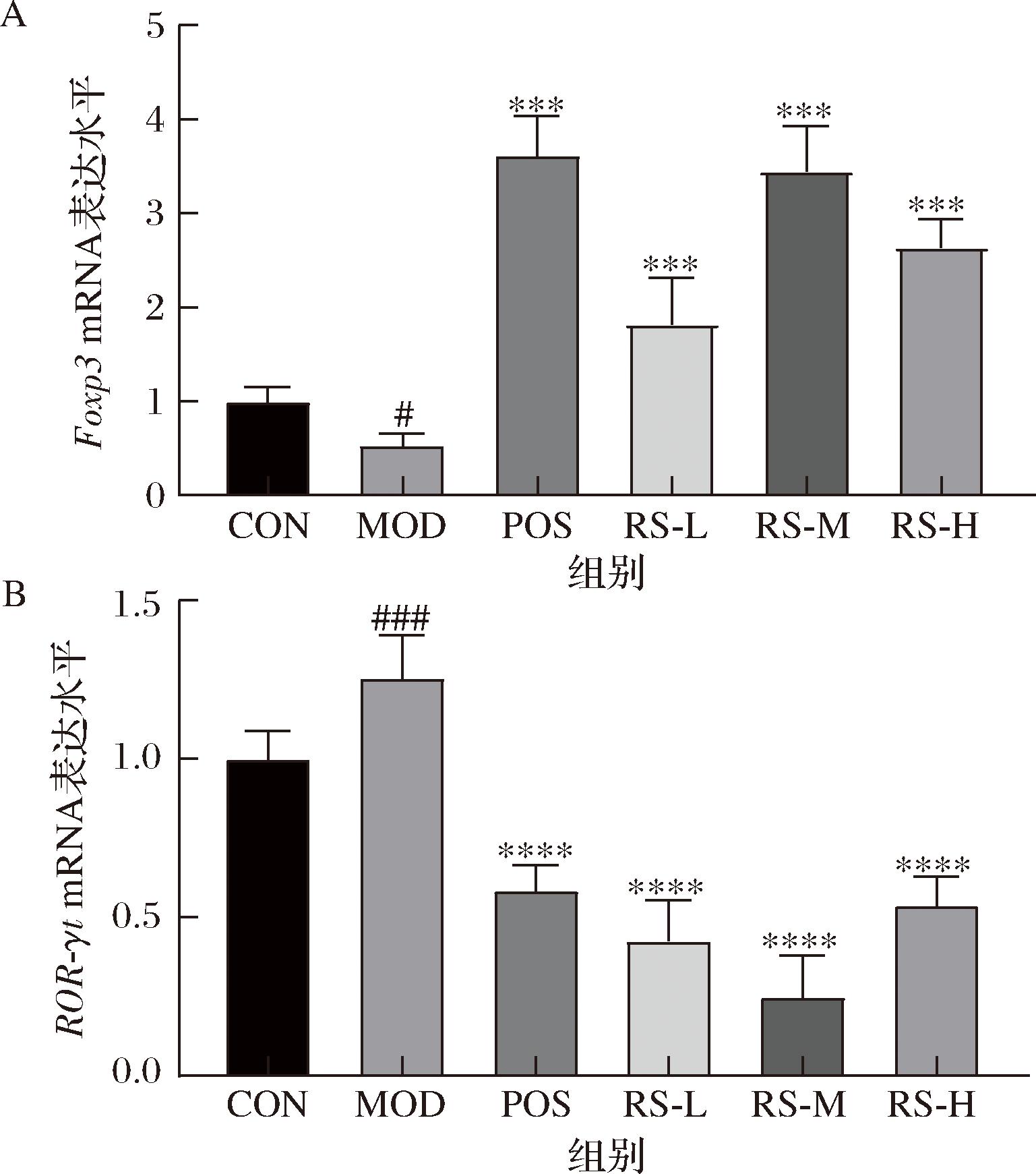
A-Foxp3;B-ROR-γt
图9 山药抗性淀粉对溃疡性结肠炎小鼠结肠组织中ROR-γt和Foxp3 mRNA表达的影响
Fig.9 Effect of yam resistant starch on ROR-γt and Foxp3 mRNA expression in colonic tissues in mice with ulcerative colitis
注:与CON组相比#P<0.05,###P<0.001;与DSS组相比****P<0.000 1。
2.9 山药抗性淀粉对小鼠肠道短链脂肪酸含量的影响
图10结果表明,与模型组相比,山药抗性淀粉各剂量组小鼠粪便中乙酸的含量显著增加(P<0.05,P<0.01,P<0.001);山药抗性淀粉各剂量组小鼠粪便中丙酸的含量显著增加(P<0.05,P<0.01,P<0.01);山药抗性淀粉各剂量组小鼠粪便中丁酸的含量显著增加(P<0.01,P<0.05,P<0.001)。山药抗性淀粉能够通过调节短链脂肪酸保护溃疡性结肠炎小鼠。
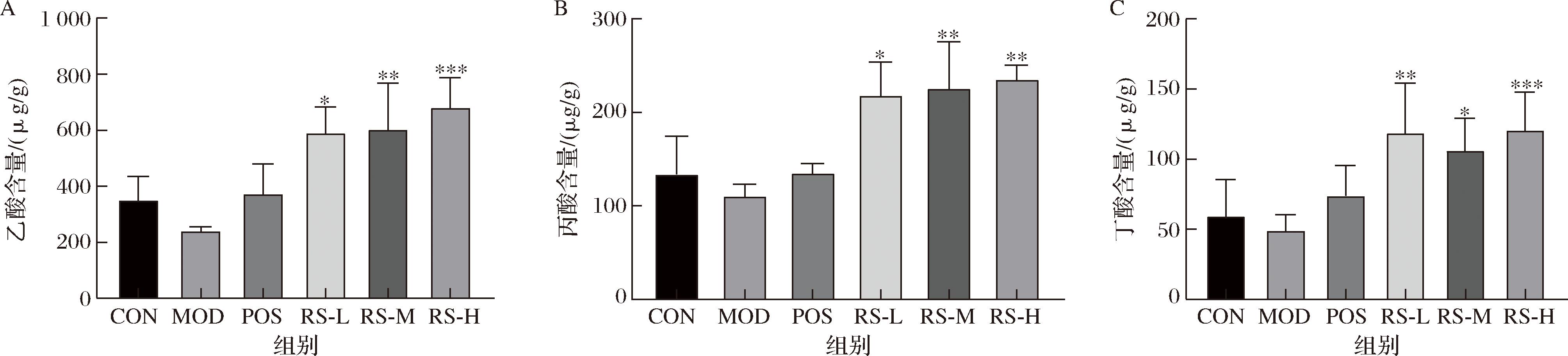
A-乙酸;B-丙酸;C-丁酸
图10 山药抗性淀粉对溃疡性结肠炎小鼠粪便中短链脂肪酸含量的影响
Fig.10 Effect of yam resistant starch on the content of short-chain fatty acids in the feces of mice with ulcerative colitis
注:与DSS组相比*P<0.05,**P<0.01,***P<0.001。
3 结果与讨论
短链脂肪酸是肠道中非消化性碳水化合物厌氧发酵的主要代谢产物,是肠上皮细胞的主要能量来源,同时有助于维持肠道pH平衡,抑制有害微生物的生长,在减轻组织炎症、维护肠道屏障功能和调节肠道免疫系统等方面发挥关键作用。肠道中最主要的短链脂肪酸包括乙酸、丙酸和丁酸,约占95%。研究表明,乙酸作为肠道中含量最高的短链脂肪酸,由多种结肠微生物,如嗜黏蛋白阿克曼菌、拟杆菌和双歧杆菌等,通过伍德—隆达尔代谢途径和丙酮酸氧化脱羧形成乙酰辅酶A途径产生乙酸[15]。此外,肠道菌群通过拟杆菌门介导的琥珀酸途径和厚壁菌门介导的乳酸途径,参与调控丙酸的产生[16]。丁酸作为目前已知的生理活性最为突出的短链脂肪酸,由两分子乙酰辅酶A缩合并还原为丁酰辅酶A,再通过经典途径由特定微生物转化为丁酸[17]。此外,丁酸也可以以外源性乙酸盐为原料产生。研究表明,丁酸盐通过促进MUC2基因表达提供能量,维持结肠细胞的完整性,增强屏障功能,并增加黏蛋白的表达[18]。在结肠产生的短链脂肪酸中,丁酸是紧密连接蛋白最重要的调节因子,已被证明可以通过增加ZO-1的表达以及Occludin的重新分布来增强肠道屏障功能[19]。丁酸盐通过逆转ZO-1的异常表达并减少内毒素易位,从而抑制巨噬细胞活化、炎细胞因子产生和中性粒细胞浸润,减轻肠道损伤。此外,短链脂肪酸还能通过列腺素途径增加肠上皮细胞MUC2黏蛋白的表达[20]。
肠道屏障是调节和维持机体内环境稳态的重要生理防御机制,主要通过以紧密连接蛋白和肠上皮细胞为主的机械屏障、以免疫细胞和细胞因子为主的免疫屏障、以肠道菌群为主的微生物屏障和以黏蛋白和抗菌肽为主的化学屏障发挥作用[21]。肠道屏障功能受损会导致有害微生物的入侵、毒素和代谢产物等物质进入体循环,过度激活免疫细胞,从而引发炎症性肠病。因此,维持肠道屏障的完整性对机体健康至关重要。黏液是一种由杯状细胞分泌的高度糖基化的MUC,覆盖在肠上皮细胞(intestinal epithelial cells, IECs)表面,起到物理隔离的作用,能有效阻止肠道微生物群直接作用于肠黏膜,黏蛋白-2(MUC-2)是由杯状细胞分泌的一种黏蛋白,可形成肠黏膜上皮的保护层[22]。此外,肠上皮细胞通过TJ蛋白(如ZO-1和Occludin)紧密结合,进一步阻止病原菌的入侵。因此,黏蛋白和TJ蛋白协同促进了肠道屏障完整性。短链脂肪酸还能促进IECs增殖[23]。在无菌小鼠中,IECs的增殖活性和细胞更新率降低。补充短链脂肪酸可以逆转这一现象,短链脂肪酸还可以促进体外肠道类器官的发育。丙酸能通过类组蛋白去乙酰化酶和G蛋白偶联受体的抑制以及信号转导子和转录激活子3的激活来增强细胞扩散和极化促进小鼠肠上皮细胞的增殖和迁移[24]。肠道干细胞的增殖和分化是肠道更新和再生的基础。研究表明,短链脂肪酸可以通过激活Wnt/β连环蛋白信号通路介导α-亚麻酸,促进肠道干细胞增殖[25]。由图7可以看出,山药抗性淀粉组小鼠MUC2、ZO-1的表达显著高于模型组。
在溃疡性结肠炎发展过程中,肠道屏障破坏,肠道细菌、内毒素等发生位移,与肠道固有层免疫细胞直接接触,进而诱发肠道免疫失衡。Th17/Treg细胞失衡在溃疡性结肠炎中扮演重要角色,保护肠道屏障,从根本上减少了肠道内容物诱导的免疫反应,减少炎症因子产生、减轻炎症反应,也有利于肠道屏障快速自我修复,Th17/Treg细胞恢复进一步改善肠道炎症。ROR-γt、Foxp3分别是Th17、Treg细胞特异性转录因子,ROR-γt/Foxp3的表达与Th17/Treg免疫稳态密切相关[26]。丁酸盐激活过氧化物酶体增殖激活受体γ(peroxisome proliferator-activated receptor, PPARγ)并重塑能量代谢以调节Th17/Treg细胞平衡[27]。在本研究中,山药抗性淀粉组小鼠结肠中ROR-γt mRNA的表达显著降低,与粪便中丁酸水平呈负相关;Foxp3 mRNA的表达显著升高,与粪便中丁酸水平呈正相关,表明山药抗性淀粉通过提高肠道中丁酸含量,抑制Th17细胞分化、促进溃疡性结肠炎恢复。
综上所述,山药抗性淀粉对DSS诱导的小鼠结肠炎有显著的保护作用。其作用机制可能是山药抗性淀粉通过调节肠道微生物产生SCFAs,促进ZO-1和MUC2表达,修复肠黏膜,减少有害物质渗出,降低炎症反应;SCFAs通过直接作用,恢复Treg/Th17细胞平衡,减轻肠道炎症,也有利于肠道修复,共同促进溃疡性结肠炎恢复。本研究为山药抗性淀粉防治UC功能食品开发提供了思路和借鉴。
[1] REUTER M A, TUCKER M, MARFORI Z, et al. Dietary resistant starch supplementation increases gut luminal deoxycholic acid abundance in mice[J]. Gut Microbes, 2024, 16:2315632.
[2] NAN N, WANG D X. Type 2 autoimmune pancreatitis associated with ulcerative colitis[J]. Frontiers in Immunology, 2023, 14:1288390.
[3] 张林瑞, 张文风. 乌梅丸治疗溃疡性结肠炎的研究进展[J/OL]. 中国实验方剂学杂志, 2024. https://link.cnki.net/doi/10.13422/j.cnki.syfjx.20241913.ZHANG L R, ZHANG W F. Research progress of wumeiwan in treatment of ulcerative colitis[J/OL]. Chinese Journal of Experimental Traditional Medical Formulae, 2024. https://link.cnki.net/doi/10.13422/j.cnki.syfjx.20241913.
[4] LE BERRE C, HONAP S, PEYRIN-BIROULET L. Ulcerative colitis[J]. The Lancet, 2023, 402(10401):571-584.
[5] 丁瑞, 王文秀, 朱远韧, 等. 桃胶多糖对DSS诱导小鼠溃疡性结肠炎的保护作用[J]. 食品工业科技, 2025, 46(14):419-429.DING R, WANG W X, ZHU Y R, et al. Protective effect of peach gum polysaccharides on DSS-induced ulcerative colitis in mice[J]. Science and Technology of Food Industry, 2025, 46(14):419-429.
[6] ORD S I, ECKMANN L, TALAMINI M, et al. Ulcerative colitis[J]. The Lancet, 2012, 380(9853):1606-1619.
S I, ECKMANN L, TALAMINI M, et al. Ulcerative colitis[J]. The Lancet, 2012, 380(9853):1606-1619.
[7] KUCHARZIK T, KOLETZKO S, KANNENGIESSER K, et al. Ulcerative colitis-diagnostic and therapeutic algorithms[J]. Deutsches Arzteblatt International, 2020, 117(33-34):564-574.
[8] ZENG W, HE D, XING Y F, et al. Internal connections between dietary intake and gut microbiota homeostasis in disease progression of ulcerative colitis: A review[J]. Food Science and Human Wellness, 2021, 10(2):119-130.
[9] 冯学锋, 黄璐琦, 格小光, 等. 山药道地药材形成源流考[J]. 中国中药杂志, 2008, 33(7):859-862.FENG X F, HUANG L Q, GE X G, et al. Textual research on origin and development of genuine medicinal herbs of Shanyao[J]. China Journal of Chinese Materia Medica, 2008, 33(7):859-862.
[10] ZHANG X Q, LIANG D, LIU N, et al. Preparation and characterization of resistant starch type 3 from yam and its effect on the gut microbiota[J]. Traditional Medicine Research, 2022, 7(2):11.
[11] NAIK B, KUMAR V, GOYAL S K, et al. Pullulanase: Unleashing the power of enzyme with a promising future in the food industry[J]. Frontiers in Bioengineering and Biotechnology, 2023, 11:1139611.
[12] SUN H J, GUO Y K, WANG H D, et al. Gut commensal Parabacteroides distasonis alleviates inflammatory arthritis[J]. Gut, 2023, 72(9):1664-1677.
[13] HODGKINSON K, EL ABBAR F, DOBRANOWSKI P, et al. Butyrate’s role in human health and the current progress towards its clinical application to treat gastrointestinal disease[J]. Clinical Nutrition, 2023, 42(2):61-75.
[14] ENGLYST H N, KINGMAN S M, CUMMINGS J H. Classification and measurement of nutritionally important starch fractions[J]. European Journal of Clinical Nutrition, 1992, 46(Suppl 2): S33-S50.
[15] SCHIEL-BENGELSDORF B, DÜRRE P. Pathway engineering and synthetic biology using acetogens[J]. FEBS Letters, 2012, 586(15):2191-2198.
[16] MARTIN-GALLAUSIAUX C, MARINELLI L, BLOTTI RE H M, et al. SCFA: Mechanisms and functional importance in the gut[J]. Proceedings of the Nutrition Society, 2021, 80(1):37-49.
RE H M, et al. SCFA: Mechanisms and functional importance in the gut[J]. Proceedings of the Nutrition Society, 2021, 80(1):37-49.
[17] KOH A, DE VADDER F, KOVATCHEVA-DATCHARY P, et al. From dietary fiber to host physiology: Short-chain fatty acids as key bacterial metabolites[J]. Cell, 2016, 165(6):1332-1345.
[18] LI Y K, LI H Q, WANG R, et al. Protective effect of sodium butyrate on intestinal barrier damage and uric acid reduction in hyperuricemia mice[J]. Biomedicine &Pharmacotherapy, 2023, 161:114568.
[19] ZHAO H R, WANG Q, ZHAO J, et al. Ento-a alleviates DSS-induced experimental colitis in mice by remolding intestinal microbiota to regulate SCFAs metabolism and the Th17 signaling pathway[J]. Biomedicine &Pharmacotherapy, 2024, 170:115985.
[20] LIU Y X, YU Z H, ZHU L P, et al. Orchestration of MUC2-The key regulatory target of gut barrier and homeostasis: A review[J]. International Journal of Biological Macromolecules, 2023, 236:123862.
[21] SUZUKI T. Regulation of the intestinal barrier by nutrients: The role of tight junctions[J]. Animal Science Journal, 2020, 91(1): e13357.
[22] KANG Y, PARK H, CHOE B H, et al. The role and function of mucins and its relationship to inflammatory bowel disease[J]. Frontiers in Medicine, 2022, 9:848344.
[23] 李新科, 杨雪, 张萱, 等. 短链脂肪酸对肠道屏障保护作用的研究进展[J]. 动物营养学报, 2024, 36(8):4861-4871.LI X K, YANG X, ZHANG X, et al. Research progress on protective effects of short chain fatty acids on intestinal barrier[J]. Chinese Journal of Animal Nutrition, 2024, 36(8):4861-4871.
[24] BILOTTA A J, MA C Y, YANG W J, et al. Propionate enhances cell speed and persistence to promote intestinal epithelial turnover and repair[J]. Cellular and Molecular Gastroenterology and Hepatology, 2021, 11(4):1023-1044.
[25] LIU J Q, XIAO Q, XIAO J N, et al. Wnt/β-catenin signalling: Function, biological mechanisms, and therapeutic opportunities[J]. Signal Transduction and Targeted Therapy, 2022, 7:3.
[26] XU M, POKROVSKII M, DING Y, et al. C-MAF-dependent regulatory T cells mediate immunological tolerance to a gut pathobiont[J]. Nature, 2018, 554(7692):373-377.
[27] BYNDLOSS M X, OLSAN E E, RIVERA-CH VEZ F, et al. Microbiota-activated PPAR-γ signaling inhibits dysbiotic Enterobacteriaceae expansion[J]. Science, 2017, 357(6351):570-575.
VEZ F, et al. Microbiota-activated PPAR-γ signaling inhibits dysbiotic Enterobacteriaceae expansion[J]. Science, 2017, 357(6351):570-575.