铁蛋白是一类天然的铁储存蛋白,广泛分布于不同生物体中,由24个蛋白亚基组成高度对称的中空笼状蛋白质分子,结构非常保守,整个蛋白分子的外径约为12 nm,内径约为8 nm[1],在八面体笼状结构中,每个亚基通过3个不同的对称相关界面与6个相邻单体进行接合[2]。这种独特的结构使得铁蛋白能够高效地储存铁离子,并在需要时释放铁以供生物体利用。天然的铁蛋白是一种良好的铁补充制剂[3],在控制细胞铁代谢、维持体内铁平衡等方面起着至关重要的作用。铁蛋白的内部空腔结构能够储存多达4 500个铁原子,从而防止游离铁离子在细胞内产生有害的氧化反应。此外,铁蛋白还参与调节铁的吸收、转运和释放,确保铁在体内的动态平衡。铁蛋白分布于哺乳动物的所有组织中,尤其是肝脏和脾脏[4],这些器官是体内铁储存和代谢的主要场所。目前,铁蛋白的研究主要集中在豆类、哺乳动物等,而水产来源的铁蛋白基础研究较为缺乏。
鲟鱼,又称鲟龙,属鲟形目,是现存淡水鱼中体型较大、寿命较长的鱼类之一,具有极高的经济价值、营养价值和生物学研究价值,发展前景广阔。但鲟鱼加工过程中产生的鱼骨、鱼皮、肝脏等加工副产物精深加工利用率较低[5],目前研究主要集中在鱼骨[6]、鱼皮[7],而鲟鱼肝脏作为加工中的主要副产物,通常会被直接丢弃。铁蛋白通常分布于肝脏等代谢旺盛的组织中,从鲟鱼肝脏中提取铁蛋白,具有生物相容性好等特点[8],可以解决传统补铁剂(如硫酸亚铁)的生物利用率低和胃肠道刺激问题。目前,针对鲟鱼源铁蛋白的研究相对较少,尤其是不同种类鲟鱼铁蛋白的对比研究尚不充分。因此,从鲟鱼肝脏中提取铁蛋白,不仅可以最大限度地利用现有食物蛋白质资源,还能够促进循环经济的发展,减少环境污染。
本研究对3种鲟鱼源肝脏铁蛋白的基本理化性质和结构特征进行了系统的研究和比较,通过实验分析与生物信息学预测相结合,揭示了3种铁蛋白在形态、粒径、二级结构、氨基酸组成等方面的共性与差异。本研究不仅为全面了解鲟鱼源肝脏铁蛋白的理化性质与结构特征提供了科学依据,还通过生物信息学分析预测了其潜在功能,为进一步探索鱼类铁蛋白在生物制药和食品保健中的应用奠定了理论基础。
1 材料与方法
1.1 材料与试剂
3种鲟鱼肝脏样品,是鲟鱼鱼子酱加工过程中的副产物,分别来源于西伯利亚鲟鱼(Acipenser baerii)、史氏鲟鱼(Acipenser schrenckii)和海博瑞鲟鱼(Huso huso),鲟鱼均为养殖7年、处于成年阶段的雌鱼,购于四川润兆食品有限公司;DE-52弱阴离子交换填料、Sephacryl-S-300凝胶过滤填料,北京瑞达恒辉科技发展有限公司;SDS-PAGE凝胶制备试剂盒,武汉博士德生物工程有限公司;5×SDS-PAGE上样缓冲液、2×Native-PAGE上样缓冲液,上海生工生物工程股份有限公司;彩色预染蛋白质Marker,美国Thermo公司;考马斯亮蓝极速染色液,山东思科捷生物技术有限公司;磷钨酸,上海源叶生物科技有限公司;溴化钾,上海麦克林生化科技有限公司;碳酸氢铵,成都市科隆化学品有限公司;乙腈、甲酸,美国Thermo公司;实验用水均为超纯水。
1.2 仪器与设备
RCD-1A高速均质乳化机,常州越新仪器制造有限公司;TGL-18M高速冷冻离心机,上海卢湘仪离心机仪器有限公司;DF-101S恒温加热磁力搅拌器,上海力辰邦西有限公司;BioLogic DuoFlow 20蛋白纯化系统、Power PacTM HV电泳仪、Gel Doc XR+凝胶成像系统,美国Bio-Rad公司;U3000高效液相色谱仪、Nicoletl iS10傅里叶红外色谱仪,美国Thermo公司;Triple TOF 5600高效液相色谱-串联质谱仪,美国SCIEX公司;JEM-2100 Plus透射电子显微镜,日本JEOL公司。
1.3 实验方法
1.3.1 3种鲟鱼源肝脏铁蛋白的制备
本实验选取3种不同品种的鲟鱼,包括西伯利亚鲟鱼、史氏鲟鱼和海博瑞鲟鱼。参考丁炳文[9]的方法进行3种不同品种鲟鱼肝脏铁蛋白的制备。从西伯利亚鲟鱼、史氏鲟鱼和海博瑞鲟鱼的肝脏中提取纯化出的铁蛋白分别命名为SLF-1、SLF-2、SLF-3,用于后续的研究。
1.3.2 蛋白质理化性质及结构表征的测定
1.3.2.1 电泳分析
Native-PAGE电泳参考LAEMMLIU[10]的方法,稍作修改。参考SDS-PAGE凝胶制备试剂盒说明书,选择5%的浓缩胶和6%的分离胶进行电泳,在4 ℃,恒流5 mA的条件下进行实验。结束后进行考马斯亮蓝染色,观察其表观分子质量的大小。
SDS-PAGE电泳参考LI等[11]的方法。参考SDS-PAGE凝胶制备试剂盒说明书,选择5%的浓缩胶和12%的分离胶进行电泳,浓缩胶电压80 V,分离胶电压120 V,电泳结束后进行考马斯亮蓝染色,观察其亚基分子质量的大小。
1.3.2.2 透射电子显微镜(transmission electron microscope, TEM)测定
参考李蝶等[12]的方法,取5 μL铁蛋白溶液(1 mg/mL)在普通碳膜铜网上静置5 min,然后用3 μL 的2%(体积分数)磷钨酸进行负染色2 min,自然晾干后,使用透射电镜以100 kV在100 nm比例尺下观察并拍摄结构成像。
1.3.2.3 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)测定
参考WANG等[13]的方法,将蛋白质冷冻干燥后,采用溴化钾压片法进行红外光谱扫描。
1.3.2.4 氨基酸组成及含量测定
参考YANG等[14]的方法,略作修改。采用高效液相色谱系统对氨基酸进行测定,紫外检测器设置在338 nm,C18色谱柱(4.6 mm×100 mm, 2.7 μm)保持在40 ℃。通过将样品的峰谱与标准氨基酸谱进行比较,对氨基酸进行鉴定和定量。
1.3.2.5 LC-MS/MS分析
参考SONG等[3]的方法,稍作修改。将脱色试纸用巯基还原密封后,用25 mmol/L 碳酸氢铵在4 ℃下稀释酶液30 min,加入缓冲液浸没试纸。然后加入5倍体积的50%(体积分数)乙腈,涡旋5 min,8 000 r/min离心1 min,重复2次。将得到的上清液在25 000 r/min下离心5 min收集上清液,取上清液冷冻干燥。干燥后的多肽样品用流动相A[2%(体积分数)乙腈,0.1%(体积分数)甲酸]重组,20 000 r/min离心10 min,取上清液进样。样品经捕集柱富集脱盐后,进入自填充C18柱(75 μm×200 mm, 3 μm),以300 nL/min流速分离,梯度为:0~30 min,流动相B(98%(体积分数)乙腈,0.1%(体积分数)甲酸) 从5%线性增至24%;30~40 min,流动相B由24%线性增加到30%;40~45 min,流动相B从30%~80%;45~50 min,80%流动相B;50~60 min,5%流动相B。将液相色谱分离的多肽传递至ESI串联质谱仪检测,离子源为Nanospray Ⅲ源。喷射电压为2 300 V,氮气压力为35 psi。MS1扫描累积时间为250 ms,范围为350 m/z~1 500 m/z。
1.3.2.6 生物信息学分析
基于ExPasy Prot-Param (https://web.expasy.org/protp aram/)预测蛋白质各种理化性质;基于ProtScale (https://web.expasy.org/protscale/)分析蛋白质的亲疏水性;通过TMHMM 2.0 (https://services.healthtech.dtu.dk/services/TMHMM-2.0/)预测蛋白质的跨膜结构域;通过SignalP 4.1 (https://services.healthtech.dtu.dk/services/SignalP-4.1/)预测信号肽;通过SOPMA (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)预测蛋白质的二级结构;通过AlphaFold server(https://alphafoldserver.com/)进行蛋白质三级结构的预测;通过STRING (https://cn.string-db.org/)进行蛋白质-蛋白质互作分析。
1.4 数据处理
所有实验独立进行3次,数据以“平均值±标准差”表示,利用SPSS Statistics 27进行数据分析,利用Origin 2021软件进行作图。
2 结果与分析
2.1 3种鲟鱼肝脏铁蛋白的制备及电泳表征
在本实验前期基础上,依次对蛋白粗提液进行DE-52弱阴离子柱层析和S-300凝胶过滤层析。如图1-a所示,DE-52层析出现4个蛋白峰 (Ⅰ~Ⅳ),其中,峰Ⅰ为杂蛋白峰,峰Ⅱ中含有少量杂蛋白,峰Ⅲ几乎不含杂蛋白,而峰Ⅳ中含有大量杂蛋白,与实验室前期实验结果一致[6]。因此,后续实验中,3种鲟鱼肝脏铁蛋白均收集峰Ⅲ的蛋白溶液,超滤浓缩后进行S-300凝胶过滤层析。如图1-b所示,在含有0.15 mol/L NaCl的Tris-HCl缓冲液 (25 mmol/L, pH 7.5)洗脱条件下,S-300层析仅出现单一蛋白峰,收集后进行电泳验证。由图1-c可知,经过考马斯亮蓝染色后,3种鲟鱼源肝脏铁蛋白在530 kDa处均呈现清晰条带,分子质量与丁炳文[9]的研究结果一致。此外,在669 kDa处还观察到一条较浅的条带,可能是蛋白浓度较高导致的二聚体现象,这一结果与夏小雨等[15]的实验结果相似。进一步分析图1-d可以发现,3种鲟鱼源肝脏铁蛋白均含有2条约为20 kDa的亚基条带,分别对应于H亚基与L亚基,达到了电泳纯。以上结果表明,本实验成功制备出了西伯利亚鲟鱼肝脏铁蛋白 (SLF-1)、史氏鲟鱼肝脏铁蛋白 (SLF-2)和海博瑞鲟鱼肝脏铁蛋白 (SLF-3),为后续研究提供了高纯度样品。
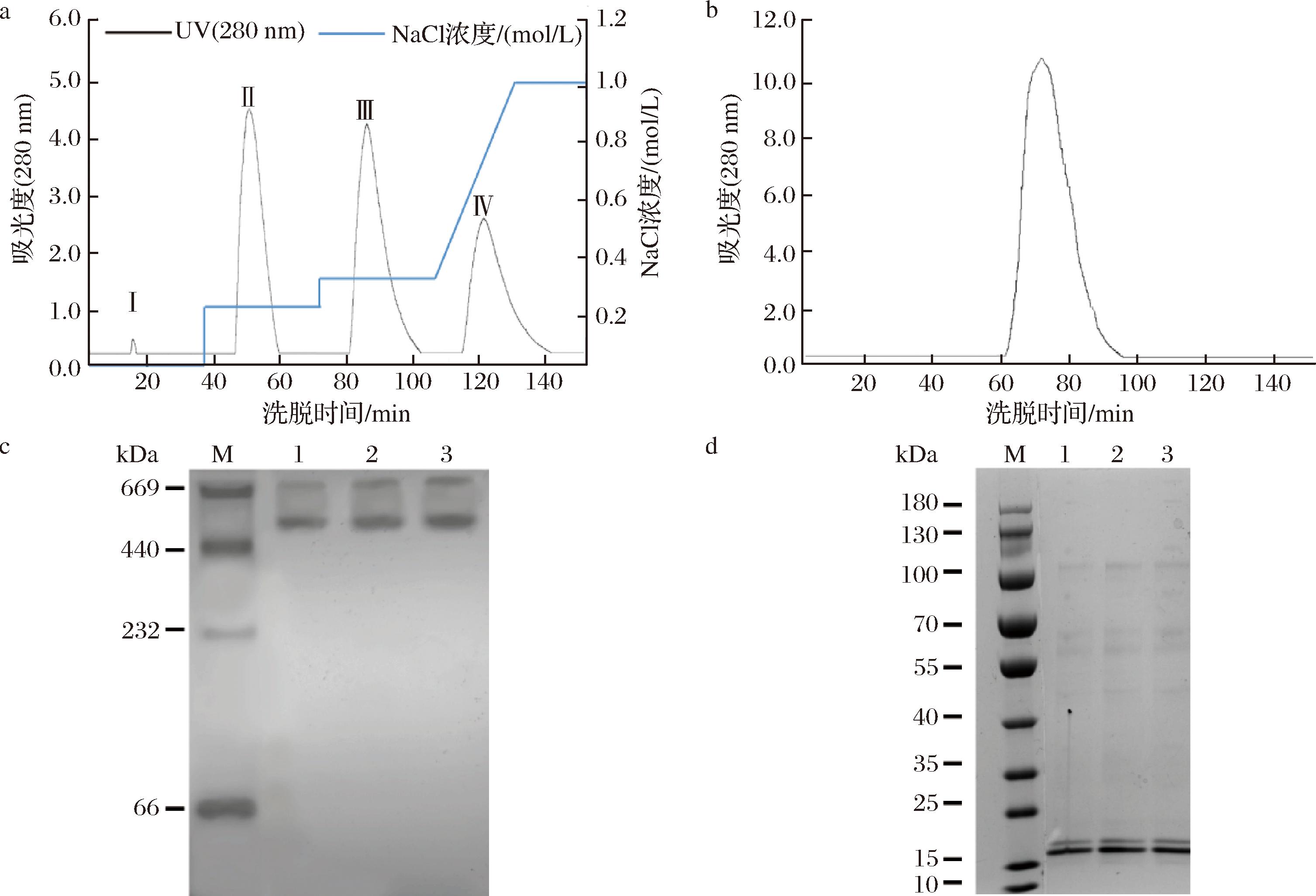
M-标准蛋白Marker,泳道1-西伯利亚鲟鱼肝脏铁蛋白,泳道2-史氏鲟鱼肝脏铁蛋白,泳道3-海博瑞鲟鱼肝脏铁蛋白。
a-DE-52弱阴离子交换层析;b-Sephacryl-S-300凝胶过滤层析;c-Native-PAGE电泳图;d-SDS-PAGE电泳图
图1 鲟鱼肝脏铁蛋白纯化结果图谱
Fig.1 Purification result of liver ferritin of sturgeon
2.2 3种鲟鱼肝脏铁蛋白的TEM分析
TEM技术是微观科学研究中的重要手段,能够提供样品的组织结构、晶体结构等详细信息。由于铁蛋白内部铁核中含有大量铁氧化物,具有较高的电子密度特征,因此本研究采用负染色方法对铁蛋白的晶体结构进行测定。图2展示了3种鲟鱼源肝脏铁蛋白的TEM图像。由图2可知,SLF-1、SLF-2和SLF-3均呈现出大小分布均匀的圆形颗粒结构,颗粒外部为白色的圆环,内部为暗色的内核。其中,白色的圆环对应铁蛋白的蛋白质外壳,而暗色的内核是由于磷钨酸负染色剂渗透到蛋白质外壳内部并染色所致,这一结果与丁炳文等[16]、YANG等[17]的研究结果一致,进一步验证了铁蛋白结构的典型特征。为进一步量化分析,本研究采用Nano Measurer 软件对TEM图像进行统计测量。结果如图3所示,SLF-1的铁蛋白分子外径为 (11.98±0.75) nm,SLF-2为(12.17±0.90) nm,SLF-3为 (12.35±1.02) nm。这些数据表明,3种鲟鱼肝脏铁蛋白的分子尺寸均与典型的铁蛋白尺寸大小相符合[3],进一步证实了其结构的保守性。

a-SLF-1;b-SLF-2;c-SLF-3
图2 3种鲟鱼肝脏铁蛋白的TEM图
Fig.2 TEM images of liver ferritin of three species of sturgeon
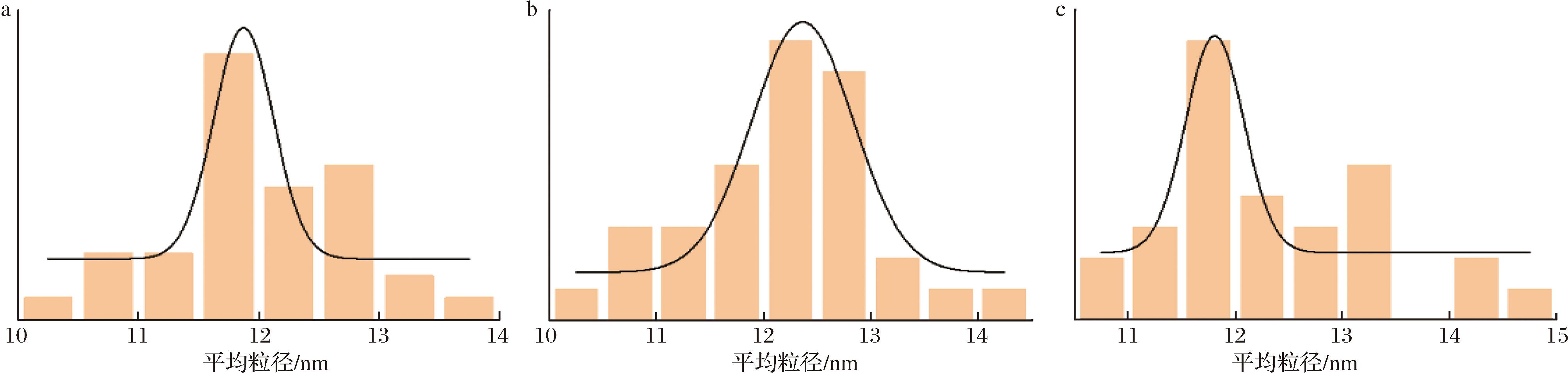
a-SLF-1;b-SLF-2;c-SLF-3
图3 3种鲟鱼肝脏铁蛋白的粒径分布图
Fig.3 Dynamic light scattering particle size distribution of liver ferritin of three species of sturgeon
2.3 3种鲟鱼肝脏铁蛋白的FTIR分析
FTIR是研究蛋白质或多肽结构变化的重要工具。图4展示了3种鲟鱼肝脏铁蛋白的FTIR光谱图。从图4中可以看出,3种铁蛋白的整体光谱特征相似,表明它们具有高度保守的二级结构,这种保守性有利于铁蛋白在铁的氧化和储存过程中发挥其生物学功能[18]。铁蛋白在3 280 cm-1波数处吸收峰是由于N—H键和O—H键的拉伸振动引起的,属于酰胺A带;2 934 cm-1波数附近的吸收峰则是由于C—H键伸缩振动引起的;1 633 cm-1波数处吸收峰对应于C![]() O键伸缩振动,属于酰胺Ⅰ带;而1 540 cm-1波数处吸收峰则是由于N—H键弯曲和C—N键拉伸引起的,属于酰胺Ⅱ带[19]。采用PeakFit V4.12软件对FTIR结果进行分析,结果表明,3种鲟鱼肝脏铁蛋白的二级结构中,α螺旋的含量均最高,其中,SLF-1为62.35%、SLF-2为52.79%、SLF-3为67.74%。该结果与典型的铁蛋白的二级结构特征一致[20],其中SLF-2的α螺旋的含量较低,这可能与其氨基酸组成或结构上的细微差异有关。
O键伸缩振动,属于酰胺Ⅰ带;而1 540 cm-1波数处吸收峰则是由于N—H键弯曲和C—N键拉伸引起的,属于酰胺Ⅱ带[19]。采用PeakFit V4.12软件对FTIR结果进行分析,结果表明,3种鲟鱼肝脏铁蛋白的二级结构中,α螺旋的含量均最高,其中,SLF-1为62.35%、SLF-2为52.79%、SLF-3为67.74%。该结果与典型的铁蛋白的二级结构特征一致[20],其中SLF-2的α螺旋的含量较低,这可能与其氨基酸组成或结构上的细微差异有关。
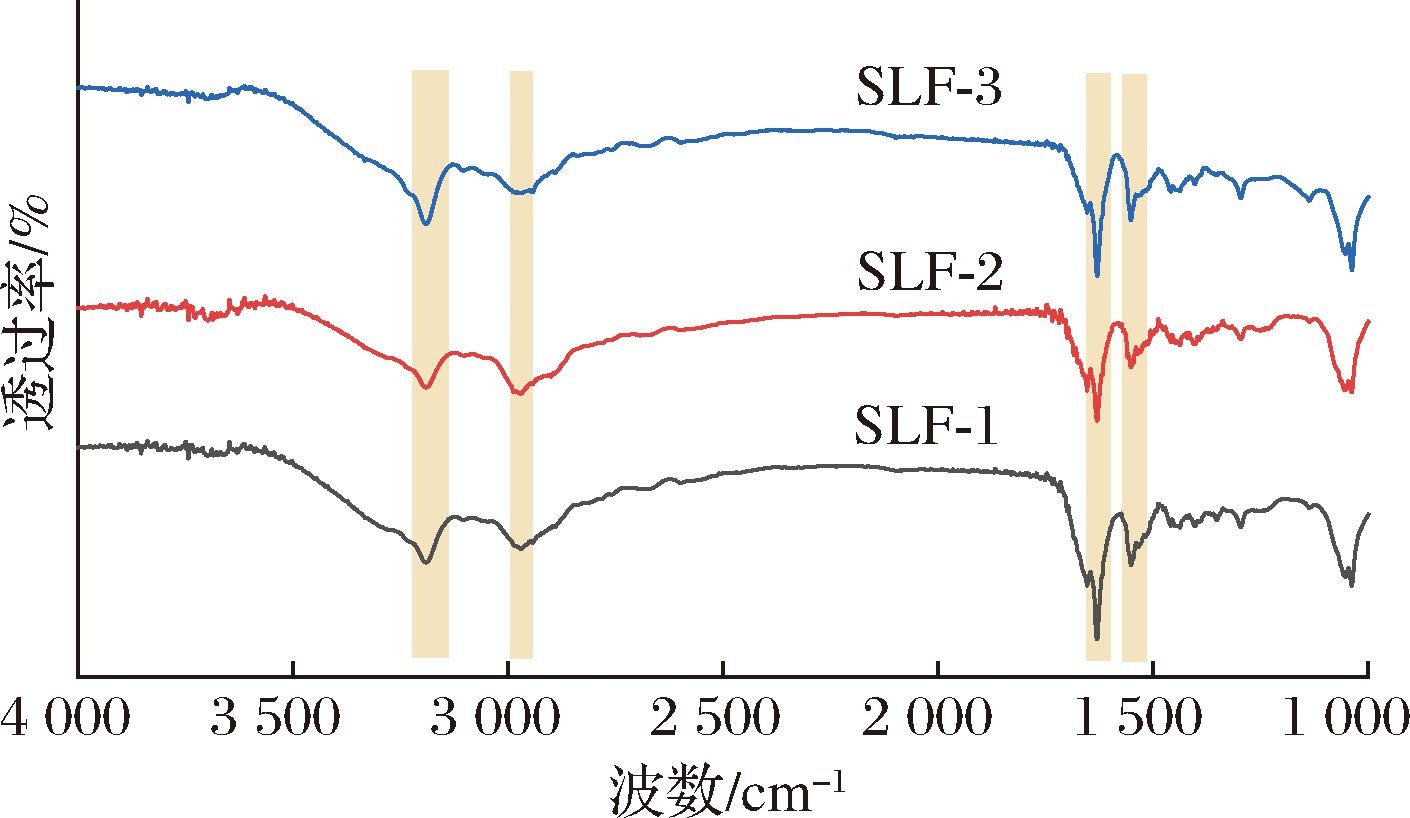
图4 3种鲟鱼肝脏铁蛋白的FTIR图
Fig.4 FTIR spectra of liver ferritin of three species of sturgeon
2.4 氨基酸组成及含量分析
本研究采用酸水解方法对3种鲟鱼肝脏铁蛋白的氨基酸组成进行了检测。图5为氨基酸组成成分的分析结果。如图5-a所示,3种铁蛋白的总氨基酸含量均超过600 mg/g,其中,SLF-1的总氨基酸含量最高,而SLF-3的总氨基酸含量最低 (P<0.05)。如图5-b和图5-c所示,SLF-1的必需氨基酸含量最高,达到281.35 mg/g,占总氨基酸含量的40.56%,符合联合国粮食及农业组织与世界卫生组织规定的理想蛋白模式标准,表明其具有较高的营养价值。如图5-d所示,SLF-1中含量最高的氨基酸有甘氨酸、谷氨酸、天冬氨酸、亮氨酸和苯丙氨酸;SLF-2中含量最高的氨基酸有谷氨酸、天冬氨酸、亮氨酸和赖氨酸;SLF-3中含量最高的氨基酸有谷氨酸、天冬氨酸、甘氨酸和丙氨酸。其中,SLF-1中的甘氨酸显著高于SLF-2和SLF-3,而SLF-2中的谷氨酸含量显著高于SLF-1和SLF-3。谷氨酸和苯丙氨酸等具有较强的自由基清除活性,表明铁蛋白具有一定的抗氧化活性[21]。此外,谷氨酸和天冬氨酸作为鲜味物质的重要组成成分,能够提升食品的鲜味,因此在调味品、饮品等食品加工行业具有广泛的应用潜力[22]。综上所述,3种鲟鱼肝脏铁蛋白不仅具有较高的营养价值,还因其独特的氨基酸组成在食品工业中展现出广阔的应用前景。这些发现为开发以铁蛋白为基础的功能性食品和保健品提供了科学依据。

a-3种鲟鱼肝脏铁蛋白的总氨基酸含量对比图;b-3种鲟鱼肝脏铁蛋白的必需氨基酸含量对比图;c-3种鲟鱼肝脏铁蛋白的必需氨基酸占比对比图;d-3种鲟鱼肝脏铁蛋白的氨基酸组成及含量的热图
图5 3种鲟鱼肝脏铁蛋白的氨基酸组成及含量分析对比图
Fig.5 Analysis of amino acid composition and content of ferritin in liver of three species of sturgeon
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.5 3种鲟鱼肝脏铁蛋白的生物信息学分析
生物信息学可以更高效、准确地分析蛋白质的性质、结构和功能。故本研究对3种鲟鱼源肝脏铁蛋白经过胰蛋白酶消化后得到的肽混合物进行LC-MS/MS分析,并将获得的肽段的质量指纹图谱数据在Uniprot 数据库中进行检索。检索结果表明,3种鲟鱼源肝脏铁蛋白所匹配的均为鲟鱼铁蛋白,经过数据库的匹配发现,SLF-1的肽段与中华鲟肝脏铁蛋白 (Accession:ABY81252.1) 匹配占比最高,SLF-2的肽段与小体鲟肝脏铁蛋白 (Accession:A0A444UM29) 匹配度最高,SLF-3的肽段与尖吻鲟肝脏铁蛋白 (Accession:A0AAD8FU36) 匹配度最高,因此后续将分别使用这3种鲟鱼铁蛋白的氨基酸序列进行生物信息学分析预测。
2.5.1 基本理化性质预测
表1为使用ProtParam在线分析3种鲟鱼源肝脏铁蛋白的理化性质结果。经ProtParam平台预测可知,SLF-1、SLF-2和SLF-3的亚基分子质量分别为20.34、25.03、20.33 kDa,与SDS-PAGE电泳结果基本一致。氨基酸含量预测结果显示,SLF-1中谷氨酸、亮氨酸含量最高,SLF-2中亮氨酸、谷氨酸和天冬氨酸含量最高,SLF-3中谷氨酸和丙氨酸含量最高,与2.4节实验结果一致。不稳定系数分别被预测为43.97、45.80、41.84,说明这3种蛋白在体外时均为不稳定蛋白。脂肪系数分别被测定为74.89、75.14、72.67,表明这3种蛋白均具有很好的热稳定性。平均亲水性分别为-0.649、-0.689、-0.686,均为负值,表明3种蛋白均为亲水性蛋白。
表1 3种鲟鱼肝脏铁蛋白的理化特征信息
Table 1 Physical and chemical characteristics of liver ferritin from three species of sturgeon
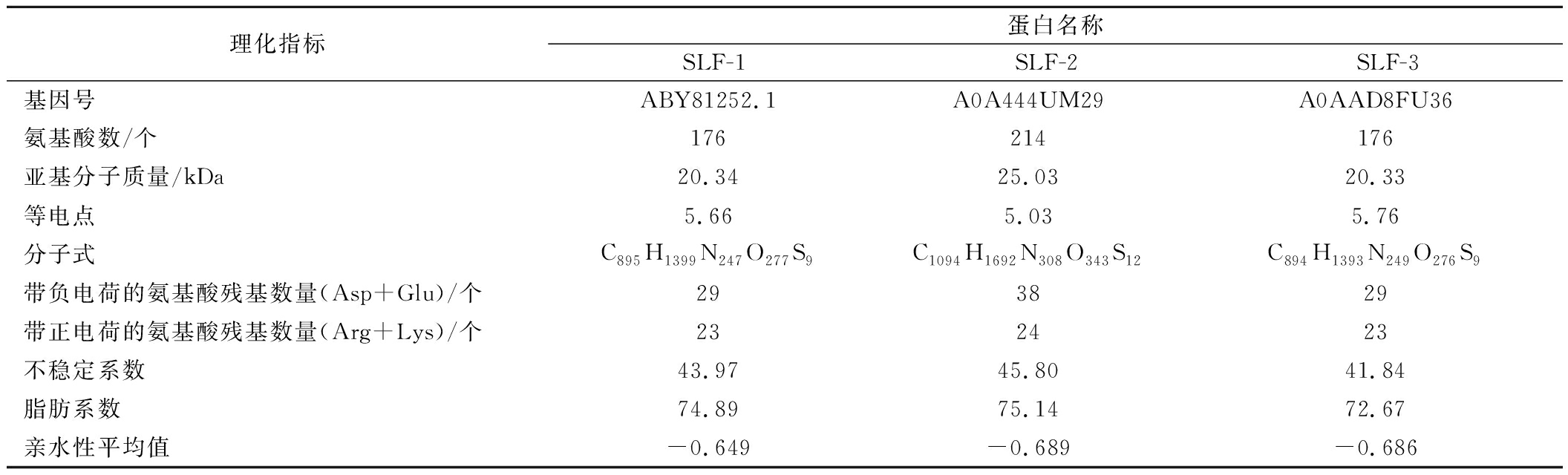
理化指标蛋白名称SLF-1SLF-2SLF-3基因号ABY81252.1A0A444UM29A0AAD8FU36氨基酸数/个176214176亚基分子质量/kDa20.3425.0320.33等电点5.665.035.76分子式C895H1399N247O277S9C1094H1692N308O343S12C894H1393N249O276S9带负电荷的氨基酸残基数量(Asp+Glu)/个293829带正电荷的氨基酸残基数量(Arg+Lys)/个232423不稳定系数43.9745.8041.84脂肪系数74.8975.1472.67亲水性平均值-0.649-0.689-0.686
2.5.2 亲疏水性预测
使用ProtScale对3种鲟鱼肝脏铁蛋白进行亲水性/疏水性分析。结果如图6所示,SLF-1的亲水性最高点在第56位,分值为-3.356,而疏水性最强的是第97、98、99位,分值均为1.267;SLF-2的亲水性最强位点为第93位,分值为-3.289,疏水性最强的是第133位,分值为1.122;SLF-3的亲水性最强位点为第56位,分值为-3.356,疏水性最强的是第97、98、99位,分值均为1.267。综合来看,3种鲟鱼肝脏铁蛋白的亲水性氨基酸数量显著多于疏水性氨基酸,表明这3种蛋白均为亲水性蛋白,这一结果与基本理化性质的预测结果一致,进一步验证了铁蛋白在水溶液中良好的溶解性和稳定性。
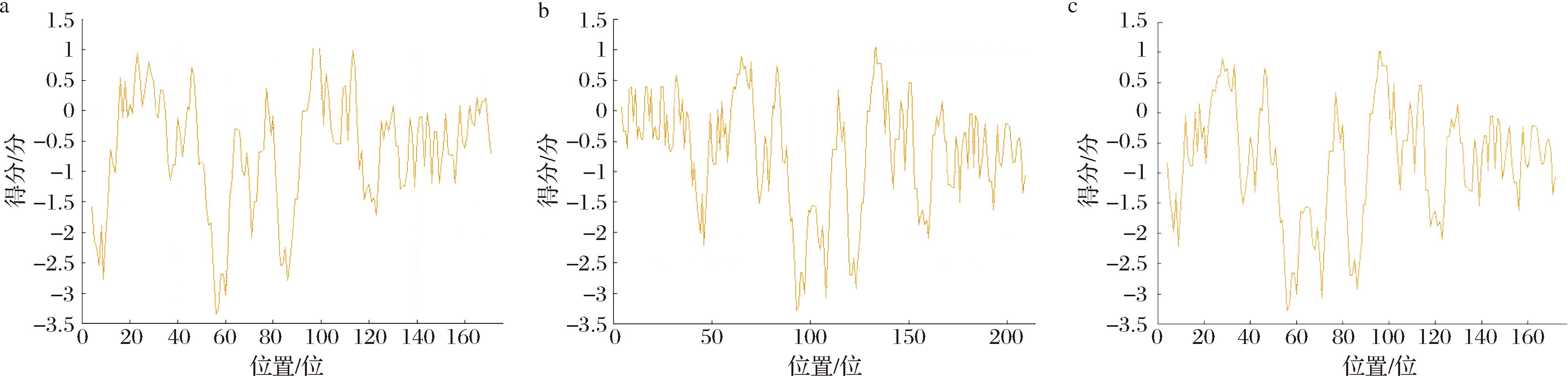
a-SLF-1;b-SLF-2;c-SLF-3
图6 3种鲟鱼肝脏铁蛋白的亲水性/疏水性预测
Fig.6 Prediction of hydrophilic/hydrophobic of liver ferritin from three species of sturgeon
2.5.3 跨膜结构域预测
通过TMHMM 2.0对蛋白质的跨膜结构域进行预测,结果如图7所示,SLF-1、SLF-2和SLF-3均不含跨膜结构域。
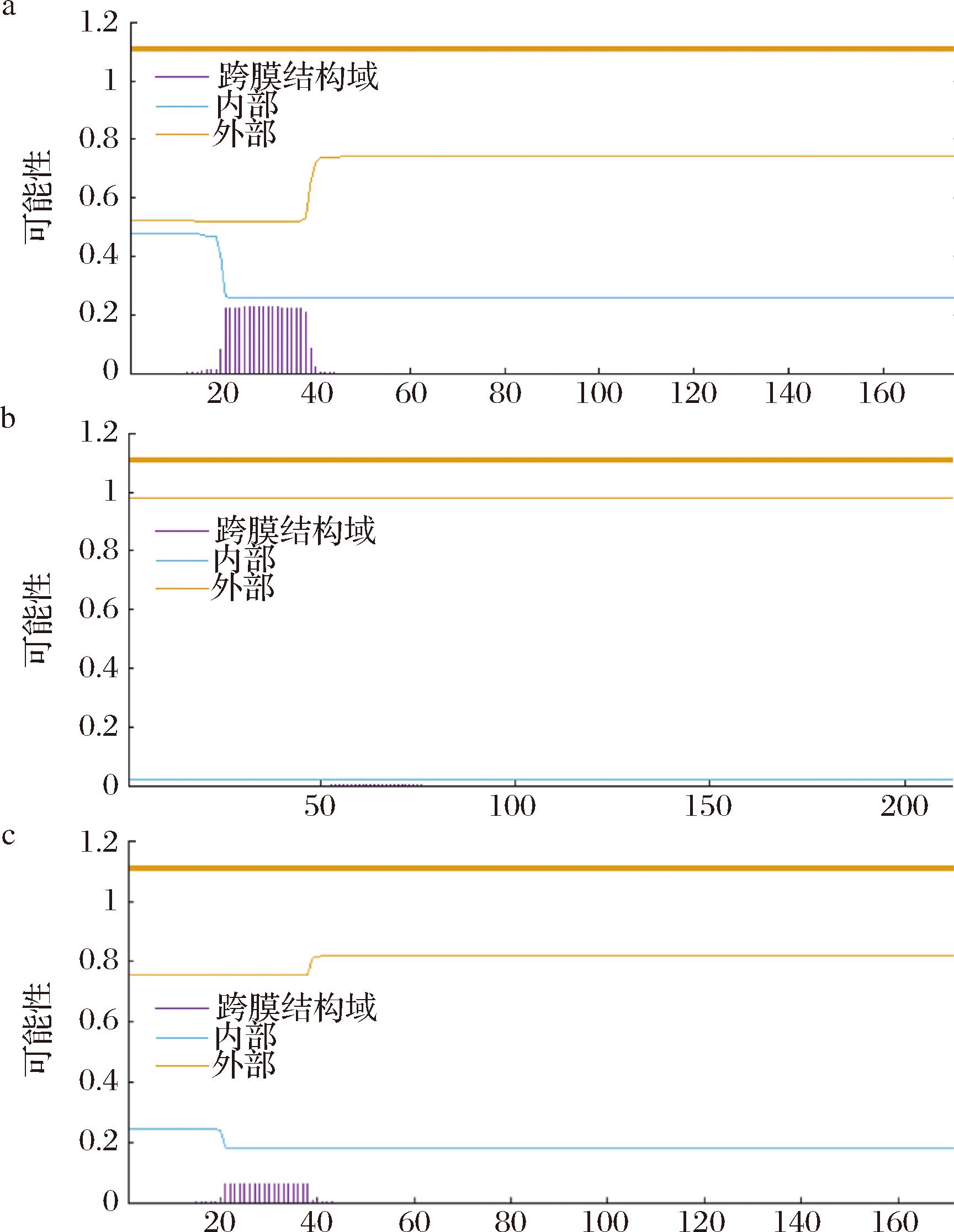
a-SLF-1;b-SLF-2;c-SLF-3
图7 3种鲟鱼肝脏铁蛋白的跨膜结构域预测
Fig.7 Prediction of transmembrane domains liver ferritin from three species of sturgeon
2.5.4 信号肽预测
通过SignalP 4.1对蛋白质信号肽进行预测,结果如图8所示,SLF-1、SLF-2和SLF-3均没有信号肽,结合3种蛋白也没有跨膜结构域,可以推测出3种蛋白均为非分泌蛋白,该结果与SONG等[3]研究结果一致。
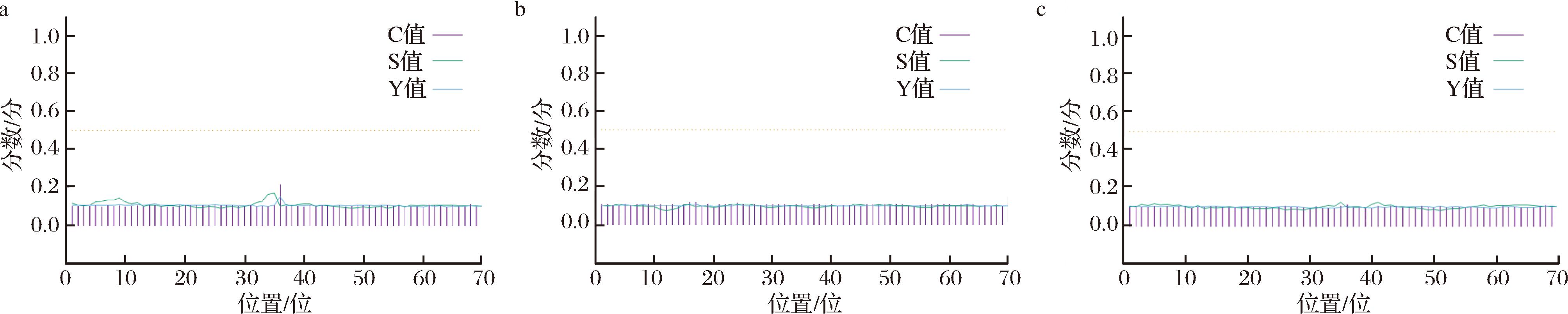
a-SLF-1;b-SLF-2;c-SLF-3
图8 3种鲟鱼肝脏铁蛋白的信号肽预测
Fig.8 Prediction of signal peptides of liver ferritin from three species of sturgeon
2.5.5 蛋白质二级结构预测
通过SOPMA对3种鲟鱼源肝脏铁蛋白的二级结构进行预测,结果如表2和图9所示。结果表明,SLF-1、SLF-2和SLF-3均含有大量的α螺旋和无规则卷曲,这2种结构是铁蛋白二级结构的主要组成部分,与经典的铁蛋白结构特征一致[20]。研究表明,α螺旋在维持蛋白质二级结构的稳定性中发挥着重要作用,而无规则卷曲则能够特异性地与抗体结合,在蛋白质功能中发挥关键作用[23]。此外,SLF-1和SLF-3的α螺旋和无规则卷曲含量较为接近,表明这两种蛋白在二级结构上具有较高的相似性。综上所述,该预测结果与FTIR光谱分析结果一致,进一步说明了铁蛋白内部通过氢键相互作用维持其结构的稳定。
表2 3种鲟鱼肝脏铁蛋白的二级结构特征
Table 2 Secondary structure feature of liver ferritin of three species of sturgeon
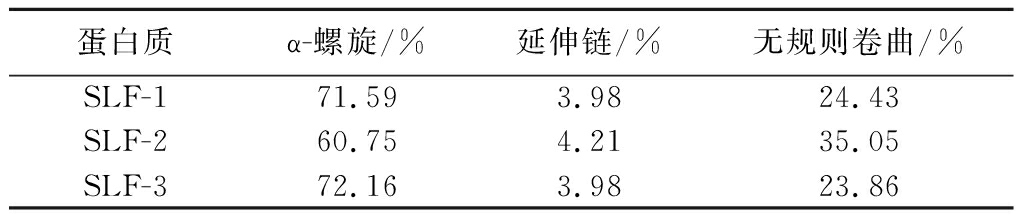
蛋白质α-螺旋/%延伸链/%无规则卷曲/%SLF-171.593.9824.43SLF-260.754.2135.05SLF-372.163.9823.86

a-SLF-1;b-SLF-2;c-SLF-3
图9 3种鲟鱼肝脏铁蛋白的二级结构预测
Fig.9 Prediction of secondary structure of liver ferritin from three species of sturgeon
注:helix表示α-螺旋;sheet表示β-折叠;turn表示β-转角;coil表示无规则卷曲。
2.5.6 蛋白质三级结构预测
通过AlphaFold server对3种鲟鱼源肝脏铁蛋白的三级结构进行预测,结果如图10所示,SLF-1、SLF-2和SLF-3的亚基结构均包含4个反向平行的α螺旋和4个连接链,与文献报道一致[8]。
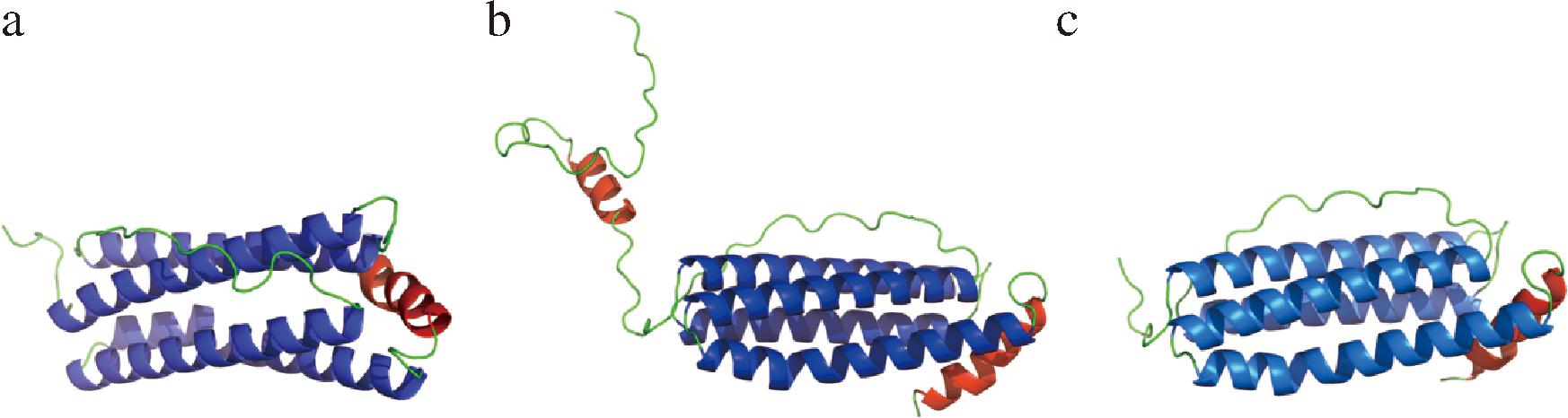
a-SLF-1;b-SLF-2;c-SLF-3
图10 3种鲟鱼肝脏铁蛋白的三级结构预测
Fig.10 Prediction of tertiary structure of liver ferritin from three species of sturgeon
2.5.7 蛋白质-蛋白质互作预测
为了充分了解3种源鲟鱼肝脏铁蛋白的特性,进一步通过STRING对蛋白质进行互作分析。结果如图11所示,SLF-1与FTL、LOC102172435、NCOA4、TFRC、GPX4、SLC40A1、IREB2、ACSL4、FECH和HMOX1存在显著相互作用;SLF-2与FTL、NCOA4、CREB1、ENSCCNP00000000882、ENSCCNP00000028246、ENSCCNP00000029785、TFRC、ENSCCNP00000003424、CLCN2和TFR2存在显著相互作用;SLF-3与FTL、LOC102172435、NCOA4、TFRC、GPX4、SLC40A1、IREB2、ACSL4、FECH和HMOX1存在显著相互作用。其中,SLF-1、SLF-2和SLF-3均与FTL的预测得分最高,分别为0.996、0.967、0.996,这是由于SLF-1、SLF-2和SLF-3被预测为铁蛋白的重链亚基,而FTL为铁蛋白轻链亚基,二者可在大部分细胞中相互作用,来稳定铁蛋白的结构[8]。TFRC为转铁蛋白受体,主要负责结合转铁蛋白-铁复合物,并将其内吞到细胞内,释放铁供细胞使用,是细胞摄取外源铁的主要途径。铁蛋白与TFRC之间没有直接的物理相互作用,而是通过铁离子和铁调节蛋白(iron regulatory protein,IRPs)间接关联。当细胞内铁水平较低时,IRPs稳定TFRC的mRNA,增加TFRC的表达,促进铁的摄取;当细胞内铁水平较高时,IRPs抑制TFRC的表达,同时促进铁蛋白的表达,增加铁的贮存[24]。谷胱甘肽过氧化物酶4(GPX4)是抑制脂质产生活性氧(reactive oxygen species,ROS)的磷脂氢过氧化物酶,可以驱动铁死亡的脂质过氧化。该结果说明SLF-1、SLF-3通过与GPX4的相互作用参与到铁死亡途径中[25]。综上,SLF-1和SLF-3在功能特性方面具有一定的相似性,可能与这2种蛋白在二级结构上具有较高的相似性有关。该发现为深入理解鲟鱼源铁蛋白的结构与功能之间的关系提供了重要依据。
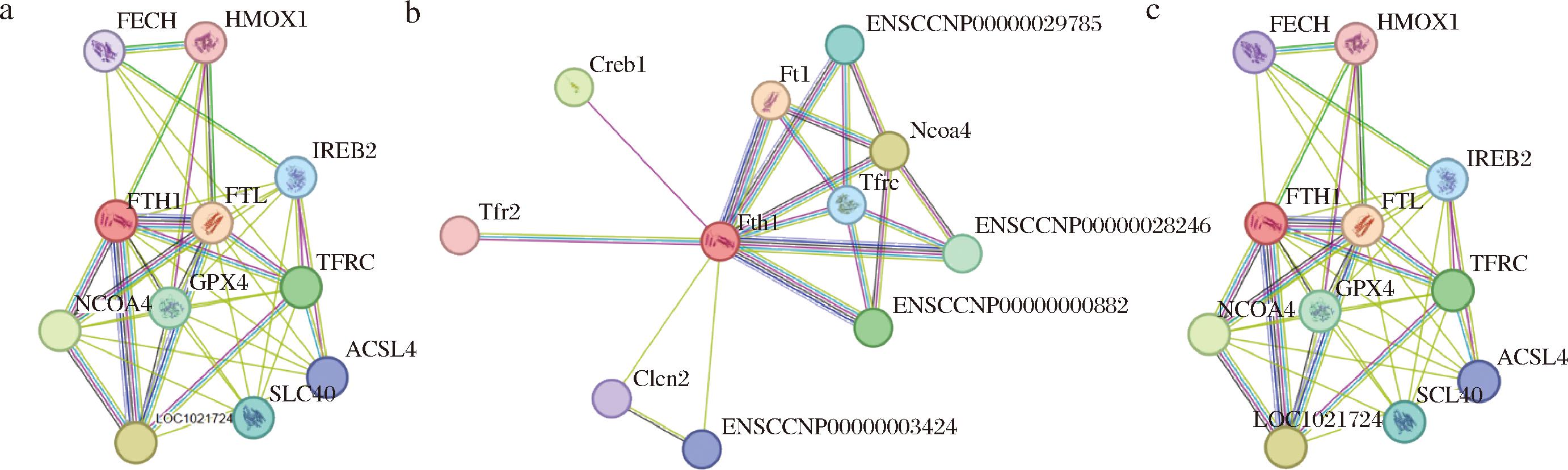
a-SLF-1;b-SLF-2;c-SLF-3
图11 三种鲟鱼肝脏铁蛋白的蛋白质-蛋白质互作预测
Fig.11 Prediction of protein-protein interaction of liver ferritin from three species of sturgeon
注:FTL:ferritin light chain,铁蛋白轻链;FTH1:ferritin heavy chain 1,铁蛋白重链 1;NCOA4:核受体辅激活因子4;TFRC:transferrin receptor,转铁蛋白受体的基因名称,其编码的蛋白质为转铁蛋白受体;SLC40A1:solute carrier family 40 member 1,溶质载体家族40成员1;IREB2:iron responsive element binding protein 2,铁反应元件结合蛋白2;ACSL4:Acyl-CoA synthetase long-chain family member 4,长链脂酰辅酶A合成酶4;GPX4:glutathione peroxidase 4,谷胱甘肽过氧化物酶4;FECH:ferrochelatase,亚铁螯合酶;HMOX1:heme oxygenase 1:血红素加氧酶1;CREB1:CAMP responsive element binding protein 1,环磷腺苷应答元件结合蛋白1;CLCN2:chloride voltage-gated channel 2,氯离子电压门控通道2;TFR2:transferrin receptor 2,转铁蛋白受体2;LOC102172435:NCBI数据库基因编号,特指人类基因组中的一个基因座;ENSCCNP00000000882:Ensembl家猫基因组数据库蛋白质编号00000000882,此编号对应的是TTC25基因(四肽重复序列蛋白25);ENSCCNP00000028246:此编号对应的是家猫的TMC6基因(跨膜通道样蛋白6);ENSCCNP00000003424:此编号对应的是 KRT10 基因(角蛋白10);ENSCCNP00000029785:此编号对应的基因为家猫的TMC8基因(跨膜通道样蛋白 8)。
3 结论
本实验成功分离纯化出3种鲟鱼源肝脏铁蛋白,并对其结构与理化特性进行了系统的分析与比较。结果表明,SLF-1、SLF-2和SLF-3有相似的形态、粒径和FTIR图谱,TEM图像均呈现出外径约为12 nm的圆形颗粒,二级结构中α螺旋含量最高。而它们的氨基酸组成存在差异,可能与品种的产地、遗传特性、生长速率、生活习性及铁代谢需求不同有关。生物信息学分析结果显示,SLF-1、SLF-2和SLF-3均为不含跨膜结构域和信号肽的亲水性耐热蛋白,其二级结构均以α螺旋为主,与FTIR结果一致,但SLF-2的α螺旋含量较低。此外,SLF-1、SLF-2和SLF-3参与维持铁蛋白结构稳定、调节细胞内铁平衡,同时,SLF-1和SLF-3还可能间接参与铁死亡途径中的脂质过氧化反应。综上所述,对3种鲟鱼源肝脏铁蛋白的结构和理化特性的系统性分析,不仅可以填补鲟鱼铁蛋白基础研究的缺口,还可为开发新型生物材料、功能性食品及医药制剂提供科学依据,推动鲟鱼产业从传统食用向高附加值生物资源开发转型。
[1] CHEN H, HAN X E, FU Y, et al.Compartmentalized chitooligosaccharide/ferritin particles for controlled co-encapsulation of curcumin and rutin[J].Carbohydrate Polymers, 2022, 290:119484.
[2] BOU-ABDALLAH F, FISH J, TERASHI G, et al.Unveiling the stochastic nature of human heteropolymer ferritin self-assembly mechanism[J].Protein Science, 2024, 33(8):e5104.
[3] SONG Z Y, NI W J, LI B Z,et al.Sustainable ferritin from bovine by-product liver as a potential resource:Ultrasound assisted extraction and physicochemical, structural, functional, and stable analysis[J].International Journal of Biological Macromolecules, 2024, 281:136264.
[4] CHAKRABORTI S, CHAKRABARTI P.Self-assembly of ferritin:Structure, biological function and potential applications in nanotechnology[J].Advances in Experimental Medicine and Biology, 2019, 1174:313-329.
[5] CHEN R, LIU Z, WANG J Z, et al.A review of the nutritional value and biological activities of sturgeon processed byproducts[J].Frontiers in Nutrition, 2022, 9:1024309.
[6] ZHU L L, LI J W, WANG Y C, et al.Structural feature and self-assembly properties of type Ⅱ collagens from the cartilages of skate and sturgeon[J].Food Chemistry, 2020, 331:127340.
[7] FENG W W, ZHAO T, ZHOU Y, et al.Optimization of enzyme-assisted extraction and characterization of collagen from Chinese sturgeon (Acipenser sturio Linnaeus) skin[J].Pharmacognosy Magazine, 2013, 9(Suppl 1):S32-S37.
[8] ZHANG S Y, DENG X R, GUO X, et al.Sustained release of chlorogenic acid by co-encapsulation of sodium alginate binding to the Northern pike (Esox Lucius) liver ferritin[J].Food Chemistry, 2023, 429:136924.
[9] 丁炳文. 鲟鱼肝脏铁蛋白理化特性研究及其载钙复合物制备的初步探究[D].雅安:四川农业大学, 2021.DING B W.Study on the physicochemical properties of liver ferritin of acipenser baerii and preliminary study on the preparation of ferritin-calcium complex[D].Ya’an:College of Food Science, Sichuan Agricultural University, 2021.
[10] LAEMMLI U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature, 1970, 227(5259):680-685.
[11] LI H, TAN X Y, XIA X Y, et al.Thermal treatment modified the physicochemical properties of recombinant oyster (Crassostrea gigas) ferritin[J].Food Chemistry, 2020, 314:126210.
[12] 李蝶, 张斌, 申淼淼, 等.基于重组虾铁蛋白装载山奈酚的三种不同方法的比较分析[J].食品与发酵工业, 2023, 49(24):251-258.LI D, ZHANG B, SHEN M M, et al.Comparative analysis of three different loading methods of kaempferol based on recombinant marsupenaeus japonicus ferritin[J].Food and Fermentation Industries, 2023, 49(24):251-258.
[13] WANG S N, GUO Y H, LIN K, et al.Study on ferritin glycation with dextran:Physicochemical characterization and its application in the delivery of resveratrol[J].LWT, 2024, 205:116498.
[14] YANG C, LIU W Y, ZHU X J, et al.Ultrasound-assisted enzymatic digestion for efficient extraction of proteins from quinoa[J].LWT, 2024, 194:115784.
[15] 夏小雨, 李晗, 王震宇, 等.人源重链铁蛋白纯化及其纳米粒制备[J].食品科学, 2020, 41(12):91-98.XIA X Y, LI H, WANG Z Y, et al.Purification and preparation of nanoparticles of human H-chain ferritin[J].Food Science, 2020, 41(12):91-98.
[16] 丁炳文, 马贵红, 李筱, 等.热处理对鲟鱼肝脏铁蛋白稳定性的影响[J].食品科学, 2022, 43(8):66-73.DING B W, MA G H, LI X, et al.Effects of heat treatment on the stability of liver ferritin from Acipenser baerii[J].Food Science, 2022, 43(8):66-73.
[17] YANG R, MA J R, HU J N, et al.Formation of ferritin-agaro oligosaccharide-epigallocatechin gallate nanoparticle induced by CHAPS and partitioned by the ferritin shell with enhanced delivery efficiency[J].Food Hydrocolloids, 2023, 137:108396.
[18] CHANG X X, LV C Y, ZHAO G H.A dual function of ferritin (animal and plant):Its holo form for iron supplementation and apo form for delivery systems[J].Annual Review of Food Science and Technology, 2023, 14:113-133.
[19] CHEN H, TAN X Y, HAN X E, et al.Ferritin nanocage based delivery vehicles:From single-, co- to compartmentalized- encapsulation of bioactive or nutraceutical compounds[J].Biotechnology Advances, 2022, 61:108037.
[20] YANG R, LIU Y Q, GAO Y J, et al.Ferritin glycosylated by chitosan as a novel EGCG nano-carrier:Structure, stability, and absorption analysis[J].International Journal of Biological Macromolecules, 2017, 105:252-261.
[21] LI Y W, LI B.Characterization of structure-antioxidant activity relationship of peptides in free radical systems using QSAR models:Key sequence positions and their amino acid properties[J].Journal of Theoretical Biology, 2013, 318:29-43.
[22] INSANG S, KIJPATANASILP I, JAFARI S, et al.Ultrasound assisted extraction of functional compound from mulberry (Morus alba L.) leaf using response surface methodology and effect of microencapsulation by spray drying on quality of optimized extract[J].Ultrasonics Sonochemistry, 2022, 82:105806.
[23] TRAN N T, LIU H, ![]() I, et al.Blunt snout bream (Megalobrama amblycephala) MyD88 and TRAF6:Characterisation, comparative homology modelling and expression[J].International Journal of Molecular Sciences, 2015;16(4):7077-7097.
I, et al.Blunt snout bream (Megalobrama amblycephala) MyD88 and TRAF6:Characterisation, comparative homology modelling and expression[J].International Journal of Molecular Sciences, 2015;16(4):7077-7097.
[24] WANG F, XU W Q, ZHANG W Q, et al. Transferrin receptor 1 promotes hepatocellular carcinoma progression and metastasis by activating the mTOR signaling pathway[J].Hepatology International, 2024, 18(2):636-650.
[25] XU Y, LI Y T, LI J X, et al.Ethyl carbamate triggers ferroptosis in liver through inhibiting GSH synthesis and suppressing Nrf2 activation[J].Redox Biology, 2022, 53:102349.