随着全球人口增长和人均肉类消费的不断增加,预计到2050年,全球肉类需求将以每年1.3%的速度持续增长[1]。这一趋势对传统畜牧业应对日益增长的肉类蛋白需求构成了巨大挑战。在这种背景下,细胞培养肉技术作为一种通过体外培养细胞生产肉制品的创新技术,已成为替代蛋白领域的一个重要研究方向[2]。它不仅提供与传统肉类相似的味道和营养,而且有望减少对自然资源的依赖,减轻对环境的负面影响[3]。与传统肉制品相似,肌肉和脂肪是细胞培养肉的主要结构和营养成分。在肉制品中,脂肪组织的含量显著影响肉类的感官特性,赋予肉类最佳的营养、口感及多汁性[4]。体外培养脂肪能够模拟天然肉类中脂肪的含量及分布方式,赋予食品更好的口感和质感,正在成为培养肉发展的一个热点领域。
在体内,脂肪组织的发育主要分为2个阶段,首先是具有成脂分化潜能的干细胞经诱导后成为前脂肪细胞,随后在各种信号通路及转录因子的作用下最终分化为成熟脂肪细胞,并出现脂滴积累[5]。多种类型的细胞能够在体外分化成脂肪,如多能干细胞、纤维脂肪祖细胞、去分化脂肪细胞和间充质干细胞[6-7]。其中,脂肪源间充质干细胞具有较强增殖能力,在体外表现出优越的成脂分化潜能,使其成为制造细胞培养脂肪的理想种子细胞。然而目前,有关脂肪源间充质干细胞分离培养的研究多集中于人或小鼠,由于家畜脂肪组织的硬度和厚度显著高于人或小鼠的脂肪组织,使用目前常规方法难以有效解离猪脂肪组织,导致猪脂肪源间充质干细胞的分离提取效率和细胞活力不足。
在体外诱导间充质干细胞分化生成脂肪细胞,传统上使用由胰岛素、罗格列酮、地塞米松、3-异丁基-1-甲基黄嘌呤和吲哚美辛组成的经典成脂分化诱导剂组合[8]。然而,使用这一传统诱导剂组合进行成脂分化的周期通常较长,一般需要10~14 d才能显著观察到脂肪细胞的生成和脂滴积累。同时,该组合中的物质均不是食品级成分,且价格昂贵,无法满足细胞培养脂肪可食用、产业化的需求[9]。此前有研究发现,游离脂肪酸在较高浓度下可以激活PPARγ通路,从而促进脂肪细胞的分化和脂肪存储的形成[10]。例如,当受到油酸或磷脂酰胆碱诱导时,鸡成纤维细胞可转分化为脂肪样细胞[11]。尽管如此,对培养脂肪的研究仍处于探索阶段。如何缩短分化周期,提升分化效率,并寻找价格低廉且可食用的成脂诱导剂,成为当前细胞培养肉领域的重要研究方向。
本研究优化了猪脂肪源间充质干细胞的分离方法,比较了不同酶种类、消化时间以及组织部位对细胞释放量和细胞活力的影响,旨在为细胞培养脂肪技术的发展提供更加高效且可控的细胞来源。此外,从脂肪酸、植物油等脂质类物质中筛选获得了食品级成脂诱导剂,进而构建了一种快速、高效、低成本的猪间充质干细胞成脂分化方法,为细胞培养脂肪的产业化生产提供了坚实的基础。
1 材料与方法
1.1 材料与试剂
实验所用猪脂肪组织购自无锡市天鹏食品城,选择脂肪厚度大、外观白净的组织进行实验。
主要试剂:
a)细胞分离与培养相关试剂:DMEM(dulbecco’s modified eagle medium)培养基、胎牛血清(fetal calf serum,FBS)、马血清(horse serum,HS)、青霉素/链霉素(penicillin/streptomycin,P/S)、Ⅰ型胶原酶、0.25%胰蛋白酶,美国Gibco公司;CCK-8试剂盒,中国碧云天公司。
b)免疫荧光染色与流式细胞术相关试剂:胶原蛋白(collagen,COL1)一抗、波形蛋白(vimentin,VIM)一抗、CoraLite488-conjugated Goat Anti-Mouse IgG(H+L)二抗,中国Proteintech公司;DAPI染色液,中国碧云天公司;40 g/L的多聚甲醛固定液,中国飞净生物公司;TritonX-100,中国国药集团;流式抗体APC Mouse Anti-Human CD29、FITC Mouse Anti-Human CD34、FITC Mouse Anti-Human CD44、FITC Mouse Anti-Pig CD45、FITC Mouse Anti-Human CD90、PE Mouse Anti-Human CD105,美国Biolegend公司。
c)成脂诱导分化与检测相关试剂:胰岛素、罗格列酮、地塞米松,美国Thermo公司;3-异丁基-1-甲基黄嘌呤,中国碧云天公司;花生四烯酸[12]、肉豆蔻油酸[13]、二十五烷酸、辛酸[14]、二十碳五烯酸[15]、二十二碳六烯酸[15]、硬脂酸[13]、α-亚麻酸[16]、肉豆蔻酸[13]、神经酸、γ-亚麻酸[16]、花生酸[12]、十五烷酸、棕榈油酸[13]、月桂酸[17]、癸酸、二十二烷酸[18],美国MCE公司;油红O染色试剂盒,中国建成科技公司;RNA提取试剂盒,美国Omega公司;反转录试剂盒、qPCR试剂盒,中国诺唯赞公司。
d)蛋白质印记(Western Blot)相关试剂:SDS-PAGE凝胶试剂盒,中国生工生物工程;FABP4一抗,美国MCE公司;ACCα一抗,美国CST公司;GAPDH一抗、HRP偶联山羊抗兔IgG、HRP偶联山羊抗小鼠IgG,中国Proteintech公司。
1.2 仪器与设备
生物安全柜、恒温培养箱,美国Thermo公司;MF53-N倒置荧光显微镜,广州市明美光电技术有限公司;AX激光共聚焦显微镜,日本Nikon公司;BD FACSAria Ⅲ流式细胞仪,美国BD公司;小型高速离心机,德国Eppendorf公司;实时荧光定量PCR仪,美国TA公司。
1.3 实验方法
1.3.1 猪脂肪源间充质干细胞的分离与培养
将猪皮下脂肪或内脏脂肪使用PBS冲洗3次后,剔除表面筋膜、血管等组织并剁碎呈糜状,称取5 g装入50 mL离心管中,并加入20 mL的2.5 g/L的胰蛋白酶或1 g/L的Ⅰ型胶原酶消化液于37 ℃振荡消化。消化时间设置为45、60、75、90 min。当使用2.5 g/L的胰蛋白酶和1 g/L的Ⅰ型胶原酶联用消化时,消化时间设置为15、30、45、60、75、90 min。消化结束后,使用1倍体积PBS终止消化,并依次使用70、40 μm细胞筛网过滤。收集滤液,以2 000 r/min离心10 min后弃上清液。加入1 mL红细胞裂解液于冰上避光裂解7 min,裂解结束后用10倍体积PBS终止,以2 000 r/min离心10 min后弃上清液,用完全培养基重悬后,使用台盼蓝染色计算细胞活率并计数初始释放细胞量。完全培养基配方为:1%(体积分数)P/S+10%(体积分数)FBS+89%(体积分数)DMEM培养基。将分离得到的细胞接种到12孔板中,置于37 ℃、5%(体积分数)CO2培养箱中培养,记为P0代。待细胞汇合度达到80%时,使用胰蛋白酶消化并进行传代培养。
1.3.2 猪脂肪源间充质干细胞的体外连续培养
取P1(P指细胞代数,下同)猪脂肪源间充质干细胞,接种4×105细胞于T25培养瓶中,添加完全培养基,置于37 ℃、5% CO2培养箱中培养。待细胞生长至汇合度80%时,细胞消化计数后,取4×105细胞接种于T25培养瓶中继续培养。重复上述方式进行细胞的连续传代培养,详细记录每次传代的时间和细胞数量。最后,根据体外培养时间,计算细胞数量、细胞扩增倍数和细胞分裂次数。根据细胞代数,按照公式(1)计算细胞群体倍增时间:
(1)
式中:Δt,培养时间;Nt,培养后细胞量;N0,接种细胞量。
1.3.3 流式细胞术检测脂肪源间充质干细胞表面标志物
取5×104个P1代猪脂肪源间充质干细胞,重悬于100 μL含有10 g/L牛血清白蛋白(bovine albumin,BSA)的PBS中,分别加入1 μL CD29、CD34、CD44、CD45、CD90、CD105抗体,进行冰上孵育45 min。随后,再加入100 μL含有10 g/L BSA的PBS,使用流式细胞仪进行检测。
1.3.4 传统成脂诱导分化方案
将细胞按照每孔1×105密度接种于96孔板中,待细胞生长至汇合度约80%时进行成脂诱导分化。成脂分化诱导的周期为10 d,具体方案如下:先使用成脂分化培养基A液诱导3 d,再使用成脂分化培养基B液继续诱导2 d(记为3A+2B),随后再重复3A+2B的方法继续诱导5 d。成脂分化培养基A液:DMEM培养基添加1% P/S、10% FBS、100 nmol/L胰岛素和诱导剂A(1 μmol/L地塞米松+0.05 μmol/L 3-异丁基-1-甲基黄嘌呤+5 μmol/L罗格列酮);成脂分化培养基B液:DMEM培养基添加1% P/S、10% FBS、100 nmol/L胰岛素和诱导剂B(5 μmol/L罗格列酮)。阴性对照使用完全培养基培养相同天数。
1.3.5 油红O染色
取分化后的细胞,吸除培养基并用PBS清洗2次。根据油红O染色试剂盒说明,将油红O储存液与稀释液按体积比5∶2混合制备油红O染色工作液1。随后,将该染色工作液加入到细胞中,室温孵育30 min,孵育结束后用PBS清洗3次。若使用吸光度法测定,则在使用染色工作液1和PBS清洗结束后,加入适量二甲基亚砜溶液,室温浸提30 min后,使用紫外分光光度计检测在490 nm处的吸光度值。若使用显微成像法测定,则在使用染色工作液1和PBS清洗结束后,加入苏木精染色液室温孵育5 min,并用PBS再次清洗3次,利用显微镜进行成像。使用Image J软件对图像中的脂滴形成面积进行量化,按照公式(2)计算每个细胞的平均脂滴面积:
单位细胞脂滴生成面积![]()
(2)
1.3.6 免疫荧光染色
细胞首先使用40 g/L的多聚甲醛室温固定15 min,接着加入0.1%(体积分数)TritonX-100通透15 min,随后使用含1% BSA的PBS封闭30 min。将一抗(波形蛋白:VIM;胶原蛋白:COL1)按体积比1∶500 使用一抗稀释液稀释,并于4 ℃孵育12 h。孵育结束后吸去一抗,加入二抗室温孵育2 h。随后加入DAPI,继续孵育5 min。用倒置荧光显微镜进行拍摄,在激发波长493 nm波长处检测绿色荧光,在340 nm 波长处检测蓝色荧光。
1.3.7 食品级成脂诱导剂的筛选
选择17种脂肪酸(1.1节)、6种植物油(亚麻籽油、茶籽油、葵花籽油、花生油、橄榄油、紫苏籽油),构建食品级成脂诱导剂候选化合物库。使用P6~P8猪脂肪源间充质干细胞进行食品级成脂诱导剂的筛选,具体分为实验组、阳性对照组和阴性对照组,分化诱导周期设置为5 d。实验组所用培养基配方为:DMEM培养基添加1% P/S、10% FBS、100 nmol/L胰岛素和脂肪酸或植物油[9];阳性对照组所用培养基配方为成脂分化培养基A液和B液,按照3A+2B的分化模式诱导分化5 d;阴性对照组为完全培养基。首先进行诱导剂种类的筛选:脂肪酸所用浓度均为10 μmol/L,植物油所用含量均为0.5 μL/mL,使用油红O染色吸光度法检测脂滴形成情况。根据上述筛选结果,选取有效物质进一步进行浓度优化:脂肪酸设置20、10、1 μmol/L、100 nmol/L浓度梯度;植物油设置1、0.5、0.1 μL/mL含量梯度。使用油红O染色显微成像法,计算单位细胞脂滴生成面积,确定最佳食品级成脂诱导剂。
1.3.8 CCK-8法检测细胞活力
根据CCK-8试剂盒的使用说明,将10 μL CCK-8溶液加入每100 μL完全培养基中,充分混匀制备工作液。在成脂分化的第5天,吸去分化培养基并用PBS清洗细胞2次,随后向每孔加入100 μL CCK-8工作液,确保完全覆盖细胞单层。将细胞置于37 ℃、5%(体积分数)CO2培养箱中孵育2 h,期间避免光照以防止试剂降解。孵育结束后,使用酶标仪在450 nm波长处测定各孔的吸光度值。每个实验组至少设置3个重复孔,同时设置无细胞的空白对照组。数据分析时,用实验组的吸光度值减去空白对照值,采用GraphPad Prism软件进行统计分析,计算细胞相对活力。
1.3.9 实时荧光定量PCR(quantitative real-time PCR,qPCR)
首先RNA提取按照试剂盒说明,使用试剂盒提取待测细胞样品RNA。RNA纯度通过分光光度计检测,要求A260/A280在1.8~2.0,A260/A230>2.0。随后利用反转录试剂盒将RNA反转为cDNA,进行qPCR检测。使用GAPDH作为内参基因,所有实验均重复进行3次,采用2-ΔΔCt法计算目标基因的相对表达量,数据分析使用GraphPad Prism软件。引物序列见表1。
表1 qPCR引物序列
Table 1 qPCR primer sequence
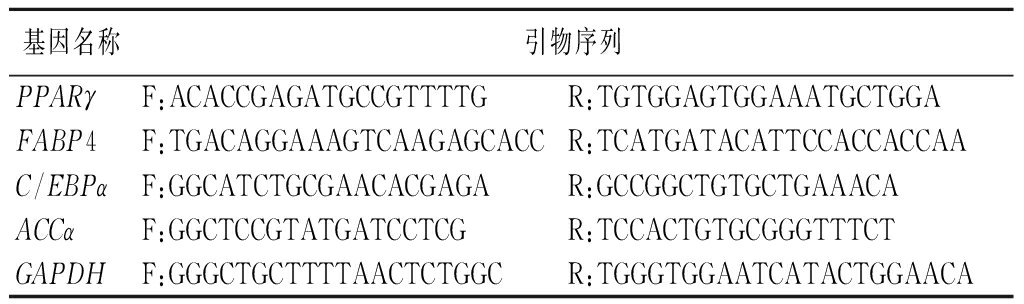
基因名称引物序列PPARγF:ACACCGAGATGCCGTTTTGR:TGTGGAGTGGAAATGCTGGAFABP4F:TGACAGGAAAGTCAAGAGCACCR:TCATGATACATTCCACCACCAAC/EBPαF:GGCATCTGCGAACACGAGAR:GCCGGCTGTGCTGAAACAACCαF:GGCTCCGTATGATCCTCGR:TCCACTGTGCGGGTTTCTGAPDHF:GGGCTGCTTTTAACTCTGGCR:TGGGTGGAATCATACTGGAACA
1.3.10 Western Blot分析
收集细胞后,使用RIPA裂解液在冰上裂解20 min,12 000 r/min离心10 min后收集上清液。随后加入1/3体积的蛋白loading buffer,水浴煮沸10 min。蛋白质样品通过100 g/L SDS-PAGE凝胶进行分离,并转移至聚偏二氟乙烯膜上。封闭处理使用快速封闭液在室温下封闭1 h。封闭后,使用TBST缓冲液清洗3次,将转印膜与一抗在4 ℃孵育12 h。一抗孵育结束后,吸除一抗并再次使用TBST缓冲液清洗3次,随后将转印膜与二抗在室温下孵育2 h。吸除二抗孵育液并用TBST清洗3次后,配制显影液,显影2~3 s,通过Tanon 4600SF扫描系统进行检测。所获数据使用Image J软件进行灰度分析。蛋白质表达水平以GAPDH为内参进行归一化,并以相对倍数变化的形式表示。
1.4 统计学分析
本研究中实验均进行3次重复,数据以“平均值±标准差”表示。对于多组间的差异分析,使用GraphPad Prism软件进行ANOVA检验分析,显著性水平以差异字母表示,相同字母表示无显著性差异(P>0.05),不同字母表示存在显著性差异(P<0.05)。
2 结果与分析
2.1 消化酶种类和时间对猪脂肪源间充质干细胞分离的影响
取猪皮下脂肪组织,使用不同的消化酶和消化时间进行解离,所获得的细胞数量存在差异。采用台盼蓝染色法对分离获得的细胞进行染色,并计算不同消化方式下细胞的数量和活率。如图1-a和图1-b所示,使用1 g/L的Ⅰ型胶原酶时,细胞活率和数量均高于使用2.5 g/L的胰蛋白酶的组别。在使用1 g/L的Ⅰ型胶原酶消化的情况下,所获细胞数量随消化时间的延长呈现先上升后下降的趋势,细胞活率均高于80%。使用1 g/L的Ⅰ型胶原酶消化75 min时,细胞数量和活率均达到最高值,每克脂肪组织释放的细胞数约为(4.07±0.71)×104个,细胞活率为97%。同样的,在细胞贴壁并培养24 h后,观察到1 g/L的Ⅰ型胶原酶组贴壁细胞数量显著高于2.5 g/L的胰蛋白酶组。并且使用不同种消化酶得到的细胞形态相似,均呈纺锤形(图1-c)。同时,进一步研究了胶原酶和胰蛋白酶联用对细胞分离效果的影响,结果显示,2.5 g/L的胰蛋白酶+1 g/L的Ⅰ型胶原酶联用分离所获细胞的存活率均在88%以下,低于使用1 g/L 的Ⅰ型胶原酶消化时的细胞活率(图1-a和图1-d)。双酶联用所获细胞数量同样也呈现随消化时间的延长先上升后下降的趋势,当消化60 min时收获的细胞数量最多,为(3.393±0.64)×104个细胞,但仍少于仅使用1 g/L的Ⅰ型胶原酶消化75 min 释放的细胞数量(4.07±0.71)×104个(图1-b和图1-e)。综上,后续采用1 g/L的Ⅰ型胶原酶消化75 min的条件进行猪脂肪源间充质干细胞的分离。

a-不同酶种类和消化时间收集到细胞的活率;b-不同酶种类和消化时间收集到细胞的数量;c-不同酶种类和消化时间收集到的细胞贴壁24 h后的形态图片(比例尺=200 μm);d-胶原酶和胰蛋白酶联用消化不同时间收集到细胞的活率;e-胶原酶和胰蛋白酶联用消化不同时间收集到的细胞数量
图1 消化酶种类和消化时间对脂肪源间充质干细胞分离效率的影响
Fig.1 Effects of digestive enzyme types and digestion time on the isolation efficiency of adipose-derived mesenchymal stem cells
注:相同字母表示无显著性差异(P>0.05),不同字母表示存在显著性差异(P<0.05)(下同)。
2.2 组织部位对猪脂肪源间充质干细胞分离的影响
随后,研究不同脂肪来源组织部位(皮下脂肪和内脏脂肪,图2-a)对脂肪源间充质干细胞分离效率的影响。皮下脂肪和内脏脂肪组织在消化后均有细胞沉积在离心管底部(图2-b)。通过将细胞重悬计数,结果显示,皮下脂肪组织的细胞分离效率最高,每克组织可获得(4.77±0.24)×104个细胞,而内脏脂肪组织的细胞数量较少,仅为(2.81±0.48)×104个(图2-c)。此外,分离48 h后,观察到来自不同脂肪组织的间充质干细胞形态相似,均为纺锤形的成纤维样结构(图2-d)。因此,后续选取皮下脂肪作为提取猪脂肪源间充质干细胞的组织来源部位。

a-不同脂肪部位外观形态图片;b-不同脂肪部位收集到的细胞沉淀;c-不同脂肪部位收集到的细胞数量;d-不同脂肪部位收集到的细胞形态(比例尺=200 μm)
图2 脂肪来源部位对脂肪源间充质干细胞分离效率的影响
Fig.2 Effect of adipose-derived sites on the isolation efficiency of adipose-derived mesenchymal stem cells
2.3 猪脂肪源间充质干细胞的鉴定
波形蛋白是一种中间纤维蛋白,广泛存在于间质来源的细胞中,例如成纤维细胞、间充质干细胞;胶原蛋白广泛存在于细胞基质中,与间充质干细胞的增殖和分化调控密不可分。因此,本研究利用免疫荧光染色检测这2种蛋白在分离获得的猪间充质干细胞中的表达情况。结果表明,波形蛋白与胶原蛋白均在细胞中高水平表达,阳性率为100%(图3-a)。为了进一步鉴定分离得到细胞的特性,利用流式细胞仪对细胞表面分子CD29、CD34、CD44、CD45、CD90、CD105进行分析。结果表明,分离得到的猪间充质干细胞高水平表达CD29、CD44、CD90、CD105,且不表达CD34和CD45(图3-b),符合间充质干细胞的鉴定标准[19]。上述结果表明,本实验分离获得的细胞为间充质干细胞且纯度较高。
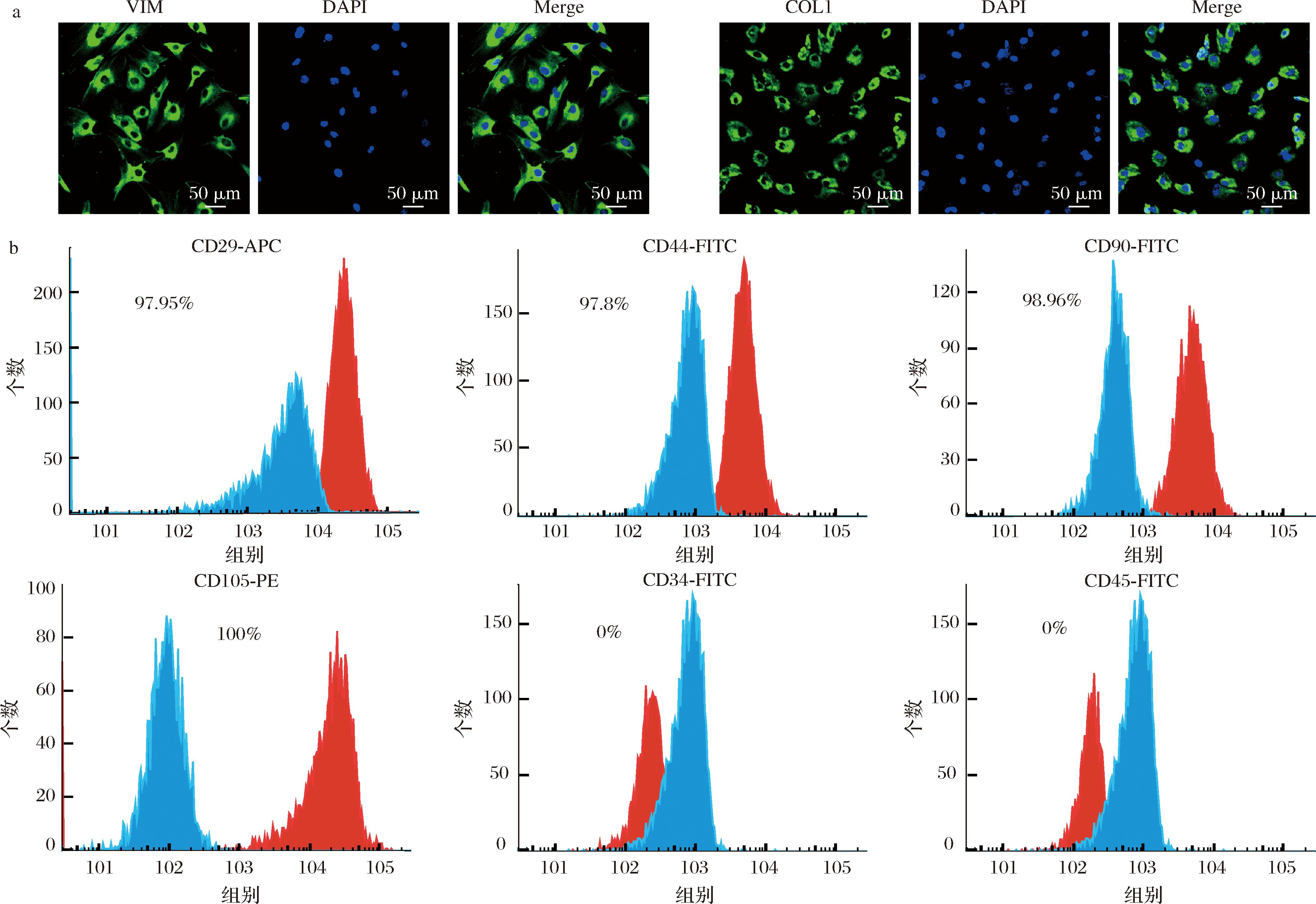
a-脂肪源间充质干细胞波形蛋白与Ⅰ型胶原蛋白免疫荧光染色(比例尺=50 μm);b-脂肪源间充质干细胞表面标志物CD29/CD34/CD44/CD45/CD90/CD105检测
图3 脂肪源间充质干细胞的鉴定
Fig.3 Identification of adipose-derived mesenchymal stem cells
注:图b中红色为抗体信号,蓝色为同型对照。
2.4 猪脂肪源间充质干细胞的体外增殖研究
将分离获得的猪间充质干细胞进行连续传代培养,以评估细胞的体外增殖活力和生存周期。经过体外连续35 d的培养,猪脂肪源间充质干细胞共传代9次,总细胞量达(1.66±0.68)×1010个,细胞扩增倍数为(4.15±1.7)×104,细胞分裂(15.24±0.69)次(图4-a~图4-c)。对不同代数细胞的群体倍增时间进行统计,结果显示,细胞在P1~P7(培养18 d)时增长速度平稳,此时群体倍增时间约为45 h。而P8以后,由于细胞衰老、凋亡等原因影响,细胞增殖逐渐缓慢,倍增时间持续延长,尤其是在约P10(培养35 d)时,倍增时间高达约(102.87±13.3) h(图4-d)。在培养不同阶段,使用β-半乳糖苷酶检测试剂盒对细胞进行了衰老检测。结果显示,P1细胞的β-半乳糖苷酶染色为阴性,表明此时细胞未发生衰老;而P6细胞的β-半乳糖苷酶染色阳性率为30%,P10细胞的阳性率则高达85%。这一结果说明,在体外传代培养过程中,细胞逐渐发生衰老(图4-e和图4-f)。综上,猪脂肪源间充质干细胞在体外培养中表现出良好的增殖能力,但随着传代次数的增加,细胞衰老现象逐渐明显,为细胞的大规模培养提供了参考。
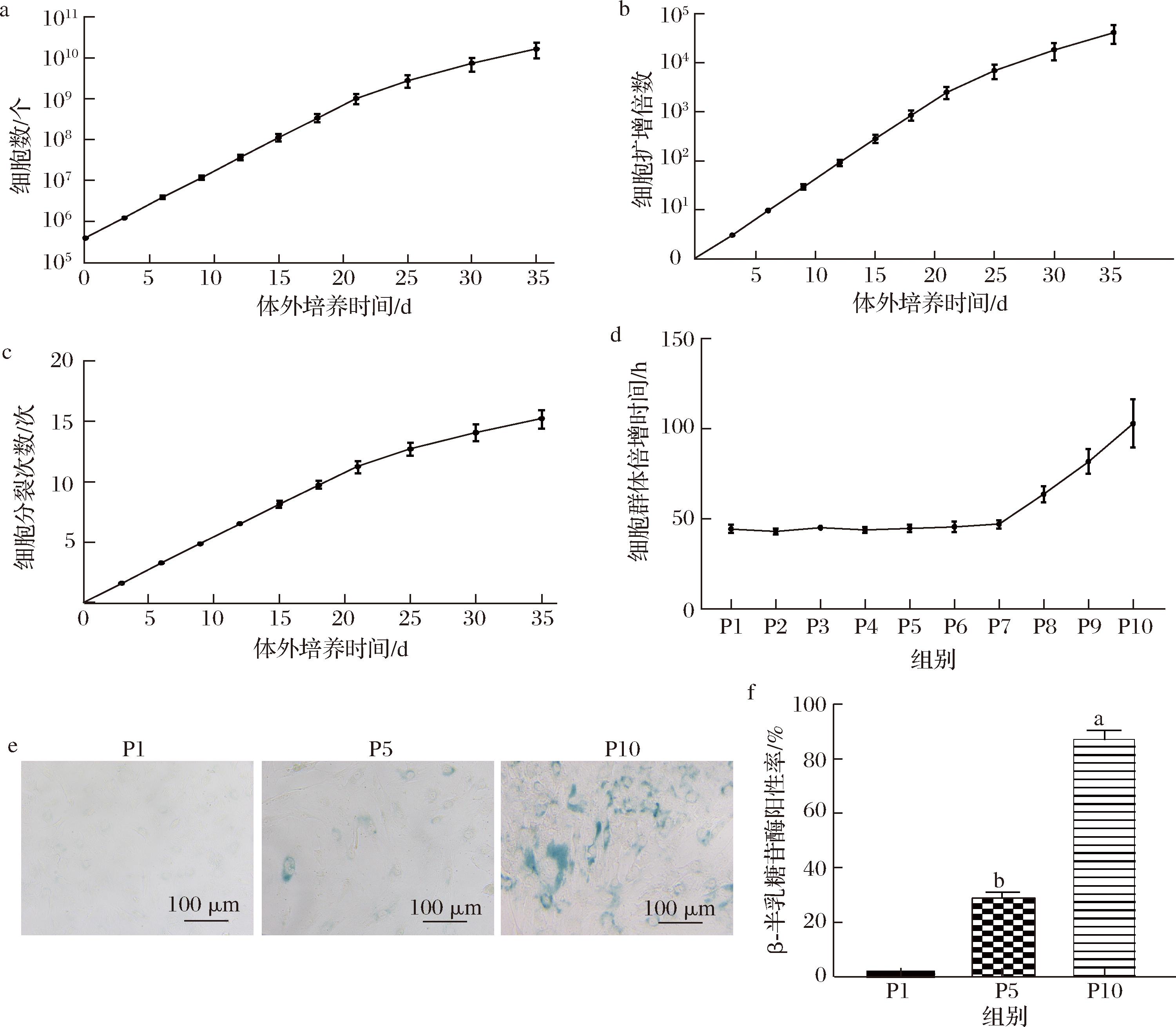
a-脂肪源间充质干细胞体外培养35 d的生长曲线;b-脂肪源间充质干细胞体外培养35 d的扩增倍数;c-脂肪源间充质干细胞体外培养35 d细胞分裂次数;d-脂肪源间充质干细胞体外培养10代内的群体倍增时间;e-脂肪源间充质干细胞的β-半乳糖苷酶染色情况(比例尺=100 μm);f-细胞衰老β-半乳糖苷酶染色情况的定量分析
图4 脂肪源间充质干细胞的体外增殖培养情况
Fig.4 In vitro proliferation culture of adipose-derived mesenchymal stem cells
2.5 猪脂肪源间充质干细胞的体外高效成脂分化研究
间充质干细胞具有多向分化的潜能,其中成脂分化是其重要的分化途径之一。因此,本研究首先采用传统成脂分化方案,评估了猪脂肪源间充质干细胞在体外培养不同阶段的成脂分化能力,结果表明,随着传代次数的增加,细胞的成脂分化能力逐渐减弱。从图5-a可以明显观察到,在培养早期(如P1)时,细胞能够高效地进行成脂分化,胞内有明显的脂滴形成。随着细胞传代的次数增加,到培养中期(如P6),尽管经诱导细胞仍能一定程度地进行成脂分化,但分化效率显著下降,脂滴的形成数量减少。到培养后期(如P10),细胞几乎完全丧失成脂分化能力,基本观察不到脂滴的形成。为提高培养中后期细胞的成脂分化效率,本研究选取P6~P8猪脂肪源间充质干细胞,评估了17种脂肪酸和6种植物油对细胞成脂分化效率的影响。通过油红O染色利用吸光度法对化合物进行初步筛选,结果显示,脂肪酸中的肉豆蔻油酸、α-亚麻酸,植物油中的茶籽油、亚麻籽油具有促进提升细胞成脂分化效率的作用(图5-b和图5-c)。
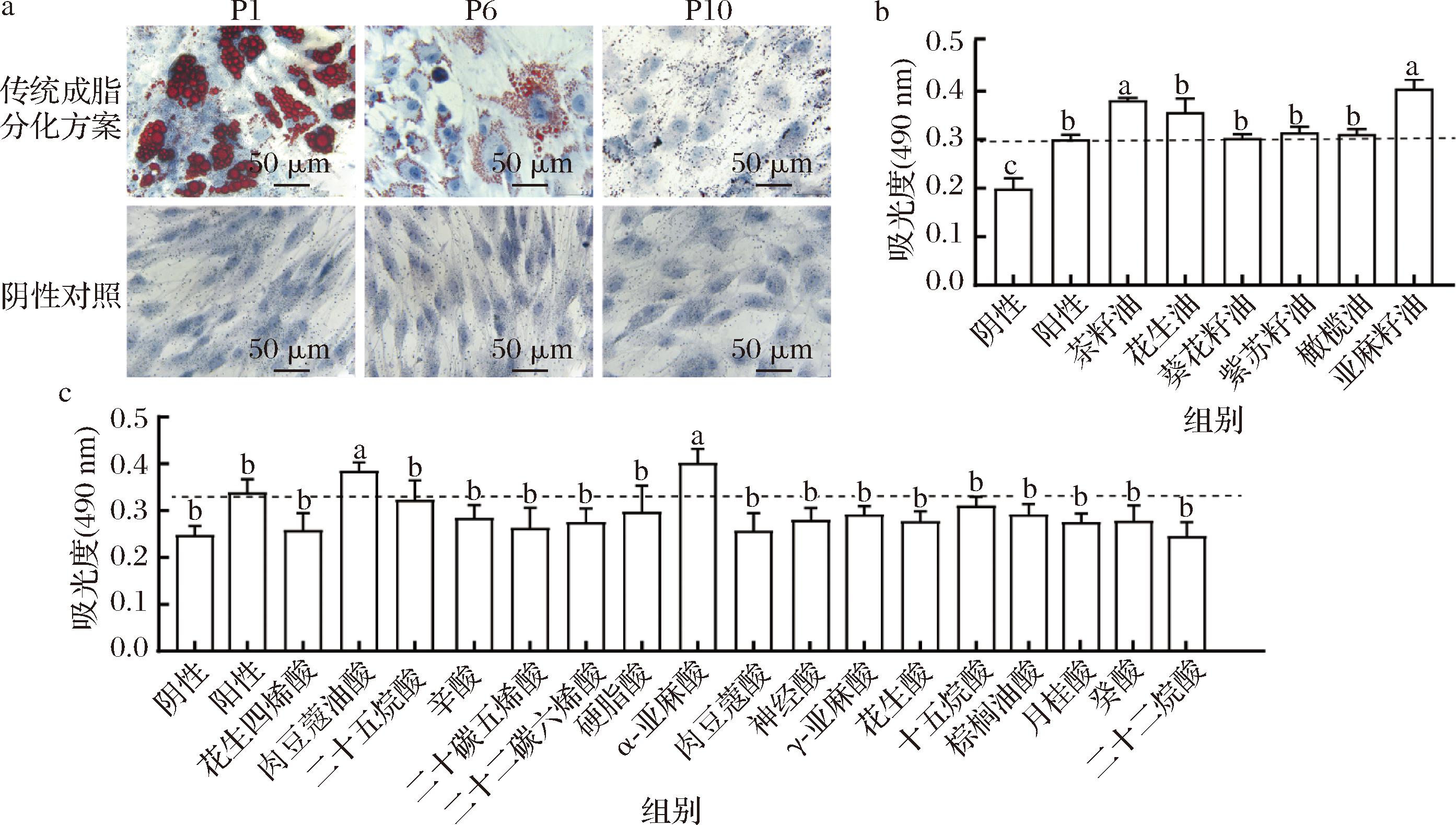
a-不同培养代数脂肪源间充质干细胞成脂情况(比例尺=50 μm);b-筛选6种植物油对脂肪源间充质干细胞成脂分化影响的吸光度检测;c-筛选17种脂肪酸对脂肪源间充质干细胞成脂分化影响的吸光度检测
图5 不同种类植物油和脂肪酸诱导猪脂肪源间充质干细胞成脂分化的情况
Fig.5 Adipogenic differentiation of porcine adipose-derived mesenchymal stem cells induced by different kinds of vegetable oils and fatty acids
随后,本研究对初步筛选得到的4种物质进行了不同浓度的作用研究,旨在确定最佳的脂肪酸与植物油及其使用浓度。通过评估细胞成脂分化后单位细胞脂滴的生成面积,发现茶籽油、亚麻籽油和α-亚麻酸均显著促进了脂滴的生成和积累,且作用效果随着使用浓度的增加而增强(图6-a和图6-b)。但是,当这些物质的使用浓度过高时,细胞出现了凋亡和脱落现象。因此,本研究利用CCK-8试验对各组细胞在诱导分化后的活力进行了定量评估。结果显示,添加高浓度的脂肪酸与植物油会显著影响猪脂肪源间充质干细胞的活力,尤其是当添加20 μmol/L α-亚麻酸、1 μL/mL亚麻籽油和茶籽油时,细胞活力显著下降(图6-c)。综上,本研究成功筛选出3种有效的食品化诱导剂,即茶籽油、亚麻籽油和α-亚麻酸,其能够有效诱导猪脂肪源间充质干细胞的成脂分化和脂滴形成。其中,10 μmol/L α-亚麻酸和0.5 μL/mL亚麻籽油分别是效果最佳的脂肪酸和植物油。
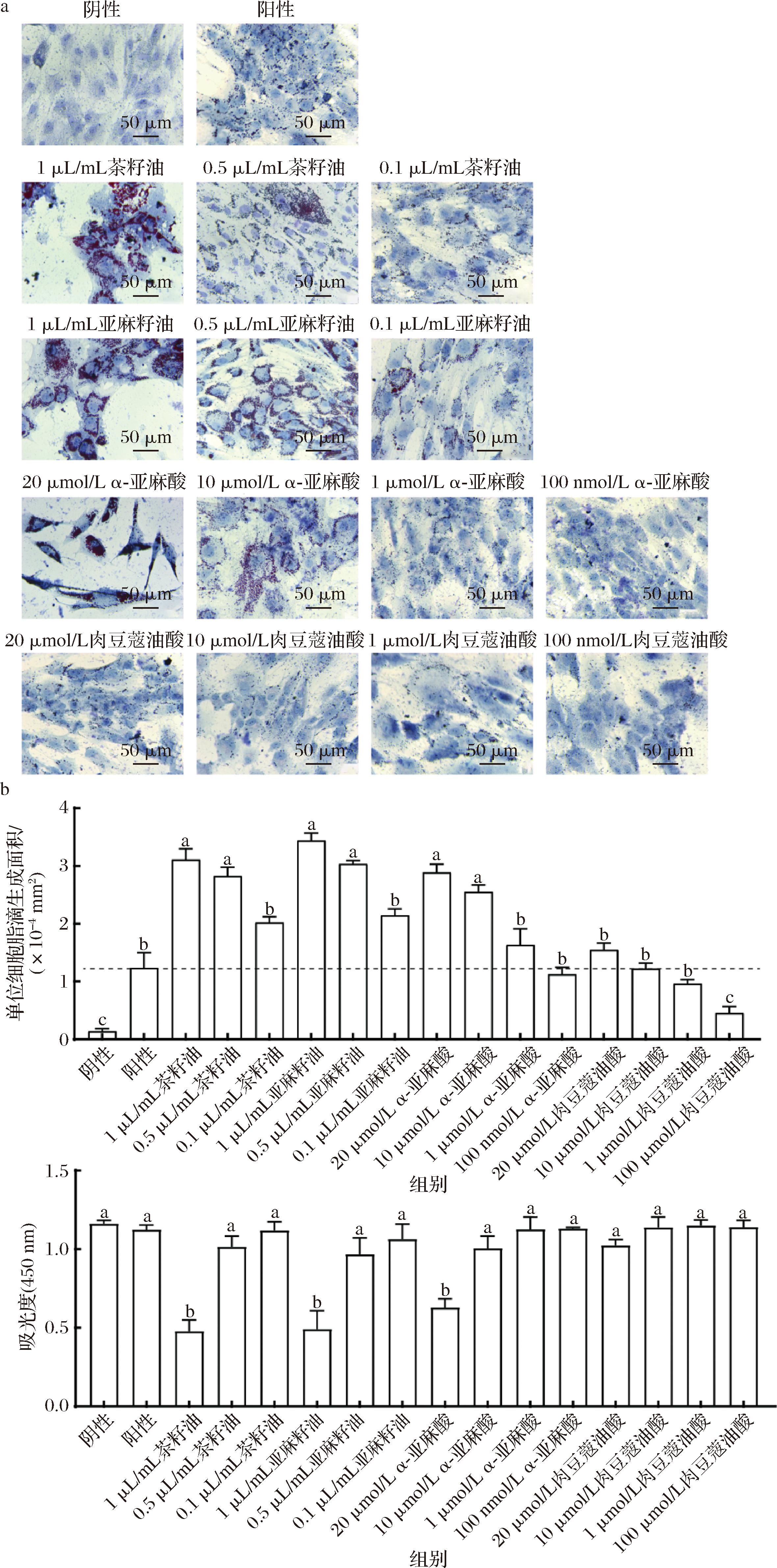
a-不同浓度的α-亚麻酸、肉豆蔻油酸、亚麻籽油和茶籽油促进脂肪源间充质干细胞成脂分化油红O染色(比例尺=50 μm);b-图a的油红O染色定量;c-使用CCK-8方法检测不同浓度的α-亚麻酸、肉豆蔻油酸、亚麻籽油和茶籽油对细胞活性的影响
图6 不同浓度茶籽油、亚麻籽油、α-亚麻酸和肉豆蔻油酸诱导猪脂肪源间充质干细胞成脂分化的情况
Fig.6 Adipogenic differentiation of porcine adipose-derived mesenchymal stem cells induced by different concentrations of tea seed oil, linseed oil, α-linolenic acid, and myristic oleic acid
据报道,使用传统诱导剂(1.3.4节)诱导间充质干细胞分化的周期较长,通常需要10~14 d[20]。因此,本研究对上述筛选得到的食品级成脂诱导剂与传统成脂分化诱导剂进行了分化周期的对比研究。结果表明,使用10 μmol/L α-亚麻酸和0.5 μL/mL亚麻籽油时,仅需5 d即可明显观察到脂滴的形成,80%的细胞周围被脂滴包围。相比之下,传统成脂分化组在同一时间点仅观察到少量小脂滴的生成(图7-a和图7-b)。继续诱导细胞分化至10 d时,传统分化方案的细胞脂滴形成逐渐积累,但是单位细胞的脂滴生成面积仍低于分化5 d的α-亚麻酸和亚麻籽油组(图7-a和图7-b)。同时,在分化10 d时,发现添加α-亚麻酸和亚麻籽油的组别出现了细胞脱落的现象,可能原因是细胞分化为成熟脂肪细胞时,其内部脂质积累增加,细胞体积膨胀,细胞形态发生变化,从而可能导致细胞与培养基底表面的黏附力减弱(图7-a和图7-b)。进一步,利用qPCR检测诱导5 d后脂肪细胞分化过程中重要的转录因子:过氧化物酶体增殖物激活受体γ(PPARγ)、脂肪酸结合蛋白(FABP4)、CCAAT增强子结合蛋白α(C/EBPα)、乙酰辅酶A羧化酶(ACCα)的表达情况,发现与传统成脂分化方案相比,利用α-亚麻酸和亚麻籽油诱导的细胞中相关基因的表达量均显著升高(图7-c)。其中,在α-亚麻酸诱导的组别中,与传统诱导剂组相比,PPARγ表达提高3.11倍、FABP4表达提高1.35倍、C/EBPα表达提高3.81倍,ACCα表达提高2.52倍;在亚麻籽油诱导的组别中,与传统诱导剂组相比,PPARγ表达提高3.68倍、FABP4表达提高2.49倍、C/EBPα表达提高4.19倍,ACCα表达提高2.74倍(图7-c)。此外,利用Western Blot检测FABP4、ACCα蛋白的表达情况,与qPCR结果相似,添加α-亚麻酸和亚麻籽油诱导后蛋白表达水平均上升(图7-d和图7-e)。上述结果表明,本研究筛选获得的食品级成脂诱导剂显著缩短了猪脂肪源间充质干细胞的分化周期,提高了分化效率,为细胞培养肉的快速生产提供了新的策略。

a-分化5 d与10 d时,添加传统诱导剂、10 μmol/L α-亚麻酸或0.5 μL/mL亚麻籽油的分化培养基诱导的脂肪源间充质干细胞成脂分化情况,比例尺=50 μm;b-图a的油红O染色定量;c-使用qPCR检测成脂相关基因的表达情况;d-使用Western Blot检测成脂相关蛋白的表达情况;e-图d Western Blot条带灰度值定量
图7 食品级成脂诱导剂与传统诱导剂对猪脂肪源间充质干细胞分化周期的影响
Fig.7 Effects of food-grade adipogenic inducers and conventional adipogenic inducers on the differentiation cycle of porcine adipose-derived mesenchymal stem cells
3 结论与讨论
经济高效地获得具有产业化发展潜力的种子细胞系是细胞培养肉技术取得突破和实现大规模生产的核心基础[21]。在细胞培养肉的制备过程中,脂肪源间充质干细胞因其能够分化为脂肪细胞的独特能力,以及在体外易于培养和扩增的特点,成为当前研究的热点,并具有广泛的应用前景。脂肪源间充质干细胞的分离方法多种多样,其中酶消化法和机械法是最常用的2种[22]。选择合适的分离技术对获得高质量、高产量的细胞至关重要。研究表明,不同的分离方法会显著影响间充质干细胞的产量和生物学特性。例如,通过对比纯机械法与机械-酶法的实验发现,使用机械-酶法获得的细胞数量显著高于纯机械法处理的细胞,表明酶消化处理能够有效提高细胞的释放效率[23]。此外,所用酶的种类、酶消化的持续时间等因素,都在一定程度上影响着细胞的分离效果和质量。因此,优化酶消化过程,选择合适的酶种类和消化时间,对于提高脂肪来源间充质干细胞的分离效果具有重要意义。本研究采用机械-酶消化法对猪脂肪来源的间充质干细胞进行分离,并系统评估了所用酶种类、消化时间对细胞分离效率的影响。结果表明,在所有消化时间组别中,使用Ⅰ型胶原酶消化脂肪组织释放细胞数量均高于胰酶组。可能的原因是,胶原酶针对胶原蛋白等细胞外基质的分解特别有效[24],而脂肪组织基质中富含胶原蛋白(占比>60%)[25],胶原酶可靶向分解胶原纤维网络,释放间充质干细胞,这对于从天然组织环境中释放间充质干细胞至关重要。而胰蛋白酶是一种丝氨酸蛋白酶,主要在赖氨酸和精氨酸残基的羧基侧切割肽键,能够有效地分离贴壁细胞与培养皿[26]。另外,随着酶消化时间的延长,细胞的释放数量呈现先增长后下降的趋势,75 min是分离猪脂肪源间充质干细胞的最佳消化时间,这可能是因为适当延长消化时间有利于组织的充分解离和细胞的完全释放,但是,长时间的消化可能会对细胞结构特别是细胞膜造成损害,降低消化效率和细胞活力。值得注意的是,本研究在方法优化过程中进一步评估了酶联用策略的可行性。实验显示,2.5 g/L的胰蛋白酶与1 g/L的Ⅰ型胶原酶联合消化60 min时达到细胞得率峰值,但仍显著低于单独使用1 g/L的Ⅰ型胶原酶消化75 min的分离效率。此外,酶联用组细胞存活率始终低于88%,而胶原酶单用组存活率稳定维持在90%以上。这可能的原因是,在联用体系的前45 min内,胶原酶主导的基质降解作用因时间不足导致消化不完全;而当消化时间延长至60~90 min时,胰蛋白酶对细胞膜蛋白的非特异性切割加剧,引发细胞损伤。
另外,不同脂肪部位的组织结构差异也会影响分离过程的效果[27]。本研究发现,在相同分离条件下,皮下脂肪组织释放细胞数量多于内脏脂肪组织。皮下脂肪通常具有较松散的结构和较低的基质细胞密度,使得酶解法在分离过程中更加高效,能够获得较高的细胞产量和较好的细胞纯度;相对而言,内脏脂肪组织则含有更多的血管细胞和紧密的基质成分,可能需要更多的处理步骤,如更高浓度的酶或更细致的机械处理,才能有效地提取干细胞。此外,有研究发现与源自内脏脂肪的间充质干细胞相比,来自皮下脂肪的脂肪间充质干细胞表现出优异的增殖和分化能力[28]。来自不同脂肪部位的间充质干细胞基因表达谱也存在显著差异。例如,与内脏脂肪间充质干细胞相比,皮下脂肪间充质干细胞已被证明表达更高水平的与干性和自我更新相关的基因,例如c-MYC和KLF4[29]。这种差异表达可能影响不同脂肪部位来源的间充质干细胞分化成各种细胞类型的能力及其整体再生潜力[30]。因此,选择皮下脂肪组织作为脂肪源间充质干细胞分离来源部位,具有显著的优势。
成脂能力是评估间充质干细胞是否具备细胞培养脂肪生产潜力的关键指标。研究发现,随着体外传代次数的增加,脂肪源间充质干细胞的成脂能力显著下降。已有研究表明,重复传代加速了间充质干细胞的衰老过程,进而导致细胞的代谢及信号通路发生改变。在这个过程中,脂肪生成相关基因的表达下调,而与衰老和细胞凋亡相关的基因上调,这种基因表达的变化使得干细胞对脂肪生成刺激的响应能力减弱,从而降低了其分化为脂肪细胞的潜力[31-32]。基因组稳定性对维持细胞干性也起着至关重要的作用。研究发现,脂肪来源的间充质干细胞在体外传代到第5代时,DNA损伤显著增加;而在第7代时,细胞甚至出现了染色体畸变[33-34]。这表明,长时间的传代过程可能导致细胞的基因组稳定性逐渐丧失,进一步影响其生物学特性和功能。此外,培养微环境对间充质干细胞的分化潜力也具有重要影响。氧气水平、营养物质的可用性以及特定生长因子的存在等因素,都会在一定程度上影响脂肪形成的过程[35-36]。因此,减缓间充质干细胞衰老速度、延长细胞分化能力维持时间对于细胞培养脂肪的高效生产具有重要意义。
在分化过程中,细胞所处的培养环境可能无法维持最佳的分化条件,这也可能是干细胞分化为脂肪细胞能力下降的原因之一。因此,优化细胞分化的条件对于促进脂肪形成具有重要意义。研究表明,n-3长链多不饱和脂肪酸,如二十碳五烯酸和二十二碳六烯酸,以及n-6脂肪酸,如亚油酸,能够显著影响间充质干细胞的成脂潜力。例如,棕榈酸甲酯(methyl palmitate,PAME)被发现能够通过激活GPR40/120介导的通路,增强大鼠脂肪组织来源的间充质干细胞的成脂分化,激活这一信号通路后,细胞内钙水平上升,并启动ERK信号传导[37]。此外,油酸作为一种单不饱和脂肪酸,已被证实能够增强3T3-L1前脂肪细胞的形态变化和脂质积累。其机制与油酸降低PPARγ和C/EBPα启动子甲基化水平,并上调脂肪形成转录因子的表达有关[38]。这些研究表明,脂肪酸能够通过多种细胞内信号级联反应来调节分化过程。本研究中发现,向成脂分化培养基中添加α-亚麻酸可以显著增强脂肪形成能力。通过α-亚麻酸处理后的脂肪源间充质干细胞表现出脂肪酸合成蛋白及成脂分化重要转录因子PPARγ和C/EBPα表达的上调,这一变化进一步支持了脂质储存增加和脂肪细胞形成加速。然而,实验也表明,较高浓度的脂肪酸在培养基中的添加能够更有效地促进成脂分化。尽管如此,脂肪酸的溶剂为DMSO,考虑到脂肪酸及其溶剂可能带来的细胞毒性,过高的脂肪酸浓度虽然能增强成脂效果,但也会对细胞造成较大毒性,进而影响细胞的正常生命活动,最终不利于细胞培养脂肪的体外生产。本研究还发现,相比于单独添加α-亚麻酸诱导分化,使用亚麻籽油诱导的脂肪生成效果更显著,这可能是因为亚麻籽油中除了含有较高浓度的α-亚麻酸外,还富含其他具有生物学活性的脂肪酸如单不饱和脂肪酸(如油酸)、ω-6系列脂肪酸(如亚油酸)以及饱和脂肪酸(如棕榈酸)等,这些脂肪酸成分可能共同作用,进一步促进脂肪细胞的分化和成熟[39]。因此,亚麻籽油中多种成分的协同效应可能是其在诱导脂肪生成过程中比单独使用α-亚麻酸更具优势的原因。同时,相比于脂肪酸,食用油不仅更易获得且成本更低,这使其成为一个更具吸引力的选择,具有广阔的应用前景。
综上所述,本研究通过优化猪脂肪源间充质干细胞分离方法,确定了使用1 g/L的Ⅰ型胶原酶消化75 min 为最佳分离条件。与内脏脂肪相比,采用皮下脂肪作为原料能够获得更多的脂肪源间充质干细胞,每克脂肪组织约可收获(4.77±0.24)×104个细胞。通过表面标志物鉴定和免疫荧光染色,确认所获得的脂肪源间充质干细胞具有较高的纯度。此外,本研究还发现α-亚麻酸和亚麻籽油可作为食品级成脂诱导剂,高效促进猪脂肪源间充质干细胞的成脂分化和胞内脂滴的积累,并显著缩短了猪脂肪源间充质干细胞的分化周期。总之,这些研究成果为细胞培养脂肪的工业化生产提供了高效的种子细胞分离培养和快速高效的成脂分化诱导方案,为后续大规模生产细胞培养脂肪奠定了坚实基础。
[1] POST M J, LEVENBERG S, KAPLAN D L, et al.Scientific, sustainability and regulatory challenges of cultured meat[J].Nature Food, 2020, 1(7):403-415.
[2] JONES N.Lab-grown meat:The science of turning cells into steaks and nuggets[J].Nature, 2023, 619(7968):22-24.
[3] MORITZ M S M, VERBRUGGEN S E L, POST M J.Alternatives for large-scale production of cultured beef:A review[J].Journal of Integrative Agriculture, 2015, 14(2):208-216.
[4] PICARD B, GAGAOUA M. Muscle fiber properties in cattle and their relationships with meat qualities: An overview[J]. Journal of Agricultural and Food Chemistry, 2020, 68(22):6021-6039.
[5] OTHMAN M, KAUR H. Thromboelastography (teg)[M]. New York: Springer New York, 2017:533-543.
[6] SONG W J, LIU P P, MENG Z Q, et al.Identification of porcine adipose progenitor cells by fluorescence-activated cell sorting for the preparation of cultured fat by 3D bioprinting[J].Food Research International, 2022, 162:111952.
[7] 王立斌, 刘婷, 马晓娜, 等.人胎盘间充质干细胞的分离与鉴定[J].宁夏医科大学学报, 2010, 32(8):864-866.WANG L B, LIU T, MA X N, et al.Isolation and characterization of mesenchymal stem cells from human placenta[J].Journal of Ningxia Medical University, 2010, 32(8):864-866.
[8] MERRICK D, SAKERS A, IRGEBAY Z, et al.Identification of a mesenchymal progenitor cell hierarchy in adipose tissue[J].Science, 2019, 364(6438):eaav2501.
[9] 关欣, 陈坚, 唐好好, 等.应用于细胞培养肉的食品级成脂分化诱导剂:中国, CN118497112A[P].2024-08-16.GUAN X, CHEN J, TANG H H, et al.Food-grade adipogenic differentiation inducer for cell cultured meat:China, CN118497112A[P].2024-08-16.
[10] KANG D H, LOUIS F, LIU H, et al.Engineered whole cut meat-like tissue by the assembly of cell fibers using tendon-gel integrated bioprinting[J].Nature Communications, 2021, 12(1):5059.
[11] PASITKA L, COHEN M, EHRLICH A, et al.Spontaneous immortalization of chicken fibroblasts generates stable, high-yield cell lines for serum-free production of cultured meat[J].Nature Food, 2023, 4(1):35-50.
[12] KHAN F, SYEDA P K, NARTEY M N N, et al.Pretreatment of cultured preadipocytes with arachidonic acid during the differentiation phase without a cAMP-elevating agent enhances fat storage after the maturation phase[J].Prostaglandins and Other Lipid Mediators, 2016, 123:16-27.
[13] CHEN Y T, YANG Q Y, MA G L, et al.Dose- and type-dependent effects of long-chain fatty acids on adipogenesis and lipogenesis of bovine adipocytes[J].Journal of Dairy Science, 2018, 101(2):1601-1615.
[14] WANG C Z, WANG J Z, CHEN K R, et al.Caprylic acid (C8:0) promotes bone metastasis of prostate cancer by dysregulated adipo-osteogenic balance in bone marrow[J].Cancer Science, 2020, 111(10):3600-3612.
[15] GHNAIMAWI S, SHELBY S, BAUM J, et al.Effects of eicosapentaenoic acid and docosahexaenoic acid on C2C12 cell adipogenesis and inhibition of myotube formation[J].Animal Cells and Systems, 2019, 23(5):355-364.
[16] WANG J H, LIANG Y, JIAN L Y, et al.Linoelaidic acid enhances adipogenic differentiation in adipose tissue-derived stromal cells through suppression of Wnt/β-catenin signaling pathway in vitro[J].Prostaglandins, Leukotrienes and Essential Fatty Acids (PLEFA), 2016, 110:1-7.
[17] DENKE M A, GRUNDY S M.Comparison of effects of lauric acid and palmitic acid on plasma lipids and lipoproteins[J].The American Journal of Clinical Nutrition, 1992, 56(5):895-898.
[18] MATTSON F H, STRECK J A.Effect of the consumption of glycerides containing behenic acid on the lipid content of the heart of weanling rats[J].The Journal of Nutrition, 1974, 104(4):483-488.
[19] YANG X F, HE X, HE J, et al.High efficient isolation and systematic identification of human adipose-derived mesenchymal stem cells[J].Journal of Biomedical Science, 2011, 18(1):59.
[20] 苗轲, 高旭, 曹亚强, 等.不同诱导周期对人白色前脂肪细胞分化水平的影响研究[J].环境卫生学杂志, 2024, 14:378-383;399.MIAO K, GAO X, CAO Y Q, et al.Effect of different induction stages on the differentiation level of human white preadipocytes[J].Journal of Environmental Hygiene, 2024, 14(5):378-383;399.
[21] YUEN J S K Jr, STOUT A J, KAWECKI N S, et al.Perspectives on scaling production of adipose tissue for food applications[J].Biomaterials, 2022, 280:121273.
[22] LENSCH M, MUISE A, WHITE L, et al.Comparison of synthetic media designed for expansion of adipose-derived mesenchymal stromal cells[J].Biomedicines, 2018, 6(2):54.
[23] RAPOSIO E, SIMONACCI F, PERROTTA R E.Adipose-derived stem cells:Comparison between two methods of isolation for clinical applications[J].Annals of Medicine and Surgery, 2017, 20:87-91.
[24] ARA JO A B, FURLAN J M, SALTON G D, et al.Isolation of human mesenchymal stem cells from amnion, chorion, placental decidua and umbilical cord:Comparison of four enzymatic protocols[J].Biotechnology Letters, 2018, 40(6):989-998.
JO A B, FURLAN J M, SALTON G D, et al.Isolation of human mesenchymal stem cells from amnion, chorion, placental decidua and umbilical cord:Comparison of four enzymatic protocols[J].Biotechnology Letters, 2018, 40(6):989-998.
[25] KIM M, YEO M, LEE K, et al.Extraction and characterization of human adipose tissue-derived collagen:Toward xeno-free tissue engineering[J].Tissue Engineering and Regenerative Medicine, 2024, 21(1):197-109.
[26] MIERSCH C, STANGE K, RÖNTGEN M.Effects of trypsinization and of a combined trypsin, collagenase, and DNase digestion on liberation and in vitro function of satellite cells isolated from juvenile porcine muscles[J].In Vitro Cellular &Developmental Biology Animal, 2018, 54(6):406-412.
[27] TAREEN W A, SABA E, RASHID U, et al.Impact of multiple isolation procedures on the differentiation potential of adipose derived canine mesenchymal stem cells[J].American Journal of Stem Cells, 2024, 13(1):27-36.
[28] QIU L H, SU Y J, ZHANG D L, et al.Identification of the centrifuged lipoaspirate fractions suitable for postgrafting survival[J].Plastic and Reconstructive Surgery, 2016, 137(1):67e-76e.
[29] RITTER A, FRIEMEL A, ROTH S, et al.Subcutaneous and visceral adipose-derived mesenchymal stem cells:Commonality and diversity[J].Cells, 2019, 8(10):1288.
[30] MASTRANGELO F, SCACCO S, BALLINI A, et al.A pilot study of human mesenchymal stem cells from visceral and sub-cutaneous fat tissue and their differentiation to osteogenic phenotype[J].European Review for Medical and Pharmacological Sciences, 2019, 23(7):2924-2934.
[31] HAN I, KWON B S, PARK H K, et al.Differentiation potential of mesenchymal stem cells is related to their intrinsic mechanical properties[J].International Neurourology Journal, 2017, 21(Suppl 1):S24-31.
[32] KIM G Y, CHOI G T, PARK J, et al.Comparative analysis of porcine adipose- and Wharton’s Jelly-derived mesenchymal stem cells[J].Animals, 2023, 13(18):2947.
[33] MALAGUTTI-FERREIRA M J, CRISPIM B A, BARUFATTI A, et al.Genomic instability in long-term culture of human adipose-derived mesenchymal stromal cells[J].Brazilian Journal of Medical and Biological Research, 2023, 56:e12713.
[34] EL ATAT O, ANTONIOS D, HILAL G, et al.An evaluation of the stemness, paracrine, and tumorigenic characteristics of highly expanded, minimally passaged adipose-derived stem cells[J].PLoS One, 2016, 11(9):e0162332.
[35] ALMAHASNEH F, ABU-EL-RUB E, KHASAWNEH R R, et al.Effects of high glucose and severe hypoxia on the biological behavior of mesenchymal stem cells at various passages[J].World Journal of Stem Cells, 2024, 16(4):434-443.
[36] REUMANN M K, LINNEMANN C, ASPERA-WERZ R H, et al.Donor site location is critical for proliferation, stem cell capacity, and osteogenic differentiation of adipose mesenchymal stem/stromal cells:Implications for bone tissue engineering[J].International Journal of Molecular Sciences, 2018, 19(7):1868.
[37] LIN J H, CHANG H H, LEE W S, et al.Palmitic acid methyl ester enhances adipogenic differentiation in rat adipose tissue-derived mesenchymal stem cells through a G protein-coupled receptor-mediated pathway[J].Stem Cells International, 2021, 2021(1):9938649.
[38] MALODOBRA-MAZUR M, CIERZNIAK A, DOBOSZ T.Oleic acid influences the adipogenesis of 3T3-L1 cells via DNA methylation and may predispose to obesity and obesity-related disorders[J].Lipids in Health and Disease, 2019, 18(1):230.
[39] 谢亚萍, 张建平, 王利民, 等.亚麻籽油营养特性、感官评价及主要挥发性物质分析[J].中国油脂, 2023.48:103-108.XIE Y P, ZHANG J P, WANG L M, et al.Analysis of nutrition property, sensory evaluation and major volatile components of flaxseed oil[J].China Oils and Fats, 2023, 48(7):103-108.