肽是对人体健康有益的活性分子,其分子质量低、易于消化和吸收,具有药理学特征,在小肠上部极化上皮细胞层的顶端侧被摄取后通过激活不同的信号通路发挥有益作用[1],发挥的物理化学作用源于独特的氨基酸组成、序列和结构等,已经成为药物开发领域中的候选药物、医学领域中治疗不适应症状的手段、保健食品领域中重要的功能成分[2]。肽按功能活性可分为抗癌肽、抗菌肽、降压肽、抗氧化肽、抗炎肽和免疫调节肽等[3]。活性肽的来源可以分为天然存在的、水解蛋白质产生的和人工合成的活性肽。天然活性肽具有高稳定性和高靶标亲力,但技术经济性不高难以用于工业化生产;人工合成的活性肽存在药效短、有副作用和成本高等特点;水解蛋白质产生的活性肽可分为酶解法和微生物发酵法,具有口服生物利用度高、不良反应少和安全等特点[4]。酶解法的酶水解位点都已解析,限制了肽的多样性[5],而微生物发酵通过使用不同类型的微生物和发酵条件,可以合成更广泛的蛋白酶来水解蛋白质,并且可以根据不同的酶特异性生产具有不同链长、不同氨基酸序列的肽,从而更有可能生产出与商业酶不同的新型肽序列。此外,蛋白水解酶的成本飙升和缺乏大规模的生产设施,导致肽的生产仍低于基准,这突显了微生物发酵更是一种经济与可持续性的生产有益肽的方法[6-7]。
微生物发酵法中,不同微生物的蛋白质水解系统不同,获得的水解物因而也会显示出不同的功能活性。SANJUKTA等[8]研究了不同枯草芽孢杆菌发酵2种大豆产生的肽具有不同的生物利用度;SEO等[9]利用不同微生物水解蛋白质,获得具有抗炎、抗氧化和抑制血管紧张素转换酶能力的肽。有研究表明,食品来源的生物活性肽在预防和管理慢性疾病方面有巨大的潜力[10]。HONISCH等[11]从蘑菇分离得到的环肽具有抗酪氨酸酶活性,酪氨酸酶与皮肤色素沉着有关。FLEURY等[12]研究了在体外消化7种不同的膳食蛋白,其中4种膳食蛋白对肠道细胞二肽基肽酶Ⅳ活性有较强的抑制作用。通过微生物发酵各种来源的蛋白质无疑是制备特定活性功肽的一种途径,其中,来自食品中的松子蛋白含有的氨基酸含量和种类非常丰富且普遍高于一般的植物蛋白[13],这为微生物发酵制备特定活性功能肽提供了非常有营养价值的蛋白原材料。
关于利用松子开展制备活性肽的相关研究较少,一般情况下的研究均集中利用酶解法制备松子肽,证明了松子肽具有抗氧化、抗衰老、抗疲劳、降血脂、增强免疫功能、抑制血管紧张素转换酶和提高学习与记忆功能等作用[14-18]。目前,通过微生物法制备松子肽的研究也证明了松子肽具有很好的抗氧化作用[19]。由于微生物特有一整套蛋白酶系统,因而能更有效地将松子蛋白质水解成具有不同功能特性的短肽[20],低分子质量肽不易被水解消化,容易通过肠道屏障而被机体吸收,随后表现出生物活性[21]。在SUN等[22]以松子粕为原材料通过酶解法和微生物发酵法制备抗氧化肽的研究中,表明了微生物法制备的松子肽更具有良好的抗氧化活性。综上,微生物发酵对于制备具有特定功能的松子肽具有非常重要的意义。目前,关于松子肽的活性功能已经得到了验证,但针对松子发酵用菌的筛选和松子蛋白的发酵过程的研究相对较少。因此,本研究重点关注筛选具有良好蛋白酶活力的松子发酵用菌并对其产酶类型进行分析,同时监测发酵过程中水解度、肽含量以及氨基酸含量的动态变化,有望为发酵松子蛋白的相关研究提供发酵菌株产酶能力及产酶类型上的参考,有望为微生物水解松子蛋白的水解效率和松子肽产量的相关研究提供数据参考。
1 材料与方法
1.1 材料与试剂
本研究的待筛菌株源自本实验室前期从松林土壤中分离纯化后保藏于实验室的菌种(14株菌株的编号为N-LYS-8~N-LYS-21);偃松松仁购自黑龙江大兴安岭地区呼中区。
十二烷基硫酸钠,北京宝诺美生物技术有限公司;邻苯二甲醛,北京博奥拓达科技有限公司;水合茚三酮、考马斯亮蓝G-250、4-(2-氨乙基)苯磺酰氟盐酸盐、N-(反式-环氧丁二酰基)-L-亮氨酸-4-胍基丁基酰胺、伊洛马司他,上海麦克林生化科技有限公司;购买的试剂均为分析纯。
a)邻苯二甲醛试剂:0.1 g十二烷基硫酸钠和3.81 g四硼酸钠完全溶解后加入2 mL用无水乙醇溶解的0.08 g邻苯二甲醛,混合均匀,最后加入0.088 g二硫苏糖醇,定容至100 mL,试剂现配现用避光保存;b)茚三酮试剂:取2%(质量分数)水合茚三酮溶液50 mL和0.1%(质量分数)抗坏血酸溶液5 mL,用去离子水定容至100 mL;c)磷酸缓冲液(pH 8.04):取0.907%(质量分数)磷酸二氢钾溶液与2.387 6%(质量分数)十二水磷酸氢二钠溶液,按1∶19(体积比)混合均匀;d)考马斯亮蓝G-250试剂:考马斯亮蓝G-250 10 mg加入5 mL 95%(体积分数)乙醇和10 mL 85%(体积分数)磷酸,溶解后定容至100 mL;e)磷酸缓冲液(pH 7.2~7.4):用去离子水溶解完全0.800 6 g氯化钠、0.020 1 g氯化钾、0.142 g磷酸氢二钠和0.097 4 g磷酸二氢钾后定至100 mL。
1.2 培养基
a)初筛培养基:用去离子水溶解0.3 g牛肉膏、0.5 g氯化钠、1 g蛋白胨和1 g脱脂奶粉后,添加1.5 g琼脂粉,去离子水定容100 mL;b)复筛培养基:用去离子水溶解完全2.5 g脱脂奶粉后定至100 mL;c)发酵培养基:称取2 g松仁蛋白,用去离子水定容至100 mL,115 ℃灭菌20 min。
1.3 仪器与设备
GI54DWS立式自动压力蒸汽灭菌锅,致微(厦门)仪器有限公司;ZQLY-180ES振荡培养箱,上海知楚仪器有限公司;DM500生物显微镜,徕卡显微系统有限公司;SP-756P紫外可见分光光度计,上海光谱仪器有限公司;FD5-5P冷冻干燥机,西盟国际公司。
1.4 实验方法
1.4.1 产蛋白酶菌株的初筛
吸取2.5 μL活化两代OD600值调至统一的菌液滴加于初筛平板中心,37 ℃静置培养,在24 h和48 h取出平板用游标卡尺量出菌落(D)与水解圈(d)直径并做好记录。
1.4.2 产蛋白酶菌株的复筛
按2%(体积分数)接种种子液至复筛培养基,37 ℃,130 r/min培养至48 h后取发酵液12 000 r/min,4 ℃离心10 min,收集上清液测蛋白酶活力,蛋白酶活力的测定参考GB/T 23527.1—2023《酶制剂质量要求 第1部分:蛋白酶制剂》。
1.4.3 生理生化鉴定和系统发育树的构建
1.4.3.1 生理生化鉴定
根据《伯杰氏细菌鉴定手册》[23]和《常见细菌系统鉴定手册》[24]对菌株进行生理生化测试。
1.4.3.2 系统发育树的构建
利用细菌DNA提取试剂盒对菌株提取DNA后,以此作为PCR的DNA模板,采用细菌通用引物27 F (5′-AGAGTTTGATCCTGGCTCAG-3′)和1492 R (5′-ACGGTTACCTTGTTACGACTT-3′) 进行PCR扩增。将PCR扩增产物进行测序,测序结果在NCBI数据库中进行BLAST比对,利用MEGA7.0软件中邻接法构建系统进化树。
1.4.4 生长曲线与产酶曲线
生长曲线:按2%(体积分数)接种量接至LB培养基中培养,每隔2 h取样1次测OD600值。
产酶曲线:按2%(体积分数)接种量接种至复筛培养基,37 ℃,130 r/min振荡培养,每隔4 h取发酵液测蛋白酶活力。
1.4.5 松子蛋白的提取
偃松松仁剥壳去红衣后置于45~60 ℃恒温烘箱烘去除水分,烘干的松仁捣碎至稀泥状,无颗粒感即可采用索氏提取法除去油脂得到松子粕。松子粕采用恒温超声辅助碱提酸沉法进行松仁蛋白的提取,称取1 g松子粕加入30 mL蒸馏水搅拌均匀后用1 mol/L NaOH调节pH=9.2后进行恒温超声(超声温度45 ℃,超声功率500 W,超声时间60 min,超声次数1次)。超声结束再次搅拌溶解调节pH=9.2,5 000 r/min离心20 min取上清液并用1 mol/L HCl 调节pH=4.5沉淀蛋白,5 000 r/min离心取蛋白,结束后将蛋白pH调节中性,冻干。
1.4.6 产酶类型的鉴定
将4-(2-氨乙基)苯磺酰氟盐酸盐、N-(反式-环氧丁二酰基)-L-亮氨酸-4-胍基丁基酰胺和伊洛马司他蛋白酶抑制剂分别添加至发酵培养基,其工作质量浓度分别为400、80、1 μg/mL,恒温摇床孵育,每隔4 h取样测蛋白酶活力,对照不添加蛋白酶抑制剂。
1.4.7 水解度的测定
水解度的测定使用邻苯二甲醛法,取发酵上清液加入等量的12%(质量分数)三氯乙酸反应5 min,12 000 r/min离心10 min,取上清液400 μL加入3 mL邻苯二甲醛试剂混合均匀,反应2 min立即在340 nm测其吸光值。水解度的计算如公式(1)所示:
水解度![]()
(1)
式中:Asample为发酵液释放游离氨基酸数的吸光值;Ablank为发酵液空白对照原有游离氨基酸数的吸光值;Atotal为松子蛋白经120 ℃、24 h、6 mol/L盐酸水解后总游离氨基酸数的吸光值。
1.4.8 发酵液中氨基酸的测定
分别取质量浓度为1 mg/mL的丝氨酸储备液0、50、75、100、125、150、175 μL定容至1 mL,取发酵液上清液1 mL加入磷酸缓冲液(pH 8.04)0.5 mL和茚三酮试剂0.5 mL,混匀沸水浴15 min,冷却定容至25 mL,10 min后于570 nm测其吸光值。
1.4.9 多肽的测定
分别取质量浓度为1 mg/mL的牛血清白蛋白储备液0、10、20、30、40、50、60、70 μL用磷酸缓冲液(pH 7.2~7.4)定容至1 mL,取发酵上清液1 mL,加入5 mL考马斯亮蓝G-250试剂反应5~10 min后于595 nm测其吸光值。
1.5 数据的统计分析
通过Excel 2019初步整理试验数据与标准偏差分析,采用SPSS 25.0软件进行显著性分析,显著性水平α设定值为0.05(显著性水平用小写字母表示,相同字母表示组间差异不显著P<0.05;不同字母表示组间差异显著P>0.05;均值最大组标a,次之标a或b,以此类推)。最后,通过Origin 2021软件进行结果可视化。
2 结果与分析
2.1 初筛
如图1-a所示,本研究的14株菌株都呈现出透明水解圈,说明14株都具有分泌胞外蛋白酶能力,其能力大小如图1-b所示,菌株N-LYS-8和N-LYS-17水解圈比值分别为1.56和1.17;菌株N-LYS-9、N-LYS-12、N-LYS-18、N-LYS-20水解圈比值为1.89~1.73;菌株N-LYS-19、N-LYS-21、N-LYS-11水解圈比值为2.16~1.91;菌株N-LYS-13、N-LYS-15、N-LYS-16、N-LYS-14水解圈比值为2.59~2.50;而菌株N-LYS-10水解圈比值最大,为2.63,由于初筛的结果与在液体摇瓶中发酵的蛋白酶活力不一定一致,因此需要对14株菌进行复筛。
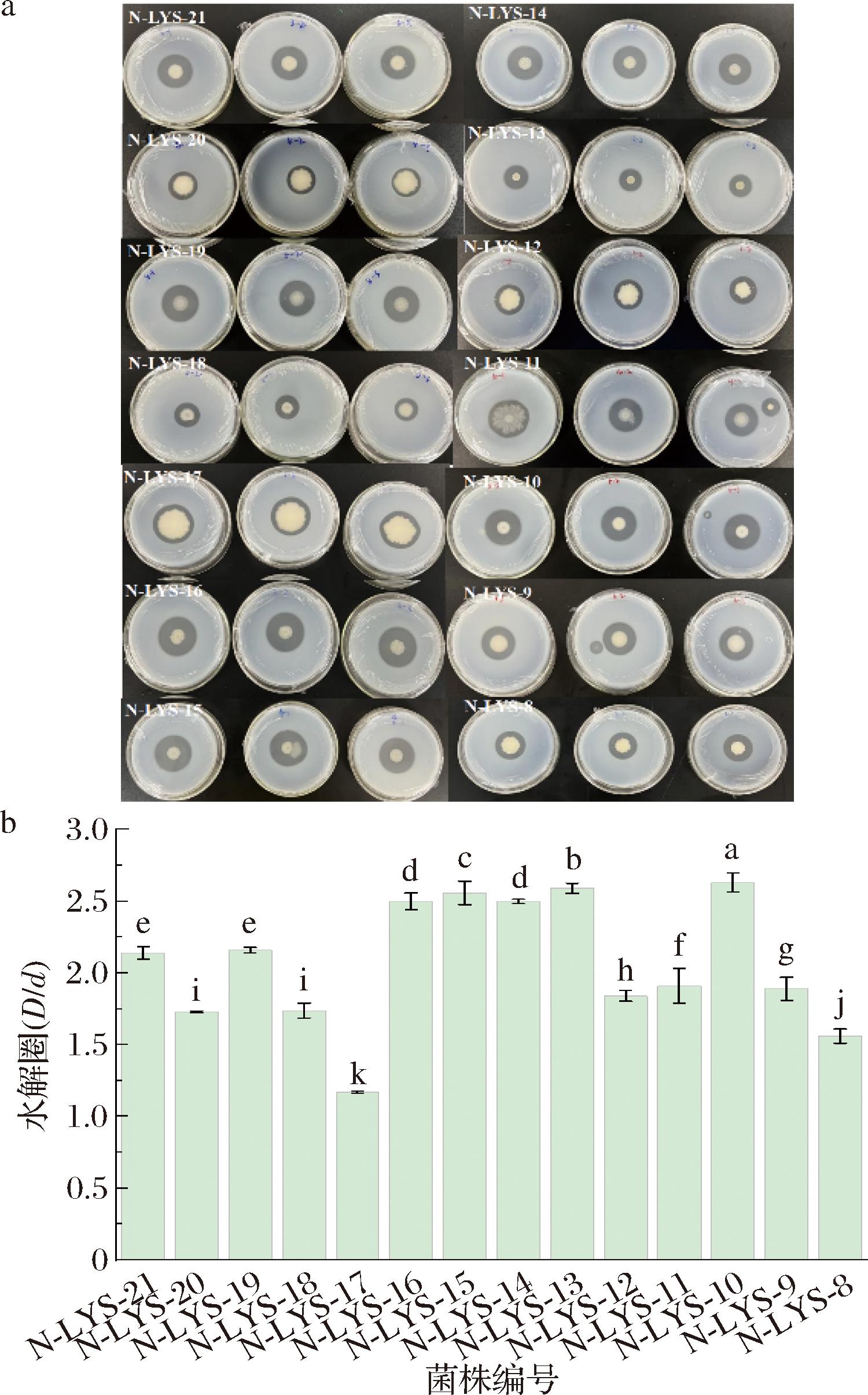
a-48 h水解圈;b-初筛结果
图1 14株菌株的水解圈与初筛结果
Fig.1 Hydrolysis circle and initial screening results of 14 strains
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.2 复筛
结果如图2所示,菌株N-LYS-14、N-LYS-18、N-LYS-21、N-LYS-10、N-LYS-15和N-LYS-12的蛋白酶活力为57.7~40.7 U/mL;菌株N-LYS-11、N-LYS-9、N-LYS-13、N-LYS-8、N-LYS-16、N-LYS-19、N-LYS-17的蛋白酶活力为70.0~62.0 U/mL,而菌株N-LYS-20的蛋白酶活力最高,为82.6 U/mL,表明好氧条件下,更适合菌株生长繁殖分泌胞外蛋白酶,因此选择菌株N-LYS-20为制备松子肽发酵用菌。
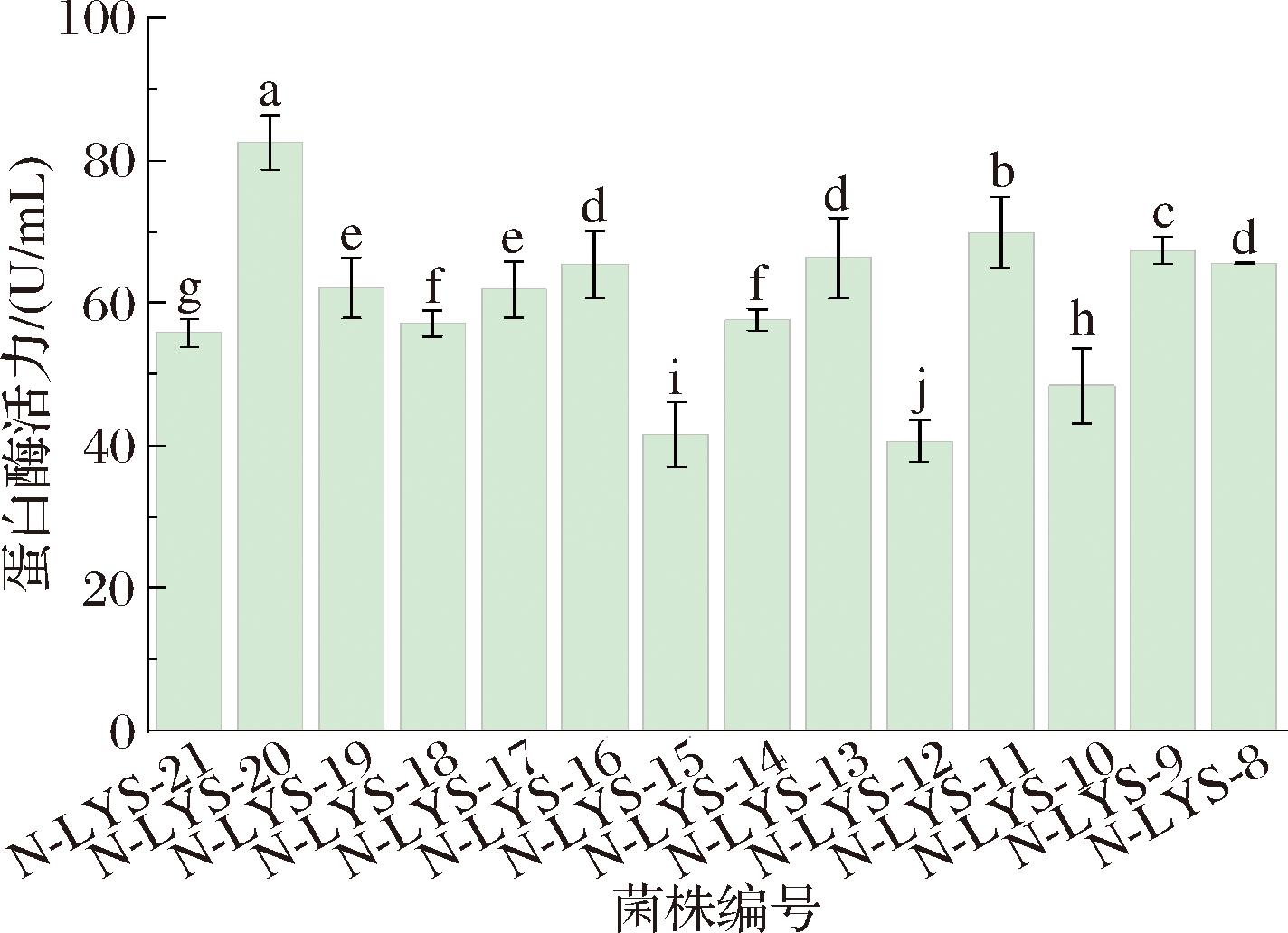
图2 14株产蛋白酶菌株的复筛结果
Fig.2 Re-screening results of 14 protease-producing strains
2.3 菌株的鉴定
2.3.1 生理生化鉴定
菌株N-LYS-20生理生化鉴定结果(表1)表明,菌株V-P试验、接触酶、MR甲基红以及硝酸盐还原为阳性,可以水解明胶,利用果糖、淀粉、D-甘露醇、蔗糖、阿拉伯糖和西蒙氏枸橼酸盐,但不可以利用乳糖、D-木糖、半乳糖、L-鼠李糖和丙二酸盐。同时,参照《伯杰氏细菌鉴定手册》[23]和《常用细菌系统鉴定手册》[24],初步判断菌株N-LYS-20可能为枯草芽孢杆菌。
表1 菌株的生理生化特性
Table 1 Physiological and biochemical properties of the strain
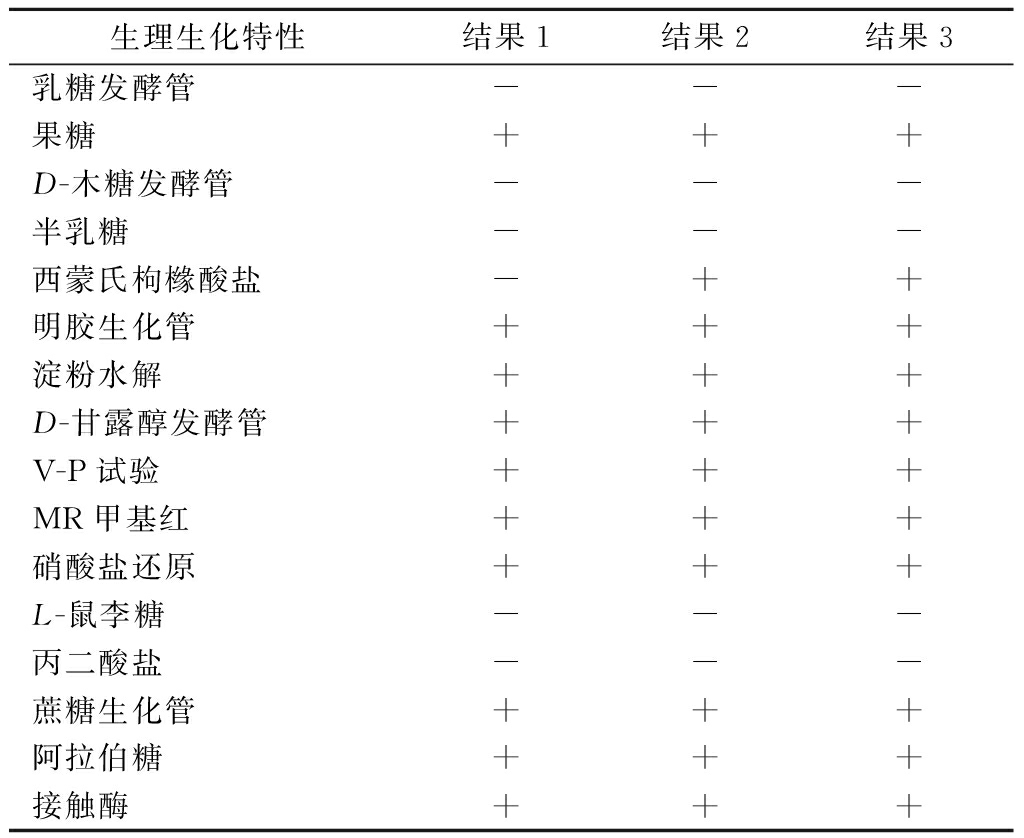
生理生化特性结果1结果2结果3乳糖发酵管---果糖+++D-木糖发酵管---半乳糖---西蒙氏枸橼酸盐-++明胶生化管+++淀粉水解+++D-甘露醇发酵管+++V-P试验+++MR甲基红+++硝酸盐还原+++L-鼠李糖---丙二酸盐---蔗糖生化管+++阿拉伯糖+++接触酶+++
注:“+”为阳性反应,“-”为阴性反应。
2.3.2 分子生物学鉴定
将菌株N-LYS-20的测序结果与已知菌株基因序列进行NCBI-BLAST比对分析,并使用MEGA 11软件构建系统发育树。结果显示菌株的16S rRNA基因序列与已知的菌株Bacillus subtilis strain SBMP4亲缘关系最接近,相似性为99%(图3)。结合生理生化特征和分子生物学结果以及参考已发表的文献,鉴定菌株N-LYS-20为枯草芽孢杆菌(Bacillus subtilis)[25-27]。

图3 菌株N-LYS-20系统发育树
Fig.3 Phylogenetic tree of strain N-LYS-20
2.4 菌株N-LYS-20的生长曲线与产酶曲线
由图4-a和图4-b可知,菌株在0~4 h生长较缓慢,位于生长延滞期,其蛋白酶活力非常低;4~14 h菌株生长速率最快,为对数生长期,其蛋白酶活力逐渐上升;14~48 h菌株生长速度逐渐减缓,趋于平稳,而在这个时间段的蛋白酶活力总体呈现上升趋势,表明了菌株的生长阶段与胞外蛋白酶的分泌有着直接的联系,处于延滞期的菌体,其胞外蛋白酶分泌少,而处于对数生长期的菌体代谢旺盛,因产酶能力更强,故选择14 h为种子液的培养时间。
由图4-b可知,菌株在0~4 h生长较缓慢因此蛋白酶活力最低,4~24 h蛋白酶活力逐渐升高,趋势与菌株生长情况相一致,与前人[28]研究一致;24 h之后菌株的酶活力极速上升至218.21 U/mL,在32 h后酶活力极速下降为150.00 U/mL,在36 h后酶活力上升至325.62 U/mL,在40 h又降为154.52 U/mL,极速上升可能由于细菌自身裂解,胞内的蛋白酶被释放到外界导致发酵液的酶活力极速升高;极速下降可能由于菌体浓度已达稳定值,可利用的营养物质贫瘠和代谢产物积累,酶被细菌视为营养物分解导致酶活力极速降低。总的来说,菌株N-LYS-20在对数生长期后期会大量分泌蛋白酶,在32 h(218.21 U/mL)和40 h(325.62 U/mL)的蛋白酶活力在48 h内达到最高,这为松子蛋白能更充分地被水解成小分子肽提供了前提条件,有望于提高松子肽的产量与质量。
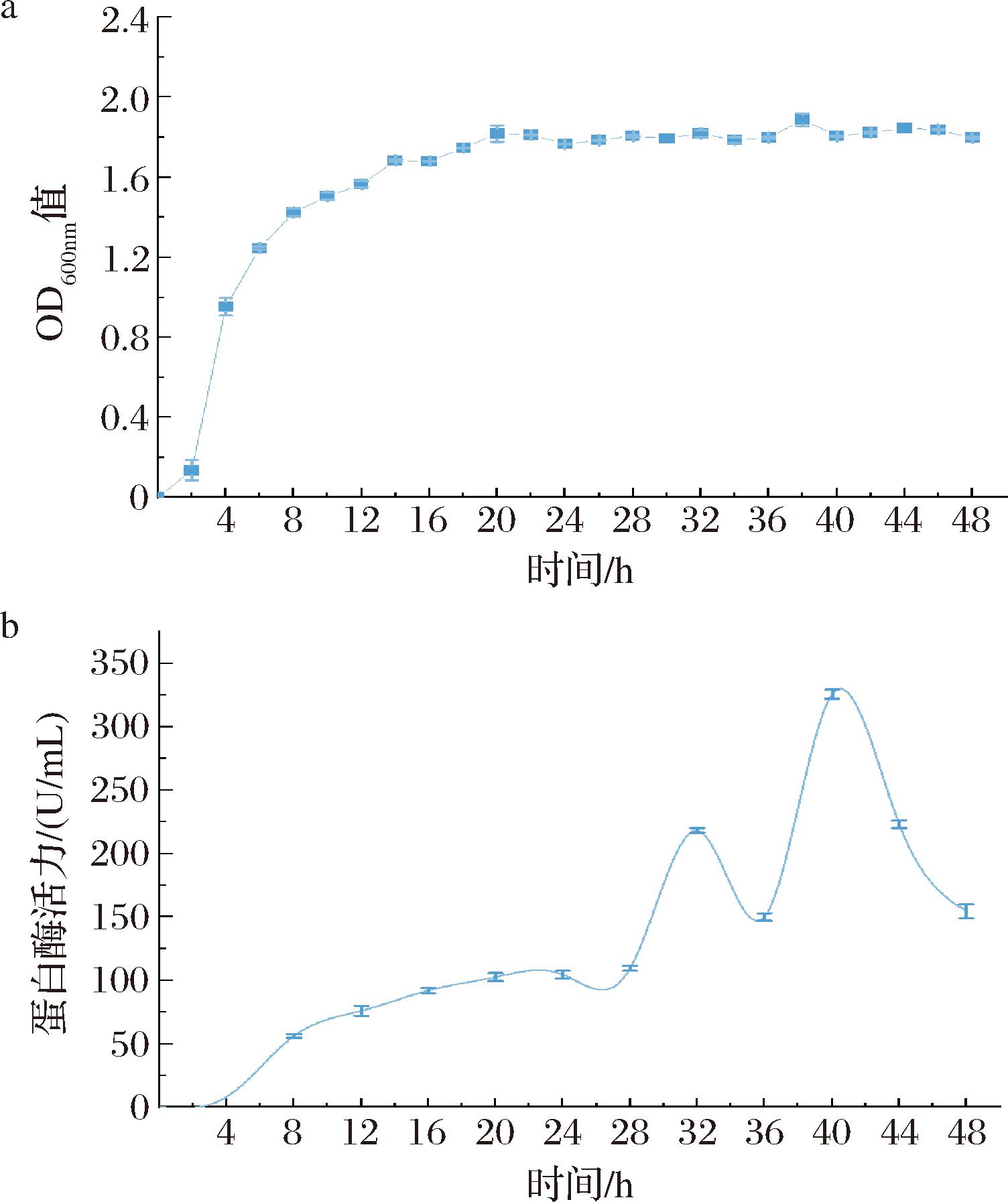
a-生长曲线;b-产酶曲线
图4 菌株N-LYS-20生长曲线与产酶曲线
Fig.4 Growth curve and enzyme production curve of strain N-LYS-20
2.5 菌株N-LYS-20的产酶类型
如图5所示,随着时间的延长,菌株N-LYS-20的蛋白酶活力被丝氨酸蛋白酶抑制剂和金属蛋白酶抑制剂的抑制程度明显递增,其被半胱氨酸蛋白酶抑制剂的抑制情况并不明显,这表明了菌株N-LYS-20主要分泌丝氨酸蛋白酶和金属蛋白酶。本研究菌N-LYS-20的主要产酶类型与KAWAMURA等[29]研究的枯草芽孢杆菌在指数生长末期时至少分泌2种类型的蛋白酶相一致。目前,不管在高产蛋白酶菌株的筛选还是在发酵制肽用菌的评价与选择的研究工作中,研究者对菌株的产酶类型研究较少,因此,可以在此研究工作中增加对菌株产酶类型的鉴定这一环节有利于制备新型活性肽,可有望提高活性肽的产量。
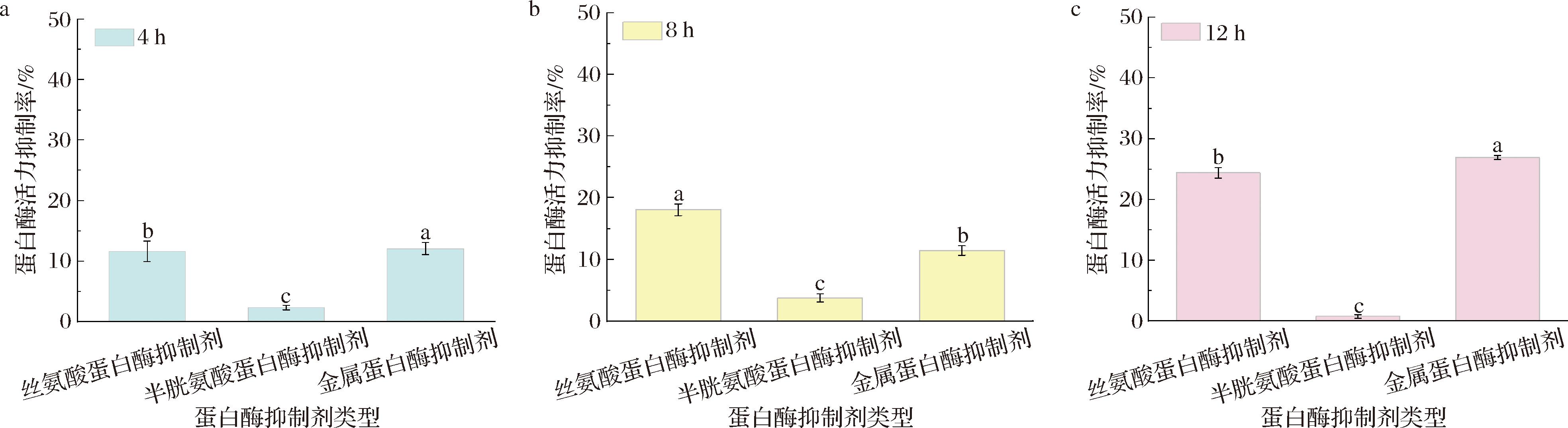
a-4 h蛋白酶活力的抑制率;b-8 h蛋白酶活力抑制率;c-12 h蛋白酶活力抑制率
图5 菌株N-LYS-20产酶类型
Fig.5 Enzyme production type of strain N-LYS-20
2.6 水解动力曲线
由图6可知,0~44 h的水解曲线与酶活力曲线趋势一致,但44 h后未出现下降趋势。随着发酵时间的延长,虽然菌株生长速度有所下降,但发酵液中仍存在大量的水解酶,同时衰老裂解的菌体释放出胞内的各种肽酶和营养物质,为菌株新一轮的生长繁殖提供了物质基础。此外,加上菌株可能通过自身防护机制抵御不良环境的影响,或环境条件尚未达到对其生存的胁迫阈值,这些因素共同促使菌株N-LYS-20的水解度总体呈现上升趋势。通过参考ZHANG等[30]、RAJENDHRAN等[31]和常通[32]发表的菌株的水解能力可知,本研究的菌株N-LYS-20的水解能力已达到文献报道的中上水平,在48 h的水解度为27.6%。以上表明了菌株N-LYS-20有良好的水解能力且能持续进行水解,更有望于将蛋白水解成更小的肽。
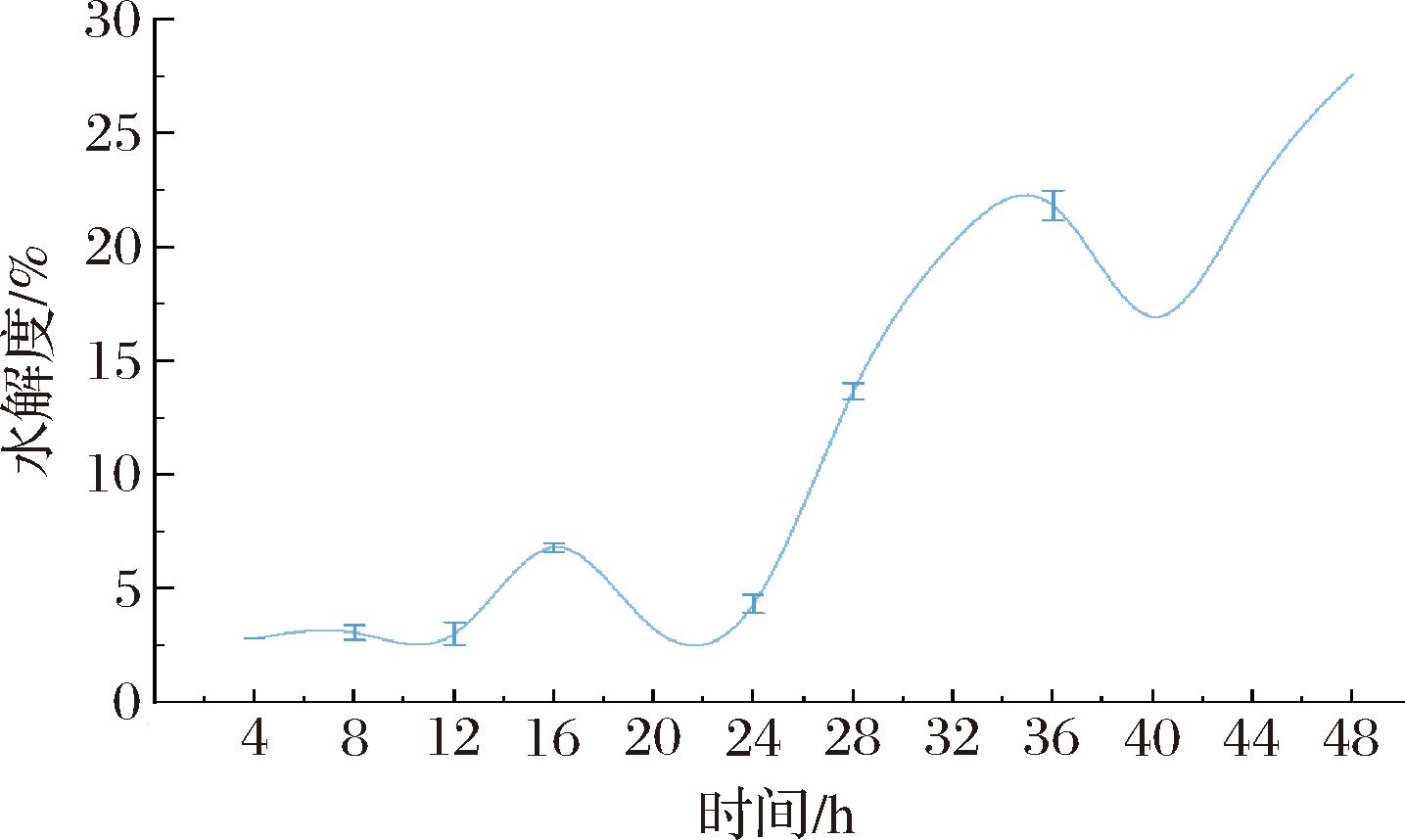
图6 菌株N-LYS-20发酵松子蛋白的水解动力曲线
Fig.6 Hydrolysis dynamics curves of pine nut protein fermented by strain N-LYS-20
2.7 发酵液中产肽情况和氨基酸含量的动态变化
如图7所示,松子多肽(>3 kDa)含量先持续上升后在28 h持续下降,而游离氨基酸含量总体呈现增长趋势并于24 h急剧上升。这说明在发酵过程中,菌株首先分泌肽链内切蛋白酶将松子蛋白水解成不同链长的肽和游离氨基酸后,其分泌外肽酶将不同链长的肽进一步水解成更小的肽(<3 kDa)和游离氨基酸,导致发酵液中多肽含量于4 h的622.26 mg/mL到28 h达到峰值1 456.23 mg/mL之后于48 h降为712.83 mg/mL,氨基酸含量从4 h的0.067 mg/mL于48 h上升为0.512 mg/mL。以上表明了本研究的菌株N-LYS-20能很好地将多肽水解成更小的肽和游离氨基酸,小肽更利于人体的吸收。
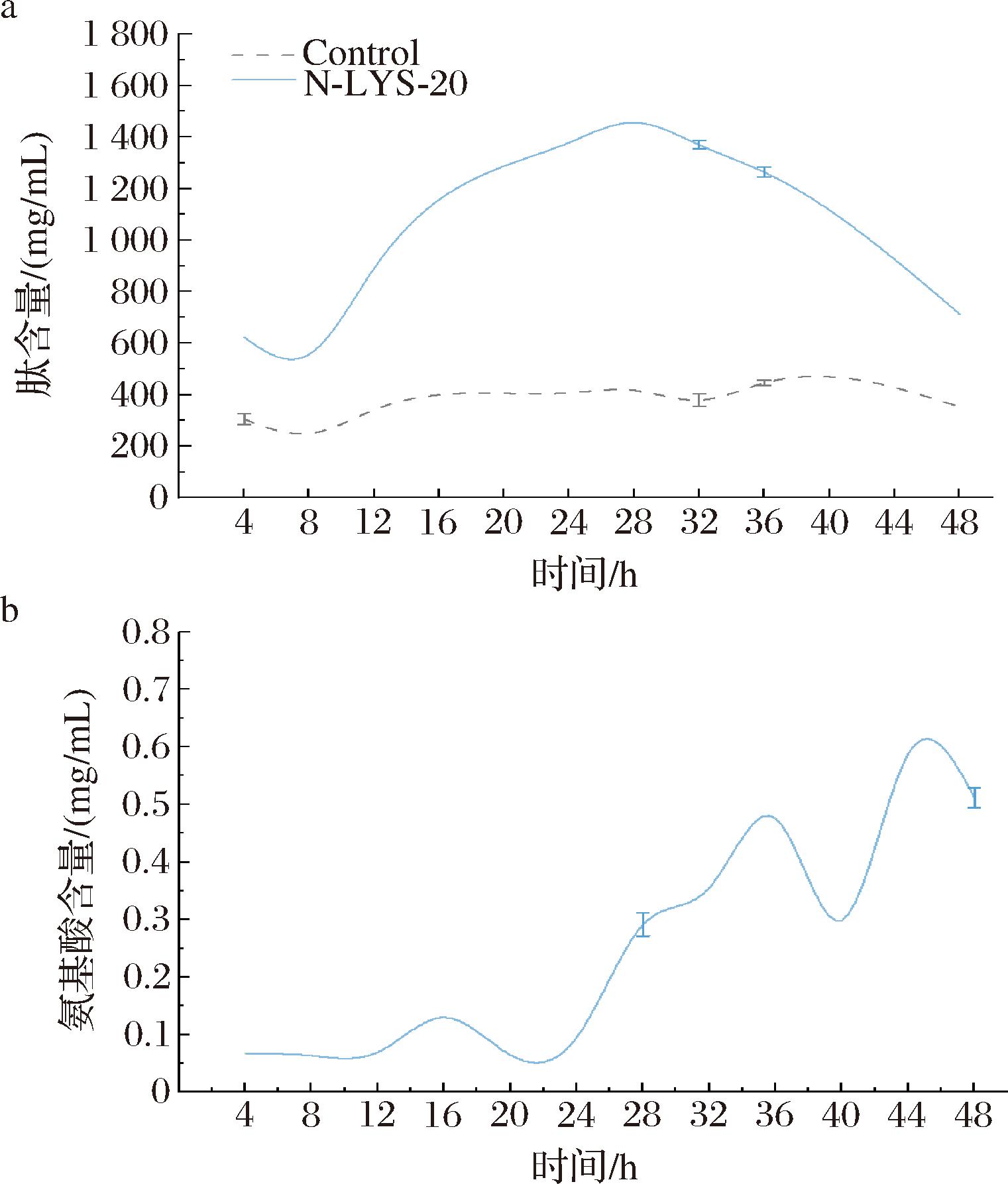
a-多肽含量;b-氨基酸含量
图7 发酵液的多肽浓度和游离氨基酸含量
Fig.7 Peptide concentration and free amino acid content of the fermentation broth
3 结论
本研究首先通过初筛与复筛从14菌株中筛出菌株N-LYS-20作为发酵菌并对其进行鉴定,为枯草芽孢杆菌;其次,对菌株N-LYS-20生长与产酶情况进行探究,结果表明菌株N-LYS-20在对数生长后期会大量分泌蛋白酶,32 h和40 h为大量分泌蛋白酶的2个时间点;接而,对菌株N-LYS-20的产酶类型和水解度进行探究,结果表明菌株N-LYS-20主要分泌丝氨酸蛋白酶和金属蛋白酶,并且有较强的持续水解能力;最后,对发酵液中的多肽与氨基酸含量进行探究,结果表明菌株N-LYS-20能很好地将松子蛋白水解成松子多肽(>3 kDa)后又将其水解为更小的松子肽(<3 kDa)和游离氨基酸。经以上研究,为微生物发酵松子蛋白制备松子肽的工艺相关研究提供发酵菌株产酶能力、产酶类型、水解效率、发酵过程中松子肽含量及氨基酸含量动态变化上的参考。未来的研究工作可考虑对发酵体系进行优化、水解产物的分离纯化及分析和松子肽的功能验证及应用等。
[1] DUCA F A, ZAVED WAISE T M, PEPPLER W T, et al.The metabolic impact of small intestinal nutrient sensing[J].Nature Communications, 2021, 12:903.
[2] 何帮林, 赵秀娟, 王洪荣.生物活性肽的功能和应用研究进展[J].中国饲料, 2022(24):12-16.HE B L, ZHAO X J, WANG H R.Research progress on the function and application of biologically active peptides[J].China Feed, 2022(24):12-16.
[3] XU Q B, HONG H, WU J P, et al.Bioavailability of bioactive peptides derived from food proteins across the intestinal epithelial membrane:A review[J].Trends in Food Science &Technology, 2019, 86:399-411.
[4] JE J Y, QIAN Z J, BYUN H G, et al.Purification and characterization of an antioxidant peptide obtained from tuna backbone protein by enzymatic hydrolysis[J].Process Biochemistry, 2007, 42(5):840-846.
[5] SALAMPESSY J, REDDY N, KAILASAPATHY K, et al.Functional and potential therapeutic ACE-inhibitory peptides derived from bromelain hydrolysis of trevally proteins[J].Journal of Functional Foods, 2015, 14:716-725.
[6] ULUG S K, JAHANDIDEH F, WU J P.Novel technologies for the production of bioactive peptides[J].Trends in Food Science &Technology, 2021, 108:27-39.
[7] DAI C H, MA H L, HE R H, et al.Improvement of nutritional value and bioactivity of soybean meal by solid-state fermentation with Bacillus subtilis[J].LWT, 2017, 86:1-7.
[8] SANJUKTA S, RAI A K, MUHAMMED A, et al.Enhancement of antioxidant properties of two soybean varieties of Sikkim Himalayan region by proteolytic Bacillus subtilis fermentation[J].Journal of Functional Foods, 2015, 14:650-658.
[9] SEO S H, CHO S J.Changes in allergenic and antinutritional protein profiles of soybean meal during solid-state fermentation with Bacillus subtilis[J].LWT, 2016, 70:208-212.
[10] GALLAND F, SANTOS DE ESPINDOLA J, LOPES D S, et al.Food-derived bioactive peptides:Mechanisms of action underlying inflammation and oxidative stress in the central nervous system[J].Food Chemistry Advances, 2022, 1:100087.
[11] HONISCH C, GAZZIERO M, DALLOCCHIO R, et al.Antamanide analogs as potential inhibitors of tyrosinase[J].International Journal of Molecular Sciences, 2022, 23(11):6240.
[12] FLEURY L, DERACINOIS B, DUGARDIN C, et al.In vivo and in vitro comparison of the DPP-IV inhibitory potential of food proteins from different origins after gastrointestinal digestion[J].International Journal of Molecular Sciences, 2022, 23(15):8365.
[13] 吴丹. 长白山松子蛋白质功能性质研究和降血压活性肽制备纯化及结构鉴定[D].长春:吉林农业大学, 2015.WU D.Study on functional properties of pine nut protein and preparation, purification and structure identification of antihypertensive active peptides[D].Changchun:Jilin Agricultural University, 2015.
[14] 张璐. 松子源活性肽制备及其抗氧化活性研究[D].天津:天津科技大学, 2019.ZHANG L.Preparation of active peptides derived from pine nuts and their antioxidant activity[D].Tianjin:Tianjin University of Science and Technology, 2019.
[15] 高岩磊. 松籽肽的制备工艺及生理活性研究[D].长春:吉林农业大学, 2021.GAO Y L.Preparation process and physiological activity of pine seed peptide[D].Changchun:Jilin Agricultural University, 2021.
[16] 杨可心. 松仁肽锌螯合物的制备及免疫功能研究[D].哈尔滨:东北林业大学, 2023.YANG K X.Preparation of zinc chelate of pine kernel peptide and immune function[D].Harbin:Northeast Forestry University, 2023.
[17] LIU X Q, MIAO X Y, WU D, et al.Purification and identification of ACE-inhibiting peptides from wild pine nut peptide fractions (PNPF)[J].European Food Research and Technology, 2018, 244(6):979-988.
[18] LU H Y, FANG L, WANG J, et al.Pine nut antioxidant peptides ameliorate the memory impairment in a scopolamine-induced mouse model via SIRT3-induced synaptic plasticity[J].Food &Function, 2021, 12(17):8026-8036.
[19] 孙家佳, 张智, 杨可心, 等.微生物法制备松仁肽-锌螯合物及其抗氧化功能的研究[J].中国粮油学报, 2020, 35(5):85-92.SUN J J, ZHANG Z, YANG K X, et al.The preparation of pine nut peptide zinc chelate by microbiological method and its antioxidant function[J].Journal of the Chinese Cereals and Oils Association, 2020, 35(5):85-92.
[20] SANJUKTA S, PADHI S, SARKAR P, et al.Production, characterization and molecular docking of antioxidant peptides from peptidome of kinema fermented with proteolytic Bacillus spp[J].Food Research International, 2021, 141:110161.
[21] CHAI K F, VOO A Y H, CHEN W N.Bioactive peptides from food fermentation:A comprehensive review of their sources, bioactivities, applications, and future development[J].Comprehensive Reviews in Food Science and Food Safety, 2020, 19(6):3825-3885.
[22] SUN J J, ZHANG Z, YANG K X, et al. In vitro antioxidant activity evaluation of pine nut peptides (Pinus koraiensis) fermented by Bacillus subtilis LS-45[J].Preparative Biochemistry &Biotechnology, 2024, 54(3):382-392.
[23] BUCHANAN R E, GIBBONS N E.Bergey's Manual of Systemaic Bacteriology[M].Beijing:Science Publishing House,1984.
[24] 东秀珠, 蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社, 2001.DONG X Z, CAI M Y.Manual for Identification of Common Bacterial Systems[M].Beijing:Science Press, 2001.
[25] 陈茏. 产蛋白酶菌株的筛选及酶学性质的研究[D].南昌:南昌大学, 2020.CHEN W.Screening of protease-producing strains and study of enzymatic properties[D].Nanchang:Nanchang University, 2020.
[26] 薛德星, 李美, 孙作文, 等.枯草芽孢杆菌KC1723的鉴定及生物学特征研究[J].山东农业科学, 2023, 55(9):154-158.XUE D X, LI M, SUN Z W, et al.Identification and biological characteristics of Bacillus subtilis KC1723[J].Shandong Agricultural Sciences, 2023, 55(9):154-158.
[27] 王晓玉, 张颖, 刘双, 等.枯草芽孢杆菌J530菌株的分离鉴定及其对鸡粪的氨减排作用[J].家畜生态学报, 2022, 43(1):47-53.WANG X Y, ZHANG Y, LIU S, et al.Isolation and identification of Bacillus strain J530 and ammonia emission reduction effect of it on chicken manure[J].Journal of Domestic Animal Ecology, 2022, 43(1):47-53.
[28] 贾仲昕. 高产蛋白酶芽孢杆菌菌株的筛选和关键酶基因的比较基因组学分析[D].保定:河北农业大学, 2022.JIA Z X.Screening of high-yielding protease-yielding Bacillus strains and comparative genomic analysis of key enzyme genes[D].Baoding:Hebei Agricultural University, 2022.
[29] KAWAMURA F, DOI R H.Construction of a Bacillus subtilis double mutant deficient in extracellular alkaline and neutral proteases[J].Journal of Bacteriology, 1984, 160(1):442-444.
[30] ZHANG Y W, ZHANG H, WANG L, et al.Influence of the degree of hydrolysis (DH) on antioxidant properties and radical-scavenging activities of peanut peptides prepared from fermented peanut meal[J].European Food Research and Technology, 2011, 232(6):941-950.
[31] RAJENDHRAN H P, VAIDYANATHAN V K, VENKATRAMAN S, et al.Optimization of enzymatic hydrolysis by protease produced from Bacillus subtilis MTCC 2423 to improve the functional properties of wheat gluten hydrolysates[J].International Journal of Food Science, 2024, 2024:5053510.
[32] 常通. 棉籽蛋白发酵制备ACE抑制肽[D].南昌:南昌大学, 2011.CHANG T.Preparation of ACE inhibitory peptide by fermentation of cottonseed protein[D].Nanchang:Nanchang University, 2011.