甲壳素又称甲壳质、几丁质,是由N-乙酰氨基-D-葡萄糖单体通过β-1,4糖苷键连接而成的直链高分子化合物,广泛存在于虾、蟹、贝类等甲壳类动物骨骼中[1],为自然界中唯一带正电荷的阳离子动物多糖,其产量仅次于纤维素[2]。甲壳素根据其晶体区域内链的排列方式被分为α-甲壳素、β-甲壳素和γ-甲壳素,其中α-甲壳素最丰富和稳定、也是工业中最具有应用潜力的结构形式[3],不仅具有良好的生物降解性和生物兼容性,还具有消炎镇痛、杀菌、抗氧化[4]等生物功能,在食品、农业、医用支架、药物递送等领域具有广泛的应用价值[5-6]。
甲壳素的制备方法包括化学法、发酵法、酶法等[7]。传统的化学法制备需要利用酸碱法脱除蛋白、矿物质、色素及其他杂质,不仅会导致其脱乙酰化和水解从而造成终端产品结构和生理特性的差异[8-9],且蛋白质、虾青素等成分无法回收,所产生的大量废液还会造成严重的环境污染[10]。相反,发酵法制备可通过产乳酸或产蛋白酶的微生物脱除虾蟹壳等废弃物中的矿物质和蛋白质。工艺不仅操作简单、成本低、而且提取甲壳素剩余的发酵液中含有大量蛋白质、糖及其他功能物质,还可以成为制备食品、多糖等的原料来源,市场应用前景极其广阔。
目前用于发酵法制备甲壳素的微生物菌株主要为乳杆菌、蜡状芽孢杆菌、枯草芽孢杆菌等[11-13]。GHORBEL-BELLAAJ等[14]利用铜绿假单胞菌A2(Pseudomonas aeruginosa A2)来提取虾壳中甲壳素,在最佳发酵条件下,蛋白质去除率约为89%。XIE等[15]先接种附生嗜酸乳杆菌(Lactobacillus acidophilus)再接种深部外生杆菌(Exiguobacterium profundum)对虾壳进行发酵处理,最终实现85.9%的脱蛋白率。然而,目前尚未见报道苏云金芽孢杆菌用于发酵制备甲壳素的相关研究。本研究从自然发酵的小龙虾壳中分离高产蛋白酶的苏云金芽孢杆菌(Bacillus thuringiensis)LX-W4,同时利用该菌株与屎肠球菌(Enterococcus faecalis)LX18-9协同发酵,通过优化发酵工艺参数,研究LX-W4菌株发酵条件对小龙虾壳脱蛋白的影响,探索一种更高效、低污染的甲壳素制备工艺,为小龙虾壳的资源化利用提供技术支撑。
1 材料与方法
1.1 材料与试剂
小龙虾壳,洪泽湖渔夫养殖中心;屎肠球菌LX18-9,本实验室保存;胰酪大豆胨琼脂培养基(tryptose soya agar,TSA),青岛海博科技有限公司;偶氮酪蛋白,美国Sigma公司;脱脂奶粉,南京森贝加生物技术有限公司;DNA提取试剂盒、酪蛋白,上海索莱宝生物科技有限公司;其他试剂均为分析纯,由国药集团化学试剂有限公司提供。
1.2 仪器与设备
ME104E电子天平、FE28 pH计,梅特勒托利多科技(中国)有限公司;HX-300A万能粉碎机,江苏费尔曼科技有限公司;RE-3000旋转蒸发器,上海亚荣生化仪器厂;UV-1800PC-DS2紫外分光光度计,上海美普达仪器有限公司;HZQ-F100恒温振荡培养箱、SW-CJ-2F超净工作台,苏州净化科技有限公司;TGL-16M 高速冷冻离心机,湖南湘仪科技有限公司;LDZM-80L-I高压蒸汽灭菌锅,上海申安医疗器械有限公司;E-poch酶标仪,美国Bio-Tek公司;IX53光学显微镜,奥林巴斯(北京)科技有限公司。
1.3 实验方法
1.3.1 产蛋白酶菌株的筛选
将小龙虾壳用水清洗干净,去肉留虾壳和虾头,破壁机搅碎,室温自然发酵3 d,用生理盐水稀释,通过平板涂布法涂布于TSA培养基,37 ℃培养24 h,随机挑选形态不同的单菌落点接于添加2%(质量分数)脱脂奶粉的TSA培养基中,选取产透明圈的菌株进行划线纯化。将纯化4次以上的菌株接入TSA液体培养基,37 ℃、180 r/min摇床培养24 h备用。
1.3.2 菌株鉴定
1.3.2.1 生理生化指标检测
参照《常见细菌系统鉴定手册》[16],对分离到纯化后具有产蛋白酶活性的菌株进行生理生化特征测定。
1.3.2.2 16S rDNA序列分析
用DNA提取试剂盒提取总DNA,PCR产物的纯化和测序交由北京擎科生物科技有限公司完成。测序结果在NCBI官网进行比对,用MEGA 11.0软件将原序列与数据库序列比对并绘制系统发育树。
1.3.3 生长曲线测定
将产蛋白酶菌株按2%(体积分数)的接种量接入胰蛋白胨大豆肉汤(trypticase soy broth,TSB)培养基中,37 ℃、120 r/min振荡培养24 h,每4 h测定OD600nm处的吸光度值,以发酵时间为横坐标,OD600nm值为纵坐标绘制生长曲线。
1.3.4 产酶能力测定
采用偶氮酪蛋白法,参考BEZERRA等[17]的方法进行测定。挑取一环斜面保存的菌种接种到TSB液体培养基中,37 ℃下120 r/min振荡培养24 h,取发酵液1 mL,4 ℃下10 000 r/min离心10 min,取上清液(粗酶液)检测蛋白酶活力。酶活力单位定义:37 ℃恒温条件下,1 min产生0.001个吸光值的酶量定义为1个酶活力单位。
1.3.5 甲壳素的制备
1.3.5.1 连续发酵法制备甲壳素
小龙虾去掉可食用部分,收集虾壳,清洗掉残余的虾肉,破碎机搅碎后在烘箱中60 ℃烘干,过60目网筛,将虾壳粉与水按比例混合,加入3%(质量分数)葡萄糖作为外源碳源,调节pH值为6,接种5%(体积分数)的LX-W4菌液,40 ℃恒温发酵4 d,再接种5%(体积分数)的屎肠球菌LX 18-9于35 ℃下发酵4 d,发酵结束后过滤、沉淀物用去离子水漂洗至中性,于60 ℃下干燥至恒重,得到的甲壳素备用。
1.3.5.2 化学法制备甲壳素
取60目虾壳粉20 g于烧杯,边搅拌边缓慢加入1 mol/L盐酸,当pH值下降至1.0左右时过滤洗涤,再向滤渣中加入2.0 mol/L NaOH溶液,于70 ℃下反应4 h,过滤洗涤至中性后,5 000 r/min离心10 min,60 ℃下干燥8 h,即得甲壳素。
1.3.6 LX-W4菌株发酵小龙虾壳脱蛋白工艺优化
将虾壳粉与水混合,加入3%葡萄糖作为外源碳源,固定菌株接种量为5%,发酵温度为40 ℃,以蛋白酶活力和脱蛋白率为指标,分别考察初始pH值(4.0、5.0、6.0、7.0、8.0)、发酵温度(25、30、35、40、45 ℃)、虾壳粉添加量(3%、6%、9%、12%、15%,质量分数)、发酵时间(1、2、3、4、5、6 d)对菌株产酶能力和脱蛋白率的影响,确定适宜发酵条件。蛋白质含量利用Bradford法[18]进行测定,按照公式(1)计算脱蛋白率:
脱蛋白率![]()
(1)
式中:MF,发酵后虾壳残留的质量,g;PF,发酵残留物中的蛋白质质量,g;M0,原始样品的质量,g;P0,原始样品中的蛋白质质量,g。
1.3.7 甲壳素的表征
1.3.7.1 扫描电镜观察
分别取发酵法制备的甲壳素和化学法制备的甲壳素微量,喷金处理30 s,放气后打开样品室,用导电胶将样品固定在载物台上,抽真空后观察表面形态。
1.3.7.2 傅里叶变换红外分析
取10 mg甲壳素样品与500 mg溴化钾,混匀充分研磨,然后在22~30 MPa下压成透明薄片,在400~4 000 cm-1范围内进行红外光谱扫描[19]。利用波数1 655、3 450 cm-1处的吸光度,根据公式(2)计算脱乙酰度[20]:
脱乙酰度![]()
(2)
式中:A1 655,波数为1 655 cm-1处的吸光度;A3 450,波数为3 450 cm-1处的吸光度。
1.3.7.3 X射线衍射分析
根据MIRANDA等[18]的方法,取100 mg甲壳素样品,研磨至状态均匀,过100目筛,烘干后放入玻片槽,用另一块玻片轻压使表面光滑,将样品放入载样台,使用X射线衍射仪测定甲壳素晶型结构。测试条件设置为:40 kV,40 mA,2θ角收集范围为5°~70°,扫描速率为4.8°/min。结晶度指数通过公式(3)计算:
结晶度指数![]()
(3)
式中:I110,(110)平面在2θ≈20°时的衍射峰强度最大值,a.u.;Iam,2θ≈12~14°时非晶衍射的强度最大值,a.u.。
1.4 数据处理
所有试验均重复3次,实验结果用“平均值±标准差(n=3)”表示,采用SPSS软件对试验结果进行统计分析,P<0.05为显著性差异,图中不同小写字母表示显著性差异。
2 结果与分析
2.1 数据处理
由表1可知,从自然发酵小龙虾壳中分离到5株产蛋白酶菌株,即LX-W4、LX-W5、LX-W6、LX18-8、LX18-9。LX-W4菌株在脱脂乳粉培养基上的水解透明圈直径与菌落直径比值(D/d值)为2.23±0.12,显著高于其他菌株(P<0.05),表明该菌株的产酶能力最强。进一步检测各菌株发酵液的蛋白酶活力,由图1可知,LX-W4菌株产蛋白酶活力为12.33 U/mL,显著高于其他菌株产酶能力(P<0.05)。综合考虑,确定LX-W4菌株为高产蛋白酶菌株,用于后续研究。
表1 产蛋白酶菌菌落与透明圈直径比值
Table 1 Changes in the diameter ratio of protease-producing bacteria colony to transparent circle
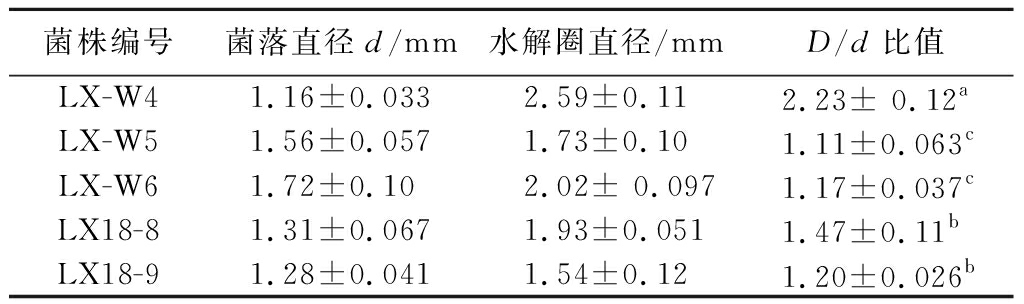
菌株编号菌落直径d/mm水解圈直径/mmD/d比值LX-W41.16±0.0332.59±0.112.23± 0.12aLX-W51.56±0.0571.73±0.101.11±0.063cLX-W61.72±0.102.02± 0.0971.17±0.037cLX18-81.31±0.0671.93±0.0511.47±0.11bLX18-91.28±0.0411.54±0.121.20±0.026b
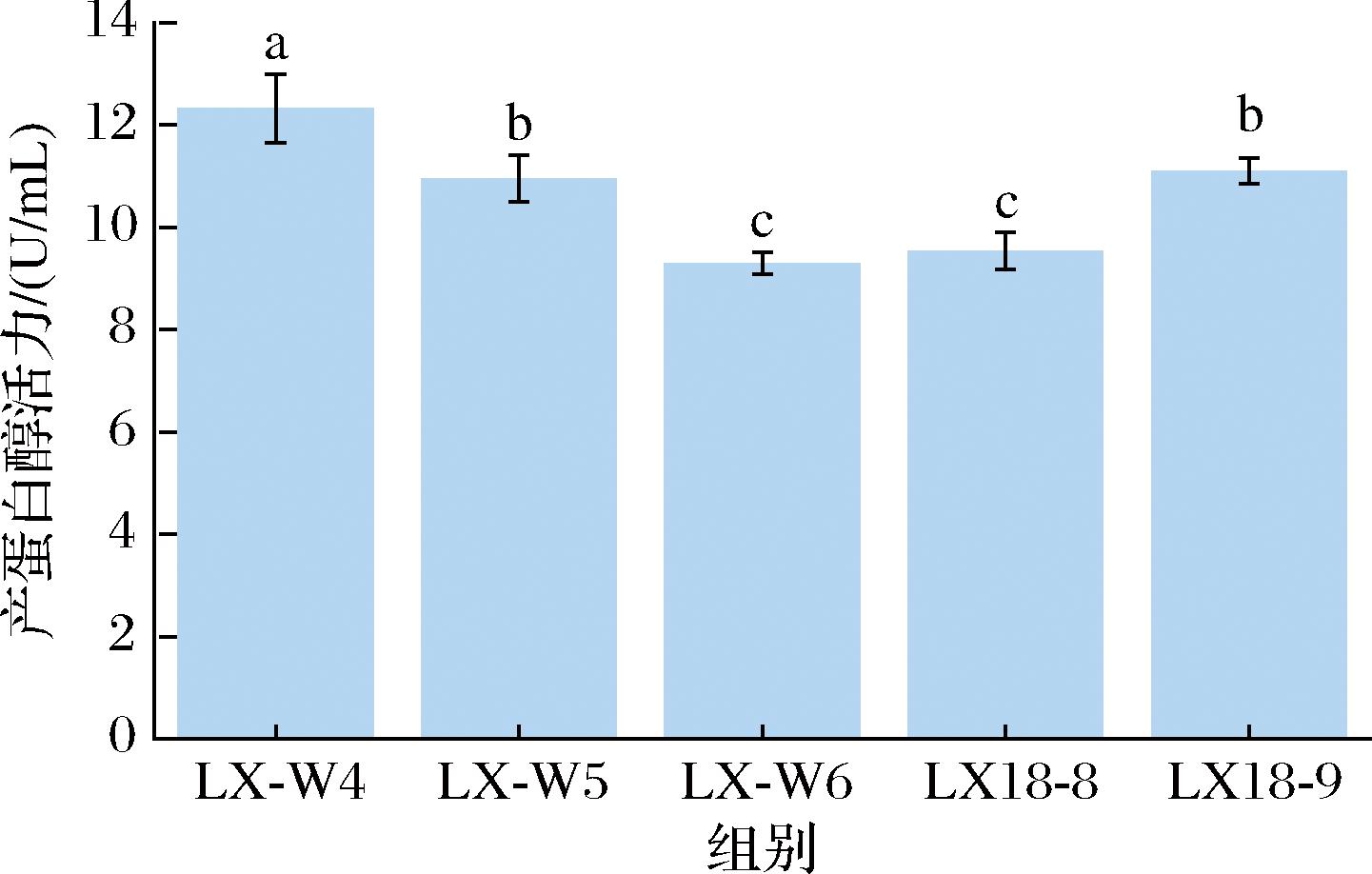
图1 不同菌株产酶活力
Fig.1 Enzyme production capacity of various bacteria
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.2 菌株鉴定
2.2.1 形态特征及生理生化鉴定
LX-W4菌株在培养基上呈圆形、奶油色,不透明,且边缘粗糙。对LX-W4菌株进行生理生化鉴定及碳源利用试验,结果如表2所示。对照《常见细菌系统鉴定手册》,确定LX-W4菌株为芽孢杆菌属。该菌株能利用葡萄糖、果糖、乳糖等单糖以及双糖、淀粉、糖醇等,革兰氏染色阳性、呈椭圆形杆状。
表2 理化特征及碳源利用情况
Table 2 Physicochemical characteristics and carbon source utilization ability of strain
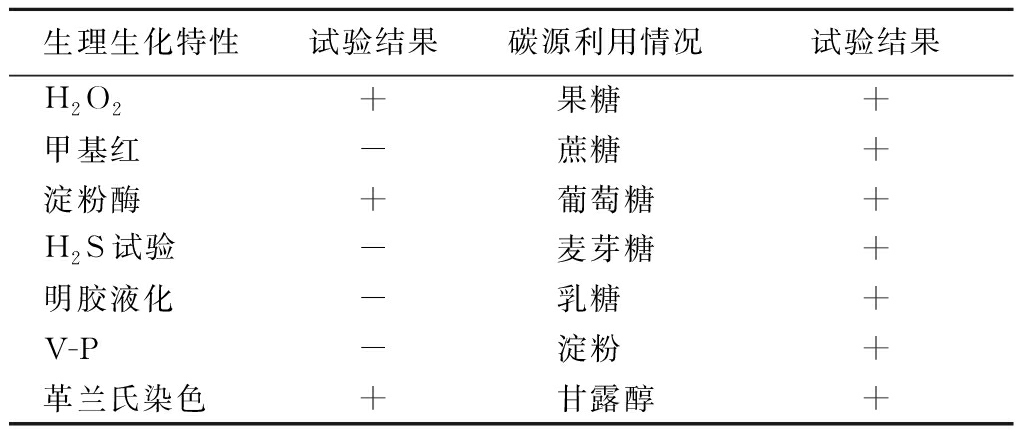
生理生化特性试验结果碳源利用情况试验结果H2O2+果糖 +甲基红-蔗糖 +淀粉酶+葡萄糖+H2S试验-麦芽糖+明胶液化-乳糖 +V-P-淀粉 +革兰氏染色+甘露醇+
注:表中“+”表示阳性,“-”表示阴性。
2.2.2 分子生物学鉴定
提取菌株的DNA并进行PCR扩增,由图2可知,LX-W4菌株PCR扩增产物大小为1 500 bp左右,条带清晰,纯度较高,可用于菌株分子学鉴定。将16S rDNA基因序列结果在NCBI数据库进行BLAST比对,用MEGA 11软件采用邻近法绘制菌株的发育树,由图3可知,菌株与苏云金芽孢杆菌的同源性为99%,结合菌落形态和生理生化特征检测结果,可确定该菌株为苏云金芽孢杆菌,命名为苏云金芽孢杆菌LX-W4。杨静等[21]报道,从郫县豆瓣中分离出的苏云金芽孢杆菌IX-01、BT-IX17菌株不仅安全无毒、还能分泌多糖、且具有较强的体外益生活性,预示着本研究分离所得苏云金芽孢杆菌LX-W4具有应用于食品工业的潜力。

图2 琼脂糖凝胶电泳结果
Fig.2 Results of agarose gel electrophoresis
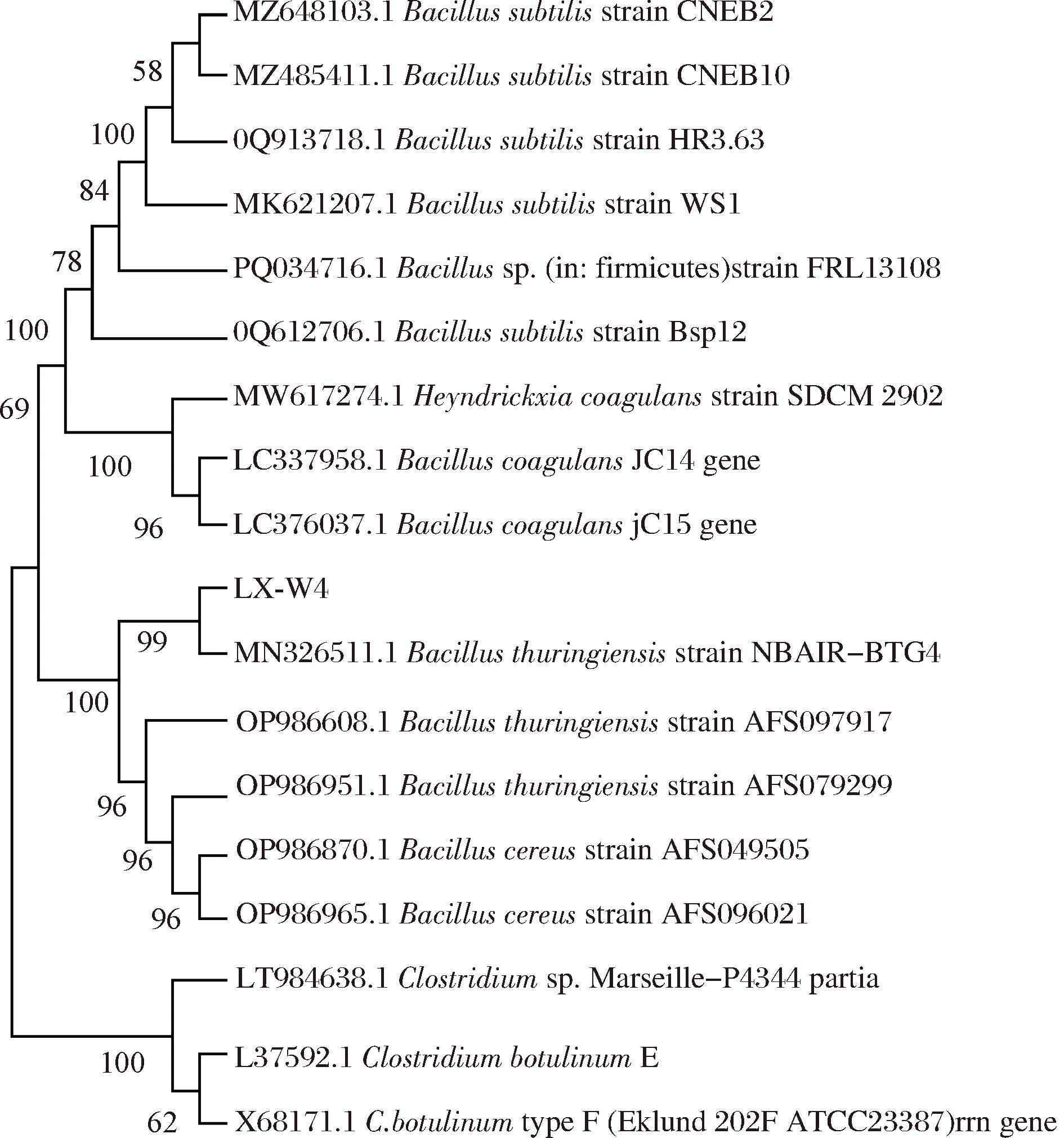
图3 16S rDNA测序基因发育树
Fig.3 16S rDNA sequencing gene development tree
2.3 LX-W4菌株生长曲线
测定菌株生长曲线,如图4所示,LX-W4菌株在0~4 h内生长缓慢,4~16 h开始进入对数生长期,16 h后逐渐进入生长稳定期,此时菌株生命力最旺盛,菌株的产酶活力与培养24 h的菌株相比无差异,因此确定用于甲壳素制备的LX-W4菌株发酵剂的最佳培养时间为16 h。
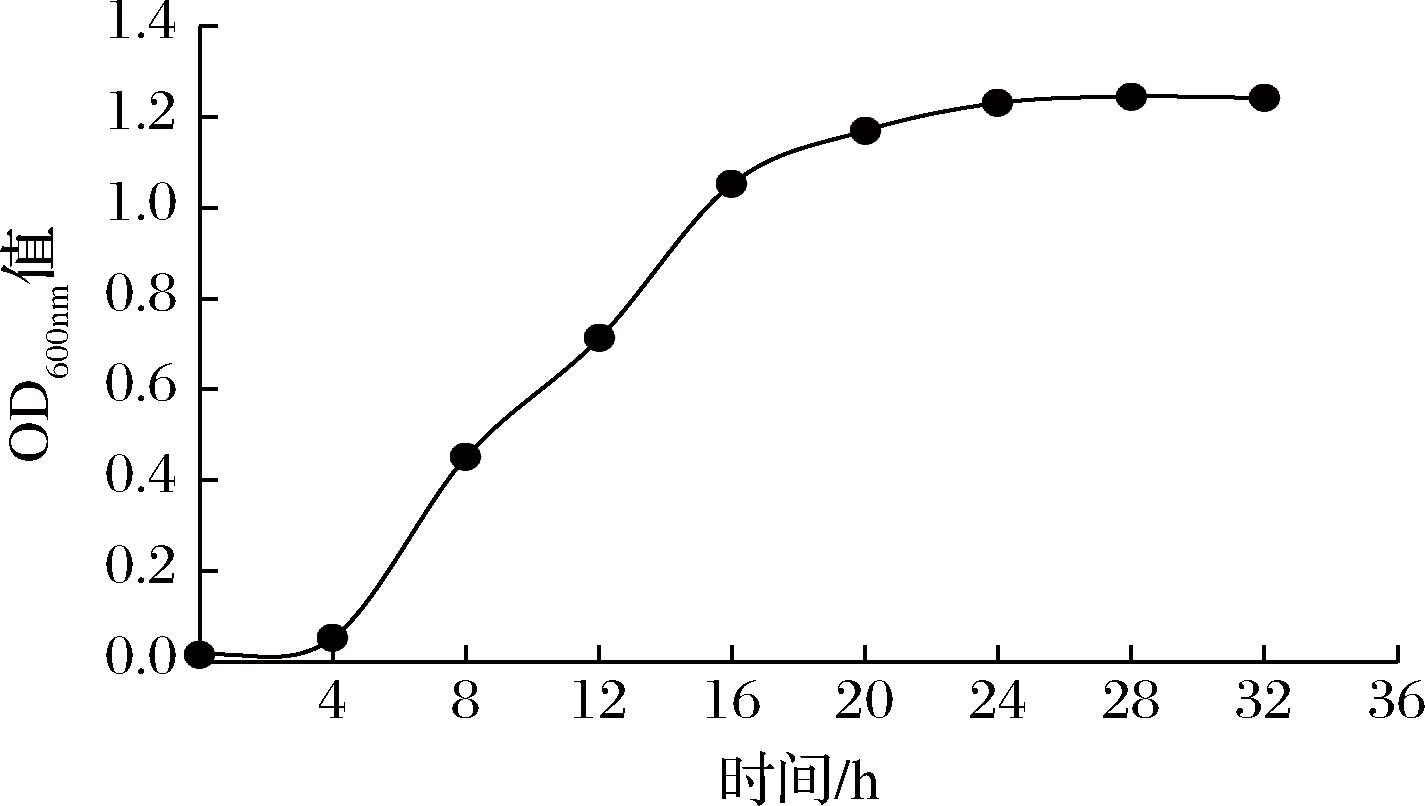
图4 LX-W4菌株生长曲线
Fig.4 The growth curve of LX-W4 strain
2.4 发酵条件的筛选
2.4.1 初始发酵pH的确定
由图5可知,所设初始pH范围内,LX-W4菌株蛋白酶活力呈现先上升后下降的趋势。当初始pH值为6时,酶活力达到最高,为78.25 U/mL,此时脱蛋白率最高,为87.59%;pH值大于6之后,酶活力迅速下降,脱蛋白率也随着降低。这是由于较高pH影响到菌株的生长繁殖,致使菌株产酶能力降低,从而降低了其脱蛋白效果。因此选择pH 6为适宜的发酵初始pH值。
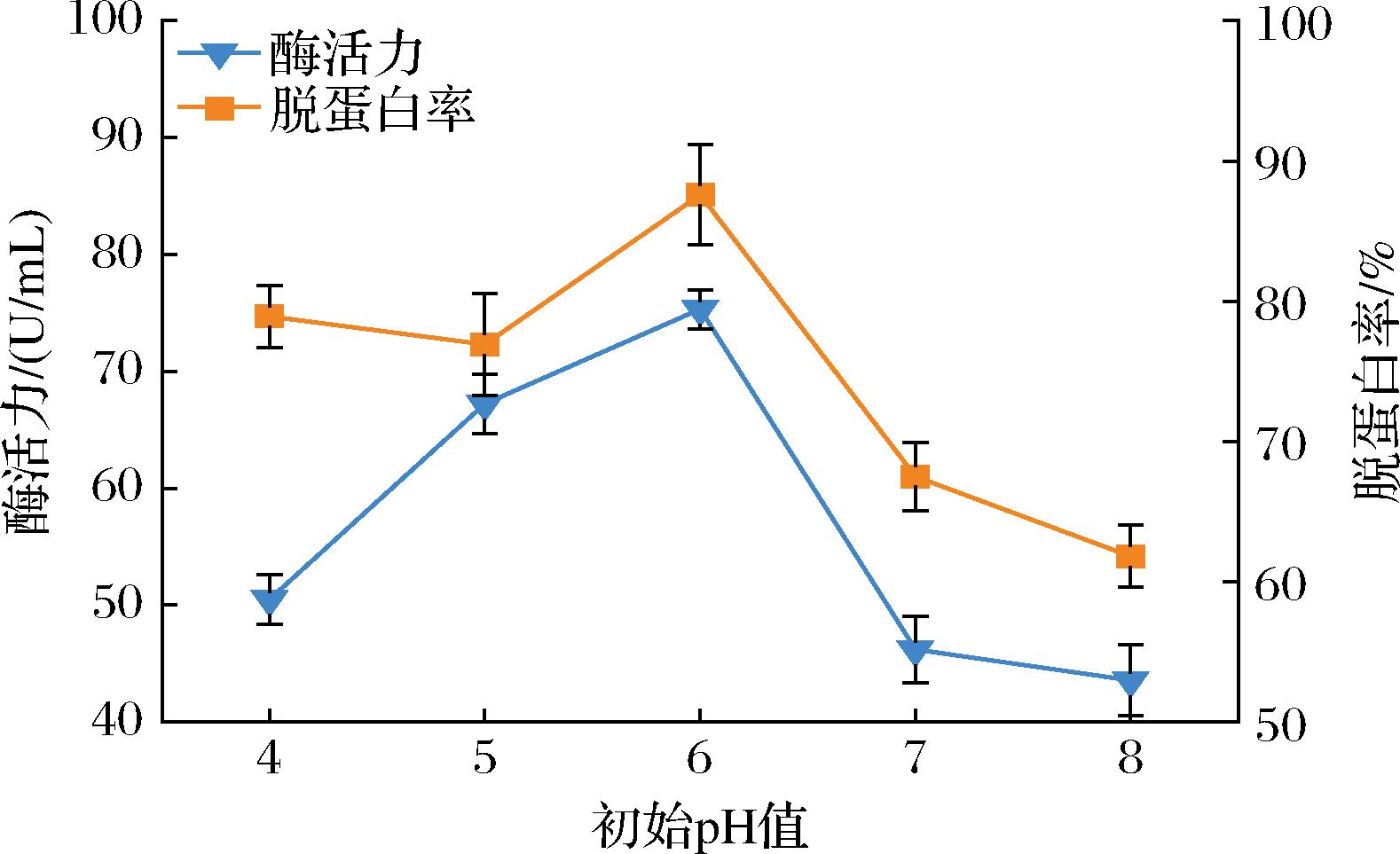
图5 不同发酵初始pH对蛋白酶活力和脱蛋白率的影响
Fig.5 The effect of different initial pH of fermentation on protease activity and deproteinization rate
2.4.2 发酵温度
由图6可知,LX-W4菌株蛋白酶活力和脱蛋白率随发酵温度的升高呈现先上升后下降的趋势。当发酵温度为40 ℃时,酶活力及其对小龙虾壳的脱蛋白率均达到最高,分别为85.32 U/mL,88.14%;超过40 ℃后,酶活力和脱蛋白率迅速降低。温度在40 ℃时,酶活力达到最大值,此温度下,菌株的代谢活动和酶分泌能力处于最佳状态,因此酶活力达到峰值。同时,这也可能表明单位细胞的产酶水平较高,因为适宜的温度能够促进菌株的蛋白分泌系统和酶合成相关酶系的活性[22]。然而,在温度高于40 ℃时,酶活力显著下降,推测这可能与菌体总量减少或单位细胞产酶水平下降有关。因此40 ℃为LX-W4菌株适宜的发酵温度。
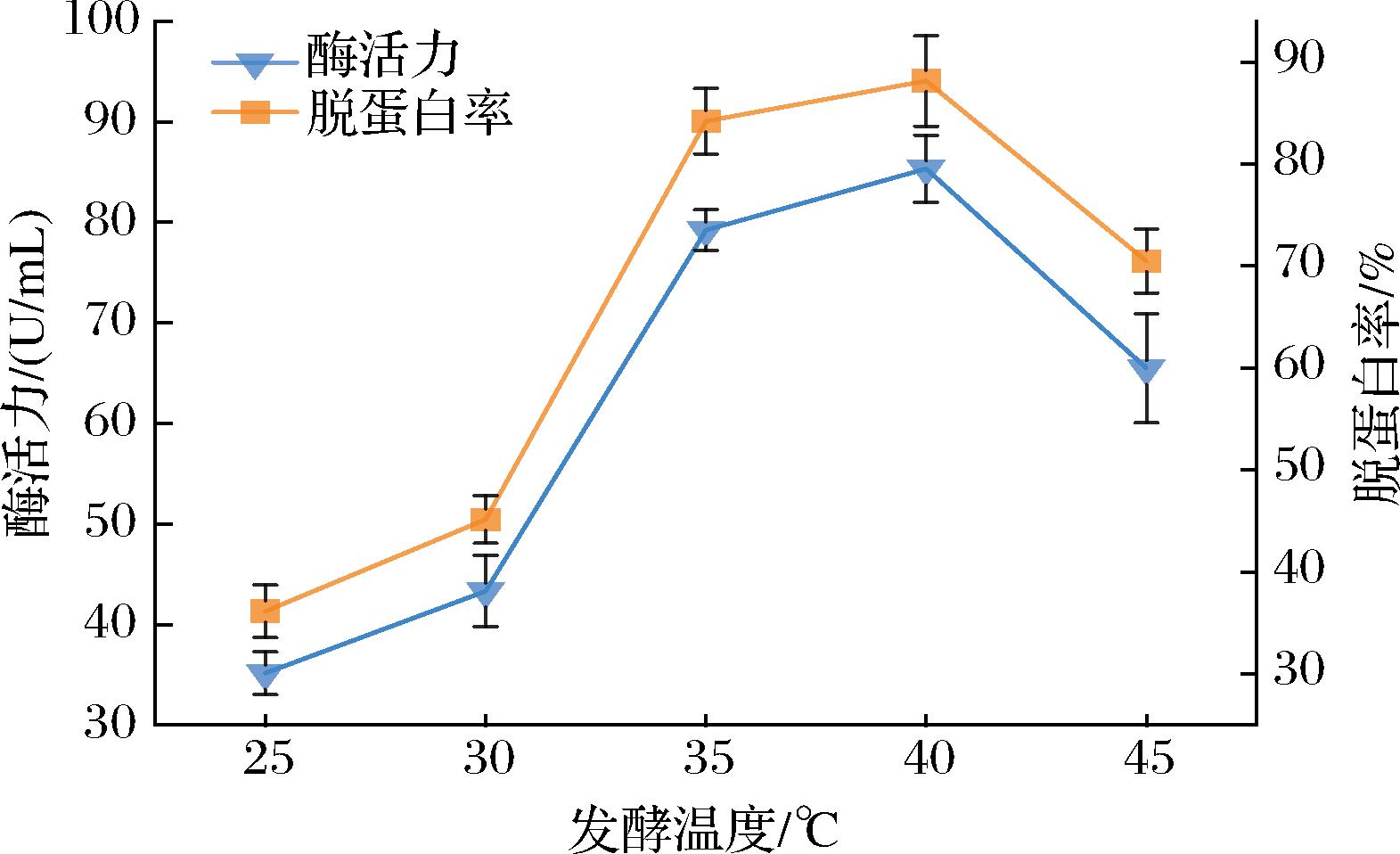
图6 不同发酵温度对蛋白酶活力和脱蛋白率的影响
Fig.6 The effect of different fermentation temperature on protease activity and deproteinization rate of shrimp shell
2.4.3 最佳龙虾壳添加量的确定
由图7可知,小龙虾壳粉添加量为3%~6%,LX-W4菌株的蛋白酶活力基本恒定,对龙虾壳的脱蛋白率为82.86%~78.26%;当虾壳粉添加量大于6%之后,菌株产酶能力随着虾壳粉添加量的增加而快速下降,导致其对龙虾壳蛋白质的脱除率也随着下降,因此确定6%的龙虾壳添加量为LX-W4菌株发酵的最适龙虾壳添加量。
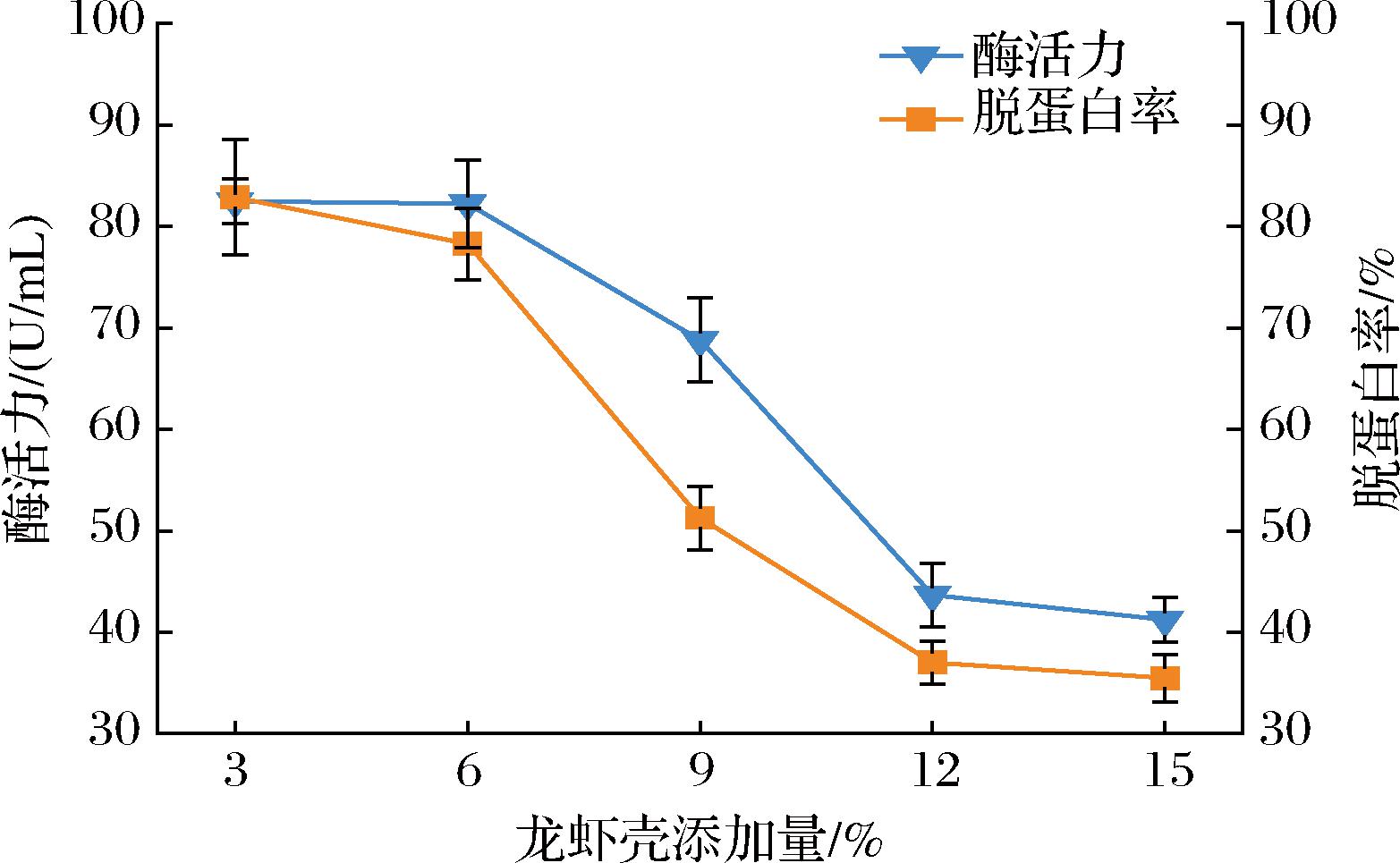
图7 不同虾壳添加量对蛋白酶活力和脱蛋白率的影响
Fig.7 The effect of different addition amount of crayfish shell on protease activity and deproteinization rate
2.4.4 最佳发酵时间的确定
由图8可知,随着发酵时间的延长发酵液的酶活力上升,到第4天达到最大值86.02 U/mL,其脱蛋白率高达95.21%,随后LX-W4菌株的蛋白酶活力及其对龙虾壳蛋白质脱除率呈现下降趋势。这可能是由于菌株进入发酵后期,活菌数减少,导致其分泌蛋白酶的能力随之下降,从而导致了龙虾壳脱蛋白率的降低。因此确定最佳发酵时间为4 d。
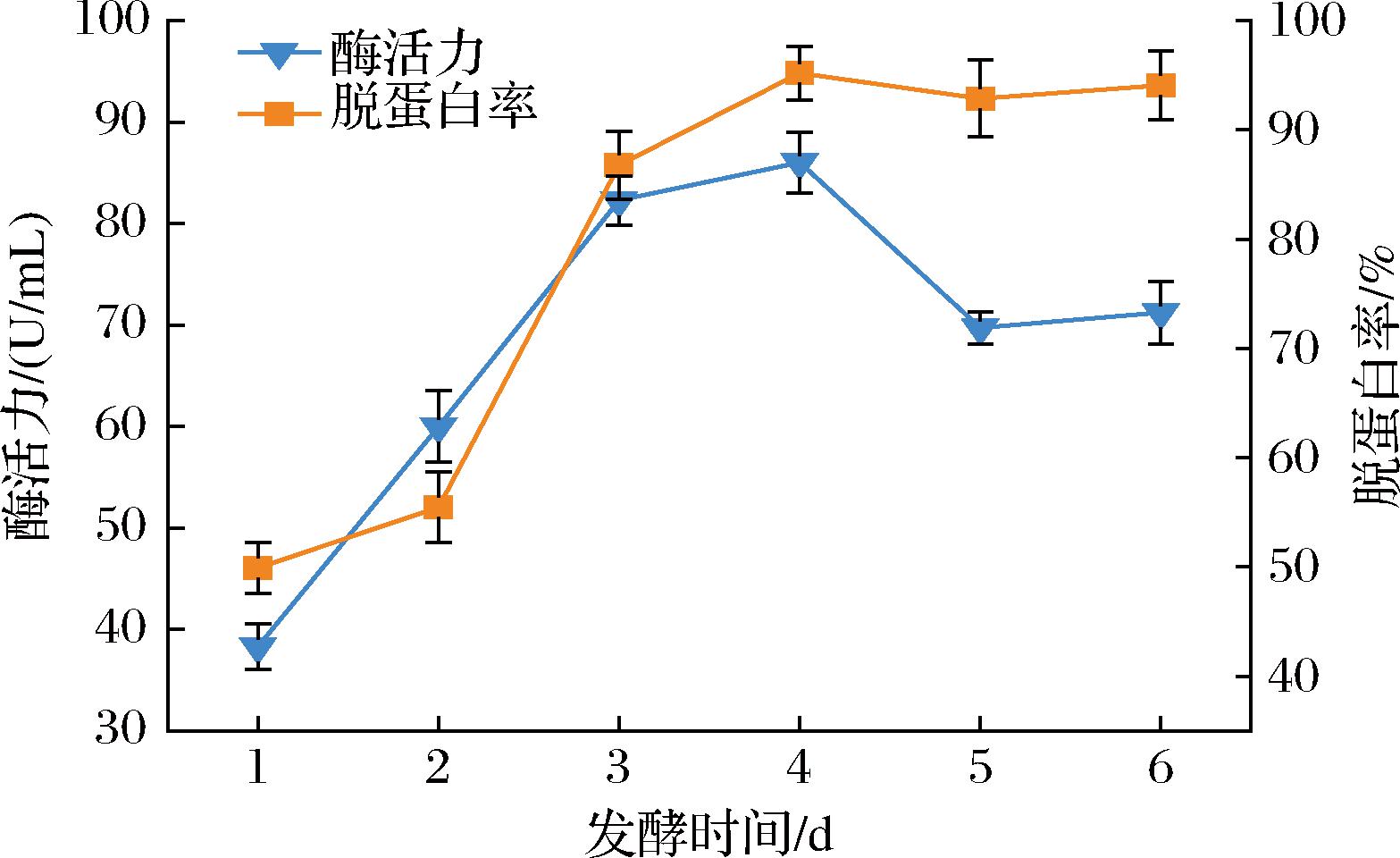
图8 不同发酵时间对蛋白酶活力和脱蛋白率的影响
Fig.8 The effect of different fermentation time on protease activity and deproteinization rate of shrimp shell
2.5 甲壳素结构分析
2.5.1 扫描电镜观察结果
以小龙虾壳粉和化学提取法制备的甲壳素为对照,通过扫描电镜观察发酵法制备的甲壳素的微观特征。由图9可知,虾壳粉(图9-c)表面粗糙,杂质较多,电镜观察到许多嵌入到内部的块状结构,主要成分为无机盐如碳酸钙、碳酸镁,蛋白质等。与虾壳粉相比,发酵法制备的甲壳素(图9-a)表面变得光滑平整多孔,并能观察到一些缝隙中的微纤维片状结构,与化学法制备的甲壳素(图9-b)相比孔隙更加疏松均匀。这与ZHANG等[23]、MOHAN等[24]报道的甲壳素表面特征相一致,预示着发酵法能较好地脱除龙虾壳中的蛋白质等杂质。

a-发酵法甲壳素;b-化学提取法甲壳素;c-龙虾壳粉
图9 发酵法甲壳素、化学提取法甲壳素、龙虾壳粉的扫描电镜图
Fig.9 Scanning electron microscopy images of chitin by fermentation, chitin by chemical extraction, and crayfish shell powder
注:放大倍数5 000×。
2.5.2 红外分析
以化学法制备的甲壳素为对照,通过傅里叶红外光谱仪对发酵法制备的甲壳素进行表征,由图10可知,2种方法制备的样品均表现出了甲壳素的特征峰。在3 000~3 500 cm-1左右为O—H、N—H伸缩振动的吸收峰,这2个吸收峰的强度受氢键的影响比较大;1 621、1 547、1 377 cm-1左右分别对应酰胺Ⅰ谱带(C![]() O)、酰胺Ⅱ谱带(N—H)、酰胺Ⅲ谱带(C—N),范围在1 200~950 cm-1为碳水化合物指纹特征图谱,这与大多虾壳甲壳素结构相一致[25]。其中酰胺Ⅰ带的吸收峰与甲壳素的晶型有关,出现双峰表明2个样品甲壳素均为是α晶型[26],蛋白质的酰胺峰与甲壳素的酰胺I带(C
O)、酰胺Ⅱ谱带(N—H)、酰胺Ⅲ谱带(C—N),范围在1 200~950 cm-1为碳水化合物指纹特征图谱,这与大多虾壳甲壳素结构相一致[25]。其中酰胺Ⅰ带的吸收峰与甲壳素的晶型有关,出现双峰表明2个样品甲壳素均为是α晶型[26],蛋白质的酰胺峰与甲壳素的酰胺I带(C![]() O基团在1 621 cm-1左右处的伸缩振动)重叠,酰胺I带未发现分裂,表明发酵处理能够从虾壳中除去蛋白质[27];酰胺Ⅱ谱带的吸收峰与脱乙酰度相关,本研究发酵法制备的甲壳素在此处的峰强度较高,表明发酵法制备的甲壳素脱乙酰度低于化学法制备甲壳素的脱乙酰度[28],经公式计算得到发酵法制备甲壳素的脱乙酰度为15%,低于化学法制备甲壳素的脱乙酰度25.45%。YOUNES等[29]研究发现,被提取的甲壳素的乙酰化程度越高,其降解程度就越低。因此,发酵法制备甲壳素有利于避免天然甲壳素的降解和部分解聚。
O基团在1 621 cm-1左右处的伸缩振动)重叠,酰胺I带未发现分裂,表明发酵处理能够从虾壳中除去蛋白质[27];酰胺Ⅱ谱带的吸收峰与脱乙酰度相关,本研究发酵法制备的甲壳素在此处的峰强度较高,表明发酵法制备的甲壳素脱乙酰度低于化学法制备甲壳素的脱乙酰度[28],经公式计算得到发酵法制备甲壳素的脱乙酰度为15%,低于化学法制备甲壳素的脱乙酰度25.45%。YOUNES等[29]研究发现,被提取的甲壳素的乙酰化程度越高,其降解程度就越低。因此,发酵法制备甲壳素有利于避免天然甲壳素的降解和部分解聚。
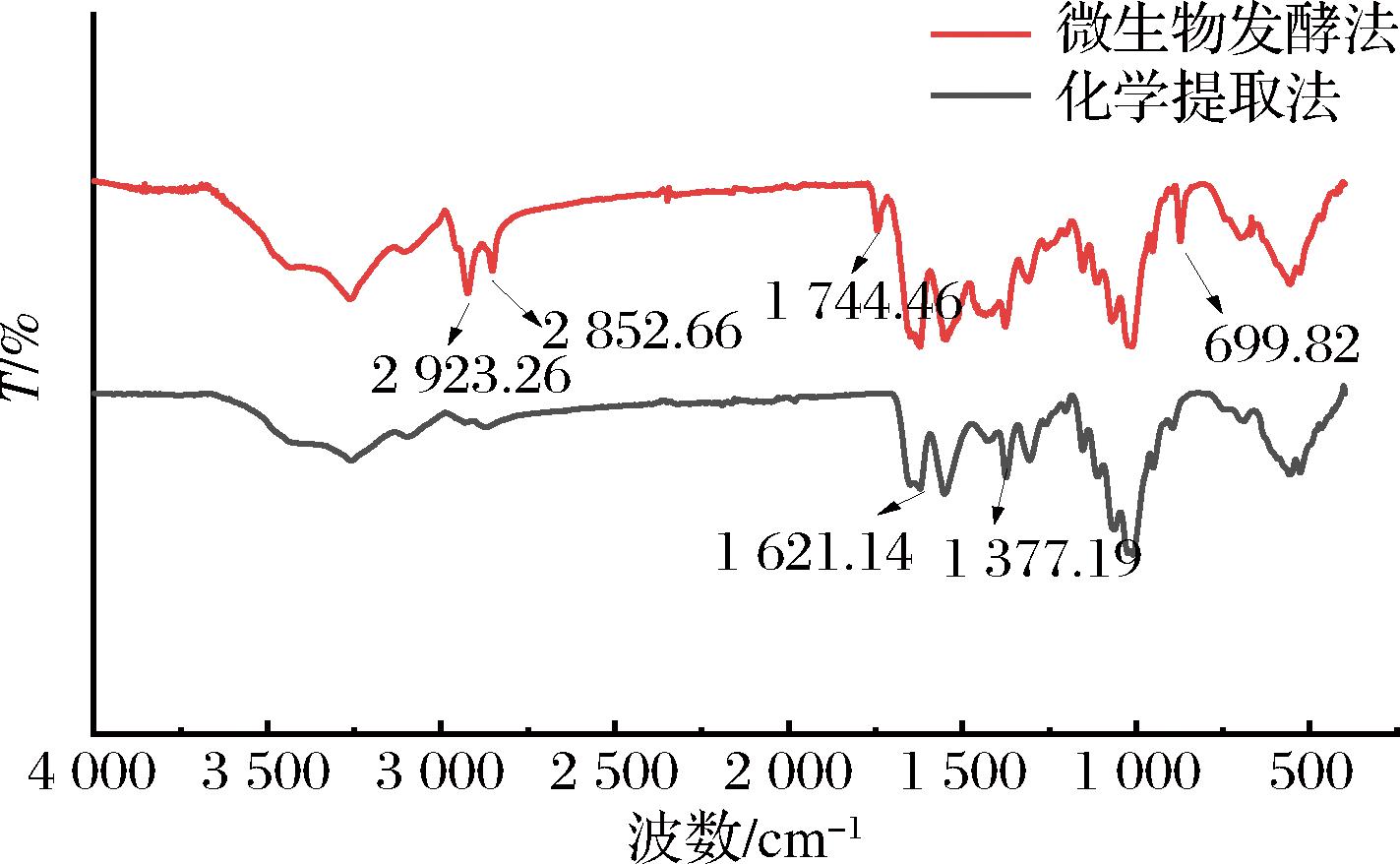
图10 微生物发酵法甲壳素、化学提取法甲壳素的红外光谱图
Fig.10 Infrared spectra of chitin extracted by fermentation and chemical methods
2.5.3 X射线衍射分析
X射线衍射技术是表征物质晶体结构的重要手段。对微生物发酵和化学法制备的甲壳素进行X射线衍射分析,由图11可见,样品X射线衍射图在9.2°、19.2°和26.5°处有3个较强的衍射峰,在12.9°、23.4°处有2个较弱的衍射峰,此为α-晶型甲壳素的典型特征峰[30],表明2种方法并未改变甲壳素晶型结构。在约2θ=29.55°处未显示出明显的碳酸钙的衍射峰[31],表明2种制备方法均能有效脱除虾壳中的矿物质。与化学法相比,发酵法制备甲壳素衍射峰强度较强,结晶度指数达84.8%,高于化学法制备甲壳素结晶度(72.5%)。这是由于随着发酵进行,龙虾壳中矿物质和蛋白质进一步被去除,使得甲壳素纯度更高,结晶度也进一步增大。研究表明[32],在脱乙酰反应进程中,结晶度会先随脱乙酰度的升高而降低,因此该结果与红外光谱脱乙酰度检测结果一致。预示着微生物发酵法制备的甲壳素纯度较高。
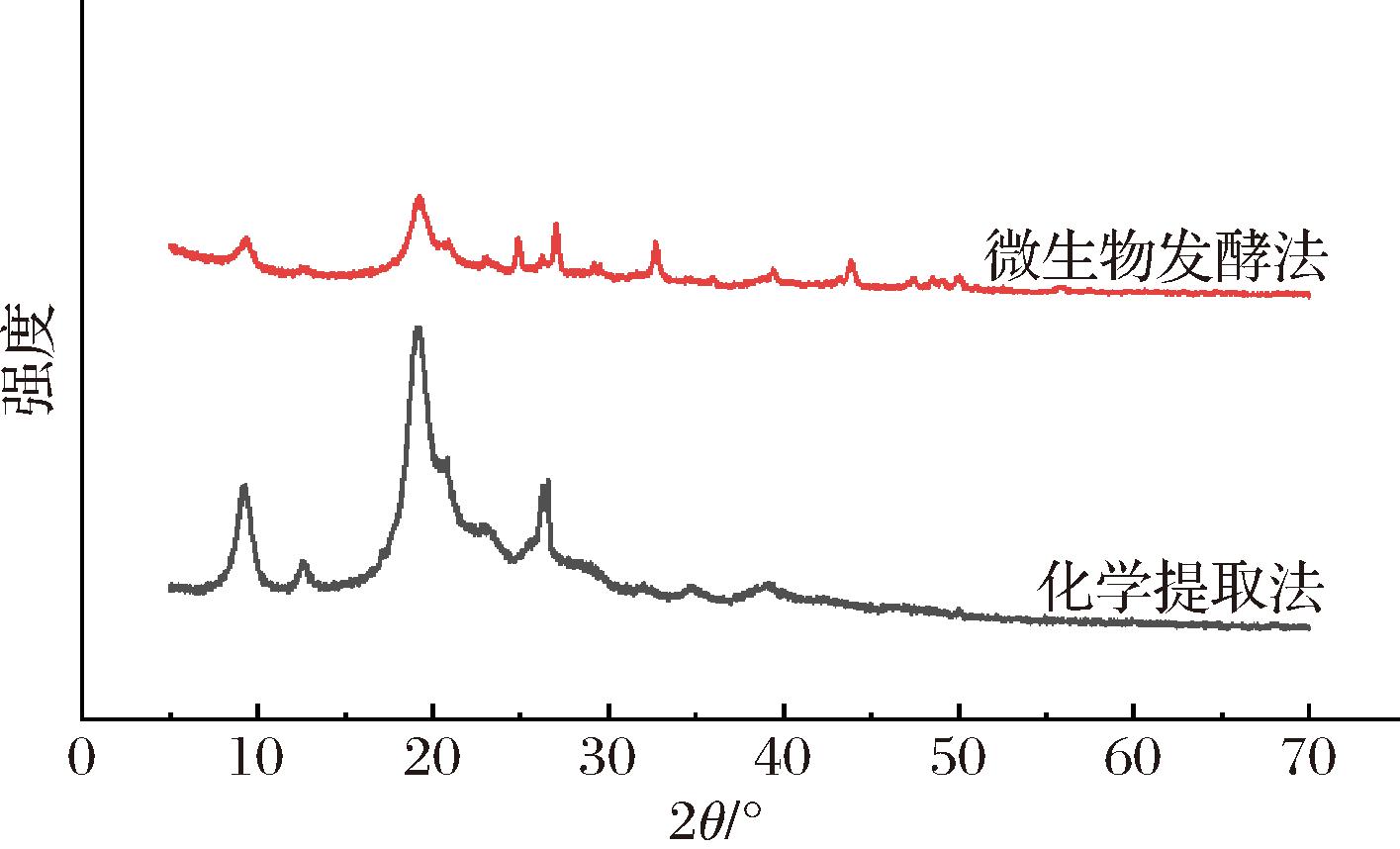
图11 微生物发酵法甲壳素和化学法提取甲壳素的X射线衍射图
Fig.11 X-ray diffraction test images of chitin extracted by fermentation and chemical methods
3 结果与讨论
本文从自然发酵小龙虾壳中筛选出一株具有产蛋白酶菌株LX-W4,经生理生化试验和分子学鉴定其为苏云金芽孢杆菌。将LX-W4菌株与屎肠球菌LX18-9联合应用于小龙虾源甲壳素的发酵法制备,获得该菌株最佳发酵工艺为:初始发酵pH值为6.0,发酵温度40 ℃,虾壳添加量为6%,发酵时间为4 d。该条件下LX-W4菌株的产蛋白酶活力及其对虾壳中蛋白质的脱除率分别为86.02 U/mL、95.21%。利用扫描电镜、傅里叶红外分析和X射线衍射技术对微生物发酵法制备的甲壳素进行结构解析,结果表明:微生物发酵法制备的甲壳素具有α-甲壳素的晶型结构特征,脱乙酰度为15%,结晶度指数为84.8%。与传统化学法制备相比,连续发酵法对甲壳素的分子结构破坏小、产品纯度高、对发酵法制备甲壳素表面光滑平整多孔,孔隙更加疏松均匀。本研究既可为发酵法制备小龙虾源甲壳素提供参考,还能为提升小龙虾副产物的循环利用提供新的技术途径,具有一定研究应用价值。
[1] ZHANG J N, MOHD SAID F, DAUD N F S, et al.Present status and application prospects of green chitin nanowhiskers:A comprehensive review[J].International Journal of Biological Macromolecules, 2024, 278:134235.
[2] 许磊, 张文昌, 赵岩, 等.非晶化甲壳素脱乙酰制备高脱乙酰度壳聚糖[J].食品工业科技, 2021, 42(13):216-220.XU L, ZHANG W C, ZHAO Y, et al.Preparation of chitosan with high degree of deacetylation from amorphous chitin[J].Science and Technology of Food Industry, 2021, 42(13):216-220.
[3] MOHAN K, MURALISANKAR T, JAYAKUMAR R, et al.A study on structural comparisons of α-chitin extracted from marine crustacean shell waste[J].Carbohydrate Polymer Technologies and Applications, 2021, 2:100037.
[4] 尹凯波, 郑子露, 金嘉悦, 等.虾蟹壳废弃物中几丁质的制备及应用进展[J].食品工业科技, 2024, 45(20):407-414.YIN K B, ZHENG Z L, JIN J Y, et al.Extraction method and application progress of chitin from shrimp and crab shell waste[J].Science and Technology of Food Industry, 2024, 45(20):407-414.
[5] ISLAM S, RAHMAN BHUIYAN M A, ISLAM M N.Chitin and chitosan:Structure, properties and applications in biomedical engineering[J].Journal of Polymers and the Environment, 2017, 25(3):854-866.
[6] RUANGWICHA J, CHEIRSILP B, SUYOTHA W.Green biorefinery of shrimp shell waste for α-chitin and high-value co-products through successive fermentation by co-lactic acid bacteria and proteolytic fungus[J].Bioresource Technology, 2024, 393:130106.
[7] 雷家炽, 张俊, 刘海, 等.甲壳素绿色提取技术的研究进展[J].食品与发酵工业, 2023, 49(12):319-328.LEI J C, ZHANG J, LIU H, et al.Research progress of green extraction technology of chitin[J].Food and Fermentation Industries, 2023, 49(12):319-328.
[8] YOUNES I, GHORBEL-BELLAAJ O, NASRI R, et al.Chitin and chitosan preparation from shrimp shells using optimized enzymatic deproteinization[J].Process Biochemistry, 2012, 47(12):2032-2039.
[9] TASER B, OZKAN H, ADIGUZEL A, et al.Preparation of chitosan from waste shrimp shells fermented with Paenibacillus jamilae BAT1[J].International Journal of Biological Macromolecules, 2021, 183:1191-1199.
[10] ZHOU N, YANG P F, CHEN J, et al.Effect of organic solvents treatment on structure of chitin and its enzymatic hydrolysis[J].Polymer Degradation and Stability, 2022, 198:109654.
[11] 杨锡洪, 辛荣玉, 宋琳, 等.虾蟹壳中甲壳素绿色提取技术研究进展[J].现代食品科技, 2020, 36(7):344-350.YANG X H, XIN R Y, SONG L, et al.Green extraction technology of chitin from shrimp shells and crab shells:A review[J].Modern Food Science and Technology, 2020, 36(7):344-350.
[12] 张巧, 黄兴, 李永成.产蛋白酶菌株的鉴定及其对虾壳的脱蛋白研究[J].中国酿造, 2020, 39(9):131-135.ZHANG Q, HUANG X, LI Y C.Identification of a protease-producing strain and deproteinization on shrimp shell[J].China Brewing, 2020, 39(9):131-135
[13] ZHANG Q, DUAN L R, LI Y C.Positive effects and mechanism of ultrasound on chitin preparation from shrimp shells by co-fermentation[J].Ultrasonics Sonochemistry, 2022, 88:106066.
[14] GHORBEL-BELLAAJ O, HMIDET N, JELLOULI K, et al.Shrimp waste fermentation with Pseudomonas aeruginosa A2:Optimization of chitin extraction conditions through Plackett-Burman and response surface methodology approaches[J].International Journal of Biological Macromolecules, 2011, 48(4):596-602.
[15] XIE J W, XIE W C, YU J, et al.Extraction of chitin from shrimp shell by successive two-step fermentation of Exiguobacterium profundum and Lactobacillus acidophilus[J].Frontiers in Microbiology, 2021, 12:677126.
[16] 东秀珠, 蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社, 2001.DONG X Z, CAI M Y.Handbook of systematic identification of common bacteria[M].Beijing:Science Press, 2001.
[17] BEZERRA R S, LINS E J F, ALENCAR R B, et al.Alkaline proteinase from intestine of Nile tilapia (Oreochromis niloticus)[J].Process Biochemistry, 2005, 40(5):1829-1834.
[18] MIRANDA M P.Comparison of the effect of Sodium Chloride concentration on protein determination:Bradford and Biuret methods[J].Analytical Biochemistry, 2024, 687:115450.
[19] ASRI S E A M, ZAKARIA Z, ARJMANDI R, et al.Isolation and characterization of chitin nanowhiskers from fermented tiger prawn waste[J].Chemical Engineering Transactions, 2017, 56:139-144.
[20] HAMDI M, HAJJI S, AFFES S, et al.Development of a controlled bioconversion process for the recovery of chitosan from blue crab (Portunus segnis) exoskeleton[J].Food Hydrocolloids, 2018, 77:534-548.
[21] 杨静, 高泽鑫, 朱莉, 等.产胞外多糖的苏云金芽孢杆菌的筛选及发酵工艺优化[J].食品与发酵工业, 2021, 47(24):124-131.YANG J, GAO Z X, ZHU L, et al.Screening of an extracellular polysaccharides producing Bacillus thuringiensis strain and its fermentation optimization[J].Food and Fermentation Industries, 2021, 47(24):124-131.
[22] 缪园欣, 田建阳, 贲锦华, 等.山楂酵素发酵工艺优化及体外生物活性研究[J].食品与机械, 2024, 40(10):181-187.MIAO Y X, TIAN J Y.BEN J H, et al.Optimization of fermentation technology and its in-vitro activity of hawthorn enzyme[J].Food &Machinery, 2024, 40(10):181-187.
[23] ZHANG Q, WANG L Y, LIU S G, et al.Establishment of successive co-fermentation by Bacillus subtilis and Acetobacter pasteurianus for extracting chitin from shrimp shells[J].Carbohydrate Polymers, 2021, 258:117720.
[24] MOHAN K N, RAVICHANDRAN S, MURALISANKAR T, et al.Extraction and characterization of chitin from sea snail Conus inscriptus (Reeve, 1843)[J].International Journal of Biological Macromolecules, 2019, 126:555-560.
[25] LEE Y S, TARTÉ R, ACEVEDO N C.Curcumin encapsulation in Pickering emulsions co-stabilized by starch nanoparticles and chitin nanofibers[J].RSC Advances, 2021, 11(27):16275-16284.
[26] ZHANG W C, ZHAO Y, XU L, et al.Superfine grinding induced amorphization and increased solubility of α-chitin[J].Carbohydrate Polymers, 2020, 237:116145.
[27] HUANG W C, ZHAO D D, GUO N, et al.Green and facile production of chitin from crustacean shells using a natural deep eutectic solvent[J].Journal of Agricultural and Food Chemistry, 2018, 66(45):11897-11901.
[28] ZHANG H C, YUN S Y, SONG L L, et al.The preparation and characterization of chitin and chitosan under large-scale submerged fermentation level using shrimp by-products as substrate[J].International Journal of Biological Macromolecules, 2017, 96:334-339.
[29] YOUNES I, HAJJI S, RINAUDO M, et al.Optimization of proteins and minerals removal from shrimp shells to produce highly acetylated chitin[J].International Journal of Biological Macromolecules, 2016, 84:246-253.
[30] SAMPATH L, NGASOTTER S, PORAYIL L, et al.Impact of extended acid hydrolysis on polymeric, structural and thermal properties of microcrystalline chitin[J].Carbohydrate Polymer Technologies and Applications, 2022, 4:100252.
[31] 何晓希, 杨荣玲, 朱千林, 等.响应面法优化三元低共熔溶剂提取克氏原螯虾中的甲壳素[J].化学试剂, 2024, 46(4):50-58.HE X X, YANG R L, ZHU Q L, et al.Optimization of extraction of chitin from crayfish (Procambarus clarkii) with ternary deep eutectic solvents by response surface methodology[J].Chemical Reagents, 2024, 46(4):50-58.
[32] SAMUELS R J.Solid state characterization of the structure of chitosan films[J].Journal of Polymer Science:Polymer Physics Edition, 1981, 19(7):1081-1105.