玫瑰(Rosa rugosa Thunb.)作食用或药用已有悠久的历史,在古中国、古罗马和古希腊文明中均有记载。其原产于我国东部沿海、朝鲜半岛、俄罗斯及日本等地区,现如今已在我国大部分地区均有栽培,以山东、甘肃、云南、北京、新疆等地为主。玫瑰在国外则主要分布于土耳其、保加利亚、法国、摩洛哥等国家[1]。
食用玫瑰的研究主要针对于其可食用部位,花瓣,以此为研究对象,检测其营养成分、生物活性物质、挥发性成分等。MALLICK等[2]选取了大马士革玫瑰在内的10种玫瑰,评价了它们颜色、酸碱度、可溶性固形物含量、总花青素等共25个指标。黄鑫等[3]对云南墨红玫瑰中的蛋白质、氨基酸、维生素和矿物质等进行了检测,并评价了其抗氧化能力,揭示了墨红玫瑰作为天然抗氧化剂、食品添加剂的潜力。现有研究显示,食用玫瑰富含多种营养物质和活性成分,如脂肪酸、氨基酸、胡萝卜素、多酚等,这些成分赋予了玫瑰独特的食用和药用价值,例如抗氧化、抗炎等[4]。现如今玫瑰在食品加工领域常被制作成食用色素、精油、纯露、饮料、甜品等,作为经济作物具有重大的潜力。
本研究采用了甘肃、云南两地的6种食用玫瑰主栽品种作为研究对象,对其脂肪酸、氨基酸、有机酸及可溶性糖的构成以及β-胡萝卜素、总多酚、总黄酮含量在内的六类共65种指标进行测定,较为全面地对比了这6种食用玫瑰鲜花之间营养的差异与相似性,同时为后续食用玫瑰资源利用与深加工产品开发提供一些理论基础。
1 材料与方法
1.1 材料与试剂
本研究中所采用的兰州大马士革白玫瑰(DM)、兰州苦水玫瑰(KS)、兰州平阴玫瑰(PY)采于甘肃省兰州市永登县苦水镇玫瑰花种植基地;大庄滇红玫瑰(DH)、大庄墨红玫瑰(DZ)采于云南省开远市大庄柴门庄园种植基地;弥勒墨红玫瑰(ML)采于云南省弥勒市弥阳镇玫瑰花种植基地。
正己烷(色谱纯)、甲醇、盐酸、乙醇、氢氧化钠(分析纯),北京现代东方科技发展有限公司;三乙胺(色谱纯)、氢氧化钾、乙腈、甲酸铵、吡啶、六甲基二硅胺烷、三甲基氯硅烷、琥珀酸、亚硝酸钠、硝酸铝、碳酸钠(分析纯)、异硫氰酸苯酯(纯度>99%)、福林酚试剂(生物试剂)、苹果酸、阿拉伯糖、木糖、果糖、葡萄糖、甘露糖、蔗糖、奎尼酸、芦丁标品(纯度>98%)、β-胡萝卜素标品(纯度>96%),上海麦克林生化科技有限公司;37种脂肪酸甲酯混标(纯度>95%),上海安谱实验科技股份有限公司;苯酚(分析纯),西陇化工股份有限公司;21种氨基酸混标(纯度>98%),天津阿尔塔有限公司;没食子酸标品(纯度>98%),上海源叶生物科技有限公司。
1.2 仪器与设备
GCMS-QP2010 Ultra气质联用仪、LC-20AT液相色谱仪、GC-2010气相色谱仪,日本岛津公司;T6紫外可见分光光度计,北京普析通用仪器有限责任公司;1-14小型台式高速离心机,德国Sigma公司;Lab Tech旋转蒸发仪,美国莱伯泰科有限公司;高速万能粉碎机,天津市泰斯特仪器有限公司。
1.3 实验方法
1.3.1 玫瑰鲜花脂肪酸测定
参考WU等[5]的实验方法并作出了部分调整。将一定质量的玫瑰鲜花热风干燥后进行粉碎,每个品种的玫瑰干花粉取10.000 g分别用150 mL正己烷进行索氏提取,浸提回流6 h。利用旋转蒸发仪在35 ℃下水浴0.5 h,将混合物中的正己烷除去后得到粗脂肪的含量。向玫瑰粗脂肪中加入正己烷进行溶解,加入质量浓度为50 g/L的氢氧化钾-甲醇溶液,振摇使其充分接触,待静置分层后取上清液待测。
GC-MS条件:参考WU等[5]的实验方法并作出了部分调整。色谱条件:色谱柱为HP-INNOWAX型毛细管柱(30 m×0.25 mm×0.25 μm);升温程序:初温160 ℃,保持1 min,以8 ℃/min升至190 ℃;接着再以10 ℃/min 升至230 ℃,保持15 min。载气为高纯氦气,流速为1 mL/min。采用分流进样,分流比30∶1。进样口温度为280 ℃。质谱条件:电子轰击(electron impact,EI)离子源电子能量为70 eV;电子倍增器电压为 1.00 kV,采用Full scan模式扫描,质量扫描范围为30~550 m/z。离子源温度250 ℃,接口温度为250 ℃。
定性和定量方法:对已知成分的脂肪酸混合标准品在同样条件下进行气质联用分析,将样品峰的保留时间与脂肪酸甲酯标准混合物的保留时间进行比较,结合NIST14、NIST14s质谱库搜索的结果来鉴定脂肪酸的种类。定量采用面积归一法。
1.3.2 玫瑰鲜花氨基酸测定
玫瑰鲜花氨基酸提取与前处理参照GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》。
LC条件:采用Kromasil 100-5-C18色谱柱(250 mm×4.6 mm×5 μm);流动相A:0.01 mol/L [V(甲酸铵)∶V(乙腈)=97∶3]缓冲液,流动相B:V(乙腈)∶V(水)=80∶20;流速0.5 mL/min;检测波长254 nm;柱温40 ℃;进样量10 μL。
定性和定量方法:对已知浓度和成分的氨基酸混合标准品在同样条件下进行液相色谱分析,根据样品出峰时间对比标准品出峰时间进行定性,由峰面积比进行定量。
1.3.3 玫瑰鲜花β-胡萝卜素测定
参考WEI等[6]的实验方法并作出了部分调整。同1.3.1节的方法得到玫瑰鲜花β-胡萝卜素提取物。准确称取0.010 g β-胡萝卜素提取物,用3 mL乙醇进行溶解后在450 nm波长下测定吸光度值。
定量方式:以β-胡萝卜素为外标绘制标准曲线。
1.3.4 玫瑰鲜花有机酸及可溶性糖测定
参考陶翠等[7]的实验方法并作出了部分调整。将玫瑰鲜花捣碎成泥浆,准确称取2.000 g,先加入60%(体积分数)乙醇8 mL,经过3 h浸泡之后在功率100 W、50 ℃下超声提取0.5 h并在8 000 r/min条件下离心10 min,分离上清液后再加入6 mL 60%(体积分数)乙醇,以同样条件再提取2次。合并3次上清液于-4 ℃下保存备用。精确移取样品提取液于鸡心瓶中,55 ℃旋转蒸发至干,加入吡啶后超声使其溶解。将鸡心瓶置于冰水浴中,依次加入六甲基二硅胺烷、三甲基氯硅烷,混匀后静置,然后离心取上清液用于气相色谱检测。
GC条件:色谱柱:HP-5(30 m×0.25 mm×0.25 μm);检测器:FID(氢火焰检测);柱温:初温180 ℃,保持2 min,以6 ℃/min升至200 ℃,保持6 min,再以40 ℃/min升至280 ℃,保持8 min。进样口:280 ℃;检测器:280 ℃;载气:氮气;柱流量:氮气(纯度99.999%):1 mL/min;H2:30 mL/min;空气:300 mL/min;尾吹气:氮气 30 mL/min。
定性和定量方法:对已知成分的有机酸及可溶性糖标准品在同样条件下进行液相色谱分析,根据所用有机酸混标的出峰时间进行定性分析。利用奎尼酸作为外标进行定量。
1.3.5 玫瑰鲜花总黄酮测定
参考颜子曦等[8]的实验方法并作出了部分调整。在0.1 mL玫瑰醇提液中加入0.3 mL 50 g/L的NaNO2溶液,静置后再加入0.3 mL 100 g/L的Al(NO3)3溶液,放置6 min后加入2 mL 40 g/L(质量分数)的NaOH溶液,放置15 min,定容至3 mL,于510 nm处测定其吸光度值。
定量方式:以芦丁标准品为外标绘制标准曲线。
1.3.6 玫瑰鲜花总多酚测定
取样品醇提液液0.01 mL,加入2.5 mL的10%(质量分数)的福林酚试剂,摇匀。反应5 min后,加入2.0 mL 75 g/L的Na2CO3溶液,摇匀,蒸馏水定容至5 mL。室温下放置60 min待反应完全。最后使用紫外分光光度计在765 nm波长条件下测量吸光度。
定量方式:以没食子酸标准品为外标绘制标准曲线。
1.4 数据处理与统计方法
所有实验重复3次进行测定,得到结果后采用SPSS 26对所有数据进行统计分析(P<0.05),实验结果均用“平均值±标准差”表示。集合交集(upset)图由ChiPlot网站(https://www.chiplot.online)在线绘制,其他所有图形由Origin 2021绘制得到。
2 结果与分析
2.1 玫瑰鲜花脂肪酸
2.1.1 玫瑰鲜花脂肪酸构成
6种玫瑰鲜花样品的脂肪酸经过GC-MS检测定性出29种脂肪酸,如图1所示。DM共检测出15种脂肪酸,含量较高的为C18:1和C18:0;KS中检测到19种脂肪酸,占主导地位的脂肪酸为C18:1和C16:0;PY中检测到22种脂肪酸,C18:2、C18:1T、C16:0含量较高;DH中检测到23种脂肪酸,含量较高的包括C18:1、C18:0、C16:0和C18:1T;ML检测到17种脂肪酸,占主导地位的脂肪酸包括C18:1、C16:0和C16:1;DZ检测到18种脂肪酸,C18:0和C18:1含量较高。C16:1和C18:1均为不饱和脂肪酸,可以通过降低血脂浓度来减少冠心病及其他心脑血管疾病的风险,因此玫瑰鲜花的不饱和脂肪酸在保健食品及制药行业具有巨大潜力[9]。

图1 玫瑰鲜花脂肪酸含量环状图
Fig.1 Circular chart of fatty acid content in fresh rose flowers
2.1.2 不同品种玫瑰鲜花脂肪酸构成对比分析
由图2可知,6种玫瑰鲜花的共有脂肪酸为8种,包括C14:1、C16:1、C17:1、C17:0、C18:0、C20:2、C20:1和C22:0。除DM外其他5种玫瑰共有脂肪酸为2种,是C12:0和C20:0。PY独有的脂肪酸为C6:0,DH独有的脂肪酸为C21:0,ML独有的脂肪酸为C11:0。总体来看,这6种玫瑰鲜花的脂肪酸种类大体上相似,仅少数脂肪酸为某个品种特有,且与产地无明显相关性。
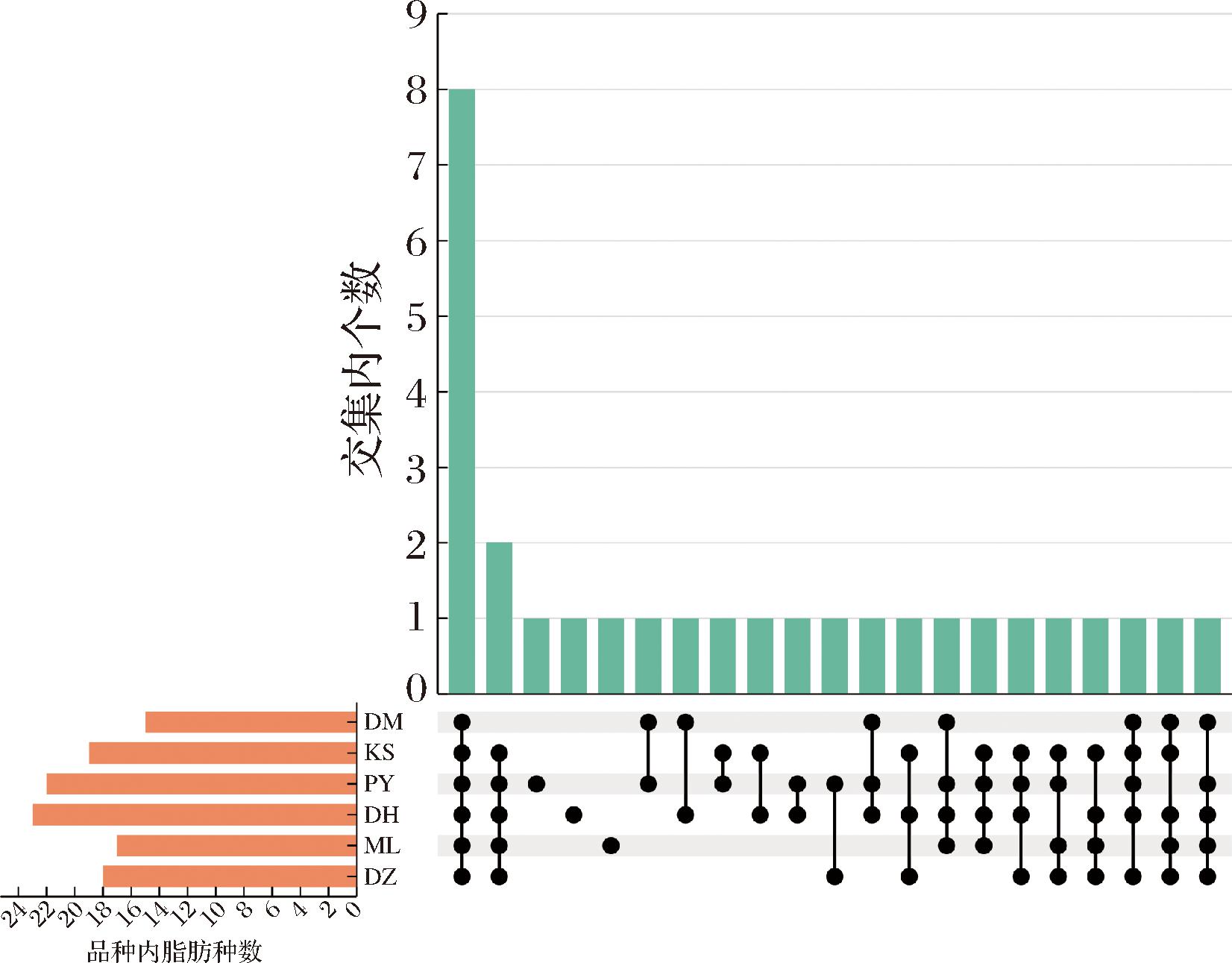
图2 不同玫瑰鲜花脂肪酸构成集合交集图
Fig.2 Upset chart of fatty acid composition in different fresh rose flowers
对玫瑰鲜花脂肪酸含量结果进行差异显著性分析,得到结果如表1所示。DH的脂肪酸含量较为丰富,其中C12:0和C23:0的百分含量显著高于其他品种的玫瑰。C12:0是一种中链脂肪酸,在食品加工中有助于提高冰淇淋胶体结构的稳定性[10],同时也具有调节神经活动、减少氧化应激、降低胆固醇[11]的作用。DM的脂肪酸种类较少,但C8:0、C10:0、C18:0、C20:4、C20:3和C20:1的百分含量均显著高于其他品种的玫瑰。C20:4是一种多不饱和脂肪酸,与细胞膜的流动性与柔韧性有关,是生物细胞膜的重要组成部分[12]。
表1 玫瑰鲜花脂肪酸构成差异显著性分析 单位:%
Table 1 Significant difference analysis of fatty acid composition in fresh rose flowers

脂肪酸DMKSPYDHMLDZC6:0——0.05±0.02a———C8:00.14±0.01a—0.03±0.01c0.05±0.02b——C10:00.43±0.01a0.17±0.02c0.25±0.03b0.21±0.05c—0.11±0.02dC11:0————0.15±0.01a—C12:0—0.98±0.17bc0.75±0.15bc1.48±0.45a1.03±0.13b0.59±0.07cC13:0—0.24±0.02c0.21±0.09c—2.40±0.81a1.18±0.13bC14:13.11±0.97b4.55±1.37a1.20±0.29c1.89±0.70bc1.28±0.17c0.90±0.10cC14:0—0.43±0.17b—0.06±0.02c0.88±0.08a0.44±0.08bC15:1—0.03±0.01b—2.62±0.51a——C15:0—0.33±0.08a0.21±0.05b———C16:10.07±0.01c1.63±0.41b0.04±0.01c2.20±0.26b17.13±1.27a0.12±0.02cC16:0—40.44±2.56a23.34±2.25c17.91±2.67d29.95±0.72b—C17:10.09±0.00bc0.12±0.01b0.06±0.01bc0.02±0.01c0.34±0.10a0.09±0.02bcC17:00.52±0.01bc1.07±0.04a0.60±0.23bc0.40±0.05c0.72±0.06b0.59±0.05bcC18:2TT0.14±0.05c—0.28±0.08b0.60±0.13a0.72±0.06a—C18:2——44.25±1.31a——0.57±0.06bC18:1T——23.36±2.33a13.42±3.23b——C18:155.57±3.82b44.19±1.53c—28.45±5.53d39.72±1.63c61.46±2.84aC18:033.07±3.19a0.23±0.06d0.08±0.03d18.10±3.34c1.06±0.16d25.01±1.70bC20:40.19±0.05a—0.03±0.01b———C20:30.19±0.06a——0.02±0.01b——C20:20.23±0.06b0.21±0.08b0.08±0.02c0.05±0.01c0.26±0.03b0.59±0.13aC20:12.58±0.94a0.30±0.13c0.13±0.03c1.38±0.33b0.38±0.07c0.49±0.10cC20:0—0.11±0.02bc0.16±0.06b0.07±0.01c0.24±0.03a0.16±0.01bC21:0———3.51±0.61a——C22:2—0.34±0.10a0.13±0.01b0.17±0.06b—0.21±0.04bC22:1—4.56±0.41ab—3.91±0.86b—5.33±1.08aC22:03.48±0.27a0.05±0.01d3.26±0.33a0.08±0.02d2.66±0.20b1.62±0.05cC23:00.19±0.02d—1.48±0.18b3.40±0.71a1.07±0.19bc0.53±0.10cd
注:“脂肪酸”一列中“T”表示一个反式结构,“C18:2TT”为反式亚油酸,“C18:1T”为反-6十八碳烯酸。“—”表示未检出,同一行中不同的小写字母上标代表存在显著差异(P<0.05)(下同)。
2.2 玫瑰鲜花氨基酸
2.2.1 玫瑰鲜花氨基酸组成
6个品种玫瑰鲜花经过LC检测后均测得19种氨基酸,根据氨基酸标品的峰面积比进行定量,整理得到图3。每种玫瑰的总氨基酸含量由高到低排列为DZ、ML、PY、KS、DH和DM,总氨基酸含量为374.49~1 512.19 mg/100 g。DZ玫瑰的氨基酸构成以甘氨酸、精氨酸、L-组氨酸、L-酪氨酸和L-茶氨酸为主,部分氨基酸含量之间存在较大差别。ML、PY和KS玫瑰含量较高的氨基酸为精氨酸、甘氨酸和谷氨酸。DH和DM玫瑰的氨基酸构成较为均匀,不同氨基酸种类之间含量差异较小。氨基酸不仅是重要的营养成分,也是植物体内香气合成的前体物质,因此,玫瑰鲜花氨基酸构成的差异可能通过其挥发性成分反映[13]。
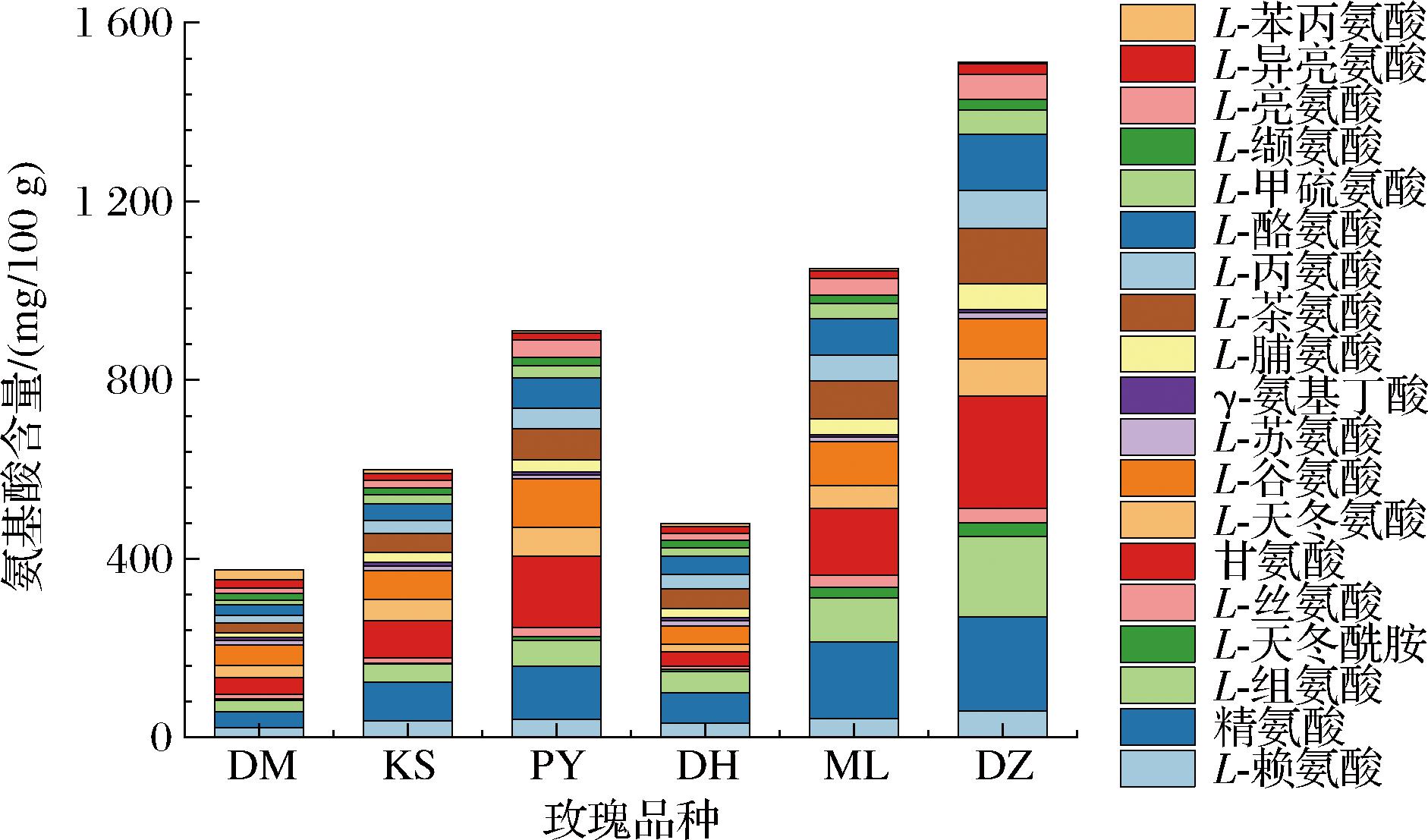
图3 玫瑰鲜花氨基酸构成堆积图
Fig.3 Accumulation chart of amino acid composition in fresh rose flowers
2.2.2 不同品种玫瑰鲜花氨基酸构成对比分析
对6个品种玫瑰鲜花氨基酸构成进行差异显著性分析得到表2。19种氨基酸中,DZ玫瑰有14种氨基酸含量显著高于其他5个品种,其中有5种为必需氨基酸,即L-赖氨酸、L-甲硫氨酸、L-缬氨酸、L-亮氨酸和L-异亮氨酸。必需氨基酸是人体无法通过自身合成的氨基酸,必须通过食物摄取才能保证足够的量,所以食物中的必需氨基酸含量可以影响人体的健康[14]。另外,DZ玫瑰的L-苏氨酸含量显著高于ML、PY和DM,DM玫瑰的L-苯丙氨酸含量显著高于其他5种玫瑰,L-苏氨酸和L-苯丙氨酸也属于必需氨基酸。丝氨酸可以调节谷胱甘肽的合成并参与对胶质瘤的治疗[15],DZ和ML玫瑰的L-丝氨酸含量显著高于其他品种。PY和ML玫瑰的L-谷氨酸含量显著高于DH、KS和DM。谷氨酸参与了多种不同的代谢,是大脑中含量最丰富的游离氨基酸,在食品加工中其常以钠盐形式作为调味品出现[16]。KS和DM玫瑰的γ-氨基丁酸显著高于ML和PY,γ-氨基丁酸是中枢神经系统中重要的抑制性神经递质,可以降低胆固醇和调节高血压[17]。
表2 玫瑰鲜花氨基酸构成差异显著性分析 单位:mg/100 g
Table 2 Significant difference analysis of amino acid composition in fresh rose flowers

指标DMKSPYDHMLDZL-赖氨酸/(mg/100 g)21.60±1.94e37.09±0.93c39.97±3.00bc31.50±2.22d43.05±4.89b58.67±3.70a精氨酸/(mg/100 g)35.95±2.05e86.29±19.05d119.54±18.64c67.99±5.55d171.61±16.47b212.11±19.31aL-组氨酸/(mg/100 g)26.17±2.37e41.54±2.57de58.06±15.84c47.77±4.59cd98.67±6.34b178.58±12.02aL-天冬酰胺/(mg/100 g)2.84±0.36de1.71±1.30e8.31±1.17c4.75±0.42d21.99±1.31b31.75±1.61aL-丝氨酸/(mg/100 g)9.69±0.27cd12.11±1.15c20.11±4.12b6.70±1.93d28.15±4.20a32.51±1.42a甘氨酸/(mg/100 g)38.24±5.82d82.85±12.09c159.57±21.50b32.46±3.28d148.78±12.22b249.62±31.83aL-天冬氨酸/(mg/100 g)27.29±3.62d46.37±7.68c64.75±5.07b17.05±5.86e51.33±2.57c83.90±4.68aL-谷氨酸/(mg/100 g)44.76±5.26d65.10±2.00c108.55±14.45a41.82±2.56d98.30±5.25ab90.14±14.52bL-苏氨酸/(mg/100 g)10.66±0.76b10.90±1.10ab8.86±2.55b10.93±0.98ab10.71±0.89b13.45±1.26aγ-氨基丁酸/(mg/100 g)7.28±0.53ab8.07±0.62a5.73±0.42c6.81±0.12b5.73±0.58c6.75±0.32bL-脯氨酸/(mg/100 g)9.85±1.10e22.46±1.14d28.24±4.18c20.72±2.17d35.03±2.75b59.01±4.24aL-茶氨酸/(mg/100 g)22.51±3.40e42.73±1.13d69.32±3.94c43.85±2.04d84.17±7.86b123.75±11.73aL-丙氨酸/(mg/100 g)16.38±2.87e27.79±2.76d45.68±6.05c32.58±1.08d59.21±6.13b83.99±9.52aL-酪氨酸/(mg/100 g)23.01±2.68d38.42±2.38cd67.54±4.62b41.33±2.06c81.42±6.81b126.60±19.33aL-甲硫氨酸/(mg/100 g)10.50±0.52d19.21±0.89c27.89±4.56b17.58±2.54c33.88±4.73b54.01±4.50aL-缬氨酸/(mg/100 g)15.51±1.13c16.85±0.36bc19.16±3.07b16.88±1.89bc18.57±0.69bc22.85±1.65aL-亮氨酸/(mg/100 g)12.44±0.85c15.58±0.83c38.49±3.50b16.83±3.30c37.66±5.36b56.74±3.66aL-异亮氨酸/(mg/100 g)17.62±0.85b15.98±0.62b15.71±2.38b14.99±1.66b15.68±2.07b23.08±0.28aL-苯丙氨酸/(mg/100 g)22.20±1.14a7.64±0.88b4.76±0.24c7.01±0.44b4.92±0.48c4.67±1.94cEAA/(mg/100 g)110.54±1.76c123.26±2.00c154.83±5.67b115.72±10.07c164.47±14.03b233.48±9.51aNEAA/(mg/100 g)263.95±20.26e475.44±30.45d755.40±84.19c363.83±15.51de884.40±68.52b1 278.71±121.24aTAA/(mg/100 g)374.49±19.14e598.70±31.84d910.24±89.81c479.55±21.56de1 048.86±81.23b1 512.19±130.70aEAA/TAA/%29.5220.5917.0124.1315.6815.44EAA/NEAA/%41.8825.9220.5031.8118.6018.26
注“氨基酸”列黑体部分为必需氨基酸;同一行中不同的小写字母上标代表存在显著差异; EAA为必需氨基酸(essential amino acids),NEAA为非必需氨基酸(non-essential amino acids),TAA为总氨基酸(total amino acids)。
2.3 玫瑰鲜花β-胡萝卜素
β-胡萝卜素是非常有效的单线态氧物理淬灭剂和其他活性氧清除剂,同时也是多烯类天然色素[18],对人体的健康有促进作用。如图4所示,6品种玫瑰鲜花β-胡萝卜素含量为6.42~15.21 μg/g,含量由高到低分别为ML玫瑰15.21 μg/g、DM玫瑰13.61 μg/g、DZ玫瑰 13.20 μg/g、DH玫瑰 10.27 μg/g、PY玫瑰 7.87 μg/g、KS玫瑰6.42 μg/g。ML玫瑰的含量显著高于PY及KS玫瑰。产地为甘肃的3个品种平均β-胡萝卜素含量为9.30 μg/g,低于云南的平均含量12.89 μg/g。值得一提的是,β-胡萝卜素虽是一种天然色素,其含量较高的DM玫瑰却呈白色,含量较低的PY、KS玫瑰呈玫红色,由此可知,β-胡萝卜素在玫瑰鲜花中并无直接的着色的作用。

图4 玫瑰鲜花β-胡萝卜素含量柱状图
Fig.4 Bar chart of β-carotene content in fresh rose flowers
注:不同的小写字母代表组间存在显著差异(P<0.05)。
2.4 玫瑰鲜花有机酸及可溶性糖
2.4.1 玫瑰鲜花有机酸及可溶性糖组成
6种玫瑰样品经过GC检测后通过混合标准品的出峰时间进行定性,奎尼酸标准曲线进行定量,得到的结果如图5所示。6个样品中共检测到3种有机酸和6种可溶性糖:琥珀酸的含量为0.22~0.35 mg/g,KS玫瑰未检出;苹果酸含量为0.15~1.82 mg/g;奎尼酸含量为0.56~4.20 mg/g;木糖含量为0.88~1.42 mg/g;果糖含量为12.17~18.53 mg/g;葡萄糖的含量为14.27~28.87 mg/g;甘露糖的含量为0.40~0.72 mg/g,DM、DH和DZ玫瑰均未检出;蔗糖含量为0.71~0.81 mg/g。6种玫瑰含有的可溶性糖均以葡萄糖和果糖为主,有机酸则以奎尼酸为主。6种玫瑰中,葡萄糖含量较高的品种,其果糖和奎尼酸含量也较高,滋味更加浓郁;仅PY和KS玫瑰奎尼酸含量较低,高甜度低酸度的食物适口性更高。
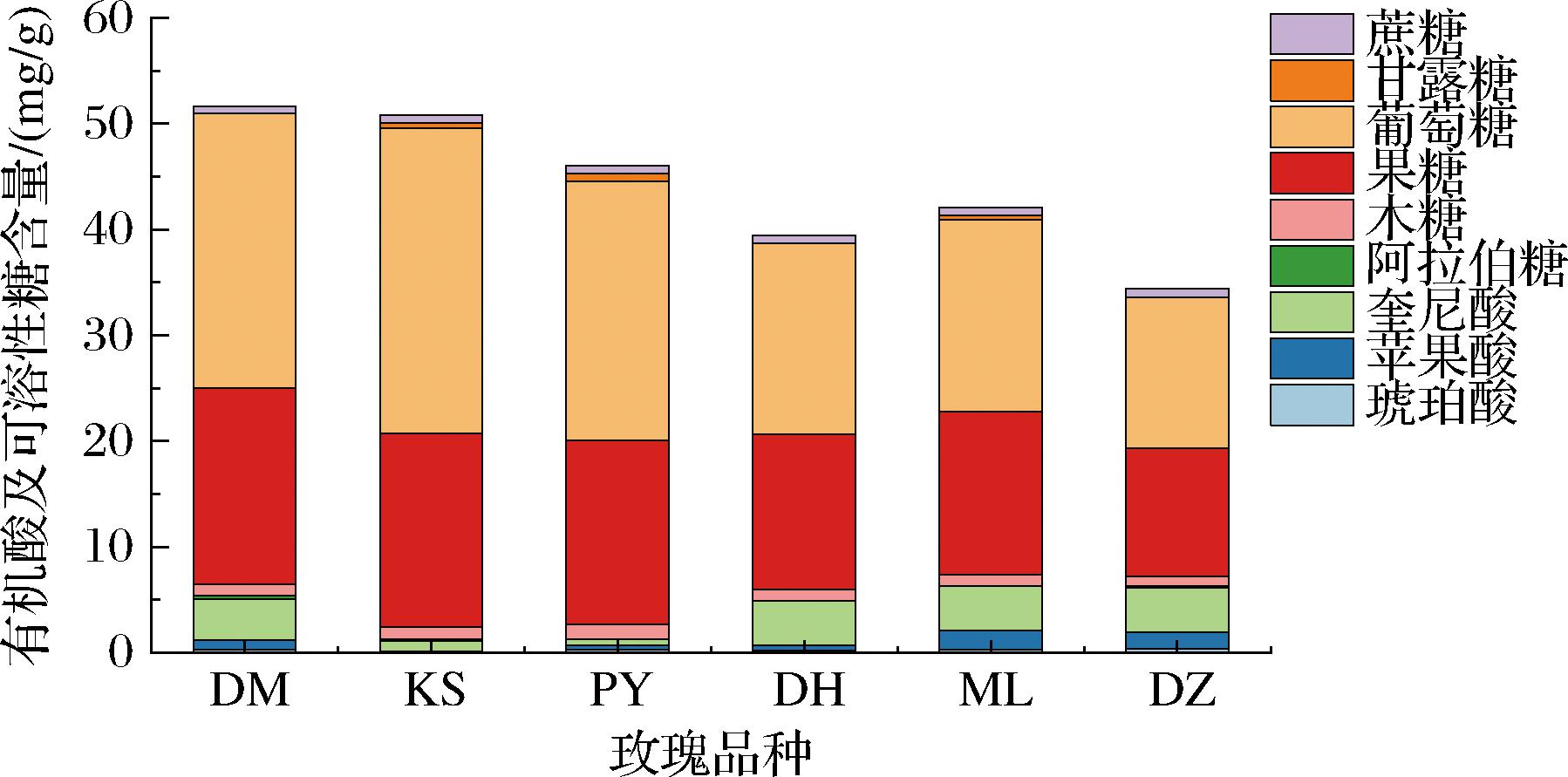
图5 玫瑰鲜花有机酸及可溶性糖构成堆积图
Fig.5 Accumulation diagram of organic acids and soluble sugars in fresh rose flowers
2.4.2 不同品种玫瑰鲜花有机酸及可溶性糖构成对比分析
对6种玫瑰有机酸及可溶性糖构成进行差异显著性分析,结果如表3所示。DZ玫瑰的琥珀酸、苹果酸、奎尼酸及有机酸总含量显著高于KS和PY玫瑰;DM玫瑰的阿拉伯糖含量显著高于其他5个品种玫瑰;KS玫瑰的葡萄糖含量显著高于其他5个品种玫瑰;PY玫瑰的木糖和甘露糖含量显著高于其他5个品种玫瑰;DM、KS和PY玫瑰的果糖和可溶性糖总量均显著高于其他3个品种玫瑰。甘肃产地的玫瑰有机酸总量平均值低于云南产地的玫瑰,可溶性糖总量平均值均高于云南产地的玫瑰,说明甘肃产地的玫瑰酸度更低,甜度较高,更具适口性。
表3 玫瑰鲜花有机酸及可溶性糖构成差异显著性分析 单位:mg/g鲜重
Table 3 Significant difference analysis of organic acids and soluble sugars in fresh rose flowers
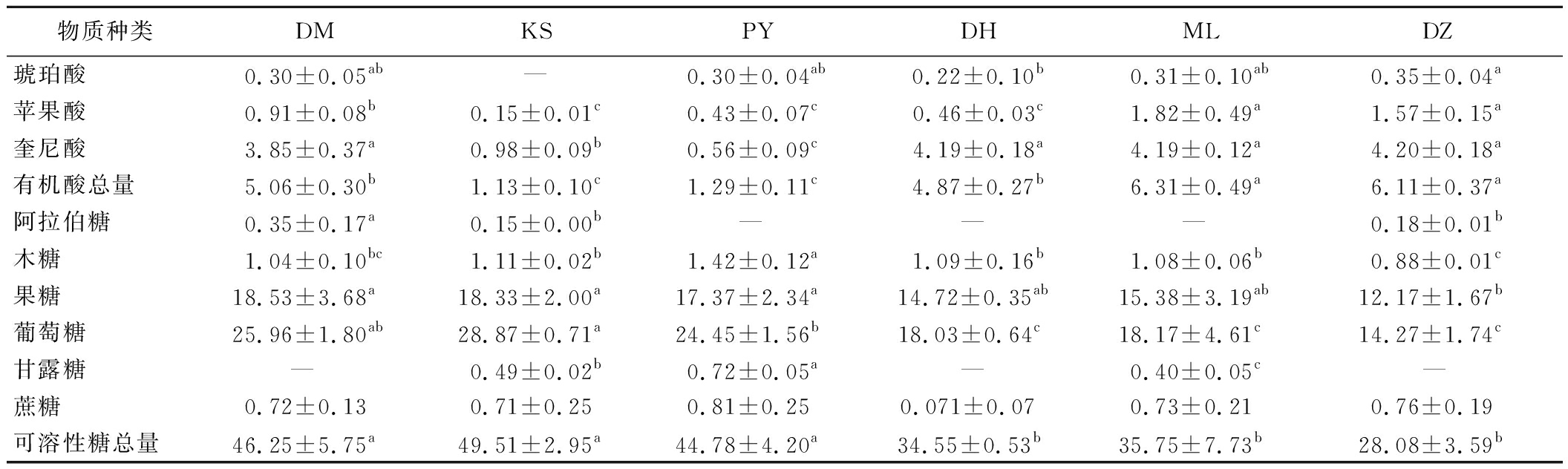
物质种类DMKSPYDHMLDZ琥珀酸0.30±0.05ab—0.30±0.04ab0.22±0.10b0.31±0.10ab0.35±0.04a苹果酸0.91±0.08b0.15±0.01c0.43±0.07c0.46±0.03c1.82±0.49a1.57±0.15a奎尼酸3.85±0.37a0.98±0.09b0.56±0.09c4.19±0.18a4.19±0.12a4.20±0.18a有机酸总量5.06±0.30b1.13±0.10c1.29±0.11c4.87±0.27b6.31±0.49a6.11±0.37a阿拉伯糖0.35±0.17a0.15±0.00b— — — 0.18±0.01b木糖1.04±0.10bc1.11±0.02b1.42±0.12a1.09±0.16b1.08±0.06b0.88±0.01c果糖18.53±3.68a18.33±2.00a17.37±2.34a14.72±0.35ab 15.38±3.19ab12.17±1.67b葡萄糖25.96±1.80ab28.87±0.71a24.45±1.56b18.03±0.64c 18.17±4.61c14.27±1.74c甘露糖— 0.49±0.02b0.72±0.05a— 0.40±0.05c— 蔗糖0.72±0.130.71±0.250.81±0.250.071±0.07 0.73±0.210.76±0.19可溶性糖总量46.25±5.75a49.51±2.95a44.78±4.20a34.55±0.53b 35.75±7.73b28.08±3.59b
2.5 玫瑰鲜花总黄酮
黄酮是来源于植物性食品的生物活性化合物,通过参与免疫反应、氧化还原代谢、细胞生长等机体活动对抑制炎症和抗癌有一定的作用[19]。如图6所示,6个品种玫瑰鲜花总黄酮含量为8.98~28.15 mg/g,含量由高到低为ML玫瑰(28.15 mg/g)、DZ玫瑰(25.06 mg/g)、KS玫瑰(24.80 mg/g)、DH玫瑰(16.62 mg/g)、DM玫瑰(16.04 mg/g)和PY玫瑰(8.98 mg/g),其中ML玫瑰的总黄酮含量显著高于其他5个品种。产自于云南的玫瑰总黄酮平均值为23.28 mg/g,高于甘肃产地的玫瑰(16.61 mg/g)。有研究表明,积温对玫瑰黄酮的形成有促进作用[20],云南气候温暖,更适合玫瑰鲜花积累黄酮化合物。
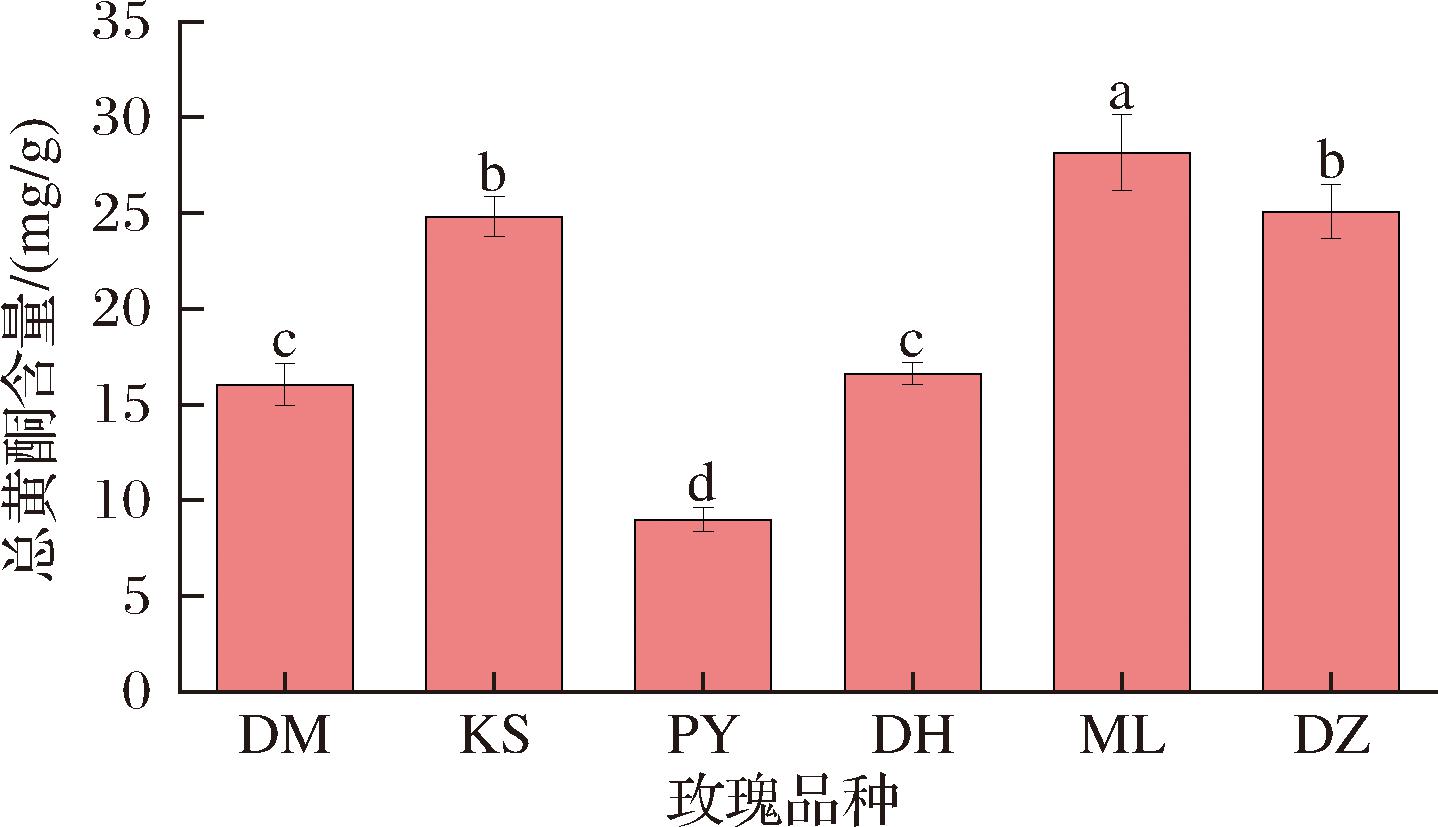
图6 玫瑰鲜花总黄酮含量柱状图
Fig.6 Bar chart of total flavonoid content in fresh rose flowers
2.6 玫瑰鲜花总多酚
多酚广泛存在于植物中,是一类具有抗衰老、抗心血管疾病作用的小分子次级代谢产物[21]。如图7所示,6个品种玫瑰总多酚含量为210.69~458.70 mg/kg,含量由高到低依次为ML玫瑰(458.70 mg/kg)、DZ玫瑰(423.72 mg/kg)、KS玫瑰(420.87 mg/kg)、DH玫瑰(258.55 mg/kg)、DM玫瑰(229.91 mg/kg)与PY玫瑰(210.69 mg/kg)。云南产地的玫瑰总多酚平均含量为380.32 mg/kg,比产于甘肃的玫瑰总多酚平均含量高了接近100 mg/kg。玫瑰鲜花中多酚的累积一方面与产地气候相关,另一方面也受种质遗传因素的影响[22],所以KS玫瑰的总多酚含量能显著高于同产地的另外2个品种。
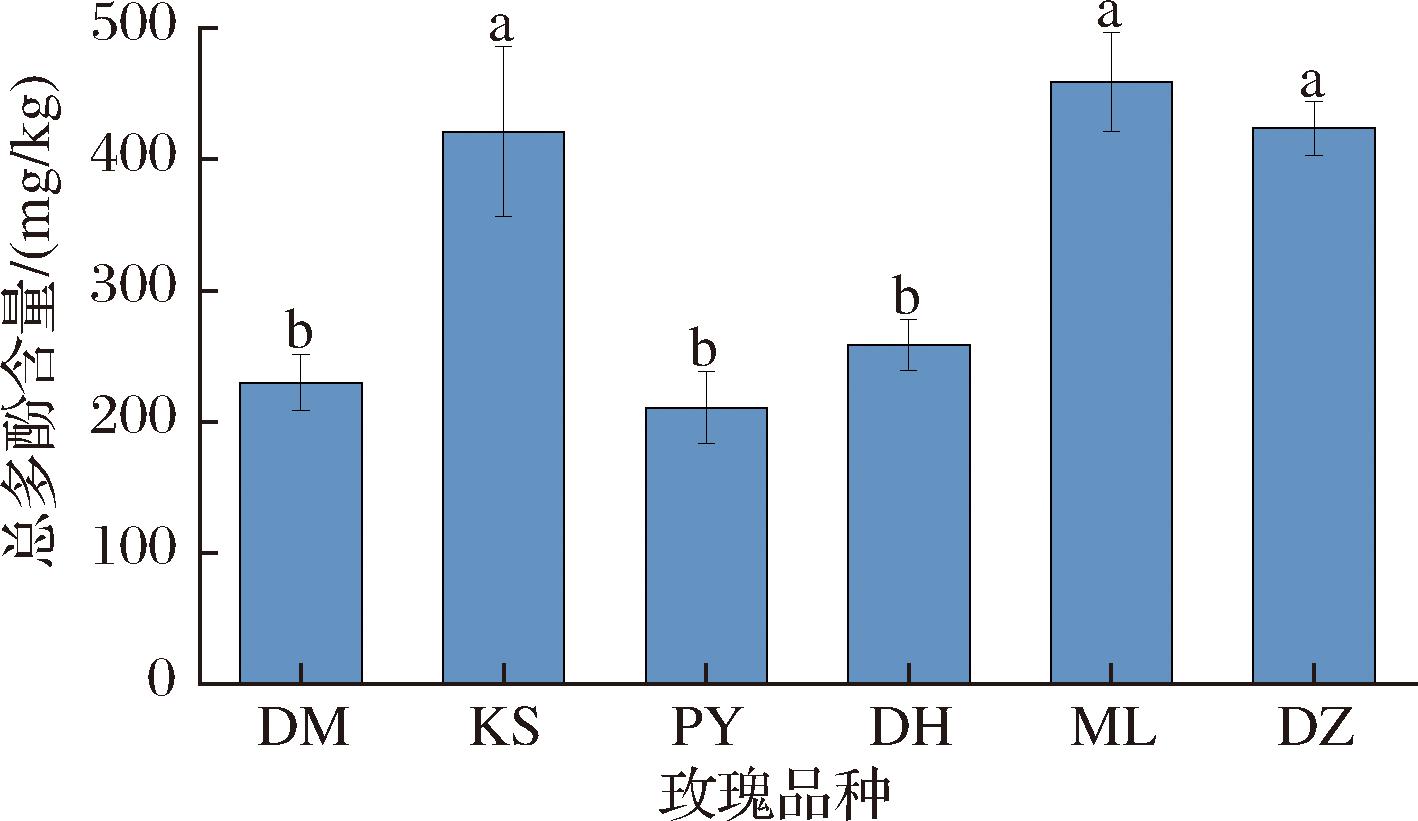
图7 玫瑰鲜花总多酚含量柱状图
Fig.7 Bar chart of total polyphenol content in fresh rose flowers
2.7 不同品种玫瑰鲜花营养成分构成对比分析
2.7.1 不同品种玫瑰鲜花营养构成主成分分析
为了进一步分析不同品种玫瑰鲜花营养成分构成的差异,对玫瑰鲜花脂肪酸、氨基酸、有机酸及可溶性糖等共65个营养成分指标进行了主成分分析。主成分分析是一种常用的统计学方法,在降低数据维度的同时尽可能地保留了原始数据的变异性[23]。如表4所示,降维后共得到18个主成分,其中前4个主成分贡献率分别为38.73%、18.42%、12.12%、11.75%,因此这4个主成分可以解释81.02%的总方差,能够代表65个指标中大部分的信息。
表4 玫瑰鲜花营养成分特征值及贡献率
Table 4 Eigenvalue and percentage of variance of nutritional components in fresh rose flowers
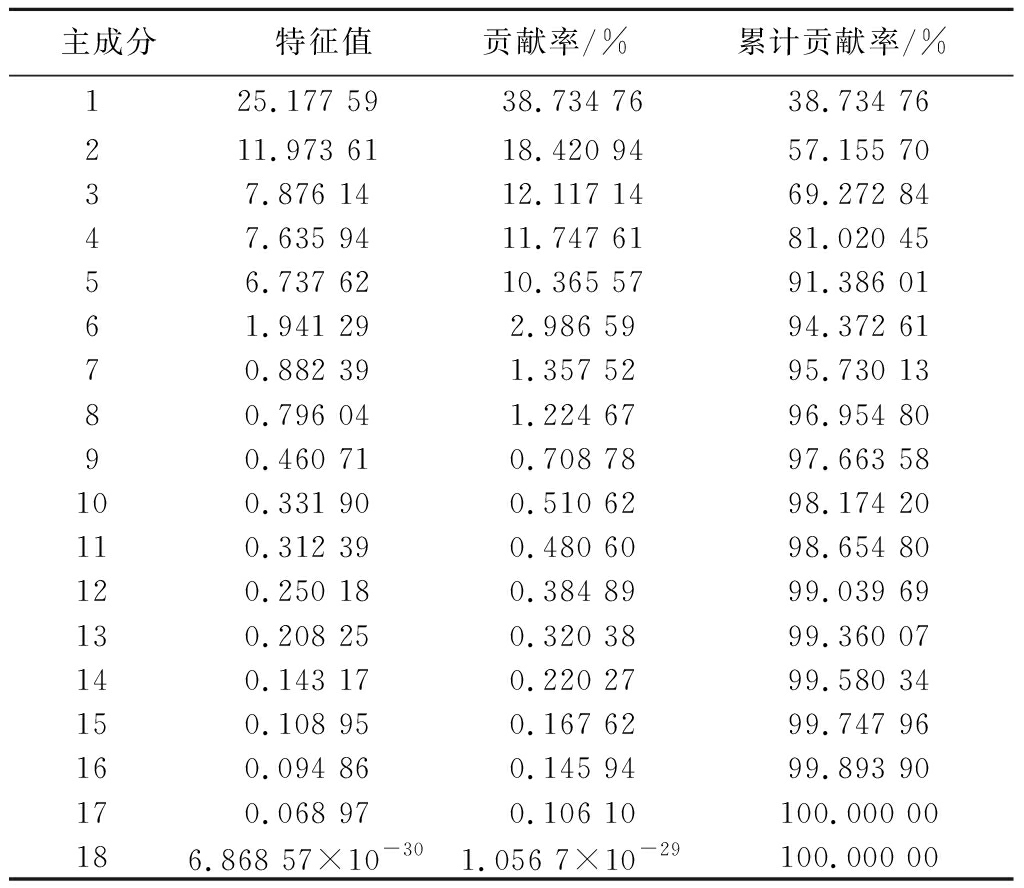
主成分特征值贡献率/%累计贡献率/%125.177 5938.734 7638.734 76211.973 6118.420 9457.155 7037.876 1412.117 1469.272 8447.635 9411.747 6181.020 4556.737 6210.365 5791.386 0161.941 292.986 5994.372 6170.882 391.357 5295.730 1380.796 041.224 6796.954 8090.460 710.708 7897.663 58100.331 900.510 6298.174 20110.312 390.480 6098.654 80120.250 180.384 8999.039 69130.208 250.320 3899.360 07140.143 170.220 2799.580 34150.108 950.167 6299.747 96160.094 860.145 9499.893 90170.068 970.106 10100.000 00186.868 57×10-301.056 7×10-29100.000 00
载荷代表了变量与主成分之间的相关性[24],可用于了解每个变量对数据中有意义的变化有多大的贡献,并解释变量之间的关系[25]。根据载荷将65个营养及活性成分指标对于前4个主成分的载荷绘制成热力图(图8),如图8所示,L-赖氨酸、精氨酸、L-组氨酸、L-天冬酰胺、L-丝氨酸、L-脯氨酸、L-茶氨酸、L-丙氨酸、L-酪氨酸、L-甲硫氨酸的含量与主成分1呈较强的正相关;C18:1、C18:0、C20:1、奎尼酸的含量与主成分2呈较强正相关,C15:0、C16:0、C18:2、木糖、甘露糖含量则呈较强的负相关;C14:0、C17:0、C22:2的含量与主成分3呈较强正相关,C18:2TT、C18:1T、C18:0、琥珀酸的含量则呈较强的负相关;C6:0、C18:2、C22:0的含量与主成分4呈较强正相关,C12:0、C16:1、C18:2TT、总黄酮含量则呈较强的负相关。综上,可以认为主成分1主要代表了氨基酸相关变量的信息,而脂肪酸、有机酸及可溶性糖等变量的信息则分散于主成分2、3、4中。
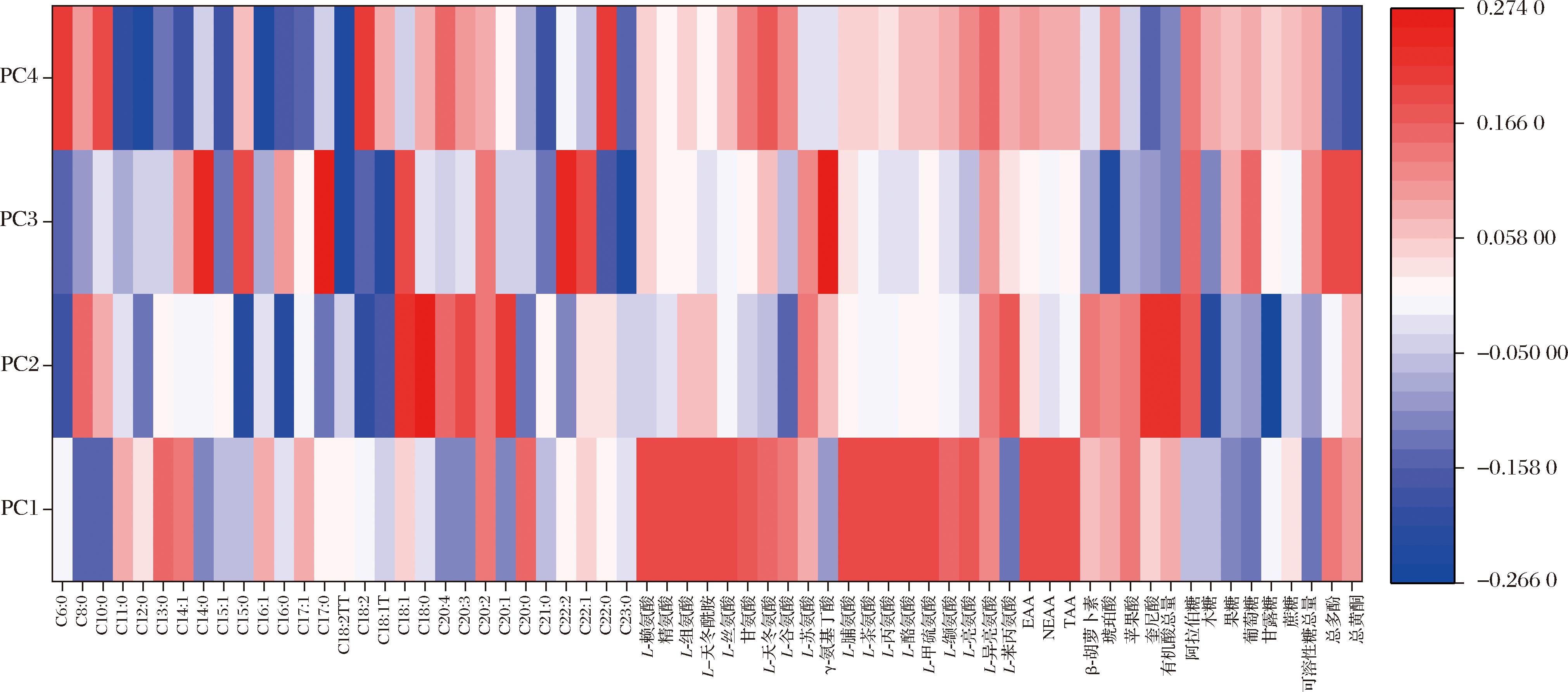
图8 玫瑰鲜花营养及活性成分载荷热力图
Fig.8 Thermogram of loadings of nutritional and active components in fresh rose flowers
注:颜色标尺表示载荷的大小。
在得分图中,样本的得分决定了样本沿每个主成分轴的位置坐标,可用于检测样本之间的分组、相似性或差异性[24]。以主成分1为x轴、主成分2为y轴绘制出不同品种玫瑰鲜花的得分图,如图9所示。DM玫瑰与DH玫瑰、KS玫瑰与PY玫瑰分别处于同一象限内且相距较近,ML玫瑰和DZ玫瑰的距离也较短,说明以上3组玫瑰的L-赖氨酸、精氨酸、L-组氨酸、L-天冬酰胺等氨基酸构成、C18:1、C18:0、C20:1等脂肪酸构成、以及奎尼酸、木糖和甘露糖含量差异较小。同时,DM玫瑰与PY玫瑰在主成分1上距离较远,说明它们之间氨基酸构成存在较大差异。同理,DM玫瑰与DZ玫瑰在C18:1、C18:0、C20:1、奎尼酸等营养物质的构成上差异最大。
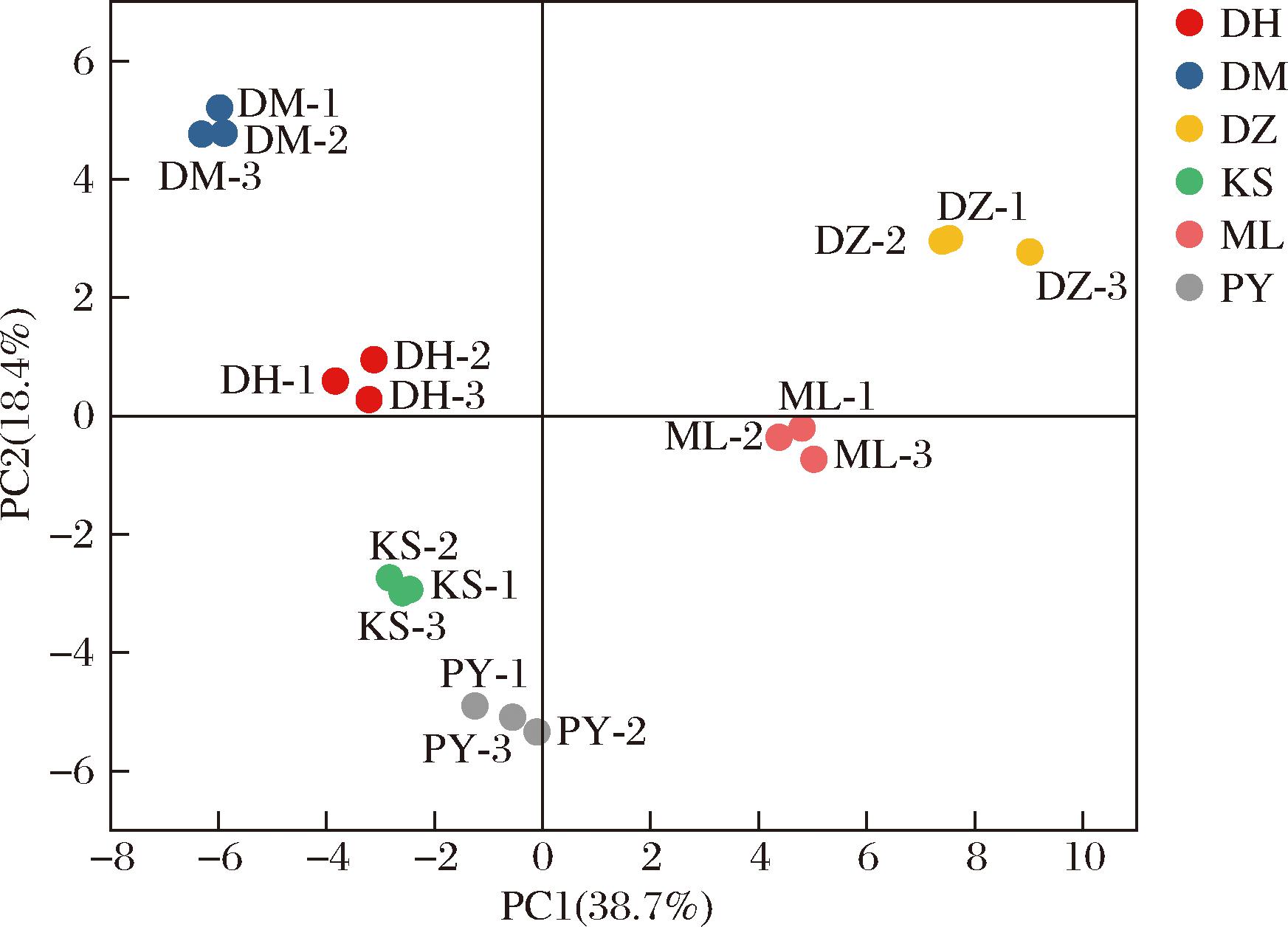
图9 玫瑰鲜花得分图(主成分1、2)
Fig.9 Scores of different varieties of rose (PC1 and PC2)
以主成分1、2、3为x、y、z轴绘制出不同品种玫瑰鲜花的得分图,如图10所示。KS玫瑰处于主成分3大于0的象限中,而其他5个品种均处于主成分3小于0的象限中,且KS玫瑰对应的位置距离其他5种玫瑰较远,表明KS玫瑰的C14:0、C17:0、C22:2等脂肪酸构成和琥珀酸含量与其他5个玫瑰品种存在较大差异;而DM、PY、DH、ML和DZ 5种玫瑰之间该部分脂肪酸构成相似。另外,云南产地的3种玫瑰相互之间距离也较近,说明该产地的玫瑰在主成分1、2、3上具有相似的营养构成。
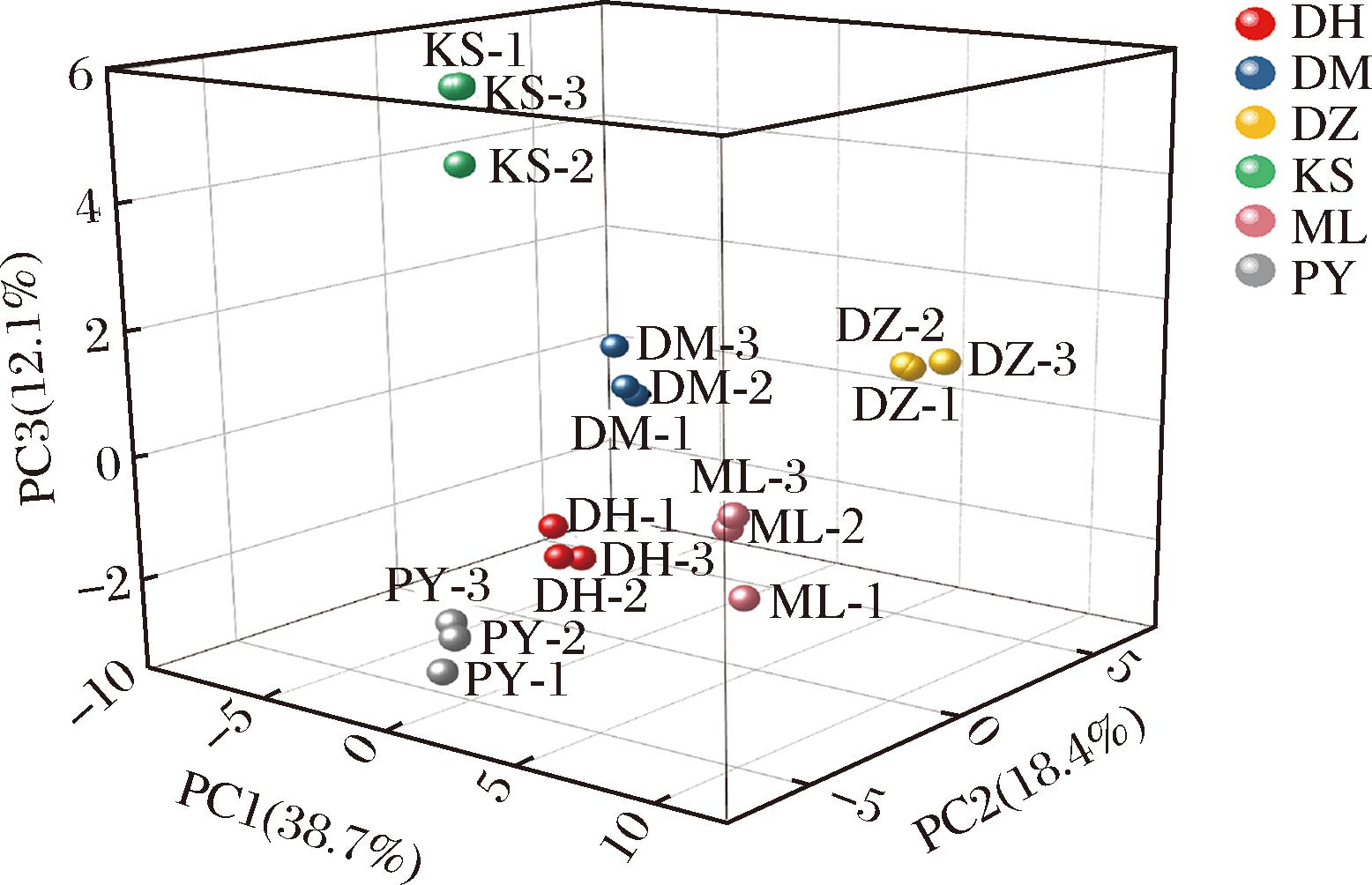
图10 玫瑰鲜花得分图(主成分1、2、3)
Fig.10 Scores of different varieties of rose (PC1, PC2, and PC3)
以主成分1、2、4为x、y、z轴绘制出不同品种玫瑰鲜花的得分图,如图11所示。DM、PY、DZ玫瑰处于主成分4大于0的象限中,其他3种玫瑰均处于主成分4小于0的象限,且这3种玫瑰所处位置与另外3种均存在较大的距离,表明DM、PY、DZ玫瑰在主成分4上具有相似的营养构成,即其C6:0、C18:2、C22:0等脂肪酸构成和总黄酮含量相似,而与KS、DH、ML玫瑰存在较大差异。
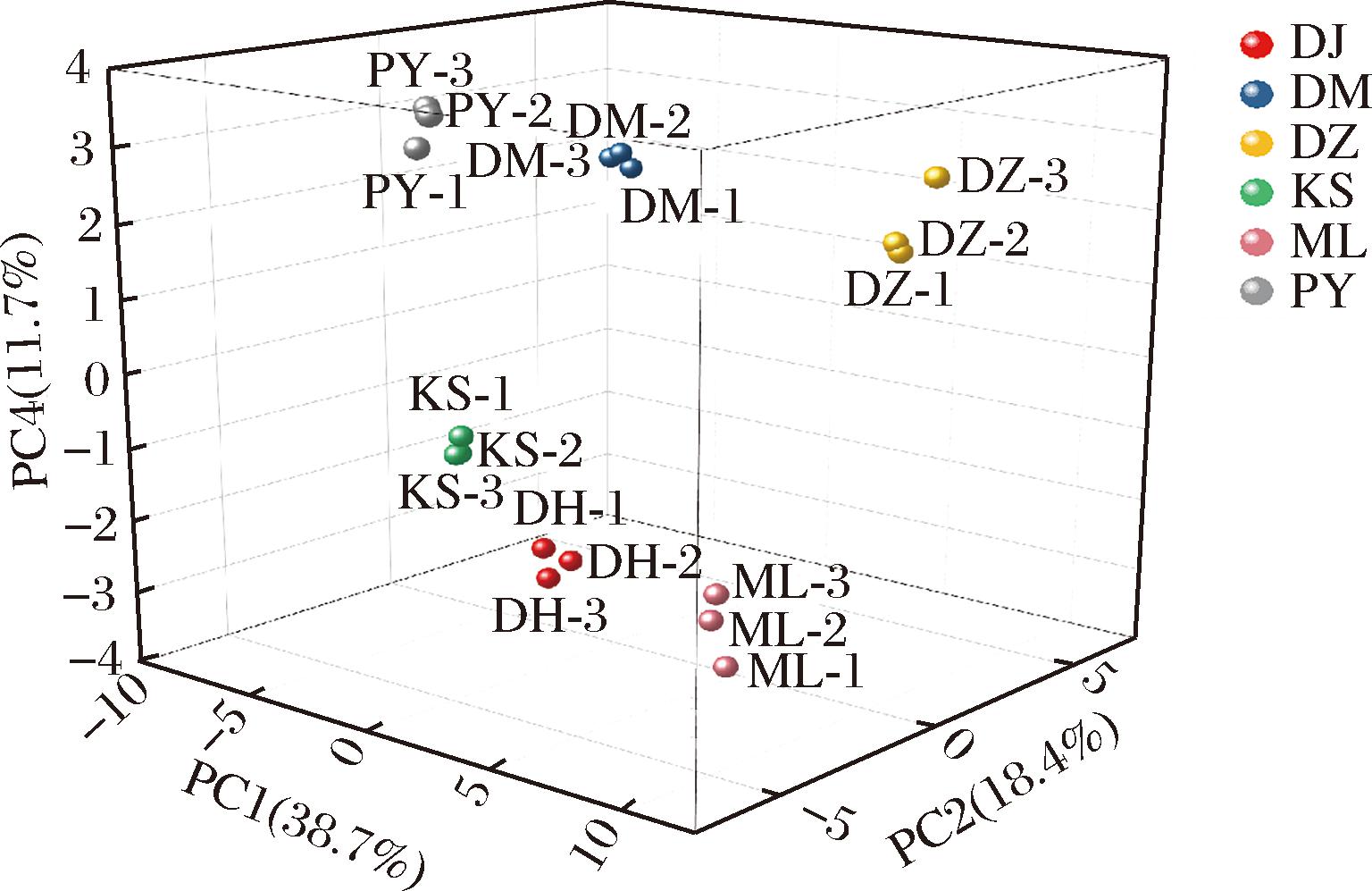
图11 玫瑰鲜花得分图(主成分1、2、4)
Fig.11 Scores of different varieties of rose (PC1, PC2, and PC4)
由上述结果可知,营养及活性成分在不同种类的玫瑰鲜花中的分布具有特征性。
2.7.2 不同产地及品种玫瑰鲜花营养及活性成分构成聚类分析
以平均为聚类方法,皮尔逊相关性为聚类类型,按变量以0~1为范围进行标准化,得到6个玫瑰品种的聚类谱系图(图12)。由图12可知,当距离为1.0时,DM玫瑰与DH玫瑰、ML玫瑰与DZ玫瑰、KS玫瑰与PY玫瑰两两聚为一类,说明其两两一组的营养及活性成分构成相似,该结论与图9 玫瑰鲜花得分图(主成分1、2)的结论一致。DM玫瑰和DH玫瑰的L-谷氨酸、L-缬氨酸、总黄酮、甘露糖、琥珀酸含量相近,ML玫瑰和DZ玫瑰的总黄酮、奎尼酸、木糖含量类似,KS玫瑰和PY玫瑰的β-胡萝卜素、L-异亮氨酸组成相近。

图12 玫瑰品种的聚类图
Fig.12 Cluster of rose varieties
3 结论与讨论
食用玫瑰的营养含量丰富,本研究通过GC-MS、LC等检测技术和差异显著性分析、主成分分析、聚类分析等分析方法对6个品种玫瑰鲜花的六类共60种营养指标进行了测定与比较,以更好地了解不同玫瑰鲜花的营养价值。结果表明,不同品种的玫瑰鲜花之间营养构成存在差异。DM玫瑰的必需氨基酸占比较高,达到了29.52%,可作为植物性氨基酸良好来源;同时其阿拉伯糖含量也处于较高水平。KS玫瑰葡萄糖含量高达28.87 mg/g,显著高于其他品种。PY玫瑰的木糖和甘露糖含量均较高。DH玫瑰的脂肪酸含量最丰富,高达29种,其中11种为不饱和脂肪酸。ML玫瑰β-胡萝卜素含量达到了15.21 μg/g,总黄酮含量达到了28.15 mg/g,总多酚含量达到了458.70 mg/kg,具有较好的抗氧化性。DZ玫瑰氨基酸总量为1 512.19 mg/100 g,19种氨基酸中有14种都显著高于其他品种;同时其有机酸含量也较为丰富。甘肃产地的3种玫瑰有机酸含量低,可溶性糖含量高,具有较好的适口性;云南产地的玫瑰β-胡萝卜素和黄酮含量较高,具备较强的抗氧化功能。
通过主成分分析和聚类分析发现,ML玫瑰和DZ玫瑰由于丰富的氨基酸构成而区别于其他几个品种;DM玫瑰与DH玫瑰因其较低的有机酸含量与较高的可溶性糖含量而区别于其他品种。
以上结论说明了玫瑰鲜花富含脂肪酸、氨基酸、有机酸及可溶性糖等营养及活性成分,具有较高的食用价值,同时为不同品种的玫瑰功能性食品开发提供了数据参考。
[1] TAKAHASHI J A, REZENDE F A G G, MOURA M A F, et al.Edible flowers:Bioactive profile and its potential to be used in food development[J].Food Research International, 2020, 129:108868.
[2] MALLICK S R, HASSAN J, HOQUE M A, et al.Color, proximate composition, bioactive compounds and antinutrient profiling of rose[J].Scientific Reports, 2024, 14(1):21690.
[3] 黄鑫, 刘晓海, 张雪春, 等.墨红玫瑰营养和化学成分、体外抗氧化和护肤活性研究[J].食品与发酵工业, 2025, 51(4):205-213. HUANG X, LIU X H, ZHANG X C, et al.Nutritional and chemical composition, in vitro antioxidant and skincare activities of Rosa‘Crimson Glory’[J].Food and Fermentation Industries, 2025, 51(4):205-213.
[4] CHENG B X, LIU X Y, LIU Y C, et al.Targeted metabolite and molecular profiling of carotenoids in rose petals:A step forward towards functional food applications[J].Food Chemistry, 2025, 464(P1):141675.
[5] WU Y, YUAN W Q, HAN X, et al.Integrated analysis of fatty acid, sterol and tocopherol components of seed oils obtained from four varieties of industrial and environmental protection crops[J].Industrial Crops and Products, 2020, 154:112655.
[6] WEI G, CHEN Y D, WANG M M, et al.Integrative application of metabolomics and transcriptomics provides new insights into carotenoid biosynthesis during Rosa rugosa hips ripening[J].Food Bioscience, 2024, 60:104422.
[7] 陶翠, 王捷, 姚玉军, 等.沙棘中白雀木醇表征方法及其分布规律[J].北京林业大学学报, 2020, 42(1):121-126.TAO C, WANG J, YAO Y J, et al.Characterization and distribution rule of quebrachitol in Hippophae rhamnoides[J].Journal of Beijing Forestry University, 2020, 42(1):121-126.
[8] 颜子曦, 李永慧, 孟德豪, 等.苦水玫瑰中49项营养及活性成分指标分析与评价[J].北京林业大学学报, 2023, 45(2):120-128.YAN Z X, LI Y H, MENG D H, et al.Analysis and evaluation of 49 nutritional and active component indexes of Kushui rose (Rosa setate × R.rugosa)[J].Journal of Beijing Forestry University, 2023, 45(2):120-128.
[9] LOPEZ-HUERTAS E.Health effects of oleic acid and long chain omega-3 fatty acids (EPA and DHA) enriched milks.A review of intervention studies[J].Pharmacological Research, 2010, 61(3):200-207.
[10] LIAO X T, XIE Y P, LIAU K Y, et al.Fat crystallization, partial coalescence and melting resistance of ice cream with lauric diacylglycerol oil[J].Journal of Food Engineering, 2025, 387:112304.
[11] ARUNIMA S, RAJAMOHAN T.Lauric acid beneficially modulates apolipoprotein secretion and enhances fatty acid oxidation via PPARα-dependent pathways in cultured rat hepatocytes[J].Journal of Exploratory Research in Pharmacology, 2018, 3(1):1-11.
[12] KHANMIRZAEI R H, DHAKAL N, BANSKOTA A H, et al.Canola meal extract as a low-cost substrate in Mortierella alpina culture for the production of arachidonic acid[J].Industrial Crops and Products, 2024, 222:119746.
[13] MENG D H, ZHAO D B, ZHAO Z C, et al.Revealing key aroma compounds and the potential metabolic pathways in sea buckthorn berries[J].Food Chemistry, 2025, 476:143430.
[14] 王小生. 必需氨基酸对人体健康的影响[J].中国食物与营养, 2005(7):48-49.WANG X S.Effects of essential amino acids in food on human body health[J].Food and Nutrition in China, 2005(7):48-49.
[15] LUO X Y, GE J W, LIU J F, et al.TFCP2, a binding protein of ATF3, promotes the progression of glioma by activating the synthesis of serine[J].Experimental Cell Research, 2022, 416(1):113136.
[16] ZHOU Y, DANBOLT N C.Glutamate as a neurotransmitter in the healthy brain[J].Journal of Neural Transmission, 2014, 121(8):799-817.
[17] TUFAIL T, AIN H B U, VIRK M S, et al.GABA (γ-aminobutyric acid) enrichment and detection methods in cereals:Unlocking sustainable health benefits[J].Food Chemistry, 2025, 464:141750.
[18] FIEDOR J, BURDA K.Potential role of carotenoids as antioxidants in human health and disease[J].Nutrients, 2014, 6(2):466-488.
[19] PONTE L G S, PAVAN I C B, MANCINI M C S, et al.The hallmarks of flavonoids in cancer[J].Molecules, 2021, 26(7):2029.
[20] 尚乐, 蒋玉梅, 钟读波, 等.不同采摘季重瓣红玫瑰花理化成分比较分析[J].食品工业科技, 2015, 36(15):365-369.SHANG L, JIANG Y M, ZHONG D B, et al.Comparison and analysis of physico- chemical components of Rose rugosa cv.‘Plena'in different harvest period[J].Science and Technology of Food Industry, 2015, 36(15):365-369.
[21] 张芮铭, 张冰炎, 邵诗举, 等.玫瑰高温水萃溶液中多酚化合物的研究及应用[J].食品工业, 2024, 45(5):15-20.ZHANG R M, ZHANG B Y, SHAO S J, et al.Study and application of polyphenol compounds in rose wastewater[J].The Food Industry, 2024, 45(5):15-20.
[22] 高嘉宁, 张丹, 何海燕, 等.不同产地、不同品种玫瑰花多酚含量及抗氧化活性研究[J].贵州科学, 2021, 39(1):1-9.GAO J N, ZHANG D, HE H Y, et al.Polyphenol content and antioxidant activity of Rosa rugosa of different varieties from different producing areas[J].Guizhou Science, 2021, 39(1):1-9.
[23] YEGANEH-ZARE S, FARHADI K, AMIRI S.Rapid detection of apple juice concentrate adulteration with date concentrate, fructose and glucose syrup using HPLC-RID incorporated with chemometric tools[J].Food Chemistry, 2022, 370:131015.
[24] ![]() L, VACEK O,
L, VACEK O, ![]() J.Principal component analysis as a tool to indicate the origin of potentially toxic elements in soils[J].Geoderma, 2005, 128(3-4):289-300.
J.Principal component analysis as a tool to indicate the origin of potentially toxic elements in soils[J].Geoderma, 2005, 128(3-4):289-300.
[25] KARA D.Evaluation of trace metal concentrations in some herbs and herbal teas by principal component analysis[J].Food Chemistry, 2009, 114(1):347-354.