根据2021年国际糖尿病联合会的报告,20~79岁的成年人中有5.37亿人患有糖尿病(diabetes mellitus,DM),预计到2045年,患糖尿病人数将增加到7.83亿[1]。DM引起的并发症很多,如视网膜病变,心血管疾病等[2],严重影响人们的日常生活。α-葡萄糖苷酶(α-glucosidase,AG)主要位于人体小肠胰腺中,通过水解低聚糖类底物的非还原末端切开α-1,4糖苷键,生成能被人体吸收的葡萄糖[3],从而引发饭后高血糖现象。由此可见,AG在人体血糖调控中起到重要作用。α-葡萄糖苷酶抑制剂(α-glucosidase inhibitor,AGI)通过有效抑制AG的活性,可延缓碳水化合物的消化,减缓葡萄糖在血液中的释放速度,从而降低餐后血糖的水平,有助于治疗及预防糖尿病及相关并发症。
目前市售的降血糖药物大多为化学合成药物,长期使用会伴随一系列副作用,如乳酸性酸中毒、贫血、胃肠系统损害、代谢营养障碍和皮肤附件损害[4]。从天然植物提取的AGI具有易吸收,无毒,无副作用,生物活性较好等性能,已成为研究的热点。目前,已从辣木籽[5]、山茶籽[6]、银杏种子[7]等天然植物中提取到有效的AGI。火麻仁(Cannabis sativa L.)含有大约30%~40%的纤维,25%~30%的油脂,25%~30%的蛋白质和6%~7%的水分,且含有丰富的维生素、卵磷脂、钙、镁等微量元素[8]。现代食品工业对火麻仁的应用主要是从火麻仁中提取火麻油,提取后剩余的火麻仁粕通常当作废弃物或动物饲料进行处理,如何实现火麻仁粕的高值化利用受到人们的关注。研究发现,火麻仁蛋白(hemp seed protein,HSP)作为火麻仁粕的主要成分,酶解处理后,可制备得到多种生物活性肽,如降血糖肽[9-11]、抗氧化肽[12-14]、降血压肽[15-17]、抗肿瘤活性肽[18]、降血脂肽[19]等等。这些功能使得HSP能运用在医药、功能性食品等领域,发挥火麻仁更大的作用。目前,对于HSP的研究主要集中在降血压肽的制备,降血糖肽的研究较少。此外,蛋白质酶解后得到的酶解液成分十分复杂,需要进行分离纯化才能获得高效的活性组分。传统的分离纯化方法步骤繁琐,耗时较长,不利于相关药物的开发研究。
本研究选用不同类型的蛋白酶对HSP进行酶解,制备火麻仁蛋白酶解液(hemp seed protein hydrolysate,HSPH),以AG抑制率为指标,通过单因素和正交实验研究其最优酶解条件,并使用课题组前期制备的新型固定化AG(3-MPBA/AG@aZIF-7/PDA)[20]对HSPH超滤液进行亲和层析,快速分离纯化出具有高活性的组分。随后利用LC-MS/MS质谱和计算机虚拟筛选技术对多肽的结构进行解析及快速筛选,并探索其抑制机理。简而言之,本研究为具有降糖作用的天然产物的开发提供理论和技术指导。
1 材料与方法
1.1 材料与试剂
火麻仁蛋白粉,广西巴马常春藤生命科技发展有限公司;碱性蛋白酶、中性蛋白酶、菠萝蛋白酶、木瓜蛋白酶,南宁庞博生物工程有限公司;胃蛋白酶(猪源)、胰蛋白酶(猪胰脏)、牛血清蛋白(bovine serum albumin,BSA),上海阿拉丁生化科技股份有限公司;AG(100 U),上海源叶生物科技有限公司;本工作中使用的所有其他化学品均为分析级。合成肽(纯度≥95%),上海吉尔生化有限公司。
1.2 仪器与设备
H1850R低温高速离心机,湖南湘仪离心机有限公司;DF-101S集热式恒温加热磁力搅拌器,上海力辰邦西仪器科技有限公司;PHS-3C pH计,上海仪电科学仪器股份有限公司;UV-2600紫外可见分光光度计,日本岛津;K3TOUCH酶标仪,飞世尔实验器材上海有限公司;BT-200SD压力泵,上海嘉鹏科技有限公司;PRACTUM224-1CN电子天平、vivaflow50膜包(100 kDa),德国赛多利斯(Sartorius)公司;Q Exactive HF-X质谱仪,赛默飞世尔科技公司。
1.3 实验方法
1.3.1 酶解液的制备
称取一定量的HSP配成质量浓度为20 g/L的水溶液,加入与HSP成一定质量比的蛋白酶溶液,在一定温度和pH下进行酶解,酶解期间通过滴加0.1 mol/L的HCl溶液或NaOH溶液调节pH,使反应体系稳定在所需的pH。酶解一定时间后放入95 ℃水浴锅中加热10 min使酶失活。冷却至室温后放入高速冷冻离心机,在8 000 r/min下离心10 min,上清液测蛋白质质量浓度后用于检测抑制AG活性。
实验选用的酶为:菠萝蛋白酶、木瓜蛋白酶、碱性蛋白酶、中性蛋白酶、胃蛋白酶和胰蛋白酶,酶解条件如表1所示。
表1 不同蛋白酶的最适酶解条件
Table 1 Optimum enzymatic hydrolysis conditions of different proteases

酶种类温度/℃pH值菠萝蛋白酶507.0木瓜蛋白酶407.0碱性蛋白酶508.5中性蛋白酶507.0胃蛋白酶 371.6胰蛋白酶 378.5
比较不同酶解液的AG抑制活性,筛选出最适的酶种类,然后通过单因素试验,考察酶解pH、加酶量、酶解温度、酶解时间对酶解效果的影响。
1.3.2 正交试验
以AG抑制率为评价指标,选取酶解环境pH、酶量、酶解温度、酶解时长为考察因素,结合单因素试验结果,选用L9(34)正交表设计试验,考察因素及水平见表2。每组实验重复3次,以平均值表示数据。使用SPSS 22.0进行以下分析:1)极差分析法:计算各因素的极差(R值),确定关键影响因素;2)方差分析法:验证各因素间的交互作用,分析组间差异的显著性(F值),以及结果由随机误差导致的几率(P值)。
表2 火麻仁蛋白酶解正交试验设计
Table 2 Orthogonal experimental design of hemp seed proteolysis

水平因素A(pH)B(酶量)/(U/g)C(温度)/℃D(时间)/h195 000350.5276 000401.0387 000451.5
1.3.3 蛋白质浓度的测定
参考夏玉宇[21]的方法制备PBS:称取3.581 4 g的Na2HPO4·12H2O,溶于100 mL去离子水中,配制得到0.1 mol/L磷酸氢二钠溶液。称取1.36 1 g的KH2PO4,溶于100 mL去离子水中,配制得到0.1 mol/L磷酸二氢钾溶液。取46 mL的0.1 mol/L Na2HPO4·12H2O溶液和53 mL的0.1 mol/L KH2PO4溶液混合均匀,即可得到pH值为6.8的0.1 mol/L PBS。取50 mL的0.1 mol/L Na2HPO4·12H2O溶液和50 mL的0.1 mol/L KH2PO4溶液混合均匀,即可得到pH值为7.0的0.1 mol/L PBS。
以BSA作为标准蛋白,采用紫外吸收法做标准曲线。用pH值为7.0的0.1 mol/L PBS配制0.1、0.2、0.4、0.6、0.8、1.0 mg/mL的BSA溶液,在280 nm波长检测吸光值,绘制标准曲线,得到拟合方程。
样品中的蛋白质含量采用相同的方法进行测定:取上清液稀释一定倍数后,在280 nm波长进行吸光度的测定,然后将吸光值代入拟合方程即可计算得到样品中的蛋白质浓度。
1.3.4 AG抑制活性的测定
根据REN等[9]的方法测定AG抑制活性:取20 μL 0.1 mol/L PBS(pH 6.8)和20 μL 1 U /mL的AG溶液混匀,于37 ℃恒温预热10 min。加入100 μL 3 mmol/L对硝基苯基-α-D-吡喃葡萄糖苷(p-nitrophenyl-α-D-glucopyranoside,PNPG)溶液混匀,37 ℃下恒温反应10 min,然后加入400 μL 0.4 mol/L Na2CO3溶液终止反应。用酶标仪测定反应液在405 nm波长处的吸光值,按照下列公式(1)计算AG抑制率:
AG抑制率![]()
(1)
式中:ODA是用等量缓冲液代替被测样品的反应液吸光度;ODB为加了被测样品的反应液吸光度;ODC为用等量缓冲液代替被测样品和PNPG溶液的反应液吸光度。
半抑制浓度(half maximal inhibitory concentration,IC50)是指AG被抑制50%时所需的抑制剂浓度。IC50越小,说明抑制效果越好。
1.3.5 火麻仁AG抑制肽的亲和纯化
用100 kDa的膜包对HSPH进行超滤,收集低于100 kDa的穿透液(HSPH100 kDa)。
参考本课题组前期已研究的方法[20]制备生物复合材料3-MPBA/AG@aZIF-7/PDA(MGZP),并将其作为亲和介质用于AGI的亲和分离纯化。
称取15 mg左右的MGZP,按5∶1(mg∶mL)的比例与0.5 mg/mL的HSPH100 kDa(用pH值为7.0的0.1 mol/L PBS稀释形成pH 7.0的吸附环境)充分混合,在室温下振荡吸附30 min。随后用2 mol/L NaCl溶液洗脱60 min得到洗脱液(HSPH100 kDa-MGZP)。
1.3.6 AG抑制肽的筛选和鉴定
1.3.6.1 活性肽的质谱鉴定
利用液相质谱联用质谱仪对收集得到的HSPH100 kDa-MGZP进行分析。使用的流动相为A(0.1%甲酸-水溶液,体积分数)和B(0.1%甲酸-乙腈水溶液,体积分数),0~50 min,B液线性梯度从4%~50%;50~54 min,B液线性梯度从50%~100%;54~60 min,B液维持在100%。随后用软件MaxQuant 1.5.5.1检索相应的数据库得到相应的氨基酸序列。
1.3.6.2 活性肽的筛选和性能预测
a)使用在线工具Peptide Ranker(https://distilldeep.ucd.ie/PeptideRanker/),对多肽生物活性预测评分进行排序,筛选出评分大于0.5的多肽。评分越接近1,就越有可能具有较高的生理活性。
b)使用Toxin Pred在线工具(https://webs.iiitd.edu.in/raghava/toxinpred/index.html)分析毒性和亲疏水性[22]。
c)使用ADMET lab(https://admetmesh.scbdd.com/)预测ACE抑制肽的吸收、分布、代谢、排泄和毒性性质[23]。
1.3.7 分子对接分析
a)小分子配体的准备:用Chemdraw3D根据氨基酸序列的结构式进行构建,使用MMFF94力场对所构建的多肽进行能量最小化优化,保存为mol2格式。在PyMOL转化为pdb格式后导入AutoDock Tools[24]并添加原子电荷和分配原子类型,保存为pdbqt文件。
b)AG的准备:在RCSB网站(http://www.rcsb.org/pdb/home/home.do)下载AG的3D模型(PDB ID:4j5t),利用PyMOL除去小分子配体,随后在AutoDock Tools中除水、加氢、加电荷并设置原子类型,保存为pdbqt文件。
c)AG与AGI对接:配体和受体在AutoDock Vina中进行半柔性对接,设置网格框全覆盖酶,对接后的结果于LigPlot进行可视化分析。
1.4 数据处理
所有数据均为3次平行试验数据,采用“平均值±标准差”表示。使用Microsoft Office 2010、Origin 8.0、SPSS 22.0、LigPlot软件对数据进行整理和作图。
2 结果与分析
2.1 BSA标准曲线
以BSA为标准品,用280 nm紫外光吸收法绘制其标准曲线,结果如图1所示。在范围为0.2~1.0 mg/mL,所测得的吸光值与蛋白质质量浓度有良好的线性关系。线性拟合,得到的方程为:y=0.595 29x-0.007 14,R2=0.994 52。
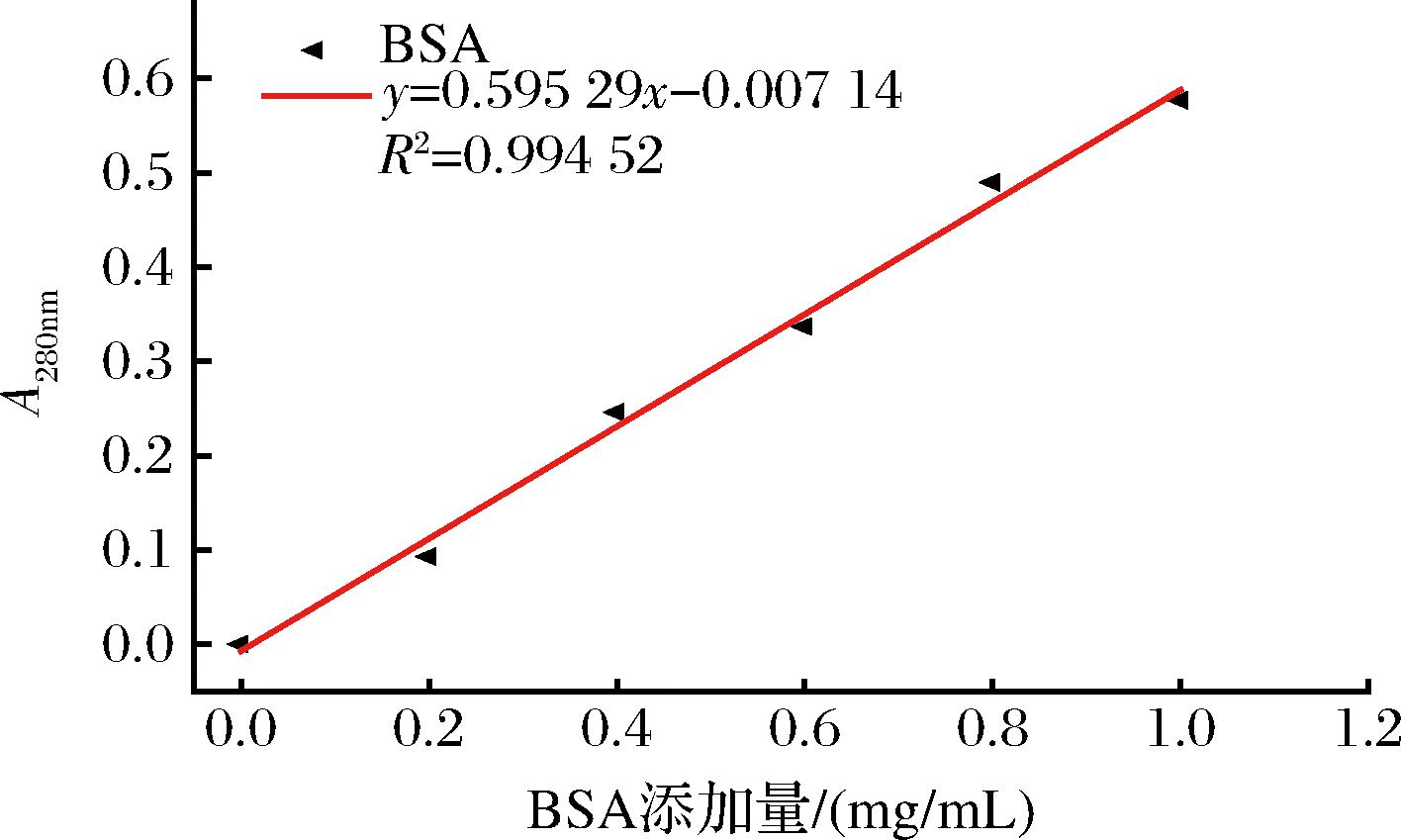
图1 BSA标准曲线
Fig.1 BSA standard curve
2.2 酶解液制备条件优化
2.2.1 单因素试验结果
图2-a为6种蛋白酶对HSP水解后,得到的HSPH对AG的抑制效果。菠萝蛋白酶与胃蛋白酶酶解产生的HSPH的AG抑制率较好,其中菠萝蛋白酶对AG抑制率为(53.58±2.66)%,后续将使用菠萝蛋白酶对HSP进行酶解。
酶解pH对HSPH的AG抑制率的影响如图2-b所示。在pH值为7.0时,酶解得到的HSPH抑制效果最好,为(53.58±2.66)%。这可能是因为酸性环境下HSP没有充分溶解在溶液中,活性片段大多未能被酶解,pH增大有利于HSP的溶解[25]。但当pH值高于7.0时,碱性对菠萝蛋白酶的活性有抑制作用,使得酶解水解度降低,活性片段未被水解出来。因此,酶解pH值选择为7.0进行后续的酶解实验。
图2-c为酶量对HSPH的AG抑制率影响。当菠萝蛋白酶与HSP质量比为6 000 U/g时,AG抑制率达到最高,为(53.58±2.66)%。这是因为当酶量低的时候,相同时间内菠萝蛋白酶对HSP的酶解不完全。随着酶量的增加,HSPH对AG抑制率亦增加;但当酶量过高,会造成过度酶解,活性多肽被分解成更小的肽段,活性反而下降。因此,酶与HSP质量比选择为6 000 U/g进行后续的酶解实验。
酶解温度对HSPH的AG抑制率影响如图2-d所示。随着温度的升高,HSPH对AG的抑制率先升高后降低,在40 ℃时,AG抑制率最高,达到(61.97±2.63)%。继续升高温度,菠萝蛋白酶在长时间的高温下容易失活,从而导致酶解效果降低,酶解液的AG抑制率下降。因此,选择40 ℃进行后续的酶解实验。
由图2-e可知,随着酶解时间的延长,HSPH对AG的抑制率先升后降。酶解1 h达到最大的抑制率,为(70.55±2.74)%。随后HSPH对AG的抑制率随着酶解时间的延长而降低。这可能是因为,随着酶解时间的延长,释放的活性肽增多,但时间过长会导致过度酶解。因此,酶解时间选择为1 h。
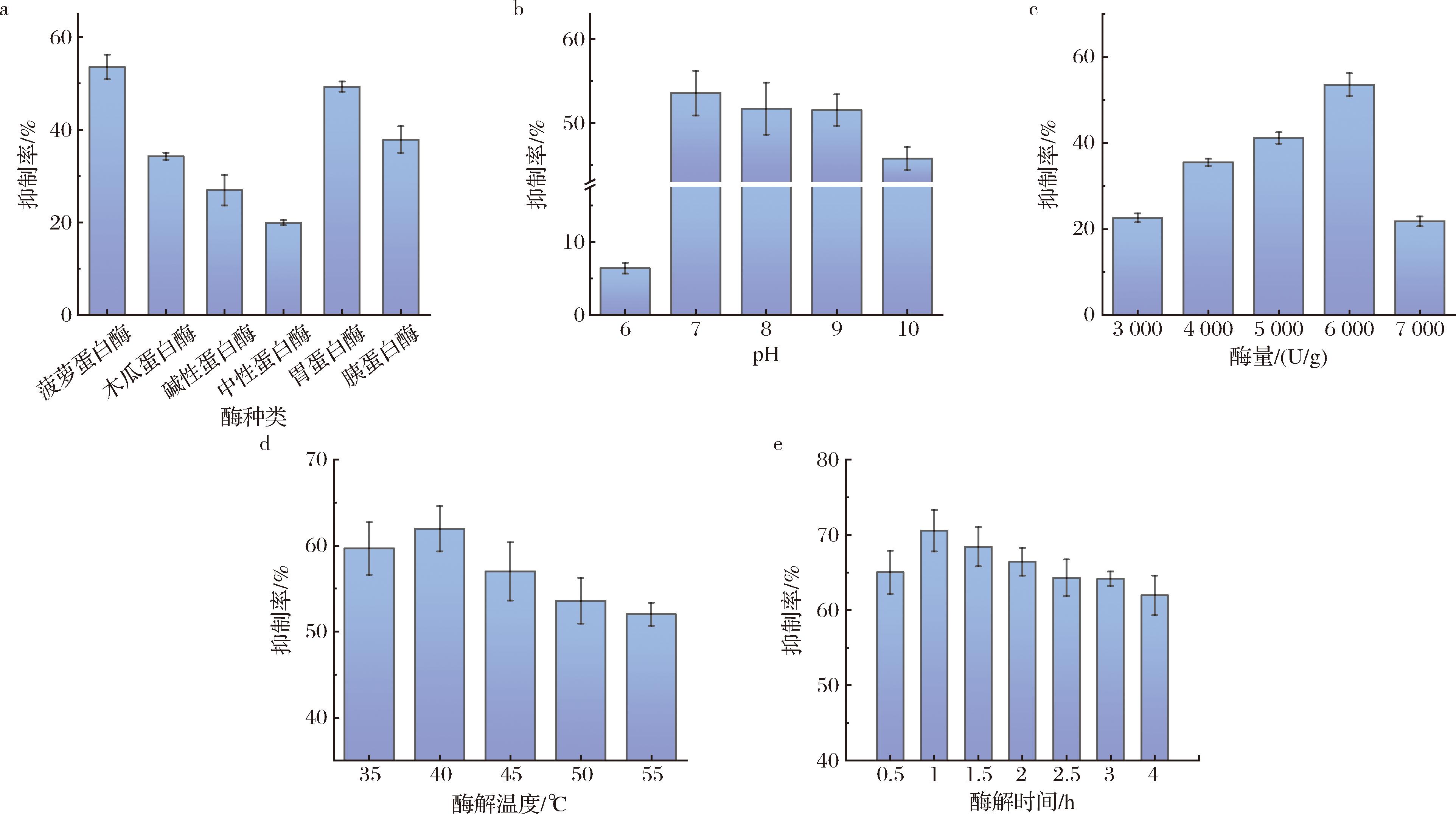
a-酶种类;b-酶解pH;c-酶量;d-酶解温度;e-酶解时长
图2 单因素对AG抑制率的影响
Fig.2 Effect of single factor on AG inhibition rate
2.2.2 正交试验结果
采用L9(34)正交试验表划分各个试验的因素-水平,以pH(A)、酶量(B)、温度(C)、时间(D)为因素设计正交试验进一步优化。各因素的直观分析表和方差分析表如表3和表4所示。
表3 正交实验结果
Table 3 Design and results of the L9 (34) orthogonal test
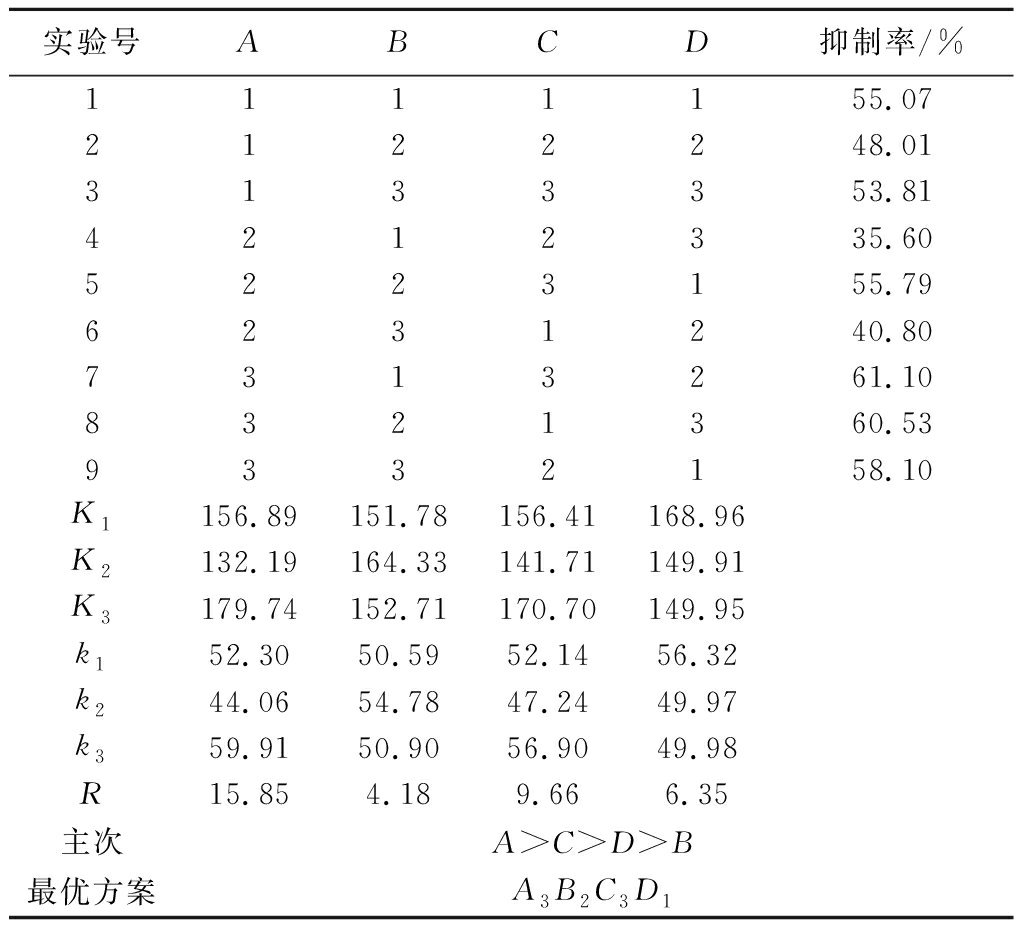
实验号ABCD抑制率/%1111155.07 2122248.01 3133353.81 4212335.60 5223155.79 6231240.80 7313261.10 8321360.53 9332158.10 K1156.89 151.78 156.41 168.96K2132.19 164.33 141.71 149.91K3179.74 152.71 170.70 149.95k152.30 50.59 52.14 56.32k244.06 54.78 47.24 49.97k359.91 50.90 56.90 49.98R15.85 4.18 9.666.35主次A>C>D>B最优方案A3B2C3D1
表4 正交实验方差分析结果
Table 4 ANOVA results of the orthogonal test
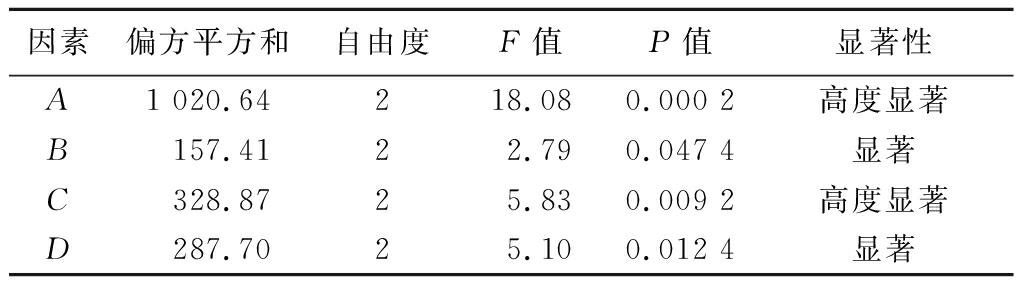
因素偏方平方和自由度F值P值显著性A1 020.64218.080.000 2高度显著B157.4122.790.047 4显著C328.8725.830.009 2高度显著D287.7025.100.012 4显著
注:n=3/组,P<0.05表示显著,P<0.01表示高度显著。
在实验范围内,各因素对AG抑制活性的影响顺序为:pH>温度>时间>酶量。实验各因素的P值皆小于0.05,说明4个因素皆有显著性差异。根据分析结果,最优酶解条件为A3B2C3D1,即在pH值为8.0,温度为45 ℃的环境下,加入6 000 U/g的酶量酶解0.5 h,得到的酶解液对AG抑制率最高。
REN等[9]利用碱性蛋白酶对HSP进行酶解,得到的酶解液对AG的IC50为(4.15±0.16) mg/mL;CAI等[25]用碱性蛋白酶对HSP酶解,产物对AG的IC50为2.83 mg/mL;本文在最优酶解条件下得到的HSPH的IC50为(2.65±0.063) mg/mL,对AG抑制效果良好,后续可用于降糖功能性食品的开发。此外,有研究发现不同工艺制备得到的火麻仁蛋白水解物还具有抗氧化[12-14]、降血压[15-17]、抗疲劳[26]、抗炎[27]、免疫调节[28]等生理功能。这些研究成果为火麻仁蛋白的高值化利用提供了重要的理论和技术支持。
2.3 火麻仁AG抑制肽的亲和纯化
采用100 kDa的膜包对HSPH进行超滤,收集<100 kDa的穿透液(HSPH100 kDa),并利用MGZP作为亲和介质进行进一步分离纯化,得到洗脱液HSPH100 kDa-MGZP。HSPH、HSPH100 kDa、HSPH100 kDa-MGZP对AG的IC50如表5所示。
表5 超滤和亲和吸附对AG抑制效果的影响
Table 5 Effects of ultrafiltration and affinity adsorption on AG inhibition
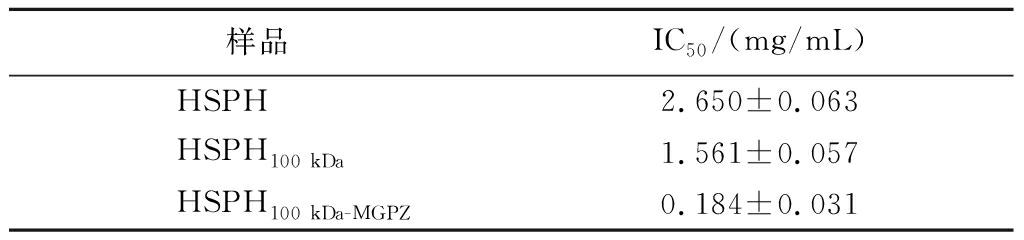
样品IC50/(mg/mL)HSPH2.650±0.063HSPH100 kDa1.561±0.057HSPH100 kDa-MGPZ0.184±0.031
结果表明,HSPH超滤后得到的HSPH100 kDa的IC50值更低,从(2.65±0.063) mg/mL下降到(1.561±0.057) mg/mL,这是因为大多AGI都是小分子多肽[29],通过超滤可用将大于100 kDa的组分分离。亲和纯化得到的HSPH100 kDa-MGPZ的IC50为(0.184±0.031) mg/mL,AG抑制活性得到了显著提高,说明MGZP能够利用包埋在中心的AG对AGI进行特异性吸附,达到快速分离纯化的目的。与传统纯化方法相比,亲和层析利用待分离目标分子与配体间的特异性相互作用实现分离目的,特别适合于目标分子的快速分离筛选[30-31]。WANG等[32]利用AG亲和超滤,从黄芪提取物中成功分离纯化出8个化合物,其中有4个化合物对AG的抑制效果比阿卡波糖更强。DENG等[33]使用琼脂糖凝胶固定化AG,从香附子提取物中迅速分离纯化出5种对AG有抑制作用的天然活性成分,亦证实了亲和层析法比传统分离纯化方法更高效。
2.4 活性肽的鉴定、筛选及抑制活性分析
采用质谱技术分析HSPH100 kDa-MGZP的氨基酸序列,随后进行多肽功能预测,并结合BioGPS在线工具与已报道过的AGI结构进行对比,得到5条评分大于0.5的新颖的多肽氨基酸序列。按照筛选出来的多肽氨基酸序列进行固相合成,用于验证其体外AG抑制活性,结果如表6所示。5个多肽的氨基酸序列分别为SLFK、YFK、KFY、KFL、SWG。这些多肽均对AG有抑制作用,其中KFY的抑制活性最强,IC50为(3.10±0.22) mmol/L。
表6 氨基酸序列虚拟筛选参数
Table 6 Virtual screening parameters of amino acid sequence
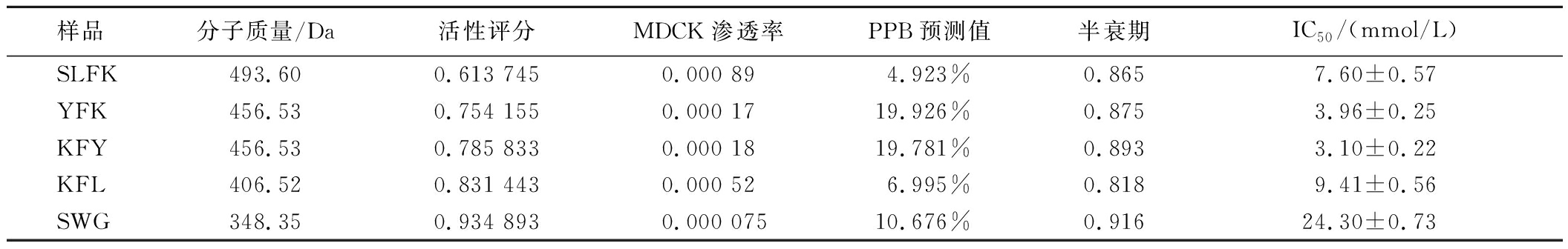
样品分子质量/Da活性评分MDCK渗透率PPB预测值半衰期IC50/(mmol/L)SLFK493.600.613 7450.000 894.923%0.8657.60±0.57YFK456.530.754 1550.000 1719.926%0.8753.96±0.25KFY456.530.785 8330.000 1819.781%0.8933.10±0.22KFL406.520.831 4430.000 526.995%0.8189.41±0.56SWG348.350.934 8930.000 07510.676%0.91624.30±0.73
2.5 活性肽抑制机理研究
利用AutoDock Vina进行半柔性对接,研究活性肽与AG之间的作用机理,结合能越小则代表着肽段和受体蛋白的结合越稳定。此外,为进一步了解多肽与AG之间的结合位点和相互作用等信息,利用LigPlot 软件对对接结果进行可视化分析,结果如表7和附图1(https://doi.org/10.13995/j.cnki.11-1802/ts.042380)所示。5条多肽与AG的结合能为-6.5~-8.2 kcal/mol,表明它们与AG的亲和力良好,能形成稳定的复合结构。
表7 多肽与AG的氢键结合位点
Table 7 Hydrogen bonding sites of polypeptide and AG
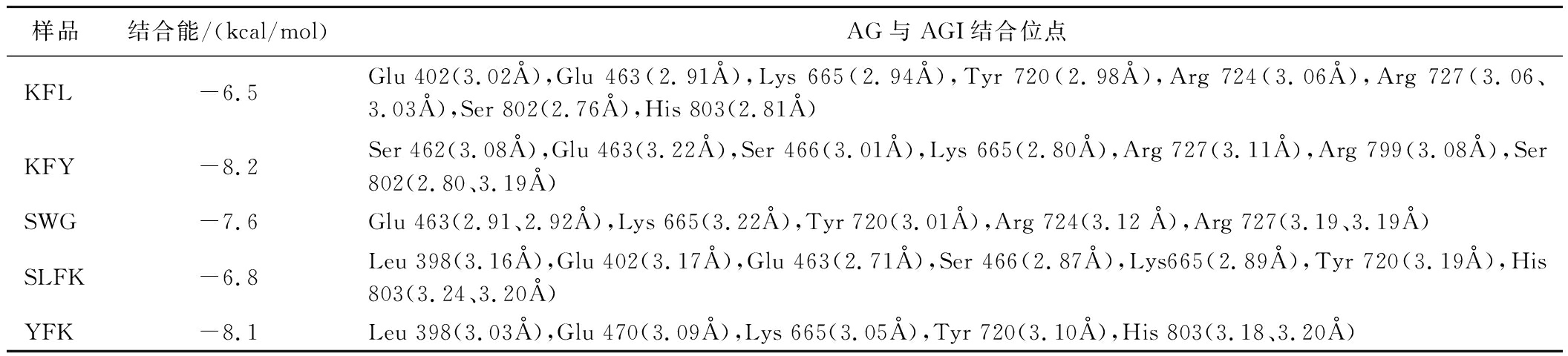
样品结合能/(kcal/mol)AG与AGI结合位点KFL-6.5Glu 402(3.02Å),Glu 463(2.91Å),Lys 665(2.94Å),Tyr 720(2.98Å),Arg 724(3.06Å),Arg 727(3.06、3.03Å),Ser 802(2.76Å),His 803(2.81Å)KFY-8.2Ser 462(3.08Å),Glu 463(3.22Å),Ser 466(3.01Å),Lys 665(2.80Å),Arg 727(3.11Å),Arg 799(3.08Å),Ser 802(2.80、3.19Å)SWG-7.6Glu 463(2.91、2.92Å),Lys 665(3.22Å),Tyr 720(3.01Å),Arg 724(3.12 Å),Arg 727(3.19、3.19Å)SLFK-6.8Leu 398(3.16Å),Glu 402(3.17Å),Glu 463(2.71Å),Ser 466(2.87Å),Lys665(2.89Å),Tyr 720(3.19Å),His 803(3.24、3.20Å)YFK-8.1Leu 398(3.03Å),Glu 470(3.09Å),Lys 665(3.05Å),Tyr 720(3.10Å),His 803(3.18、3.20Å)
RAM REZ等[34]提出AGI对AG的抑制依赖于氢键的存在。此外,YE等[35]证明疏水相互作用也有助于增强抑制AG活性,因为抑制肽与酶的疏水相互作用会增强抑制肽与酶之间的亲和力,从而结合位点的稳定性得到增强[36]。
REZ等[34]提出AGI对AG的抑制依赖于氢键的存在。此外,YE等[35]证明疏水相互作用也有助于增强抑制AG活性,因为抑制肽与酶的疏水相互作用会增强抑制肽与酶之间的亲和力,从而结合位点的稳定性得到增强[36]。
由表7的结果可知,抑制活性最强的KFY与AG的结合能最低,为-8.2 kcal/mol,与AG上的Ser 462、Glu 463、Ser 466、Lys 665、Arg 727、Arg 799、Ser 802形成了8个氢键,与Met 401、Glu 402、Tyr 720、Asp 724、Tyr 728、Pro 731、His 803形成了疏水相互作用。SLFK、KFL、YFK和SWG也都能与AG上的不同氨基酸残基形成至少6个氢键,同时存在多个疏水相互作用。此外,AG上的Lys 665与每个多肽均形成了氢键,而Glu 463、Tyr 720、Arg 727、His 803也与多个AGI形成氢键。研究表明,电负性越强的原子,形成的氢键也越强,分子间的结合就越牢固。Lys、Arg和His的侧链含氨基(—NH2),氨基中的氮原子电负性极强,极易吸引氢原子形成氢键。Tyr含有羟基(—OH),以及Glu侧链羧基(—COOH)上皆含有电负性极强的氧原子,这可能是其容易形成氢键的原因。这些相互作用是多肽与AG形成稳定复合物的关键因素。
HUAU等[37]利用分子对接对油棕叶中分离纯化出的7种AGI进行研究,这些AGI均与AG活性位点中的特定氨基酸(特别是Arg 647、Glu 271、Lys 765、Pro 676)形成氢键。LIU等[38]通过分子对接模拟发现具有AG抑制效果的紫杉叶素和AG的氨基酸残基(Glu 429、Asp 568和Glu 771)之间通过氢键连接。本文中的5个AGI,通过氢键与AG结合的结合位点氨基酸,与HAU等[37]和LIU等[38]研究发现的AG氨基酸残基均包含了Glu、Arg、Lys等氨基酸,说明这些氨基酸有可能是AG活性中心的关键氨基酸。
3 结论
本文以火麻仁蛋白为原料,采用酶解法制备AGI,并利用超滤和亲和层析对AGI进行分离纯化。经过单因素试验和正交试验优化得到的最优酶解条件为:酶解pH值为8.0,酶解温度为45 ℃,菠萝蛋白酶与蛋白质的比例为6 000 U/g,酶解时间为0.5 h。在此条件下制备得到的火麻仁酶解液对AG的IC50为(2.65±0.063) mg/mL。酶解液经过超滤和亲和层析,得到洗脱液的IC50为(0.184±0.031) mg/mL,实现了AGI的快速筛选富集。使用液相质谱联用质谱仪鉴定并虚拟筛选出了5种具有潜在AG抑制活性的新型多肽(KFY、YFK、SLFK、KFL、SWG)。体外活性测定及分子对接表明,5种多肽均具有AG抑制活性,且表现出良好的AG结合能力,其中KFY活性最强,IC50为(3.10±0.22) mmol/L。本研究采用的AGI的制备和筛选方法简便、快捷、高效,对天然活性产物的制备和相关药物的研发有着重要的指导意义。
[1] SUN H, SAEEDI P, KARURANGA S, et al.IDF diabetes atlas:Global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045[J].Diabetes Research and Clinical Practice, 2022, 183:109119.
[2] NICKERSON H D, DUTTA S.Diabetic complications:Current challenges and opportunities[J].Journal of Cardiovascular Translational Research, 2012, 5(4):375-379.
[3] SUN L J, SONG Y, CHEN Y J, et al.The galloyl moiety enhances the inhibitory activity of catechins and theaflavins against α-glucosidase by increasing the polyphenol-enzyme binding interactions[J].Food &Function, 2021, 12(1):215-229.
[4] 向玉芳, 孙辉, 陈月, 等.2型糖尿病降糖药不良反应及联合用药情况分析[J].中国药物警戒, 2022, 19(3):313-316.XIANG Y F, SUN H, CHEN Y, et al.Medication safety and combined medication in patients with type 2 diabetes mellitus[J].Chinese Journal of Pharmacovigilance, 2022, 19(3):313-316.
[5] 魏光强, 赵娜, 范尧珠, 等.响应面法优化辣木籽降糖肽的酶法制备工艺及其体外活性评价[J].食品工业科技, 2021, 42(24):136-143.WEI G Q, ZHAO N, FAN Y Z.et al.Optimization of enzymatic preparation process of hypoglycemic peptide from Moringa oleifera seeds by response surface methodology and its hypoglycemic activities evaluation in vitro[J].Science and Technology of Food Industry, 2021, 42(24):136-143.
[6] ZHANG Y P, WU F H, HE Z P, et al.Optimization and molecular mechanism of novel α-glucosidase inhibitory peptides derived from Camellia seed cake through enzymatic hydrolysis[J].Foods, 2023, 12(2):393.
[7] WANG X, DENG Y J, XIE P J, et al.Novel bioactive peptides from Ginkgo biloba seed protein and evaluation of their α-glucosidase inhibition activity[J].Food Chemistry, 2023, 404:134481.
[8] 国家药典委员会. 中华人民共和国药典-一部[M].北京:中国医药科技出版社, 2015.National Pharmacopoeia Committee.People’s Republic of China (PRC) Pharmacopoeia[M].China Medical Science and Technology Press, 2015.
[9] REN Y, LIANG K, JIN Y Q, et al.Identification and characterization of two novel α-glucosidase inhibitory oligopeptides from hemp (Cannabis sativa L.) seed protein[J].Journal of Functional Foods, 2016, 26:439-450.
[10] MOLLARD R C, JOHNSTON A, SERRANO LEON A, et al.Acute effects of hemp protein consumption on glycemic and satiety control:Results of 2 randomized crossover trials[J].Applied Physiology, Nutrition, and Metabolism, 2021, 46(8):887-896.
[11] CAI L, WU S W, JIA C G, et al.Active peptides with hypoglycemic effect obtained from hemp (Cannabis sativa L) protein through identification, molecular docking, and virtual screening[J].Food Chemistry, 2023, 429:136912.
[12] TANG C H, WANG X S, YANG X Q.Enzymatic hydrolysis of hemp (Cannabis sativa L.) protein isolate by various proteases and antioxidant properties of the resulting hydrolysates[J].Food Chemistry, 2009, 114(4):1484-1490.
[13] ZHANG J J, GRIFFIN J, LI Y H, et al.Antioxidant properties of hemp proteins:From functional food to phytotherapy and beyond[J].Molecules, 2022, 27(22):7924.
[14] 孙晓波, 刘卫萍, 王小明, 等.火麻籽粕多酚微波辅助提取工艺及其抗氧化活性[J].食品研究与开发, 2022, 43(16):111-118. SUN X B, LIU W P, WANG X M, et al.Microwave-assisted extraction process and antioxidant activity of polyphenols from hemp seed meal. Food Research and Development, 2022, 43(16):111-118.
[15] ORIO L P, BOSCHIN G, RECCA T, et al.New ACE-inhibitory peptides from hemp seed (Cannabis sativa L.) proteins[J].Journal of Agricultural and Food Chemistry, 2017, 65(48):10482-10488.
[16] MALOMO S A, ONUH J O, GIRGIH A T, et al.Structural and antihypertensive properties of enzymatic hemp seed protein hydrolysates[J].Nutrients, 2015, 7(9):7616-7632.
[17] SAMAEI S P, MARTINI S, TAGLIAZUCCHI D, et al.Antioxidant and angiotensin Ⅰ-converting enzyme (ACE) inhibitory peptides obtained from alcalase protein hydrolysate fractions of hemp (Cannabis sativa L.) bran[J].JOurnal of Agricultural and Food Chemistry, 2021, 69(32):9220-9228.
[18] WEI L H, DONG Y, SUN Y F, et al.Anticancer property of Hemp Bioactive Peptides in Hep3B liver cancer cells through Akt/GSK3β/β-catenin signaling pathway[J].Food Science &Nutrition, 2021, 9(4):1833-1841.
[19] ZANONI C, AIELLO G, ARNOLDI A, et al.Hempseed peptides exert hypocholesterolemic effects with a statin-like mechanism[J].Journal of Agricultural and Food Chemistry, 2017, 65(40):8829-8838.
[20] 刘精杏, 李焯颖, 陈婷, 等. 3-MPBA/AG@aZIF-7/PDA的制备及其对α-葡萄糖苷酶抑制肽的吸附. 食品与发酵工业, 2025, 51(12):191-198.LIU J X, LI Z Y, CHEN T, et al. Preperation of 3-MPBA/AG@aZIF-7/PDA and their application in adsorption of α-glucosidase inhibitory peptides. Food and Fermentation Industries, 2025, 51(12):191-198.
[21] 夏玉宇. 化学实验室手册[M].北京:化学工业出版社, 2008.XIA Y Y.Handbook of Chemistry Laboratory[M].BEI JING:Chemical industry press,2008.
[22] GUPTA S, KAPOOR P, CHAUDHARY K, et al. Peptide toxicity prediction. Computational Peptidology. New York, NY: Springer New York, 2014:143-157.
[23] XIONG G L, WU Z X, YI J C, et al.ADMETlab 2.0:An integrated online platform for accurate and comprehensive predictions of ADMET properties[J].Nucleic Acids Research, 2021, 49(W1):W5-W14.
[24] JAGHOORI M M, BLEIJLEVENS B, OLABARRIAGA S D.1001 Ways to Run AutoDock Vina for virtual screening[J].Journal of Computer-Aided Molecular Design, 2016, 30(3):237-249.
[25] CAI L, WU S W, JIA C G, et al.Hydrolysates of hemp (Cannabis sativa L.) seed meal:Characterization and their inhibitory effect on α-glucosidase activity and glucose transport in Caco-2 cells[J].Industrial Crops and Products, 2023, 205:117559.
[26] ZHU Y, HUANG Y Y, LI M Y, et al.High Fischer ratio peptide of hemp seed:Preparation and anti-fatigue evaluation in vivo and in vitro[J].Food Research International, 2023, 165:112534.
[27] TORRECILLAS-LOPEZ M, RIVERO-PINO F, TRIGO P, et al.Immunomodulatory properties of hempseed oligopeptides in an LRRK2-associated Parkinson’s disease animal model[J].Food &Function, 2024, 15(22):11115-11128.
[28] MONTSERRAT-DE LA PAZ S, VILLANUEVA-LAZO A, MILLAN F, et al.Production and identification of immunomodulatory peptides in intestine cells obtained from hemp industrial by-products[J].Food Research International, 2023, 174(Pt 1):113616.
[29] IBRAHIM M A, BESTER M J, NEITZ A W H, et al.Structural properties of bioactive peptides with α-glucosidase inhibitory activity[J].Chemical Biology &Drug Design, 2018, 91(2):370-379.
[30] 冯学珍. 裙带菜ACE抑制肽的分离纯化及其抑制机理研究[D].南宁:广西大学, 2022.Feng X Z.Purification and action mechanism of ACE inhibitory peptides form WAKAME (Undaria pinnatifida) [D].Nanning:Guangxi University, 2022.
[31] LAN X D, LIAO D K, WU S G, et al.Rapid purification and characterization of angiotensin converting enzyme inhibitory peptides from lizard fish protein hydrolysates with magnetic affinity separation[J].Food Chemistry, 2015, 182:136-142.
[32] WANG H P, LIN Z Z, ZHAO C, et al.Screening of potential α-glucosidase inhibitors from Astragalus membranaceus by affinity ultrafiltration screening coupled with UPLC-ESI-Orbitrap-MS method[J].Journal of Asian Natural Products Research, 2024, 26(11):1348-1357.
[33] DENG S R, XIA L B, ZHU X M, et al.Natural alpha-glucosidase inhibitors rapid fishing from Cyperus rotundus using immobilized enzyme affinity screening combined with UHPLC-QTOF MS[J].Iranian Journal of Pharmaceutical Research, 2019, 18(3):1508-1515.
[34] RAM REZ FUENTES L, RICHARD C, CHEN L Y.Sequential alcalase and flavourzyme treatment for preparation of α-amylase, α-glucosidase, and dipeptidyl peptidase (DPP)-Ⅳ inhibitory peptides from oat protein[J].Journal of Functional Foods, 2021, 87:104829.
REZ FUENTES L, RICHARD C, CHEN L Y.Sequential alcalase and flavourzyme treatment for preparation of α-amylase, α-glucosidase, and dipeptidyl peptidase (DPP)-Ⅳ inhibitory peptides from oat protein[J].Journal of Functional Foods, 2021, 87:104829.
[35] YE C Y, ZHANG R F, DONG L M, et al.α-Glucosidase inhibitors from brown rice bound phenolics extracts (BRBPE):Identification and mechanism[J].Food Chemistry, 2022, 372:131306.
[36] LU H, XIE T T, WU Q, et al.Alpha-glucosidase inhibitory peptides:Sources, preparations, identifications, and action mechanisms[J].Nutrients, 2023, 15(19):4267.
[37] HUAN H, YEE C, KOON Y, et al.Oil palm leaf protein hydrolysate and its novel peptides as alternative plant-based α-glucosidase inhibitors[J].International Journal of Biological Macromolecules, 2025, 291:138897.
[38] LIU J, WANG X S, GENG S, et al.Inhibitory mechanism of taxifolin against α-glucosidase based on spectrofluorimetry and molecular docking[J].Natural Product Communications, 2017, 12(11):1725-1728.