食用玫瑰属蔷薇科植物,富含花色苷、酚酸、黄酮等功能性成分,具有抗氧化、抗肿瘤、抗辐射、抑菌和延缓衰老等功能。还含有多糖、维生素、氨基酸、膳食纤维等多种营养成分,这些成分就决定了食用玫瑰具有很高的营养价值和药用价值[1]。我国玫瑰花种植面积广,在采摘期往往因采量大,造成销售困难、产品积压,导致腐败变质。当今市场,玫瑰花主要用于提炼精油、制作玫瑰花茶、玫瑰花饼等,产品新种类有待开发。
益生菌发酵饮料可以改善食品的风味和口感,提高营养价值,延长保质期,比未发酵的饮料更受欢迎。乳酸菌是发酵饮料中最常用的一类菌种,它具有较快的发酵速度,能在短时间内将糖类转化为有机酸,还能产生多种芳香化合物,赋予发酵饮料独特的香味。它具有较强的耐酸能力,能抑制病原体的生长和繁殖,增强机体的免疫力[2]。它代谢所产生的生物活性多肽和短链脂肪酸能够促进肠道蠕动、营养物质吸收和降低胆固醇含量,对人体具有很大的益处。酵母菌也经常应用于发酵饮料,它可以产生具有自由基清除能力的超氧化物歧化酶,提高体系的抗氧化能力。它产生的纤维素酶能消化植物细胞壁中的纤维素,促进活性成分的释放。它还能产生丰富的酯类和醇类物质,增强发酵饮料的花香和果香[3]。有研究指出,在共同发酵中,酵母菌可以为乳酸菌提供丙酮酸、氨基酸等营养物质[4],乳酸菌还可以利用酵母菌发酵产生的代谢产物,以促进自身的生长,效果可能优于单菌发酵。且共发酵能更好地控制酒精含量,避免出现只有酵母菌发酵产生较多的酒精。
目前,玫瑰花发酵的研究取得了一定进展,但多以单菌发酵为主,张婷阳[5]使用酿酒酵母和乳酸菌混合发酵玫瑰花渣酵素,抗氧化能力得到提升。目前,还未见非酿酒酵母和乳酸菌共发酵玫瑰花饮料的相关探究。因此,本研究通过使用克鲁弗毕赤酵母菌(Pichia kluyveri)和植物乳植杆菌(Lactiplantibacillus plantarum),探究不同发酵方式对玫瑰花饮料理化品质、活性成分、抗氧化能力、挥发性化合物、游离氨基酸和感官评价的影响,为玫瑰花发酵饮料市场提供理论依据与技术支持。
1 材料与方法
1.1 材料与试剂
可食用玫瑰干花,台州天君科技有限公司;克鲁弗毕赤酵母菌XT110,保藏于中国典型微生物保藏中心;植物乳植杆菌CICC 21796,中国工业微生物菌种保藏管理中心;食品级果胶酶和纤维素酶,沧州夏盛酶生物技术有限公司;仲辛醇,上海源叶生物科技有限公司;其余试剂均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
JM-L50胶体磨,温州强忠机械科技有限公司;HR1100-IIA2生物安全柜,青岛海尔生物医疗股份有限公司;FE-20 pH计,梅特勒托利多科技有限公司;L8紫外可见分光光度计,上海仪电分析仪器有限公司;8890-5977B气质联用仪-嗅闻仪、Agilent 1100游离氨基酸分析专用高效液相色谱仪,美国安捷伦科技有限公司。
1.3 实验方法
1.3.1 玫瑰花发酵饮料的制备
根据前期大量的预实验,玫瑰花发酵饮料的制备工艺如下:挑选完好无腐烂的干玫瑰花,将花和水以质量比1∶30在胶体磨中打浆,添加0.1%果胶酶和0.1%(质量分数)纤维素酶,在50 ℃水浴锅中酶解2 h;将玫瑰花液的pH值和可溶性固形物含量分别调至6.0和13%,在100 ℃加热5 min进行灭菌处理,冷却至室温后,备用。酵母菌发酵:在生物安全柜中接入克鲁弗毕赤酵母菌,28 ℃发酵4 d;乳酸菌发酵:在生物安全柜中接入植物乳植杆菌,37 ℃发酵4 d;共发酵:在生物安全柜中接入克鲁弗毕赤酵母菌,28 ℃发酵1 d后,在100 ℃加热5 min灭酵母菌,再接入植物乳植杆菌,37 ℃发酵3 d。将发酵结束的饮料过滤后取上清进行后续测定。
1.3.2 pH、总酸和总糖的测定
使用pH计测定pH值;总酸含量采用GB 12456—2021《食品安全国家标准 食品中总酸的测定》中的pH计电位滴定法测定;总糖含量采用苯酚-硫酸法测定[6],取1 mL稀释过的样品,依次缓慢加入1 mL体积分数为5%苯酚、5 mL浓硫酸,混合均匀后静置5 min,在30 ℃水浴加热15 min,并在490 nm处测定其吸光值,结果通过葡萄糖标曲计算。
1.3.3 花色苷、总酚和总黄酮的测定
花色苷含量采用pH示差法测定。取2份1 mL样品,分别加入适量pH 1.0和pH 4.5缓冲液,并在520和700 nm处测定其吸光值,花色苷含量计算如公式(1)所示:
C/(mg/mL)
(1)
式中:C为花色苷含量,mg/mL;M为花色苷的相对分子质量,449.2 g/mol;D为稀释倍数;ε为花色苷的摩尔吸收率,26 900 L/(mol·cm);L为光程,1 cm。
总酚含量采用福林酚法测定[7]。取1 mL稀释过的样品,加入0.5 mL福林酚试剂,混合均匀后再加入1.5 mL 7.5%(质量分数,下同)碳酸钠溶液,在70 ℃ 水浴加热30 min,冷却后用蒸馏水将溶液定容至10 mL,并在760 nm处测定其吸光值,结果通过没食子酸标曲计算。
总黄酮含量采用氯化铝比色法测定[8]。取1 mL稀释过的样品,加入0.5 mL 50 g/L亚硝酸钠溶液,反应5 min后,加入0.3 mL 100 g/L硝酸铝溶液,反应6 min后,再加入4 mL 40 g/L氢氧化钠,用蒸馏水定容至10 mL,室温反应12 min,并在510 nm处测定其吸光值,结果通过芦丁标曲计算。
1.3.4 抗氧化能力的测定
DPPH自由基清除能力的测定参考文献[9]。取0.5 mL样品,加入2 mL DPPH溶液(适当浓度的DPPH稀释液),混合均匀后避光放置30 min,在517 nm处测定其吸光值,记为Ax;取0.5 mL样品,加入2 mL无水乙醇,在517 nm处测定其吸光值,记为Ax0;取0.5 mL无水乙醇,加入2 mL DPPH溶液,在517 nm处测定其吸光值,记为A01,DPPH自由基清除率计算如公式(2)所示:
DPPH自由基清除率![]()
(2)
ABTS阳离子自由基清除能力的测定参考文献[9]。取0.5 mL样品,加入2 mL ABTS溶液(适当浓度的ABTS稀释液和2.5 mmol/L过硫酸钾溶液按体积1∶1混合,避光反应12 h后,用无水乙醇将其稀释至在734 nm处的吸光值为0.70±0.02),混合均匀后避光放置30 min,在734 nm处测定其吸光值,记为Ay;取0.5 mL样品,加入2 mL无水乙醇,在734 nm处测定其吸光值,记为Ay0;取0.5 mL无水乙醇,加入2 mL ABTS溶液,在734 nm处测定其吸光值,记为A02,ABTS阳离子自由基清除率计算如公式(3)所示:
ABTS阳离子自由基清除率![]()
(3)
1.3.5 挥发性化合物的测定
采用顶空固相微萃取结合三重四极杆气质联用仪(solid phase microextraction-GC-MS,SPME-GC-MS)对样品中的挥发性化合物进行分析[8]。取5 mL样品和1 g NaCl置于20 mL顶空瓶中,加入5 μL仲辛醇(0.081 9 μg/uL)作为内标物。将50 μm二乙烯苯/羧基/聚二甲基硅氧烷萃取头置于样品瓶顶部,同时加入转子,在40 ℃、400 r/min下萃取40 min,萃取后,在250 ℃下解析5 min。初始温度为45 ℃,保持3 min;以5 ℃/min的速度升温至120 ℃;再以8 ℃/min的速度升温至230 ℃,保持5 min。以氦气为载气(纯度99.99%),流速为1.8 mL/min,不分流进样。电子轰击电离源,电离能量为70 eV,离子源温度为230 ℃,接口温度为250 ℃,溶剂延迟0 min,质量扫描范围40~550 m/z,全扫描模式。通过将质谱全离子扫描图谱与美国国家标准与技术研究院(National Institute of Standards and Technology,NIST)质谱数据库进行比较,判定目标化合物,并根据所加内标物对挥发性物质进行半定量。
1.3.6 游离氨基酸的测定
游离氨基酸含量采用液相色谱法测定[10]。取适量样品和等体积的三氯乙酸(0.1 g/mL)混合均匀后静置1 h,用双层滤纸过滤,将滤液在8 000 r/min下离心20 min,上清液过0.22 μm水膜,然后取400 μL加入到液相样品瓶中,通过游离氨基酸分析专用HPLC测定样品中的游离氨基酸含量。
1.3.7 感官评价
参考GB 7101—2022《食品安全国家标准 饮料》中的感官要求并适当优化,选取色泽、滋味、气味和组织状态4个指标制定感官评分标准,总分为100分,具体标准如表1所示。邀请10名受过专业训练的感官评定人员进行感官评价(5名男性和5名女性,年龄为20~30岁)。在光线明亮处,将常温下不同的玫瑰花发酵饮料样品(各20 mL)随机分装在标有序号的透明塑料杯中以供测试,每个样品测试后漱口以消除残留感官刺激。最后,统计10名感官评价员的平均得分,评价结果用雷达图表示。
表1 感官评分标准
Table 1 The sensory scoring criteria

指标标准与评分色泽(20分)发酵饮料呈鲜红色,色泽均匀一致,光泽度高,15~20分发酵饮料呈暗红色,色泽较均匀,光泽度较高,10~14分发酵饮料呈褐色,色泽局部不均匀,光泽度一般,<10分滋味(30分)发酵饮料口感细腻柔和,酸甜比例协调,微微涩味,25~30分发酵饮料口感较好,稍微偏酸或偏甜,带有苦涩味,15~24分发酵饮料口感一般,过酸或过甜,苦涩味突出,<15分气味(30分)发酵饮料气味协调,玫瑰花香味浓郁,无异味,25~30分发酵饮料气味较协调,玫瑰花香味较淡,略有异味,15~24分发酵饮料气味不协调,玫瑰花香味淡,带刺激性气味,<15分组织状态(20分)发酵饮料澄清透亮,无沉淀,无杂质,15~20分发酵饮料较澄清,少许沉淀,无杂质,10~14分发酵饮料较浑浊,较多沉淀,少许杂质,<10分
1.4 数据处理
通过SPSS Statistics 26和Origin 2021软件分析实验数据和绘图,所有数据均为3次平行,P<0.05表示有显著性差异,结果表示为“平均值±标准差”。
2 结果与分析
2.1 pH、总酸和总糖含量的分析
pH和总酸是判断菌种发酵特性的重要指标,其能直接影响发酵饮料的感官品质,如颜色和味道。由图1-a可知,与未发酵相比,3个发酵样品的pH均显著性降低(P<0.05),主要是由于2种菌在发酵过程中产生的有机酸的排泄以及酵母对碱性氨基酸的吸收,除了氢离子的排泄、初级磷酸盐的吸收和缓冲能力的变化也会导致饮料发酵过程pH降低[11]。LI等[12]发酵苹果汁,苹果中的糖被植物乳植杆菌发酵产生酸,pH呈下降趋势,总酸含量呈上升趋势,最终pH值为4.03。乳酸菌的产酸能力优于酵母菌,乳酸菌发酵样品的pH值最低,为3.91,酵母菌发酵样品的pH值最高,为4.89,共发酵样品的pH值介于2个单菌种发酵样品之间,为4.04,符合发酵饮料标准(pH≤4.5)。由图1-b可知,4个样品的总酸含量与pH呈负相关,这与KAPRASOB等[13]的研究结果一致,即pH越低,总酸含量越高。
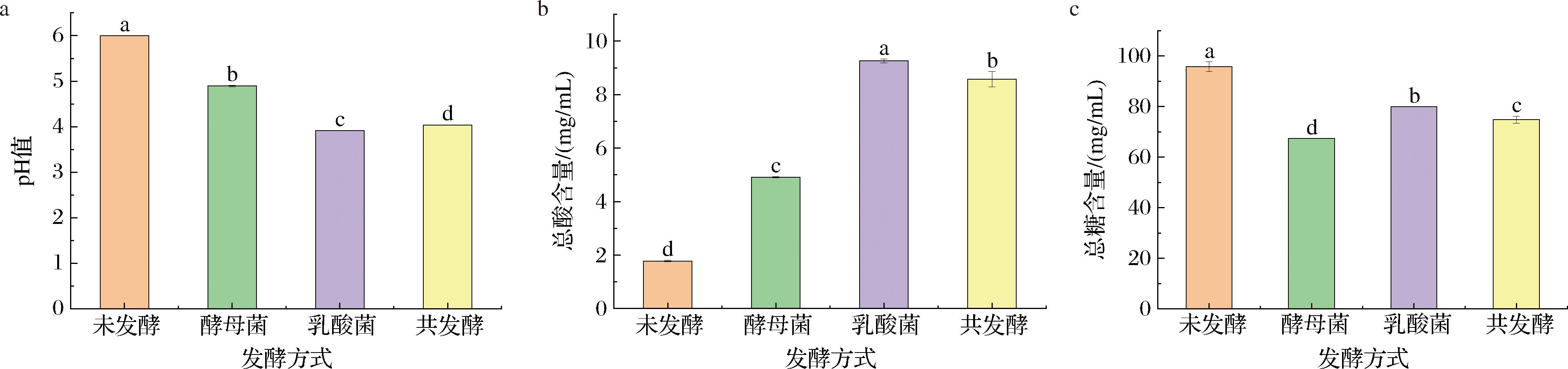
a-pH值;b-总酸含量;c-总糖含量
图1 不同发酵方式玫瑰花饮料的pH值、总酸含量、总糖含量分析
Fig.1 Analysis of pH, total acid content, and total sugar content of rose beverages with different fermentation methods
注:不同小写字母表示差异显著(P<0.05)(下同)。
由图1-c可知,与未发酵相比,酵母菌发酵、乳酸菌发酵和共发酵样品的总糖含量分别降低了29.62%、16.49%和21.86%。发酵后总糖含量降低的原因一是部分被生物转化为有机酸,二是在发酵过程中,菌种需要糖代谢来维持自身生长和繁殖所需的能量[13],异型乳酸菌可通过磷酸戊糖途径,将葡萄糖转化为乳酸等,引起低pH和高酸度[12],而在体系未添加碳源的情况下,糖类物质作为主要碳源物质和发酵底物不断被消耗,导致总糖含量降低。
2.2 花色苷、总酚和总黄酮的分析
花色苷、总酚、总黄酮均是玫瑰花发酵饮料的活性成分。由图2-a可知,与未发酵相比,酵母菌发酵和乳酸菌发酵样品的花色苷含量均显著降低(P<0.05),共发酵样品花色苷含量无显著性差异(P>0.05),3个发酵样品的花色苷保留率分别为92.11%、84.87%和97.37%。李洁莹等[14]用不同酵母菌发酵无醇杨梅果酒,所得花色苷含量均显著降低(P<0.05)。WANG等[15]对蓝莓汁进行不同方式的发酵,得到单酿酒酵母发酵样品花色苷含量显著低于其他样品(P<0.05)。由于花色苷的不稳定性,其在发酵过程中会发生降解,酵母细胞壁可以吸收花色苷[15],酵母菌产生的β-葡萄糖苷酶也可以降解花色苷,导致花色苷含量降低。乳酸菌不仅可以通过β-葡萄糖苷酶将花色苷水解为酚类物质,还能通过去糖基化、去羟基化、碳碳双键还原将花色苷转化为酚酸[16]。共发酵样品的花色苷含量高于单发酵样品,可能是共发酵过程中死亡的酵母细胞自溶后从细胞壁中释放出甘露糖蛋白,对花色苷的稳定性起到了重要作用[17]。
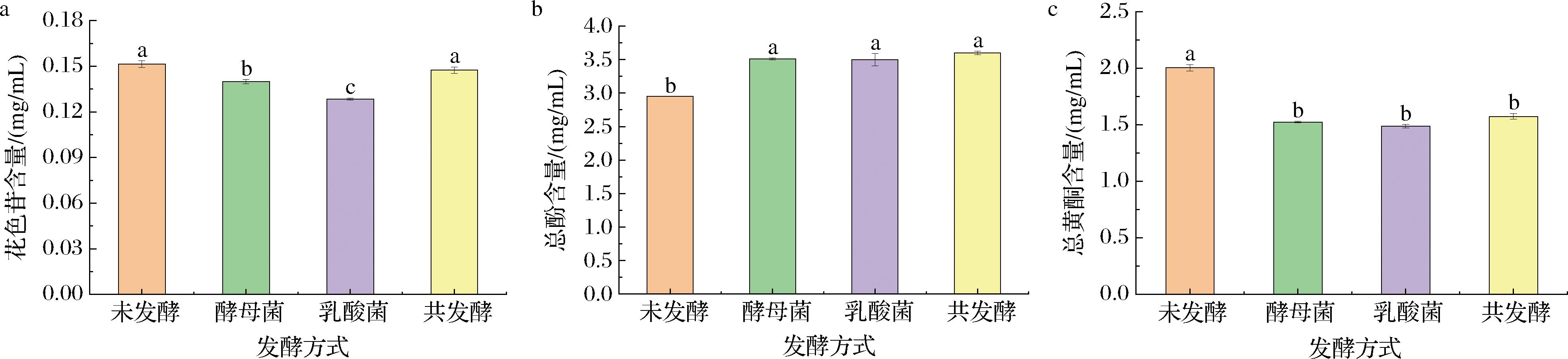
a-花色苷含量;b-总酚含量;c-总黄酮含量
图2 不同发酵方式玫瑰花饮料的花色苷含量、总酚含量、总黄酮含量分析
Fig.2 Analysis of anthocyanin content, total phenol content, and total flavonoid content of rose beverages with different fermentation methods
由图2-b可知,与未发酵相比,酵母菌发酵、乳酸菌发酵和共发酵样品的总酚含量分别增加了18.98%、18.47%和22.03%,可能是2种菌在发酵底物中的适应性较强,可以将酚类物质去糖基化,从原料细胞壁中释放出更多的不溶性结合酚或可溶性共轭酚类物质[18],也可能是酶将复杂的多酚物质分解为简单的黄酮醇物质。共发酵样品的总酚含量最高,为3.60 mg/mL,可能是2种菌在发酵过程中相互促进的结果,复杂的植物化学成分被水解为更简单的植物化学成分。而CHEN等[19]用乳酸菌发酵杨梅汁后,总酚含量降低。WU等[20]研究的乳酸菌发酵苹果汁后,总酚含量降低26.90%,这可能是单体酚转化为其他物质或大分子酚类物质解聚。
由图2-c可知,与未发酵相比,酵母菌发酵、乳酸菌发酵和共发酵样品的总黄酮含量均显著性降低(P<0.05),可能是菌种在发酵过程中将黄酮类物质降解或转化为其他物质,这与WU等[20]研究的苹果汁在发酵后总黄酮含量显著降低(P<0.05)的结果一致,而QIU等[8]研究的乳酸菌发酵玫瑰香菇饮料中总黄酮含量显著增加(P<0.05),这归因于菌种的个体差异以及其在发酵基质中的适应性差异。
2.3 抗氧化能力的分析
如图3所示,发酵后,饮料的DPPH自由基清除能力和ABTS阳离子自由基清除能力均显著增加(P<0.05),可能是因为发酵后总酚含量增加,玫瑰花发酵饮料中具有较多的酚类物质,它们具有氢原子转移或给电子自由基的能力,能作为还原剂、自由基清除剂和单线态氧猝灭剂,具有显著的抗氧化活性[21]。其次,酵母菌和乳酸菌本身含有酶和非酶抗氧化机制,能使饮料在发酵过程具有较高的抗氧化能力[22],自由基清除能力还与酚类物质的生物转化能力相关,比如酚类糖苷在菌种发酵产生的β-葡萄糖苷酶的作用下,能水解成具有较高自由基清除能力的苷元[8]。KOKKINOMAGOULOS等[23]用不同酵母菌发酵石榴酒后,DPPH自由基清除能力均降低10%以上,可能是酚类物质或其他分子之间发生了氧化反应。ZHAO等[24]用11种乳酸菌分别发酵红枣枸杞复合汁,其中7个样品的DPPH自由基清除能力均降低,8个样品的ABTS阳离子自由基清除能力均降低,这与菌株的多样性有关。在本研究中,共发酵样品的DPPH自由基和ABTS阳离子自由基清除能力分别为1.79和1.43 mg RT/mL,在发酵样品中均为最高,可能是灭酵母菌后使得酵母内超氧化物歧化酶释放出细胞外,发挥其酶特性清除自由基,呈现出高抗氧化性。
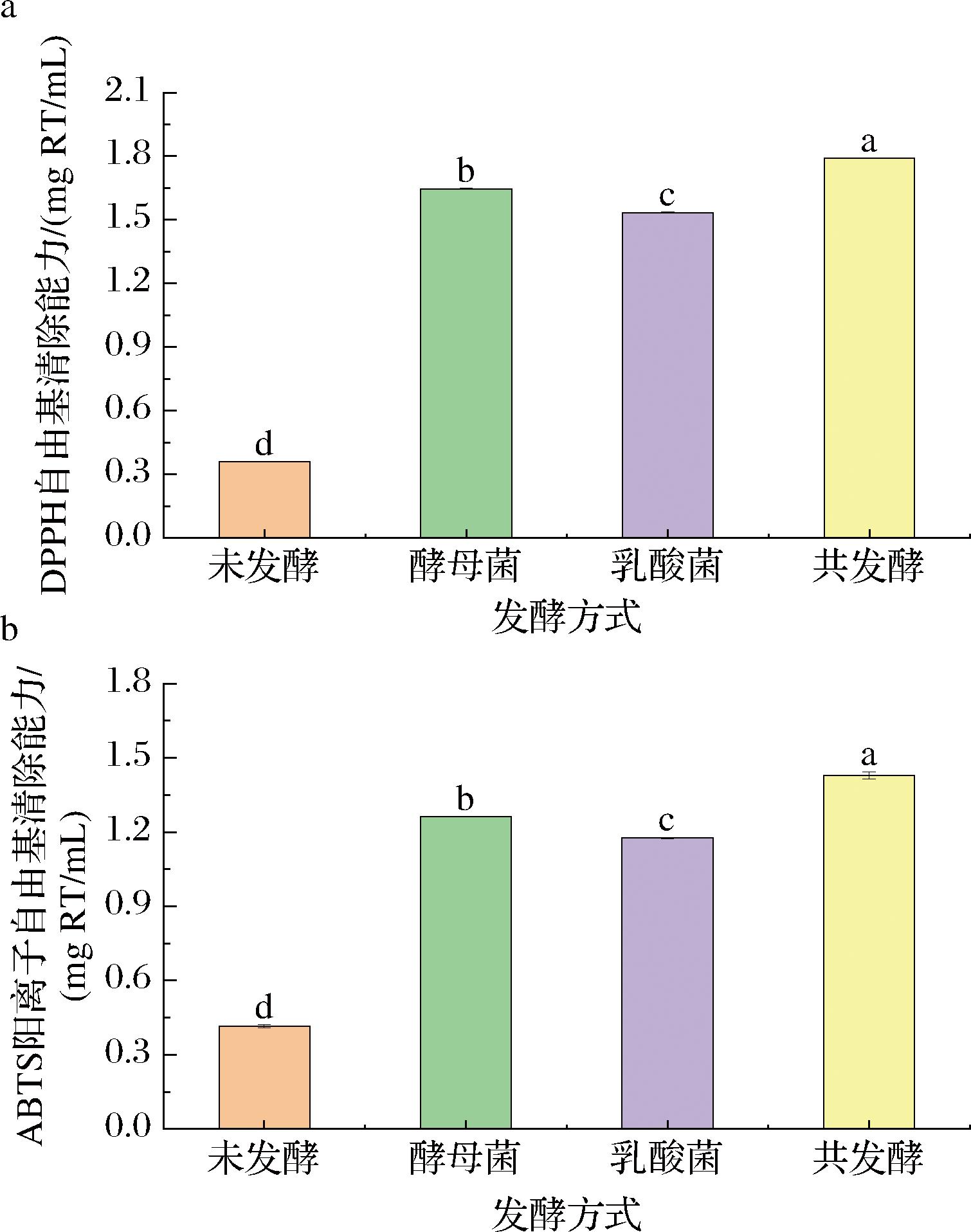
a-DPPH自由基清除能力;b-ABTS阳离子自由基清除能力
图3 不同发酵方式玫瑰花饮料的抗氧化能力分析
Fig.3 Analysis of antioxidant capacity of rose beverages with different fermentation methods
2.4 挥发性化合物的分析
2.4.1 整体分析
为了探究不同发酵方式对玫瑰花饮料风味特征的影响,利用SPME-GC-MS分析了4个样品的挥发性物质,如表2所示。在4个样品中共检出8类、58种挥发性物质,其中酯类16种、醇类18种、酸类8种、醛类5种、酚类4种、烯烃类3种、酮类2种和其他2种,4个样品的挥发性化合物总含量分别为80.20、5 528.32、649.32和1 636.96 μg/mL。
表2 不同发酵方式玫瑰花饮料的挥发性物质含量 单位:μg/mL
Table 2 The content of volatile compounds of rose beverages with different fermentation methods

分类挥发性物质未发酵酵母菌发酵乳酸菌发酵共发酵苯甲酸甲酯0.19±0.031.16±0.251.35±0.211.04±0.14乙酸乙酯0±0763.50±6.380±0368.08±3.75乙酸异丁酯0±032.96±1.240±00.02±0.01乙酸异戊酯0±01 053.74±8.177.81±0.7553.48±1.24辛酸甲酯0±02.61±0.570±01.32±0.26壬酸乙酯0±04.49±0.950±00.91±0.03癸酸甲酯0±00.43±0.050±00.11±0.01酯类癸酸乙酯0±05.03±0.280±00.6±0.021,3-丙二醇,二乙酸酯0±011.21±0.420±00.8±0.12乙酸香叶酯0±03.95±0.980±00.44±0.02苯乙酸乙酯0±00.78±0.130±01.06±0.18乙酸苯乙酯0±0613.62±3.4625.52±1.02 53.13±1.752,2,4-三甲基-1,3-戊二醇二异丁酸酯0±05.87±0.730±04.07±0.61十六烷酸乙酯0±01.34±0.340±00.33±0.11邻苯二甲酸二丁酯0±00.54±0.060.34±0.020.39±0.02乙酸苯甲酯0±00±00.67±0.060.84±0.04小计0.192 501.2335.69486.622-乙基-1-己醇2.66±0.373.84±0.912.35±0.842.89±0.77芳樟醇1.16±0.141.92±0.5211.23±1.22 6.33±0.864-萜烯醇0.21±0.020.25±0.090.25±0.080.21±0.06α-松油醇0.64±0.090±00±01.57±0.24香茅醇19.38±0.98 0±042.23±1.78 39.26±1.56橙花醇11.76±0.45 19.59±1.03 30.94±1.57 27.74±1.26苯甲醇2.98±0.39 6.50±0.59 8.67±0.71 8.53±0.83醇类苯乙醇13.77±0.51 65.60±2.06 28.47±1.58 68.88±2.37β-桉叶醇 0.71±0.040.65±0.160.72±0.2 0.71±0.242-甲基丙醇0±0100.02±2.78 0±041.41±1.62异戊醇0±0634.7±7.34 0±0357.69±5.681-戊醇0±03.72±0.089.12±0.198.67±0.213-乙氧基丙醇0±02.62±0.410±00.83±0.151-庚醇0±02.11±0.574.74±0.692.78±0.422-甲基-6-庚烯-1-醇0±00.67±0.031.19±0.070.82±0.082-莰醇0±01.42±0.212.74±0.381.97±0.27香叶醇0±026.91±1.76 36.03±1.85 36.89±0.72乙醇0±02 091.33±9.25 84.07±0.54 332.56±2.59小计53.272 961.85262.75939.74己酸0.39±0.0119.19±0.84 2.18±0.122.27±0.13辛酸0.80±0.034.56±0.690±07.26±0.73香叶酸6.28±0.767.88±1.6813.40±1.96 12.88±1.71酸类乙酸0±019.19±1.35119.62±4.59 95.80±3.722-甲基丙酸0±05.91±0.384.76±0.316.63±0.42山梨酸0±00.18±0.010.28±0.020.35±0.023,7-二甲基-6-辛烯酸0±00.20±0.010±00.37±0.03月桂酸0±00.74±0.130.36±0.060.49±0.07小计7.4757.85140.6126.05壬醛1.81±0.251.79±0.160±02.04±0.13苯甲醛6.94±0.831.75±0.242.35±0.391.85±0.21苯乙醛1.16±0.190.46±0.110±00.23±0.06醛类柠檬醛2.53±0.321.52±0.320±02.76±0.453,4-二甲基苯甲醛0.73±0.090±04.94±1.034.05±0.84小计13.175.527.2910.93甲基丁香酚0.20±0.010.28±0.030.27±0.020.26±0.01
续表2
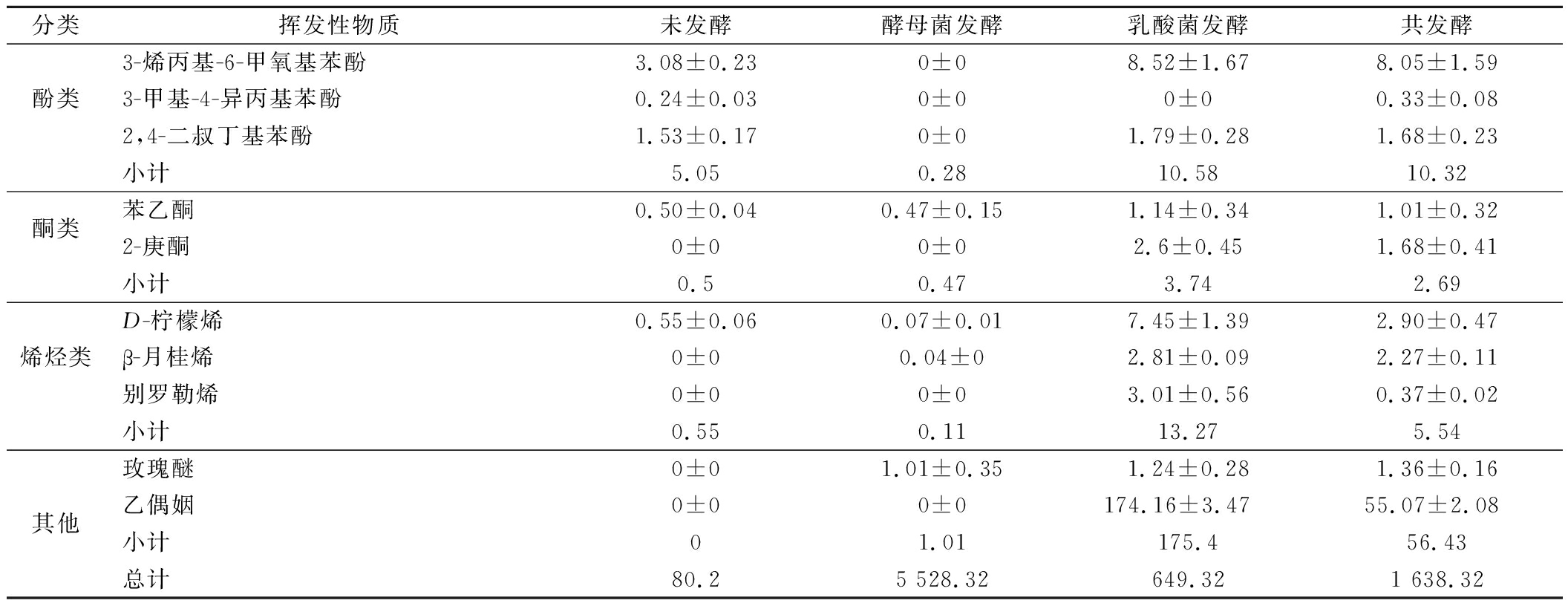
分类挥发性物质未发酵酵母菌发酵乳酸菌发酵共发酵3-烯丙基-6-甲氧基苯酚3.08±0.230±08.52±1.678.05±1.59酚类3-甲基-4-异丙基苯酚0.24±0.030±00±00.33±0.082,4-二叔丁基苯酚1.53±0.170±01.79±0.281.68±0.23小计5.050.2810.5810.32酮类苯乙酮0.50±0.040.47±0.151.14±0.341.01±0.322-庚酮0±00±02.6±0.451.68±0.41小计0.50.473.742.69D-柠檬烯0.55±0.060.07±0.017.45±1.392.90±0.47烯烃类β-月桂烯0±00.04±02.81±0.092.27±0.11别罗勒烯0±00±03.01±0.560.37±0.02小计0.550.1113.275.54玫瑰醚0±01.01±0.351.24±0.281.36±0.16其他乙偶姻0±00±0174.16±3.47 55.07±2.08 小计01.01175.456.43总计80.25 528.32649.321 638.32
由图4可知,不同发酵方式对饮料产生挥发性物质的种类和含量影响较大,其中共发酵产生挥发性物质的种类最多,酵母菌发酵产生挥发性物质的含量最多。酵母菌发酵产生了较多的酯类和醇类物质,两者占总含量的98.82%。乳酸菌发酵产生了较多的醇类和酸类物质,两者占总含量的62.12%。共发酵产生了较多的酯类和醇类物质,两者占总含量的87.06%。
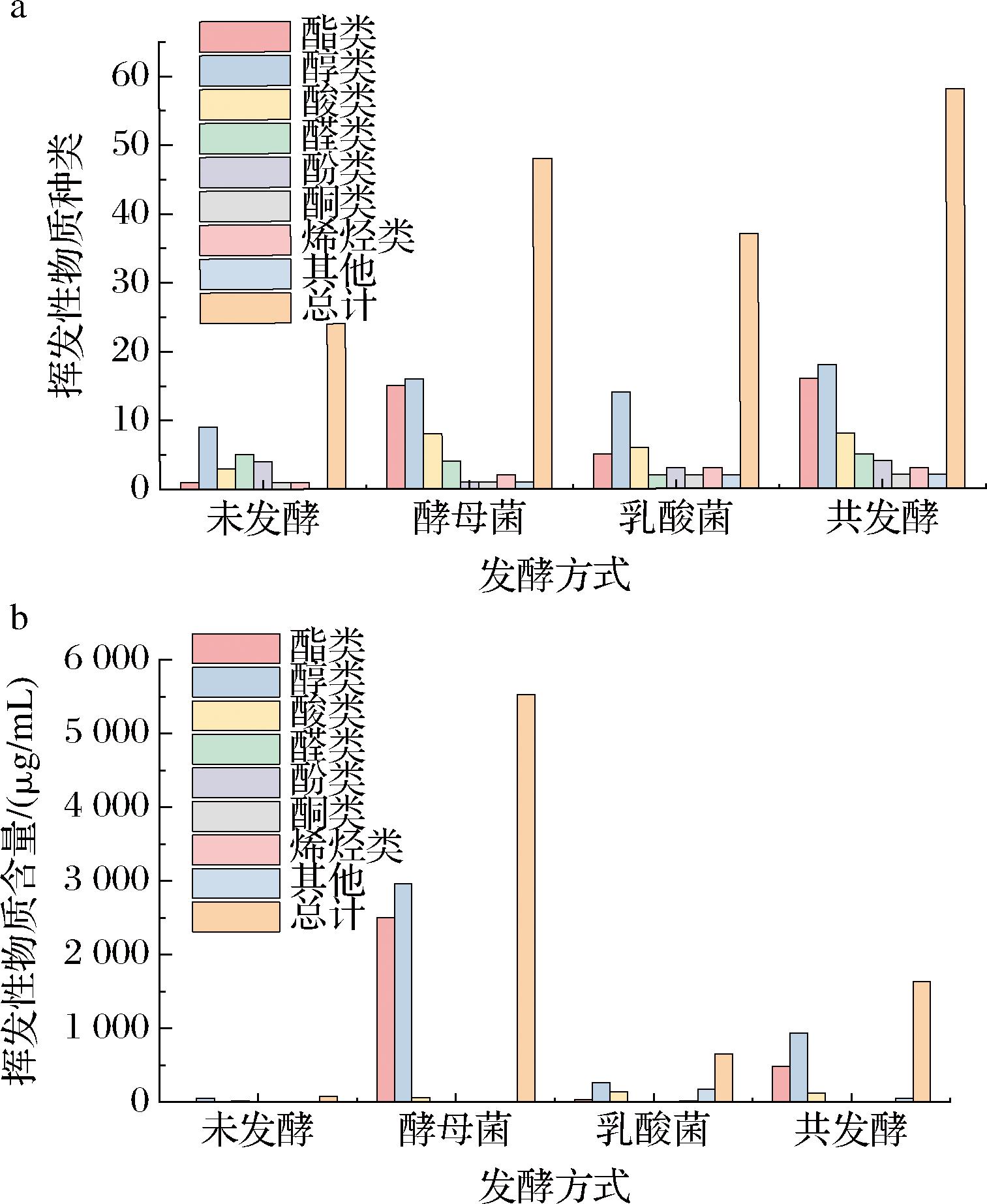
a-挥发性物质种类;b-挥发性物质含量
图4 不同发酵方式玫瑰花饮料的挥发性物质整体分析
Fig.4 Overall analysis of volatile compounds of rose beverages with different fermentation methods
发酵后,醛类物质含量降低。因为它们具有不稳定性,在微生物的作用下,可以还原为醇类或氧化成酸类物质。而且醛类浓度越高,饮料味道越差,消费者接受度越低[25],因此发酵能改善醛类物质带来的不良风味。酵母菌发酵后,酯类和醇类物质明显增加。乙醇对饮料香气起着重要作用,当其含量超过350 μg/mL时,被认为存在香气缺陷[13],在本研究中,酵母菌发酵样品的乙醇含量和醇类物质总量都较高,导致产品酒味突出,掩盖了玫瑰花香味。乳酸菌发酵后,醇类和酸类物质增加。其中乙酸含量最高,为119.62 μg/mL,说明植物乳植杆菌激活了磷酸葡萄糖酸途径中的醋酸激酶途径[26],乙酸含量的增加还有可能来自于柠檬酸的代谢。有机酸是产品酸味的来源,适量的有机酸能给产品带来愉悦爽口的滋味,但过量的有机酸会引起酸败味。共发酵后,乙醇含量为332.56 μg/mL,符合发酵饮料对酒精含量的要求(≤0.5%)。共发酵产生的香气成分较多,比如苯乙酸乙酯、乙酸苯甲酯、α-松油醇、苯乙醇、壬醛、柠檬醛、玫瑰醚等。苯乙醇具有玫瑰和蜂蜜的味道,可以在厌氧条件下由微生物合成[27],主要包括2种途径:苯丙氨酸或亮氨酸的生物转化和糖酵解或磷酸戊糖途径[28]。α-松油醇具有丁香、松树、薄荷的味道[29],是酵母菌通过甲羟戊酸途径和缩合反应生物转化而来。其均在共发酵样品中含量最高,可能是由于鲁弗毕赤酵母菌和植物乳植杆菌在香气化合物的形成中存在着相互促进的作用。
2.4.2 香气活性值(odor activity value,OAV)分析
饮料风味不仅与所含挥发性化合物含量有关,还与其阈值有关,香气活性值OAV由挥发性化合物含量除以其阈值得到[30],OAV>1的挥发性化合物通常被认为是赋予发酵饮料独特风味的关键物质。如表3所示,4个样品中共有29种挥发性化合物的OAV>1,说明所使用的2种菌能良好的产生丰富饮料风味的香气化合物。在未发酵样品中,苯甲醛(杏仁味)和苯乙醛(风信子味)是赋予其风味的关键物质。在酵母菌发酵样品中,乙酸乙酯(水果香)、乙酸异丁酯(水果香)、癸酸乙酯(果香和酒香)等是赋予其风味的关键物质。在乳酸菌发酵样品中,芳樟醇(柑橘香)、β-月桂烯(甜橘味和香脂气)等是赋予其风味的关键物质。在共发酵样品中,苯乙酸乙酯(蜂蜜香气)、乙酸苯甲酯(茉莉花香)、香叶醇(玫瑰花香)等是赋予其风味的关键物质,此外,具有木质花香的α-松油醇仅在共发酵样品中检测到,它不仅能丰富饮料风味还具有抗菌活性。
表3 不同发酵方式玫瑰花饮料的挥发性物质OAV
Table 3 The OAV of volatile compounds of rose beverages with different fermentation methods
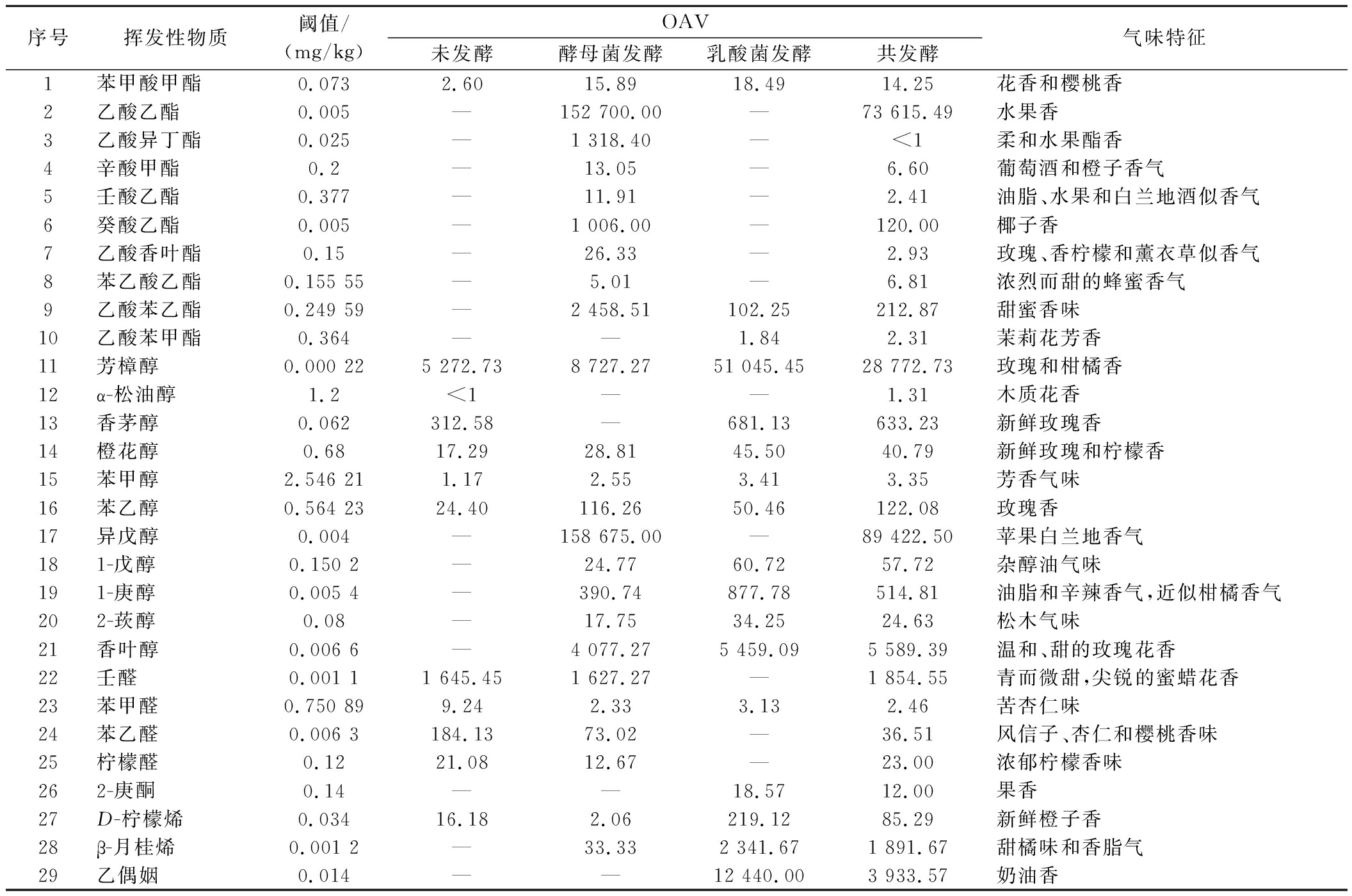
序号挥发性物质阈值/(mg/kg)OAV未发酵酵母菌发酵乳酸菌发酵共发酵气味特征1苯甲酸甲酯0.0732.6015.8918.4914.25花香和樱桃香2乙酸乙酯0.005—152 700.00—73 615.49水果香3乙酸异丁酯0.025—1 318.40—<1柔和水果酯香4辛酸甲酯0.2—13.05—6.60葡萄酒和橙子香气5壬酸乙酯0.377—11.91—2.41油脂、水果和白兰地酒似香气6癸酸乙酯0.005—1 006.00—120.00椰子香7乙酸香叶酯0.15—26.33—2.93玫瑰、香柠檬和薰衣草似香气8苯乙酸乙酯0.155 55—5.01—6.81浓烈而甜的蜂蜜香气9乙酸苯乙酯0.249 59—2 458.51102.25212.87甜蜜香味10乙酸苯甲酯0.364——1.842.31茉莉花芳香11芳樟醇0.000 225 272.738 727.2751 045.4528 772.73玫瑰和柑橘香12α-松油醇1.2<1——1.31木质花香13香茅醇0.062312.58 —681.13 633.23 新鲜玫瑰香14橙花醇0.6817.29 28.81 45.50 40.79 新鲜玫瑰和柠檬香15苯甲醇2.546 211.172.553.413.35芳香气味16苯乙醇0.564 2324.40 116.26 50.46 122.08 玫瑰香17异戊醇0.004—158 675.00—89 422.50苹果白兰地香气181-戊醇0.150 2—24.7760.7257.72杂醇油气味191-庚醇0.005 4—390.74877.78514.81油脂和辛辣香气,近似柑橘香气202-莰醇0.08—17.7534.2524.63松木气味21香叶醇0.006 6—4 077.275 459.095 589.39温和、甜的玫瑰花香22壬醛0.001 11 645.451 627.27—1 854.55青而微甜,尖锐的蜜蜡花香23苯甲醛0.750 899.242.333.132.46苦杏仁味24苯乙醛0.006 3184.1373.02—36.51风信子、杏仁和樱桃香味25柠檬醛0.1221.0812.67—23.00浓郁柠檬香味262-庚酮0.14——18.5712.00果香27D-柠檬烯0.03416.182.06219.1285.29新鲜橙子香28β-月桂烯0.001 2—33.332 341.671 891.67甜橘味和香脂气29乙偶姻0.014——12 440.003 933.57奶油香
注:—表示无数据。
2.4.3 主成分分析(principal component analysis,PCA)
为了更好的区分4个样品之间的风味差异,对4个样品所有的风味物质和OAV>1的关键风味物质进行PCA。图5-a为PCA得分图,未发酵样品和发酵样品分布在两侧,说明玫瑰花饮料经发酵后,挥发性物质的种类和含量发生了较大变化。3个发酵样品明显分离,说明发酵方式对其风味物质有较大影响。主成分PC1方差为47.6%,PC2方差为38.6%,两者总方差为86.2%,说明PCA能很好地解释样品之间的差异性。图5-b为PCA双图,结合表3可知,2-莰醇、1-庚醇、苯甲醇、橙花醇、1-戊醇等物质距离共发酵样品较近,说明它们与共发酵样品风味的形成具有强相关性。
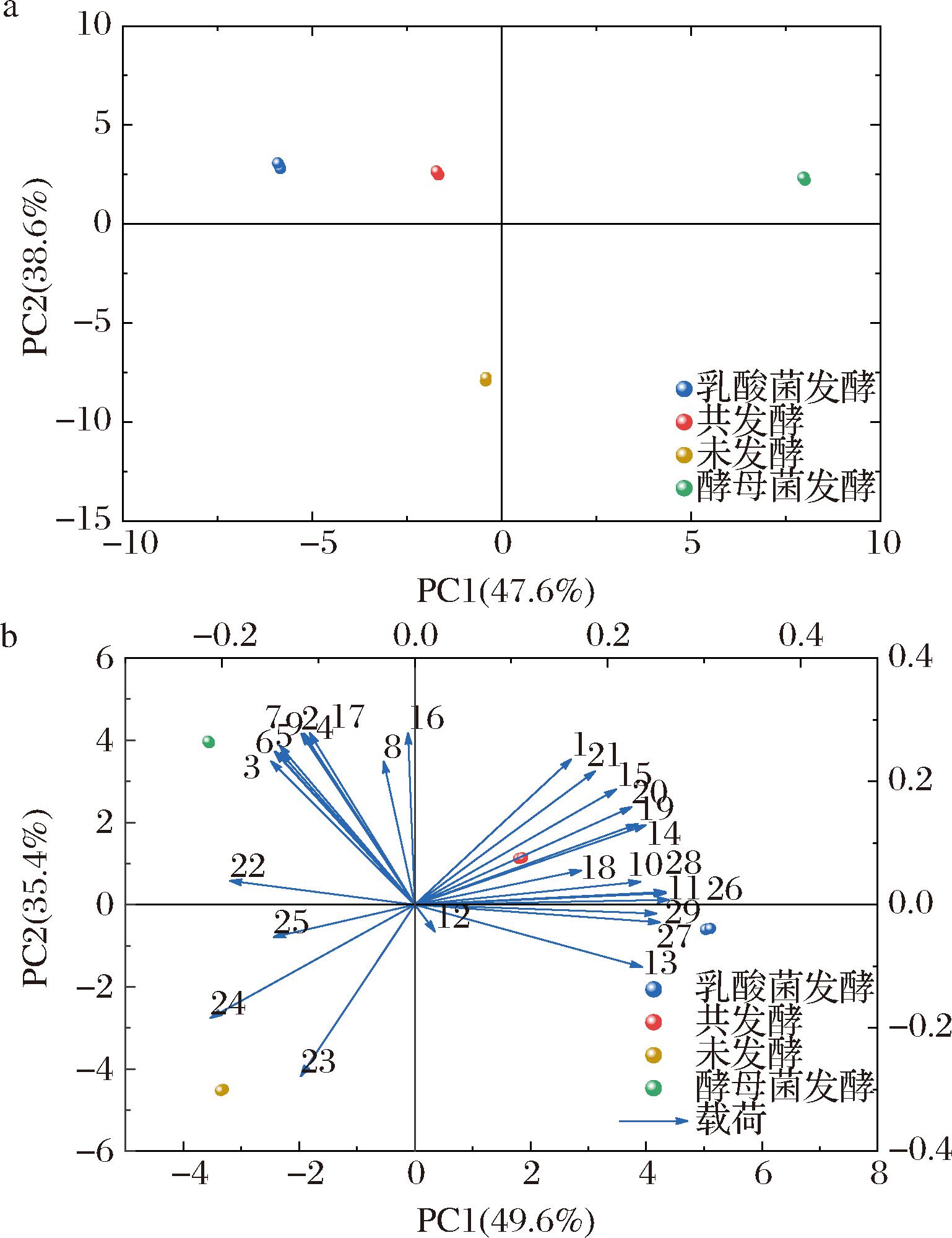
a-挥发性物质PCA得分图;b-OAV>1物质PCA双图
图5 不同发酵方式玫瑰花饮料的挥发性物质主成分分析
Fig.5 Principal component analysis of volatile compounds of rose beverages with different fermentation methods
2.4.4 聚类分析
对4个样品的挥发性化合物进行聚类分析,以热图表示。如图6所示,蓝色越深代表含量越高,发酵后,挥发性化合物的变化显著,与PCA的结果一致。未发酵样品的苯甲醛、苯乙醛含量远高于发酵样品,乳酸菌发酵和共发酵都有着较高含量的醇类物质(香茅醇、1-戊醇、橙花醇、香叶醇和苯甲醇)、酸类物质(香叶酸和山梨酸)、酚类物质(2, 4-二叔丁基苯酚)和玫瑰醚。酵母菌发酵样品较高含量的多为酯类(癸酸甲酯、壬酸乙酯、癸酸乙酯、乙酸苯乙酯等)。

图6 不同发酵方式玫瑰花饮料的挥发性物质聚类分析
Fig.6 Cluster analysis of volatile compounds of rose beverages with different fermentation methods
2.5 游离氨基酸的分析
游离氨基酸是食品中重要的滋味物质,也是芳香化合物的底物。不同发酵饮料的游离氨基酸含量(free amino acid content,FAAC)如表4所示,酵母菌发酵样品、乳酸菌发酵样品和共发酵样品的FAAC低于未发酵样品,其中共发酵样品的FAAC在发酵样品中最高。4个样品FAAC的不同是菌株特性差异、发酵方式差异和体系中酶的代谢差异引起的。乳酸菌在转氨酶的作用下可以将氨基酸转化为α-酮酸,再经过酶催化或化学反应,转化为醇、酸、醛等物质[31]。XIAO等[32]发现,毕赤酵母中存在与氨基酸代谢相关的基因,氨基酸代谢是毕赤酵母促进发酵辣椒独特风味形成的两大原因之一。在本研究中发现,克鲁弗毕赤酵母菌和植物乳植杆菌可能也含有各种代谢氨基酸的酶,使发酵后的玫瑰花饮料滋味更加宜人。不同氨基酸具有不同的味觉特征,分为四类:鲜味(天冬氨酸和谷氨酸)、甜味(丝氨酸、甘氨酸、苏氨酸、丙氨酸和脯氨酸)、无味(半胱氨酸)和苦味(组氨酸、精氨酸、酪氨酸、缬氨酸、甲硫氨酸、苯丙氨酸、异亮氨酸、亮氨酸和赖氨酸)[8]。在18种检测到的氨基酸中,天冬氨酸含量最高,其和谷氨酸是饮料滋味的主要贡献者。具有甜味特征的丝氨酸和甘氨酸在共发酵样品中含量最高。具有苦味特征的苯丙氨酸、亮氨酸和赖氨酸在共发酵样品中含量最低。发酵后谷氨酸和γ-氨基丁酸含量均降低,谷氨酸可以在谷氨酸脱羧酶的作用下生成γ-氨基丁酸,γ-氨基丁酸又可以转化为琥珀酸盐,进一步改善风味[33]。发酵后缬氨酸、异亮氨酸和亮氨酸含量均降低,可能是转化为了其他具有麦芽香和果香的物质[34]。
表4 不同发酵方式玫瑰花饮料的游离氨基酸含量 单位:μg/mL
Table 4 The content of free amino acids of rose beverages with different fermentation methods
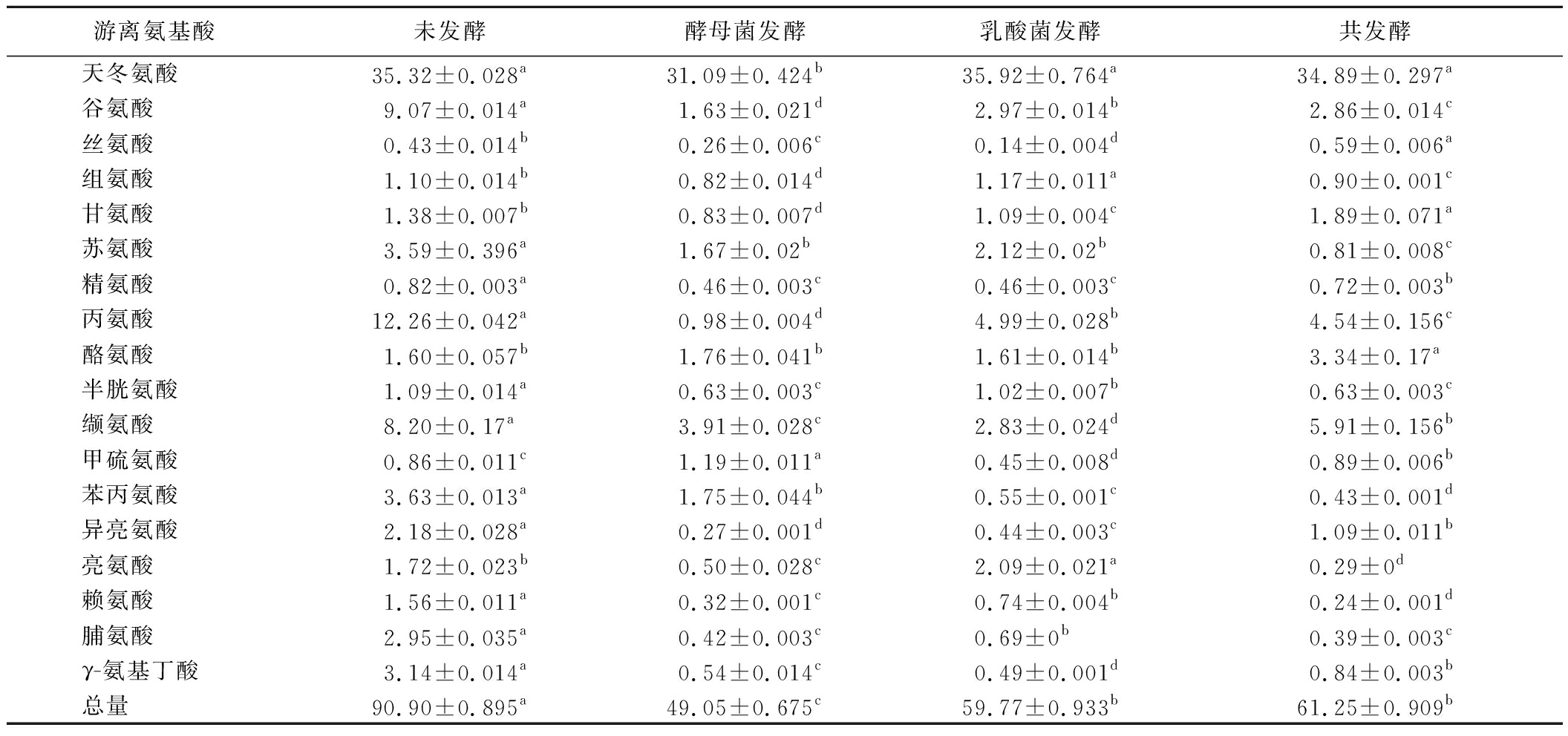
游离氨基酸未发酵酵母菌发酵乳酸菌发酵共发酵天冬氨酸35.32±0.028a31.09±0.424b35.92±0.764a34.89±0.297a谷氨酸9.07±0.014a1.63±0.021d2.97±0.014b2.86±0.014c丝氨酸0.43±0.014b0.26±0.006c0.14±0.004d0.59±0.006a组氨酸1.10±0.014b0.82±0.014d1.17±0.011a0.90±0.001c甘氨酸1.38±0.007b0.83±0.007d1.09±0.004c1.89±0.071a苏氨酸3.59±0.396a1.67±0.02b2.12±0.02b0.81±0.008c精氨酸0.82±0.003a0.46±0.003c0.46±0.003c0.72±0.003b丙氨酸12.26±0.042a0.98±0.004d4.99±0.028b4.54±0.156c酪氨酸1.60±0.057b1.76±0.041b1.61±0.014b3.34±0.17a半胱氨酸1.09±0.014a0.63±0.003c1.02±0.007b0.63±0.003c缬氨酸8.20±0.17a3.91±0.028c2.83±0.024d5.91±0.156b甲硫氨酸0.86±0.011c1.19±0.011a0.45±0.008d0.89±0.006b苯丙氨酸3.63±0.013a1.75±0.044b0.55±0.001c0.43±0.001d异亮氨酸2.18±0.028a0.27±0.001d0.44±0.003c1.09±0.011b亮氨酸1.72±0.023b0.50±0.028c2.09±0.021a0.29±0d赖氨酸1.56±0.011a0.32±0.001c0.74±0.004b0.24±0.001d脯氨酸2.95±0.035a0.42±0.003c0.69±0b0.39±0.003cγ-氨基丁酸3.14±0.014a0.54±0.014c0.49±0.001d0.84±0.003b总量90.90±0.895a49.05±0.675c59.77±0.933b61.25±0.909b
注:同行中的不同字母表示显著性差异(P<0.05)。
2.6 感官评价
感官评分可直接反映产品的被接受度。如图7所示,在色泽方面,酵母菌发酵样品呈红褐色,颜色暗淡,乳酸菌发酵样品和共发酵样品具有较低的pH,饮料呈鲜红色且有光泽,因而得分高。在滋味和气味方面,4个样品得分差异较大,结合风味物质,酵母菌发酵样品中含有较多醇类物质,如异戊醇、乙醇等,因此其酒味突出,掩盖了酸甜口感和玫瑰花香味,乳酸菌发酵样品偏酸,玫瑰花香味较弱,共发酵样品醇类物质和酸类物质含量适中,具有较高的香茅醇、苯乙醇、香叶醇含量,口感酸甜适中,玫瑰花香味浓郁,无刺激性气味,得分最高。在组织状态方面,3个发酵样品均无沉淀无杂质,颜色越鲜红的越澄清透亮。综上,共发酵样品的感官评价总分最高。
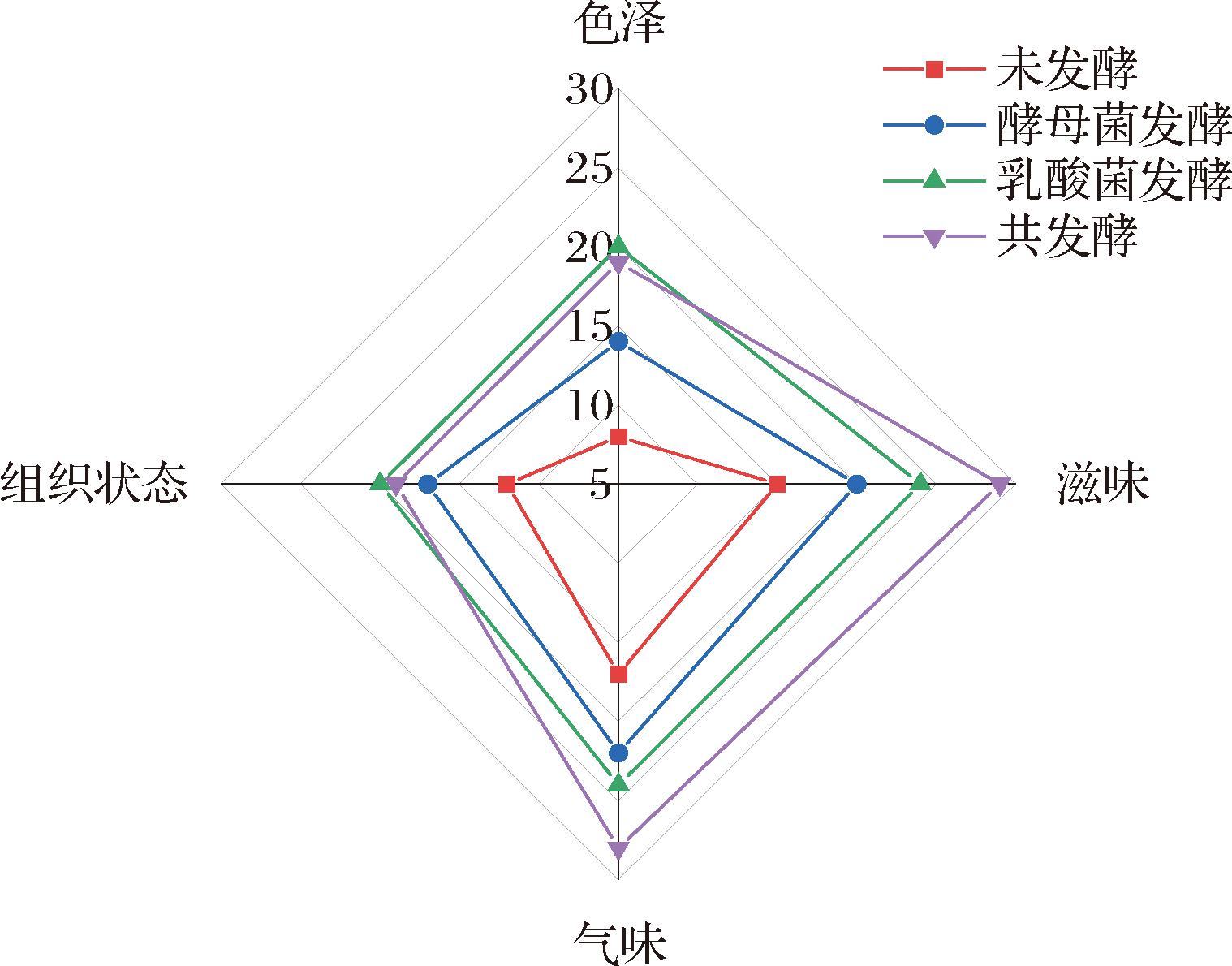
图7 不同发酵方式玫瑰花饮料的感官评分
Fig.7 Sensory evaluation of rose beverages with different fermentation methods
3 结论
本研究利用克鲁弗毕赤酵母菌和植物乳植杆菌对玫瑰花饮料进行不同方式的发酵,分析其理化品质、活性成分、抗氧化能力、挥发性物质和游离氨基酸含量,并进行感官评价。结果表明,发酵可提高玫瑰花饮料的总酚含量、抗氧化能力和感官评分,但降低了花色苷含量和总黄酮含量,此外,发酵能降低醛类物质含量,增加酯类物质、醇类物质含量等,改善饮料的风味,增加其感官评分。在3个发酵样品中,共发酵样品的花色苷含量、总酚含量、总黄酮含量、抗氧化能力和感官评分在发酵样品中均为最高,说明克鲁弗毕赤酵母菌和植物乳植杆菌共发酵能更好地改善玫瑰花饮料的品质和风味,进一步验证了克鲁弗毕赤酵母菌和植物乳植杆菌在玫瑰花发酵饮料生产中的应用潜力。后续将深入研究2种菌之间的互作机制,全面评估共发酵对玫瑰花饮料生产过程中的影响,为玫瑰花发酵饮料的工业化生产提供坚实的理论支撑。
[1] HEGDE A S, GUPTA S, SHARMA S, et al.Edible rose flowers:A doorway to gastronomic and nutraceutical research[J].Food Research International, 2022, 162:111977.
[2] PALENCIA-ARGEL M, RODR GUEZ-VILLAMIL H, BERNAL-CASTRO C, et al.Probiotics in anthocyanin-rich fruit beverages:Research and development for novel synbiotic products[J].Critical Reviews in Food Science and Nutrition, 2024, 64(1):110-126.
GUEZ-VILLAMIL H, BERNAL-CASTRO C, et al.Probiotics in anthocyanin-rich fruit beverages:Research and development for novel synbiotic products[J].Critical Reviews in Food Science and Nutrition, 2024, 64(1):110-126.
[3] LI N, WANG Q Q, XU Y H, et al.Increased glycosidase activities improved the production of wine varietal odorants in mixed fermentation of P.fermentans and high antagonistic S.cerevisiae[J].Food Chemistry, 2020, 332:127426.
[4] SUN L, SUN X Y, DU Y F, et al.Effect of the starch structure fermented by Lactobacillus plantarum LB-1 and yeast on rheological and thermomechanical characteristics of dough[J].Food Chemistry, 2022, 369:130877.
[5] 张婷阳. 玫瑰花渣发酵酵素工艺及其产品开发[D].成都:成都大学, 2023.ZHANG T Y.Technology of rose residue fermented enzyme and its product development[D].Chengdu:Chengdu University, 2023.
[6] YUE F F, ZHANG J R, XU J X, et al.Effects of monosaccharide composition on quantitative analysis of total sugar content by phenol-sulfuric acid method[J].Frontiers in Nutrition, 2022, 9:963318.
[7] YU Q, DUAN J J, YU N, et al.Enhancing the antityrosinase activity of saponins and polyphenols from Asparagus by hot air coupled with microwave treatments[J].LWT, 2020, 124:109174.
[8] QIU L Q, ZHANG M, CHANG L.Effects of lactic acid bacteria fermentation on the phytochemicals content, taste and aroma of blended edible rose and shiitake beverage[J].Food Chemistry, 2023, 405:134722.
[9] JAKUBCZYK K, MELKIS K, JANDA-MILCZAREK K, et al.Phenolic compounds and antioxidant properties of fermented beetroot juices enriched with different additives[J].Foods, 2024, 13(1):102.
[10] XU Y, JIN Y M, SU J J, et al.Changes in the nutritional value, flavor, and antioxidant activity of brown glutinous rice during fermentation[J].Food Bioscience, 2021, 43:101273.
[11] BENUCCI I, CECCHI T, LOMBARDELLI C, et al.Novel microencapsulated yeast for the primary fermentation of green beer:Kinetic behavior, volatiles and sensory profile[J].Food Chemistry, 2021, 340:127900.
[12] LI H C, HUANG J T, WANG Y Q, et al.Study on the nutritional characteristics and antioxidant activity of dealcoholized sequentially fermented apple juice with Saccharomyces cerevisiae and Lactobacillus plantarum fermentation[J].Food Chemistry, 2021, 363:130351.
[13] KAPRASOB R, KERDCHOECHUEN O, LAOHAKUNJIT N, et al.Changes in physico-chemical, astringency, volatile compounds and antioxidant activity of fresh and concentrated cashew apple juice fermented with Lactobacillus plantarum[J].Journal of Food Science and Technology, 2018, 55(10):3979-3990.
[14] 李洁莹, 杜晶, 韩飞, 等.无醇杨梅果酒发酵工艺优化及其品质分析[J].食品与发酵工业, 2016, 42(12):76-82.LI J Y, DU J, HAN F, et al.Optimization of fermentation processing of non-alcohol Chinese bayberry wine and its quality analysis[J].Food and Fermentation Industries, 2016, 42(12):76-82.
[15] WANG Y, QI X Y, FU Y, et al.Effects of Torulaspora delbrueckii co-fermented with Saccharomyces cerevisiae on physicochemical and aromatic profiles of blueberry fermented beverage[J].Food Chemistry, 2023, 409:135284.
[16] GUI H L, SUN L J, LIU R H, et al.Current knowledge of anthocyanin metabolism in the digestive tract:Absorption, distribution, degradation, and interconversion[J].Critical Reviews in Food Science and Nutrition, 2023, 63(22):5953-5966.
[17] 陈文鼎, 白卫滨, 孙建霞.食品微生物对花色苷呈色的影响[J].中国食品学报, 2023, 23(4):463-472.CHEN W D, BAI W B, SUN J X.The influence of food microorganisms on the color of anthocyanins[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(4):463-472.
[18] SHUMOY H, GABAZA M, VANDEVELDE J, et al.Impact of fermentation on in vitro bioaccessibility of phenolic compounds of tef injera[J].LWT, 2019, 99:313-318.
[19] CHEN Y, LIU F F, CHEN J, et al.Effects of fermentation conditions on physicochemical properties and flavor quality of fermented bayberry juice[J].Food Quality and Safety, 2022, 6:fyac023.
[20] WU C Y, LI T L, QI J, et al.Effects of lactic acid fermentation-based biotransformation on phenolic profiles, antioxidant capacity and flavor volatiles of apple juice[J].LWT, 2020, 122:109064.
[21] WU Y, LI S J, TAO Y, et al.Fermentation of blueberry and blackberry juices using Lactobacillus plantarum, Streptococcus thermophilus and Bifidobacterium bifidum:Growth of probiotics, metabolism of phenolics, antioxidant capacity in vitro and sensory evaluation[J].Food Chemistry, 2021, 348:129083.
[22] 李敏. 马铃薯酵素发酵工艺研究[D].杨凌:西北农林科技大学, 2018.LI M.Study on fermentation technology of potato ferment[D].Yangling:Northwest A&F University, 2018.
[23] KOKKINOMAGOULOS E, NIKOLAOU A, KOURKOUTAS Y, et al.Evaluation of yeast strains for pomegranate alcoholic beverage production:Effect on physicochemical characteristics, antioxidant activity, and aroma compounds[J].Microorganisms, 2020, 8(10):1583.
[24] ZHAO X X, TANG F X, CAI W C, et al.Effect of fermentation by lactic acid bacteria on the phenolic composition, antioxidant activity, and flavor substances of jujube-wolfberry composite juice[J].LWT, 2023, 184:114884.
[25] MELGAREJO P, CAL N-S
N-S NCHEZ
NCHEZ  ,
, ![]() L, et al.Volatile composition of pomegranates from 9 Spanish cultivars using headspace solid phase microextraction[J].Journal of Food Science, 2011, 76(1):S114-S120.
L, et al.Volatile composition of pomegranates from 9 Spanish cultivars using headspace solid phase microextraction[J].Journal of Food Science, 2011, 76(1):S114-S120.
[26] FILANNINO P, DI CAGNO R, GOBBETTI M.Metabolic and functional paths of lactic acid bacteria in plant foods:Get out of the labyrinth[J].Current Opinion in Biotechnology, 2018, 49:64-72.
[27] ZHOU X Y, GUO T, LU Y L, et al.Effects of amino acid composition of yeast extract on the microbiota and aroma quality of fermented soy sauce[J].Food Chemistry, 2022, 393:133289.
[28] RICCI A, CIRLINI M, LEVANTE A, et al.Volatile profile of elderberry juice:Effect of lactic acid fermentation using L.plantarum, L.rhamnosus and L.casei strains[J].Food Research International, 2018, 105:412-422.
[29] SIEBERT T E, BARTER S R, DE BARROS LOPES M A, et al.Investigation of ‘stone fruit’ aroma in Chardonnay, Viognier and Botrytis Semillon wines[J].Food Chemistry, 2018, 256:286-296.
[30] 易子程, 常腾文, 司慧宁, 等.本土非酿酒酵母对混合发酵威代尔冰酒风味及品质影响的比较分析[J].食品与发酵工业, 2025,51(12):215-225.YI Z C, CHANG T W, SI H N, et al.Comparative analysis of impact of local non-Saccharomyces yeasts on flavor and quality of mixed-fermented Vidal ice wine[J].Food and Fermentation Industries, 2025,51(12):215-225.
[31] 史梅莓, 伍亚龙, 吕鹏军, 等.不同乳酸菌接种发酵对泡白菜理化特征及风味的影响[J].食品与发酵工业, 2024, 50(1):80-88.SHI M M, WU Y L, LYU P J, et al.Effect of different lactic acid bacteria inoculation fermentation on the physicochemical characteristics and flavor of Chinese cabbage pickles[J].Food and Fermentation Industries, 2024, 50(1):80-88.
[32] XIAO Y, ZHANG S Y, LIU Z J, et al.Effect of inoculating Pichia spp.starters on flavor formation of fermented chili pepper:Metabolomics and genomics approaches[J].Food Research International, 2023, 173:113397.
[33] HAN S K, LIU H, HAN Y, et al.Effects of calcium treatment on malate metabolism and γ-aminobutyric acid (GABA) pathway in postharvest apple fruit[J].Food Chemistry, 2021, 334:127479.
[34] SEVINDIK O, GUCLU G, AGIRMAN B, et al.Impacts of selected lactic acid bacteria strains on the aroma and bioactive compositions of fermented gilaburu (Viburnum opulus) juices[J].Food Chemistry, 2022, 378:132079.