杨梅(Myrica rubra Sieb.et Zucc)属于杨梅科(Myricaceae)杨梅属(Myrica)的常绿乔木,是我国长江流域以南的重要水果经济作物之一,其中以浙江省栽培面积最大、产量最高[1]。绍兴市上虞区是浙江省杨梅重点产区,特产的“深红种”二都杨梅被古人称作“越中果品第一”,为绍兴特色优势林产品[2]。因杨梅采摘期短且气温和湿度较高,果实呼吸作用旺盛,同时由于杨梅的无外表皮包被特征,采后贮藏期短,导致鲜果腐烂率达30%~60%以上[3]。目前,杨梅以鲜食为主,加工产业仍然缺乏,主要用于制作浸泡杨梅酒、杨梅汁和杨梅果酱等[1]。拓展杨梅精深加工领域以降低杨梅鲜果资源浪费率并提升其附加价值,已成为当前推动杨梅产业经济提质增效的关键议题。
食用植物酵素是以可用于食品加工的植物为主要原料,添加或不添加辅料,经微生物发酵制得的含有特定生物活性成分可供人类食用的酵素产品(QB/T 5323—2018 《植物酵素》)。研究表明,益生菌发酵产生的酶系通过降解植物细胞壁促进天然产物的释放;或通过代谢引起氢化、异构化、脂化、裂解等反应,从而产生新的化学成分,显著提高原料中活性物质的多样性、利用度及功能性[4]。食用植物酵素发酵方式主要为自然发酵和接种发酵。接种发酵中普遍采用的商业益生菌制剂虽能保持安全性和稳定性,但由于原料的差异性、菌种的特异性及其对底物的偏好性可能导致发酵菌剂对特定原料发酵利用不充分、不适配或同质化[5]。传统的自然发酵主要依靠原料表面和环境中微生物进行发酵,研究表明不同地域、环境的菌种基因型多样性存在较大差异;同时,很多植物内生与外在菌群结构存在密切关联,这些菌群与植物共进化生长而更具亲和性[6]。因此,基于上虞特产“深红种”杨梅的独有风味及功能,有必要探究其自身微生物作用下的自然发酵过程,从中选育优良菌株应用于杨梅酵素制备。
有机酸是食用植物酵素特征性指标之一,不仅能抑制有害菌生长,同时能增强酵素风味的复杂性,且许多有机酸具有显著生物活性[7]。研究表明,植物原料发酵过程中有机酸组成与真菌群落演替密切相关,酵母菌属、曲霉菌属等真菌在代谢过程中能生成丰富的有机酸;同时,有机酸的产生也会改变微生态环境、影响代谢过程酶活力,从而影响真菌生理活动状态[8]。康晓乐等[9]研究表明苹果酵素自然发酵过程中假丝酵母属(Candida)、枝孢属(Cladosporium)、有孢圆酵母属(Torulaspora)等均与乳酸和柠檬酸含量呈正相关,是影响有机酸代谢的主要菌属。钟志宏[10]研究发现海带酱发酵中米曲霉和黑曲霉可能通过分泌蛋白酶、酸性羧基态酶、亮氨酸氨基肽酶等酶类生成多种有机酸。东方伊萨酵母可利用葡萄糖、乳糖等为底物,经还原性三羧酸(tricarboxylic acid,TCA)循环、氧化性TCA循环和乙醛酸分流产生乳酸和琥珀酸[11]。
本文以杨梅鲜果为主要原料进行自然发酵,通过高通量测序分析发酵过程中真菌群落组成的动态变化,采用高效液相色谱法对不同发酵阶段的琥珀酸、乳酸、乙酸、柠檬酸等有机酸进行分离、鉴定,探讨群落结构演替与有机酸组成变化的相互关系,解析杨梅自然发酵中的核心菌群,为优选高性能接种菌株及实现发酵过程理性调控提供技术依据。
1 材料与方法
1.1 材料与试剂
绍兴上虞二都“深红种”杨梅鲜果,上虞真山杨梅农民合作社;50%(体积分数)低聚果糖,广西南宁纵联科技有限公司;白砂糖,合肥农英食品有限公司。
1.2 仪器与设备
LC-20A 高效液相色谱仪,岛津公司;AllegraX-12R 型冷冻离心机,美国贝克曼库尔特有限公司;HD-650 超净工作台,上海尚道仪器制造有限公司;ABI GeneAmpR 9700 PCR仪,上海博迅实业有限公司。
1.3 实验方法
1.3.1 杨梅酵素的制备
选取未腐败变质的新鲜杨梅果实,去离子水冲洗除去表面杂质后晾干,称取450 g杨梅、450 g白砂糖与300 g低聚果糖,将少量果实平铺在2 200 mL灭菌后的玻璃发酵罐中,再加入少量白砂糖覆盖,再加入少量低聚果糖液体,按照以上顺序依次加入剩余杨梅和糖类,室温半封闭发酵60 d。分别在第5、10、15、20、30、40、50、60天取样,样品在高速离心机8 000 r/min下离心20 min,按T1、T2、T3、T4、T5、T6、T7、T8编号,-80 ℃保存,用于高通量测序及有机酸分析。
1.3.2 有机酸含量的测定
配制有机酸混合标准溶液,草酸、抗坏血酸浓度为100 mg/L,L-酒石酸浓度为500 mg/L,L-苹果酸、乳酸、乙酸、柠檬酸、琥珀酸浓度均为1 000 mg/L,莽草酸、马来酸、富马酸浓度均为10 mg/L。
有机酸含量的测定采用HPLC法。HPLC分离条件:色谱柱为Agilent TC-C18柱(250 mm×4.6 mm i.d.,5 μm),流动相为0.01 mol/L的KH2PO4溶液(用磷酸调pH=2.7),流速1 mL/min,柱温20 ℃,检测波长210 nm。待测样品用0.01 mol/L的KH2PO4溶液(pH=2.7)稀释5倍,0.22 μm微孔滤膜过滤后,待上机分析。
1.3.3 PCR扩增及Illumina Miseq测序
使用MO BIO PowerSoil DNA试剂盒提取杨梅酵素样品中微生物基因组 DNA。采用引物ITS3F/ITS4R(ITS3F引物序列:5′-GCATCGATGAAGAACGCAGC-3′;ITS4R引物序列:5′- TCCTCCGCTTATTGATATGC-3′)对 IST2区域进行PCR扩增。PCR循环条件如下:95 ℃预变性2 min;95 ℃ 变性20 s、56 ℃退火45 s、72 ℃延伸90 s,共循环35次;72 ℃最终延伸10 min。将PCR扩增后的产物置于琼脂糖凝胶电泳进行可视化检测,利用Quant-iT PicoGreen双链DNA检测试剂盒对PCR产物进行定量,最后用ChargeSwitch PCR纯化试剂盒回收纯化。所提合格的基因组DNA采用Illumina MiSeq基因测试试剂盒v3600循环(2×300 bp)在Illumina MiSeq平台上进行测序。
1.4 数据处理与分析
使用USEARCH v7.1对测序数据进行拼接和过滤,除最小重叠长度设置为50 bp外均使用默认设置。通过Qiime 2对经质量过滤序列进行处理,采用UNITE ver.8.0 Classifier作为参考数据库进行筛选和优化,并对样本序列进行分类操作单元(operational taxonomic units, OTU)划分和注释分类(相似性阈值设置为0.97)。
全部实验均平行进行3次,实验结果表示为“平均值±标准差”形式。利用SPSS 26.0进行单因素方差分析及相关性分析,利用在线galaxy服务器进行LEfSe分析,采用R语言4.3.3进行β多样性的主坐标分析(principal co-ordinates analysis, PCoA)、主成分分析(principal components analysis, PCA)以及相关性分析,并绘制图表。
2 结果与分析
2.1 杨梅酵素发酵过程中真菌群落结构变化
图1反映了杨梅酵素在发酵过程中门水平上的真菌群落分布情况。子囊菌门(Ascomycota)是整个发酵阶段的绝对优势菌门,在发酵T1~T7阶段其相对丰度均高于99%,T8时略微下降至(98.12±1.40)%(P<0.05)。研究表明,番茄酵素、蓝莓酵素、桑葚酵素、火龙果酵素的优势菌门均为子囊菌门[12]。松针复合酵素发酵阶段的15个真菌门中子囊菌门以98.38%的相对丰度成为优势菌门[13]。邹毅辉等[14]通过高通量测序分析了覆盆子酵素自然发酵过程中的菌群分布,子囊菌门为优势菌门,其相对丰度从发酵初期的99.9%降低至98.7%,与本研究结果相似。
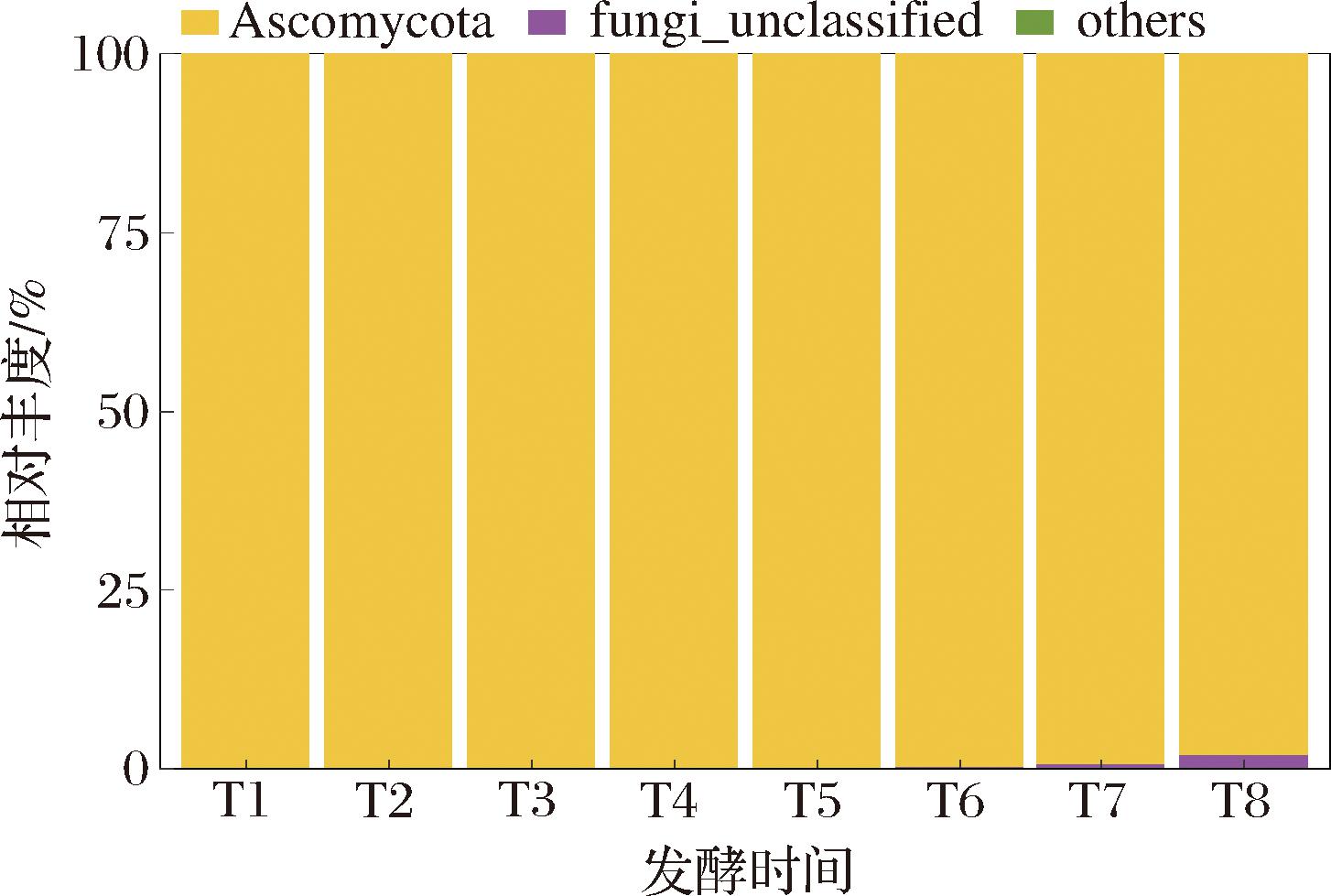
图1 杨梅酵素发酵过程中门水平上真菌群落结构变化
Fig.1 Changes on relative abundance of fungi phylum during the fermentation of bayberry Jiaosu
杨梅酵素中共检测出47个真菌属,丰度在1%以上的属有9个,分别为酵母目未分类属(Saccharomycetales fam Incertae sedis)、酵母属(Saccharomyces)、汉逊酵母属(Hanseniaspora)、许旺酵母属(Schwannionmyces)、接合酵母属(Zygosaccharomyces)、毕赤醇母属(Pichia)、未分类子囊菌门(Ascomycota unclassified)、未分类真菌(fungi unclassified)和耐热克鲁维酵母属(Lachancea)。发酵过程中杨梅酵素的真菌属分布如图2所示,T1 时酵母目未分类属的相对丰度高达(97.66±0.90)%,其次为汉逊酵母属,相对丰度为(1.65±0.56)%;酵母目未分类属在发酵前期占据压倒性优势,T1~T4阶段其平均相对丰度为98.85%,且无显著差异。随着发酵进行,酵母属相对丰度显著上升(P<0.05),T5和T6阶段分别为(29.24±7.60)%和(51.01±4.95)%,而酵母目未分类属相对丰度分别降低至(70.42±7.60)%和(48.29±4.89)%;T7~T8阶段时酵母属的平均相对丰度为91.61%,成为该发酵阶段的绝对优势菌属。在种水平上酿酒酵母(Saccharomyces cerevisiae)在发酵后期发挥主导作用。
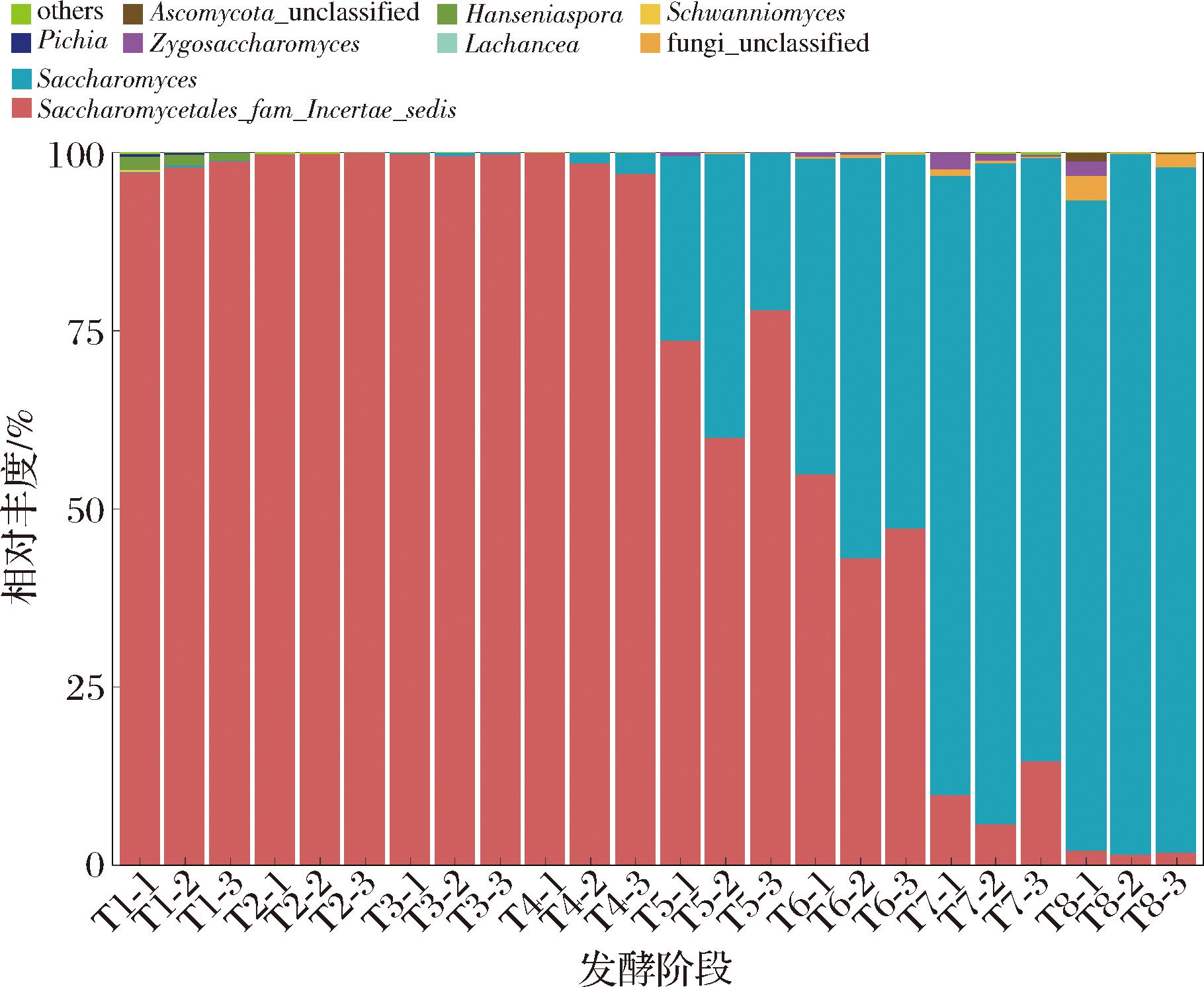
图2 杨梅酵素发酵过程中属水平上真菌群落结构变化
Fig.2 Changes on relative abundance of fungi genus during the fermentation of bayberry Jiaosu
康晓乐等[9]通过自然发酵制备苹果酵素,主要真菌包括酵母属、汉逊酵母属和接合酵母属,接合酵母属在前、后期占据优势,相对丰度为89.5%和80.3%,而汉逊酵母属在中期占据优势,相对丰度达60.6%。阴芳冉[15]研究发现,红树莓酵素自然发酵阶段前期优势微生物为酵母属,中后期优势微生物为哈萨克斯坦酵母属(Kazachstania)和汉逊酵母属。牛广财等[16]对沙棘酵素自然发酵过程微生物多样性的分析得出:随发酵时间延长,未分类酵母属代替刺盘孢属成为绝对优势菌属,相对丰度达58.06%。上述研究显示,酵母属、接合酵母属、汉逊酵母属等是食用植物酵素自然发酵过程中常见的优势真菌,但不同原料在各发酵阶段属水平上的优势菌群结构存在明显的区别。同时,鉴于杨梅酵素中真菌群落结构同样随发酵推进发生显著的变化,有必要进一步延长发酵时间监测菌群是否发生新的演替。
基于PCoA结果,发酵时间对杨梅酵素中真菌群落结构具有显著影响。图3中各分散点显示,T1~T4发酵阶段聚类较为密集,说明该阶段菌群结构受发酵时间的影响较小;T5~T6发酵阶段的真菌β-多样性相较前期产生较为明显的动态变化(P<0.001);T7~T8发酵阶段与其他阶段有明显分离,说明其群落结构不同于其他时期。杨梅酵素发酵过程中的8个时间点可明显区分为3个不同阶段,第1阶段为:T1~T4时期,酵母目未分类属为优势真菌属;第2阶段为T5~T6时期,酵母目未分类属和酵母属为优势真菌属;第3阶段为T7~T8时期,酵母属为优势真菌属。
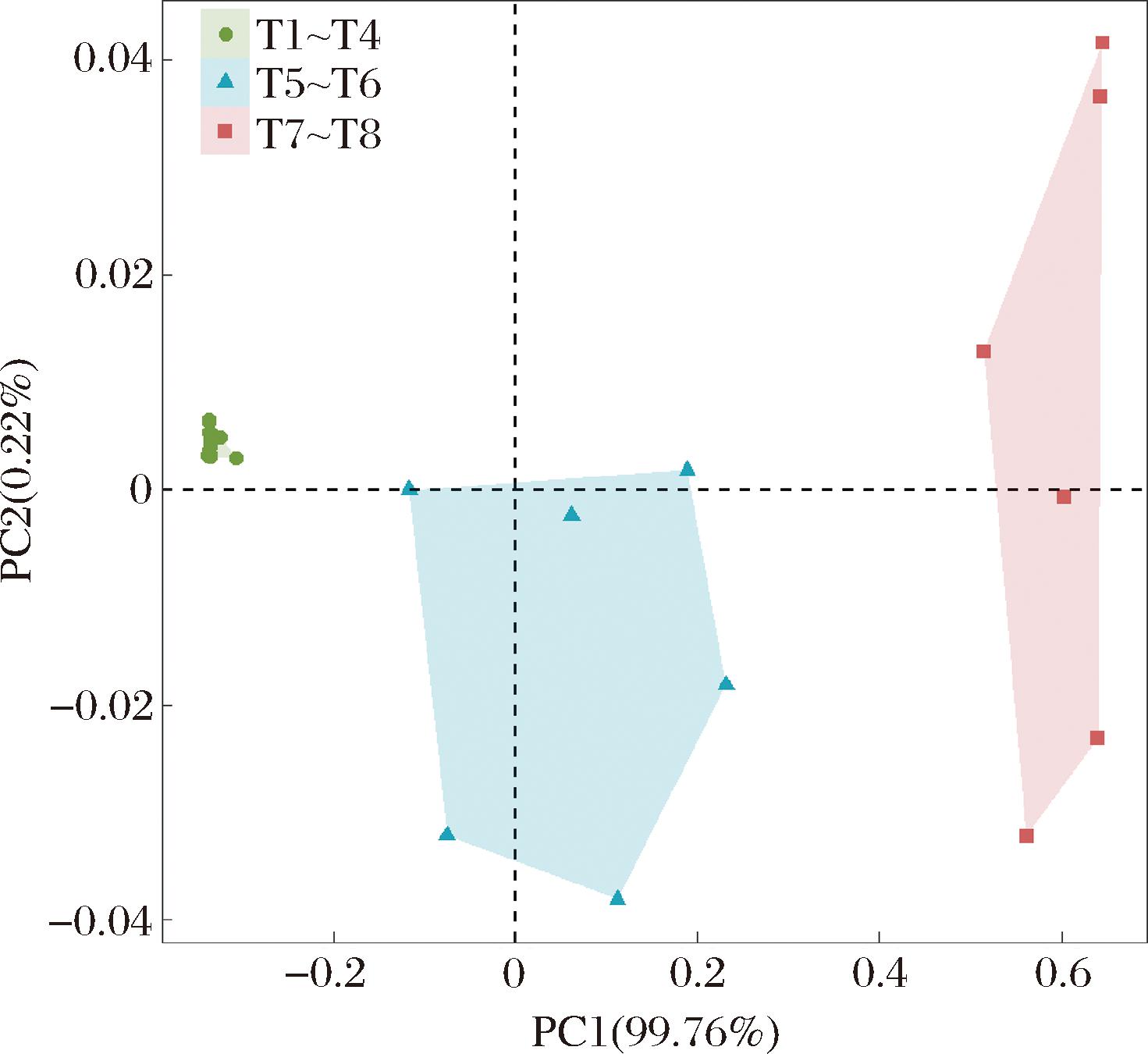
图3 杨梅酵素发酵过程中真菌β-多样性变化
Fig.3 Shift of fungal β-diversity during the fermentation of bayberry Jiaosu
通过LEfSe分析探究杨梅酵素不同发酵时间具有显著性差异的真菌类群,确定区分不同时期的重要生物标志物。根据图4,发酵过程中相对富集5个真菌类群[P<0.05,LDA(linear discriminant analysis)score>3],其中2个真菌分支LDA分值大于4,表明杨梅酵素发酵阶段含有2种明显特征的真菌物种:即T2阶段的特征真菌属酵母目未分类属和T8阶段特征真菌属酵母菌,其LDA分值分别为5.65和5.68;而T1阶段的特征真菌属是汉逊酵母、许旺酵母和毕赤醇母,其LDA分值分别为3.88、3.28和3.27。杨梅酵素发酵初期多种共存真菌可能来源于原料内生菌或表面微生物,而随着发酵进行,酵素真菌菌群的多样性和丰富度呈现降低趋势。
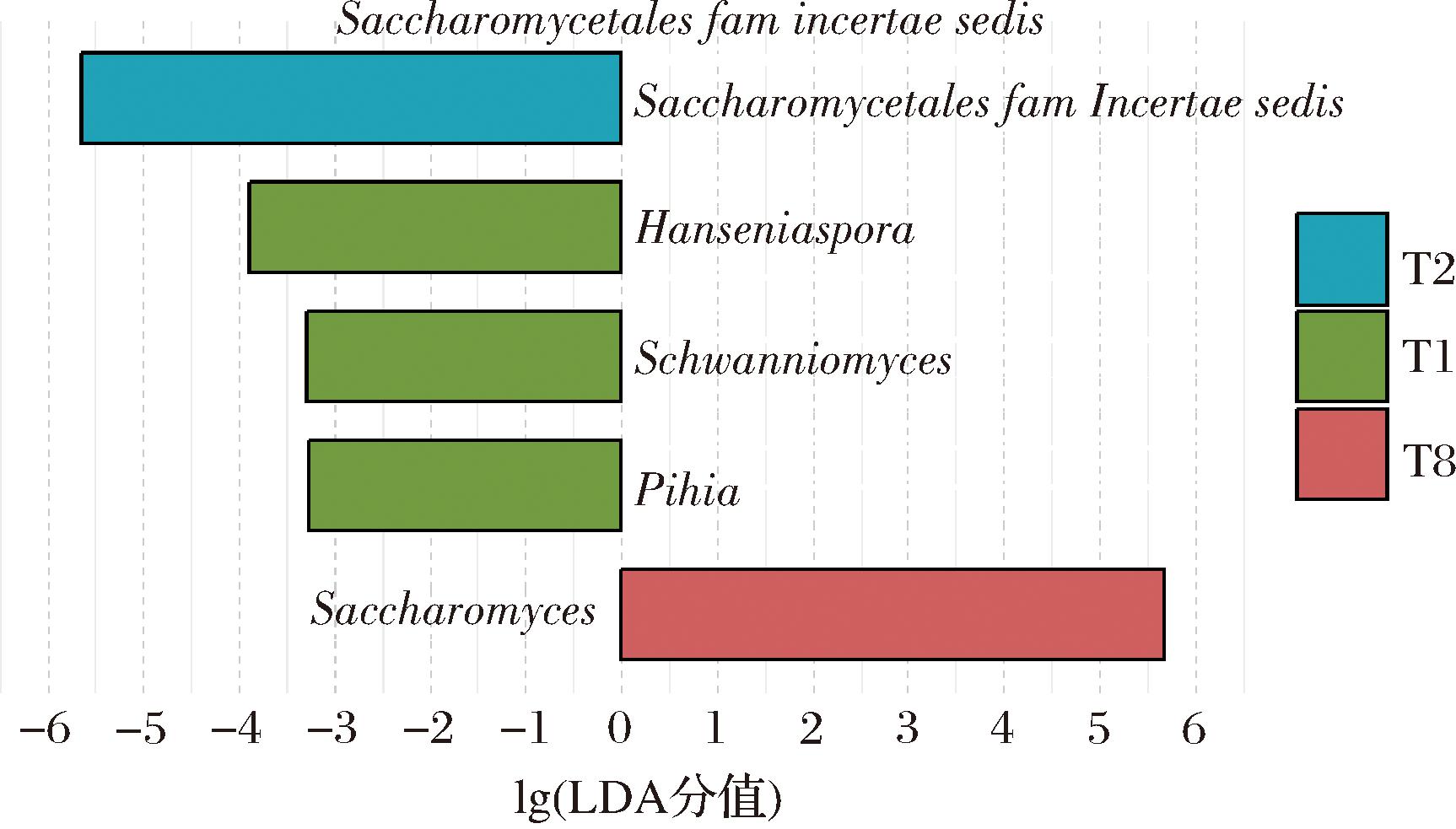
图4 基于属水平杨梅酵素发酵过程中真菌群落的LEfSe
Fig.4 Fungal LEfSe results during the fermentation of bayberry Jiaosu based on genus level
2.2 杨梅酵素发酵过程中有机酸变化
杨梅酵素中有机酸组成丰富,共检测出7种有机酸,包括苹果酸、草酸、乳酸、酒石酸、乙酸、柠檬酸和琥珀酸,发酵过程中不同有机酸的含量变化趋势存在差异(图5)。其中,琥珀酸、柠檬酸和草酸含量变化趋势类似,均随发酵时间延长持续增加,T8时其含量较T1分别增加381.31%、141.34%和297.47%;乙酸含量呈先增加后减少再升高的动态变化;酒石酸含量呈先增加后减少变化;而苹果酸和乳酸含量呈不规则变化。发酵阶段杨梅酵素中柠檬酸的含量显著高于其他有机酸(P<0.05),T8时含达(4.72±0.24) g/L;其次是乙酸和琥珀酸,含量分别为(1.66±0.06) g/L和(0.82±0.02) g/L,占总有机酸含量的79.35%。杨梅自然发酵阶段各种有机酸含量平均值排序为:柠檬酸>乙酸>琥珀酸>苹果酸>酒石酸>草酸>乳酸。许银玉[13]对松针酵素的研究同样发现琥珀酸对总有机酸的贡献显著,其他主导有机酸为苹果酸和乳酸,发酵结束时共占据总有机酸含量的94.61%。沙棘酵素中琥珀酸、胡椒酸、苯乙酸等有机酸含量较高,其中琥珀酸被认为是维持沙棘酵素风味具有重要贡献的载体之一[17]。
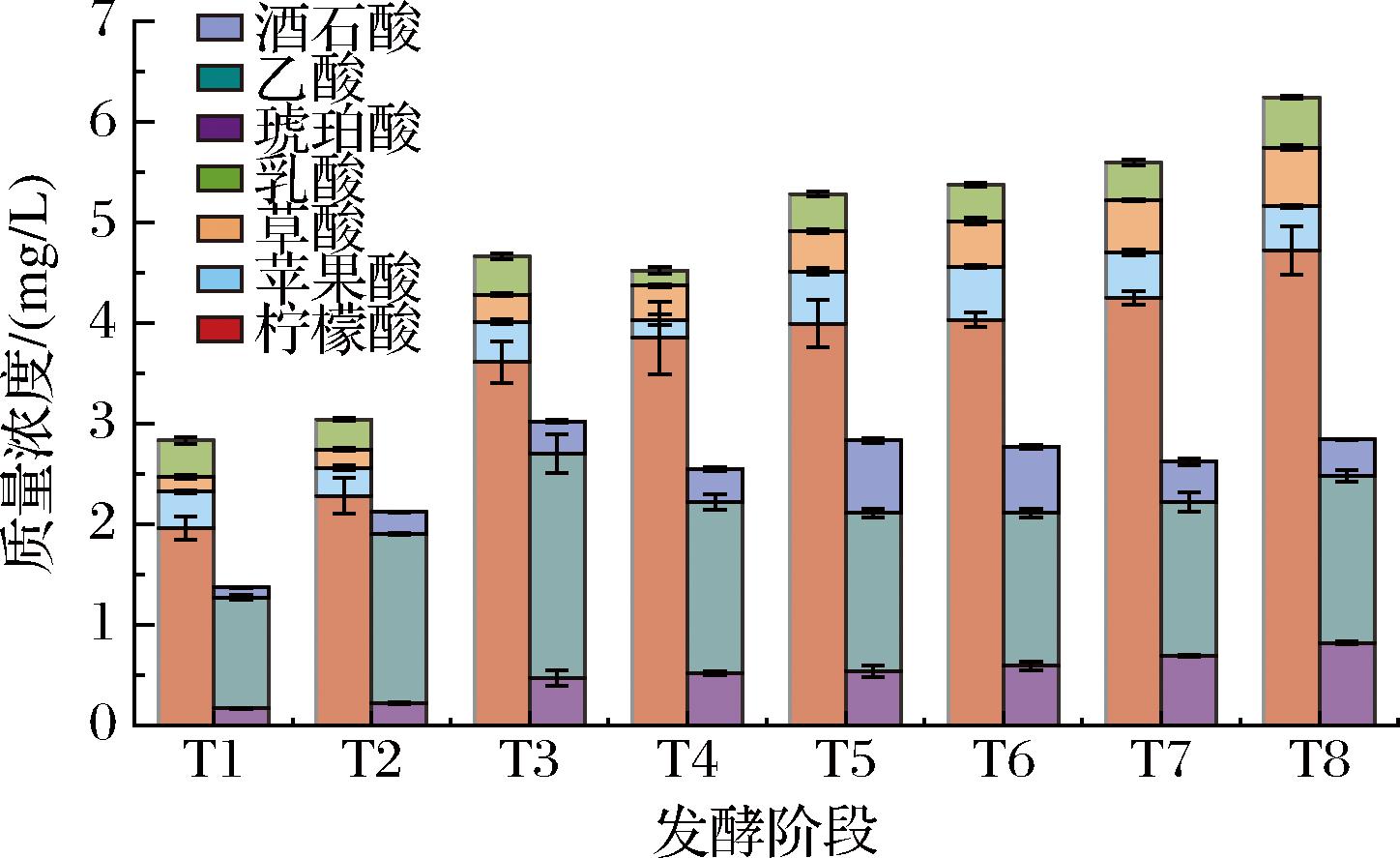
图5 杨梅酵素发酵过程中有机酸含量变化
Fig.5 Changes of organic acid contents during the fermentation of bayberry Jiaosu
对杨梅发酵过程中的有机酸含量进行PCA,其中第一主成分的贡献率为56.6%,第二主成分的贡献率为19.0%。由图6可知,PC1可以很好地将发酵T1~T2阶段、T3~T4阶段和发酵T5~T8阶段区分开来,将不同发酵时间的杨梅酵素样品分为发酵前期、发酵中期和发酵后期3个阶段。T1~T2阶段以T3~T4阶段的样品排布较为分散,说明样品在该阶段性质变化比较大;而T5~T8阶段的样品距离相近,特征差异较小;而根据PCA得分值和载荷值,有机酸含量呈现向第1主成分正向变化,发酵后期有机酸含量基本达到最高,主要包括柠檬酸、乙酸、琥珀酸等,这与发酵前后期有机酸含量变化规律相符。
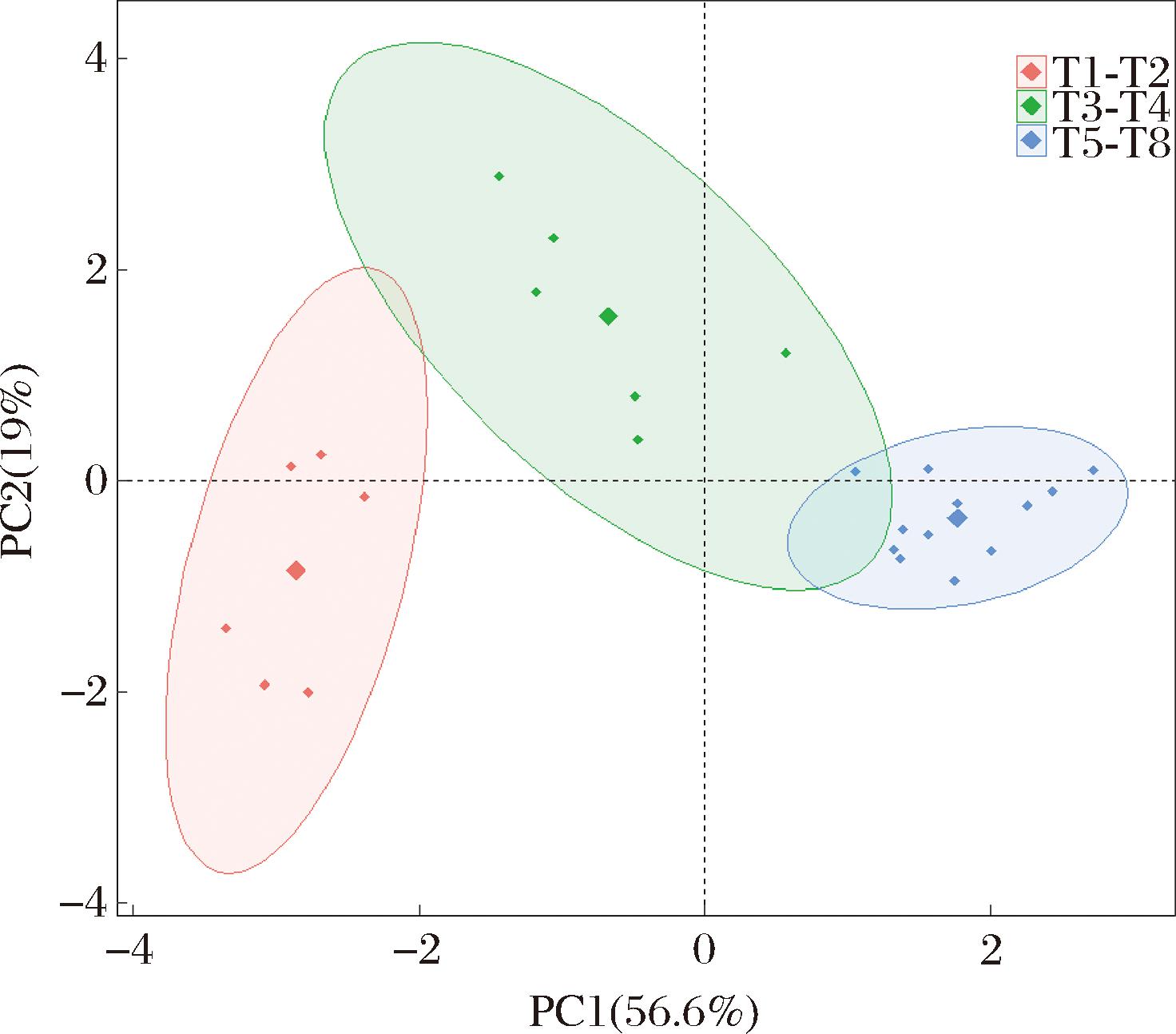
图6 杨梅酵素发酵过程中有机酸主成分分析
Fig.6 PCA results of organic acids during the fermentation of bayberry Jiaosu
2.3 杨梅酵素发酵过程真菌与有机酸变化的相关性
根据图7,杨梅酵素发酵过程中酵母菌属与琥珀酸、草酸含量均呈极显著正相关(P<0.01),与柠檬酸呈显著正相关(P<0.05),相关性系数分别为0.839、0.917和0.734。而酵母目未分类属与上述3种有机酸呈极显著负相关(P<0.01)或显著负相关(P<0.05)。此外,接合酵母和未分类真菌均与琥珀酸和草酸含量呈显著正相关(P<0.05);耐热克鲁维酵母属与乳酸和苹果酸含量呈显著负相关(P<0.05)。
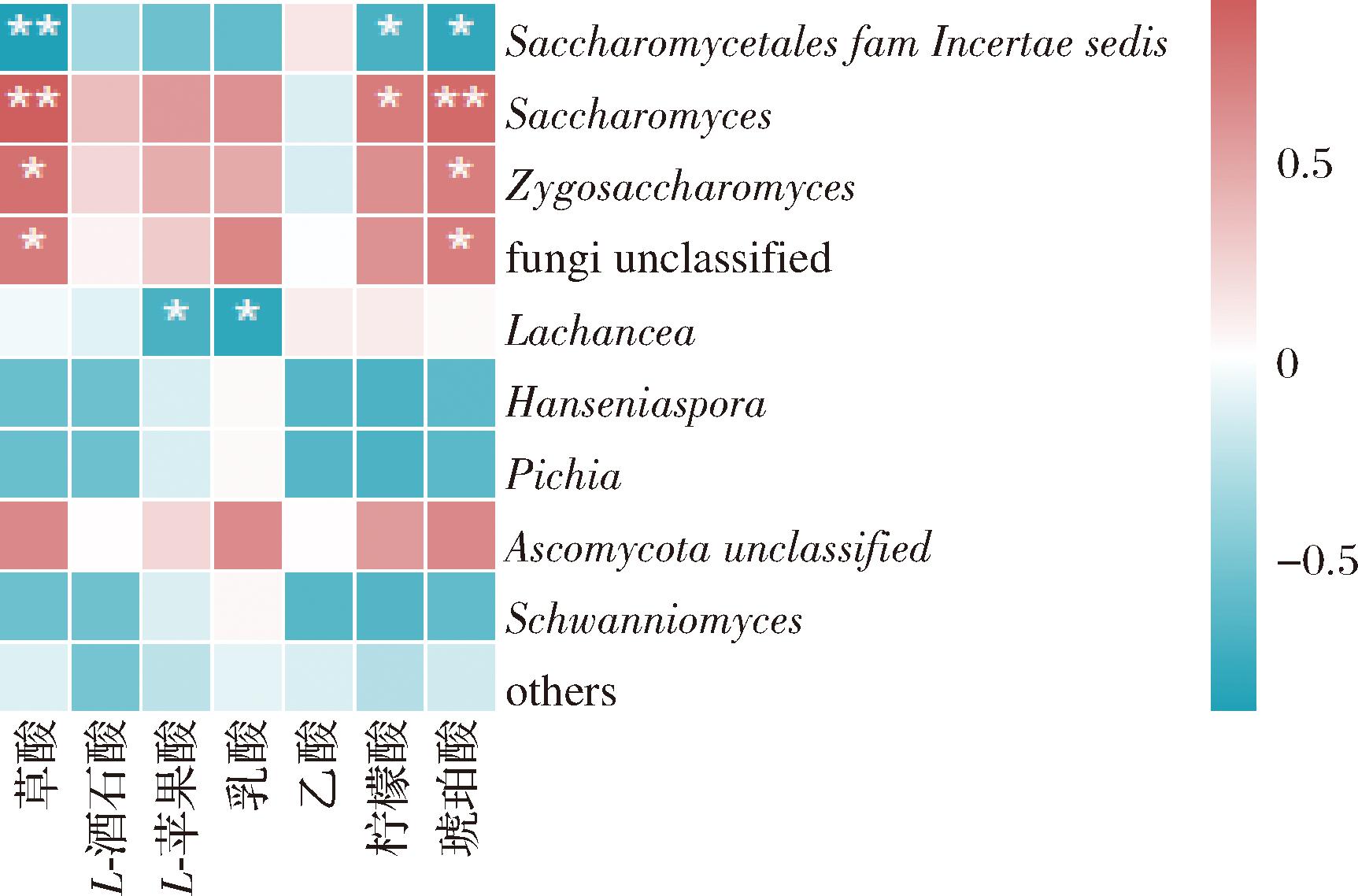
图7 杨梅酵素发酵过程中真菌群落与有机酸变化的相互关系
Fig.7 Relations between fungal community and organic acids during the fermentation of bayberry Jiaosu
注:*:P<0.05(显著相关),**:P<0.01(极显著相关)。
武林芝等[18]研究表明红树莓酵素自然发酵过程中酵母菌属与酒石酸、苹果酸呈显著负相关性,哈萨克斯坦酵母属与柠檬酸、乳酸呈显著正相关性(P<0.05);薛虎贵[19]发现醋曲中酵母菌属与琥珀酸具有显著正相关性,而发酵过程中琥珀酸与伊萨酵母属(Issatchenkia)呈显著正相关。不同发酵过程中酵母属等真菌与有机酸动态变化的相互关系存在区别,可能是因为差异的微生态环境作用下物种活性和繁殖不同或由各种来源的同类菌株所表现出的不同基因型导致。
3 讨论
杨梅酵素中真菌群落结构和多样性在发酵过程中进行了重塑,酵母属逐渐替代酵母目未分类属成为优势真菌。2种菌属相对丰度随时间的交替变化表明,菌群之间存在被动或主动的相互作用,包括发酵底物、空间和氧气的竞争或代谢物及细胞间接触等,这种竞争关系迫使酵素中竞争能力较弱的真菌逐步被更能适应微生态环境变化的真菌所替代。毕赤酵母属、汉逊酵母属和接合酵母属等非酿酒酵母广泛存在于表皮、果园环境中,在杨梅酵素发酵过程中这些菌群的生长可能因酿酒酵母的存在受到抑制,原因包括对低氧利用率耐受性较差、对酿酒酵母生长诱导产热较敏感等[20];或与酿酒酵母之间存在共生关系,虽然无法主导群落,但被认为对酵素的香气和风味具有积极贡献,例如毕赤酵母属可通过代谢生成乙酸乙酯、乙酸异戊酯等[21]。魏如腾[22]对葡萄自然发酵过程的研究表明,酵母属与毕赤酵母属、汉逊酵母属存在明显的竞争关系,并体现出更强的发酵性。酵母菌是兼性厌氧的单细胞真菌,本身含有丰富营养物质包括蛋白质、维生素、矿物质等,其细胞壁内层为葡聚糖层,外层为甘露聚糖层,这种结构对高酸度环境具有显著耐受性;同时,食用酵素发酵通常采用高糖基质,使具有高糖浓度耐受能力的酵母属在与其他物种竞争过程中具备更强的繁殖能力[20]。
杨梅酵素中起主导作用的有机酸包括柠檬酸、乙酸和琥珀酸,其中琥珀酸和柠檬酸含量均呈增加趋势(P<0.05),而琥珀酸含量增幅最大。琥珀酸可能来源于胡索酸水合酶和延胡索酸还原酶黄素蛋白亚基对苹果酸的酶解,其合成途径包括苹果酸酶途径、丙酮酸羧化酶途径、TCA循环氧化支路途径等[23]。苹果酸在苹果酸脱氢酶作用下参与TCA循环生成草酰乙酸,并进一步产生草酸、丙酮酸,或与乙酰辅酶A缩合形成柠檬酸;柠檬酸在异柠檬酸脱氢酶催化下经2次脱氢和1次底物水平磷酸化生成琥珀酸[24]。在TCA循环中,琥珀酸可由琥珀酸脱氢酶及富马酶催化脱氢和水化后生成苹果酸;苹果酸再次转化为草酰乙酸形成循环,或经苹果酸-乳酸发酵降解为乳酸[25]。柠檬酸和苹果酸均参与TCA循环和柠檬酸-丙酮酸循环,而琥珀酸不参与柠檬酸-丙酮酸循环。同时,琥珀酸可通过天冬氨酸和谷氨酸等一些氨基酸的转氨基作用产生,这些原因可能致使发酵过程中琥珀酸的富集效果最为明显。
相关性分析显示,酵母菌属与琥珀酸、柠檬酸2种主要有机酸具有显著的正相关作用(P<0.05)。琥珀酸和柠檬酸等有机酸可以是TCA循环的产物,酵母属是参与TCA循环的主要物种之一,其他还包括汉逊酵母属、接合酵母属等,它们负责循环所需基因,包括乌头酸水合酶、富马酸还原酶、富马酸水合酶和苹果酸脱氢酶;在这些酶系作用下,顺乌头酸转变为异柠檬酸,继续脱氢生成琥珀酰-CoA后转化为琥珀酸[26]。结合杨梅发酵过程中有机酸变化趋势,TCA循环中琥珀酸和柠檬酸的生成可能限制了苹果酸的积累。梁璋成等[27]研究发现琥珀酸是酵母菌酸代谢主要产物之一;红树莓酵素中酵母属的生长繁殖可能会催化琥珀酸的合成[23]。
4 结论
本文对杨梅酵素自然发酵过程中真菌群落及有机酸组成的变化进行了分析。结果表明,杨梅酵素发酵阶段的优势真菌门为子囊菌门;属水平上,酵母目未分类属和酵母属占据绝对优势,酵母属的相对丰度在T4~T8阶段呈上升变化(P<0.01),T8时达到(95.17±2.93) %。β多样性分析将发酵过程区分为3个阶段:即T1~T4 时期,优势菌为酵母目未分类属;T5~T6时期,优势菌为酵母目未分类属和酵母属;T7~T8 时期,优势菌为酵母属。杨梅酵素中共检测出 7 种有机酸,其中琥珀酸、柠檬酸和草酸含量随发酵进行增加;T8时酵素中主要有机酸为柠檬酸、乙酸和琥珀酸,含量分别为(4.72±0.24) g/L、(1.66±0.06) g/L和(0.82±0.02) g/L,发酵对杨梅酵素中琥珀酸、柠檬酸等有机酸的累积有利。杨梅酵素发酵过程中酵母菌属与琥珀酸、草酸含量均呈极显著正相关(P<0.01)。
综上所述,酵母属在杨梅自然发酵的微生物群落演替中逐渐成为绝对优势菌,并对发酵阶段琥珀酸等多种有机酸变化具有显著影响。除杨梅品种、采集地环境等因素,果实的成熟度对表面菌群多样性也有重要影响,后续可考察不同发育阶段杨梅自然发酵过程微生物群落结构的差异。此外,杨梅含有丰富的氨基酸、可溶性糖、黄酮类及酚酸类等,这些活性成分在发酵过程中的转化及其与核心菌群的作用有待明确,鉴于酵素发酵过程成分异常复杂,有必要结合代谢组学等进行多组学联合研究,全面表征发酵代谢物,探究差异代谢物与菌群的相互关系。最后,在全面地分析菌群微生态机制基础上,对优势菌株进行选育,解析发挥重要作用的代谢通路,进一步利用平行生物反应器进行高通量筛选并实现发酵工艺理性调控。
[1] 朱艳云. 杨梅渣酵素的制备及其抗氧化功能研究[D]. 浙江大学,2022.ZHU Y Y. Preparation of Chinese bayberry pomace Jiaosu and study on its antioxidant function[D]. Zhejiang University, 2022.
[2] 叶剑芳, 池小君, 贾小华. 上虞驿亭杨梅产业规模、困境及其对策思考[J]. 现代园艺, 2019(17):42-43; 55.YE J F, CHI X J, JIA X H. Industrial scale, dilemma and countermeasures of bayberry in Shangyu yiting[J]. Xiandai Horticulture, 2019(17):42-43; 55.
[3] 胡子聪, 雷琳, 周晨光, 等. 杨梅的营养功效及其应用研究进展[J]. 果树学报, 2023, 40(9):1966-1979.HU Z C, LEI L, ZHOU C G, et al. Research progress on nutritional efficacy and application of Myrica rubra[J]. Journal of Fruit Science, 2023, 40(9):1966-1979.
[4] DAI J, SHA R Y, WANG Z Z, et al. Edible plant Jiaosu: Manufacturing, bioactive compounds, potential health benefits, and safety aspects[J]. Journal of the Science of Food and Agriculture, 2020, 100(15):5313-5323.
[5] DRUMONDE-NEVES J, FRANCO-DUARTE R, VIEIRA E, et al. Differentiation of Saccharomyces cerevisiae populations from vineyards of the Azores Archipelago: Geography vs Ecology[J]. Food Microbiology, 2018, 74:151-162.
[6] 李江, 顾逸菲, 王珍珍, 等. 霍山石斛酵素发酵过程中抗氧化性能的变化[J]. 中国食品学报, 2023, 23(3):80-89.LI J, GU Y F, WANG Z Z, et al. The changes of antioxidant activity of Dendrobium huoshanense jiaosu[J]. Journal of Chinese Institute of Food Science and Technology, 2023, 23(3):80-89.
[7] GAO R C, LIU H J, LI Y, et al. Correlation between dominant bacterial community and non-volatile organic compounds during the fermentation of shrimp sauces[J]. Food Science and Human Wellness, 2023, 12(1):233-241.
[8] 苏永平.有机酸对酒醅发酵过程中风味组成及微生物群落结构动态变化的影响研究[D].四川轻化工大学,2022.SU Y P. Effects of organic acids on flavor composition and microbial community st ructure during fermentation of fermented grains[D]. Sichuan University of Science &Engineering, 2022.
[9] 康晓乐, 李东霓, 李晨, 等. 苹果自然发酵酵素微生物多样性分析[J]. 中国食品学报, 2021, 21(1):283-290.KANG X L, LI D N, LI C, et al. Analysis of microbial diversity of naturally fermented apple jiaosu[J]. Journal of Chinese Institute of Food Science and Technology, 2021, 21(1):283-290.
[10] 钟志宏.海带酱微生物发酵技术的研究与应用[D]. 福建农林大学, 2023.ZHONG Z H. Research and application of microbial fermentation technology of kelp paste[D]. Fujian Agriculture and Forestry University, 2023.
[11] XIAO H, SHAO Z Y, JIANG Y, et al. Exploiting Issatchenkia orientalis SD108 for succinic acid production[J]. Microbial Cell Factories, 2014, 13:121.
[12] 姚笛, 徐磊, 李佳慧. 三种酵素的抗氧化活性与微生物多样性的相关性研究[J]. 天然产物研究与开发, 2020, 32(6):928-936.YAO D, XU L, LI J H. Correlation research on antioxidant activity and microbial diversity of three Jiaosu[J]. Natural Product Research and Development, 2020, 32(6):928-936.
[13] 许银玉. 松针复合酵素发酵过程中微生物多样性及其代谢产物的研究[D]. 中南林业科技大学, 2024.XU Y Y. Research on microbial diversity and metabolites during Pine Needle Enzyme fermentation process[D]. Central South University of Forestry and Technology, 2024.
[14] 邹毅辉, 陈育青, 黄建军. 基于高通量测序分析覆盆子酵素自然发酵过程中的微生物多样性[J]. 中国食品添加剂, 2023, 34(9):120-126.ZOU Y H, CHEN Y Q, HUANG J J. Analysis of microbial diversity during natural fermentation of Rubus chingii Hu enzymes by high-throughput sequencing[J]. China Food Additives, 2023, 34(9):120-126.
[15] 阴芳冉. 红树莓自然发酵过程中生物活性研究与微生物多样性分析[D]. 河北农业大学, 2019.YIN F R. Bioactivity and microbial diversity analysis of Red Raspberry during the natural fermentation process[D]. Hebei Agricultural University, 2019.
[16] 牛广财, 张琪, 朱丹, 等. 沙棘酵素自然发酵过程中真菌多样性及群落结构[J]. 中国食品学报, 2022, 22(7):267-277.NIU G C, ZHANG Q, ZHU D, et al. Fungal diversity and community structure during natural fermentation of sea buckthorn jiaosu[J]. Journal of Chinese Institute of Food Science and Technology, 2022, 22(7):267-277.
[17] 范蕊, 王文文, 王腾斌, 等. 基于非靶向代谢组学分析不同发酵时期新疆沙棘酵素代谢产物的差异[J]. 食品与发酵工业, 2025, 51(10):167-176.FAN R, WANG W W, WANG T B, et al. Difference of enzyme metabolites in Xinjiang seabuckthorn during different fermentation periods based on non-targeted metabolomics[J]. Food and Fermentation Industries, 2025, 51(10):167-176.
[18] 武林芝, 郝秀萍. 自然发酵过程中红树莓的微生物多样性及活性成分研究[J]. 中国调味品, 2022, 47(5):75-78.WU L Z, HAO X P. Study on microbial diversity and active components in the natural fermentation process of Rubus idaeus L[J]. China Condiment, 2022, 47(5):75-78.
[19] 薛虎贵. 陈醋发酵过程中风味物质变化及微生物群落分析[D]. 山西大学, 2023.XUE H G. Changes of flavoring substances and microbial community in fermentation of vinegar[D]. Shanxi University, 2023.
[20] WEI R T, DING Y T, CHEN N, et al. Diversity and dynamics of microbial communities during spontaneous fermentation of Cabernet Sauvignon (Vitis vinifera L.) from different regions of China and their relationship with the volatile components in the wine[J]. Food Research International, 2022, 156:111372.
[21] 王倩倩, 覃杰, 马得草, 等. 优选发酵毕赤酵母与酿酒酵母混合发酵增香酿造爱格丽干白葡萄酒[J]. 中国农业科学, 2018, 51(11):2178-2192.WANG Q Q, QIN J, MA D C, et al. Aroma enhancement of ecolly dry white wine by co-inoculation of selected Pichia fermentans and Saccharomyces cerevisiae[J]. Scientia Agricultura Sinica, 2018, 51(11):2178-2192.
[22] 魏如腾. 葡萄-葡萄酒自然体系中微生物多样性及其对葡萄酒风味物质的作用[D]. 西北农林科技大学, 2023.WEI R T. Microbial diversity in the grape-wine natural system and its effects on wine flavor compounds[D]. Northwest A&F University, 2023.
[23] 禹伟, 高教琪, 周雍进. 一碳生物转化合成有机酸的研究进展[J]. 合成生物学, 2024, 5(5):1169-1188.YU W, GAO J Q, ZHOU Y J. Bioconversion of one carbon feedstocks for producing organic acids[J]. Synthetic Biology Journal, 2024, 5(5):1169-1188.
[24] 窦志霞, 何兴芬, 薛宇航, 等. 猕猴桃酵素的乳酸菌和酵母菌发酵特性及成分变化[J]. 中国食品学报, 2024, 24(9):322-332.DOU Z X, HE X F, XUE Y H, et al. The fermentation characteristics and composition changes of fermented kiwifruit extract by lactic acid bacteria and yeasts[J]. Journal of Chinese Institute of Food Science and Technology, 2024, 24(9):322-332.
[25] CHEN C, LU Y Q, YU H Y, et al. Influence of 4 lactic acid bacteria on the flavor profile of fermented apple juice[J]. Food Bioscience, 2019, 27:30-36.
[26] GIBBS M E, BOWSER D N. Astrocytes and interneurons in memory processing in the chick hippocampus: Roles for G-coupled protein receptors, GABA(B) and mGluR1[J]. Neurochemical Research, 2009, 34(10):1712-1720.
[27] 梁璋成, 何志刚, 林晓婕, 等. 黄酒酿造酵母菌发酵过程的有机酸代谢研究[J]. 福建农业学报, 2016, 31(3):289-292.LIANG Z C, HE Z G, LIN X J, et al. Study on organic acid metabolism of rice wine yeast durling fermentation[J]. Fujian Journal of Agricultural Sciences, 2016, 31(3):289-292.