大曲,作为中国传统酒精发酵饮品白酒的发酵剂,根据发酵工艺中达到的温度阈值差异,大曲通常分为高温大曲、中高温大曲和低温大曲。其中,中高温大曲通常是使用小麦再辅以豌豆等辅料按照一定比例加水拌合压制而成,其制曲发酵过程中最高温度能达到50~60 ℃[1]。曲胚中小麦颗粒与添加的辅料、水分以及微生物胞外代谢产物混合形成了与土壤介质类似的多孔环境[2];在这种环境条件下,水分传递影响微生物在多孔基质内定殖,保证发酵过程大曲温度稳定性[3]。促使其在发酵过程中形成了独特的微生物结构和风味化合物[4-5]。而大曲发酵过程中芽孢杆菌因耐高温和抗氧化特性成为常见的优势菌群,因其在大曲风味的形成以及淀粉糖化和液化能力方面的关键作用,受到广泛研究。目前的研究中,对芽孢杆菌(Bacillus)的贡献分析依旧以风味形成和理化性质贡献的分析为主;LI等[6]和刘青阳等[7]的研究表明,芽孢杆菌可以增加大曲中酯类、吡嗪类物质的含量,强化风味;LI等[8]的研究体现了芽孢杆菌的群落结构调控作用,解淀粉芽孢杆菌(Bacillus amyloliquefaciens)和绒毛芽孢杆菌产生的抗真菌脂肽对大曲霉菌存在抑制作用。以上对大曲中芽孢杆菌的研究主要针对其代谢酶系、风味物质的产生和其群落调控能力,对芽孢杆菌在大曲发酵升温过程中占据优势地位的原因以及对大曲发酵调控机制的分析相对欠缺。
生物膜是微生物附着于惰性或活性实体的表面,繁殖、分化,并分泌一些多糖基质,将菌体群落包裹其中而形成的聚合体膜状物,其可以营造一个菌体与营养物质、水分和其他代谢物混合的相对独立的环境,并强化微生物的抗逆性,对生物膜的相关研究也已经证明了生物膜在环境调控中的作用。KANG等[9]发现在白酒发酵体系中,微生物的相互作用关系会受到生物膜的影响,产生从合作到竞争的转变,同时,生物膜中的酵母菌与乳酸菌可以增强有氧呼吸,并改变发酵底物中淀粉与蔗糖的呈现模式;同样的,在大曲发酵过程中产膜微生物代谢产生的生物膜可能会对大曲的底物分解、菌群结构调控以及理化指标的变化产生一定的影响。SUN等[10]发现红球菌SM-1菌株的胞外多糖由于具有多羟基的结构,因此比甘油(一种吸湿性很强的多元醇)更具吸湿性,并且在保湿性能方面优于透明质酸。胞外多糖作为生物膜的重要组成部分,也会协助改变微生物与环境之间的关系,富集环境中的水分。芽孢杆菌是一种典型的产膜微生物,它可以通过生物膜在一定程度上调控自身周围的生存环境[11],因此本研究从芽孢杆菌的产膜特性出发,分析芽孢杆菌在大曲发酵过程中的抗逆机制,以及生物膜对发酵进程的具体影响。
本研究使用了扩增子测序分析了中高温大曲4个发酵阶段的微生物群落结构,并利用实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qPCR)方法对高温条件下筛选出的3株芽孢杆菌进行生物量检测,结合结晶紫染色法对芽孢杆菌生物膜的形成能力进行分析,分析生物量变化与生物膜形成能力之间的关系,最后使用离子色谱法检测了芽孢杆菌胞外代谢产物的成分差异,验证并解释了芽孢杆菌代谢产生生物膜对大曲的水分代谢的调控机制,为筛选并优化产膜微生物提升大曲发酵品质提供了新的解释角度,回归实际生产过程中使用芽孢杆菌进行原位强化发酵以提高大曲的发酵品质提供了新的参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
解淀粉芽孢杆菌GKT04,地衣芽孢杆菌(Bacillus licheniformis)SCDB和赖氨酸芽孢杆菌(Lysinibacillus)anQ-h6均筛选分离自江苏连云港一酒厂发酵第7天的中高温大曲,由江南大学智能与合成发酵研究室保藏。
1.1.2 试剂
葡萄糖、蛋白胨、酵母浸出粉、牛肉膏、NaCl、结晶紫、甲酸、乙酸、HCl、大豆粉木瓜酶消化物、胰蛋白胨,磷酸氢二钾、十二水磷酸氢二钠、氯化钾、磷酸二氢钾、氯仿、正丁醇,葡萄糖、木糖、N-乙酰葡萄糖、阿拉伯糖、岩藻糖和鼠李糖,国药集团化学试剂有限公司;DNA提取通用试剂盒和2×SYBR qPCR mix,南京诺唯赞生物科技股份有限公司;E.Z.N.ATM Mag-Bind土壤DNA试剂盒,美国Omega Bio-tek公司。
1.2 仪器与设备
SW-CJ-1FD超净工作台,苏州净化设备有限公司;HH-3A数显恒温水浴锅,国华(常州)仪器制造有限公司;SCIENTZ-10 N真空冷冻干燥箱,宁波新芝生物科技股份有限公司;HWS-150B恒温恒湿箱,上海博讯实业有限公司医疗设备有限公司;K3酶标仪,上海腾名生物科技有限公司;Step One Plus实时荧光定量PCR仪,美国应用生物系统公司;Quanta 200电子显微镜,美国FEI公司;ED5000脉冲安培检测器,赛默飞世尔科技(中国)有限公司;Hitachi HCP-2临界点干燥器和Hitachi Model E-1010离子溅射器,适安佳(北京)生物科技有限公司。
1.3 实验方法
1.3.1 培养基和试剂的配制
胰蛋白胨大豆肉汤(tryptic soy broth,TSB)液体培养基(g/L):大豆粉木瓜酶消化物3、胰蛋白胨17,磷酸氢二钾2.5、葡萄糖2.5、NaCl 5。
LB液体培养基(g/L):蛋白胨10、NaCl 5、酵母浸出粉5。
LB固体培养基:与LB液体培养基相同,另加20 g/L的琼脂粉。
PBS缓冲液(g/L):十二水磷酸氢二钠3.581、氯化钾0.2、磷酸二氢钾0.24、NaCl 8,用HCl调节pH值至7.4。
1.3.2 菌株活化与培养
用接种环从甘油保藏管中蘸取少量菌液,在LB固体培养基上进行三区划线,随后倒置于37 ℃恒温培养箱中培养24 h。挑取单菌落于5 mL LB液体培养基中,37 ℃培养12 h。以体积分数为1%的接种量将培养液接种到新鲜的LB液体培养基或TSB液体培养基中,培养48 h后得到活化的种子液或细菌培养物。
1.3.3 中高温大曲的扩增子检测
使用E.Z.N.ATM Mag-Bind土壤DNA试剂盒参考描述的从大曲中提取总基因组DNA的方法,以及2个PCR扩增引物细菌16S rRNA和真菌内部转录间隔区1(ITS1)的v3~v4区通过引物338F(ACTCCTACGGGAGGCAGCA)和806R(GGACTACHVGGGTWTCTAAT)进行PCR扩增;分别为2043-ITS1F(CTTGGTCATTTA-GAGGAAGTAA)/2043-ITSR(GCTGCGTTCTTCATCGATGC)。第2轮扩增旨在引入Illumina桥式PCR兼容引物,将PCR管置于PCR仪器中进行扩增。PCR扩增程序包括在95 ℃下预变性3 min;94 ℃ 30 s、58 ℃ 20 s和72 ℃ 30 s的20个循环,并在72 ℃下延伸5 min。通过2%琼脂糖凝胶电泳检测文库大小,并使用Qubit 3.0荧光定量仪测定文库浓度。所有样品均以1∶1等质量混合[12]。
1.3.4 模拟大曲发酵实验
取110 g小麦粉碎后置于500 mL锥形瓶中,加入20 mL蒸馏水,在121 ℃下20 min高压蒸汽灭菌后晾凉加入20 mL种子液(混和菌株条件下每种菌株种子液添加10 mL)和40 mL无菌水使用灭菌后的取样匙搅拌均匀,放置于恒温培养箱中培养,设置温度为28、37、42、47、52 ℃,每个温度下培养2 d[13]。
1.3.5 芽孢杆菌的生物量的qPCR检测
取各个时间段的大曲样品5 g,加入10 mL PBS振荡混匀,随后于6 000 r/min下离心4 min,重复上述操作3次,随后取用上清液25 mL,随后采用8 000 r/min下离心8 min,去上清液,加入1 mL蒸馏水重悬沉淀,随后使用DNA提取通用试剂盒提取基因组;最后使用表1中所示引物进行荧光定量PCR检测芽孢杆菌生物量;荧光定量PCR反应的反应体系为:2×SYBR qPCR mix 12.5 μL,上游引物0.5 μL,下游引物0.5 μL,待检测样品总基因组DNA 2.5 μL,ddH2O 9 μL;荧光定量PCR反应的反应程序为:95 ℃预变性3 min;95 ℃变性5 s,60 ℃退火、延伸20 s,采集荧光信号,设置40个循环;熔解曲线分析:95 ℃变性15 s,60 ℃退火、延伸1 min,95 ℃变性15 s,60 ℃退火、延伸15 s[14]。
引物设计使用了NCBI数据库,分别使用了NZ_CP072120.1,NZ_CP014842.1和NZ_CP084108.1中的菌株序列信息设计引物(表1)。
表1 菌株和其引物信息表
Table 1 Strains and their primer information table
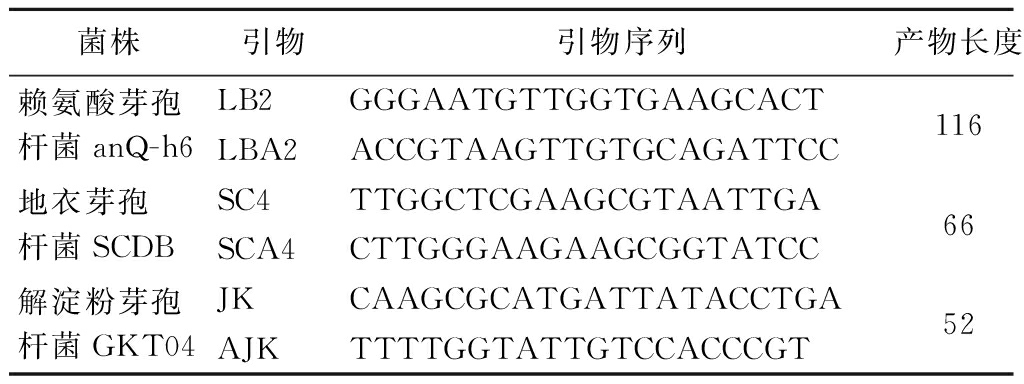
菌株引物引物序列产物长度赖氨酸芽孢杆菌anQ-h6LB2GGGAATGTTGGTGAAGCACT116LBA2ACCGTAAGTTGTGCAGATTCC地衣芽孢杆菌SCDBSC4TTGGCTCGAAGCGTAATTGA66SCA4CTTGGGAAGAAGCGGTATCC解淀粉芽孢杆菌GKT04JKCAAGCGCATGATTATACCTGA52AJKTTTTGGTATTGTCCACCCGT
1.3.6 菌株生物膜生成能力检测
生物膜的形成能力使用结晶紫染色法测定。将细菌培养物稀释至106 CFU/mL。在96孔板中,每孔加入50 μL目标细菌培养物和50 μL其他细菌培养物或TSB培养基混合。在37 ℃孵育24 h后,弃去细胞悬液,用水冲洗威尔斯孔。加入结晶紫溶液(10 g/L)染色,30 min后提取染色液。使用酶标仪测量570 nm处的OD值。在37 ℃下再孵育24 h后,将平板冲洗2次以除去剩余的生物膜。使用前述方法测量剩余的生物膜[15],生物膜形成率计算如公式(1)所示:
生物膜形成率![]()
(1)
1.3.7 大曲的理化指标测定
大曲发酵过程中大曲水分含量、糖化力、液化力的测定按QB/T 4257—2011《酿酒大曲通用分析方法》进行。
1.3.8 生物膜胞外多糖的离子色谱检测
取干燥大曲样品1 g,用20 mL超纯水溶解,在15 ℃条件下超声60 mL,静置后取上清液4 mL,离心取上清液,再使用1/4体积的Sevage试剂[V(氯仿)∶V(正丁醇)=5∶1]去除样品中的蛋白,离心取2 mL水相,稀释10倍后作为待测样品。标准品制备:分别取50 mg的葡萄糖、半乳糖、木糖、N-乙酰葡萄糖、阿拉伯糖、岩藻糖、鼠李糖分别于烧杯中溶解,随后用50 mL容量瓶定容,配制成终质量浓度为1 g/L的标准溶液,随后分别稀释到20 mg/mL,混合作为标准品。样品与标准品在检测前均需要通过0.22 μm滤膜。使用色谱柱Carbo Pac PA10,流动相:18.2 MΩ超纯水、250 mmol/L NaOH、1.0 mol/L CH3COONa。样品进样体积10 μL,柱温30 ℃,ED5000脉冲安培检测器[16]。
1.3.9 生物膜的扫描电子显微镜(scanning electron microscope, SEM)图像检测
首先将样品分散成小的颗粒,在-80 ℃条件下冷冻6 h,随后使用真空冷冻干燥器干燥24 h,切取小片样品作为待测样品,最后用Hitachi HCP-2临界点干燥器进行脱水。然后在Hitachi Model E-1010离子溅射器中用金-钯涂覆脱水的样品4~5 min[15]。最后使用Quanta 200电子显微镜在5 000×(10 μm)倍数下进行观察拍摄。
1.4 数据统计分析
所有数据使用SPSS 25.0分析处理,组间的统计分析采用单因素方差分析(ANOVA)进行比较,P<0.05 表示具有显著性差异;使用Origin 2021和Adobe Illustrator 2022进行绘图。
2 结果与分析
2.1 中高温大曲中微生物结构与水分变化
2.1.1 中高温大曲中微生物结构分析
通过扩增子检测的方法检测分析了大曲样品的微生物结构与相对丰度变化。从12个大曲样品当中共检测出1 103个细菌操作分类单元(operational taxonomic unit,OTU)和80个真菌OTU,在4个发酵阶段细菌的OTU数量均远高于真菌OTU,在发酵第17天,细菌的OTU数量最高,达到了617个OTU,在4个发酵阶段有237个相同的细菌OTU(图1-a);真菌在发酵第3天具有最高的OTU,达到了67个OTU,随着发酵的进行,OTU的数量显著下降,4个发酵阶段仅有32个相同的真菌OTU(图1-b)。中高温大曲的发酵过程中,Limosilactobacillus、Lactobacillus、Weissella、Thermoactinomyces、Lactococcus、Bacillus和Acetobacter在发酵过程中的平均丰度均大于1%,是主要的优势细菌属;Bacillus在发酵0 d时相对丰度低于0.2%,但随着发酵进行,对比发酵初期相对丰度显著提高,达到了2.9%(图1-c),在发酵中后期占据了优势地位,相比其他细菌属,Bacillus随着发酵的进行,相对丰度的提升幅度最大,芽孢杆菌作为一种典型的耐热菌,可能是受到了温度的选择因此成为了发酵中后期的优势种[17]。发酵过程中的优势真菌属相对较少,Pichia、Rhizopus、Blumeria、Lichtheimia、Candida和Rhizomucor为主要的优势属,发酵过程中的平均相对丰度大于1%(图1-d)。由于大曲发酵的相关影响因素多而复杂,因此本研究中的优势菌群相较于其他研究存在一些差异[18-19],这可能是由于地理环境因素引起的,由于不同地区的气候条件存在明显差异,并且环境微生物的种类也有所不同,导致大曲发酵过程中的理化指标和群落结构存在一定差异[20],但芽孢杆菌依旧普遍存在于各个地区的中高温大曲中,并对大曲发酵产生作用[17]。
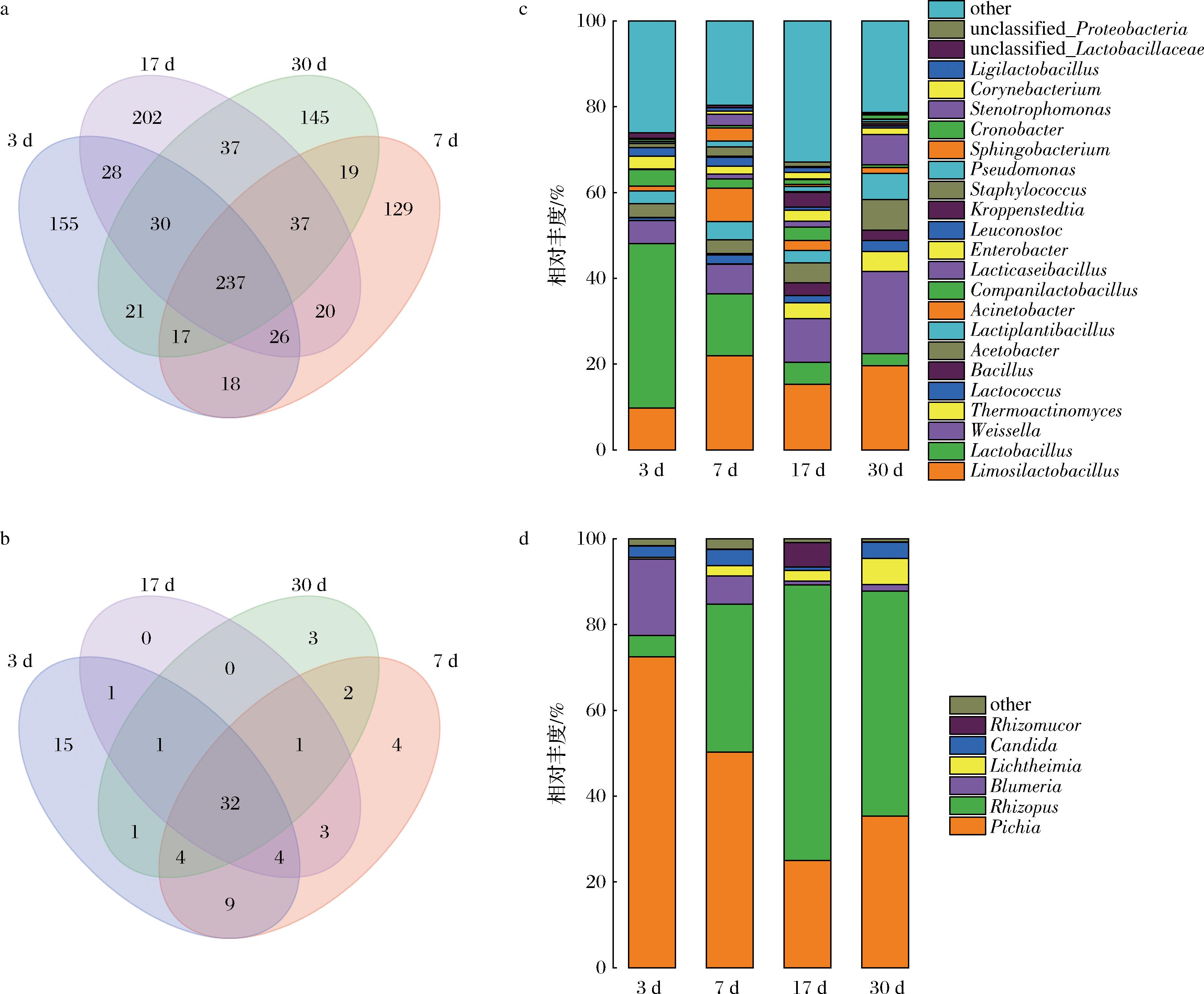
a-细菌OTU韦恩图;b-真菌OTU韦恩图;c-细菌属相对丰度构成;d-真菌属相对丰度构成
图1 中高温大曲发酵过程中4个时期的微生物构成
Fig.1 Composition of microorganisms in four stages of medium-high temperature Daqu fermentation
2.1.2 中高温大曲中水分变化分析
为了确认大曲水分变化情况,同时检测了大曲样品的水分含量。在发酵第0~17天,水分呈现稳定的下降趋势,但在17~23 d时存在一个小幅度的回升,随后再下降(图2-a),水分降低速率在0~17 d不断是上升,在第17天达到最高,在第23天水分有所回升,相对于第17天,在发酵第33天,水分的变化速率有一定降低(图2-b);在相关的研究中,通常的结论是,发酵后期由于温度降低,水分蒸发会逐渐减少甚至于停止[21],因此水分含量几乎不再降低。
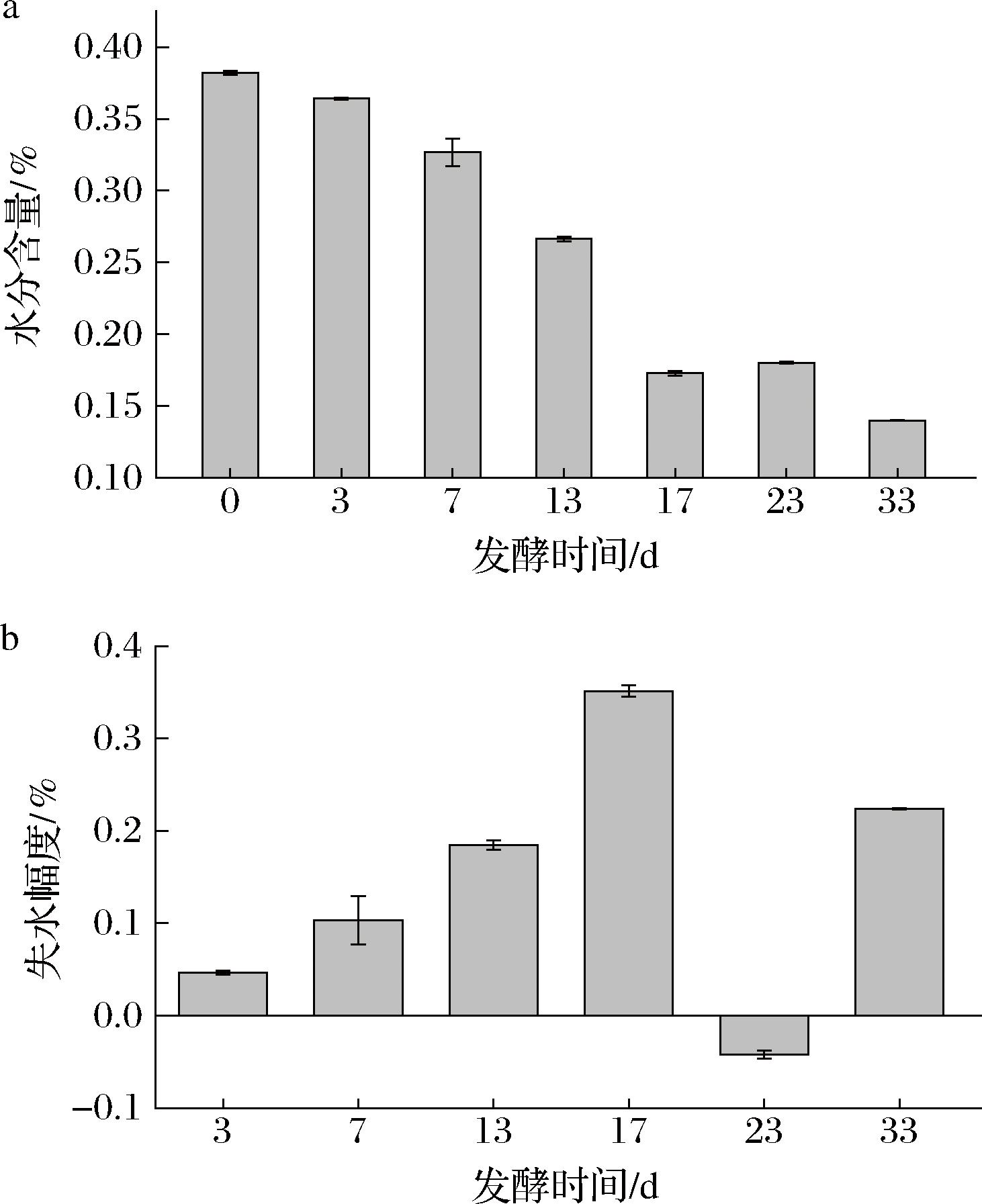
a-水分含量变化;b-失水幅度
图2 中高温大曲发酵过程中的水分含量变化
Fig.2 Changes of moisture content during fermentation of medium-high temperature Daqu
2.1.3 中高温大曲中芽孢杆菌的生长状况分析
有研究已经表明芽孢杆菌与大曲的酸度、发酵力和水分之间存在着显著的正相关关系,但具体的相关机制没有明确的解析[22]。为了确定芽孢杆菌在生长过程中如何影响大曲水分变化,对大曲样品中筛选出的3株芽孢杆菌建立了荧光定量PCR检测方法,对其生物量做了检测。如图3所示,在发酵的0~7 d内,解淀粉芽孢杆菌GKT04与地衣芽孢杆菌SCDB生物量明显提高,地衣芽孢杆菌SCDB在发酵前期生物量为(1.6±0.028) lg CFU/g,在发酵第7~17天生物量有一定降低,在发酵后期达到了(3.9±0.03) lg CFU/g,解淀粉芽孢杆菌GKT04在发酵第7天生物量达到峰值(5.5±0.037) lg CFU/g,在随后的发酵阶段生物量均在4.4 lg CFU/g以上,而赖氨酸芽孢杆菌anQ-h6在温度上升阶段的生长受到了一定的抑制,在发酵第7天生物量几乎未检出,在发酵后期生物量峰值也仅为(2.6±0.038) lg CFU/g。解淀粉芽孢杆菌GKT04在发酵过程中表现出显著高于其他2种菌株的生物量,对比其他2种菌株在大曲发酵过程中占据优势地位。芽孢杆菌菌株生物量在17~23 d提高的趋势与2.1.2节中水分回升的现象存在一定的吻合,因此推测水分变化与芽孢杆菌的生长也存在一定的联系。
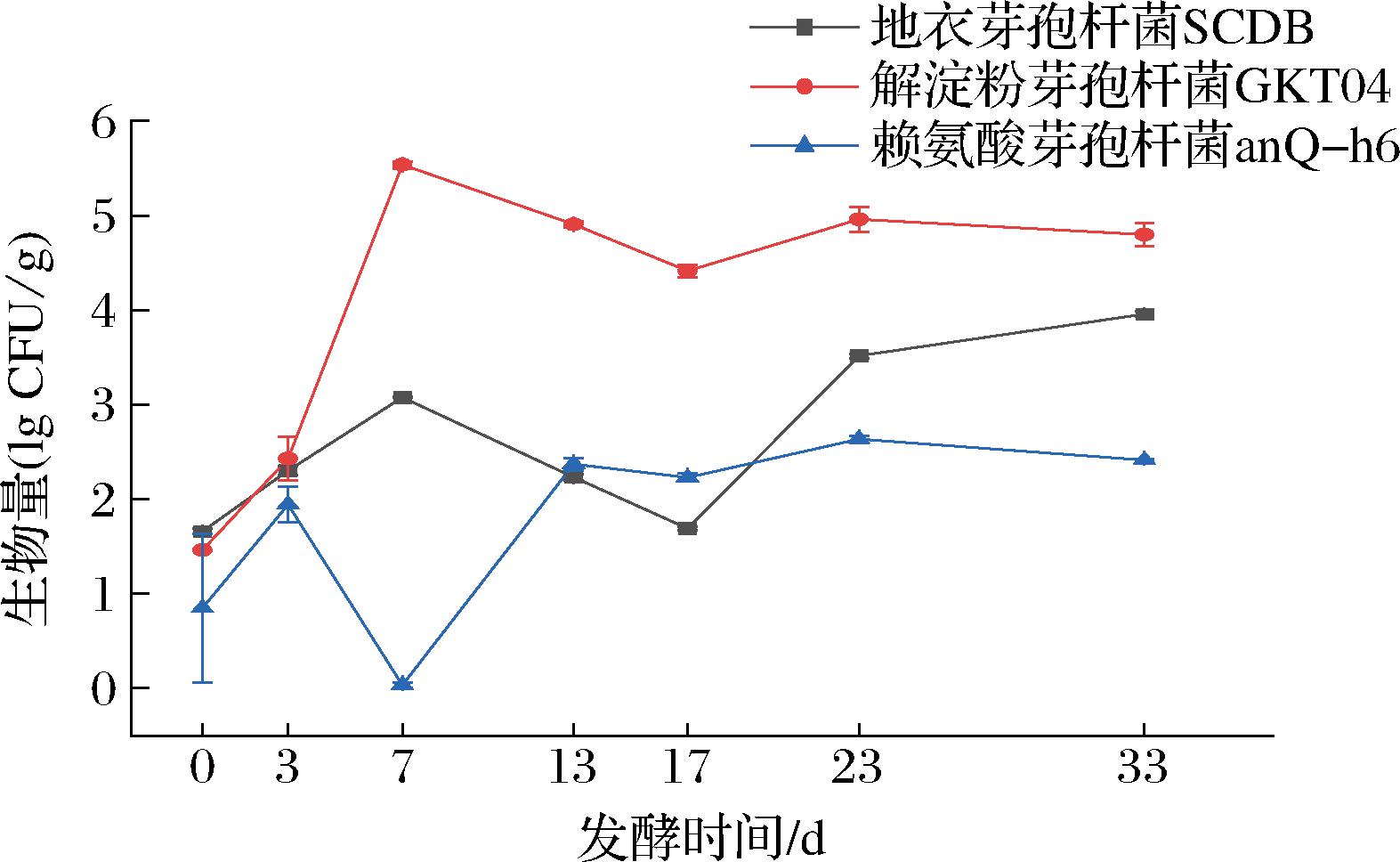
图3 中高温大曲发酵过程中芽孢杆菌的生物量变化
Fig.3 Biomass changes of Bacillus during fermentation of medium-high temperature Daqu
2.2 芽孢杆菌生物膜的相关性质解析
2.2.1 芽孢杆菌的生物膜形成能力检测
为了评估筛选出的芽孢杆菌的生物膜形成能力,通过结晶紫染色法检测了不同芽孢杆菌菌株的生物膜形成能力。如图4所示,解淀粉芽孢杆菌GKT04的生物膜形成能力相对高于地衣芽孢杆菌SCDB与赖氨酸芽孢杆菌anQ-h6菌株1倍以上;而具有更丰富的生物膜的微生物通常对恶劣环境的抗性更强[23],这表明更强的生物膜生成能力是解淀粉芽孢杆菌GKT04在2.1.3节的研究中生物量相对更高的原因之一。
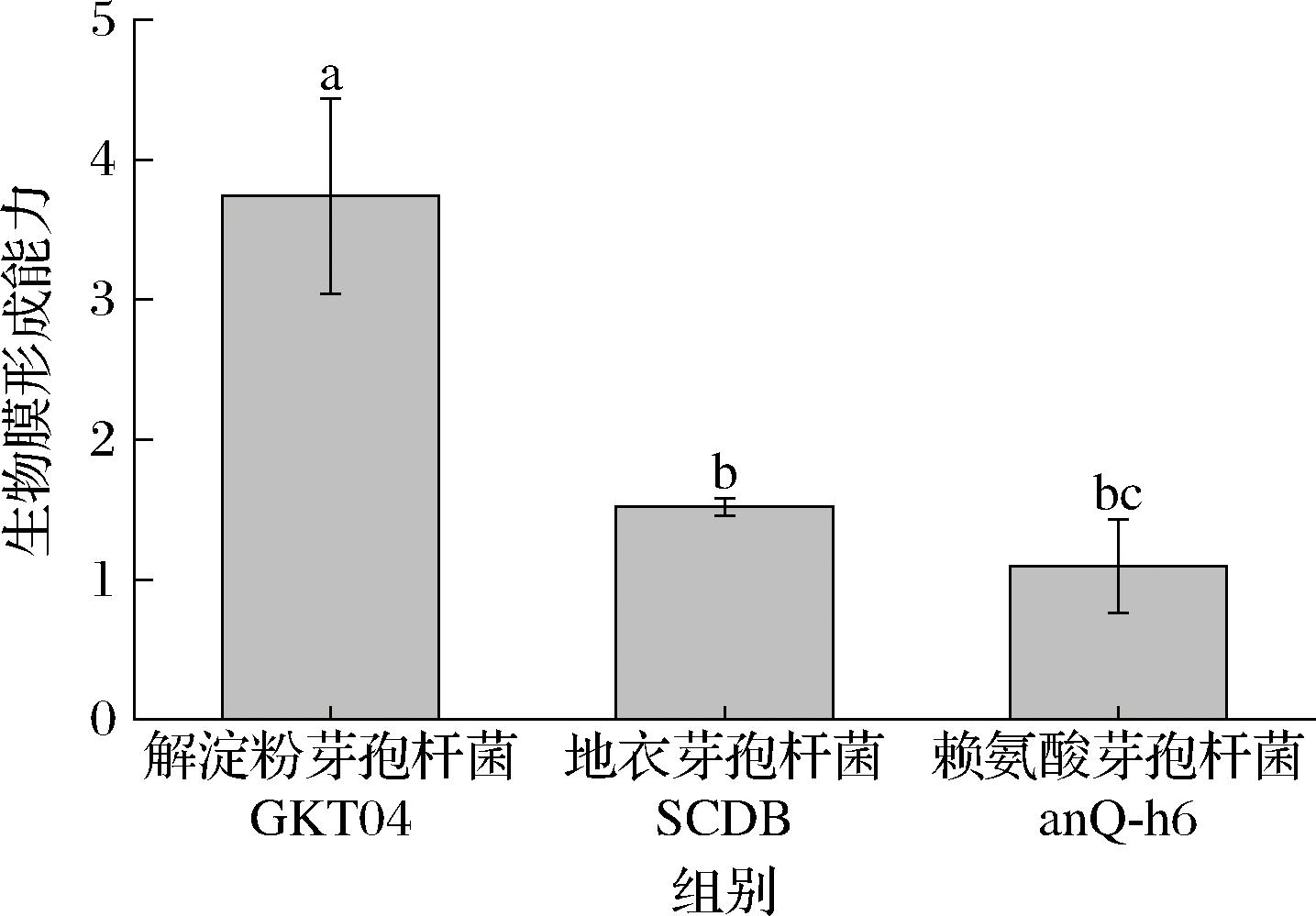
图4 三种芽孢杆菌的生物膜形成能力
Fig.4 Biofilm formation ability of three Bacillus species
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.2.2 芽孢杆菌生物膜的胞外多糖组成分析
通过离子色谱方法,对3种芽孢杆菌代谢的胞外多糖的单糖构成进行检测。基于图5-b~图5-d所示检测结果与标准品(图5-a)进行的对比分析,通过计算得出表2中的实验数据。结果表明,解淀粉芽孢杆菌GKT04菌株的代谢产物中检测出了更多的葡萄糖,质量浓度达到了3.5 g/L,而地衣芽孢杆菌SCDB和赖氨酸芽孢杆菌anQ-h6菌株体系中葡萄糖含量只有232.9和243.7 mg/L,赖氨酸芽孢杆菌anQ-h6菌株体系中还存在20 mg/L的半乳糖,相较于地衣芽孢杆菌SCDB和赖氨酸芽孢杆菌anQ-h6菌株,解淀粉芽孢杆菌GKT04菌株体系中还检测出了N-乙酰-葡萄糖、木糖、甘露糖、鼠李糖、阿拉伯糖、以及少量半乳糖,含量比约为22∶14∶11∶9∶7∶1,其中半乳糖含量为8.7 mg/L。解淀粉芽孢杆菌GKT04菌株体系中有显著高于地衣芽孢杆菌SCDB和赖氨酸芽孢杆菌anQ-h6菌株体系中的葡萄糖含量和单糖种类,这是由于解淀粉芽孢杆菌GKT04菌株具有更强的淀粉液化和糖化能力[7],同时也促使大曲底物的分解,产生了更多的糖类,因此提高了解淀粉芽孢杆菌GKT04菌株体系中的单糖种类和浓度,其中,解淀粉芽孢杆菌GKT04菌株代谢产生的鼠李糖和甘露糖,具有多羟基结构,有助于与水分子结合形成氢键[24],可以提高生物膜的黏性和稳定性,因此赋予了其生物膜更强的水分保持性能,同时也有利于菌株生物膜的形成[25],这是解淀粉芽孢杆菌GKT04具有更强的生物膜形成能力的一个重要原因。
表2 芽孢杆菌不同菌株胞外多糖的单糖构成和含量
Table 2 Monosaccharide composition and content of exopolysaccharides in different strains of Bacillus
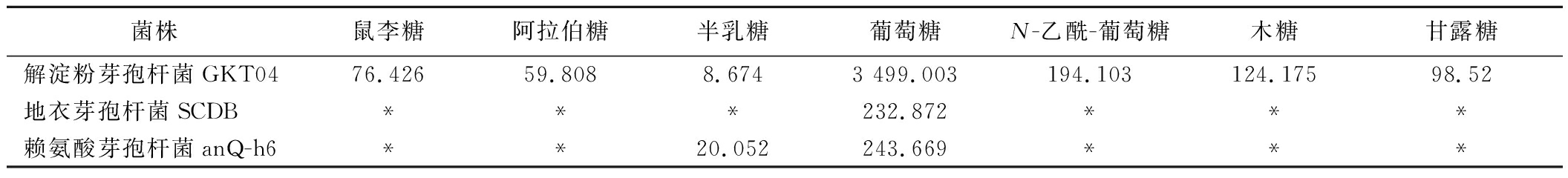
菌株鼠李糖阿拉伯糖半乳糖葡萄糖N-乙酰-葡萄糖木糖甘露糖解淀粉芽孢杆菌GKT0476.42659.8088.6743 499.003194.103124.17598.52地衣芽孢杆菌SCDB***232.872***赖氨酸芽孢杆菌anQ-h6**20.052243.669***
注:含量单位为mg/L,其中“*”表示未检出相关成分。
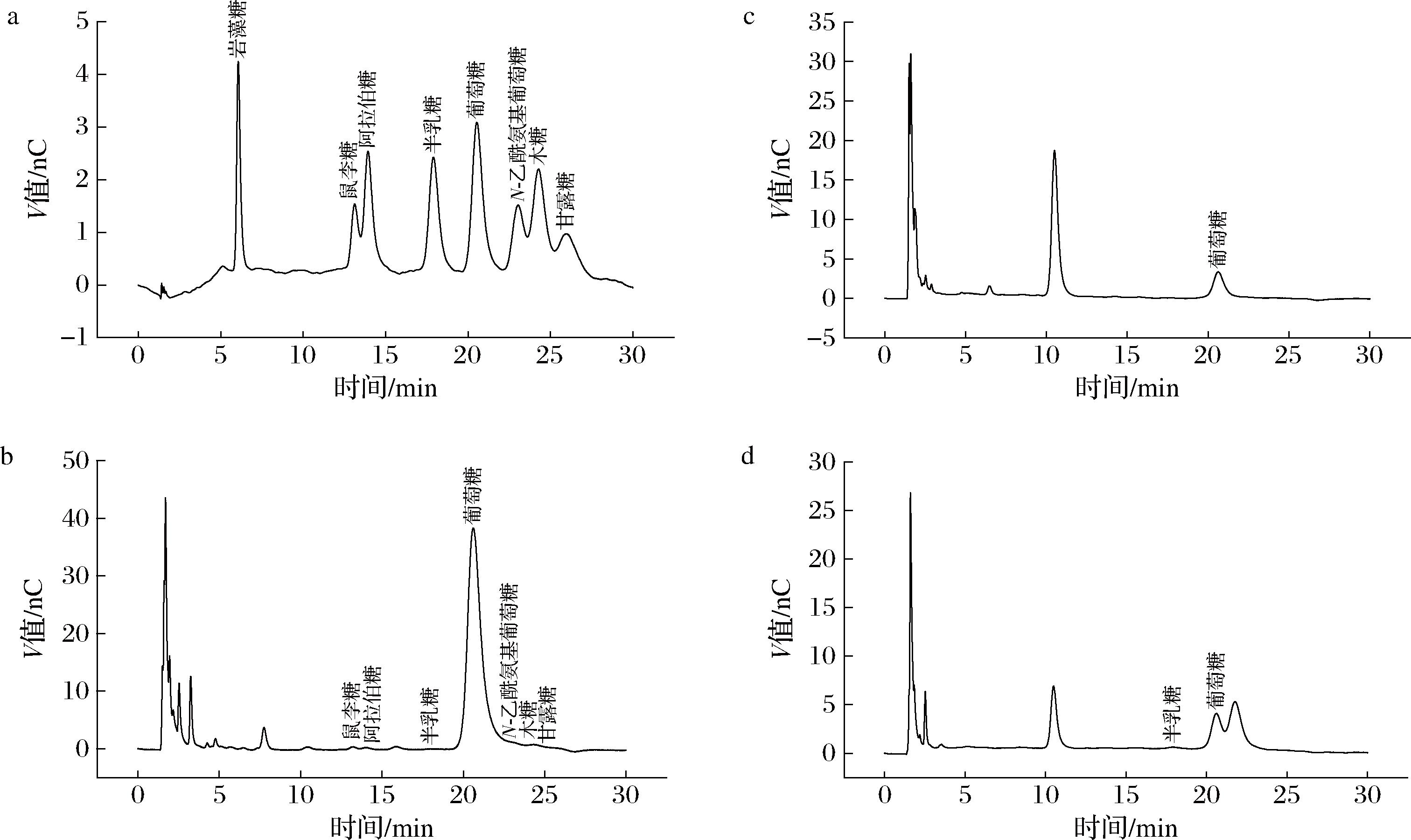
a-混合标准曲线;b-解淀粉芽孢杆菌GKT04;c-地衣芽孢杆菌SCDB;d-赖氨酸芽孢杆菌anQ-h6
图5 三种菌株在模拟发酵过程中代谢单糖构成的离子色谱检测
Fig.5 Ion chromatographic detection of monosaccharides metabolized by three strains during simulated fermentation
2.3 模拟大曲发酵
2.3.1 模拟大曲发酵中芽孢杆菌的生物量变化
为了研究芽胞杆菌对大曲发酵的调控机制和对发酵品质的有利贡献,设置了模拟大曲发酵实验。解淀粉芽孢杆菌GKT04在单菌株发酵条件下生长较为稳定,在发酵温度达到42 ℃时,生物量有一个小幅下降,地衣芽孢杆菌SCDB在单菌株培养时在不同温度条件下可以稳定生长,总体生物量水平为(7.58±0.45) lg CFU/g,赖氨酸芽孢杆菌anQ-h6在单菌株条件下生物量水平相对其他2种菌株更低(图6-a);解淀粉芽孢杆菌GKT04在与地衣芽孢杆菌SCDB共培养过程中,生长稳定,生物量处于在一个稳定的范围内(7.02±0.28) lg CFU/g,而地衣芽孢杆菌SCDB生物量有显著的下降,为(4.45±0.35) lg CFU/g(图6-b);解淀粉芽孢杆菌GKT04在与赖氨酸芽孢杆菌anQ-h6共培养过程中,生长同样稳定,同时生物量水平有一定的提高,总体水平达到了(7.87±0.34) lg CFU/g,赖氨酸芽孢杆菌anQ-h6在中高温条件时,生物量有显著的下降,最低为(2.41±0.19) lg CFU/g(图6-c);地衣芽孢杆菌SCDB在与赖氨酸芽孢杆菌anQ-h6共培养过程中,生物量从低温条件下的(7.04±0.17) lg CFU/g降为(5.98±0.17) lg CFU/g,赖氨酸芽孢杆菌anQ-h6在高温阶段生物量有所提高,最高达(7.9±0.15) lg CFU/g(图6-d)。总体数据显示,解淀粉芽孢杆菌GKT04菌株在不同发酵温度条件下生物量的总体波动不大,并且在与其他菌株共培养时生物量依然可以保持稳定,相对于其他2种菌株,解淀粉芽孢杆菌GKT04对抗恶劣环境的能力更强,结合2.2.1节中生物膜形成能力的差异可以看出,生物膜形成能力更强的菌株在模拟大曲发酵过程中更容易保持稳定的生长,在温度波动变化或是其他菌株的影响下生物量能保持在一个较高的水平,并且生物量的波动范围处在一个较小的区间之内。
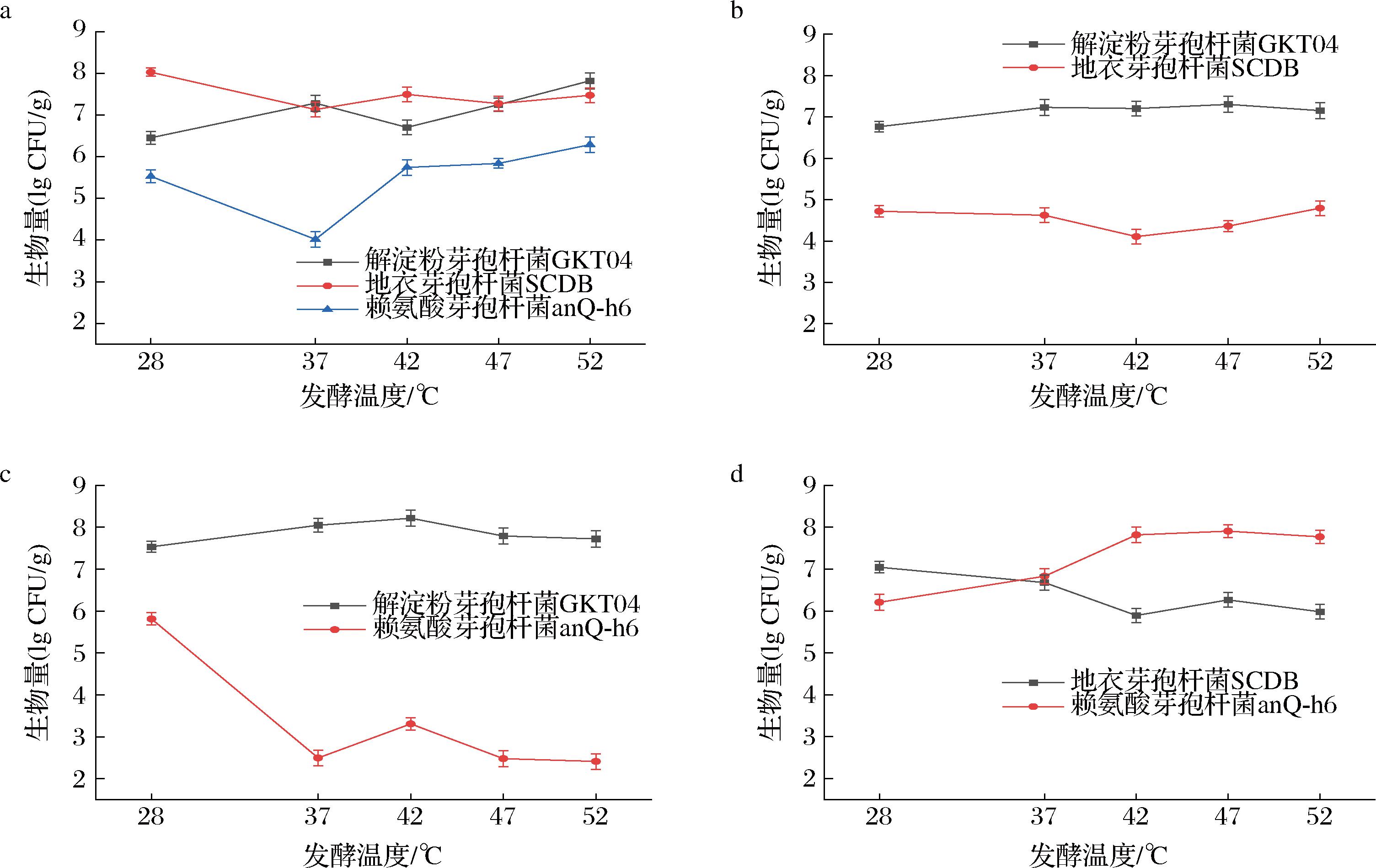
a-单菌株模拟发酵;b-解淀粉芽胞杆菌GKT04与地衣芽孢杆菌SCDB混合发酵;c-解淀粉芽胞杆菌GKT04与赖氨酸芽孢杆菌anQ-h6混合发酵;d-地衣芽孢杆菌SCDB与赖氨酸芽孢杆菌anQ-h6混合发酵
图6 模拟大曲发酵过程中芽孢杆菌随发酵温度升高的生物量变化
Fig.6 Biomass change of Bacillus with increasing fermentation temperature during the simulated Daqu fermentation
2.3.2 模拟大曲发酵过程中的水分变化
同时对模拟发酵过程中的水分含量进行检测,验证芽胞杆菌对大曲保水性的积极作用。由图7可知,模拟大曲发酵过程中,单菌株培养条件下,在发酵温度为28 ℃和37 ℃时,不同组别的含水量不存在显著差异,但当温度继续升高时,解淀粉芽孢杆菌GKT04组别的水分含量开始显著高于地衣芽孢杆菌SCDB和赖氨酸芽孢杆菌anQ-h6,在发酵温度达到42 ℃时,地衣芽孢杆菌SCDB和赖氨酸芽孢杆菌anQ-h6组别的水分含量已经开始低于空白对照组,而解淀粉芽孢杆菌GKT04组别高于空白对照组,最高达到了0.52±0.003 7,而赖氨酸芽孢杆菌anQ-h6的含水量最低,发酵结束时仅为0.31±0.003 1。解淀粉芽孢杆菌GKT04在模拟大曲发酵过程中可以显著提高高温发酵阶段的大曲水分含量。结合2.2.1节中生物膜形成能力的差异可以看出,生物膜形成能力更强的菌株在发酵达到高温阶段时能使得基质中的水分含量处于一个相对更高的水平。
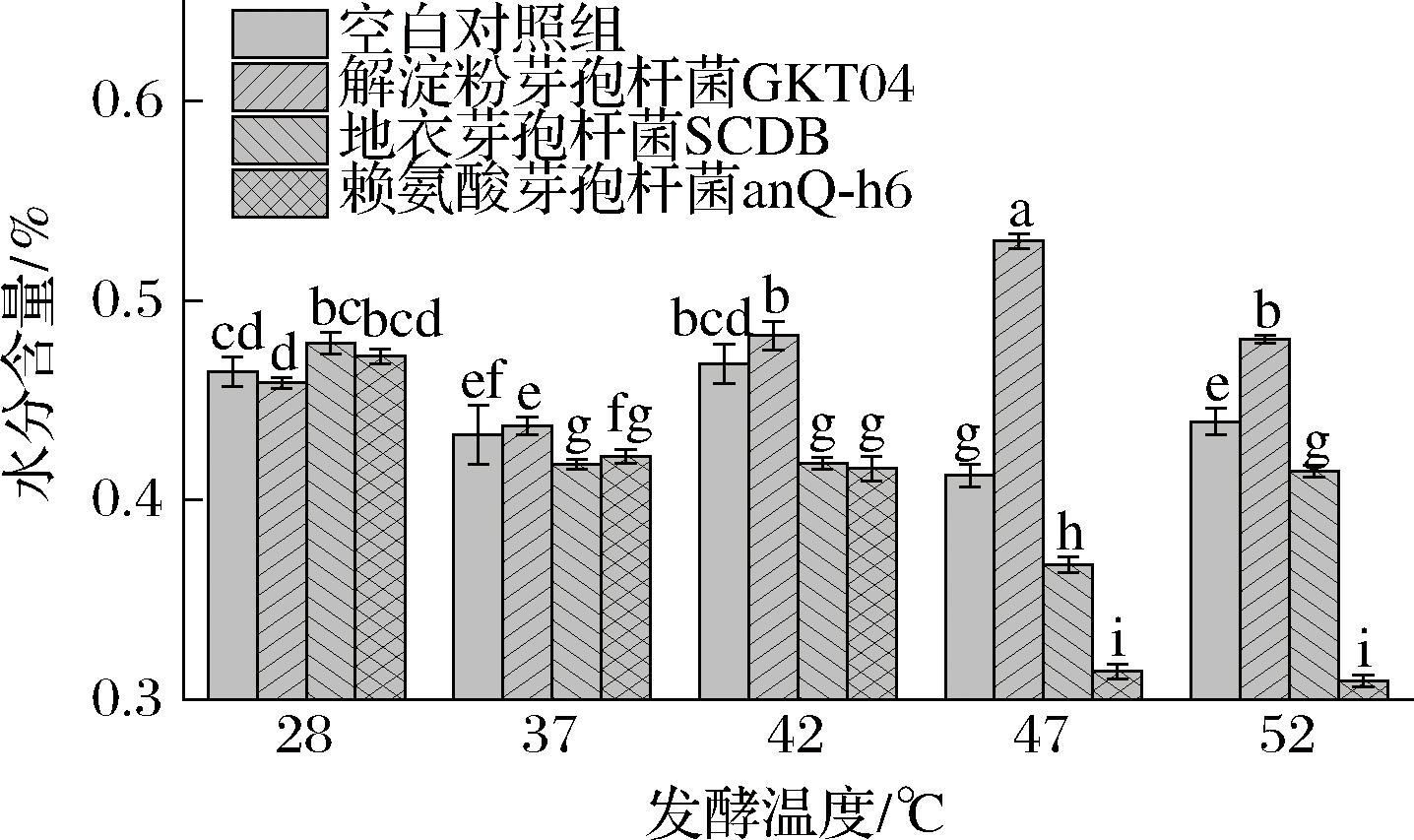
图7 模拟发酵过程中不同发酵时期的样品水分含量
Fig.7 Sample moisture content at different fermentation periods during the simulated fermentation process
2.3.3 模拟大曲发酵过程中的糖化力和液化力变化
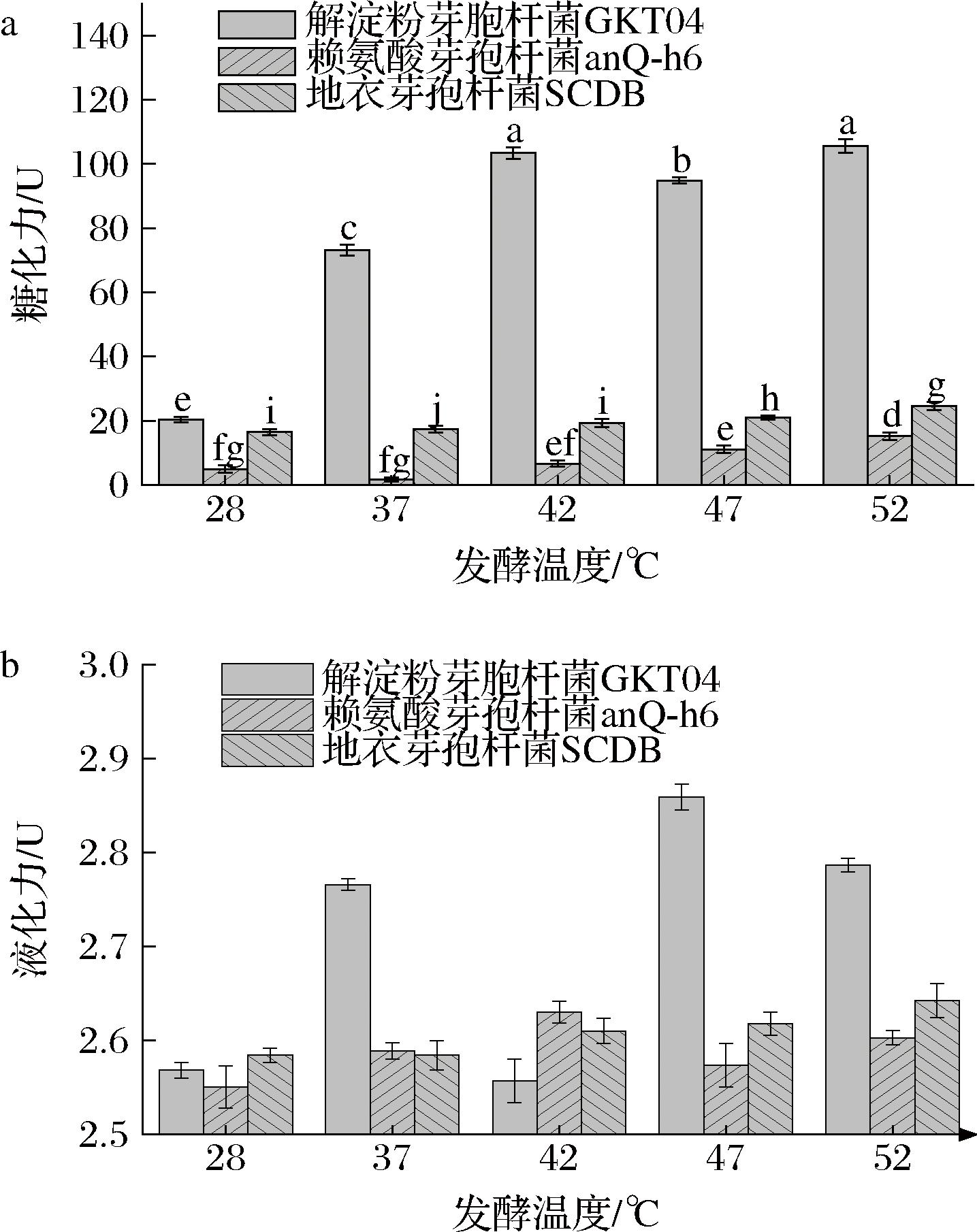
通过对3株菌株的糖化力和液化力分析发现,解淀粉芽孢杆菌GKT04菌株的糖化力和液化力均高于其他2株菌株,其中液化力在发酵温度达到47 ℃时最高达到了2.9,而糖化力在发酵温度达到52 ℃时最高达到了105.6;地衣芽孢杆菌SCDB和赖氨酸芽孢杆菌anQ-h6菌株的液化力相差不大,但赖氨酸芽孢杆菌anQ-h6菌株的糖化力很低(图8)。解淀粉芽孢杆菌GKT04菌株可以赋予模拟发酵大曲更强的淀粉糖化和液化能力。
a-糖化力;b-液化力
图8 模拟大曲发酵过程中不同时期的糖化力和液化力
Fig.8 Saccharification and liquefaction forces at different stages of simulated Daqu fermentation
2.3.4 模拟大曲发酵过程中的生物膜
大曲是一种典型的多孔固态发酵介质,在大曲发酵过程中添加的水分以及微生物代谢产生的各类物质缠结可以填补介质中的孔隙,增强液相的保水性,并维持液相的连续性。芽胞杆菌代谢生成的生物膜也许是一种可以有效填充固态发酵基质中孔隙的物质,因此通过SEM观察模拟发酵过程中芽胞杆菌对发酵基质的覆盖情况验证此猜想。由图9-a可知,解淀粉芽孢杆菌GKT04菌株参与培养的体系中均出现了明显的细胞团和膜状包被结构,覆盖于发酵基质的表层,并填补孔隙,地衣芽孢杆菌SCDB菌株和赖氨酸芽孢杆菌anQ-h6菌株膜状结构相对不明显,菌体之间界限分明,显示出清晰的缝隙与孔洞(图9-b、图9-c),这会在一定程度上影响大曲发酵过程中的水分变化。借助更丰富的生物膜,解淀粉芽孢杆菌GKT04菌株可以在大曲高温发酵环境下处于一个稳定的生长状态,并由于2.2.2节中提到的,通过代谢生成鼠李糖和甘露糖强化胞外多糖的持水吸湿性能从而提升了大曲的保水性能。

a-解淀粉芽孢杆菌GKT04;b-地衣芽孢杆菌SCDB菌株;c-赖氨酸芽孢杆菌anQ-h6
图9 SEM电镜下的模拟大曲发酵样品生物膜
Fig.9 Biofilm of simulated Daqu fermentation samples under SEM
3 结论与讨论
a)芽胞杆菌是受到温度选择的大曲优势发酵菌种,在大曲的高温发酵阶段占据优势地位,对比其他菌种,在发酵高温阶段芽孢杆菌的相对丰度提升最大,相对丰度对比发酵初期提高了10倍。
b)解淀粉芽孢杆菌GKT04具有更强的生物膜形成能力,更加丰富的生物膜有助于强化其抗逆性,并且有利于提高大曲基质的水分保持能力,在高温发酵阶段可以更有效地避免水分的过快散失。
c)相较于地衣芽孢杆菌SCDB和赖氨酸芽孢杆菌anQ-h6菌株,解淀粉芽孢杆菌GKT04菌株的代谢产物中检测出了更多的葡萄糖,质量浓度达到了3.5 g/L,并且其产生的胞外多糖中含有甘露糖(98.5 mg/L)和鼠李糖(76.4 mg/L),有利于增强其产生的生物膜的黏性和保湿能力,从而进一步提高解淀粉芽孢杆菌GKT04对大曲水分保持的积极效应。
d)使用芽孢杆菌强化大曲并不仅仅可以调控微生物结构和强化大曲的风味,对大曲的糖化力和液化力也具有促进作用,在实际生产过程中的大曲水分散失过快的问题也可以尝试通过芽孢杆强化发酵进行调控。
[1] ZHU M, ZHENG J, XIE J, et al.Effects of environmental factors on the microbial community changes during medium-high temperature Daqu manufacturing[J].Food Research International, 2022, 153:110955.
[2] BENARD P, ZAREBANADKOUKI M, BRAX M, et al.Microhydrological niches in soils:How mucilage and EPS alter the biophysical properties of the rhizosphere and other biological hotspots[J].Vadose Zone Journal, 2019, 18(1):180211.
[3] TANG J, WEI J L, YANG Y, et al.Spatio-temporal scales of the Chinese Daqu microbiome:Heterogeneity, niche differentiation, and assembly mechanisms[J].Trends in Food Science &Technology, 2025, 156:104832.
[4] 侯强川, 王文航, 徐媛媛, 等.徐坊中高温大曲发酵过程中理化品质、风味及真菌群落结构变化规律研究[J].食品工业科技, 2024, 45(19):133-141.HOU Q C, WANG W H, XU Y Y, et al.Dynamic changes of physicochemical quality, flavor and fungal community structure during medium-high temperature Daqu fermentation process in xufang region[J].Science and Technology of Food Industry, 2024, 45(19):133-141.
[5] BAN S B, SHEN Y, CHENG W, et al.Community dynamics and assembly is driven by environmental microbiota mediated by spatiotemporal distribution:The case of Daqu fermentation[J].International Journal of Food Microbiology, 2025, 426:110933.
[6] LI H D, LIU S Y, LIU Y B, et al.Functional microorganisms in Baijiu Daqu:Research progress and fortification strategy for application[J].Frontiers in Microbiology, 2023, 14:1119675.
[7] 刘青阳,黄晓宁,陆玮,等.中高温大曲中芽孢杆菌多样性及代谢特征研究[J].中国酿造, 2022, 41(7):26-31.LIU Q Y, HUANG X N, LU W, et al.Diversity and metabolic characteristics of Bacillus strains isolated from medium-high temperature Daqu[J].China Brewing, 2022, 41(7):26-31.
[8] LI Z, FERNANDEZ K X, VEDERAS J C, et al.Composition and activity of antifungal lipopeptides produced by Bacillus spp.in Daqu fermentation[J].Food Microbiology, 2023, 111:104211.
[9] KANG J M, LI R S, HU Y N, et al.Microbial interactions in mixed-species biofilms on the surfaces of Baijiu brewing environments[J].Food Research International, 2024, 191:114698.
[10] SUN X Q, WANG L, FU R J, et al.The chemical properties and hygroscopic activity of the exopolysaccharide lubcan from Paenibacillus sp.ZX1905[J].International Journal of Biological Macromolecules, 2020, 164:2641-2650.
[11] YANG N, RØDER H L, WICAKSONO W A, et al.Interspecific interactions facilitate keystone species in a multispecies biofilm that promotes plant growth[J].The ISME Journal, 2024, 18(1):wrae012.
[12] WU M Y, LUO Y, YAO Y Q, et al.Multidimensional analysis of wheat original crucial endogenous enzymes driving microbial communities metabolism during high-temperature Daqu fermentation[J].International Journal of Food Microbiology, 2024, 413:110589.
[13] 孙佳, 杜海, 徐岩.高温大曲中大曲岩石芽孢杆菌的筛选及其特性分析[J].食品与发酵工业, 2023, 49(17):75-84.SUN J, DU H, XU Y.Screening and characterization analysis of Scopulibacillus daqui in high-temperature Daqu[J].Food and Fermentation Industries, 2023, 49(17):75-84.
[14] LIN H B, LIAO S Q, ZHOU Z S, et al.Investigation into the potential mechanism of Bacillus amyloliquefaciens in the fermentation of broad bean paste by metabolomics and transcriptomics[J].Food Research International, 2024, 183:114202.
[15] ALIZADEH BEHBAHANI B, NOSHAD M, VASIEE A, et al.Probiotic Bacillus strains inhibit growth, biofilm formation, and virulence gene expression of Listeria monocytogenes[J].LWT, 2024, 191:115596.
[16] 石彩玲,田侠,孙一鸣,等.离子色谱-脉冲积分安培法同时测定甘薯中10种可溶性糖组分[J].中国食品学报, 2023, 23(9):324-330.SHI C L, TIAN X, SUN Y M, et al.Determination of ten kinds of soluble sugars in sweetpotato by ion chromatography and pulsed amperometric detector[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(9):324-330.
[17] ZHU Q, CHEN L Q, PENG Z, et al.Analysis of environmental driving factors on Core Functional Community during Daqu fermentation[J].Food Research International, 2022, 157:111286.
[18] JIANG X Y, PENG Z, ZHU Q, et al.Exploration of seasonal fermentation differences and the possibility of flavor substances as regulatory factors in Daqu[J].Food Research International, 2023, 168:112686.
[19] ZHANG Y D, DING F, SHEN Y, et al.Characteristics of the microbiota and metabolic profile of high-temperature Daqu with different grades[J].World Journal of Microbiology and Biotechnology, 2022, 38(8):137.
[20] KANG J M, CHEN X X, HAN B Z, et al.Insights into the bacterial, fungal, and phage communities and volatile profiles in different types of Daqu[J].Food Research International, 2022, 158:111488.
[21] WILKING J N, ZABURDAEV V, DE VOLDER M, et al.Liquid transport facilitated by channels in Bacillus subtilis biofilms[J].Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(3):848-852.
[22] LEI Y, CAI W C, WANG Y R, et al.Elucidating the physicochemical parameters, bacterial community structure, and correlation characteristics of medium-high temperature Daqu[J].Food Bioscience, 2024, 58:103679.
[23] 戚韩英,汪文斌,郑昱,等.生物膜形成机理及影响因素探究[J].微生物学通报, 2013, 40(4):677-685.QI H Y, WANG W B, ZHENG Y, et al.Mechanism of biofilm formation and analysis of influencing factors[J].Microbiology China, 2013, 40(4):677-685.
[24] JIANG X Y, LIU R C, XIE Y Q.Hydrogen bonding dominated self-assembly mechanism of amphiphilic molecules in Chinese Baijiu[J].Food Chemistry, 2024, 452:139420.
[25] SAHARAN B S, BENIWAL N, DUHAN J S.From formulation to function:A detailed review of microbial biofilms and their polymer-based extracellular substances[J].The Microbe, 2024, 5:100194.