机体脂质过度积累会通过脂质过氧化途径生成过氧化产物,继而引发DNA损伤、细胞代谢紊乱和慢性炎症反应,最终导致衰老相关的生理变化[1-2]。衰老相关分泌表型(senescence-associated secretory phenotype,SASP)是衰老细胞的一个重要特征[3-4],表现为促炎细胞因子、细胞外基质降解酶及其他代谢产物的大量分泌。这些分泌产物通过自分泌和旁分泌机制,在局部微环境中形成负反馈,进一步加剧衰老过程。SASP的形成与核因子κB(nuclear factor kappa-B,NF-κB)信号通路的激活密切相关,NF-κB通路在慢性炎症反应中起着核心作用[5]。其中,p65蛋白在NF-κB信号通路中发挥重要作用,通过调控下游促炎因子如环氧化酶-2(cyclooxygenase-2,COX-2)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)等的表达,促进慢性炎症的发展。SASP的形成不仅加剧衰老相关的炎症反应,还会影响细胞的代谢功能。脂质积累引发的慢性炎症与DNA损伤的联动效应,进一步导致肝脏等重要代谢器官功能的下降,恶化机体的整体代谢状态,形成恶性循环。因此,改善肝脏等器官的代谢功能,减缓由脂质积累引发的炎症反应,并修复DNA损伤,是抗衰老研究中的重要方向。
甘草作为一种重要的中药材,已有数千年的历史,其主要活性成分包括三萜类、黄酮类、酚类和生物碱类化合物。甘草酸(glycyrrhizic acid,GA)是甘草中最重要的三萜类化合物之一,因其显著的抗氧化、抗炎和代谢调节功能而备受青睐[6],并已广泛应用于各类食品和化妆品中[7-8]。DI PAOLA等[9]研究表明,GA具有显著的抗炎作用,能够通过抑制NF-κB通路降低肠道组织中的炎症因子[白介素(interleukin,IL)-1β和肿瘤坏死因子(tumor necrosis factor,TNF)-α]的水平;SIL等[10]发现GA可以缓解高糖饮食导致的肝细胞损伤以及脂质过氧化。然而,GA的口服生物利用度较低,这限制了其在临床中的应用效果[6]。肠道微生物群在药物的代谢、转化和吸收中起着至关重要的作用[11]。研究发现,某些微生物可以对GA进行代谢转化,进而改善GA的生物利用度。例如,巴氏葡萄球菌(Staphylococcus pasteuri)3I10菌株可将GA转化为甘草次酸,从而提升其生物活性[12]。某些内生真菌,如ZUO等[13]研究中的Z6与Z15也可以促进GA的转化和代谢物富集,从而增强其生物效应。YUAN等[14]发现鼠乳杆菌(Lactobacillus murinus)与GA联合用药可提升其临床治疗效果。值得注意的是,微生物对GA的代谢转化能力与β-葡萄糖醛酸酶(β-glucuronidase,GUS)的酶活特性密切相关。该酶属于GH2糖苷水解酶家族[15],能特异性水解GA中β-糖苷键连接的葡萄糖醛酸,产生具有更高生物活性的单葡萄糖醛酸甘草次酸(glycyrrhetinic acid mono-glucuronide,GAMG)和甘草次酸。它们在GA生物转化中显示出3种不同转化类型[16],分类如下:a)GA → GAMG;b)GA → GAMG+甘草次酸;c)GA→甘草次酸。不同菌株的GUS在催化路径上表现出差异:部分菌株能实现GA到GAMG的水解,而某些菌株如3I10水解则产生甘草次酸,这与其酶活性中心结构域的差异有关。
基于上述背景,本研究通过高脂饮食诱导C57BL/6 J小鼠脂质积累引起衰老,探究GA与卷曲乳杆菌(Lactobacillus crispatus)CCFM1362联合干预的降脂及抗衰老作用。通过测定衰老标志物、炎症信号以及DNA损伤信号通路等探讨其调控脂质代谢、缓解慢性炎症以及修复DNA损伤的分子机制,为GA与益生菌的协同作用提供新的科学依据,还为其天然功能成分与微生物联合应用于功能食品的开发提供了理论支持。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株来源
实验所用的卷曲乳杆菌CCFM1362由江南大学食品微生物菌种保藏中心(Culture Collection of Food Microorganisms,CCFM)提供。
1.1.2 药品与试剂
甘草酸GA(S24734),上海源叶生物科技有限公司;小鼠β-半乳糖苷酶(M0355)、IL-1β(M0027)、IL-6(M0657)、TNF-α(M0030)、NF-κB p65(M0313)、COX2(M0847)、iNOS(M0041)酶联免疫吸附(ELISA)试剂盒,南京森贝佳生物科技有限公司;qPCR相关引物,上海生工生物工程有限公司;BCA蛋白浓度测定试剂盒(p0011),上海碧云天生物技术有限公司;RNA提取试剂盒(RC113)、反转录试剂盒(R433)、SYBR qPCR荧光定量试剂盒(Q712),南京诺唯赞生物科技有限公司;通用型组织固定液(中性)(G1101),武汉赛维尔生物科技有限公司;40只雄性C57BL/6J小鼠[8周龄,(22±1) g],北京维通利华实验动物技术有限公司;小鼠饲料,南通特洛菲饲料科技有限公司。其他所有化学品均购自国药集团试剂有限公司。
1.2 仪器与设备
HWS-150恒温培养箱,上海森信实验仪器有限公司;384实时定量PCR仪器、c1000实时定量基因扩增仪,美国Bio-Rad公司;5425R高速冷冻离心机,艾本德中国有限公司;MLS-3750蒸汽灭菌锅,山洋电气有限公司;SCIENTZ-48高通量组织研磨机、SCIENTZ-10N/A冷冻干燥机,宁波新芝生物科技股份有限公司;BS-480自动生化分析仪,深圳迈瑞生物医疗电子股份有限公司;Pannoramic MIDI切片电子扫描仪,匈牙利3DHISTECH公司;Multiscan Go多功能酶标仪,上海智诚有限公司;Vanquish超高效液相色谱仪、Orbitrap Exploris120质谱仪,赛默飞世尔科技公司。
1.3 实验方法
1.3.1 动物实验样品的制备
1.3.1.1 菌株冻干粉的制备
将卷曲乳杆菌CCFM1362在MRS固体培养基上划线,平板于37 ℃倒置培养48 h,挑取单菌落接入5 mL的MRS液体培养基中于37 ℃培养48 h,制备得到种子液;而后将种子液接种于MRS培养基中,接种活菌数为5×107 CFU/mL,厌氧环境培养至菌株对数生长期,得到卷曲乳杆菌菌液;随后,通过离心法从液体培养基中收集菌体,与冻干保护剂(质量分数为12%的脱脂乳粉)混合,通过冷冻干燥得到菌株冻干粉。将冻干粉用生理盐水复溶后使用MRS固体培养基涂布计数。
1.3.1.2 发酵GA冻干粉的制备
配制GA发酵培养基(g/L):GA 1、酵母浸粉5、葡萄糖10、柠檬酸氢二胺2,以纯净水混合,pH调至6.0~6.2,在115 ℃灭菌20 min。在GA发酵培养基中接种卷曲乳杆菌CCFM1362至5×107 CFU/mL,37 ℃恒温培养48 h,发酵完成后,对发酵液进行65 ℃,30 min的热处理,之后以1 200 Bar高压均质6次,冻干后得到卷曲乳杆菌CCFM1362发酵GA冻干粉。
1.3.2 动物实验
小鼠在江南大学动物中心的无特定病原体环境中饲养,饲养温度20~26 ℃、相对湿度40%~60%。实验共13周,分别为适应期1周,造模期8周以及干预期4周,从而对小鼠缓解脂质积累[17]以及抗衰水平进行评估[18-19]。适应期结束后,将C57BL/6 J小鼠随机分为8组,每组5只小鼠,分别为:对照组、模型组、甘草酸组、卷曲乳杆菌CCFM1362组、低剂量合生制剂组、高剂量合生制剂组、低剂量发酵液组、高剂量发酵液组。对照组饲喂低脂低糖饲料(TP23302),其余组饲喂高脂饲料(60%脂肪供能,TP23300),直至实验结束,所有分组均为自由饮水和摄食。干预期各实验组按分组以0.2 mL/(只·d)的量对小鼠进行灌胃,具体灌胃物质见表1。本研究中进行的动物程序得到了江南大学动物伦理委员会的批准(伦理编号为JN.No20240430c1520820[204])。实验结束后取小鼠血清和肝脏组织用于后续分析。
表1 动物实验方案
Table 1 Animal experimental design
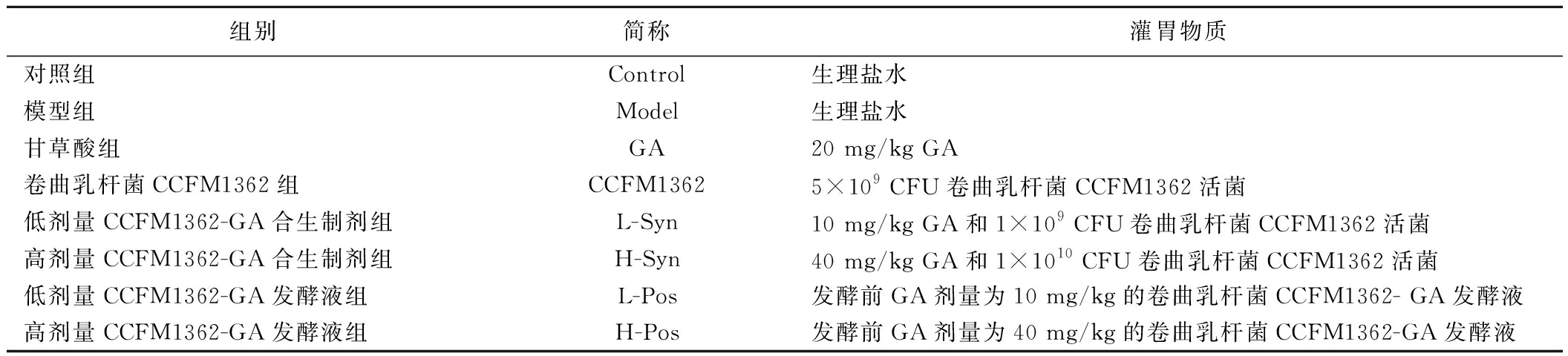
组别简称灌胃物质对照组Control生理盐水模型组Model生理盐水甘草酸组GA20 mg/kg GA卷曲乳杆菌CCFM1362组CCFM13625×109 CFU卷曲乳杆菌CCFM1362活菌低剂量CCFM1362-GA合生制剂组L-Syn10 mg/kg GA和1×109 CFU卷曲乳杆菌CCFM1362活菌高剂量CCFM1362-GA合生制剂组H-Syn40 mg/kg GA和1×1010 CFU卷曲乳杆菌CCFM1362活菌低剂量CCFM1362-GA发酵液组L-Pos发酵前GA剂量为10 mg/kg的卷曲乳杆菌CCFM1362- GA发酵液高剂量CCFM1362-GA发酵液组H-Pos发酵前GA剂量为40 mg/kg的卷曲乳杆菌CCFM1362-GA发酵液
1.3.3 肝脏病理学和免疫荧光分析
肝脏组织在4%(体积分数)多聚甲醛溶液中固定48 h后,委托上海赛维尔生物公司进行石蜡包埋、切片制作、苏木精-伊红(hematoxylin-eosin,HE)染色[17]以及γ-H2AX免疫荧光染色[18]。使用数字切片扫描仪Pannoramic MIDI系统进行自动扫描。
1.3.4 血清生化分析
使用自动生化分析仪测量血清中丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、血糖(glucose,GLU)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)的含量。
1.3.5 酶联免疫吸附检测分析
根据说明书,使用ELISA试剂盒检测肝脏组织中的β-半乳糖苷酶、IL-1β、IL-6、TNF-α、NF-κB p65、COX2、iNOS的含量。
1.3.6 实时荧光定量PCR
根据说明书,使用总RNA提取试剂盒从肝组织中提取RNA,之后使用反转录试剂盒将RNA反转录为cDNA。使用RT-qPCR系统测定mRNA水平。内参基因为β-actin来检测聚腺苷二磷酸-核糖聚合酶1(poly ADP-ribose polymerase-1,PARP1)。扩增循环温度梯度如下:预变性95 ℃、300 s;变性95 ℃、10 s;退火55 ℃、30 s;延伸72 ℃、20 s,循环40次“变性-退火-延伸”的反应后结束程序。
1.3.7 GA发酵液的非靶向代谢组学分析
非靶向代谢组由上海百趣生物医学科技有限公司进行并进行分析。移取100 μL GA发酵液样品至离心管中,加入400 μL提取液[V(甲醇)∶V(乙腈)=1∶1],提取液用同位素标记内标;涡旋混匀30 s,超声10 min(冰水浴);-40 ℃静置1 h;将样品4 ℃,12 000 r/min离心15 min,取上清液,再于4 ℃,12 000 r/min离心15 min;取上清液于进样瓶中上机检测;所有样品另取等量上清液混合成QC(quality control)样品上机检测。
表2 动物实验中的引物序列
Table 2 Primer sequences used in mice experiments
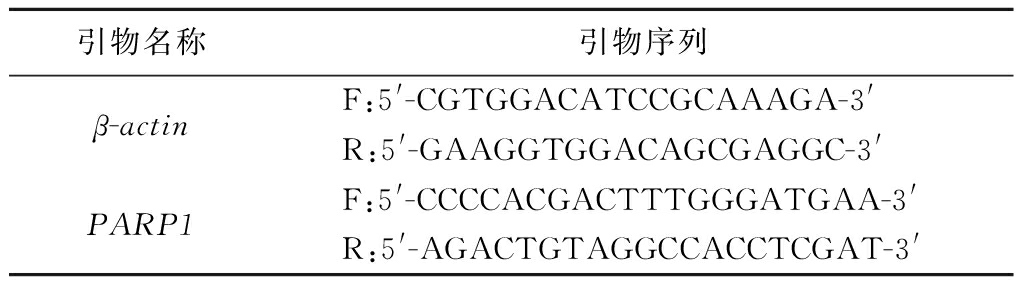
引物名称引物序列β-actinF:5'-CGTGGACATCCGCAAAGA-3'R:5'-GAAGGTGGACAGCGAGGC-3'PARP1F:5'-CCCCACGACTTTGGGATGAA-3'R:5'-AGACTGTAGGCCACCTCGAT-3'
使用Vanquish超高效液相色谱仪,通过Phenomenex Kinetex C18 (2.1 mm×50 mm,2.6 μm)液相色谱柱对目标化合物进行色谱分离。液相色谱A相为水相,含0.01%(体积分数)乙酸,B相为V(异丙醇)∶V(乙腈)=1∶1。柱温25 ℃,样品盘温度4 ℃,进样体积2 μL。Orbitrap Exploris120质谱仪能够在控制软件(Xcalibur, 版本:4.4,Thermo)控制下进行一级、二级质谱数据采集。鞘气流速50 Arb,辅助气流速15 Arb,毛细管温度320 ℃,吹扫气流速1 Arb,汽化器温度350 ℃。全扫描质谱分辨率60 000,二级质谱(MS/MS)分辨率:15 000,碰撞能量:阶梯式归一化碰撞能量(SNCE)20/30/40,喷雾电压:正离子模式3.8 kV或负离子模式-3.4 kV。
查阅资料,收集化合物名称、分子式、分子质量、保留时间等信息。依据P<0.05和log2FC>2进行差异代谢产物筛选。
1.4 数据分析
使用GraphPad Prism 10.1.2进行统计分析和绘图,使用Tukey检验进行的方差分析用于确定组间差异性。实验数据以“平均值±标准差”表示(n=5)。
2 结果与分析
2.1 卷曲乳杆菌CCFM1362发酵GA对小鼠体重和表观指标影响
实验期间小鼠的体重变化如图1-a所示,造模期间对照组的小鼠体重缓慢增长,而高脂饮食组的小鼠体重显著增加,表明高脂饮食会显著增加小鼠体内脂肪积累。干预期后各组小鼠的体重变化如图1-b所示,单独灌胃GA与卷曲乳杆菌CCFM1362未能显著缓解高脂饮食引起的体重增加。合生制剂组别的体重增长量有所减少,但未达到统计学显著性。而灌胃发酵液组别的小鼠体重增长量分别减少了4.21 g和5.95 g(P<0.01),降幅优于合生制剂组,表明GA发酵液在减缓高脂饮食引起的体重增加方面优于合生制剂。
各组肝脏质量和附睾脂肪质量变化如图1-c、图1-d所示。干预结束后,各组小鼠的肝脏质量无明显差异,说明实验干预方式对小鼠肝脏肥大影响较小。附睾脂肪质量有不同程度减少,特别是高剂量发酵液组在减轻附睾脂肪堆积方面表现出显著效果(P<0.000 1),表明高剂量GA与卷曲乳杆菌CCFM1362的协同能够有效缓解高脂饮食引起的体重增加和脂肪堆积。
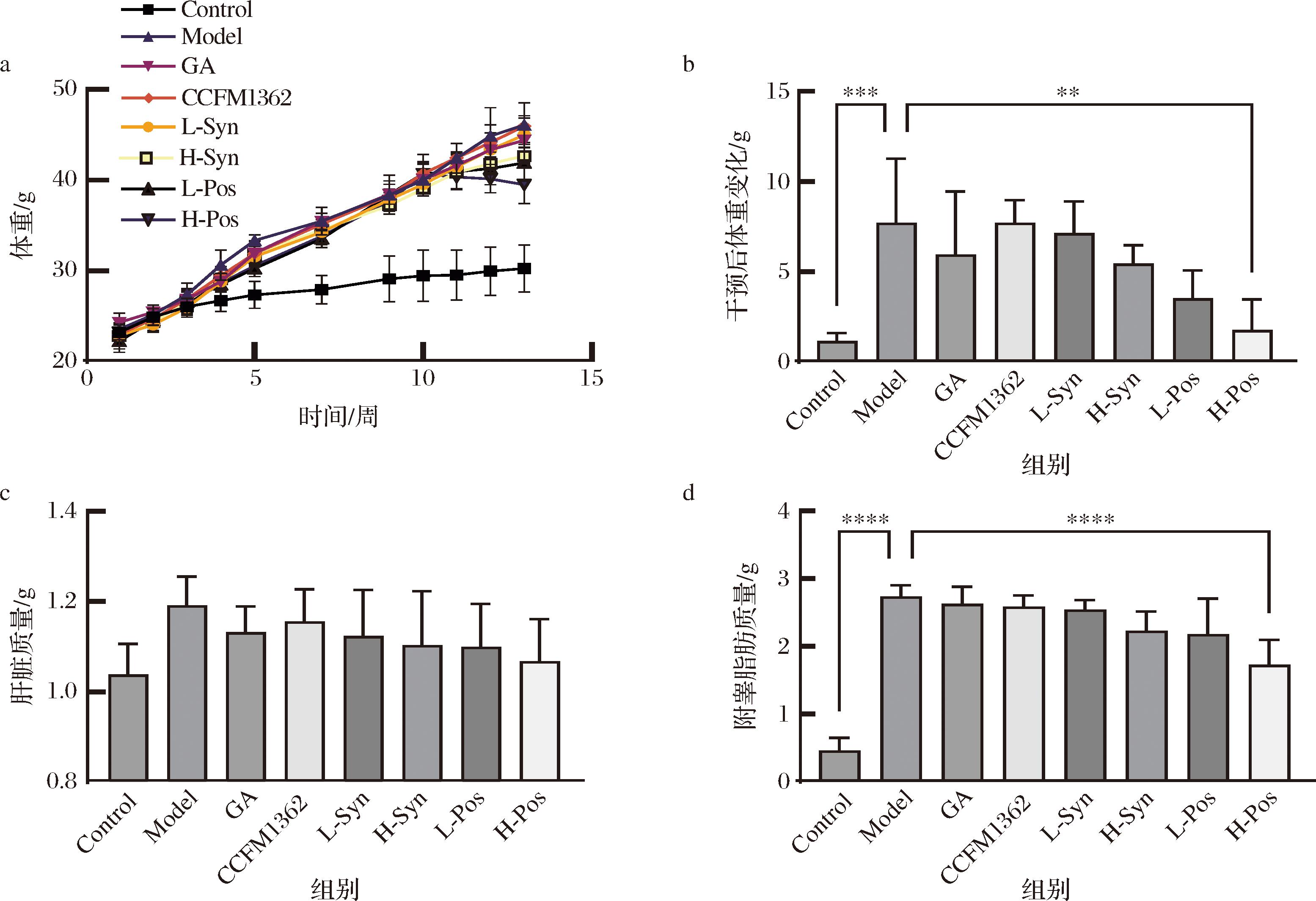
a-实验周期小鼠体重变化;b-干预后小鼠体重变化;c-小鼠肝脏重量;d-小鼠附睾脂肪重量
图1 小鼠体重、肝脏重量与附睾脂肪重量
Fig.1 Mouse body weight, liver weight, and epididymal fat weight levels
注:*表示P<0.05;**表示P<0.01;***表示P<0.001;****表示P<0.000 1(图2~图7同)。
2.2 CCFM1362发酵GA对小鼠肝脏的影响
如图2-a所示,对照组小鼠的肝脏组织呈现均匀的着色,脂肪蓄积较少,肝细胞排列紧密且均一,细胞形态规则,而模型组小鼠肝脏组织则表现出明显的病理学变化,肝细胞周围出现大量脂肪空泡,细胞间连接松散,细胞肿胀且细胞完整性受到破坏,细胞内容物流出。卷曲乳杆菌CCFM1362与GA制得的合生制剂或发酵液均能够有效缓解高脂饮食引起的小鼠肝脏脂肪堆积和病变,效果优于单独灌胃GA或卷曲乳杆菌CCFM1362。其中高剂量发酵液表现最佳,其肝脏脂质积累缓解效果接近于对照组。
ALT和AST是常用于评估肝脏功能的生物标志物,其能反映肝脏细胞受损情况。如图2-b和图2-c所示,模型组的小鼠血清ALT和AST含量显著高于对照组(P<0.000 1),表示脂质积累已导致肝细胞严重受损,这与肝脏病理学切片结果一致。单独卷曲乳杆菌CCFM1362和GA干预的小鼠ALT和AST含量有所下降,但无统计学差异。高剂量合生制剂能够降低ALT(P<0.05)和AST(P<0.01)含量,表明其在改善肝功能方面具有一定作用。GA经卷曲乳杆菌CCFM1362发酵后,高剂量发酵液组ALT和AST含量均显著降低,分别为28.39%(P<0.01)和22.57%(P<0.01),表明卷曲乳杆菌CCFM1362发酵GA后能够更有效减轻由脂质堆积引起的肝脏损伤并改善肝功能。

a-小鼠肝脏HE染色切片;b-血清ALT含量;c-血清AST含量
图2 小鼠肝脏病理学切片及ALT、AST含量
Fig.2 Mice liver pathological sections and ALT and AST content
2.3 卷曲乳杆菌CCFM1362发酵GA对小鼠血清血脂的影响
如图3-a~图3-d所示,模型组小鼠的血清TG、TC、LDL-c和HDL-c含量较对照组均呈现显著升高(P<0.000 1),表明高脂饮食导致了高血脂。
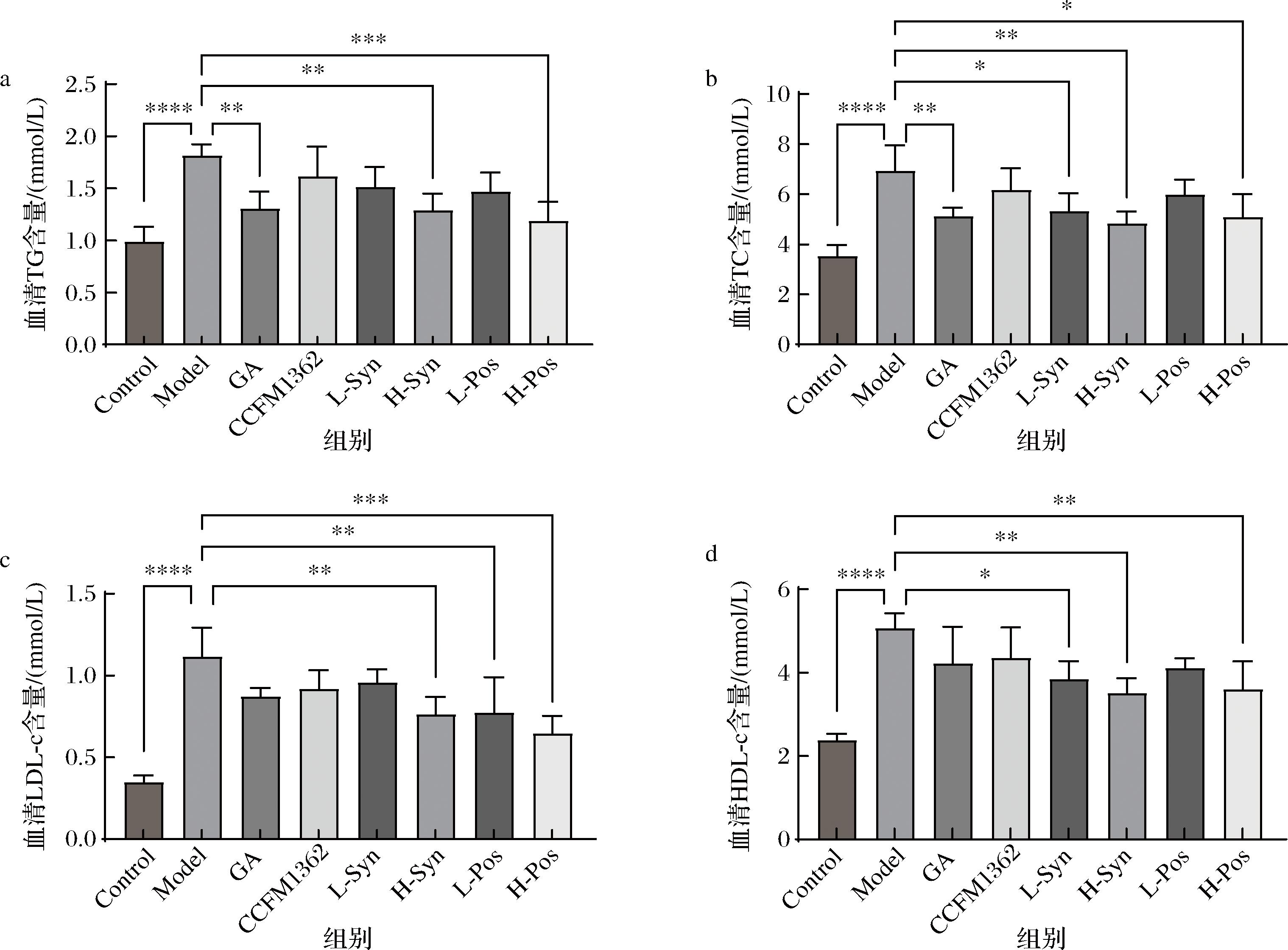
a-血清TG含量;b-血清TC含量;c-血清LDL-c含量;d-血清HDL-c含量
图3 小鼠血脂水平
Fig.3 Serum lipid profile levels in mice
TG含量的差异如图3-a所示,单独灌胃GA的TG含量较模型组降低27.89%(P<0.01),而单独灌胃卷曲乳杆菌CCFM1362降幅不明显。经过两者协同干预后,发酵液组表现出降TG效果,其中高剂量发酵液的干预对TG的降幅达到34.67%(P<0.001),优于合生制剂干预组以及单独干预组。在TC改善方面,如图3-b所示,高剂量发酵液组效果相较模型组下降26.56%(P<0.05),说明在降低TC方面发酵液有一定效果,但未显示出比合生制剂更强的协同增效效果。
在LDL-c方面,GA和CCFM1362组虽有下降趋势,但无统计学差异,而高剂量合生制剂组显著降低LDL-c(P<0.01)。发酵液组降幅更大,低剂量和高剂量分别下降30.78%(P<0.01)和41.98%(P<0.001),表明甘草酸经卷曲乳杆菌CCFM1362发酵后在降低LDL-c方面更具优势。在HDL-c含量上,GA和CCFM1362组无显著下降趋势。相比之下,高剂量合生制剂和发酵液组分别降低30.75%(P<0.01)和29.00%(P<0.01)。
综上所述,GA经卷曲乳杆菌CCFM1362发酵后产生的协同干预效果在各项血脂指标上均表现出不同程度的降脂效果。综合评估4项血脂含量,认为高剂量发酵液组降脂效果最佳。
2.4 卷曲乳杆菌CCFM1362发酵GA对小鼠衰老相关分泌表型的影响
SASP是指衰老细胞分泌的一类促炎细胞因子、细胞外基质降解酶及其他代谢产物,包括IL-1β、IL-6、TNF-α等[20],这些因子通过促进慢性低度炎症反应,进而加速机体衰老的过程。如图4-a~图4-c所示,与对照组相比,高脂饮食模型组小鼠的IL-1β、IL-6和TNF-α水平显著升高(P<0.000 1),表明高脂饮食诱导的衰老小鼠存在明显的炎症反应。
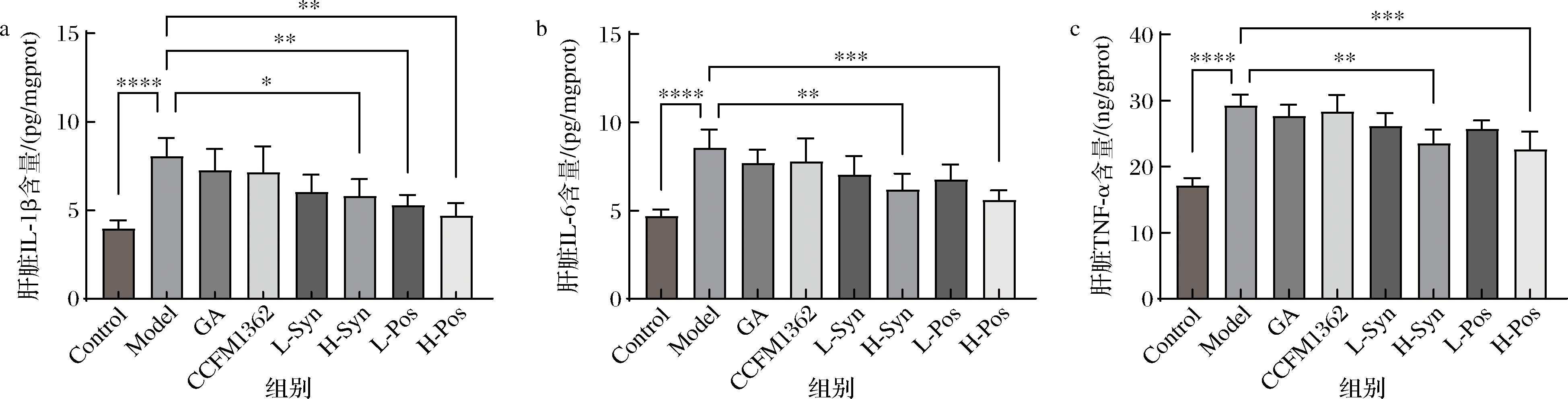
a-肝脏IL-1β含量;b-肝脏IL-6含量;c-肝脏TNF-α含量
图4 小鼠SASP水平
Fig.4 Levels of SASP in mice
与模型组相比,单独灌胃GA和CCFM1362虽然能够降低炎症因子的分泌,但未显示出统计学差异。高剂量合生制剂对IL-1β、IL-6和TNF-α的降幅与单独干预组相比有不同程度的显著下降(P<0.05),然而高剂量发酵液组对IL-1β、IL-6和TNF-α的降幅优于合生制剂组,分别下降41.51%(P<0.001)、34.33%(P<0.001)和22.62%(P<0.001),表明发酵处理可能通过体外代谢转化提升机体的抗炎活性。此外,上述炎症因子的改善呈现出剂量依赖性,表明卷曲乳杆菌CCFM1362发酵GA产生协同效果,能够有效调控SASP,减少促炎因子的分泌,从而抑制慢性炎症反应的发生。
2.5 卷曲乳杆菌CCFM1362发酵GA对小鼠β-半乳糖苷酶的影响
在衰老细胞中,溶酶体的数量和大小通常会增加,而β-半乳糖苷酶作为与溶酶体质量直接相关的酶,是表征衰老水平的重要生物标志物[21]。由图5可知,单独灌胃卷曲乳杆菌CCFM1362或GA的小鼠β-半乳糖苷酶含量分别下降7.69%和17.21%,但未达到统计学显著性。合生制剂组(低、高剂量)的β-半乳糖苷酶水平分别下降15.98%和22.77%(P<0.01),但其降幅接近于单独干预组的叠加效应。相比之下,发酵液组的低、高剂量组的干预效果优于合生制剂,β-半乳糖苷酶水平分别下降20.70%(P<0.05)和35.00%(P<0.000 1)。上述结果表明,合生制剂能够一定程度上降低β-半乳糖苷酶水平,发酵处理通过菌株的生物转化作用生成新的活性成分,而非合生制剂组的简单混合,从而显著增强了对衰老标志物的抑制作用,表明卷曲乳杆菌CCFM1362发酵GA对提升抗衰能力的协同作用。
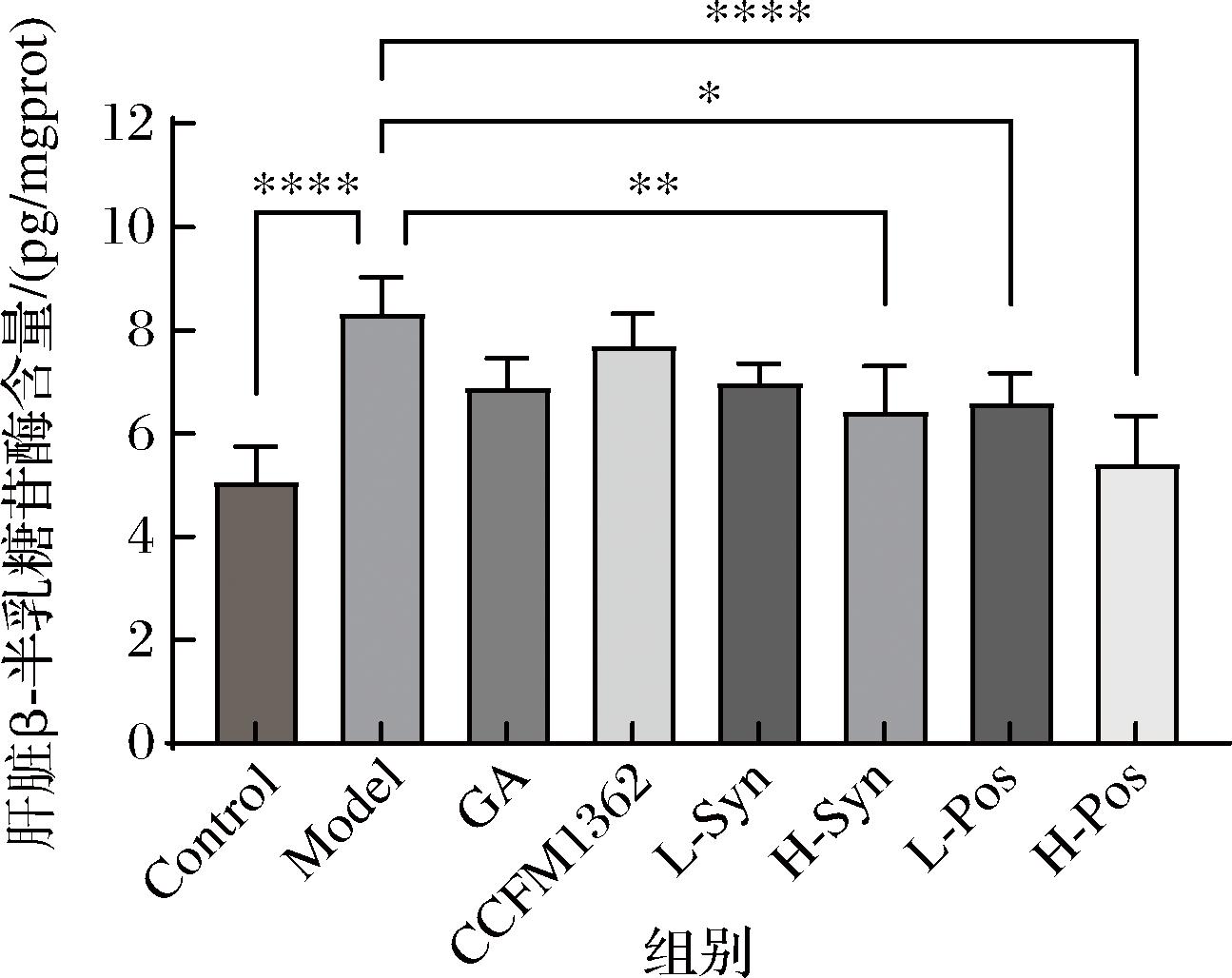
图5 小鼠肝脏β-半乳糖苷酶含量
Fig.5 Liver β-galactosidase activity in mice
2.6 卷曲乳杆菌CCFM1362发酵GA对小鼠慢性炎症通路的影响
如图6所示,与对照组相比,模型组小鼠因脂质堆积诱发慢性炎症,导致肝脏NF-κB p65的激活,同时下游炎症因子COX2和iNOS水平升高,进一步加剧炎症反应。单独灌胃GA和卷曲乳杆菌CCFM1362对COX2和iNOS指标的降幅均无统计学显著性,仅有CCFM1362对NF-κB p65含量有显著下调效果(P<0.05)。合生制剂的干预之下,多项炎症指标显著降低,尤其是高剂量合生制剂组NF-κB p65、COX2和iNOS含量较模型组分别下降25.78%、21.74%和24.88%(P<0.05)。进一步分析发现,高剂量发酵液组NF-κB p65、COX2和iNOS含量分别下降27.18%(P<0.05)、26.73%(P<0.001)和27.88%(P<0.05),各项指标的降幅均优于合生制剂。上述结果表明,卷曲乳杆菌CCFM1362通过发酵代谢GA,能够更高效地抑制NF-κB信号通路并抑制下游炎症因子,缓解小鼠慢性炎症。

a-肝脏NF-κB p65含量;b-肝脏COX2含量;c-肝脏iNOS含量
图6 小鼠肝脏慢性炎症通路蛋白水平
Fig.6 Protein levels of inflammation pathways in mice liver
2.7 卷曲乳杆菌CCFM1362发酵GA对小鼠DNA损伤通路的影响
DNA损伤修复是维持基因组稳定性和细胞功能的关键过程。随着年龄的增长,PARP1基因的表达能力会逐渐下降,DNA损伤修复能力减弱,导致细胞在衰老过程中DNA损伤越来越严重,而γ-H2AX通常作为DNA损伤的标志物。通过测定PARP1基因相对表达量以及γ-H2AX免疫荧光染色可以评估小鼠DNA损伤情况[18]。
如图7-a显示,与对照组相比,高脂饮食模型组小鼠的PARP1表达显著下降(P<0.01),与模型组相比,单独灌胃GA和卷曲乳杆菌CCFM1362的小鼠PARP1相对表达量分别提升了321.08%和48.21%,但无统计学显著性。合生制剂干预后,低剂量与高剂量提升PARP1表达量113%和460.54%(P<0.01),但其效果仍显著低于发酵液组的效果,发酵液低剂量和高剂量组的PARP1表达分别上调789.24%(P<0.000 1)和916.14%(P<0.000 1),表明卷曲乳杆菌CCFM1362发酵GA能够有效增强DNA修复相关基因的表达,减轻DNA损伤。

a-肝脏PARP1相对表达量;b-γ-H2AX免疫荧光染色
图7 小鼠DNA损伤信号的表达
Fig.7 Expression of DNA damage signaling in mice
γ-H2AX免疫荧光染色结果进一步验证了这一结论。模型组小鼠γ-H2AX荧光信号显著增强,反映出较高水平的DNA双链断裂。相比之下,单独灌胃GA、卷曲乳杆菌CCFM1362及低剂量合生制剂组的小鼠γ-H2AX荧光强度有所减弱,但在高剂量发酵液组中,γ-H2AX染色信号明显降低,表明发酵液干预可有效缓解DNA损伤。
上述结果表明,卷曲乳杆菌CCFM1362发酵GA协同增效可显著增强小鼠的DNA修复能力,从而有助于减缓衰老进程。其中,高剂量发酵液的干预效果最为显著,表现出最佳的DNA损伤修复作用。
2.8 卷曲乳杆菌CCFM1362发酵GA前后的代谢产物解析
通过非靶向代谢组学,对卷曲乳杆菌CCFM1362发酵GA前后的代谢产物进行了分析。结果显示,发酵前后的代谢物在主坐标分析(principal coordinates analysis,PCoA)图中的分布显著不同,表明经过CCFM1362菌株发酵过后,GA发酵液的成分发生了显著变化(图8-a)。通过火山图筛选差异活性成分,设定P值为0.05,log2 FC值为2,最终发现38种成分在经过发酵后含量出现显著差异,主要为萜类、莽草酸及苯丙酸类、脂肪酸类、氨基酸及短肽类等物质,其中15种成分在发酵过后显著增加(图8-b)。

a-GA发酵前后代谢物PCoA图;b-发酵前后差异的代谢物及其丰度火山图;c-发酵前后非靶向代谢物差异
图8 卷曲乳杆菌CCFM1362-GA发酵液非靶向代谢组学分析
Fig.8 Untargeted metabolomic analysis of Lactobacillus curvatus CCFM1362-fermented glycyrrhizic acid
为了进一步筛选出显著增加的物质,根据log2FC值展现发酵前后代谢物的差异倍数绘制了热图(图8-c)。结果显示,甘草次酸3-O-葡萄糖醛酸苷的含量显著增加。考虑到该物质在发酵过程中显著增高,可能与抗衰老和脂质代谢调节相关,甘草次酸3-O-葡萄糖醛酸苷是一种天然甜味剂[22],是GA的远端葡萄糖醛酸苷水解物[23],具有比GA更高的生物利用度和更强的生理功能,包括抗肿瘤、抗病毒和抗炎活性[24],可能是GA发挥功效的关键物质。
3 讨论
本研究采用高脂饮食诱导的脂质积累致衰小鼠模型,这一模型常用于模拟肥胖相关的慢性炎症及衰老[25-27]。比起D-半乳糖诱导衰老模型或自然衰老模型,高脂饮食模型更符合肥胖及代谢综合征患者的衰老特征,更能有效模拟脂质积累过度引发的早衰过程。高脂饮食不仅会导致脂质代谢紊乱,还会通过炎症通路促进SASP的形成,从而加速机体衰老[28-29]。SASP是衰老细胞的重要特征,其分泌的炎症因子(如IL-1β、IL-6、TNF-α)可通过NF-κB信号通路进一步放大炎症反应,SASP通过旁分泌和内分泌机制,进一步加剧慢性炎症和细胞损伤,形成恶性循环[5]。
本研究结果显示,脂质积累诱导小鼠SASP显著增加,伴随NF-κB p65的激活,验证了其在脂质积累致衰中的关键作用[30]。此外,β-半乳糖苷酶作为衰老标志物,其含量也在模型组显著升高,与已有研究报道一致[31]。本研究发现,单独甘草酸或卷曲乳杆菌CCFM1362的干预对肝脏损伤修复、血脂调控、SASP和β-半乳糖苷酶的抑制作用较弱。合生制剂的效果优于单独灌胃但却未展现出更优异的效果,即两者简单组合可能不足以发挥协同增效作用。发酵GA(特别是高剂量组)能够显著改善肝脏脂质积累和血脂水平,降低SASP因子水平和β-半乳糖苷酶含量,表明发酵过程能够增强GA生物活性,提高其抗衰老作用。值得一提的是,HDL-c作为“好胆固醇”,在胆固醇逆转转运中发挥重要作用,适度维持其含量有助于降低动脉粥样硬化风险。因此,尽管发酵液组的HDL-c降幅低于合生制剂组,这可能并不意味着其效果较弱,而是更有利于维持HDL-c的平衡,从而优化健康效应。一些研究表明GA具有抗炎、抗氧化和降脂作用[32-33]。但本研究发现单独GA干预效果有限,可能因其在体内需经菌群代谢或肠道吸收转化为甘草次酸等物质后才能发挥作用,而长期的高脂饮食影响肠道菌群以及肠道代谢过程,导致其药效降低[34-35]。发酵卷曲乳杆菌GA比单独GA在缓解脂质积累引起的衰老方面更具优势,这是因为卷曲乳杆菌CCFM1362可能通过β-葡萄糖醛酸酶等催化GA转化为甘草次酸,甘草次酸可能是发酵GA增强抗衰老作用的关键代谢产物[36-37]。结构上看,甘草次酸3-O-葡萄糖醛酸苷可能是甘草次酸经卷曲乳杆菌CCFM1362糖基化修饰的产物。综上所述,发酵GA表现优异的抗衰效果,这可能归因于其代谢产物甘草次酸及其衍生物的生物活性。
为进一步排除卷曲乳杆菌CCFM1362-GA发酵液中其他代谢物的潜在影响,并明确GA生物转化的关键作用,本研究设置了合生制剂组,即卷曲乳杆菌CCFM1362与甘草酸的直接混合物。实验结果表明,GA经卷曲乳杆菌CCFM1362发酵后,其衍生物展现出较发酵前更强的生物活性。尽管合生制剂组中菌株也可能在体内对GA进行代谢,生成一些代谢产物,这些产物与发酵液中的代谢产物可能存在一定程度的重叠,但本研究的重点在于探讨菌株在GA代谢及其增效中的作用,而非菌株本身产生的代谢物。因此,发酵液的增效作用主要源于GA的发酵产物,而非菌株直接产生的其他代谢产物。
WEI等[12]研究巴氏葡萄球菌3I10,发现其虽具备一定的GUS活性,但其水解GA中葡萄糖醛酸能力较低,影响GA的高效转化。YUAN等[14]研究发现鼠乳杆菌主要通过影响肠道药物转运蛋白(MDR1、MRP2)的表达,提高GA的生物利用度,但其GUS活性及GA转化效率未被充分研究。本研究中卷曲乳杆菌CCFM1362不仅具备GUS活性,能够催化GA向GAMG的转化,还能进一步促进GA的衍生物生成,增强其抗衰老作用。值得注意的是,卷曲乳杆菌已被列入《可用于食品的菌种名单》,其应用安全性具有保障。因此,本研究不仅验证了卷曲乳杆菌CCFM1362在GA生物转化中的优势,也为其在食品和健康产品中的应用提供了科学依据。
4 结论
卷曲乳杆菌CCFM1362发酵GA通过调节脂质代谢,有效减少高脂饮食引起的体重增加、肝脏肥大及脂肪堆积,同时显著降低IL-1β、IL-6、TNF-α等衰老相关分泌表型因子的水平,改善慢性低度炎症状态,并通过抑制NF-κB p65相关通路,减少下游炎症因子COX2、iNOS的分泌,从而缓解衰老症状。此外,GA发酵液能提高DNA损伤修复关键酶PARP1的表达,减少DNA损伤标志物γ-H2AX的积累,从而从分子水平保护基因稳定。进一步研究发现,GA经卷曲乳杆菌CCFM1362发酵后可生成甘草次酸3-O-葡萄糖醛酸苷等代谢产物,从而增强发酵液的降脂及抗衰功效。本研究阐明了乳杆菌转化GA在缓解脂质积累引起衰老中的作用机制,为益生菌与植物化合物协同作用的功能性食品开发提供了新的思路。
[1] GORGOULIS V, ADAMS P D, ALIMONTI A, et al.Cellular senescence:Defining a path forward[J].Cell, 2019, 179(4):813-827.
[2] MUTLU A S, DUFFY J, WANG M C.Lipid metabolism and lipid signals in aging and longevity[J].Developmental Cell, 2021, 56(10):1394-1407.
[3] XU M, PIRTSKHALAVA T, FARR J N, et al.Senolytics improve physical function and increase lifespan in old age[J].Nature Medicine, 2018, 24(8):1246-1256.
[4] DE DIEGO I, PELEG S, FUCHS B.The role of lipids in aging-related metabolic changes[J].Chemistry and Physics of Lipids, 2019, 222:59-69.
[5] L PEZ-OT
PEZ-OT N C, BLASCO M A, PARTRIDGE L, et al.Hallmarks of aging:An expanding universe[J].Cell, 2023, 186(2):243-278.
N C, BLASCO M A, PARTRIDGE L, et al.Hallmarks of aging:An expanding universe[J].Cell, 2023, 186(2):243-278.
[6] LI F F, LIU B, LI T, et al.Review of constituents and biological activities of triterpene saponins from Glycyrrhizae radix et rhizoma and its solubilization characteristics[J].Molecules, 2020, 25(17):3904
[7] DING Y M, BRAND E, WANG W Q, et al.Licorice:Resources, applications in ancient and modern times[J].Journal of Ethnopharmacology, 2022, 298:115594.
[8] HOSSEINZADEH H, NASSIRI-ASL M.Pharmacological effects of Glycyrrhiza spp.and its bioactive constituents:Update and review[J].Phytotherapy Research, 2015, 29(12):1868-1886.
[9] DI PAOLA R, MENEGAZZI M, MAZZON E, et al.Protective effects of glycyrrhizin in a gut hypoxia (ischemia)-reoxygenation (reperfusion) model[J].Intensive Care Medicine, 2009, 35(4):687-697.
[10] SIL R, CHAKRABORTI A S.Oxidative inactivation of liver mitochondria in high fructose diet-induced metabolic syndrome in rats:Effect of glycyrrhizin treatment[J].Phytotherapy Research, 2016, 30(9):1503-1512.
[11] ZIMMERMANN M, ZIMMERMANN-KOGADEEVA M, WEGMANN R, et al.Separating host and microbiome contributions to drug pharmacokinetics and toxicity[J].Science, 2019, 363(6427):eaat9931.
[12] WEI B, WANG P P, YAN Z X, et al.Characteristics and molecular determinants of a highly selective and efficient glycyrrhizin-hydrolyzing β-glucuronidase from Staphylococcus pasteuri 3I10[J].Applied Microbiology and Biotechnology, 2018, 102(21):9193-9205.
[13] ZUO X, XU Y, REN G X, et al.Licorice endophytes activate glycyrrhizin synthesis metabolic flux through feedback of β-glucuronidase conversion activity[J].International Journal of Biological Macromolecules, 2025, 302:140484.
[14] YUAN T J, WANG J, CHEN L T, et al.Lactobacillus murinus improved the bioavailability of orally administered glycyrrhizic acid in rats[J].Frontiers in Microbiology, 2020, 11:597.
[15] TALENS-PERALES D, G RSKA A, HUSON D H, et al.Analysis of domain architecture and phylogenetics of family 2 glycoside hydrolases (GH2)[J].PLoS One, 2016, 11(12):e0168035.
RSKA A, HUSON D H, et al.Analysis of domain architecture and phylogenetics of family 2 glycoside hydrolases (GH2)[J].PLoS One, 2016, 11(12):e0168035.
[16] WANG X Y, LIU Y L, WANG C, et al.Properties and structures of β-glucuronidases with different transformation types of glycyrrhizin[J].RSC Advances, 2015, 5(84):68345-68350.
[17] LEE E S, KWON M-H, KIM H M, et al.Curcumin analog CUR5-8 ameliorates nonalcoholic fatty liver disease in mice with high-fat diet-induced obesity[J].Metabolism, 2020, 103:154015.
[18] LEE G, KIM Y Y, JANG H, et al.SREBP1c-PARP1 axis tunes anti-senescence activity of adipocytes and ameliorates metabolic imbalance in obesity[J].Cell Metabolism, 2022, 34(5):702-718.e5.
[19] HENN R E, ELZINGA S E, GLASS E, et al.Obesity-induced neuroinflammation and cognitive impairment in young adult versus middle-aged mice[J].Immunity &Ageing, 2022, 19(1):67.
[20] FAGET D V, REN Q H, STEWART S A.Unmasking senescence:Context-dependent effects of SASP in cancer[J].Nature Reviews Cancer, 2019, 19(8):439-453.
[21] YOUNG A R J, CASSIDY L D, NARITA M.Autophagy and senescence, converging roles in pathophysiology as seen through mouse models[J].Advances in Cancer Research,2021, 150:113-145.
[22] GUO L C, ZHANG M Q, FEI Y, et al.Natural sweetener, glycyrrhetinic acid 3-O-mono-beta-d-glucuronide, for postprandial hyperglycemia management[J].Journal of Agricultural and Food Chemistry, 2024, 72(9):4747-4756.
[23] HE D M, KALEEM I, QIN S Y, et al.Biosynthesis of glycyrrhetic acid 3-O-mono-β-d-glucuronide catalyzed by β-d-glucuronidase with enhanced bond selectivity in an ionic liquid/buffer biphasic system[J].Process Biochemistry, 2010, 45(12):1916-1922.
[24] LI B, YANG Y A, CHEN L Z, et al.18α-Glycyrrhetinic acid monoglucuronide as an anti-inflammatory agent through suppression of the NF-κB and MAPK signaling pathway[J].MedChemComm, 2017, 8(7):1498-1504.
[25] MCKINZIE S R, KAVERINA N, SCHWEICKART R A, et al.Podocytes from hypertensive and obese mice acquire an inflammatory, senescent, and aged phenotype[J].American Journal of Physiology.Renal Physiology, 2024, 326(4):F644-F660.
[26] SOHOULI M H, ESLAMIAN G, MALEKPOUR ALAMDARI N, et al.Effects of N-acetylcysteine on aging cell and obesity complications in obese adults:A randomized, double-blind clinical trial[J].Frontiers in Nutrition, 2023, 10:1237869.
[27] BOURNOT L, PAYET T, SICARD F, et al.Aging alone or combined with obesity increases white adipose tissue inflammatory status in male mice[J].Scientific Reports, 2024, 14:16268.
[28] BASTARD J P, MAACHI M, LAGATHU C, et al.Recent advances in the relationship between obesity, inflammation, and insulin resistance[J].European Cytokine Network, 2006, 17(1):4-12.
[29] ELLULU M S, PATIMAH I, KHAZA’AI H, et al.Obesity and inflammation:The linking mechanism and the complications[J].Archives of Medical Science, 2017, 13(4):851-863.
[30] WANG C, NING L P, WANG Y H, et al.Nuclear factor-kappa B mediates TRPV4-NO pathway involved in thermal hyperalgesia following chronic compression of the dorsal root ganglion in rats[J].Behavioural Brain Research, 2011, 221(1):19-24.
[31] HICKSON L J, LANGHI PRATA L G P, BOBART S A, et al.Senolytics decrease senescent cells in humans:Preliminary report from a clinical trial of Dasatinib plus Quercetin in individuals with diabetic kidney disease[J].EBioMedicine, 2019, 47:446-456.
[32] YAMAMOTO M, NAGASAWA Y, FUJIMORI K.Glycyrrhizic acid suppresses early stage of adipogenesis through repression of MEK/ERK-mediated C/EBPβ and C/EBPδ expression in 3T3-L1 cells[J].Chemico-Biological Interactions, 2021, 346:109595.
[33] LUO L H, GE M, SUN Y M, et al.New findings on the antagonism of the environmental chemical toxicity 2-ethylhexyl diphenyl phosphate:Glycyrrhizic acid as an Nrf2 activator targets Nrf2/ROS/STAT3 signalling crosstalk to alleviate thymic injury in chicks[J].Poultry Science, 2025, 104(4):104918.
[34] YUAN Y, HU X M, GUO C G, et al.Reduction of intestinal RIPK1 ameliorates HFD-induced metabolic disorders in female mice[J].iScience, 2025, 28(2):111906.
[35] YANG M, GUO D Y, REN Z Y, et al.Anti-obesity effects of luteoloside on high fat diet induced obese mice:Modulation of white adipose tissue, gut microbiota, and PPAR signaling pathways[J].Food Research International, 2025, 203:115892.
[36] ZHANG J, ZHANG J Z, YAO Z Z, et al.GAMG ameliorates silica-induced pulmonary inflammation and fibrosis via the regulation of EMT and NLRP3/TGF-β1/Smad signaling pathway[J].Ecotoxicology and Environmental Safety, 2024, 285:117124.
[37] ZHENG L, ZHU Q, XU C, et al.Glycyrrhizin mitigates radiation-induced acute lung injury by inhibiting the HMGB1/TLR4 signalling pathway[J].Journal of Cellular and Molecular Medicine, 2020, 24(1):214-226.