老龄化将是未来几十年全球面临的重大社会问题。联合国《世界人口展望2024》指出,随着中国人口老龄化的发展,至本世纪中叶,老年人口将会超过5亿人[1]。衰老是生物体功能随着时间的推移而退化的一种复杂过程,受饮食、生活方式、环境、遗传和疾病等多种因素的影响[2]。在衰老过程中,老年人的身体组织器官发生功能衰退或退化,从而增加其患老年性疾病的几率,给世界各国在养老、医疗支出、健康保障等方面带来巨大的财政压力[3,4]。近年来,越来越多的研究表明,膳食干预在抗衰老过程中发挥着重要作用,主要包括调节能量代谢、改善线粒体功能、降低氧化应激和慢性炎症水平等。例如,富含抗氧化剂、多酚类化合物和Omega-3脂肪酸的膳食模式被证明能够有效延缓衰老进程,并在改善认知功能、心血管健康等方面具有积极效果[5]。也有报道指出通过补充特定营养素和调整膳食结构,可以调控细胞内关键信号通路,从而促进细胞自噬和DNA修复,提高机体的抗衰老能力[6]。因此,深入研究营养干预对衰老机制的调控作用,将为开发针对老龄化问题的个性化营养策略提供科学依据,同时为优化人类健康和寿命延长提供新见解。
藤茶(学名显齿蛇葡萄,Ampelopsis grossedentata)是一种传统中药材,广泛分布于中国南方地区,在2013年12月被国家卫生与计划生育委员会批准为新食品原料,正式成为药食同源物质。二氢杨梅素(dihydromyricetin,DHM)是一种黄酮类化合物,在藤茶中的含量较高(约占干重的20%~30%),目前市面上所有药物和膳食补充剂使用的DHM均提取自藤茶[7]。DHM具有多种生物活性,包括糖脂代谢调节、抗氧化、抗炎、抗肿瘤和抗衰老等[8-11]。关于DHM延缓衰老的研究指出其作用途径主要是清除自由基、抑制炎症反应、增强线粒体功能和神经保护作用,作用机制涉及调节SIRT1通路、p53/p21通路、Nrf2/ARE通路、AMPK/mTOR通路等[8,12-15]。
为了进一步发掘藤茶活性成分DHM延缓衰老的直接证据和深入机制,本研究将使用生命周期较短且易于基因编辑的经典衰老模式动物——秀丽隐杆线虫(Caenorhabditis elegans)进行研究,旨在探究DHM对线虫寿命的直接影响及其延缓衰老的作用机制。
1 材料与方法
1.1 材料与试剂
1.1.1 生物资源
OP50大肠杆菌、野生型N2线虫、CF1038 daf-16(mu86) Ⅰ线虫、VC1003 vha-3(ok1501) Ⅳ线虫、CZ10175 zdIs5[mec-4p::GFP + lin-15(+)]Ⅰ线虫、DA1116 eat-2(ad1116) Ⅱ线虫、MQ130 clk-1(qm30) Ⅲ线虫、RB1206 rsks-1(ok1255) Ⅲ线虫、OH2096 otEx1131[unc-47::GFP+rol-6(su1006)+pBS] 线虫、TG38 aak-2(gt33) Ⅹ线虫、CB4037 glp-1(e2144) Ⅲ线虫、DM8005 raIs5 [myo-3p::GFP::myo-3+rol-6(su1006)] 线虫、SJZ47 foxSi16 [myo-3p::tomm-20::mKate2::HA::tbb-2 3′ UTR]Ⅰ线虫,均来自美国明尼苏达秀丽隐杆线虫遗传学中心(CGC),该中心由NIH研究基础设施项目办公室(P40 OD010440)资助。atg-7(bp422) Ⅳ由中国科学院生物物理研究所张宏院士赠予。
1.1.2 主要试剂
DHM(CAS号:27200-12-0,纯度HPLC>98%,提取自藤茶),上海源叶生物科技有限公司。磷酸氢二钾、氯化钠、磷酸二氢钾、氯化钾、氨苄青霉素、琼脂糖、LB培养基、Triton X-100、4%(体积分数)多聚甲醛固定液,上海生工生物工程股份有限公司;蛋白胨(Gibco Bacto Peptone),英淮捷基(上海)贸易有限公司;硫酸镁、胆固醇、氯化钙、氢氧化钠、1,4-哌嗪二乙磺酸倍半钠盐、次氯酸钠、异丙醇、5-氟-2′-脱氧尿嘧啶核苷(5-Fluoro-2′-deoxyuridine,FUdR)和叠氮化钠,德国西格玛奥德里奇贸易有限公司,所有化学品均为分析纯级。
1.2 仪器与设备
SHP-250生化培养箱,上海精宏实验设备有限公司;MQT-60R振荡培养箱,上海旻泉实验设备有限公司;SW-CJ-2FD超净工作台,苏静安泰实验设备有限公司;ME104E分析天平,瑞士Mettler Toledo公司;SZ650体视显微镜,重庆奥特光学仪器有限公司;Zeiss Discovery V12荧光显微镜,德国ZEISS公司;Nikon ECLIPSE Ti2+AX激光共聚焦显微镜,日本Nikon公司。
1.3 实验方法
1.3.1 秀丽线虫与大肠杆菌培养
大肠杆菌OP50接种在37 ℃的LB肉汤中,恒温摇床过夜培养后分装存于4 ℃冰箱备用。野生型和基因突变型秀丽隐杆线虫雌雄同体均培养在滴加了大肠杆菌OP50的线虫生长培养基(nematode growth medium,NGM)培养皿上,在20 ℃温度下置于生化培养箱中培养。
1.3.2 秀丽线虫的同步化、冻存和复苏
同步化:为确保实验所用线虫处在相对均一的发育时期,所有实验开始前均进行了同步化。选择带有大量虫卵的线虫培养皿进行同步化,将线虫和虫卵用M9缓冲液(3 g KH2PO4,15.2 g Na2HPO4·12 H2O,5 g NaCl,并加入1 mL MgSO4溶液(1 mol/L),ddH2O定容至1 L,高压灭菌)冲洗至离心管中,离心去除上清液。随后加入500 μL的线虫漂洗液[10 mL NaClO(质量分数4%)、10 mL NaOH(1 mol/L)、20 mL ddH2O混匀避光保存],摇晃3~5 min,离心收集虫卵,用1 mL M9缓冲液洗涤2次后将虫卵转移至NGM板的菌苔附近,待虫卵孵化后即完成同步化。
冻存与复苏:根据缓冻速融原则,将待冻存的Dauer期线虫使用线虫冻存液(无菌的850 mL S-buffer和150 mL甘油混合)清洗并离心,吸取含线虫沉淀的1 mL液体至冻存管。将冻存管置于梯度降温盒中置于-80 ℃冰箱冷冻,次日取出冻存管转移至液氮罐保存。复苏时,将含有线虫的冻存管置于37 ℃水浴锅中加热1 min。在5 000 r/min下离心2~3 min,弃上清液,使用50 μL M9缓冲液重悬线虫沉淀,滴加至NGM板的菌苔周围,1天后观察线虫生长情况。
1.3.3 秀丽线虫寿命实验
寿命测定分别在滴加了二甲基亚砜(dimethyl sulfoxide,DMSO)载体对照的大肠杆菌OP50和DHM(1 mmol/L)溶液的大肠杆菌OP50的培养基上进行,同时培养基中含有50 μg/mL FUdR以阻止线虫胚胎发育。首先,使用次氯酸钠溶液将N2野生型线虫(或相应的基因敲除线虫)同步化,之后放入20 ℃生物培养箱等待卵孵化,待培养至L4后期,将线虫转移到上述对照组和给药组处理的培养基上,并在20 ℃下培养生长。每组3个培养皿,每个皿中50条线虫。每天对线虫进行观察并记录,判断存活、死亡或消失:触摸后无任何运动现象的线虫定义为死亡,爬到培养皿侧壁或盖子上的线虫剔除出实验。待全部线虫死亡后分析寿命周期数据并绘制存活曲线,线虫L4末期的成年期前期(young adult,YD)阶段视为第0天,进行了3次独立实验。
1.3.4 线虫触摸反应实验
本研究使用10次触摸分析法测量触觉反应,对同步化且食物充足的不同期线虫施加机械刺激,用眉毛触碰动物身体的头部和尾部,总共6次。如果动物在每次刺激后改变方向,则判定为有反应并记为1分,无反应则记为0分,总分6分。在本研究中,分别对DHM组或对照组处理3、5、10 d的线虫进行测试,记录线虫机械感觉神经对触摸的有效反应次数。
1.3.5 线虫运动能力测试
在本研究中,分别对DHM组或对照组处理3、5、10 d的线虫进行运动能力测试。首先,将每条虫子单独转移到新的空NGM平板中,让每条虫子自由移动60 s,以尽量减少惊吓行为。线虫在空NGM平板中央自由运动时,观察记录其在30 s内的运动过程,记录身体弯曲次数。记录标准:头部摆动角度超过90°时记为摆动一次,每组使用15条线虫测试。
1.3.6 荧光成像
以下基因编辑的秀丽线虫通过不同荧光蛋白标记成像:线虫mec-4p::GFP使用绿色荧光蛋白GFP标记机械感觉神经元,线虫unc-47::GFP使用绿色荧光蛋白(green fluorescent protein,GFP)标记γ-氨基丁酸(gamma-aminobutyric acid,GABA)神经元,线虫myo-3p::GFP::myo-3使用绿色荧光蛋白GFP标记肌肉细胞;线虫myo-3p::tomm-20::mKate2::HA::tbb-2使用红色荧光蛋白(mKate2)标记肌肉细胞中的线粒体。分别对DHM组或对照组处理3、5、10 d的线虫进行荧光成像,使用25 mmol/L叠氮化钠麻醉线虫后,将线虫转移至带有2%(质量分数)琼脂糖垫层的载玻片上,使用Zeiss Discovery V12荧光显微镜进行拍照。
1.4 数据统计与分析
在本研究中,荧光图片采用Image J软件分析荧光强度值,全部数据使用Graphpad Prism 10.0软件进行数据统计分析,数据以“平均值±标准差”表示,通过t检验比较各组间差异,P<0.05时表示具有显著性差异。
2 结果与分析
2.1 DHM延长秀丽线虫寿命
为了直观评估DHM延缓衰老的效果,本研究测试了OP50+DHM喂食条件下N2野生型线虫的寿命。结果显示,相较于对照组(28 d),DHM显著延长了N2线虫寿命(36 d)(P<0.000 1)(图1-A)。由于减少进食的条件也会延长线虫寿命,为了排除DHM是否通过影响线虫能量摄入影响其寿命,本研究使用热灭活的OP50+DHM喂食条件进行了寿命实验(图1-B)。结果显示DHM依然可以显著延长节食条件下的线虫的寿命(由29 d延长到37 d)(P<0.000 1),说明DHM延长线虫寿命是直接作用而非间接作用。

A-N2常规食物模型;B-N2热量限制模型
图1 DHM延长秀丽线虫寿命
Fig.1 DHM extends lifespan in C.elegans
注:DHM(1 mmol/L)处理对2种条件下秀丽线虫的寿命的影响;数值=平均值±标准差(n=100),与对照组比较的显著性差异标识****为P<0.000 1,t检验;N2:野生型线虫,HK E.coli:热灭活大肠杆菌;Mock:对照组(下同)。
2.2 DHM依赖于自噬和溶酶体活性延长线虫寿命
为了进一步探究DHM延长线虫寿命的信号途径,本研究使用了8种寿命调节相关通路缺陷的基因敲除线虫,分别为:rsks-1(ok1255):mTOR途径缺陷型线虫;daf-16(mu86):IGF1途径缺陷型线虫;atg-7(bp422):自噬相关基因7(atg-7)缺陷型线虫;vha-3(ok1501):溶酶体功能障碍(V-ATP缺陷)型线虫;clk-1(qm30):线粒体功能障碍型线虫;aak-2(gt33):AMPK途径缺陷型线虫;glp-1(e2144):Notch途径缺陷型线虫;eat-2(ad1116):饮食限制型线虫。在DHM喂食不同基因敲除线虫后,通过寿命测试结果筛选得到了其主要信号途径。结果显示,基因敲除线虫rsks-1(ok1255)、daf-16(mu86)、aak-2(gt33)、glp-1(e2144)的寿命被显著延长(P<0.000 1),与N2线虫结果一致,说明DHM延长线虫寿命的信号通路不依赖于mTOR、IGF1、AMPK、Notch途径(图2-A、图2-B、图2-F、图2-G)。重要的是,atg-7(bp422)和vha-3(ok1501)线虫的寿命不再被DHM延长,证明DHM延缓线虫衰老的作用依赖于自噬(atg-7)与溶酶体功能(V-ATP)途径(图2-C、图2-D)。此外,DHM喂食后基因敲除线虫clk-1(qm30)和eat-2(ad1116)的寿命也有稍微延长,证明其抗衰老作用可能部分依赖于线粒体代谢途径(图2-E、图2-H)。
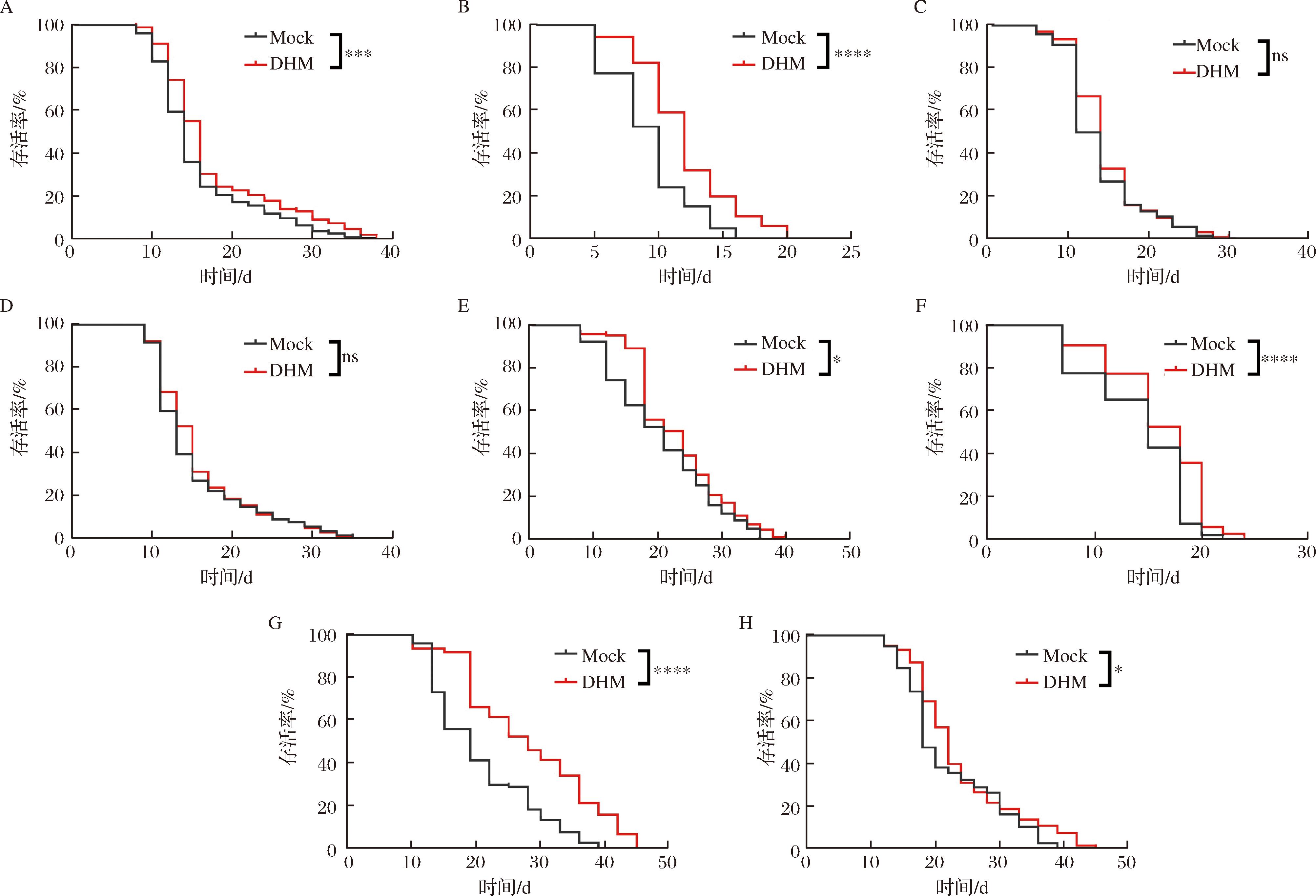
A-rsks-1(ok1255);B-daf-16(mu86);C-atg-7(bp422);D-vha-3(ok1501);E-clk-1(qm30);F-aak-2(gt33);G-glp-1(e2144);H-eat-2(ad1116)
图2 DHM依赖于自噬和溶酶体活性延长线虫的寿命
Fig.2 DHM activates autophagy and lysosomal activity to extend the lifespan in C.elegans
注:DHM(1 mmol/L)处理对不同基因缺陷型秀丽线虫的寿命的影响。数值=平均值±标准差(n=100),与对照组比较的显著性差异标识***为P<0.001,*为P<0.05,ns为P>0.05,t检验(下同)。
2.3 DHM对于线虫机械感觉神经元衰老无显著影响
由于DHM依赖于自噬途径延缓衰老。因此,推测DHM有可能具有维持细胞内蛋白稳态的功能,而在衰老过程中,神经系统和肌肉组织经常因为蛋白稳态失衡而提前衰老。因此,分析DHM对于神经衰老和肌肉衰老的影响。为了探究DHM对其机械感觉神经元的影响,本研究使用了机械感觉神经元标记线虫mec-4p::GFP,通过荧光成像可以直接显示出线虫在衰老过程中的机械感觉神经元的结构变化。如图3-A所示,黄色箭头指出的机械感觉神经元随着线虫衰老进程逐渐退化,而DHM喂食干预未造成显著影响,与对照组比较无统计学差异(图3-B~图3-D)。在第10天时,Mock组与DHM组的机械感觉神经元完整形态占比分别为28.57%和31.58%。同时,触摸反应测试实验评估的表型结果也显示,DHM虽然在第5天时增强了线虫对触摸的反应,但在第10天时对衰老线虫无显著影响(图3-E)。综上所述,DHM对线虫机械感觉神经元的衰老无显著影响。

A-DHM处理后不同年龄的机械感觉神经元标记线虫mec-4p::GFP的荧光代表图像(10×);B~D-A图的量化与统计;E- DHM处理后不同年龄的N2野生型线虫的触摸反应测试
图3 DHM对于线虫机械感觉神经元的衰老无显著影响
Fig.3 DHM has no significant effect on the aging of mechanosensory neurons in C.elegans
注:比例尺200 μm,数值=平均值±标准差(n=16);Breakage:神经元全部断裂的线虫,Mix:部分神经元断裂的线虫,Integrity:神经元全部完整的线虫(下同);黄色箭头所指处为机械感觉神经元。
2.4 DHM延缓GABA神经元衰老
为了进一步探究DHM是否对线虫中其他神经元的衰老起作用,本研究使用了GABA神经元标记线虫unc-47::GFP,后者可以通过荧光成像显示出线虫在衰老过程中的GABA神经元的结构变化。GABA神经元是一类释放γ-氨基丁酸作为主要神经递质的神经元,主要调节线虫的神经网络并维持神经系统稳定。结果显示,GABA神经元在对照组线虫的衰老过程中断裂退化速度更快,而DHM组的GABA神经元在同时期明显更多(图4)。在第3天、第5天、第10天时Mock组的GABA完整神经元占比分别为6.25%、13.33%和6.25%,而DHM组的GABA完整神经元占比分别为33.33%、33.33%和13.33%。这些结果说明DHM可以延缓秀丽线虫中GABA神经元的衰老。
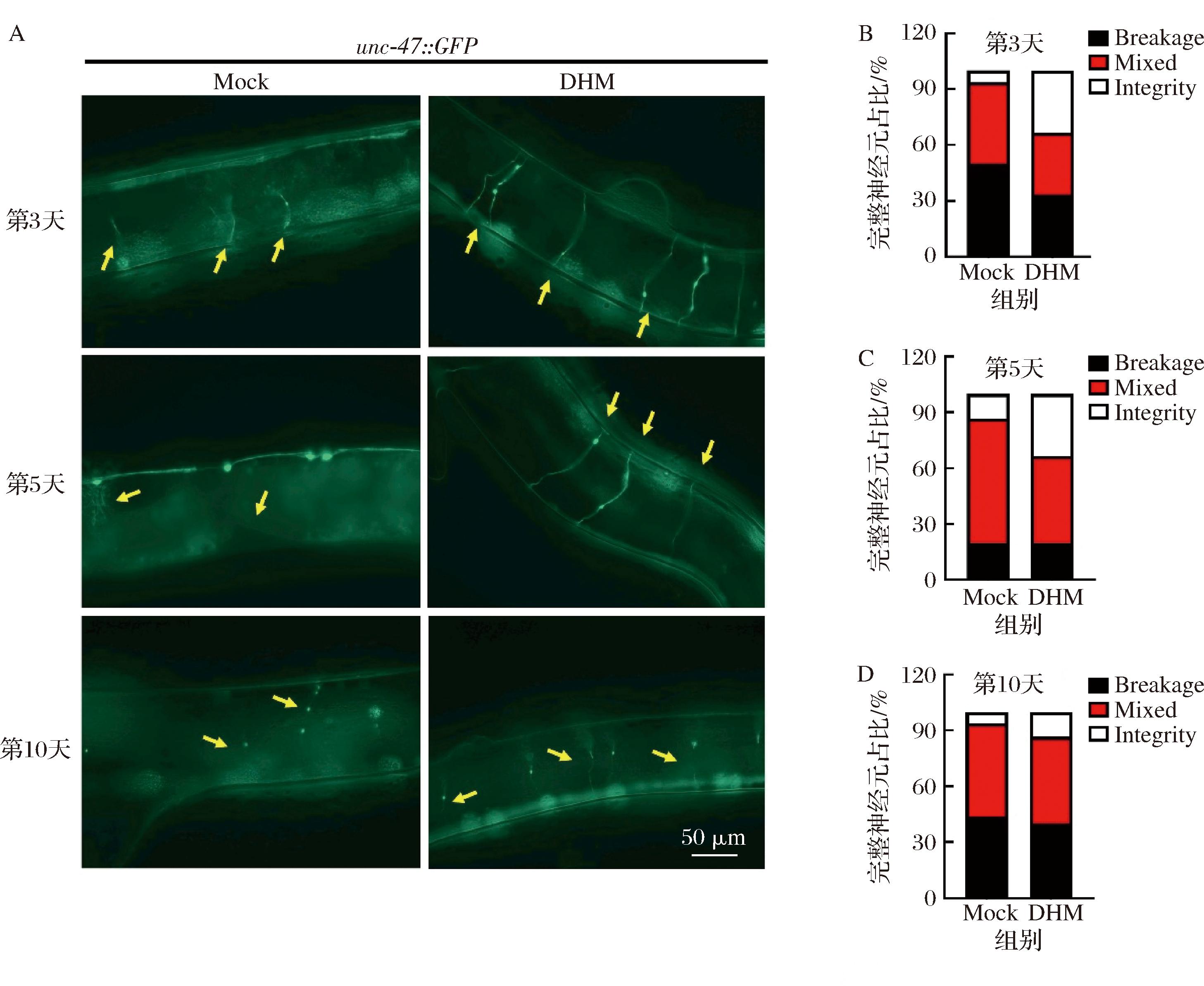
A-DHM处理后不同年龄的GABA神经元标记线虫unc-47::GFP的荧光代表图像(20×);B~D-A图的量化与统计
图4 DHM延缓GABA神经元的衰老
Fig.4 DHM delays aging of GABA neurons in C.elegans
注:比例尺50 μm,数值=平均值±标准差(n=16);黄色箭头所指处为GABA神经元。
2.5 DHM延缓秀丽线虫肌肉衰老
同样,在秀丽线虫衰老过程中,肌肉细胞也会逐渐衰老并丧失功能,表型体现为线虫运动能力的下降。为了探究DHM对线虫肌肉组织在衰老过程中的影响,本研究使用了肌纤维标记线虫myo-3p::GFP::myo-3,后者可以通过荧光成像显示出线虫在衰老过程中的肌肉细胞的变化。如图5-A~图5-D所示,年轻时的秀丽线虫肌肉细胞呈有序且致密的连续排列,随着衰老的进程肌肉细胞逐渐紊乱并出现断裂和不规则聚集,喂食10天DHM后,DHM组的肌纤维断裂点和不规则聚集点显著少于对照组(黄色箭头处),第10天时Mock组和DHM组的断裂肌肉纤维占比分别为70.58%和50.00%。同时进行了运动能力测试,DHM处理的第10天衰老线虫每30 s的摆动速率显著高于对照组(由中位数14次增加至16次),证明DHM延缓了秀丽线虫的肌肉衰老(图5-E~图5-G)。
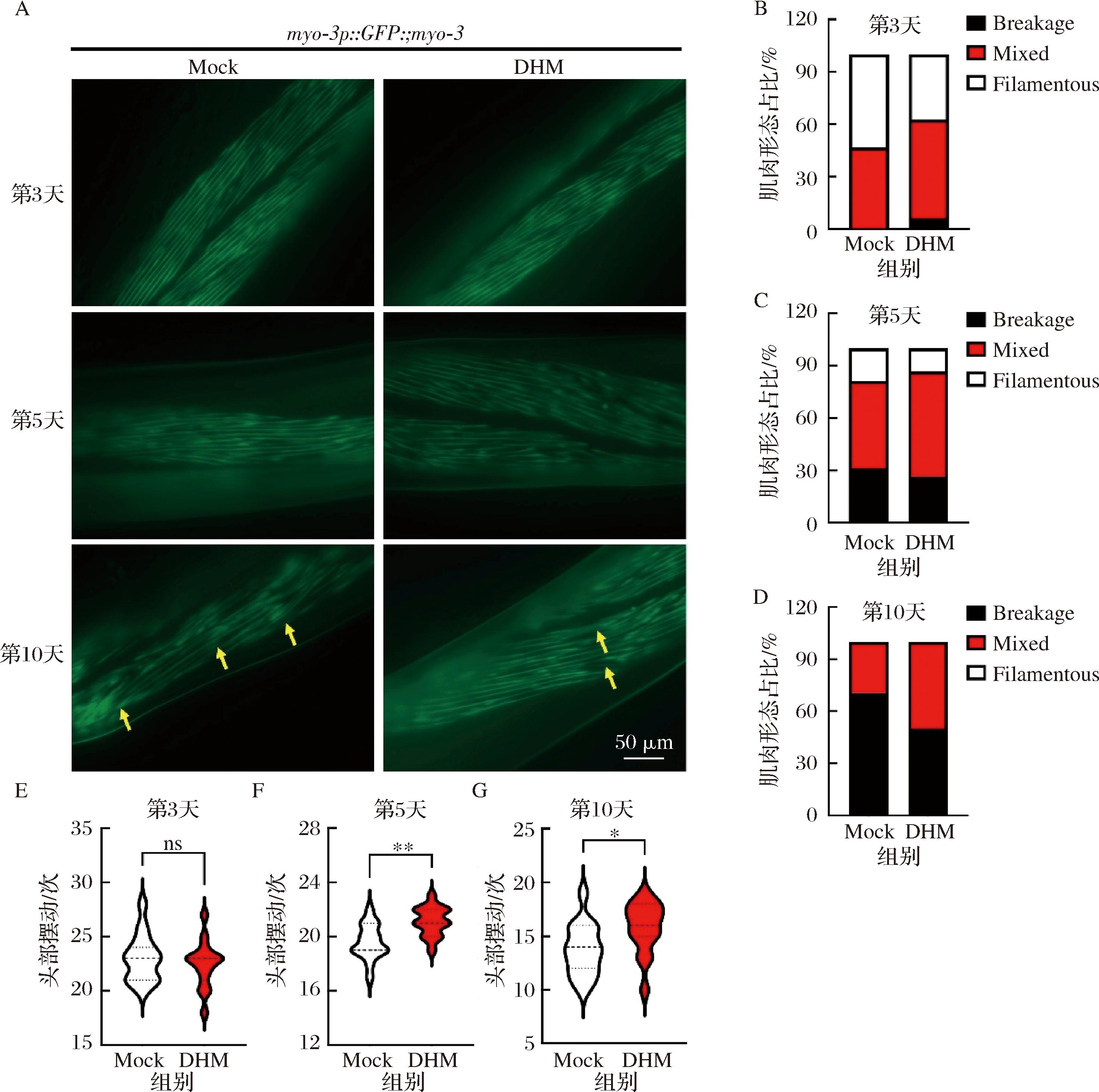
A-DHM处理后不同年龄的肌纤维标记线虫myo-3p::GFP::myo-3的荧光代表图像(20×);B~D-A图的量化与统计;E~G-DHM处理后不同年龄的N2野生型线虫的运动能力测试
图5 DHM延缓秀丽线虫肌肉衰老
Fig.5 DHM delays muscle aging in C.elegans
注:比例尺50 μm,数值=平均值±标准差(n=16);Breakage:大量肌纤维紊乱的线虫,Mix:少量肌纤维紊乱的线虫,Filamentous:肌纤维规律排列的线虫;黄色箭头所指处为肌纤维断裂紊乱的部分。
2.6 DHM通过维持线粒体形态延缓线虫肌肉衰老
肌肉细胞的活性和功能与线粒体代谢密切相关,线虫肌肉细胞中的线粒体数量和功能会随着衰老进程逐渐退化。为了进一步探索DHM延缓线虫肌肉衰老的作用机制,本研究构建了肌肉细胞中的线粒体标记线虫myo-3p::tomm-20::mKate2::HA::tbb-2,后者可以通过荧光成像显示出线虫在衰老过程中的肌肉细胞中线粒体的形态变化。如图6所示,年轻时的秀丽线虫肌肉细胞中的线粒体呈管状有序排列,随着衰老的进程这些线粒体排列的管状形态逐渐紊乱并出现断裂和聚集点。在第10天的衰老线虫中,对照组肌肉细胞中的线粒体群已基本丧失管状形态并出现大量聚集点,而DHM组的线粒体聚集点显著少于对照组(黄色箭头处),并且仍存在部分管状线粒体,携带管状线粒体的线虫占总数的16.67%。这些结果说明DHM组线虫的线粒体状态更健康,DHM在线虫衰老过程中维持了线粒体形态,揭示了其延缓线虫肌肉衰老的根本原因。
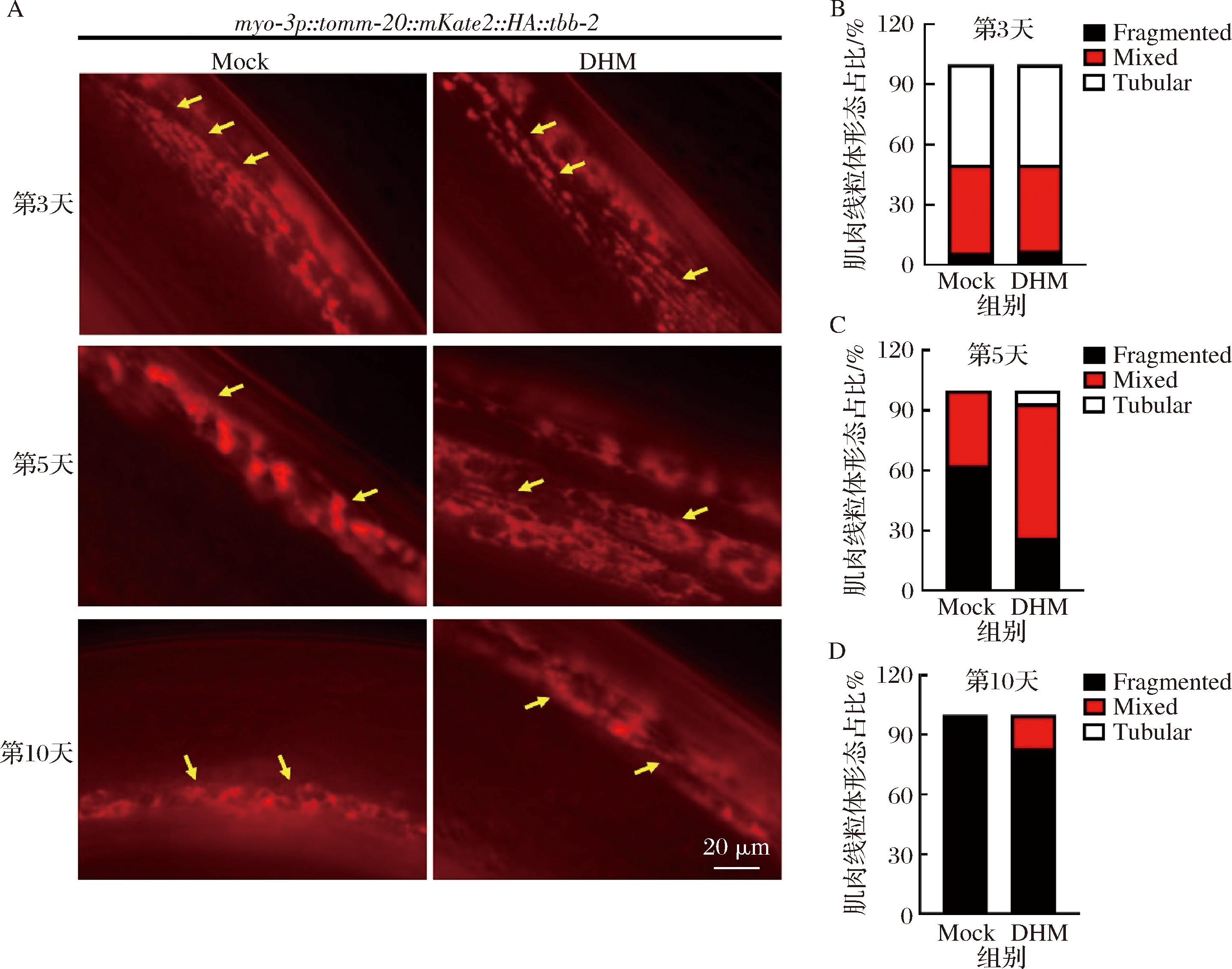
A-DHM处理后不同年龄的肌肉线粒体标记线虫myo-3p::tomm-20::mKate2::HA::tbb-2的荧光代表图像(63×);B~D-A图的量化与统计
图6 DHM通过维持线粒体形态延缓线虫肌肉衰老
Fig.6 DHM delays muscle aging by maintaining mitochondrial morphology in C.elegans
注:比例尺20 μm,数值=平均值±标准差(n=16);Fragmented:肌肉线粒体碎片化的线虫,Mix:部分肌肉线粒体碎片化的线虫,Tubular:肌肉线粒体呈管状的线虫;黄色箭头所指处为管状线粒体或碎片化球状线粒体聚集点。
2.7 讨论
藤茶在中国有超过1200年的食用历史,因其多方面的治疗特性而闻名,主要包括清热解毒、抗炎、缓解咽喉肿痛、降血压、增强骨骼和肌肉[15,16]。近年来,藤茶已作为功能性饮料和膳食补充剂等产品进入市场,具有抗氧化、抗疲劳等功能[17]。报道指出,藤茶提取物可以通过激活AMPK途径增加小鼠肝糖原和肌糖原的储存,并通过抑制FOXO信号通路增加肌肉质量,从而缓解疲劳[18]。另外,藤茶水提物可通过降低促炎因子水平、增强肝脏抗氧化酶活性以及激活Nrf2信号通路,有效缓解机体的氧化应激[19]。现代药理学研究发现,藤茶含有丰富的黄酮类化合物,包括DHM、杨梅素、槲皮素等[20],其关键黄酮类化合物成分之一是DHM,具有抗氧化、缓解疲劳、保护神经、调节线粒体合成等功能[21-23]。然而,DHM的生物活性研究缺乏在延缓衰老方向的深入报道,限制了DHM作为抗衰老膳食补充剂的应用转化。因此,本研究利用经典衰老模式动物秀丽线虫,探究了DHM延缓衰老的生物活性并阐明了其作用机制。
在本研究中,首先,寿命实验结果表明DHM可以显著延长线虫的生命周期,并且在热量摄入限制的条件下依然有效,证明DHM的延缓线虫衰老的效果是直接作用,这与先前DHM在果蝇动物模型中的研究一致[24]。相较于相关研究中羊乳酪蛋白酶解物对秀丽线虫寿命的延长效果(最大寿命增加14.06%),DHM的延寿效果更好(最大寿命增加27.58%)[25]。此外,本研究使用8种基因敲除线虫筛选了DHM抗衰老的主要信号通路,对应的这8个寿命调节信号通路包括:mTOR途径、IGF1途径、自噬、溶酶体功能、线粒体功能、AMPK途径、Notch途径和热量摄入途径,筛选结果显示DHM延缓线虫衰老的作用主要依赖于自噬信号与溶酶体信号,这与DHM先前在HepG2细胞模型中的报道相似[26]。基于此结果,推测DHM延缓衰老的机制与溶酶体自噬活动有关,溶酶体自噬对细胞维持健康状态至关重要,因此,本研究进一步探索了DHM对线虫衰老过程中神经元和肌肉细胞退化过程的影响。
在后续研究中,分别通过构建机械感觉神经元、GABA神经元和肌肉细胞荧光标记线虫跟踪观察了衰老过程中这些细胞形态的变化以及DHM干预的效果,结果发现DHM不能延缓感觉神经元的衰老退化,但是可以显著延缓GABA神经元和肌肉细胞的衰老,重要的是,DHM显著抑制了线虫衰老过程中运动能力的下降,这是另一个DHM延缓衰老的直接证据。近年来,越来越多的研究指出DHM可以改善肌肉萎缩和肌肉损伤[27-29],报道指出DHM可能通过激活小鼠骨骼肌中的SIRT3信号通路促进骨骼肌线粒体结构与功能,从而挽救了肌肉细胞的损伤[29]。同样,在实验结果中也观察到了类似的结果,DHM在线虫肌肉细胞衰老过程中显著阻止了线粒体结构的退化,使更多的线粒体维持健康的管状形态。
综合分析DHM在秀丽线虫衰老过程中的多种影响,本研究认为DHM在线虫中的抗衰老作用是通过激活溶酶体自噬清除了衰老过程中积累的毒性蛋白和受损线粒体,从而维持了部分GABA神经元和肌肉细胞的健康状态,最终提升了衰老线虫的运动能力和寿命。
遗憾的是,本研究也存在一定局限性,比如DHM激活溶酶体自噬的详细分子机制以及作用靶点,在未来的研究中将进一步阐明DHM通过激活自噬延缓衰老的完整分子机制。
3 结论
综上所述,本研究以秀丽隐杆线虫为衰老动物模型探究了DHM延缓衰老的作用与机制,发现DHM显著延长线虫寿命(最大寿命增加27.58%),提升了10天龄衰老线虫的14%运动能力,抑制了10天龄衰老线虫中GABA神经元和肌肉细胞的形态退化(分别降低7.08%和20.58%),并阻止了10天龄衰老线虫中线粒体结构的退化(16.67%),机制研究发现DHM延缓衰老的作用依赖于溶酶体自噬途径的激活。因此,DHM具有作为延缓衰老的膳食补充剂的潜在应用价值。
[1] United Nations Department of Economic and Social Affairs. World population prospects 2024: Summary of results (UNDESA/POP/2024/TR/NO. 9) [R]. New York: United Nations, 2024.
[2] MOQRI M, HERZOG C, POGANIK J R, et al. Validation of biomarkers of aging[J]. Nature Medicine, 2024, 30(2):360-372.
[3] CAI Y S, SONG W, LI J M, et al. The landscape of aging[J]. Science China Life Sciences, 2022, 65(12):2354-2454.
[4] WANG K, LIU H C, HU Q C, et al. Epigenetic regulation of aging: Implications for interventions of aging and diseases[J]. Signal Transduction and Targeted Therapy, 2022, 7:374.
[5] HU F. Diet strategies for promoting healthy aging and longevity: An epidemiological perspective[J]. Journal of Internal Medicine, 2024, 295(4): 508-531.
[6] LONGO V D, ANDERSON R M. Nutrition, longevity and disease: From molecular mechanisms to interventions[J]. Cell, 2022, 185(9):1455-1470.
[7] CHEN J, LI M, GAO Q R, et al. Dihydromyricetin, a flavonoid from vine tea (Ampelopsis grossedentata) provides hepatoprotection by modulating gut microbiota-mediated bile acid homeostasis[J]. Journal of Agriculture and Food Research, 2024, 18:101376.
[8] ZHANG J Y, CHEN Y, LUO H Q, et al. Recent update on the pharmacological effects and mechanisms of dihydromyricetin[J]. Frontiers in Pharmacology, 2018, 9:1204.
[9] WANG Z Y, CAO Z R, YUE Z Y, et al. Research progress of dihydromyricetin in the treatment of diabetes mellitus[J]. Frontiers in Endocrinology, 2023, 14:1216907.
[10] WU J J, XIAO Z W, LI H F, et al. Present status, challenges, and prospects of dihydromyricetin in the battle against cancer[J]. Cancers, 2022, 14(14):3487.
[11] SUN Y, LIU S S, YANG S W, et al. Mechanism of dihydromyricetin on inflammatory diseases[J]. Frontiers in Pharmacology, 2022, 12:794563.
[12] LIU M M, GUO H, LI Z Y, et al. Molecular level insight into the benefit of myricetin and dihydromyricetin uptake in patients with Alzheimer’s diseases[J]. Frontiers in Aging Neuroscience, 2020, 12:601603.
[13] LI C, LUO C, LI X, et al. Repair of the nervous system by dihydromyricetin and the treatment of diseases[J]. International Journal of Frontiers in Medicine,2024,6(6):.
[14] MART NEZ-CORIA H, MENDOZA-ROJAS M X, ARRIETA-CRUZ I, et al. Preclinical research of dihydromyricetin for brain aging and neurodegenerative diseases[J]. Frontiers in Pharmacology, 2019, 10:1334.
NEZ-CORIA H, MENDOZA-ROJAS M X, ARRIETA-CRUZ I, et al. Preclinical research of dihydromyricetin for brain aging and neurodegenerative diseases[J]. Frontiers in Pharmacology, 2019, 10:1334.
[15] CARNEIRO R C V, YE L Y, BAEK N, et al. Vine tea (Ampelopsis grossedentata): A review of chemical composition, functional properties, and potential food applications[J]. Journal of Functional Foods, 2021, 76:104317.
[16] XIE K, HE X, CHEN K Y, et al. Antioxidant properties of a traditional vine tea, Ampelopsis grossedentata[J]. Antioxidants, 2019, 8(8):295.
[17] Wu R R, Li X, Cao Y H, et al. China medicinal plants of the ampelopsis grossedentata—a review of their botanical characteristics, use, phytochemistry, active pharmacological components, and toxicology[J]. Molecules, 2023, 28(20): 7145.
[18] QI S Y, ZENG T X, SUN L, et al. The effect of vine tea (Ampelopsis grossedentata) extract on fatigue alleviation via improving muscle mass[J]. Journal of Ethnopharmacology, 2024, 325:117810.
[19] WANG Z, JIANG Q, LI P, et al. The water extract of Ampelopsis grossedentata alleviates oxidative stress and intestinal inflammation [J]. Antioxidants, 2023, 12(3): 547.
[20] WU J G, WANG C H, HUANG G, et al. Biotransformation of vine tea (Ampelopsis grossedentata) by solid-state fermentation using medicinal fungus Poria cocos[J]. Journal of Food Science and Technology, 2016, 53(8):3225-3232.
[21] WU L T, RAN L, LANG H D, et al. Myricetin improves endurance capacity by inducing muscle fiber type conversion via miR-499[J]. Nutrition &Metabolism, 2019, 16(1):27.
[22] ZOU D, CHEN K, LIU P, et al. Dihydromyricetin improves physical performance under simulated high altitude[J]. Medicine and Science in Sports and Exercise, 2014, 46(11): 2077-2084.
[23] CHU J G, WANG X J, BI H J, et al. Dihydromyricetin relieves rheumatoid arthritis symptoms and suppresses expression of pro-inflammatory cytokines via the activation of Nrf2 pathway in rheumatoid arthritis model[J]. International Immunopharmacology, 2018, 59:174-180.
[24] FAN X L, ZENG Y, FAN Z Q, et al. Dihydromyricetin promotes longevity and activates the transcription factors FOXO and AOP in Drosophila[J]. Aging, 2021, 13(1):460-476.
[25] 朱秋轶,宋玉,星雨, 等.羊乳酪蛋白酶解物对秀丽线虫衰老的改善作用[J]. 现代食品科技, 2023, 39(6): 1-9.ZHU Q Y, SONG Y, XING Y, et al. Ameliorating Effect of Goat Milk Casein Hydrolysates on Senescence of Caenorhabditis elegans[J].Modern Food Science &Technology, 2023, 39(6): 1-9.
[26] XIA J, GUO S W, FANG T, et al. Dihydromyricetin induces autophagy in HepG2 cells involved in inhibition of mTOR and regulating its upstream pathways[J]. Food and Chemical Toxicology, 2014, 66:7-13.
[27] YOU L. Dihydromyricetin inhibits ferroptosis to attenuate cisplatin-induced muscle atrophy[J]. Physiological Research, 2024(3/2024):405-413.
[28] HOU L J, JIANG F Y, HUANG B, et al. Dihydromyricetin resists inflammation-induced muscle atrophy via ryanodine receptor-CaMKK-AMPK signal pathway[J]. Journal of Cellular and Molecular Medicine, 2021, 25(21):9953-9971.
[29] WU Y, WANG D-W, LI J, et al. Protective effect of dihydromyricetin against exercise-induced muscle damage and its mechanism[J]. Chinese Medical Sciences Journal, 2024, 39(1):46-53.