目前,大型真菌(亦称蘑菇)作为一种理想的健康营养物质和生物活性成分的可持续来源,在世界各地的功能性食品、膳食补充剂、营养保健品和制药中得到越来越多的应用。一般来说,真菌多糖(fungi polysaccharides,FPs)是真菌细胞深层发酵分泌的一种天然促进健康的大分子,是真菌众多活性成分中最值得关注和研究的[1]。因此,这类食用真菌越来越受到消费者的重视。柴达木双层环伞菌[Agaricus bitorquis (Quél.) Sacc],俗称大肥菇,作为青藏高原真菌资源宝库中的代表种被公认为最有应用价值的名贵野生食用菌类之一,其具有地下结实、子实体巨大、抗逆性强、营养丰富等特点,为地生蘑菇中高原特殊菌种,富含多糖、三萜、酚酸等物质[2]。研究发现双层环伞菌胞外多糖(exopoly saccharides,EPS)具有显著的抗缺氧[3-4]、抗氧化活性[1,5]和提高免疫力活性[6],可作为一种有效缓解氧化、缺氧应激、提高免疫力的功能性食品,具有很强的开发潜力[7]。为避免野生双层环伞菌的过度采摘并切实保护生态环境,课题组对其开展人工驯化菌与液体深层培养研究,取得的成果已申报国家发明专利[8]。但在实现该真菌规模化液体培养生产多糖的研究过程中发现,由于柴达木双层环伞菌斜面菌种分离自地下生长的野生菇体,其菌丝细胞易发生褐变衰老,极大地影响了多糖的产量[9]。因此,寻找与研究调控双层环伞菌生长和多糖合成的发酵策略对实现真菌产业化意义重大。
前期研究发现添加外源抗氧化物质(黑果枸杞花色苷粗提物)可通过提高柴达木双层环伞菌细胞的抗氧化应激作用,延长细胞的生长稳定期从而促进菌体胞内多糖(intracellular polysaccharides,IPS)合成[9]。目前,关于黑果枸杞花色苷应用于食用菌液体发酵调控的研究仅限于本课题组,而课题组也只是在摇瓶发酵实验中对花色苷的添加方式、最适发酵温度、最适起始pH、最适溶氧含量等工艺条件进行了优化。由于实现规模化生产需要50 L发酵罐及以上的放大培养,故其调控因子的添加方式、发酵温度的精准控制等都需要进一步探究,以期获得最优的发酵调控体系,并在此基础上构建发酵动力学模型,从而了解微生物的生理特征,菌体生长和产物形成的合适条件,以及各种发酵参数之间的关系,为发酵过程的工艺控制、发酵罐的设计放大和用计算机对发酵过程的控制创造条件。因此,通过中试化发酵调控实验构建集成工艺体系的发酵动力学,是实现食用菌液体发酵技术自动化的关键策略。
本研究基于摇瓶发酵实验的基础,于放大反应体系中开展柴达木双层环伞菌多糖合成的研究,探究黑果枸杞花色苷最优添加方式及最优发酵条件并完成发酵动力学模型的构建。本研究不仅可促进边远地区特色传统食用菌资源的基础研究与产业化应用,还为其他特殊大型真菌资源的挖掘与利用提供了研究范例。
1 材料与方法
1.1 材料与试剂
柴达木双层环伞菌菌种[Agaricus bitorquis (Quél.) Sacc.Chaidam]为青海大学农牧学院食品工程实验室保藏菌种;黑果枸杞花色苷粗提物(粗提物纯度为95%左右,经质谱鉴定主要成分为矮牵牛花色苷90%左右,原花青素8%左右)由青海大学农牧学院食品工程实验室提供。葡萄糖、苯酚、浓硫酸、95%(体积分数)乙醇、三氯化铁、铁氰化钾、磷酸二氢钠、氢氧化钠、磷酸氢二钠、氯化钠、三氯乙酸、硫酸亚铁、氯化亚铁、过氧化氢、水杨酸、盐酸、邻苯三酚等均为分析纯,合肥波美生物科技有限公司。
1.2 仪器与设备
KQ-300E超声波清洗器,东莞市科桥超声波设备有限公司;BS-1E振荡培养箱,常州国华电器有限公司;BIOTECH-50 JS-7000E 50 L发酵罐,上海保兴生化设备有限公司;722 N可见分光光度计,上海佑科仪器仪表有限公司;Epoch T2酶标仪,美国伯腾仪器有限公司。
1.3 实验方法
1.3.1 培养基配方
a)斜面培养基(g/L):采用改良PDA法;马铃薯(去皮)200.00 g浸汁,葡萄糖20.00,琼脂20.00。
b)一级种子液培养基(g/L):马铃薯200.00 g浸汁,麦芽糖35.00,蛋白胨5.00,MgSO4 0.10,CaCl2 0.14,维生素B 1.00。
c)发酵培养基(g/L):麦芽糖浆20.00,果糖糖浆20.00,蛋白胨5.00,MgSO4 0.60,CaCl2 0.14,维生素B 1.00[10]。
d)50 L发酵罐培养基(按装液量30 L):复合糖浆1 500.00 g[麦芽糖浆∶果糖糖浆=1∶1(质量比)],蛋白胨150.00 g,MgSO4 18.00 g,CaCl2 4.20 g,维生素B 30.00 g[10]。
1.3.2 斜面菌种的活化
从母种保藏斜面中切取出绿豆大小的菌丝块2~3块,接种于固体斜面培养基的中部;于25 ℃恒温培养箱中培养9 d。
1.3.3 液体一级种子培养
将培养好的斜面菌种切取出绿豆大小的菌丝块2~3块,接种于液体培养基中,250 mL三角瓶装液量为30%(80 mL),于25 ℃、80 r/min恒温摇床中培养9~11 d。
1.3.4 液体二级种子培养
将一级种子液按10%(体积分数)的接种量接入1 000 mL三角瓶中的装液量为30%(300 mL),25 ℃、80 r/min培养4 d[10]。
1.3.5 发酵罐(50 L)液体培养
发酵罐内按照发酵罐液体发酵培养基配方比例加入内容物后,进行实消,115 ℃湿热灭菌15 min。冷却后将二级种子液按10%(体积分数)的接种量接入发酵罐(30 L装液量)。在温度25.0 ℃,转速100 r/min,通气流量维持0.04~0.06 MPa,获得液体菌种。培养过程中,间隔24 h进行取样检测,记录数据,5 d后结束发酵[10]。
1.3.6 柴达木双层环伞菌胞内外多糖提取
将发酵液混合体系进行过滤,滤渣为菌丝体,滤液为发酵液。利用超声辅助提取多糖方法,VPS∶菌丝体(滤渣)与水按料液比为1∶20(g∶mL),于70 ℃下超声提取20 min过滤浓缩;EPS:滤液与乙醇按体积比为1∶4,于40 ℃下超声提取30 min过滤浓缩。采用醇沉法于4 ℃冰箱静置过滤,备用[9]。
1.3.7 菌丝体生物量的测定
每隔24 h取一定体积的发酵液抽滤,用去离子水冲洗,烘干至恒重后称重,计算生物量[10]。
1.3.8 多糖含量的测定
采用苯酚硫酸法测定EPS和IPS的含量[10]。对不同浓度葡萄糖溶液的吸光度值OD490进行线性回归,得到(polysaccharides,PS)的标定曲线。其中,测定得到葡萄糖标准曲线如下:y=0.031 918x+0.056 9(R2=0.998 2);准确吸取样品1.0 mL,测定样品吸光值,代入纵坐标以葡萄糖标曲计算多糖含量(mg/mL)。
1.3.9 还原糖含量的测定
采用3,5-二硝基水杨酸法[11]。其中测得到葡萄糖标准曲线如下:y=0.086 8x+0.010 1(R2=0.995 4),准确吸取样品1.0 mL,测定样品吸光值,以葡萄糖标曲计算还原糖含量。
1.3.10 可溶性蛋白测定
采用考马斯亮蓝法[12]。可溶性蛋白标曲绘制:所测数据以蛋白含量为横坐标,以吸光度为纵坐标得到回归方程:y=0.003 4x+0.504 2(R2=0.996 8)。
1.4 发酵动力学模型的构建
1.4.1 生长动力学模型
利用Logistics方程描述柴达木双层环伞菌在优化调控条件下的生长规律[13],其微分方程如公式(1)所示:
(1)
式中:dCx/dt为菌体的生长速率,g/(L·h);Cx为菌体质量浓度,g/L;Cx,max为最大菌体质量浓度,g/L;t为发酵时间,h;μm为最大比生长速率,h-1。
当t=0 h,Cx=C0时,对公式(1)进行积分,得到积分式如公式(2)所示:
(2)
公式(2)整理得公式(3):
(3)
式中:a为积分常数且C=ea。
1.4.2 产物合成动力学模型
Gauss方程[14]如公式(4)所示:
(4)
式中:Cp为产物合成速率,g/(L·h);Cp,0为初始产物合成速率,g/(L·h);ω为与菌体生长速率有关联的产物合成常数;A为与菌体浓度有关联的产物合成常数。
1.4.3 底物消耗动力学模型
Luedeking-Piret方程[15]如公式(5)所示:
(5)
式中:-dCs/dt为底物的消耗速率,g/(L·h);YX/S为菌体对底物的得率,g/g;YP/S为菌体对底物的得率,g/g;Cs为底物浓度,g/L;Ke为细胞维持系数,h-1。
对公式(5)积分,并使![]() b3,可得公式(6):
b3,可得公式(6):
(6)
代入公式(1)、公式(4)并对公式(6)积分,可得公式(7):
(7)
1.5 数据处理
实验中所测定的数据采用Excel整理,数据以“平均值±标准差”(n=3)表示,经SPSS 25软件进行方差分析,采用Duncan新复极差法进行处理间显著性检验,显著水平设定为P<0.05,利用Origin 2018软件进行作图。
2 结果与分析
2.1 黑果枸杞花色苷调控菌体生长及多糖合成
2.1.1 黑果枸杞花色苷添加方式对生物量的影响
前期研究发现分批添加方式中,二次添加较一次、三次添加更利于柴达木双层环伞菌菌体生长和多糖合成,因此在50 L中试化发酵实验以二次添加方式为基础,开展进一步的调控实验。在本实验中分别采取分批二次添加(发酵0 h、12 h二次添加,花色苷质量浓度1 mg/mL,总加量1 800 mL)、半流加(发酵0~36 h分别以0.83 mL/min速率流加,总加量1 800 mL)及全流加(发酵0~72 h分别以0.42 mL/min速率流加,总加量1 800 mL)等方式,探究不同添加方式对柴达木双层环伞菌菌丝体生物量的影响。由图1可知,随着发酵过程的进行,二次添加、半流加、全流加及空白对照组中的生物量都呈现较明显的上升趋势,均在96 h达最大值。与空白组、二次添加实验组及全流加实验组比较,半流加实验组生物量最高,其次为二次添加组、全流加组及空白组;半流加组生物量最高达到20.43 mg/mL,较空白组(14.31 mg/mL)增加了42.77%,差异显著(P<0.05)。半流加组与二次添加组(18.87 mg/mL)和全流加组(15.93 mg/mL)相比,生物量分别增加了8.27%和28.28%,差异显著(P<0.05)。故半流加花色苷对柴达木双层环伞菌菌丝体生物量影响最为显著,这可能与不同的流加方式对花色苷在液体发酵体系中的维持浓度水平有关。由于黑果枸杞中花色苷稳定性较差、在水溶液中易分解变性[16],尤其是在浓度较高时更易发生,而分批二次添加及全流加方式会使花色苷浓度水平在短期内会达到溶解度的高限水平[17-18],进一步降低其在发酵液中的溶解稳定性,从而影响其对菌丝体生长活力的抗氧化保护作用的发挥[19]。
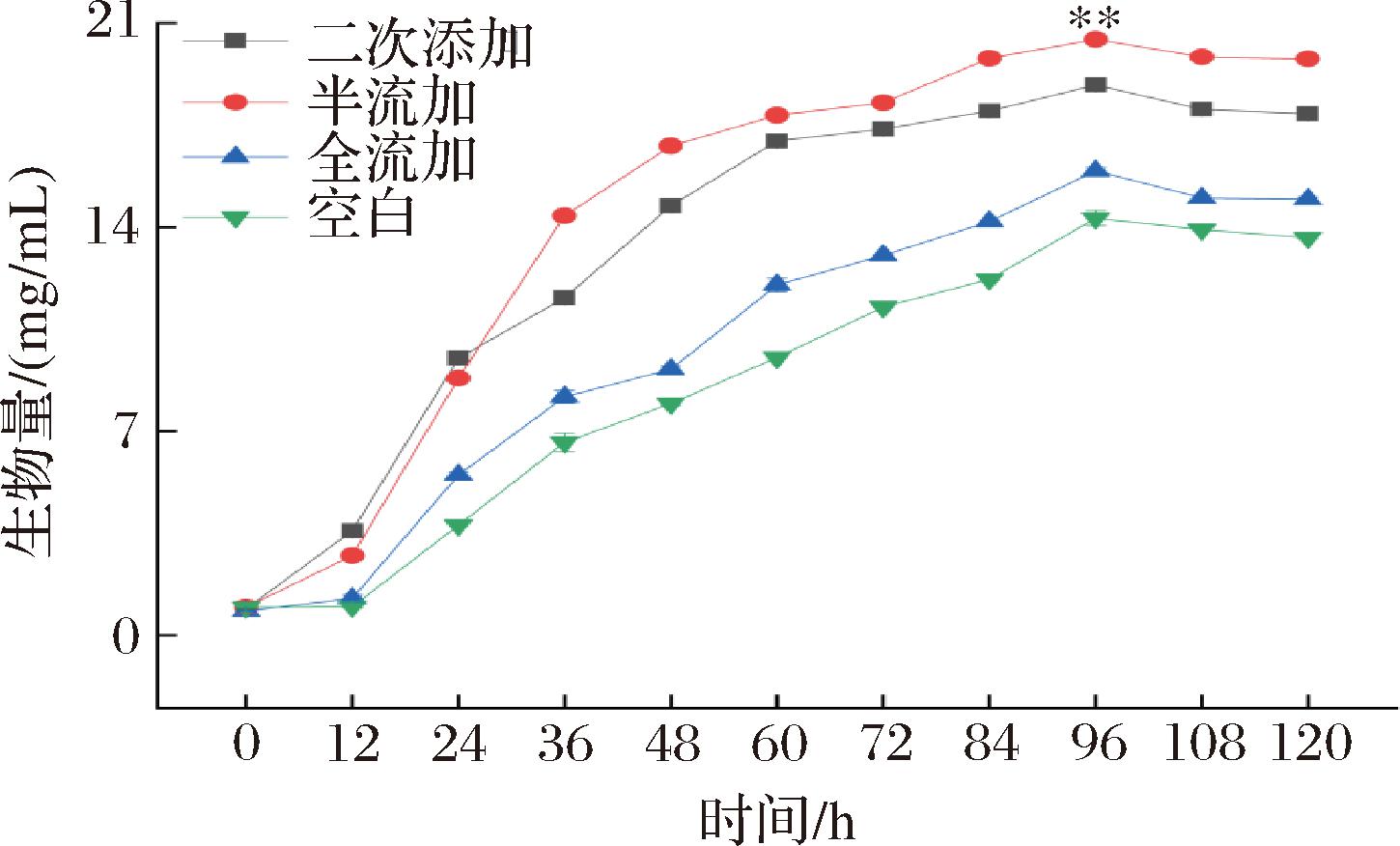
图1 花色苷不同添加方式对生物量的影响
Fig.1 Effect of anthocyanin on biomass under different modes of addition
注:**表示差异极显著(P<0.01)(下同)。
2.1.2 黑果枸杞花色苷添加方式对IPS、EPS产量的影响
由图2可知,随着发酵过程的进行,二次添加、半流加、全流加及空白对照组中的IPS含量都呈现先上升后下降的趋势,均在96 h达最大值。与空白实验组、二次添加实验组及全流加实验组比较,半流加实验组IPS含量最高,其次为二次添加组、全流加组、空白组;半流加组IPS含量最高达到1.57 mg/mL较空白组(1.10 mg/mL)增加了42.73%,差异显著(P<0.05)。半流加组与二次添加组(1.41 mg/mL)和全流加组(1.16 mg/mL)相比,IPS含量分别提高了11.35%、35.34%,差异显著(P<0.05)。故半流加花色苷对柴达木双层环伞菌IPS含量影响最为显著。由图2可知,随着发酵过程的进行,二次添加、半流加、全流加及空白对照组中的EPS含量都呈现出先升高后降低的趋势,均在96 h达最大值。与空白实验组、二次添加实验组及全流加实验组比较,半流加实验组的EPS含量最高,其次为二次添加组、全流加组、空白组;半流加组EPS最大值为24.26 mg/mL,与空白组(13.70 mg/mL)相比提高了77.08%,差异显著(P<0.05)。半流加组与二次添加组(19.96 mg/mL)和全流加组(14.12 mg/mL)相比,EPS分别提高了21.54%、71.81%,差异显著(P<0.05)。故半流加花色苷处理方式对EPS的合成也具有明显的促进作用。其原因不仅与半流加的方式可以较好地减弱由花色苷短期内浓度过高而引起的自我反馈抑制作用的发生有关[20],而且与EPS在花色苷调控下增量合成的多个代谢通路相关联[9-10]。

a-IPS;b-EPS
图2 不同添加方式下花色苷对多糖含量的影响
Fig.2 Effect of anthocyanin on polysaccharide under different modes of addition
注:*表示差异显著(P<0.05)(下同)。
2.1.3 黑果枸杞花色苷添加方式对发酵条件的影响
由图3-a可知,随着发酵时间的延长,二次添加、半流加、全流加及空白对照组中的还原糖含量都呈现较明显的下降趋势,在半流加实验组中,与空白实验组、二次添加实验组及全流加实验组比较,还原糖总体含量水平最低,并呈现较规律(阶梯状)的下降趋势,半流加组还原糖利用率最高为72.55%,与空白组、二次添加、全流加组相比,还原糖利用率分别提高了24.31%、5.83%、20.45%,差异显著(P<0.05),表明半流加的调控方式有利于菌体对糖类物质的稳定吸收和利用;如图3-b所示,随着发酵时间的延长,二次添加、半流加、全流加及空白对照组中的pH水平都呈现明显的下降趋势,在半流加实验组中,与空白实验组、二次添加实验组及全流加实验组相比,pH下降速率在发酵84 h后趋于稳定,表明半流加的调控方式能有效减缓细胞的衰老和自溶;如图3-c所示,随着发酵时间的延长,二次添加、半流加、全流加及空白对照组中的溶解氧水平都呈现明显的下降趋势,在半流加实验组中,与空白实验组、二次添加实验组及全流加实验组相比,溶解氧含量处于相对较低的水平,半流加溶解氧利用率最高为53.29%,与空白组、二次添加、全流加组,溶解氧利用率分别提高了24.83%、16.67%、17.28%,差异显著(P<0.05),表明半流加的调控方式可提高系统中溶氧量的利用率,有利于菌体更好地生长。
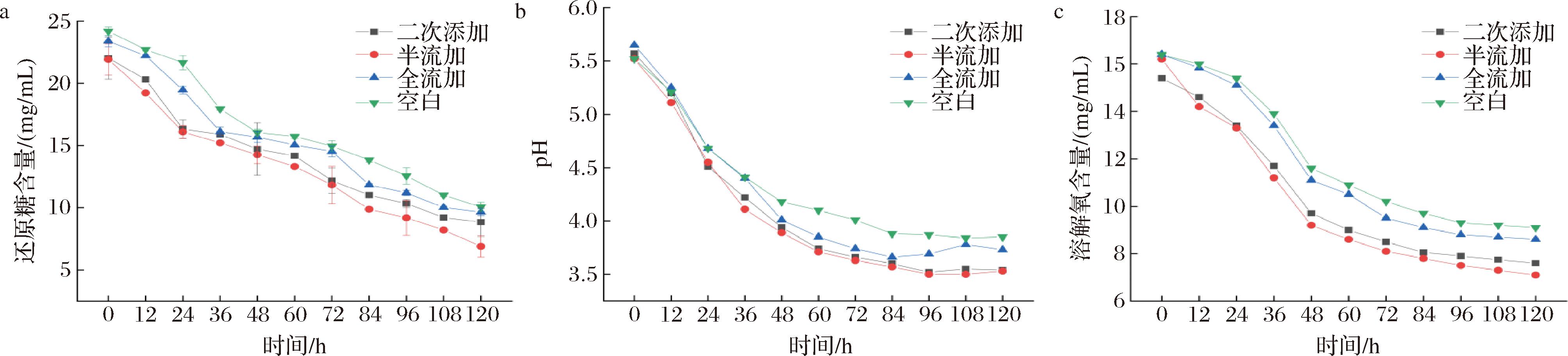
a-还原糖含量;b-pH;c-溶解氧含量
图3 不同添加方式下花色苷对发酵条件的影响
Fig.3 Effect of anthocyanin on fermentation conditions under different addition modes
综合考虑生物量、胞内外多糖含量及其他发酵条件等指标,确定半流加黑果枸杞花色苷的添加方式为最佳调控方式,即在发酵0~36 h,分别以0.83 mL/min速率流加(总加量1 800 mL)的水平添加黑果枸杞花色苷粗提物。
2.2 发酵温度对花色苷调控菌体生长和多糖合成的影响
2.2.1 不同发酵温度对菌体生物量的影响
以半流加方式添加黑果枸杞花色苷,分别采用恒温培养(23、25、27 ℃)和变温培养(0~36 h为23 ℃,36~96 h为25 ℃,96~120 h为23 ℃),其他条件不变,进一步开展发酵调控实验。由图4可知,柴达木双层环伞菌生物量前96 h先上升然后呈下降趋势;实验组四生物量最大为19.50 mg/mL,实验组二、一、三次之,分别为18.87、12.29、10.86 mg/mL。实验组一、二、三、四峰值处的生物量分别较第1天提高了96.01%、96.34%、95.21%、97.38%,差异显著(P<0.05)。在前36 h实验组二生物量最高;36~48 h,实验组四生物量迅速上升,高于其他3个组,故实验组四对菌丝体生物量促进作用最为显著。
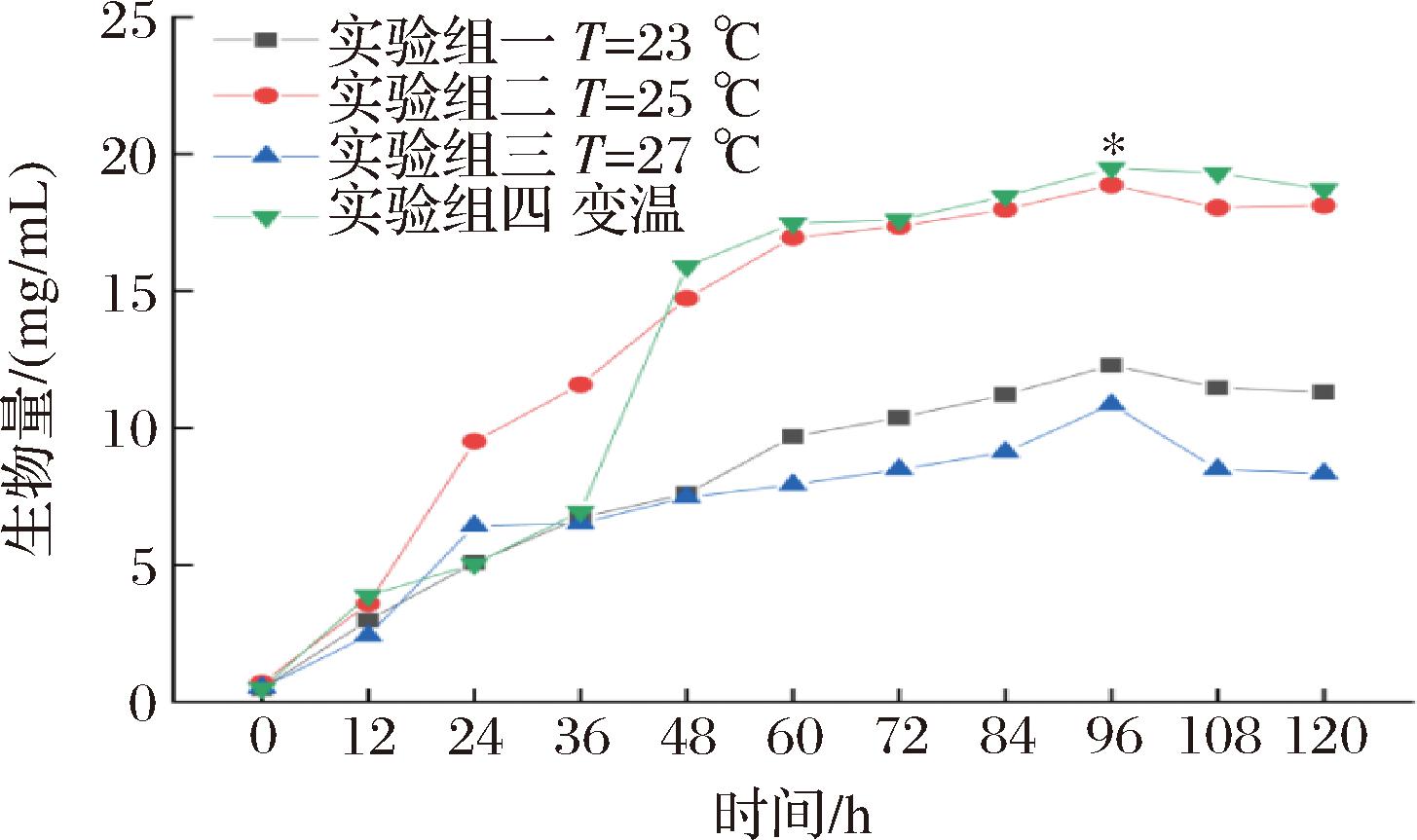
图4 不同发酵温度对发酵过程中生物量的影响
Fig.4 Effect of different fermentation temperatures on biomass during the fermentation process.
2.2.2 不同发酵温度对IPS、EPS产量的影响
由图5-a可知,柴达木双层环伞菌IPS含量随着发酵时间的延长先上升后下降,实验组四IPS含量最大为1.34 mg/mL,实验组二、一、三次之,分别为1.32、1.22、1.05 mg/mL。实验组一、二、三、四峰值处的IPS含量分别较第1天提高了55.24%、54.92%、51.46%、57.46%,差异显著(P<0.05)。在前36 h实验组二IPS含量最高;36~48 h,实验组四IPS含量迅速上升,高于其他3个组,故实验组四对菌丝体IPS合成促进作用最为显著,这可能是因为培养温度影响细胞膜上协助物质运输的载体蛋白,使生成的多糖较稳定地留存在细胞内[21]。由图5-b可知,柴达木双层环伞菌EPS含量随着发酵时间的增加先上升又下降,实验组四EPS含量最大为40.09 mg/mL,实验组二、一、三次之,分别为37.57、30.67、28.94 mg/mL。实验组一、二、三、四峰值处的EPS含量分别较第1天提高了1.38%、51.48%、37.46%、55.03%,差异显著(P<0.05)。36~60 h,实验组四EPS含量迅速上升,且延长了峰值时间,可能是因为变温培养能够提高多糖合成代谢相关酶的活性,从而影响EPS的生成,且在此条件下菌体大量生长,不断累积多糖,使其含量显著高于其他实验组。
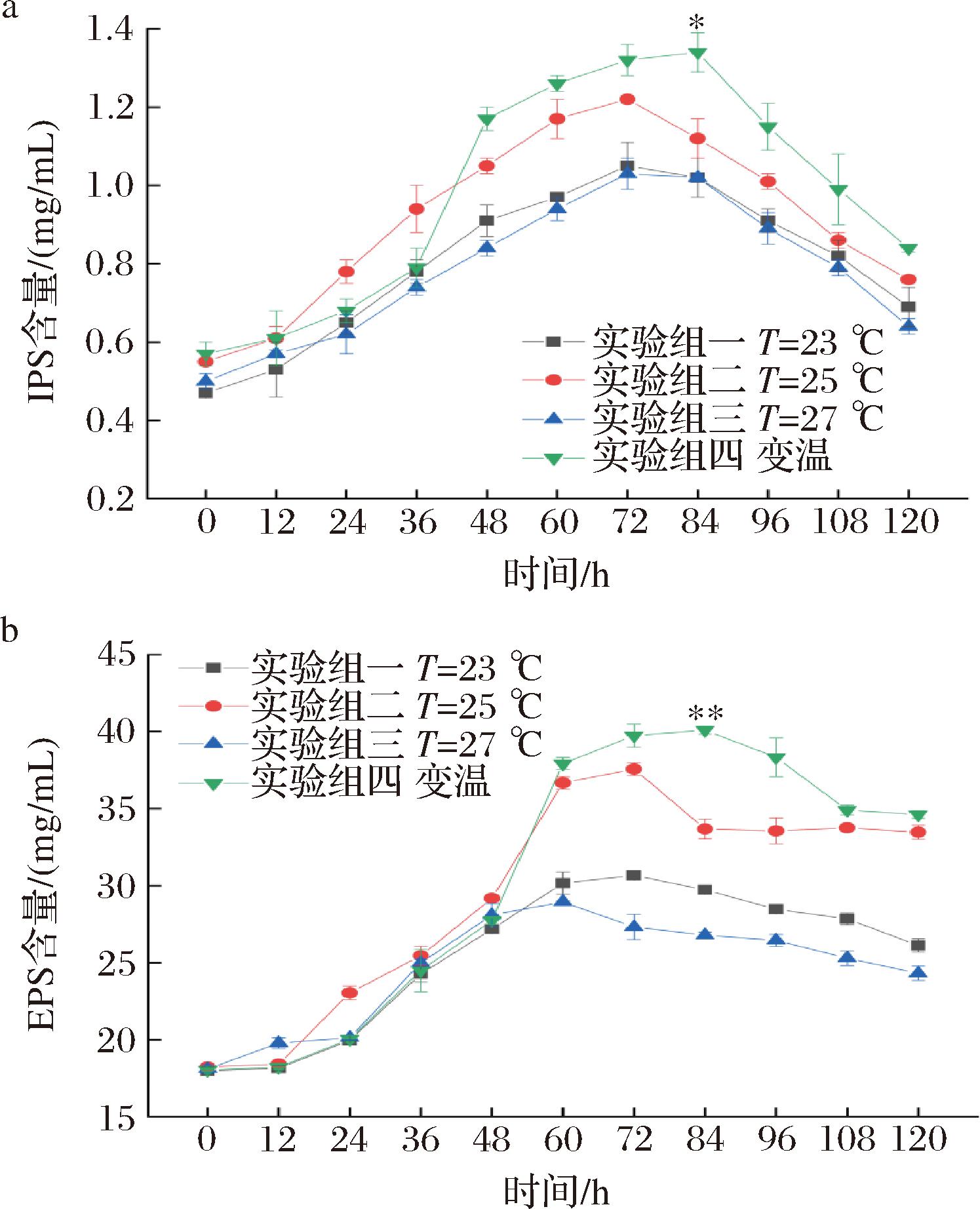
a-IPS;b-EPS
图5 不同发酵温度对多糖含量的影响
Fig.5 Effect of different fermentation temperature on polysaccharide content
2.2.3 不同发酵温度对菌丝发酵条件的影响
由图6-a可知,柴达木双层环伞菌还原糖含量随着发酵时间的延长而下降,实验组四还原糖利用率最高为77.02%,较实验组一、二、三还原糖利用率分别提高了18.66%、12.93%、22.89%,差异显著(P<0.05)。如图6-b所示,柴达木双层环伞菌起始pH随着发酵时间的延长而下降后趋于稳定,起始pH下降速率也没有明显的差别。如图6-c所示,柴达木双层环伞菌溶解氧含量随着发酵时间的延长而下降,实验组四溶解氧利用率最高为50.46%,消耗氧气最多。与实验组一、二、三、四相比,溶解氧利用率分别提高了20.24%、3.96%、32.71%,差异显著(P<0.05)。综上,根据柴达木双层环伞菌发酵过程中生物量,胞内外多糖含量等指标确定调控中试化发酵实验温度为变温培养。

a-还原糖含量;b-pH;c-溶解氧含量
图6 不同发酵温度对发酵条件的影响
Fig.6 Effects of different fermentation temperatures on fermentation conditions
2.3 黑果枸杞花色苷中试化调控实验优化结果比较
由图7-a、图7-b、表1可知,随着发酵过程的进行,调控前、后柴达木双层环伞菌菌体生物量均呈先上升后下降的趋势,调控前生物量于72 h达到最大值(10.31 mg/mL),调控后生物量于96 h达到最大值(19.49 mg/mL),调控后柴达木双层环伞菌生物量相较于调控前提高了89.04%;调控前、后柴达木双层环伞菌EPS产量均呈先上升后下降的趋势,调控前EPS产量在60 h达到最大值(24.23 mg/mL),调控后EPS产量在84 h达到最大值(40.09 mg/mL),调控后柴达木双层环伞菌EPS产量相较于调控前提高了65.46%;调控前、后柴达木双层环伞菌IPS产量均呈先上升后下降的趋势,调控前IPS在72 h达到最大值(1.02 mg/mL),调控后IPS产量在84 h达到最大值(1.34 mg/mL),调控后柴达木双层环伞菌IPS含量相较于调控前提高了31.37%;调控前、后柴达木双层环伞菌发酵体系中还原糖含量均为下降的趋势,与调控前还原糖利用率相比,还原糖利用率提高了19.1%。由此可见,通过调控技术,可明显延长菌体的稳定期、增加菌体生物量,同时也可延长胞内外多糖的生产期、提高胞内外多糖产量。
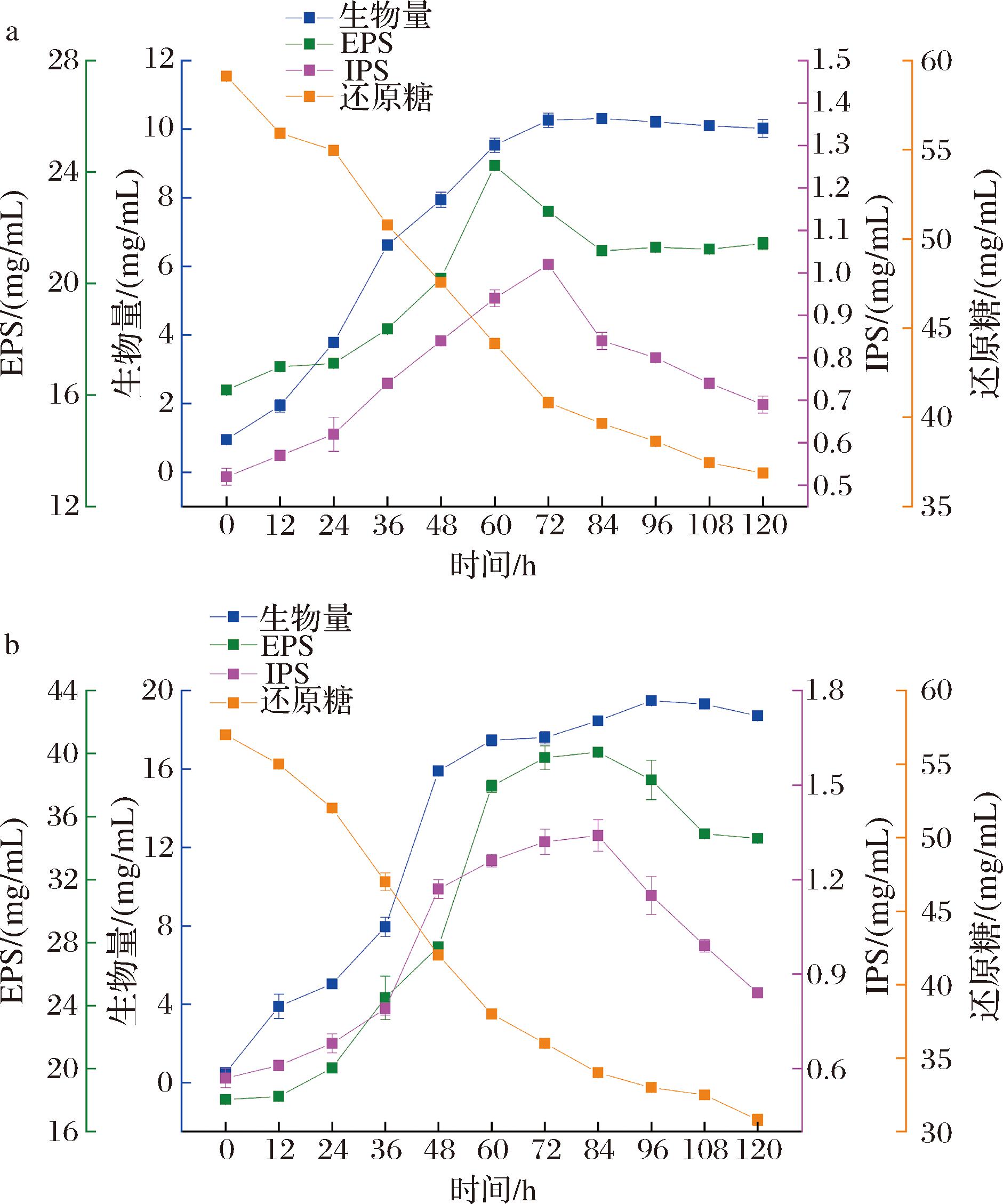
a-调控前;b-调控后
图7 调控前后发酵代谢变化曲线
Fig.7 Curve of fermentation metabolism before and after regulation
表1 调控前后50 L发酵罐中试试验的发酵指标比较
Table 1 Comparison of fermentation indexes in the pilot test of 50 L fermenter before and after regulation
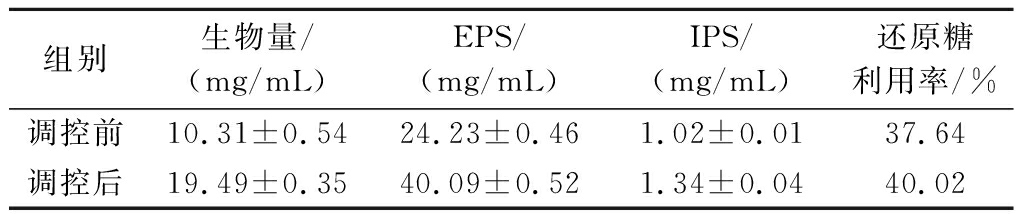
组别生物量/(mg/mL)EPS/(mg/mL)IPS/(mg/mL)还原糖利用率/%调控前10.31±0.5424.23±0.461.02±0.0137.64调控后19.49±0.3540.09±0.521.34±0.0440.02
注:生物量、EPS及IPS含量均为最大值数据。
通过对菌丝体液体发酵过程中黑果枸杞花色苷添加方式及发酵温度的调控优化,不仅缩短了菌丝细胞到达生长稳定期的时间,而且明显提高了菌丝体生物量与胞内外多糖的含量,表明柴达木双层环伞作为高原野生珍稀食用菌对缓慢添加外源物及变温的发酵调控策略较高的适应性,从而也体现了其在极端条件下对生长条件产生的进化敏感性。
2.4 黑果枸杞花色苷调控柴达木双层环伞菌多糖合成动力学模型
2.4.1 柴达木双层环伞菌细胞生长动力学
菌体生长动力学模型中,最常用的是Monod方程和Logistics方程,而在食药用真菌发酵动力学模型中,Logistics方程较Monod方程能够更好地呈现底物浓度对菌体自身生长的影响,更具有适用性[17]。将图7中柴达木双层环伞菌生物量的实验数据代入公式(3)中,采用Origin18.0软件进行非线性拟合,拟合曲线、拟合方程和模型参数分别见图8-a、图8-b及表2、表3。
表2 生长动力学拟合方程相关系数
Table 2 Growth kinetic equation correlation coefficients
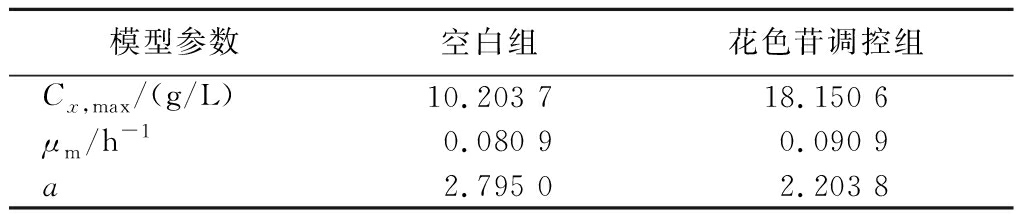
模型参数空白组花色苷调控组Cx,max/(g/L)10.203 718.150 6μm/h-10.080 90.090 9a2.795 02.203 8
表3 生长动力学模型拟合方程及拟合优度
Table 3 Growth kinetic model fitting equation and goodness-of-fit

组别Logistics拟合方程拟合度空白组 Cx=10.203 71+e2.795 0-0.090 9×tR2=0.990 9花色苷调控组Cx=18.150 61+e2.203 8-0.080 9×tR2=0.982 8
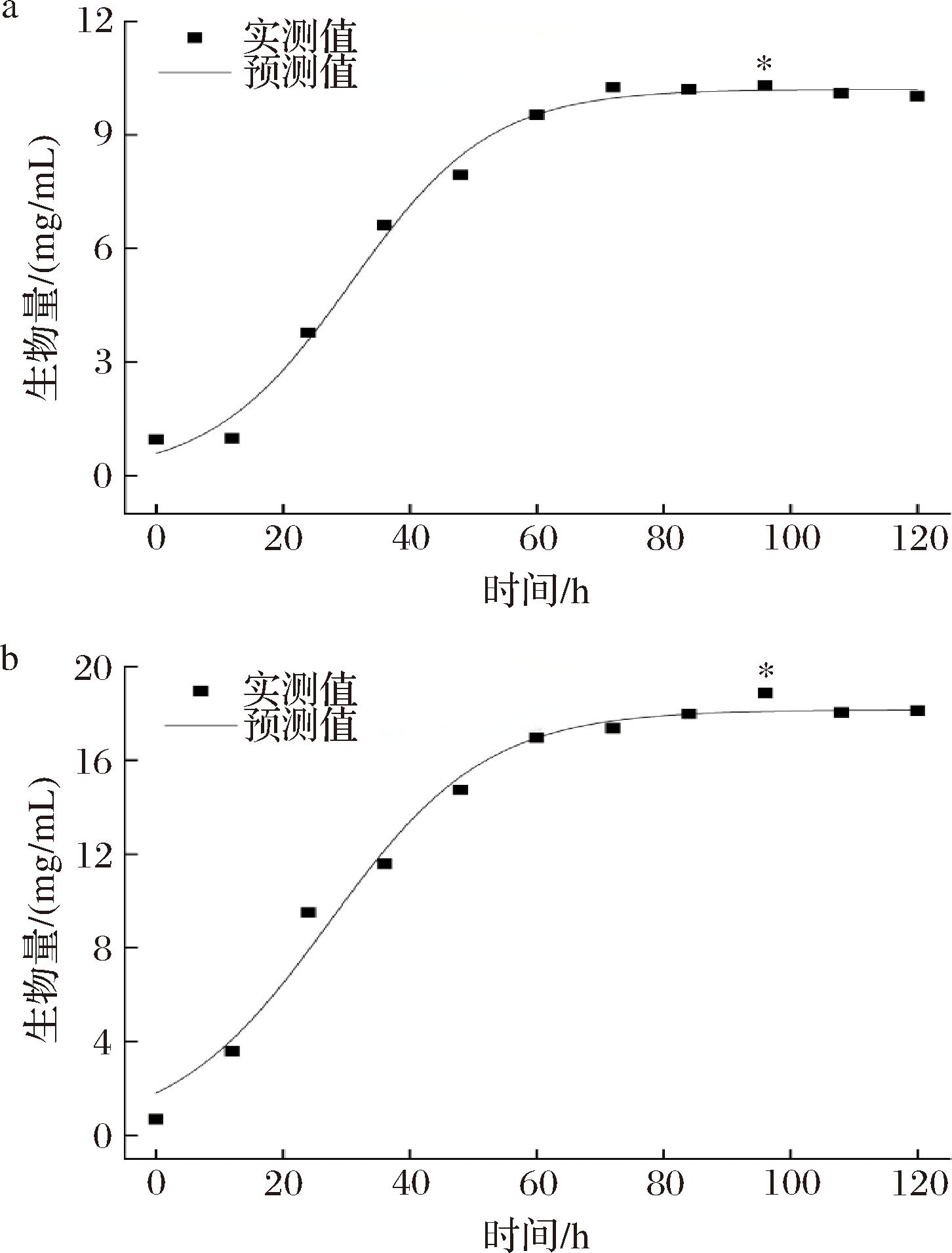
a-空白组;b-花色苷调控组
图8 菌体生长动力学模型拟合曲线
Fig.8 Fitting of kinetic model on mycelium growth
如图8-a、图8-b所示,空白组和调控组菌丝体生物量的实验测定值与模型预测值拟合度较高,其中空白组拟合度为0.990 9,调控组拟合度为0.982 8,表明该模型在空白组与调控组中均能够很好地反映柴达木双层环伞菌的实际生长情况。如表2所示,在Logistics拟合方程中,花色苷调控组的最大菌体质量浓度可达18.150 6 g/L,是空白组的11.78倍,且菌丝体的最大比生长速率也高于空白组。当发酵12 h时,空白组的实测值与模型预测值偏差较大,推测与菌丝体适应期生长延滞较长有关;调控组于发酵96 h时实测值与模型预测值偏差较大,可能是因为菌丝体在花色苷的作用下进行了二次生长有关。此外,与空白组拟合曲线相比,调控处理组菌丝体的生长速率明显较高,说明黑果枸杞花色苷调控处理可显著提高柴达木双层环伞菌的生长速度。
2.4.2 柴达木双层环伞菌产物(EPS)合成动力学
在发酵过程中,产物合成与菌体生长的关系主要分为偶联型、非偶联型以及部分偶联型,而真菌生长存在菌丝体生长和菌体不繁殖并继续发酵的时期,故真菌发酵产物合成属于部分生长偶联型[22]。将图7中柴达木双层环伞菌EPS的实验数据代入公式(4)中,采用Origin 18.0软件进行非线性拟合,拟合曲线、拟合方程和模型参数分别见图9-a、图9-b及表4、表5。如图9-a、图9-b所示,空白组和调控组EPS产量的实验测定值与模型预测值拟合系数均大于0.92,表明该模型在空白组与调控组中均能在高于92%的程度上反映菌体EPS的实际产生情况。如表4、表5所示,在Gauss拟合方程中,花色苷调控组的EPS含量高于空白组。于发酵0~24 h时,空白组的实测值与模型预测值偏差较大,推测与菌丝体适应期的生长延滞性较长导致EPS的浓度较低有关,在发酵后期,空白组的实测值与模型预测值偏差也较大;调控组在发酵后期实测值与模型预测值偏差较大,可能与菌丝体的二次生长使EPS合成速率增加有关。此外,与空白组拟合曲线相比,调控处理组EPS的合成速率明显较高,说明黑果枸杞花色苷调控处理可显著增加柴达木双层环伞菌EPS的合成。
表4 产物合成拟合方程相关系数
Table 4 Correlation coefficients for product generation equations
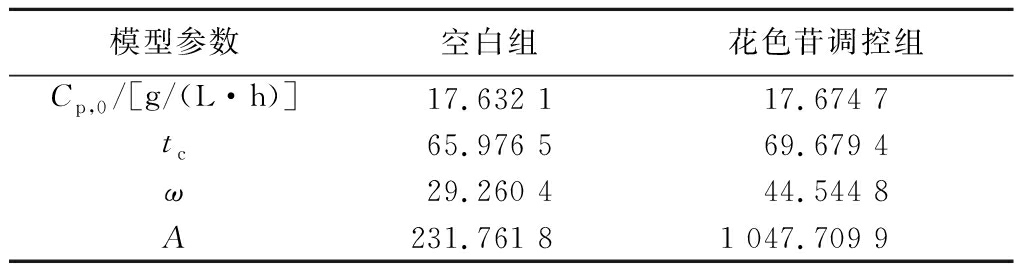
模型参数空白组花色苷调控组Cp,0/[g/(L·h)]17.632 117.674 7tc65.976 569.679 4ω29.260 444.544 8A231.761 81 047.709 9
表5 产物合成拟合方程及拟合优度
Table 5 Fitting equation and goodness-of-fit for product generation

组别Gauss拟合方程拟合度空白组CP=17.632 1+6.319 8×e-2×(t-65.976 5)2856.168 1R2=0.923 2花色苷调控组CP=17.674 7+18.766 5×e-2×(t-69.679 4)21 984.239 2R2=0.938 5
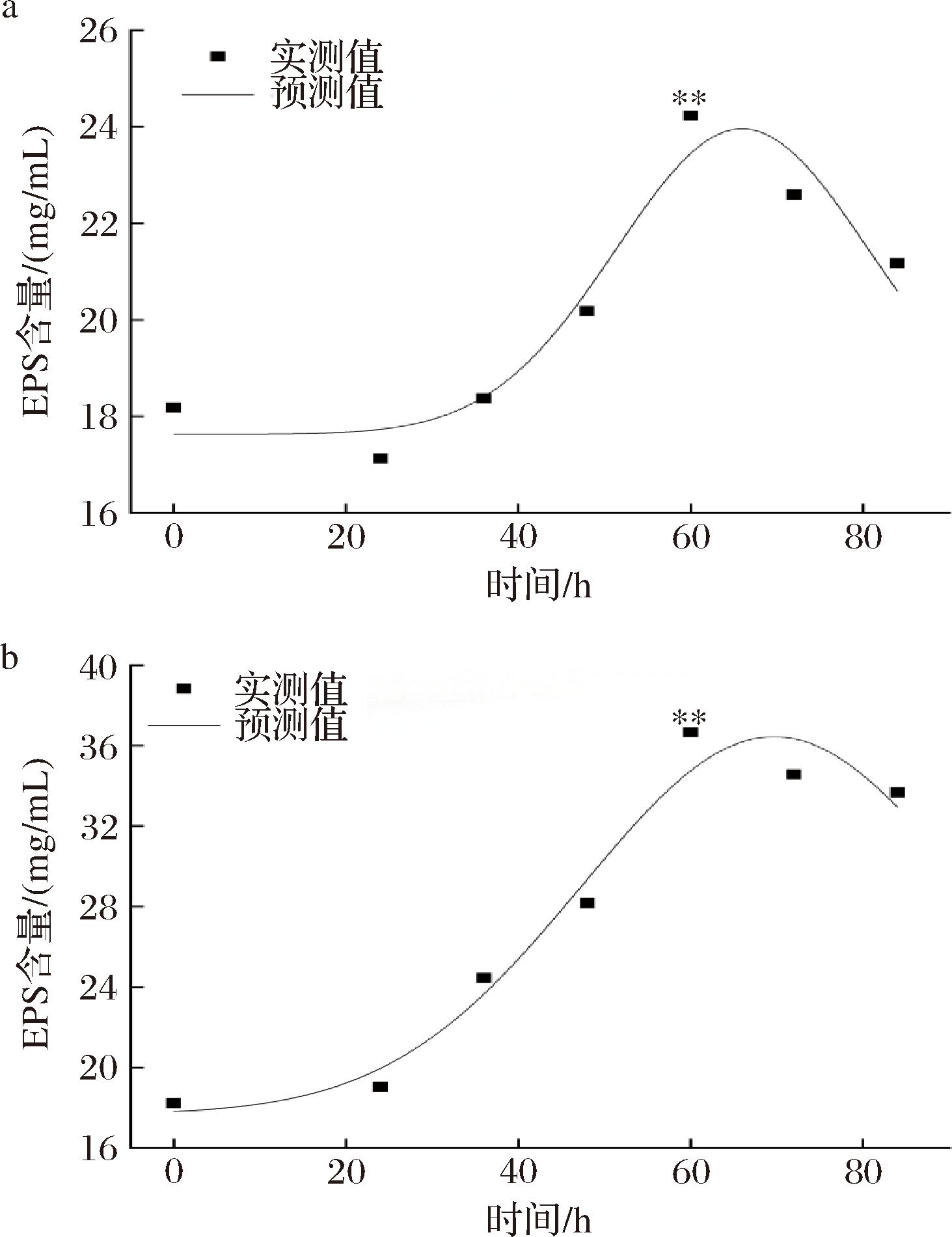
a-空白组;b-花色苷调控组
图9 产物(EPS)合成动力学模型拟合曲线
Fig.9 Fitting of kinetic model on EPS synthesis
2.4.3 柴达木双层环伞菌底物(碳源)消耗动力学
底物包括细胞生长所需各种营养成分,其消耗主要有3个方面:a)细胞生长消耗,用以合成新的细胞;b)细胞维持基本生命活动消耗;c)用于合成代谢产物[23]。将图7中柴达木双层环伞还原糖含量的实验数据代入公式(7)中,采用Origin 18.0软件进行非线性拟合,拟合曲线、拟合方程和模型参数分别见图10-a、图10-b及表6、表7。由表6、表7可知,空白组和调控组EPS产量的实验测定值与模型预测值拟合度均大于0.99,表明该模型在空白组与调控组中均能很好地反应菌体还原糖消耗的实际情况。如图10-a、图10-b所示,在Luedeking-Piret拟合方程中,花色苷调控组的还原糖含量均低于空白组。在发酵后期,相较于空白组,调控组的实测值与模型预测值的还原糖含量较低,说明黑果枸杞花色苷调控可显著提高还原糖的利用率。
表6 底物(碳源)消耗拟合方程相关系数
Table 6 Macromolecular
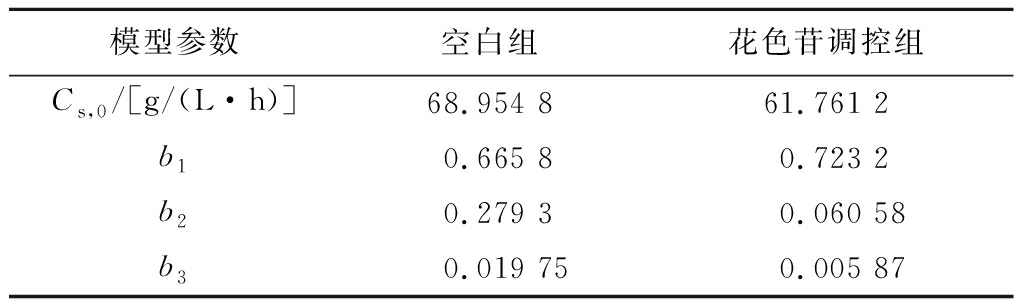
模型参数空白组花色苷调控组Cs,0/[g/(L·h)]68.954 861.761 2b10.665 80.723 2b20.279 30.060 58b30.019 750.005 87
表7 底物(碳源)消耗拟合方程及拟合优度
Table 7 Substrate consumption (carbon source) fitting equation and goodness-of-fit

组别Luedeking-Piret拟合方程拟合度空白组CS=68.954 8-0.665 8×10.203 71+e2.795 0-0.090 9×t-0.279 3×(17.632 1+6.319 8×e-2×(t-65.976 5)2856.168 1)-0.019 75×112.266 5×ln(e0.090 9×t+e2.795 0)R2=0.991 3花色苷调控组CS=61.761 2-0.723 2×18.150 61+e2.203 8-0.080 9×t-0.060 58×(17.674 7+18.766 5×e-2×(t-69.679 4)21 984.239 2)-0.005 87×224.386 0×ln(e0.080 9×t+e2.203 8)R2=0.993 2
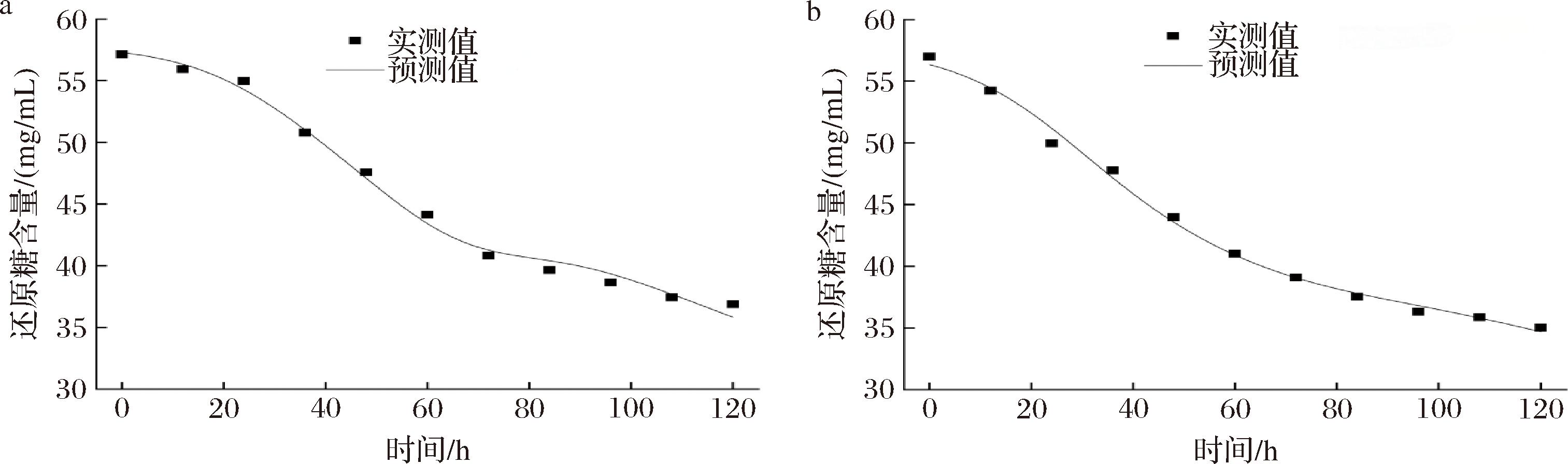
a-空白组;b-花色苷调控组
图10 底物(碳源)消耗动力学模型拟合曲线
Fig.10 Fitting of carbon source substrate consumption
2.4.4 柴达木双层环伞菌底物(氮源)消耗动力学
将图7中柴达木双层环伞菌EPS的实验数据代入公式(7)中,采用Origin 18.0软件进行非线性拟合,拟合曲线、拟合方程和模型参数分别见图11-a、图11-b及表8、表9。如图11-a、图11-b所示,空白组和调控组EPS产量的实验测定值与模型预测值拟合度均大于0.94,表明该模型在空白组与调控组中均能够很好地反映柴达木双层环伞菌的利用氮源的实际情况。如表8、表9所示,在Luedeking-Piret拟合方程中,花色苷调控组的氮源浓度均低于空白组。于发酵48 h后,相较于空白组,调控组的实测值与模型预测值的氮源浓度降低较多,说明黑果枸杞花色苷调控可显著提高氮源的利用率。
表8 底物消耗(氮源)拟合方程相关系数
Table 8 Correlation coefficients for the fitted equation for substrate consumption (nitrogen source)
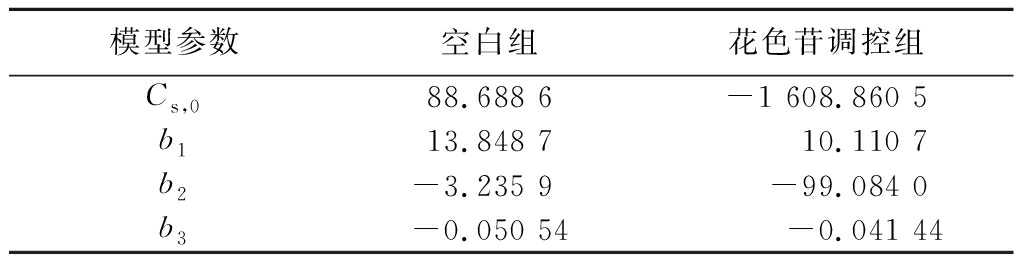
模型参数空白组花色苷调控组Cs,088.688 6-1 608.860 5b113.848 710.110 7b2-3.235 9-99.084 0b3-0.050 54-0.041 44
表9 底物消耗(氮源)拟合方程及拟合优度
Table 9 Substrate consumption (nitrogen source) fitting equation and goodness-of-fit

Luedeking-Piret拟合方程拟合度空白组CS=88.688 6-13.848 7×10.203 71+e2.795 0-0.090 9×t+3.235 9×(17.632 1+6.319 8×e-2×(t-65.976 5)2856.168 1)+0.050 54×112.266 5×ln(e0.090 9×t+e2.795 0)R2=0.983 8花色苷调控组CS=-1 608.860 5-10.110 7×18.15061+e2.203 8-0.080 9×t+99.084 0×(17.674 7+18.766 5×e-2×(t-69.679 4)21 984.239 2)+0.041 44×224.386 0×ln(e0.080 9×t+e2.203 8)R2=0.940 5
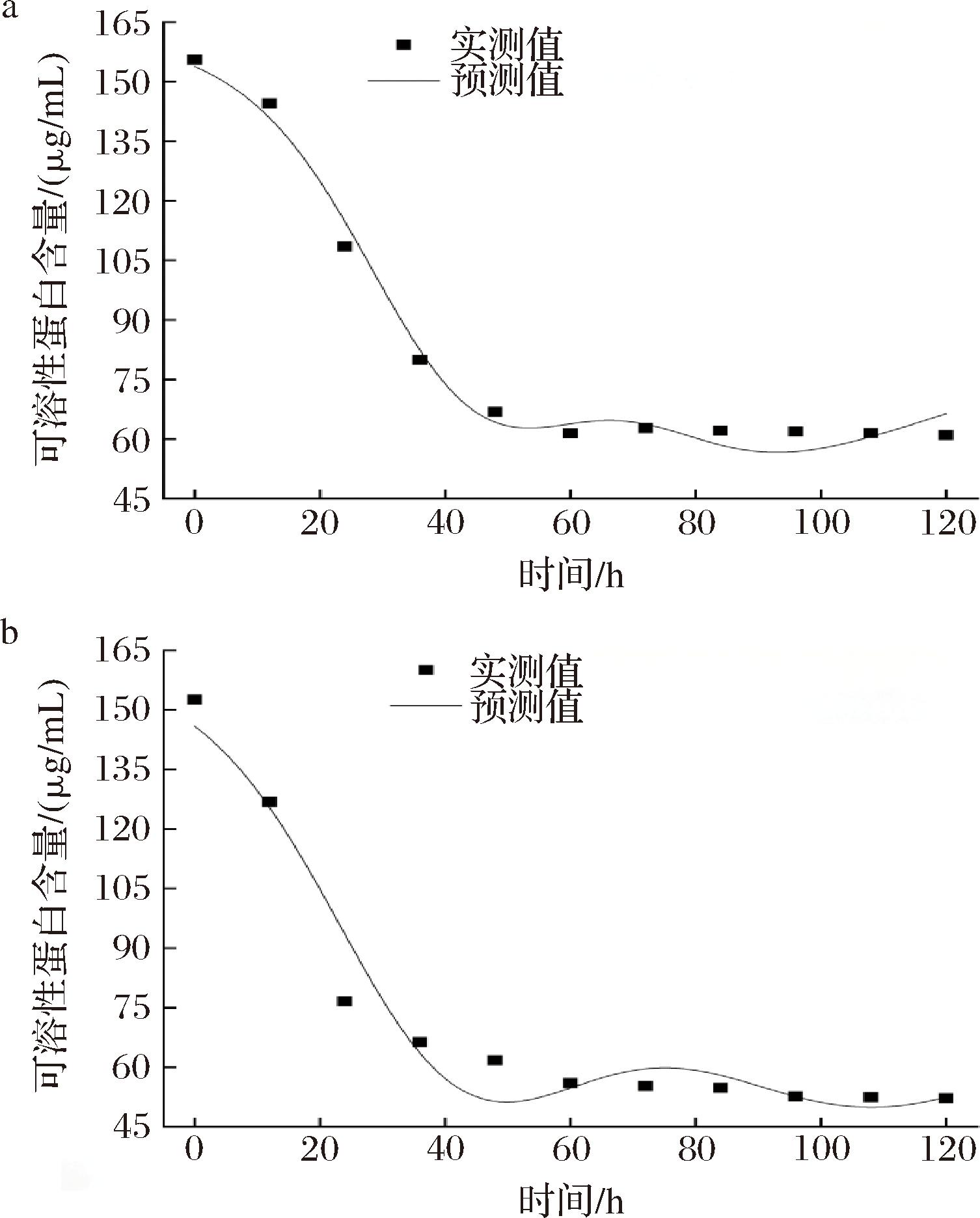
a-空白组;b-花色苷调控组
图11 底物(氮源)消耗动力学模型构建与拟合
Fig.11 Construction and fitting of nitrogen source substrate consumption
3 结论
本实验研究了在放大生物反应体系中开展柴达木双层环伞菌生长与多糖合成的影响,构建获得具有延缓菌体应激衰老及其驱动多糖合成的实际发酵调控策略。结果表明,半流加黑果枸杞花色苷粗提物(发酵0~36 h流加,速率0.83 mL/min,总添加量1 800 mL),变温培养(0~36 h为23 ℃,36~96 h为25 ℃,96~120 h为23 ℃),为获得菌丝生物量提高89.04%、多糖产量增加65.46%的最佳调控体系;利用Logistics、Gauss和Luedeking-Piret动力学方程分别构建了菌体生长、产物合成和底物消耗动力学模型,得到调控组的拟合度分别为0.982 8(菌体生长)、0.938 5(产物合成)、0.993 1(碳源消耗)和0.940 5(氮源消耗),均高于空白对照组,说明实验值与模型预测值拟合良好,表明黑果枸杞花色苷不仅提高了柴达木双层环伞菌的生物量和多糖产量,还缩短了菌体发酵过程中的延滞期,显著提升了菌丝体细胞的生长活力,加快了菌体对碳源和氮源的吸收代谢,可为今后柴达木双层环伞菌工业化生产提供一定的理论参考。
[1] KUANG H, JIAO Y C, WANG W, et al.Characterization and antioxidant activities of intracellular polysaccharides from Agaricus bitorquis (Quél.) Sacc.Chaidam ZJU-CDMA-12[J].International Journal of Biological Macromolecules, 2020, 156:1112-1125.
[2] LU H Y, JIAO Z H, JIAO Y C, et al.Phenolic acids-rich fractions from Agaricus bitorguis (quél.) sacc.chaidam ZJU-CDMA-12 mycelia modulate hypoxic stress on hypoxia-damaged PC12 cells[J].Molecules, 2020, 25(20):4845.
[3] JIAO Y C, KUANG H, HU J J, et al.Structural characterization and anti-hypoxia activities of polysaccharides from the sporocarp, fermentation broth and cultured Mycelium of Agaricus bitorquis (Quél.) Sacc.Chaidam in mice[J].Journal of Functional Foods, 2018, 51:75-85.
[4] JIAO Y C, KUANG H, WU J N, et al.Polysaccharides from the edible mushroom Agaricus bitorquis (quél.) sacc.chaidam show anti-hypoxia activities in pulmonary artery smooth muscle cells[J].International Journal of Molecular Sciences, 2019, 20(3):637.
[5] LI H J, CHEN H Y, FAN L L, et al.In vitro antioxidant activities and in vivo anti-hypoxic activity of the edible mushroom Agaricus bisporus (Lange) sing.chaidam[J].Molecules, 2015, 20(10):17775-17788.
[6] LIN X M, LI W X, YUEN H, et al.Immunomodulatory effect of intracellular polysaccharide from mycelia of Agaricus bitorquis (Quél.) Sacc.Chaidam by TLR4-mediated MyD88 dependent signaling pathway[J].International Journal of Biological Macromolecules, 2021, 183:79-89.
[7] HU S C, GAO K, JIAO Y C, et al.Glycolysis characteristics of intracellular polysaccharides from Agaricus bitorquis (Quél.) sacc.Chaidam and its effects on intestinal flora from different altitudes of mice in vitro fermentation[J].Food Research International, 2023, 173(Pt 2):113382.
[8] 焦迎春, 余梅, 王虹.一种高产柴达木大肥菇多糖的液体发酵培养基及应用:中国, CN201610142576.0[P].2016,6-22.JIAO Y C,YU M,WANG H.A liquid fermentation medium for the high yield of polysaccharides from Agaricus bisporus (Quél.) sacc.Qaidam and its application:China, CN201610142576.0[P].2016,6-22.
[9] DENG Y Y, JIAO Y C, YUAN Z Z.The antioxidant mechanism of exopolysaccharides’synthesis from Agaricus bitorquis (Quél.) Sacc.Chaidam under the influence of Lycium ruthenicum Murr.anthocyanin extract[J].Macromolecular Research, 2023, 31(10):1001-1017.
[10] WU S, LU H Y, CHEN Q H, et al.Anthocyanin extract from Lycium ruthenicum enhanced production of biomass and polysaccharides during submerged fermentation of Agaricus bitorquis (Quel.) Sacc.Chaidam[J].Bioprocess and Biosystems Engineering, 2021, 44(11):2303-2313.
[11] 詹梦涛, 娄水珠, 刘仙花,等.3,5-二硝基水杨酸法测定液体糖中总糖含量[J].云南民族大学学报(自然科学版), 2020, 29(4):317-321.ZHAN M T, LOU S Z, LIU X H, et al.Determination of the total sugar content in liquid sugar by 3,5-dinitrosalicylic acid method[J].Journal of Yunnan Minzu University(Natural Sciences Edition), 2020, 29(4):317-321.
[12] 徐亚,范会芬,赵玎玲,等.考马斯亮蓝法测定大豆水溶性蛋白提取方法的优化[J].大豆科学, 2022, 41(2):196-202.XU Y,FAN H F,ZHAO D L,et al.Optimization of extraction method for water-soluble protein determination by coomassie bright blue method[J].Soybean Science, 2022, 41(2):196-202.
[13] MITRA R, CHAUDHURI S, DUTTA D.Modelling the growth kinetics of Kocuria marina DAGII as a function of single and binary substrate during batch production of β-Cryptoxanthin[J].Bioprocess and Biosystems Engineering, 2017, 40(1):99-113.
[14] 邢思雨,英高飞,李薪同,等.葡萄糖酸促进氧化亚铁硫杆菌磁小体合成的发酵动力学[J].微生物学报, 2024,64(7):2260-2276.XING S Y, YING G F, LI X T, et al.Fermentation kinetics of Acidithiobacillus ferrooxidans for magnetosome synthesis improved by gluconic acid addition[J].Acta Microbiologica Sinica, 2024, 64(7):2260-2276.
[15] LU H Y, LOU H H, WEI T Y, et al.Ultrasound enhanced production of mycelia and exopolysaccharide by Agaricus bitorquis (Quél.) Sacc.Chaidam[J].Ultrasonics - Sonochemistry, 2020, 64:105040.
[16] KUMAR R, SHARMA R, THAKUR M S, et al.Comparative study of phytochemicals, antioxidant activities and chromatographic profiling of different parts of Lycium ruthenicum Murr of Trans-Himalayan region[J].Phytomedicine Plus, 2022, 2(4):100339.
[17] VILA E, FERREIRA J, LAREO C, et al.Zeaxanthin production by an Antarctic Flavobacterium sp.effect of dissolved oxygen concentration and modeling kinetics in batch and fed-batch fermentation[J].ACS Omega, 2024, 9(51), 50367-50376.
[18] 沈霞,刘惠娜.中药提取物对灰树花深层发酵产胞外多糖的影响[J].菌物研究, 2021, 19(2):115-121.SHEN X, LIU H N.Effects of the extracts of traditional Chinese medicines on the extracellular polysaccharide production of Grifola frondosa fermentation system[J].Journal of Fungal Research, 2021,19(2):115-121.
[19] 陈瑾, 陈晓燕.黑果枸杞花青素稳定性及应用研究进展[J].食品安全导刊, 2022(24):116-119.CHEN J, CHEN X Y.Research progress on stability and application of anthocyanins in Lycium ruthenicum Murr[J].China Food Safety Magazine, 2022(24):116-119.
[20] 宋路萍,邢体坤,王亚萍,等.Fed-batch培养中补料及接种密度对RABV-G蛋白表达量的影响[J].中国当代医药, 2022, 29(36):18-21.SONG L P, XING T K, WANG Y P, et al.Effect of feeding and inoculation density on the expression of Glycoprotein in Fed-batch culture[J].China Modern Medicine, 2022, 29(36):18-21.
[21] GOBBI M, COMITINI F, DOMIZIO P, et al.Lachancea thermotolerans and Saccharomyces cerevisiae in simultaneous and sequential co-fermentation:A strategy to enhance acidity and improve the overall quality of wine[J].Food Microbiolgy, 2013, 33(2):271-281.
[22] MOHAMAD N L, MUSTAPA KAMAL S M, MOKHTAR M N, et al.Dynamic mathematical modelling of reaction kinetics for xylitol fermentation using Candida tropicalis[J].Biochemical Engineering Journal, 2016,111:10-17.
[23] 杨清清, 雷霜江, 包善思,等.鼠李糖乳杆菌产胞外多糖发酵条件优化及发酵动力学模型构建[J].中国酿造, 2023, 42(5):206-211.YANG Q Q, LEI S J, BAO S S, et al.Optimization of fermentation conditions and construction of fermentation kinetic model of exopolysac-charide production by Lactobacillus rhamnosus[J].China Brewing, 2023, 42(5):206-211.