蜂蜜是蜜蜂采集植物的花蜜、分泌物或蜜露,与自身分泌物混合后,经充分酿造而成的天然甜味物质[1],其化学成分相当丰富且复杂,主要由糖类、矿物质、维生素、有机酸、蛋白质、酚酸、黄酮类化合物等营养物质和活性成分组成[2]。蜂蜜的香气和风味主要由挥发性化合物组成,这些成分来源于蜜蜂采集的花蜜或蜜露及在蜜蜂酿蜜过程和贮藏过程中形成的化学反应产物[3]。因此,蜂蜜的香气特征不仅反映了植物来源的挥发性化合物,还受到蜜蜂行为和蜂蜜贮藏过程的影响。
蜂蜜独特香气由多种挥发性化合物协同作用形成,其组成与浓度受多重生物与环境因素调控,包括蜜源植物种类、蜜蜂行为、地理气候以及加工贮藏条件[4]。其中,蜜源植物是挥发性成分的核心来源:不同植物通过次生代谢途径合成具有物种特异性的挥发性化合物(即植物源特征性化合物)[5],这些化合物在蜂蜜中的含量与比例影响其风味特征。例如:洋槐蜜富含芳樟醇氧化物,橙花醇氧化物、乙酯类及丁香醛等共同构成菩提树蜜香气基底[6];邻氨基苯甲酸甲酯[7]、4-萜品酮[8]、4-甲氧基苯乙酮[9]、2-甲基丁酸[10]、2-甲基丁酸乙酯与3-甲基戊酸[11]分别为橙花蜜、向日葵蜜、薰衣草蜜、石楠花蜜、藿香蜜的标志性成分。此类特征性化合物不仅赋予蜂蜜独特的风味,还可作为蜂蜜植物溯源的关键生物标志物,为蜂蜜真实性鉴别提供化学依据。蜂蜜中的挥发性化合物可用于区分不同地理来源的蜂蜜。例如,3种橙花蜜可通过其特征成分加以区分:意大利蜂蜜中类黄酮占主导,希腊蜂蜜则以萜类和环烯醚萜为主要成分,埃及蜂蜜中辛二酸及其脂肪酸酯衍生物被鉴定为化学标记,GC-MS分析在希腊蜂蜜样品中检测到新的呋喃类衍生物,可以作为特征标识物[12]。
除了植物源和地理来源的影响,蜜蜂的行为也对蜂蜜中的挥发性成分产生一定影响作用。蜜蜂的生物学行为主要通过2种途径影响挥发性成分:一是选择性采集,蜜蜂对特定蜜源植物的偏好导致挥发性成分的初始富集差异[13];二是酶促转化,蜜蜂唾液中的葡萄糖氧化酶、转化酶等催化花蜜中前体物质(如萜类苷元)的降解或修饰,生成新的挥发性衍生物(如芳樟醇氧化物)[13]。此外,加工与贮存条件(如温度、时间)可能诱导挥发性成分的化学转化。例如,长期贮存或高温环境会促进羟甲基糠醛(hydroxymethyl furfural,HMF)的生成,同时导致萜烯类物质的氧化损失。因此,蜂蜜香气的最终呈现是植物源特征物质、蜂种代谢调控及环境因素共同作用的结果。
国内现有蜂蜜挥发性成分研究多聚焦于单一蜂种对不同植物源蜂蜜的对比分析,关于不同蜂种对蜂蜜中挥发性化合物影响差异的研究较为缺乏。本研究以同一植物源的中蜂蜂蜜与意蜂蜂蜜为研究对象,采用顶空固相微萃取-气相色谱-质谱联用技术(headspace solid-phase microextraction,HS-SPME-GC-MS),对中蜂和意蜂所产鸭脚木蜜中的挥发性化合物成分进行分析,比较二者在组成及含量上的差异。在此基础上,选取差异显著的化合物,扩大样本进行验证,为揭示不同蜂种对蜂蜜挥发性化合物的影响提供科学依据。
1 材料与方法
1.1 实验样品
本章选择12种不同来源的蜂蜜作为研究对象,包括6种中蜂蜂蜜和6种意蜂蜂蜜。样品信息见表1,4 ℃保存等待分析,根据报道的标准方法确定其蜂蜜样品的蜂种来源,以确保其真实性[14]。
表1 蜂蜜样品信息表
Table 1 Honey samples information
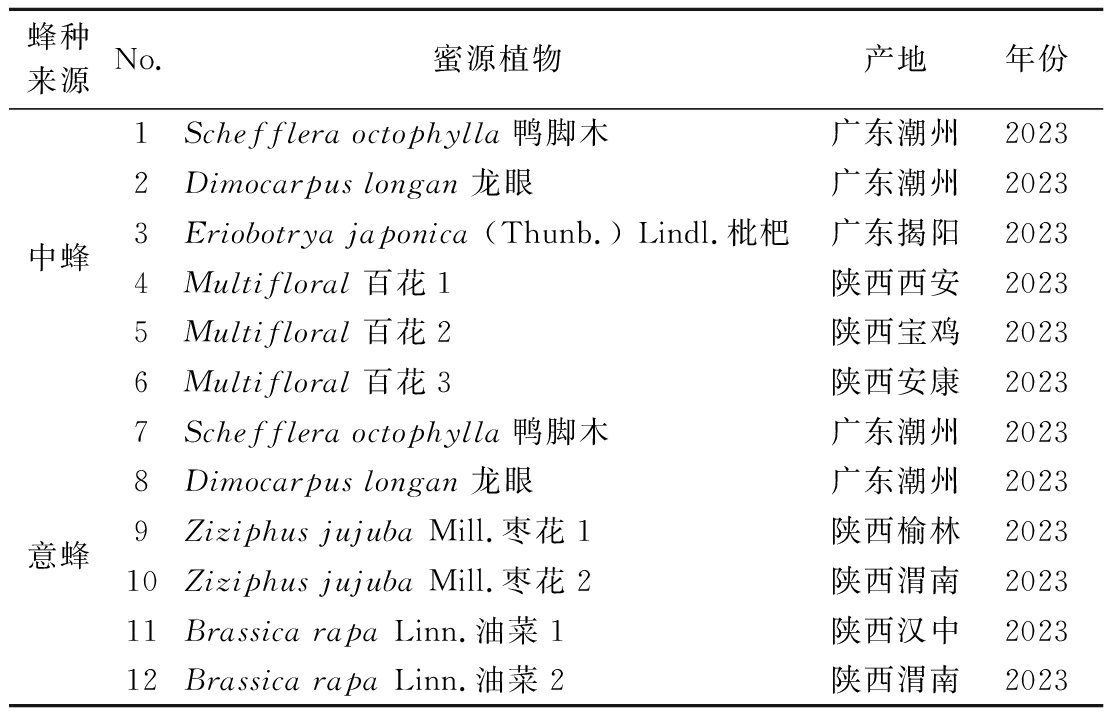
蜂种来源No.蜜源植物产地年份中蜂1Schefflera octophylla鸭脚木广东潮州20232Dimocarpus longan龙眼广东潮州20233Eriobotrya japonica (Thunb.) Lindl.枇杷广东揭阳20234Multifloral百花1陕西西安20235Multifloral百花2陕西宝鸡20236Multifloral百花3陕西安康2023意蜂7Schefflera octophylla鸭脚木广东潮州20238Dimocarpus longan龙眼广东潮州20239Ziziphus jujuba Mill.枣花1陕西榆林202310Ziziphus jujuba Mill.枣花2陕西渭南202311Brassica rapa Linn.油菜1陕西汉中202312Brassica rapa Linn.油菜2陕西渭南2023
1.2 仪器与设备
DVB/CAR/PDMS固相微萃取柱、8890-7000D气相色谱质谱联用仪、DB-5 MS色谱柱(60 m×0.25 mm×0.25 μm),美国Agilent。
1.3 实验方法
1.3.1 理化指标实验方法
蜂蜜主要理化性质依据GH/T 18796—2012《蜂蜜》进行测定,包括水分、还原糖、HMF、淀粉酶活性等指标;蛋白质含量依据GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》进行测定;脯氨酸含量依据文献[15]报道的方法进行测定。
1.3.2 HS-SPME-GC-MS实验方法
参照祝敏[16]的研究方法,准确称取蜂蜜样品2.000 0 g,依次加入2 mL超纯水及0.200 0 g氯化钠(NaCl),涡旋振荡至完全溶解后转移至20 mL气相进样瓶(含PTFE/硅胶隔垫),并加入20 μL质量浓度为100 μg/mL的苯甲酮内标溶液,混匀后密封待测。
挥发性成分采用顶空固相微萃取法(headspace solid-phase microextraction,HS-SPME)富集,具体参数如下:萃取纤维:DVB/CAR/PDMS三相复合涂层(Supelco,美国);萃取程序:参照文献[17]优化条件(如平衡时间10 min、萃取温度60 ℃、萃取时间40 min、解吸时间5 min等)。
GC-MS条件:以氦气为载气,流速1.8 mL/min,不分流。进样温度250 ℃,柱箱温度45 ℃。升温程序为:45 ℃,保持1 min;3 ℃/min上升至225 ℃;225 ℃保持3 min;3 ℃/min上升至240 ℃;240 ℃保持5 min。质谱条件:离子源温度240 ℃,电子能量70 eV,四极杆检测温度150 ℃,离子质荷比扫描范围为50~350。
1.4 数据分析
实验采用C6~C40正烷烃标准品作为碳标,在待测样品相同分析条件下进行GC-MS检测。根据分离各化合物色谱峰保留时间计算目标化合物的KI指数进行化合物定性分析,计算如公式(1)所示:
(1)
式中:xi为目标化合物色谱峰保留时间;xn和xn+1为目标化合物前后相邻2个正烷烃标准品所对应的保留时间。
实验通过NIST 17质谱库对各色谱峰的质谱数据进行谱库比对和人工解析,结合保留指数与匹配度实现化合物定性鉴别。以苯甲酮为内标物,通过目标物与内标峰面积比进行半定量分析。
所有实验均进行3次平行实验并取平均值,结果分析采用Origin 2024软件。
2 结果与分析
2.1 蜂蜜理化特性
本章节所用的中蜂蜂蜜和意蜂蜂蜜的理化特性结果见表2,蜂蜜的品质与其理化指标密切相关。结果表明,这些蜂蜜的pH、电导率、水分、还原糖、HMF、淀粉酶活性等参数均符合GH/T 18796—2012《蜂蜜》中二级及以上品质要求。HMF含量显著低于国家限量标准(≤40 mg/kg),说明蜂蜜样品新鲜度高,未经历高温或长期储存导致的糖类热降解。研究表明,脯氨酸含量是评估蜂蜜成熟度的关键指标,欧盟规定成熟蜂蜜的脯氨酸含量不得低于180 mg/kg[18]。检测结果显示,所有样本的脯氨酸含量均高于该标准。蜂蜜的脯氨酸水平因蜜源植物及地理环境等条件而存在差异[19-20]。综上所述,本研究通过对蜂蜜样品理化特性的检测,表明这些蜂蜜具有高品质,符合相关国家标准。
表2 蜂蜜样品理化指标汇总表
Table 2 Summary table of physicochemical indexes of honey samples
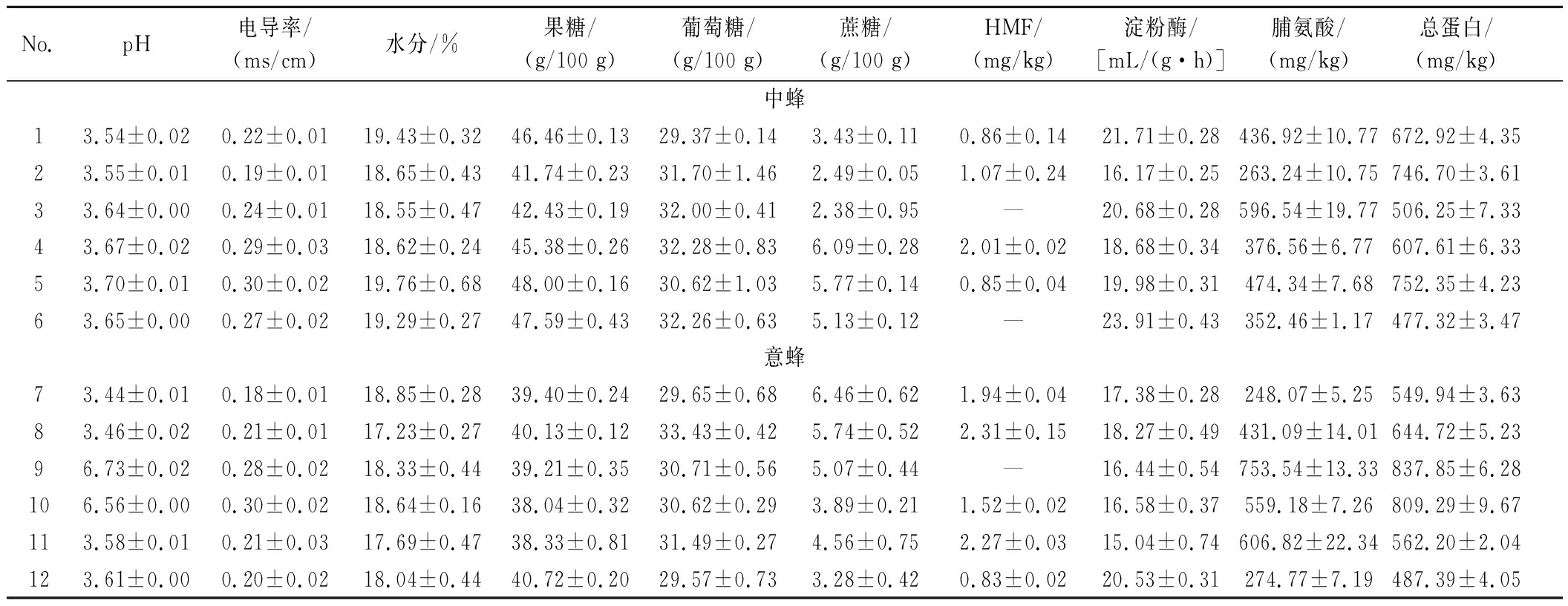
No.pH电导率/(ms/cm)水分/%果糖/(g/100 g)葡萄糖/(g/100 g)蔗糖/(g/100 g)HMF/(mg/kg)淀粉酶/[mL/(g·h)]脯氨酸/(mg/kg)总蛋白/(mg/kg)中蜂13.54±0.020.22±0.0119.43±0.3246.46±0.1329.37±0.143.43±0.110.86±0.1421.71±0.28436.92±10.77672.92±4.3523.55±0.010.19±0.0118.65±0.4341.74±0.2331.70±1.462.49±0.051.07±0.2416.17±0.25263.24±10.75746.70±3.6133.64±0.000.24±0.0118.55±0.4742.43±0.1932.00±0.412.38±0.95—20.68±0.28596.54±19.77506.25±7.3343.67±0.020.29±0.0318.62±0.2445.38±0.2632.28±0.836.09±0.282.01±0.0218.68±0.34376.56±6.77607.61±6.3353.70±0.010.30±0.0219.76±0.6848.00±0.1630.62±1.035.77±0.140.85±0.0419.98±0.31474.34±7.68752.35±4.2363.65±0.000.27±0.0219.29±0.2747.59±0.4332.26±0.635.13±0.12—23.91±0.43352.46±1.17477.32±3.47意蜂73.44±0.010.18±0.0118.85±0.2839.40±0.2429.65±0.686.46±0.621.94±0.0417.38±0.28248.07±5.25549.94±3.6383.46±0.020.21±0.0117.23±0.2740.13±0.1233.43±0.425.74±0.522.31±0.1518.27±0.49431.09±14.01644.72±5.2396.73±0.020.28±0.0218.33±0.4439.21±0.3530.71±0.565.07±0.44—16.44±0.54753.54±13.33837.85±6.28106.56±0.000.30±0.0218.64±0.1638.04±0.3230.62±0.293.89±0.211.52±0.0216.58±0.37559.18±7.26809.29±9.67113.58±0.010.21±0.0317.69±0.4738.33±0.8131.49±0.274.56±0.752.27±0.0315.04±0.74606.82±22.34562.20±2.04123.61±0.000.20±0.0218.04±0.4440.72±0.2029.57±0.733.28±0.420.83±0.0220.53±0.31274.77±7.19487.39±4.05
注:“—”表示未检出。
2.2 中、意蜂鸭脚木蜜挥发性成分分析
本研究旨在探讨蜂种差异对同一蜜源植物(鸭脚木蜜)挥发性成分的影响,以成熟鸭脚木蜜为研究对象,通过HS-SPME-GC-MS,系统对比分析了中蜂与意蜂所产成熟蜂蜜的挥发性组分特征。经NIST谱数据库比对鉴定,中蜂蜂蜜共鉴定出挥发性组分82种、意蜂蜂蜜75种,总鉴定化合物达110种,其中共有组分47种,占比42.73%,见图1。
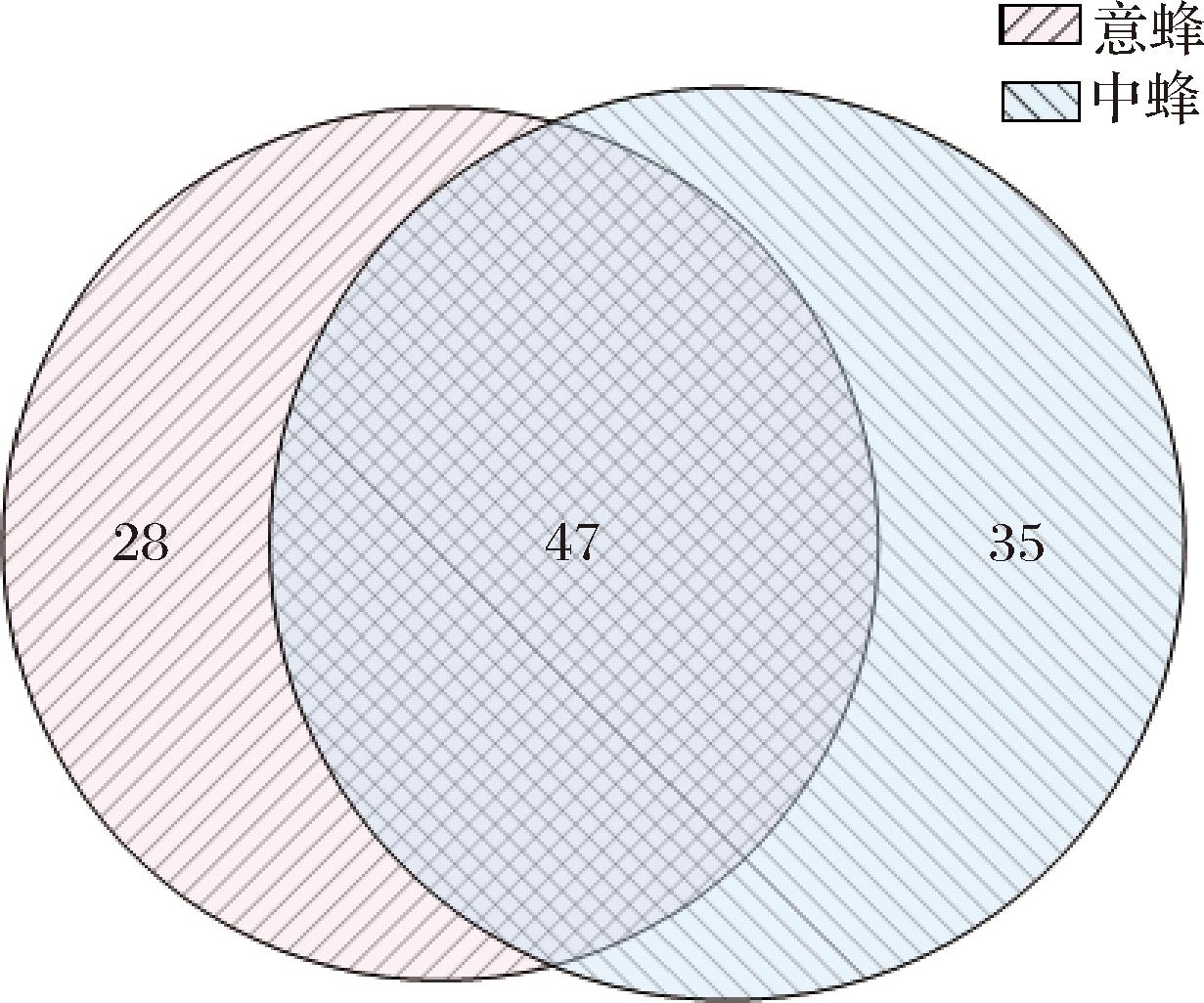
图1 中、意蜂鸭脚木蜜挥发性成分比较分析韦恩图
Fig.1 Venn diagram for comparative analysis of volatile components in Schefflera octophylla honey produced by Apis cerana and Apis mellifera
中、意蜂鸭脚木蜜挥发性成分的总离子流色谱图(TIC,图2)显示,2种蜂蜜挥发性组分的峰形分布及相对丰度呈现差异,在萃取温度60 ℃,萃取时间40 min,解析时间5 min,目标化合物的分离度和峰形对称性均符合定性和定量分析要求。
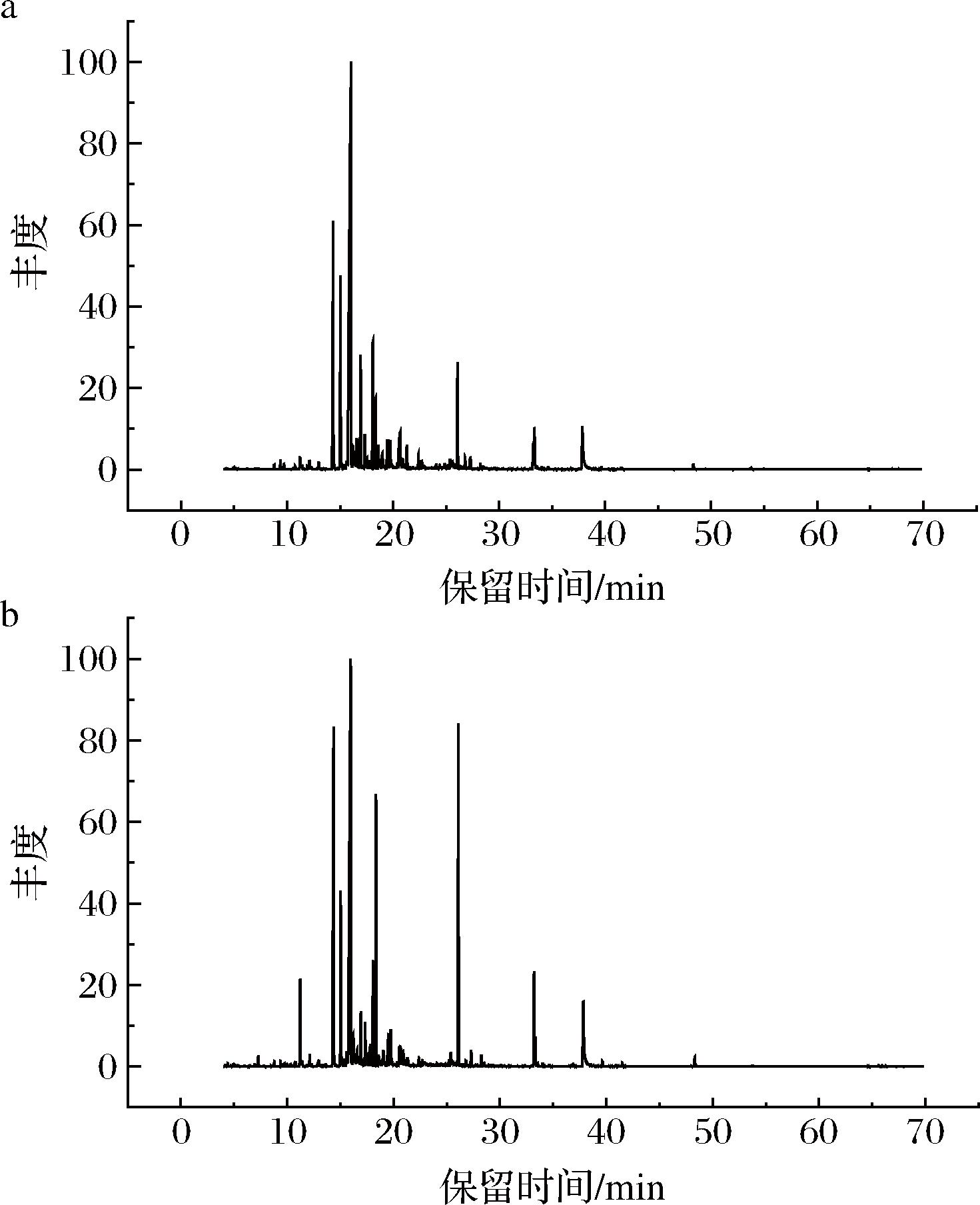
a-意蜂;b-中蜂
图2 中、意蜂鸭脚木蜜挥发性成分的总离子图
Fig.2 Total ion chromatograms of GC-MS for volatile compounds of Schefflera octophylla honey from Apis cerana and Apis mellifera
本研究通过对鸭脚木蜜挥发性化合物的系统分析,揭示其化学组成特征及蜂种间的差异。由图3可知,鸭脚木蜜的挥发性化合物主要由醇类、萜烯类、酮类、烃类和醛类构成,其中醇类与萜烯类化合物的含量尤为丰富。定量分析显示,意蜂所产蜂蜜中该两类物质总相对含量达80.12%,而中蜂为81.57%,证实醇类和萜烯类化合物是鸭脚木蜜的主要挥发性成分(图3)。
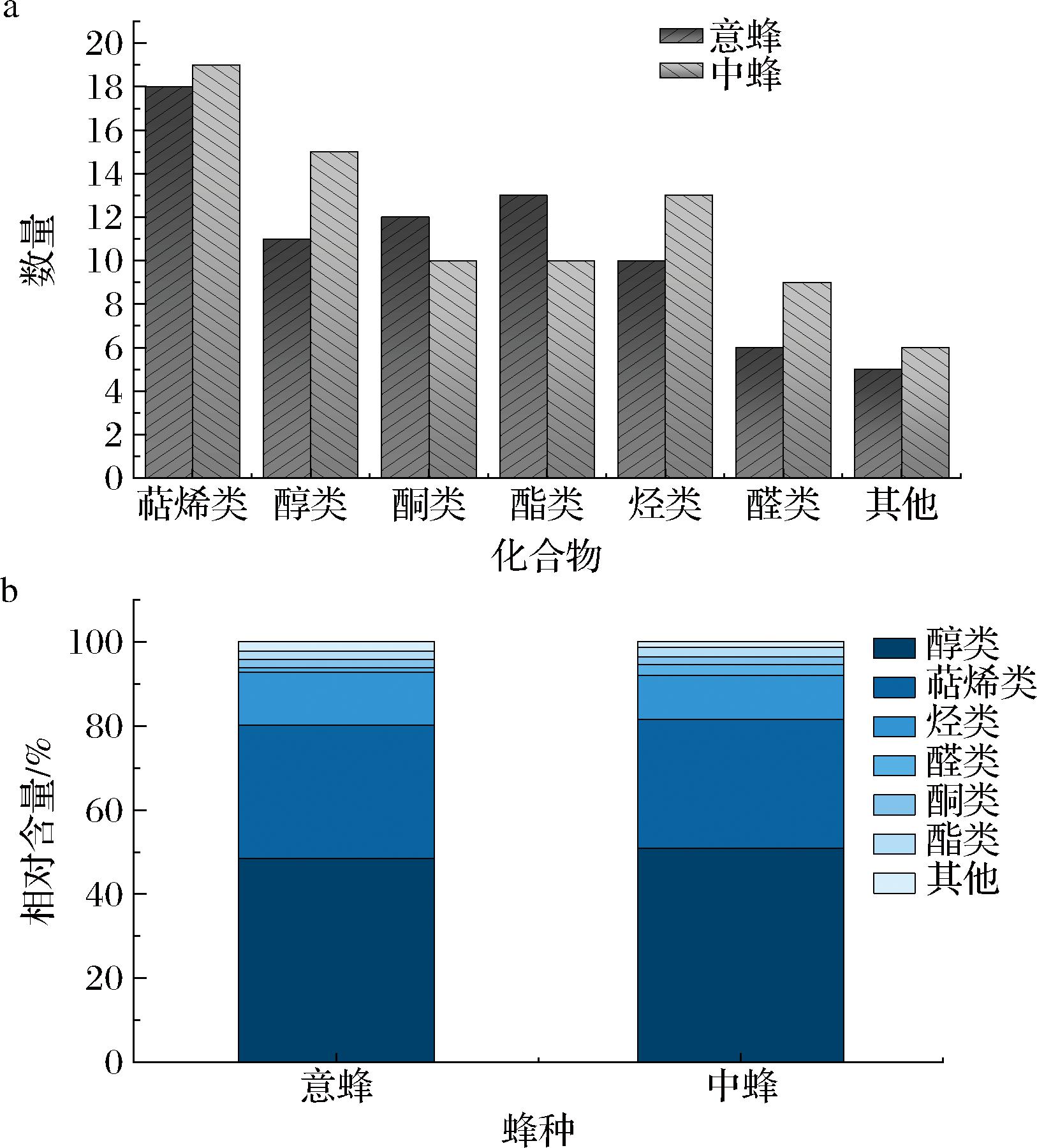
a-挥发性成分的种类分布;b-相对含量分析
图3 中、意蜂鸭脚木蜜挥发性成分的种类分布及相对含量分析
Fig.3 Analysis on distribution and relative content of volatile components in Schefflera octophylla honey produced by A.cerana and A.mellifera
差异分析结果表明,中蜂与意蜂采集的鸭脚木蜜在挥发性成分组成上呈现高度相似性,检测出的47种相同化合物在中、意蜂鸭脚木蜜中的含量占比均达90%以上。这一现象说明2种蜂蜜的核心挥发性化合物构成呈现高度趋同,由此推断中蜂与意蜂对鸭脚木蜜源的采集选择倾向及体内代谢转化过程具有相似的生物学特性。
萜烯类化合物作为芳香植物精油的核心成分,具有甜味和花香,通过蜜蜂采集花蜜转移至蜂蜜中,赋予蜂蜜特殊的香气和风味,是构成其挥发性特征的重要化学基础。本实验中,三烯醇和芳樟醇氧化物在中、意蜂鸭脚木蜜中含量尤为丰富,二者加在一起的占比均已超过55%。三烯醇(3,7-二甲基-1,5,7-三烯-3-醇)是一种萜烯类化合物,作为芳樟醇的重要衍生物,是中蜂蜂蜜和意蜂蜂蜜中最丰富的挥发性成分之一,具有一定的不稳定性,通常被认为是热生成反应的产物。然而,实验研究已证实其在天然蜂蜜中的存在,印证了萜烯类物质在蜂蜜中的植物源主导特性。例如,在未经热处理的皮木(Eucryphia lucida Baill.)蜂蜜的挥发性成分中,三烯醇是主要成分之一[5],本研究也支持了这一发现。这表明,三烯醇可能源于鸭脚木花蜜中萜烯前体(如芳樟醇及其糖苷),经蜜蜂唾液酶系(羟化酶、糖苷酶)催化及蜂巢微环境(温度、pH)调控,发生氧化、重排等转化,最终形成特征性挥发物。它的浓度可能会在蜂蜜生产过程中通过芳樟醇的氧化降解或通过糖苷键的断裂而显著增加,此外三烯醇也可以通过2,6-二甲基-3,7-辛二烯-2,6-二醇,3,7-二甲基-1,7-辛二烯-3,6-二醇的烯丙基重排或(E)-和(Z)-8-hidroxilinol的脱水得到[5]。在蜂蜜贮存过程中,还有一些芳樟醇衍生物,如芳樟醇氧化物,也可能会产生,其是蜂蜜中主要的醇类化合物之一,赋予蜂蜜花香和甜香的气味。萜烯类作为蜂蜜生物有机研究的关键对象,其分析研究以植物化学溯源为核心,通过对比花蜜、蜂蜜及其对应植物精油的萜烯组成,鉴定蜜源特异性标记物(如柑橘蜜中的芳樟醇氧化物);本研究更关注同一蜜源下不同蜂种间的蜂蜜挥发性化合物的区别,以此解析蜂种间酶活性差异对萜烯转化效率及产物分布的影响。
2.3 中、意蜂鸭脚木蜜差异性挥发性成分分析
蜂蜜酿造是一个由工蜂主导的多阶段生物转化过程,主要包括物理脱水(水分从约80%降至20%以下)与酶促化学反应的协同作用。工蜂通过翅翼扇动及巢内微环境调控,显著降低花蜜的水分含量,并由此形成高浓度基质,为后续酶促反应提供必要条件[21]。在此过程中,工蜂通过咽下腺与唾液腺分泌转化酶、葡萄糖氧化酶、糖苷酶等关键酶类,催化花蜜中蔗糖的水解(生成葡萄糖与果糖)、酚类化合物的氧化修饰及挥发性前体物质的释放(如萜烯苷元脱糖基化)[22]。这些反应使得花蜜的化学成分发生系统性转变,最终形成蜂蜜特有的理化特性与风味谱。研究表明,蜂种间的酶活性差异显著影响蜂蜜的功能与挥发性成分。
中蜂和意蜂作为不同种的蜜蜂,其消化道和腺体分泌物的化学成分存在差异,因此在酿蜜过程中会产生不同的生化反应和反应产物,导致蜂蜜中挥发性化学成分的差异[23]。部分研究表明(表3),中蜂与酿蜜过程关联密切的关键基因集中于糖代谢通路(如淀粉酶、蔗糖酶相关基因),而意蜂则更显著富集于糖酵解/糖异生通路相关基因[21],中蜂在糖类分解与转化效率可能会更高,但其与意蜂的具体差异仍需更多系统性研究验证。此外,蜜蜂消化酶的分泌易受蜜源植物、气候等外界环境因素影响,需结合具体实验条件综合分析。本实验结果显示,中蜂鸭脚木蜜中的三烯醇和芳樟醇氧化物的相对含量略高于意蜂鸭脚木蜜,可能与糖苷酶的活性差异有关。糖苷酶催化糖苷键断裂,释放游离萜烯前体,进而促进萜烯类化合物的积累。然而,糖苷酶的活性可能受蜂群生理状态及蜜源环境影响,需结合长期观测数据进一步验证。本实验结果显示,中蜂鸭脚木蜜的酯类化合物的相对含量略高于意蜂鸭脚木蜜,这可能与中蜂鸭脚木蜜的酿造时间较长有关。在此过程中,葡萄糖在葡萄糖氧化酶的作用下生成葡萄糖酸,从而导致蜂蜜酸度的增加[22]。酸性环境有助于酯类化合物(如辛酸甲酯、壬酸甲酯、癸酸甲酯等)的稳定性。实验结果显示,中蜂鸭脚木蜜中的大马士酮、芳樟醇和酚类化合物的相对含量略高于意蜂鸭脚木蜜。大马士酮是一种自由基清除剂[24],芳樟醇具有抗菌活性和调节机体免疫的功能。同时,酚类化合物是蜂蜜抑菌能力的影响因素之一[25],中蜂蜂蜜的抑菌能力可能部分归因于上述化合物的协同作用。
表3 中、意蜂鸭脚木蜜中关键挥发性成分相对含量
Table 3 Relative content of key volatile compounds in Schefflera octophylla honey produced by A.cerana and A.mellifera
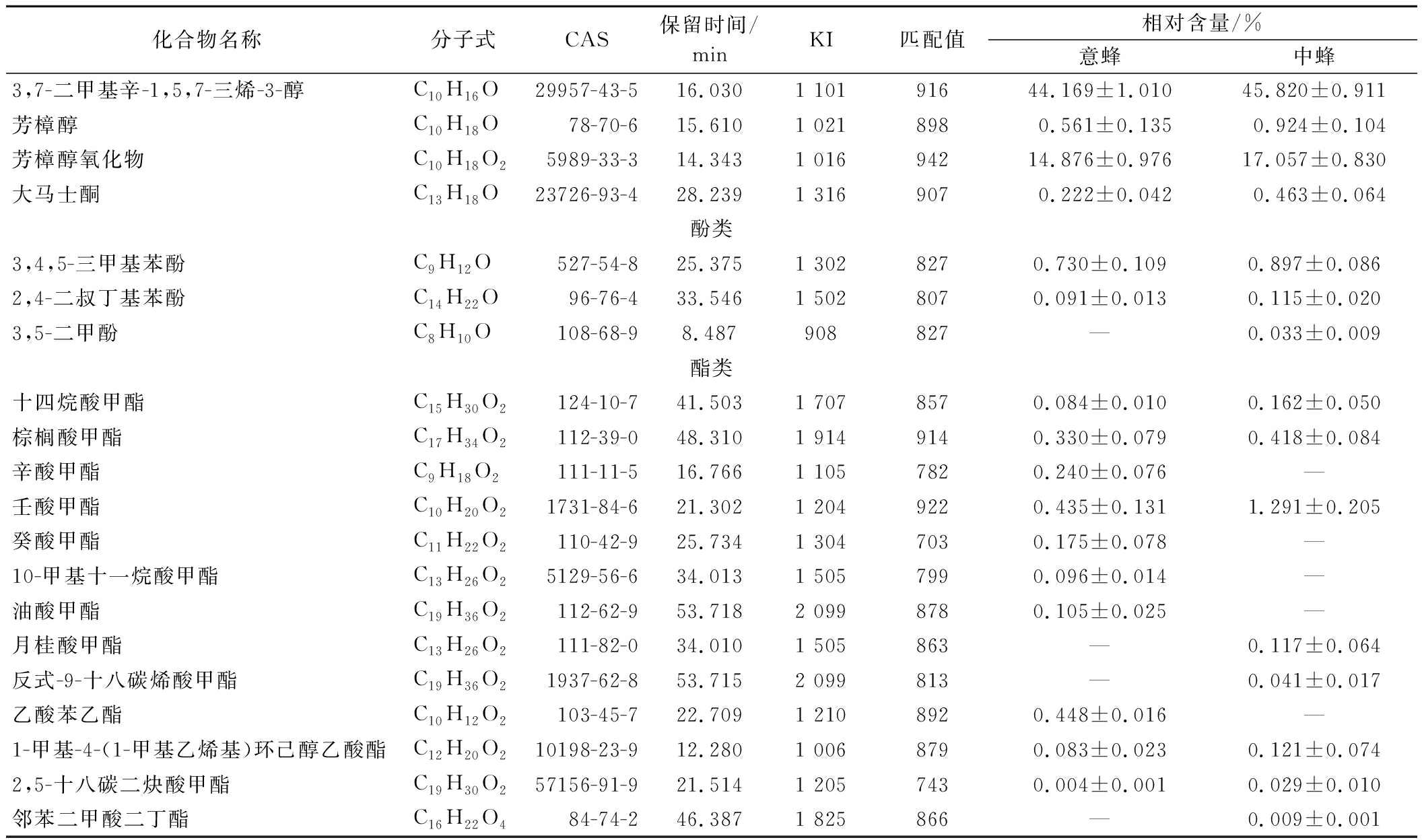
化合物名称分子式CAS保留时间/minKI匹配值相对含量/%意蜂中蜂3,7-二甲基辛-1,5,7-三烯-3-醇C10H16O29957-43-5 16.0301 10191644.169±1.01045.820±0.911芳樟醇C10H18O78-70-6 15.6101 0218980.561±0.1350.924±0.104芳樟醇氧化物C10H18O25989-33-3 14.3431 01694214.876±0.97617.057±0.830大马士酮C13H18O23726-93-4 28.2391 3169070.222±0.0420.463±0.064酚类3,4,5-三甲基苯酚C9H12O527-54-8 25.3751 3028270.730±0.1090.897±0.0862,4-二叔丁基苯酚C14H22O96-76-4 33.5461 5028070.091±0.0130.115±0.0203,5-二甲酚C8H10O108-68-9 8.487908827—0.033±0.009酯类十四烷酸甲酯C15H30O2124-10-7 41.5031 7078570.084±0.0100.162±0.050棕榈酸甲酯C17H34O2112-39-0 48.3101 9149140.330±0.0790.418±0.084辛酸甲酯C9H18O2111-11-5 16.7661 1057820.240±0.076—壬酸甲酯C10H20O21731-84-6 21.3021 2049220.435±0.1311.291±0.205癸酸甲酯C11H22O2110-42-9 25.7341 3047030.175±0.078—10-甲基十一烷酸甲酯C13H26O25129-56-6 34.0131 5057990.096±0.014—油酸甲酯C19H36O2112-62-9 53.7182 0998780.105±0.025—月桂酸甲酯C13H26O2111-82-0 34.0101 505863—0.117±0.064反式-9-十八碳烯酸甲酯C19H36O21937-62-8 53.7152 099813—0.041±0.017乙酸苯乙酯C10H12O2103-45-7 22.7091 2108920.448±0.016—1-甲基-4-(1-甲基乙烯基)环己醇乙酸酯C12H20O210198-23-9 12.2801 0068790.083±0.0230.121±0.0742,5-十八碳二炔酸甲酯C19H30O257156-91-921.5141 2057430.004±0.0010.029±0.010邻苯二甲酸二丁酯C16H22O484-74-2 46.3871 825866—0.009±0.001
注:“—”表示未检出,未列出无CAS号的化合物。
本研究从中、意鸭脚木蜜中分别检测到82种和75种挥发性成分,其中35种为中蜂鸭脚木蜜特有,占总挥发性成分的42.7%,其中柠檬醛和2-(4-甲基苯基)丙-2-醇含量较高;28种为意蜂鸭脚木特有,占总挥发性成分的37.3%,其中α-异丁基-2,4,6-三甲基苯甲醇含量较高,低含量成分(<0.01%)的相对含量占比可能受检测条件或生物学差异的影响(表4)。2个蜂源的鸭脚木蜜共有47种挥发性成分,其数量超过各自的特有成分。可以看出,在相同花期和植物源的情况下,不同蜂种酿造的蜂蜜其挥发性化学成分存在差异,根据以上我们分析的相对含量有所差距的成分和蜂源特有成分可作为潜在标志物进行区分两种蜂蜜。
表4 中、意蜂鸭脚木蜜中差异挥发性成分相对含量
Table 4 Relative content of different volatile compounds in S.octophylla honey produced by A.cerana and A.mellifera
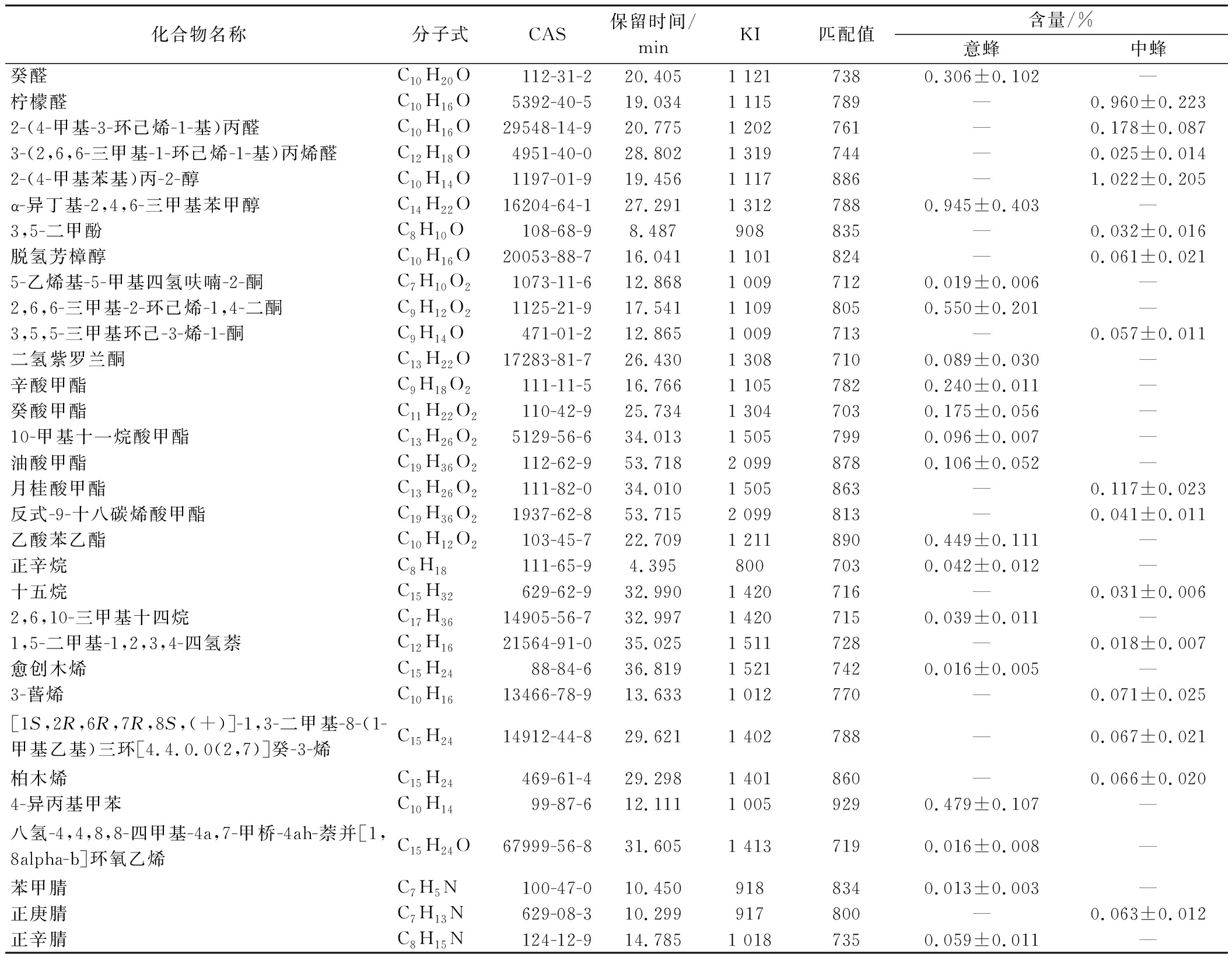
化合物名称分子式CAS保留时间/minKI匹配值含量/%意蜂中蜂癸醛C10H20O112-31-2 20.4051 1217380.306±0.102—柠檬醛C10H16O5392-40-5 19.0341 115789—0.960±0.2232-(4-甲基-3-环己烯-1-基)丙醛C10H16O29548-14-9 20.7751 202761—0.178±0.0873-(2,6,6-三甲基-1-环己烯-1-基)丙烯醛C12H18O4951-40-0 28.8021 319744—0.025±0.0142-(4-甲基苯基)丙-2-醇C10H14O1197-01-9 19.4561 117886—1.022±0.205α-异丁基-2,4,6-三甲基苯甲醇C14H22O16204-64-1 27.2911 3127880.945±0.403—3,5-二甲酚C8H10O108-68-9 8.487908835—0.032±0.016脱氢芳樟醇C10H16O20053-88-716.0411 101824—0.061±0.0215-乙烯基-5-甲基四氢呋喃-2-酮C7H10O21073-11-6 12.8681 0097120.019±0.006—2,6,6-三甲基-2-环己烯-1,4-二酮C9H12O21125-21-9 17.5411 1098050.550±0.201—3,5,5-三甲基环己-3-烯-1-酮C9H14O471-01-2 12.8651 009713—0.057±0.011二氢紫罗兰酮C13H22O17283-81-7 26.4301 3087100.089±0.030—辛酸甲酯C9H18O2111-11-5 16.7661 1057820.240±0.011—癸酸甲酯C11H22O2110-42-9 25.7341 3047030.175±0.056—10-甲基十一烷酸甲酯C13H26O25129-56-6 34.0131 5057990.096±0.007—油酸甲酯C19H36O2112-62-9 53.7182 0998780.106±0.052—月桂酸甲酯C13H26O2111-82-0 34.0101 505863—0.117±0.023反式-9-十八碳烯酸甲酯C19H36O21937-62-8 53.7152 099813—0.041±0.011乙酸苯乙酯C10H12O2103-45-7 22.7091 2118900.449±0.111—正辛烷C8H18111-65-9 4.3958007030.042±0.012—十五烷C15H32629-62-9 32.9901 420716—0.031±0.0062,6,10-三甲基十四烷C17H3614905-56-732.9971 4207150.039±0.011—1,5-二甲基-1,2,3,4-四氢萘C12H1621564-91-0 35.0251 511728—0.018±0.007愈创木烯C15H2488-84-636.8191 5217420.016±0.005—3-蒈烯C10H1613466-78-9 13.6331 012770—0.071±0.025[1S,2R,6R,7R,8S,(+)]-1,3-二甲基-8-(1-甲基乙基)三环[4.4.0.0(2,7)]癸-3-烯C15H2414912-44-8 29.6211 402788—0.067±0.021柏木烯C15H24469-61-4 29.2981 401860—0.066±0.0204-异丙基甲苯C10H1499-87-612.1111 0059290.479±0.107—八氢-4,4,8,8-四甲基-4a,7-甲桥-4ah-萘并[1,8alpha-b]环氧乙烯C15H24O67999-56-8 31.6051 4137190.016±0.008—苯甲腈C7H5N100-47-0 10.4509188340.013±0.003—正庚腈C7H13N629-08-3 10.299917800—0.063±0.012正辛腈C8H15N124-12-9 14.7851 0187350.059±0.011—
注:“—”表示未检出;相对含量小于0.01%且无CAS号的化合物未列出。
2.4 中蜂蜂蜜和意蜂蜂蜜特有挥发性成分验证
基于前期挥发性化合物检测结果,对中蜂与意蜂鸭脚木蜜中筛选获得的潜在特异性标志物进行验证分析。为消除蜜源植物对标志物筛选的干扰,通过扩大样本量,中蜂蜂蜜增加了枇杷蜜、龙眼蜜、百花蜜等5个蜂蜜样品,意蜂蜂蜜增加了龙眼蜜、枣花蜜、油菜蜜等5个蜂蜜样品开展系统性验证。采用双维度筛选策略:首先通过种属共有性分析,要求候选化合物在中蜂蜂蜜中检出率为100%且在意蜂蜂蜜中零检出(或反之),基于韦恩图筛选出中蜂蜂蜜共有挥发性化合物8种,意蜂蜂蜜共有挥发性化合物9种(图4);其次结合种属排他性标准,将上述共有成分与潜在标志物进行交叉比对分析,要求候选化合物需严格满足蜂种鉴别的特异性。最终确认辛烷、辛酸甲酯和癸酸甲酯这3种化合物呈现意蜂特异性,其在意蜂样本中检出率为100%,而在所有中蜂样本中均未检出,月桂酸甲酯和3-蒈烯这2种化合物呈现中蜂特异性,其在中蜂样本中检出率为100%,而在所有意蜂样本中均未检出。上述标志物的特异性分布与蜜源植物成分无显著关联,表明其可作为蜂种鉴别的可靠化学标记物。本研究为开发基于挥发性成分的蜂种鉴别技术提供了可靠的理论依据。
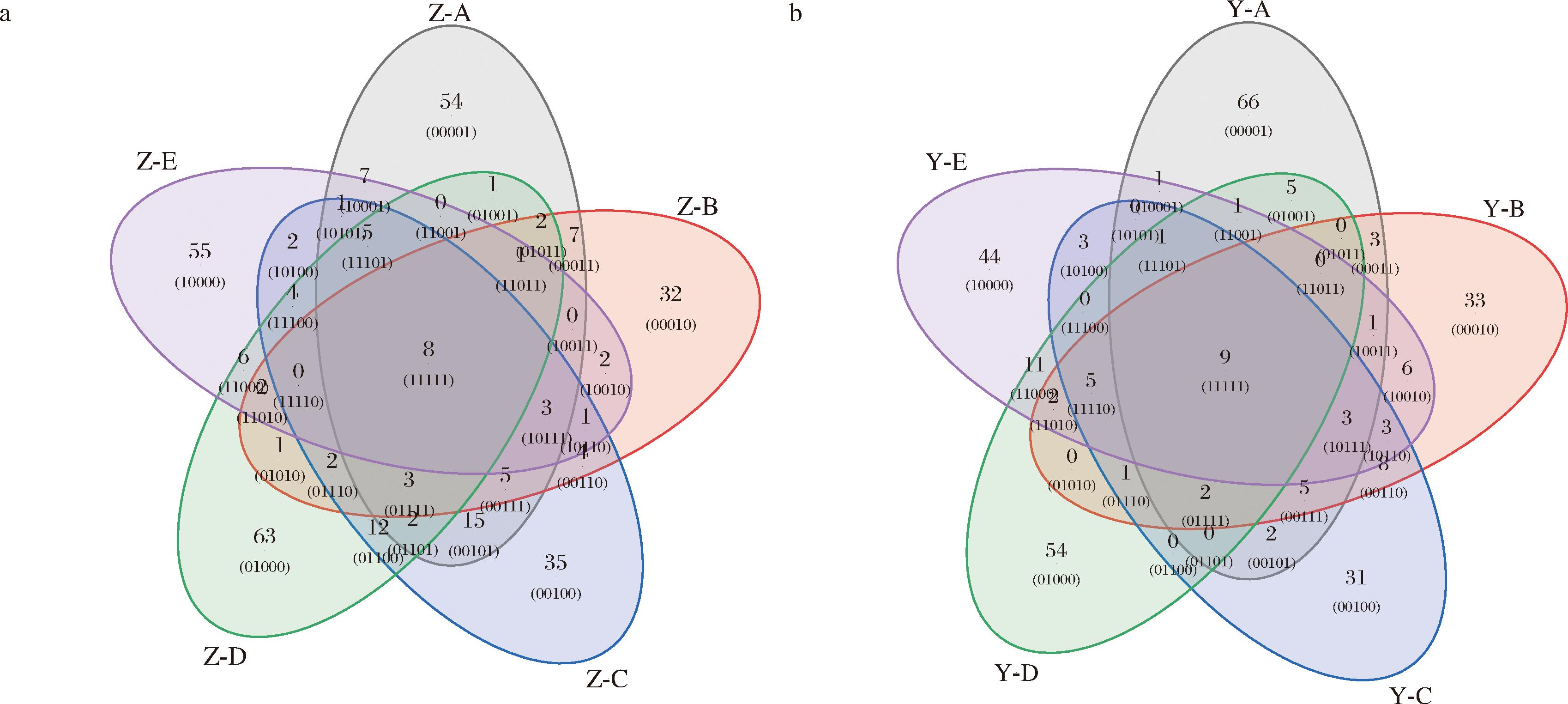
a-中蜂;b-意蜂
图4 蜂种共有化合物韦恩图
Fig.4 Venn diagram of compounds common to different bee species
注:Z-A/B/C/D/E中蜂代表百花蜜1/百花蜜2/百花蜜3/龙眼蜜/枇杷蜜;Y-A/B/C/D/E意蜂代表油菜蜜1/油菜蜜2/枣花蜜1/枣花蜜2/龙眼蜜。
3 结论
本文采用HS-SPME-GC-MS对中蜂与意蜂鸭脚木蜜的挥发性成分进行系统性分析,共鉴定出110种挥发性化合物。其中,两类蜂蜜共有组分47种(占比42.73%),萜烯类及醇类物质为两者的主要挥发性成分。对比分析显示,中蜂鸭脚木蜜中三烯醇、芳樟醇氧化物、酯类及酚类物质的相对含量高于意蜂鸭脚木蜜。中蜂鸭脚木蜜存在35种特有成分,意蜂鸭脚木蜜存在28种独有成分。经扩大样品对特有成分进行蜂种特异性验证,月桂酸甲酯与3-蒈烯在中蜂蜂蜜中稳定检出,而辛烷、辛酸甲酯和癸酸甲酯则特异分布于意蜂蜂蜜。上述挥发性成分的蜂种特异性研究,为解析中蜂与意蜂蜂蜜的差异化特征及蜂种鉴别技术开发提供了关键化学标记物与理论支撑。
[1] FAUSTINO C, PINHEIRO L.Analytical rheology of honey:A state-of-the-art review[J].Foods, 2021, 10(8):1709.
[2] ESCUREDO O, SEIJO M C.Honey:Chemical composition, stability and authenticity[J].Foods, 2019, 8(11):577.
[3] 杨明华, 谭霞, 宋文菲, 等.源自中华蜜蜂和西方蜜蜂的澳洲坚果蜜挥发性成分比较分析[J].云南农业大学学报(自然科学), 2022, 37(2):269-277.YANG M H, TAN X, SONG W F, et al.Comparative analysis of volatile compounds in macadamia honey from chinese and western honeybees[J].Journal of Yunnan Agricultural University (Natural Science), 2022, 37(2):269-277.
[4] MAHMOUD M A A, K L
L Ç-BÜYÜKKURT Ö, ABOUL FOTOUH M M, et al.Aroma active compounds of honey:Analysis with GC-MS, GC-O, and molecular sensory techniques[J].Journal of Food Composition and Analysis, 2024, 134:106545.
Ç-BÜYÜKKURT Ö, ABOUL FOTOUH M M, et al.Aroma active compounds of honey:Analysis with GC-MS, GC-O, and molecular sensory techniques[J].Journal of Food Composition and Analysis, 2024, 134:106545.
[5] ![]() I,
I, ![]() P M.Terpenes in honey:Occurrence, origin and their role as chemical biomarkers[J].RSC Advances, 2014, 4(60):31710-31728.
P M.Terpenes in honey:Occurrence, origin and their role as chemical biomarkers[J].RSC Advances, 2014, 4(60):31710-31728.
[6]  TEF
TEF NIKOV
NIKOV J, MARTI
J, MARTI OV
OV P,
P,  NIRC M, et al.Screening of the honey aroma as a potential essence for the aromachology[J].Applied Sciences, 2021, 11(17):8177.
NIRC M, et al.Screening of the honey aroma as a potential essence for the aromachology[J].Applied Sciences, 2021, 11(17):8177.
[7] JUAN-BORR S M, PERICHE A, DOMENECH E, et al.Correlation between methyl anthranilate level and percentage of pollen in Spanish citrus honey[J].International Journal of Food Science &Technology, 2015, 50(7):1690-1696.
S M, PERICHE A, DOMENECH E, et al.Correlation between methyl anthranilate level and percentage of pollen in Spanish citrus honey[J].International Journal of Food Science &Technology, 2015, 50(7):1690-1696.
[8]  P
P NIK I, PAŽITN
NIK I, PAŽITN A,
A,  I
I KA P, et al.The determination of botanical origin of honeys based on enantiomer distribution of chiral volatile organic compounds[J].Food Chemistry, 2014, 158:497-503.
KA P, et al.The determination of botanical origin of honeys based on enantiomer distribution of chiral volatile organic compounds[J].Food Chemistry, 2014, 158:497-503.
[9] CASTRO-V ZQUEZ L, LEON-RUIZ V, ALA
ZQUEZ L, LEON-RUIZ V, ALA ON M E, et al.Floral origin markers for authenticating Lavandin honey (Lavandula angustifolia x latifolia).Discrimination from Lavender honey (Lavandula latifolia)[J].Food Control, 2014, 37:362-370.
ON M E, et al.Floral origin markers for authenticating Lavandin honey (Lavandula angustifolia x latifolia).Discrimination from Lavender honey (Lavandula latifolia)[J].Food Control, 2014, 37:362-370.
[10] SEISONEN S, KIVIMA E, VENE K.Characterisation of the aroma profiles of different honeys and corresponding flowers using solid-phase microextraction and gas chromatography-mass spectrometry/olfactometry[J].Food Chemistry, 2015, 169:34-40.
[11] ZHANG Y Z, SI J J, LI S S, et al.Chemical analyses and antimicrobial activity of nine kinds of unifloral Chinese honeys compared to manuka honey (12+ and 20+)[J].Molecules, 2021, 26(9):2778.
[12] KASIOTIS K M, BAIRA E, IOSIFIDOU S, et al.Fingerprinting chemical markers in the Mediterranean orange blossom honey:UHPLC-HRMS metabolomics study integrating melissopalynological analysis, GC-MS and HPLC-PDA-ESI/MS[J].Molecules, 2023, 28(9):3967.
[13] ![]() I,
I, ![]() Z, et al.Traceability of Satsuma mandarin (Citrus unshiu Marc.) honey through nectar/honey-sac/honey pathways of the headspace, volatiles, and semi-volatiles:Chemical markers[J].Molecules, 2016, 21(10):1302.
Z, et al.Traceability of Satsuma mandarin (Citrus unshiu Marc.) honey through nectar/honey-sac/honey pathways of the headspace, volatiles, and semi-volatiles:Chemical markers[J].Molecules, 2016, 21(10):1302.
[14] LIU X T, SUN J, JI P R, et al.Hydroxy fatty acids as novel markers for authenticity identification of the honey entomological origin based on the GC-MS method[J].Journal of Agricultural and Food Chemistry, 2023, 71(18):7163-7173.
[15] 何亮亮. 枸杞蜜的理化性质及其抗氧化活性谱效关系研究[D].西安:西北大学, 2019.HE L L.Physicochemical properties and antioxidant spectrum-effect relationship of medlar honey[D].Xi’an:Northwest University, 2019.
[16] 祝敏. 西北五种特色单花种蜂蜜花源特征性成分及其对酒精性胃损伤的保护作用研究[D].西安:西北大学, 2021.ZHU M.Characteristic components of five special monofloral honeys from northwest China and the gastroprotective effect against ethanol-induced gastric injury[D].Xi’an:Northwest University, 2021.
[17] NAKIB R, SHANTAL RODR GUEZ-FLORES M, ESCUREDO O, et al.Retama sphaerocarpa, Atractylis serratuloides and Eruca sativa honeys from Algeria:Pollen dominance and volatile profiling (HS-SPME/GC-MS)[J].Microchemical Journal, 2022, 174:107088.
GUEZ-FLORES M, ESCUREDO O, et al.Retama sphaerocarpa, Atractylis serratuloides and Eruca sativa honeys from Algeria:Pollen dominance and volatile profiling (HS-SPME/GC-MS)[J].Microchemical Journal, 2022, 174:107088.
[18] THRASYVOULOU A, TANANAKI C, GORAS G, et al.Legislation of honey criteria and standards[J].Journal of Apicultural Research, 2018, 57(1):88-96.
[19] CARTER C, SHAFIR S, YEHONATAN L, et al.A novel role for proline in plant floral nectars[J].Naturwissenschaften, 2006, 93(2):72-79.
[20] 问亚琴, 张金振, 金玥, 等.基于多酚类物质和脯氨酸的多元统计分析鉴别不同植物源单花蜜[C].二十一世纪第二届全国蜂业科技与蜂产业发展大会论文集.北京: 2016.WEN Y Q, ZHANG J Z, JIN Y, et al.Characterization of Chinese monofloral honeys from different botanical origins with multivariate analysis of proline andphenolic profile as markers[C].Proceedings of the 2nd National Apicultural Science &Technology And Industry Development Conference In 21 st Century Bee World.Beijing, 2016.
[21] 章晋武. 工蜂酿蜜生物学特性研究[D].南昌:江西农业大学, 2024.ZHANG J W.Study on biological characteristics of worker bee processing nectar[D].Nanchang:Jiangxi Agricultural University, 2024.
[22] 王欣然. 中蜂蜜和意蜂蜜的识别及肠道抗炎活性研究[D].北京:中国农业科学院, 2022.WANG X R.Study of identification and intestinal anti-inflammatory activity of A.cerana honey and A.mellifera honey[D].Beijing:Chinese Academy of Agricultural Sciences, 2022.
[23] 王桃红, 崔宗岩, 张少博, 等.中蜂与意蜂荔枝蜜挥发性成分的测定与对比分析[J].食品研究与开发, 2020, 41(7):159-166.WANG T H, CUI Z Y, ZHANG S F, et al.Determination and comparative analysis of volatile compounds in lychee honeys produced by Apis cerana cerana and Apis mellifera ligustica[J].Food Research And Development, 2020, 41(7):159-166.
[24] PATTAMAYUTANON P, ANGELI S, THAKEOW P, et al.Biomedical activity and related volatile compounds of thai honeys from 3 different honeybee species[J].Journal of Food Science, 2015, 80(10):M2228-M2240.
[25] 王银, 刘彩玲, 苟心怡, 等.秦岭中蜂蜂蜜酚类提取物的鉴定及其抑菌活性研究[J].食品与发酵工业, 2022, 48(7):154-159.WANG Y, LIU C L, GOU X Y, et al.Phenolic compounds of Qinling Apis cerana honey and its antimicrobial activity against foodborne pathogens[J].Food and Fermentation Industries, 2022, 48(7):154-159.