米酵菌酸(bongkrekic acid,BA)是唐菖蒲伯克霍尔德菌椰毒致病变种分泌的一种强呼吸毒素[1],其进入体内后主要作用于人体的脑、肝脏、肾脏等器官,且造成的影响迅速而强烈,能够在短时间内导致人体的多器官功能衰竭。目前,针对米酵菌酸中毒没有标准的治疗方案。据研究表明,米酵菌酸中毒的死亡率在40%~100%,主要取决于暴露剂量,目前的研究和案例表明人体摄入1.0~1.5 mg米酵菌酸即可引起生命垂危[2]。该毒素是非热敏性毒素,一般的高温烹煮方式不能破坏该毒素。对于食品中米酵菌酸,目前在实际应用中没有较好的降解办法,只能在加工和贮藏阶段避免该种毒素的产生。另外,提高米酵菌酸的检测水平,加强对它的监测力度,防止受污染的食品进入流通市场,是减少该毒素中毒事件的重要手段。因此,对食品中的米酵菌酸进行精准的检测显得及其重要,这与食品安全和消费者的生命健康关系重大。
目前,米酵菌酸的检测方法主要是液相色谱法[3-4]高效液相色谱法串联质谱法[5-6]。我国现行对米酵菌酸的检测标准主要是GB 5009.189—2023《食品安全国家标准 食品中米酵菌酸的测定》,其中液相色谱的检出限为5.0 μg/kg,串联质谱法的检出限为1.0 μg/kg,两者准确性和精密性表现良好,且可广泛应用于薯类、谷类、湿米粉类等含有米酵菌酸的样品,但存在分析时间长、检出限高、取样量大的缺点。
相对于传统仪器法,快速检测法具有快速、简便,对仪器依赖度低,成本低,便于携带以及对操作人员技术要求低等特点,适合较为紧急的现场检查以及大规模样品速筛等检测工作。目前国内外的针对食品基质的快速检测方法主要有酶抑制法、酶联免疫法、生物传感器法、光谱法等。其中酶抑制法主要利用的是特定酶与目标药物特异性结合的原理,来实现快速定性或半定量检测的目的。如目前有报道利用乙酰胆碱酯酶来检测有机磷或氨基甲酸酯类农药[7]。酶联免疫法是基于抗原抗体特异性结合以及结合后的复合物能够被识别和检测的原理[8]。根据不同的检验方法可以分为直接法、间接法和夹心法等,方法的选择需要综合考量。例如采用直接法,该检验方法是利用带酶标的一抗直接与抗原结合,最后加入底物显色并检测吸光度。直接法具有操作简单的优点,同时可以避免抗原和二抗发生交叉反应导致的结果错误,但是所采用的检测抗体既要保证免疫活性又要标记酶标信息,制备困难且成本较高。生物传感器法是利用酶、抗体、线粒体等生物活性物质来识别检测物质,通过传感器将反应中的理化反应转化为电信号并放大的以达到检测目的的一种快检方法[9]。该种方法可以用于检测食品中的农药残留、微生物及其代谢物等指标,保卫食品安全。光谱法主要是通过分析样品的光谱特征的主要用于定性检测的方法,其特点是操作简单,无需样品制备,在线分析[10]。但是该方法在灵敏度、抗干扰能力方面存在较为严重的技术缺陷,从而大大限制了其发展。免疫层析方法是快速检测法的一种,目前常见的免疫层析法的主要标记材料有胶体金、乳胶微球及时间分辨荧光微球等[11]。目前已有报道利用胶体金对米酵菌酸进行快速检测的方法[12-13],胶体金灵敏度较低、定量范围较窄以及不稳定[14],在实际应用过程中无法准确定量,多用于定性测定,且定性检测限较高使其在检测应用中常出现假阴性现象。而对比于胶体金,乳胶微球颜色丰富、大小均匀、比表面积较大,提供更多的结合位点,能够满足更多的检测要求,有更高的稳定性,但无法做到屏蔽干扰[15]。时间分辨荧光微球是由镧系元素及螯合物组成的微粒,镧系元素具有荧光寿命长,stokes位移大以及发射光谱窄的特点,这使得时间分辨荧光微球用于免疫分析技术时,可以有效避免短寿命背景荧光对检测结果的干扰,从而提高检测方法的信噪比和灵敏度,实现高信噪比。此外,镧系元素还有stokes位移大的特点,即发射光谱与激发光谱存在较大的波长差,通过对其波长和时间2个参数进行测量,能够很好的屏蔽掉非特异性荧光的干扰,并可重复多次测定[16-17]。综上说明,时间分辨荧光微球非常适用于应用到免疫层析技术当中,不仅可以提高检测方法的灵敏度和准确性,实现“又快又准”,还可以保证在出现可疑结果并对免疫层析试纸条进行回顾时,由于短寿命背景荧光的湮灭,结果“更加准确”。
本研究通过探针制备条件、层析工作条件以及样品提取方法等一系列优化,建立了米酵菌酸的时间分辨荧光免疫层析快速检测方法,并对其准确度、灵敏度、特异性进行验证,方法对米酵菌酸的快速检测方法发展具有重大意义。
1 材料与方法
1.1 材料与试剂
SB08样品垫、SB06样品垫、RB65样品垫、GF-2样品垫、CH37K吸水纸、SMA31-40 PVC底板、硝酸纤维素膜(nitrocellulose membrane,NC膜),上海良信科技有限公司;米酵菌酸标准品(纯度≥ 98%),上海安谱实验科技股份;米酵菌酸包被原、抗米酵菌酸单克隆抗体(mAb),实验室自制;时间分辨荧光微球(time-resolved fluorescent microspheres,TrFM),苏州为度生物技术有限公司;2-(N-吗啉代)乙磺酸、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐[1-(3-dimethylaminopropyl)-3-ethylcarbodiimide,EDC]、牛血清白蛋白(bovine serum albumin,BSA)、N-羟基丁二酰亚胺(N-hydroxysuccinimide,NHS)、Procline-300,美国Sigma-Aldrich有限公司;银耳、木耳、米粉,广州食品检验所;聚乙烯比咯烷酮(polyvinyl pyrrolidone, PVP)、蔗糖、吐温-20(Tween-20)、磷酸、硼砂(Na2B4O7·10H2O)、硼酸、甲醇、乙酸乙酯、乙腈,天津大茂化学试剂厂;若干浓度和pH值不同的磷酸缓冲液(phosphate buffer,PB)、硼酸盐缓冲液(borate buffer,BB)、2-吗啉乙磺酸缓冲液[2-(4-morpholino)ethanesulfonic acid,MES],实验室配制取用。
1.2 仪器与设备
L10-L191样品粉碎搅拌机,九阳公司;京制00000246号电子分析天平,赛多利斯科学仪器(北京)有限公司;移液枪,美国 Thermo 公司;B11-2恒温磁力搅拌器,上海司乐仪器有限公司;UNIQUE-R10纯水仪,广州誉维生物科技仪器有限公司;KQ-100E超声波清洗器,昆山市超声仪器有限公司;DHG-9070A电热鼓风干燥箱,山东博科科学仪器有限公司;RS-NSY-1样品浓缩仪,广州瑞森生物科技股份有限公司;Vortex-6旋涡混合器,海门麒麟医用仪器厂;XYZ 三维划膜喷金仪、CTS300数控裁条机、ZQ2002微电脑自动斩切机,上海金标生物科技有限公司;FIC-Q1多功能条读取器,苏州和迈精密仪器有限公司。
1.3 实验方法
1.3.1 溶液的配制
活化液:0.05 mol/L MES,pH 6.0。偶联缓冲液:12.5 mmol/L Na2B4O7·10H2O,50 mmol/L H3BO3。探针复溶液:蔗糖10 g,BSA 1 g,3%(质量分数)Procline-300 2 mL,10%(质量分数)Tween-20 10 mL,10%(质量分数)PVP 6 mL,0.5 mol/L PB 8 mL,蒸馏水174 mL,均为质量分数。样品缓冲液:50 mmol/L Na2B4O7·10H2O,200 mmol/L H3BO3。
1.3.2 荧光微球免疫探针的制备
通过活化TrFM表面羧基,使其与高亲和力和高特异的米酵菌酸抗体共价偶联[18-19],从而制备出TRFMs探针。具体操作步骤如下:将10 μL TrFM加入到1 mL活化液中,振荡混匀;依次加入20 μL 10 mg/mL EDC和24 μL 10 mg/mL NHS,轻微振荡活化15 min;通过在14 000 r/min,4 ℃下离心10 min,缓慢弃去上清液。将获得的沉淀物复溶在1 mL偶联缓冲液中,超声分散后振荡混匀;加入50 μL(用一级水稀释100倍)的米酵菌酸单克隆抗体(mAb),轻微振荡标记30 min;往偶联好的溶液中加入40 μL 10%的BSA,轻微振荡封闭15 min;通过在14 000 r/min,4 ℃下离心10 min,缓慢弃去上清液。将获得的沉淀物复溶在200 μL的探针复溶液中,超声分散混匀,2~6 ℃冷藏保存。
1.3.3 试纸条的制作
采用样品垫处理液(准确移取7.5 mL 10% Tween-20,3 mL 10% PVP,2.5 mL 20% BSA,4 mL 0.5 mol/L PB,83 mL 一级水于锥形瓶中,均为质量分数,现配现用)将样品垫充分润湿后,于37 ℃烘箱中烘干8 h,然后按宽度15 mm裁切成条;利用划膜仪将包被原(质量浓度0.32 mg/mL)和羊抗鼠抗体(质量浓度0.175 mg/mL)喷涂于NC膜上分别作为T线(检测线)和C线(控制线),37 ℃烘箱中烘干8 h后待用;将处理好的样品垫、NC膜和吸水纸贴在PVC底板上,所贴的位置依次为下端、中部、上端;组装完成后采用自动斩切机切成宽度为3.05 mm的长条,贮存于塑料袋中,于干燥阴凉的地方存放。
1.3.4 样品前处理
称取1 g样品于10 mL离心管中,向样品中加浓度为100 μg/kg的米酵菌酸溶液,涡旋混合均匀,再往样品中加入3 mL乙酸乙酯,振荡5 min,4 000 r/min离心5 min,吸取2 mL上清液于另一10 mL离心管中,样品浓缩仪吹干后加入200 μL 0.1 mol/L pH 7.4 PB复溶,超声分散后涡旋均匀。
1.3.5 检测过程
往酶标孔中加入100 μL样品处理液,加入1 μL探针复溶液,孵化3 min后插入试纸条,静置3 min,取出试纸条,刮下样品垫即可入机检测。根据读数仪所读出试纸条的T/C值,即可计算出B/B0值,将其代入线性曲线即可得出相应的米酵菌酸浓度。米酵菌酸时间分辨荧光免疫层析检测步骤如图1所示。
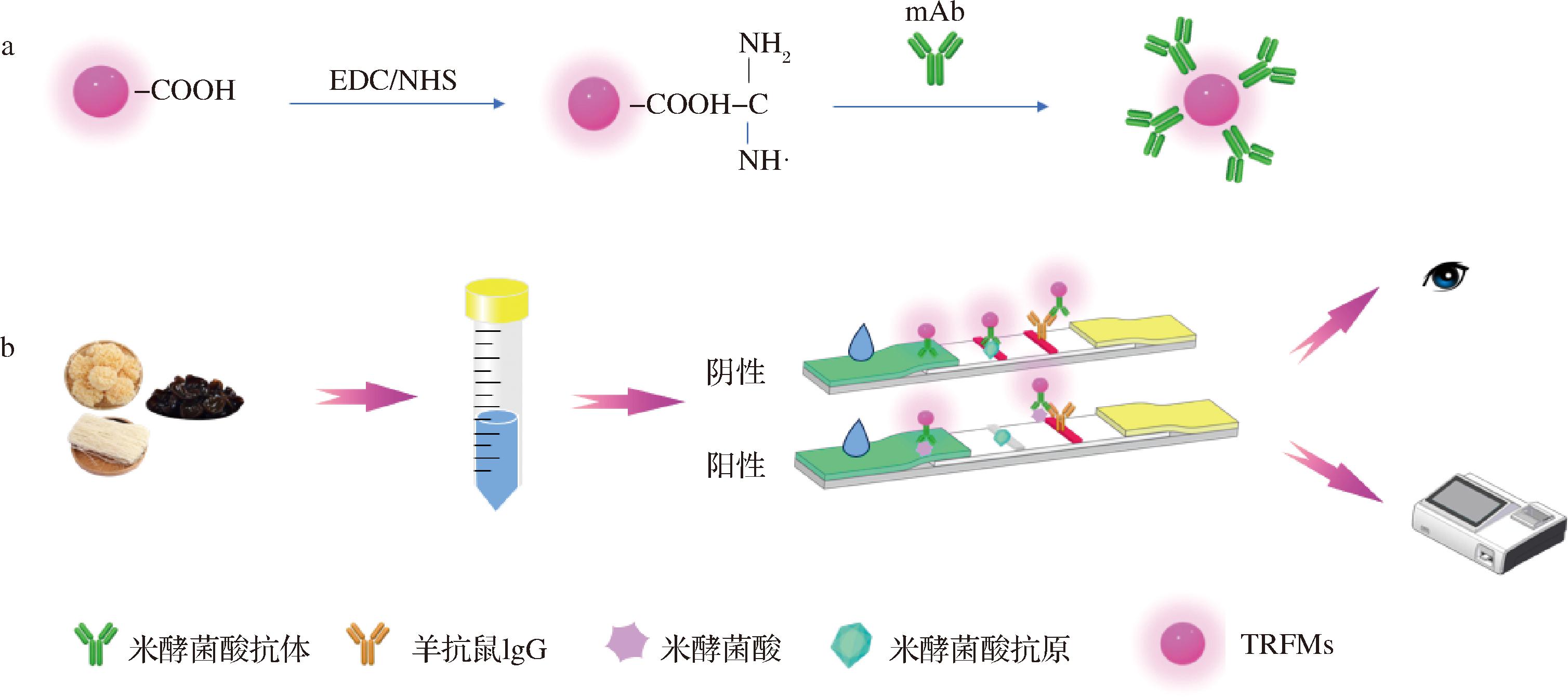
图1 米酵菌酸时间分辨荧光免疫层析检测步骤
Fig.1 Detection steps of time-resolved fluorescence immunochromatography for BA
2 结果与分析
2.1 荧光微球免疫层析法条件优化
2.1.1 探针制备条件的优化
2.1.1.1 荧光微球活化pH值及偶联pH值的选择
TrFM的活化pH值影响到其分子上结合羧基的活性,偶联pH值能够影响其与抗体的结合稳定性和效率,最终影响到探针的性能[20]。用NaOH溶液(1 mol/L)将活化液的pH值调至4.5、5.0、5.5、6.0、6.5,分别采用浓度为0.02 mol/L,pH值为7.0、7.4的PB缓冲液以及pH值为8.0、8.4的BB作为偶联环境,对比其对探针的显色强度的影响,选择阴性T线显示强度高,阳性T线退色明显位最佳条件。pH值的优化情况如图2-a、图2-b所示。结果显示,在活化pH值为6.0时,探针有着最好的显色强度,因此选择pH 6.0为最佳活化pH值;在偶联pH值为8.0时,探针有着最好的显色强度,因此选择pH 8.0为最佳偶联pH值。
2.1.1.2 抗体稀释液选择
抗体稀释液是影响抗体活性的关键因素[21],抗体稀释液会对抗体在荧光微球表面的均匀分布造成影响,从而影响试纸条T线与C线的荧光强度。实验选取一级水、0.01 mol/L(pH 7.4) PB、0.01 mol/L BB(pH 8.0)、0.5% BSA溶液,作为抗体稀释缓冲液,对比对显色强度的影响。稀释液优化情况见图2-c。结果表明,以上4种稀释液的效果相当,其中水最易获得、成本最低,所以选择水为抗体稀释液。
2.1.1.3 标记抗体用量的选择
合适的抗体用量能够提高TrFM与抗体的偶联效率和探针的灵敏度以及显色强度[22],在标记过程中,设置0.04 mg/mL抗体稀释液加入量分别为25、50、75、100 μL,探究不同抗体加入量对显色的影响效果,其优化结果如图2-d所示。结果表明,随着抗体用量,增加显色也在增强,50 μL的抗体稀释液用量已经有足够的荧光强度,在保证显色强度下为了节省抗体,选择50 μL的抗体稀释液用量。

a-活化pH;b-偶联pH;c-抗体稀释液;d-抗体用量
图2 探针制备条件优化
Fig.2 Optimization of probe preparation conditions
注:红色虚线框内为优化后所得的最优条件,M为mol/L的缩写(下同)。
2.1.1.4 封闭剂的选择
选择合适的封闭剂不仅能加强TrFM-抗体结合物的结构稳定性,也能在一定程度上提高显色强度[23]。分别采用PEG 4000、脱脂奶粉、BSA、甘氨酸4种封闭剂,优化结果如图3-a所示,以BSA作封闭剂有最好的显色效果。
2.1.1.5 探针复溶液的优化
选取PB、BB、Tris-HCl、PBS作为探针复溶液,其优化结果如图3-b所示,以PB作探针复溶液有着最好的显色强度和抑制率。
2.1.2 试纸条制作条件的优化
2.1.2.1 包被液浓度的选择
为了得到较好的显色强度,提高试纸条的灵敏度,同时尽可能降低cut-off值,避免出现假阴性的现象,本研究优化了试纸条NC膜上的T线包被液浓度,实验对比了4组包被质量浓度:0.13、0.16、0.21、0.32、0.64 mg/mL,结果表明在包被质量浓度为0.32 mg/mL时,试纸条的灵敏度和显色强度达到最佳(图3-c)。
2.1.2.2 样品垫材质的选择
经处理过的吸附性样品垫上浸有缓冲盐和表面活性剂,使样品适合与检测系统相互作用,在同样的前处理方法下,不同的样品垫使试纸条在检测中表现出不同的显色强度,本研究经对比得出选用SB08样品垫效果最佳(图3-d)。
2.1.3 样品前处理提取溶剂优化
米酵菌酸为长链脂肪酸,其疏水基团占分子绝大部分。因此,米酵菌酸在水中的溶解度很小。实验分别采用0.1 mol/L的PB、甲醇、乙酸乙酯和乙腈作为样品前处理的提取溶剂。结果表明,PB作为提取溶剂时样品液中基质效应带来的干扰较大,显著抑制了荧光检测信号。采用甲醇作为提取溶剂时,阴性样品T线显色弱而阳性样品T线显色较强,出现了假阴性和假阳性的现象。采用乙酸乙酯和乙腈作为提取溶剂时,荧光信号比值较为合理,但是乙腈样品的抑制率较低。综上所述,选取乙酸乙酯作为样品前处理的提取溶剂(图3-e)。

a-封闭剂种类;b-复溶液种类;c-包被液浓度;d-样品垫种类;e-样品提取液种类
图3 探针制备优化+试纸条优化
Fig.3 Optimization of probe preparation, test strip optimization and sample extraction
2.2 方法验证与评价
2.2.1 灵敏度
以线性检出范围、cut-off值、检测限(limit of detection,LOD)和定量限(limit of quantitation,LOQ)值来评价该检测方法的灵敏度。用PB制备0、0.1、0.3、0.5、0.7、1.0、1.5、2.0、4.0、8.0、16.0 μg/kg系列浓度米酵菌酸溶液,每个水平重复检测3次。使T线消失的最低浓度为cut-off值。如图4-a所示,当BA含量达到6 μg/kg时,试纸条上的T线消除,因此cut-off值为6.0 μg/kg。测定各浓度的B/B0值(B是阳性样品的T/C值,B0是阴性样品的T/C值),以浓度的对数为横坐标,其相应的B/B0值为纵坐标,绘制标准曲线,以半抑制(抑制率为50%)浓度为IC50值。
抑制率![]()
(1)
式中:B是阳性样品的T/C值,B0是阴性样品的T/C值。
LOD和LOQ分别取20个阴性样品的B/B0值的平均值加上3倍和10倍标准偏差所获得的相应浓度[24]。最终的线性拟合结果显示,本研究建立的检测方法LOD值为0.5 μg/kg,LOQ值为1.0 μg/kg,在1.0~8.0 μg/kg线性关系良好,线性方程为y=-0.55x+0.62,拟合优度R2为0.992(图4-b)。
2.2.2 特异性
以该方法对食品中常见的其他毒素进行检测,观察是否有交叉反应的发生。将黄曲霉毒素B1(aflatoxin B1,AFB1)、伏马菌素B1(fumonisin B1,FB1)、赭曲霉毒素A(ochratoxins,OTA)、呕吐毒素(deoxynivalenol,DON)、T-2毒素(trichothecenes,TS)、毒黄素(toxoflavin,TF)、玉米赤霉烯酮(zearalenone,ZEN)等毒素用0.01 mol/L pH 7.4 PB缓冲液稀释至浓度为1 000.0 μg/kg,将米酵菌酸稀释为10 μg/kg,通过比较BA阴性及阳性试纸条的T/C值来评价方法的特异性。结果显示BA在较低浓度10.0 μg/kg下,形成了对T线的强抑制,T/C值极低,检测结果定性解读为强阳性,而其他毒素在较高浓度1 000.0 μg/kg下,却并没有形成对T线的抑制,检测结果定性解读为阴性。以上表明该方法特异性良好,与其他毒素无交叉反应(图4-d)。
2.2.3 仪器确证
首先对3、6、30 μg/kg梯度水平加标的米粉、木耳、银耳样品进行LC-MS/MS法的检测,每个梯度水平进行6个平行检测,然后与本研究的方法进行检测结果的比对。2种方法测得结果的R2为0.993(图4-c),实验表明本文建立的方法与GB 5009.189—2023《食品安全国家标准 食品中米酵菌酸的测定》中LC-MS/MS法的检测结果相关性良好。通过多梯度、多样品平行的方法验证,能够表明本研究建立方法的准确性和精确性良好。
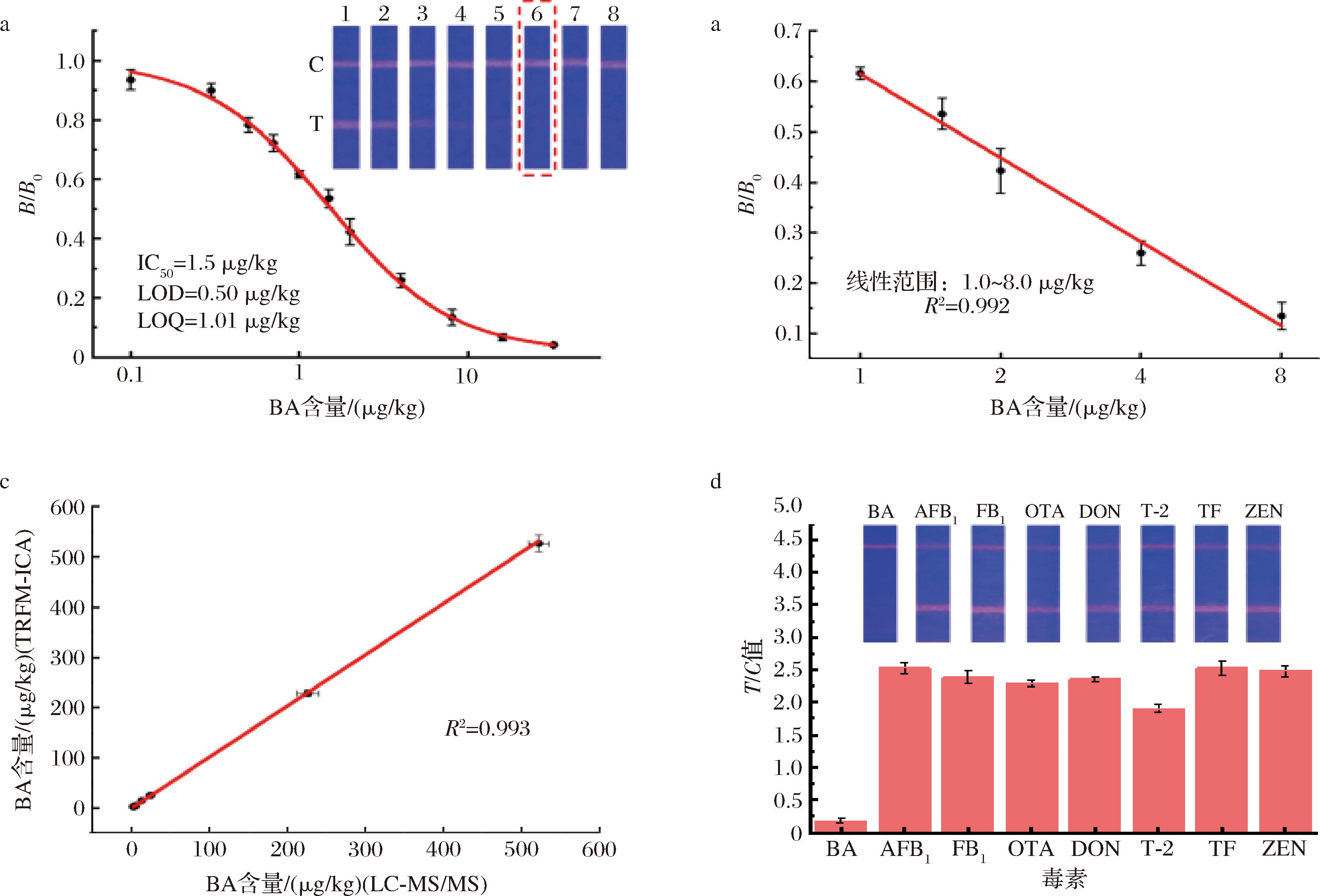
a-标准曲线;b-线性范围;c-仪器确证;d-特异性实验
图4 检测方法性能评价
Fig.4 Performance evaluation of time-resolved fluorescence immunochromatography
2.2.4 加标回收实验
应用项目建立的方法对阴性样品米粉、木耳、银耳进行加标回收实验,选取LOQ值以上的低浓度水平、cut-off浓度邻近值、以及高浓度水平为依据,加标水平分别为1.5、5.0、25.0 μg/kg。分别购买并分批处理共3批次样品,每个批次的每个浓度水平重复检测3次,计算添加回收率,从而说明检测方法在不同批次食品基质间表现出的检测稳定性。其结果如表1所示,3种样品的添加回收率在94.0%~107.9%,变异系数为1.3%~6.5%,这说明数据的波动程度相对较小,变化范围相对有限,检测方法的稳定性和准确性良好,适用于对精度要求较高的场景。在实际的应用场景中,对于准确性和精度要求极高的情况,可先使用本法快速进行大规模筛查,对于可疑样品再进行传统仪器检测法的重复确证。
表1 实际样品检测结果(n=9)
Table 1 Actual sample test results(n=9)
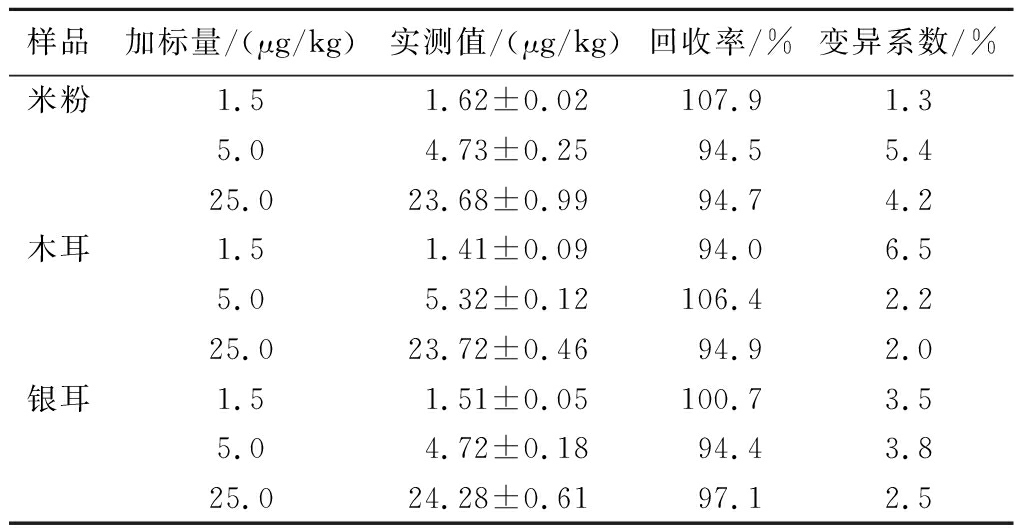
样品加标量/(μg/kg)实测值/(μg/kg)回收率/%变异系数/%米粉1.51.62±0.02107.91.35.04.73±0.2594.55.425.023.68±0.9994.74.2木耳1.51.41±0.0994.06.55.05.32±0.12106.42.225.023.72±0.4694.92.0银耳1.51.51±0.05100.73.55.04.72±0.1894.43.825.024.28±0.6197.12.5
2.2.5 试纸条稳定性评价
将试纸条置于45 ℃的条件下进行保存,进行加速稳定性实验,图5显示了随着时间推迟,试纸条在相同检测条件下的变化,结果表明试纸条稳定性良好。
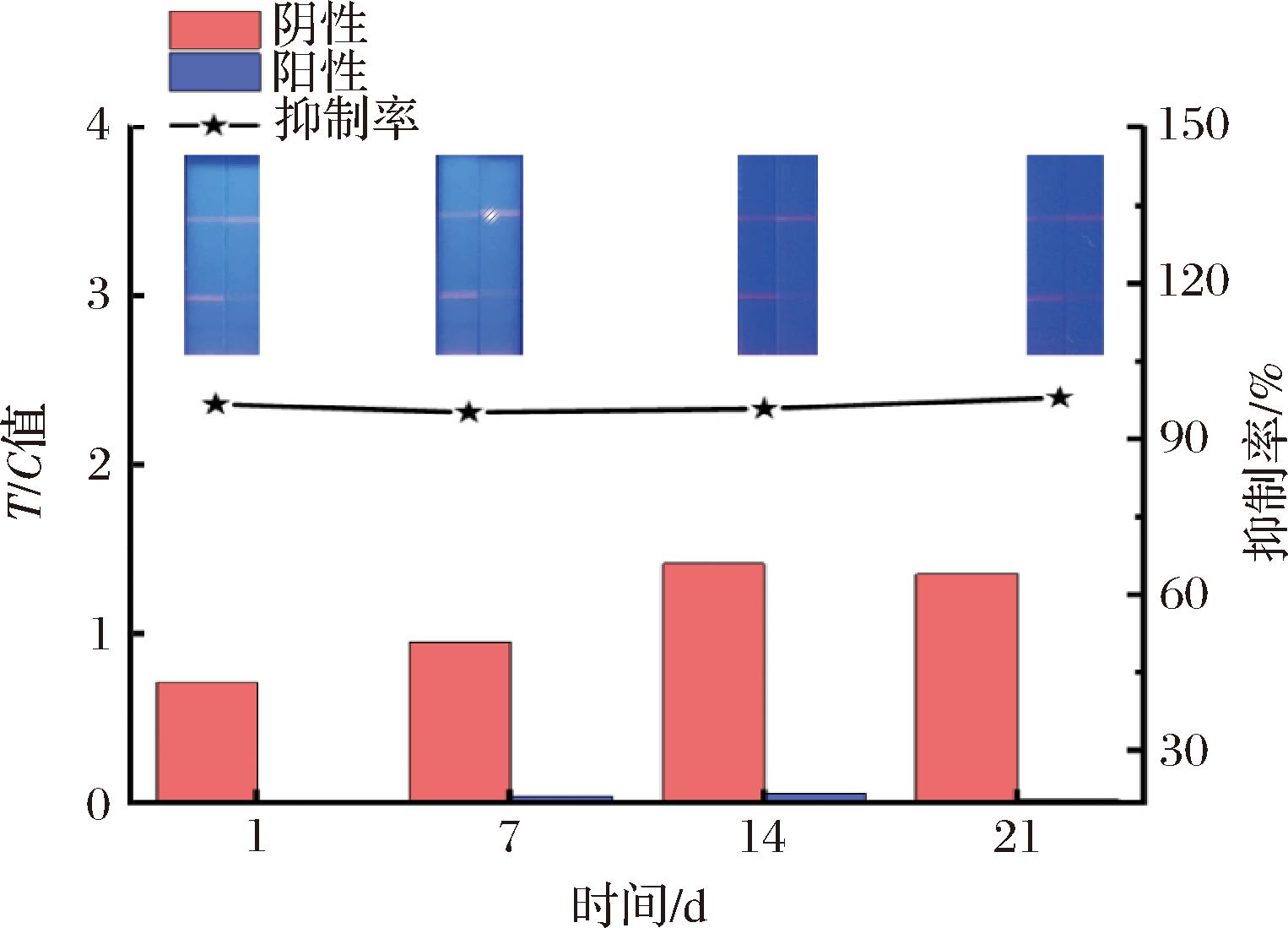
图5 加速稳定性实验
Fig.5 Accelerated stability test
3 结论与讨论
本研究建立了一种针对米粉、木耳、银耳样品中米酵菌酸的时间分辨荧光微球定量免疫层析检测方法。通过一系列条件的优化,包括TrFM活化pH值,偶联pH值,抗体稀释液、抗体用量、封闭剂等探针制备过程的选择,试纸条制作的优化以及样品前处理提取溶剂的筛选等,确定了方法的最佳条件,对方法的灵敏度、特异性、质谱法对比及加标回收试验进行评价。结果表明,方法的LOD值为0.5 μg/kg,LOQ值为1.0 μg/kg,定性cut-off值为5.0 μg/kg,灵敏度较高;与常见毒素无交叉反应,特异性良好;添加回收率在94.0%~107.9%,变异系数为1.3%~6.5%,方法有良好的准确度和精密度。本研究建立的方法快速、简便,能实现痕量检测,适合于大批量样品的快速筛查鉴定,满足食品安全紧急需要,具有重要的研究意义和应用价值。
[1] FALCONER T M, KERN S E, BRZEZINSKI J L, et al.Identification of the potent toxin bongkrekic acid in a traditional African beverage linked to a fatal outbreak[J].Forensic Science International, 2017, 270:e5-e11.
[2] LYU R G, ZENG W X, ZHANG P D, et al.The toxicokinetic and extracorporeal removal of bongkrekic acid during blood purification therapies:A case report[J].Toxicon, 2023, 233:107275.
[3] 李红艳, 金燕飞, 黄海智, 等.高效液相色谱-二极管阵列检测器结合固相萃取法快速测定食品中米酵菌酸残留[J].食品科学, 2016, 37(24):247-251.LI H Y, JIN Y F, HUANG H Z, et al.Fast determination of bongkrekic acid in foods using mixed-mode weak anion exchange solid phase extraction coupled with high performance liquid chromatography with diode array detection (HPLC-DAD)[J].Food Science, 2016, 37(24):247-251.
[4] 周霞,陈万勤,傅红雪, 等.全自动固相萃取-超高效液相色谱法快速测定食品中米酵菌酸含量[J].安徽农业科学, 2018, 46(8):159-160;182.ZHOU X, CHEN W Q, FU H X, et al.Fast determination of bongkrekic acid in food by auto solid phase extraction-ultra high performance liquid chromatography[J].Journal of Anhui Agricultural Sciences, 2018, 46(8):159-160;182.
[5] LIANG M, CHEN R Q, XIAN Y P, et al.Determination of bongkrekic acid and isobongkrekic acid in rice noodles by HPLC-Orbitrap HRMS technology using magnetic halloysite nanotubes[J].Food Chemistry, 2021, 344:128682.
[6] 周海青,黄素美.UPLC-MS/MS同时检测湿米粉(粉条)中脱氢乙酸、米酵菌酸[J].食品工业, 2024, 45(4):304-307.ZHOU H Q, HUANG S M.Simultaneous determination of dehydroacetic acid and bongkrekic acid in wet rice noodles and wet vermicelli by UPLC-MS/MS[J].The Food Industry, 2024, 45(4):304-307.
[7] 陈梅. 蔬菜水果农药残留检测技术及质量安全管理[J].食品安全导刊, 2020(15):139.CHEN M.Detection technology and quality safety management of pesticide residues in vegetables and fruits[J].China Food Safety Magazine, 2020(15):139.
[8] 邢玮玮. 酶联免疫吸附法在食品安全检测中的应用综述[J].柳州职业技术学院学报, 2018, 18(1):121-125.XING W W.Application of ELISA in food safety determination[J].Journal of Liuzhou Vocational &Technical College, 2018, 18(1):121-125.
[9] CUI H F, WU W W, LI M M, et al.A highly stable acetylcholinesterase biosensor based on chitosan-TiO2-graphene nanocomposites for detection of organophosphate pesticides[J].Biosensors and Bioelectronics, 2018, 99:223-229.
[10] 李伟, 张雪莉, 苏勤, 等.可见近红外光谱的甘蓝叶片毒死蜱农药残留定性分析[J].光谱学与光谱分析, 2022, 42(1):80-85.LI W, ZHANG X L, SU Q, et al.Qualitative analysis of chlorpyrifos pesticide residues in cabbage leaves based on visible near infrared spectroscopy[J].Spectroscopy and Spectral Analysis, 2022, 42(1): 80-85.
[11] 刘源, 张开惠, 王莹莹, 等.多重免疫层析检测技术在食品安全快速检测中的研究进展[J].食品与发酵工业, 2023, 49(1):337-346;360.LIU Y, ZHANG K H, WANG Y Y, et al.Research progress of multiplex immunochromatography assay in food safety rapid detection[J].Food and Fermentation Industries, 2023, 49(1), 337-346;360.
[12] 林津, 龚蕾, 皮江一, 等.食品中米酵菌酸快速检测方法的研究和建立[J].食品科技, 2023, 48(12):299-306.LIN J, GONG L, PI J Y, et al.Study and establishment of a rapid detection method for bongkrekic acid in food[J].Food Science and Technology, 2023, 48(12):299-306.
[13] 曹雪铭, 徐振林, 苏燕瑜, 等.胶体金免疫层析法快速检测食品中的米酵菌酸[J].中国食品学报, 2023, 23(2):309-318.CAO X M, XU Z L, SU Y Y, et al.The rapid detection of bongkrekic acid in foods using colloidal gold immunochromatographic assay[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(2):309-318.
[14] SAHA K, AGASTI S S, KIM C, et al.Gold nanoparticles in chemical and biological sensing[J].Chemical Reviews, 2012, 112(5):2739-2779.
[15] CHEN J Y, LUO P J, LIU Z W,et al.Rainbow latex microspheres lateral flow immunoassay with smartphone-based device for simultaneous detection of three mycotoxins in cereals[J].Analytica Chimica Acta, 2022, 1221:340138.
[16] 张佳林,马立才,侯璐, 等.利用时间分辨荧光免疫层析法同时定量检测玉米中的伏马毒素B1、B2和B3[J].食品工业科技,2024,45(13):265-271.ZHANG J L, MA L C, HOU L, et al.Application of time-resolved fluorescence immunoassay to concurrently quantify fumonisin B1, B2 and B3 in corn[J].Science and Technology of Food Industry, 2024, 45(13):265-271.
[17] TANG X Q, LI P W, ZHANG Q, et al.Time-resolved fluorescence immunochromatographic assay developed using two idiotypic nanobodies for rapid, quantitative, and simultaneous detection of aflatoxin and Zearalenone in maize and its products[J].Analytical Chemistry, 2017, 89(21):11520-11528.
[18] DEGAN P, PODEST A, MONTAGNOLI G.Time-resolved fluoroimmunoassay[J].Molecular Biotechnology, 1999, 13(3):215-222.
A, MONTAGNOLI G.Time-resolved fluoroimmunoassay[J].Molecular Biotechnology, 1999, 13(3):215-222.
[19] LI X M, CHEN X M, WU J X, et al.Portable, rapid, and sensitive time-resolved fluorescence immunochromatography for on-site detection of dexamethasone in milk and pork[J].Foods, 2021, 10(6):1339.
[20] 卢迪莎, 王序, 杨金易, 等.同时检测玉米中黄曲霉毒素B1和赭曲霉毒素A的时间分辨荧光免疫层析试纸条的研制[J].食品科学, 2022, 43(2):2346-2354.LU D S, WANG X, YANG J Y, et al.Development of a time-resolved fluorescence immunochromatographic strip for the simultaneous detection of aflatoxin B1 and ochratoxin A in corn samples[J].Food Science, 2022, 43(2):2346-2354.
[21] 郑佳乐, 何子贤, 黎莹莹, 等.荧光定量免疫层析法测定鸡肉和牛奶中的氯霉素[J].食品安全质量检测学报, 2023, 14(19):20-28.ZHENG J L, HE Z X, LI Y Y, et al.Determination of chloramphenicol in chicken and milk by fluorescence quantitative immunochromatography[J].Journal of Food Safety &Quality, 2023, 14(19):20-28.
[22] 李淼. 基于荧光免疫层析定量检测牛奶中真菌毒素的方法研究及试纸条研制[D].无锡:江南大学,2021.LI M.Research on the method of quantitative detection of mycotoxins in milk based on fluorescent immunochromatography and the development of test strips [D].Wuxi:Jiangnan University, 2021.
[23] 卢中炜. 沙门氏菌检测与分型的免疫层析方法的建立[D].南昌:南昌大学,2023.LU Z W.Establishment of immunochromatographic methods for Salmonella detection and typing [D].Nanchang:Nanchang University, 2023.
[24] ![]() J.Strategy for determination of LOD and LOQ values-Some basic aspects[J].Talanta, 2014, 119:178-180.
J.Strategy for determination of LOD and LOQ values-Some basic aspects[J].Talanta, 2014, 119:178-180.