乙酯是一类由酸(通常是有机酸)和醇通过酯化反应生成的化合物,广泛存在于自然界和工业产品中,具有重要的生物、化学和工业意义。除了其化学性质外,酯类物质在日常生活中的作用也不容忽视。例如,在某些酒类中,酯类物质能够对脑部神经产生舒缓作用,当酒体中的高级醇和乙醇含量保持平衡时,酯类物质的种类和含量越丰富,且高级醇与酯类的比例越协调,就越能减少引起“上头”的可能性[1]。然而,当酯类含量过低时,会影响酒的品质,使其味道变得平淡。其中乙酸乙酯、己酸乙酯、丁酸乙酯和乳酸乙酯四类酯占酒类酯类物质总量的90%以上[2],并被认为是影响酒类品质和风味特征的关键因素。
在酒类酿造过程中,乙酯合成多采用微生物催化法[3],相比于化学合成法,通过微生物合成乙酯不仅可以减少污染,还能提高产量,符合当代可持续发展原则[4]。化学合成乙酯通常是通过乙酸、乙醇以及化学催化剂获得[5],其合成反应是可逆反应,酯化反应速率较慢,加热过程中会导致多种副反应发生[6],此外,化学合成常用以浓硫酸为催化剂,存在着设备腐蚀严重、产物与硫酸分离困难以及产生大量含酸废水,污染环境等问题[4]。相较之下,在酒类酿造中,乙酯的合成通常由酵母在发酵过程中催化完成,酵母的代谢途径和相关酶系对乙酯的合成起着重要作用[7]。尤其是酿酒酵母,它通过葡萄糖代谢生成醇和酸,在相应的酯化酶的作用下合成乙酸乙酯等风味酯类化合物[8]。
随着对酒类风味研究的深入,乙酯化合物的合成代谢逐渐受到广泛关注。酵母在酯化反应中的核心作用已经被广泛研究,并且其基因和酶的调控机制也逐渐被揭示。研究表明,通过调节酿酒酵母的代谢途径、优化发酵条件和添加特定酶系[9],可以有效提高乙酯的产量,进而改善酒的风味和品质。此外,酯化反应的效率和酒体风味的稳定性还受到多种因素的影响,如发酵温度、酵母菌株及其营养环境等[10]。
本综述旨在总结近年来乙酯合成代谢的研究进展,探讨酿酒酵母在乙酯合成中的代谢途径、关键酶和基因,以及影响乙酯合成的主要因素,进一步推动酒类生产中乙酯合成的优化和应用研究。
1 酵母合成乙酯的基本代谢途径
在酒类酿造过程中,乙酯的合成与葡萄糖代谢途径密切相关。葡萄糖通过糖酵解途径转化为葡萄糖-6-磷酸,进一步生成丙酮酸,丙酮酸通过乙醛脱氢酶转化为乙酸,成为乙酯合成的前体[11]。乙酯的合成核心步骤是乙酸与乙醇的酯化反应,该反应通常由乙酸酯酶催化,将乙醇与乙酸结合生成乙酸乙酯。乙酸乙酯是一种挥发性化合物,赋予酒类及其他发酵产品独特的风味和香气。多种微生物(如细菌、霉菌和酵母菌)均能通过不同途径催化酯化反应[12]。目前微生物可以通过以下4个途径实现酯化反应[13](图1)。如酸醇酯化、半缩醛脱氢、单加氧酶催化2-酮类物质生成酯等。其中,酵母菌通过醇酰基转移酶催化生成的酯类,主要参与酒类发酵中的风味物质合成,尤其是浓香型酒类的小分子脂肪酸乙酯合成[14]。
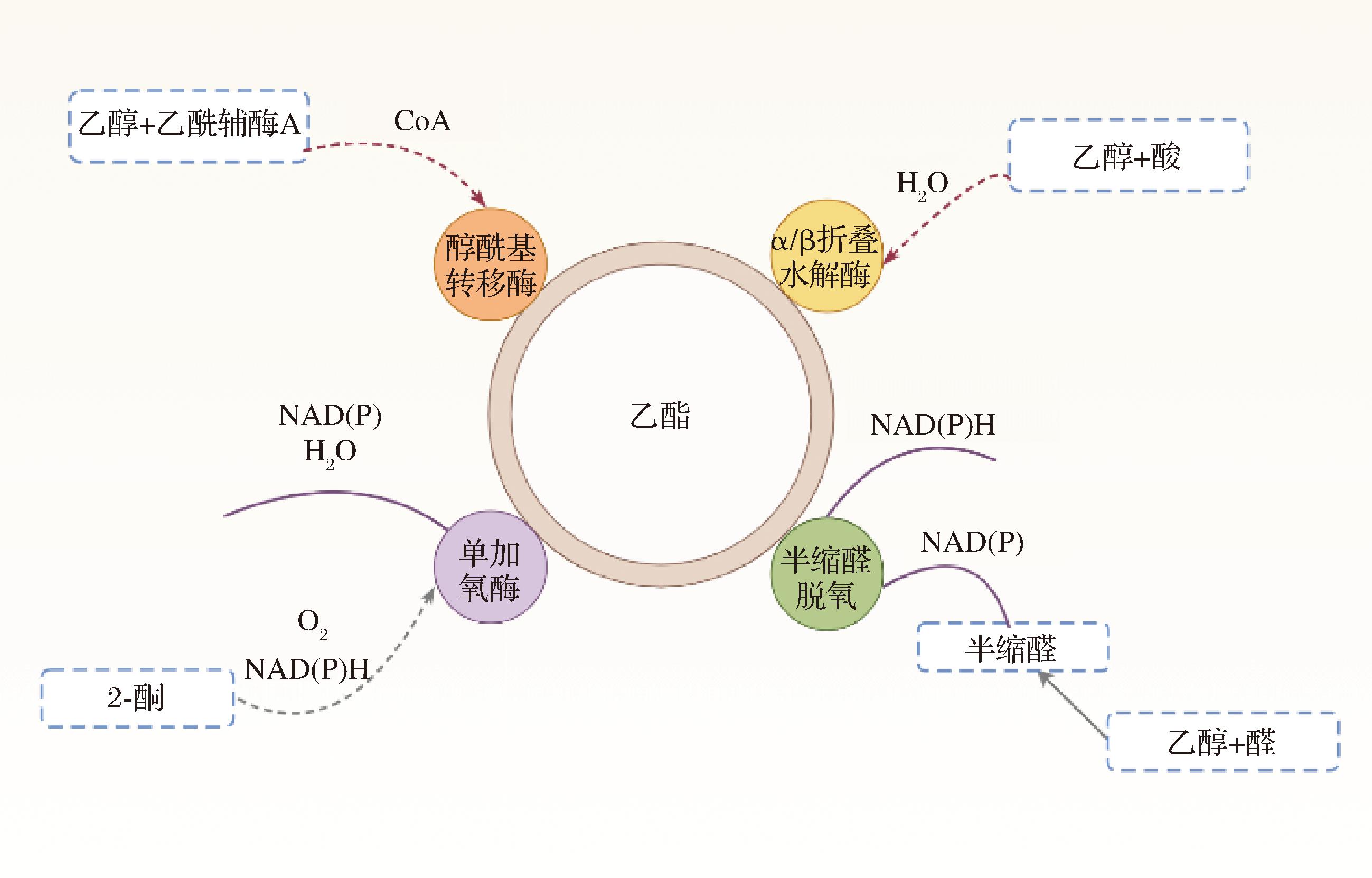
图1 乙酯代谢合成途径
Fig.1 Ethyl ester metabolic synthesis pathway
在酵母细胞内,乙酯的合成和贮存受多重调控。酵母细胞通过调节相关酶的活性,特别是乙酸酯酶,以控制乙酯的生成速率[15]。此外,乙酯可能在细胞内以囊泡或其他形式进行贮存,以适应细胞内外的环境变化。微生物酶催化法合成乙酸乙酯展现出多方面的技术优势:该方法具有较高的催化效率(转化率可达90%以上),反应条件温和(常温常压),且易于精确调控,同时具备操作简便、安全性高等特点,因此越来越受到研究者的关注。然而,底物浓度、最适反应条件、酶的种类和用量等因素限制了乙酸乙酯的合成,如何优化这些参数仍是未来研究的重要方向。
近年来,许多研究探索了不同酵母菌株和微生物的产酯特性。如LÖSER等[16]对马克斯克鲁维酵母DSM 5422进行了研究,发现该菌株所产酯酶能有效催化乙酸乙酯合成。郑树炀等[17]研究了山河陈醋生产中酵母菌的产酯特性,发现某些酵母菌株能显著提高乙酸乙酯含量。这些研究均表明,不同酵母菌株在产酯能力上会存在差异,可能与其内源性酯酶表达水平、底物利用效率及代谢网络调控机制有关,而深入研究酵母菌株的代谢特性和关键酶活性,或可为优化酯类产量提供新的思路。为了进一步提高乙酯的产量和改善酒体风味,近年来的研究重点逐渐转向通过优化发酵条件、调节酵母的代谢途径以及添加特定酶系,甚至应用基因工程对酵母进行精细化调控。这些方法能够显著提高乙酯的合成效率,使酒类产品风味更加丰富。
2 影响酵母乙酯合成的关键酶和基因
酯类物质的合成途径可分为3种主要类型:酯化反应、醇酰基转移酶催化反应和醇脱氢酶催化反应。这些途径涉及不同的酶和底物,通过代谢网络的协同作用,实现酯类化合物的生成。其中,酯化反应是酸和醇直接反应生成酯;醇酰基转移酶途径通过催化酰基辅酶A与醇反应生成酯[18];而醇脱氢酶途径则是通过调节醇的生成,为酯类合成提供底物支持。这些途径的组合在微生物体系中发挥重要作用,尤其在酒类发酵过程中,通过协同调控促进酯类风味物质的生成。目前,普遍认为酵母菌在发酵过程中以葡萄糖为底物,通过糖酵解途径代谢生成乙醇和乙酸,随后在酯酶的催化下生成乙酸乙酯[19]。
酒类中的酯类化合物主要可分为两类:乙酸酯和脂肪酸乙酯。乙酸酯的合成主要由醇乙酰基转移酶催化,其反应底物为乙酰辅酶A和乙醇;而脂肪酸乙酯的合成则依赖于醇酰基转移酶的催化作用,使特定的脂肪酸酰基辅酶A与乙醇结合形成。在酒类酿造微生物中,乙酸乙酯的合成主要受乙酰辅酶A醇乙酰基转移酶活性调控[20]。在这一过程中,醇脱氢酶及其相关基因对乙醇的生成和乙酯合成有直接影响。醇脱氢酶通过催化乙醛还原为乙醇,提供了酯化反应的底物乙醇,其活性和表达水平对乙酯的最终产量至关重要[11]。此外,水解酶及其相关基因也在乙酯合成中发挥重要作用。在酯的合成过程中,酯可能会发生水解反应,水解酶能够催化乙酰辅酶A和其他酰基辅酶A的水解,影响细胞内这些底物的浓度,从而调控乙酯的生成。尤其是在酒类酿造微生物中,乙酸乙酯的生成主要受乙酰辅酶A、醇乙酰基转移酶活性,以及醇脱氢酶和水解酶活性的综合影响。所以调控以上的相关酶及其相关基因可以对酵母合成乙酯产生一定影响。
2.1 乙酰辅酶A及相关基因对酵母合成乙酯的影响
对于酒类发酵来说,乙酸乙酯的生成依赖于乙酰辅酶A和乙醇的底物浓度,以及醇乙酰基转移酶的酶活性。在酿酒酵母细胞中,乙酰辅酶A是最丰富的酰基辅酶A,广泛分布于细胞核、细胞质、线粒体和过氧化物酶体等多个亚细胞区室[21]。乙酰辅酶A主要通过丙酮酸代谢途径在细胞中合成,部分通过丙酮酸脱氢酶反应在线粒体内生成,而少量则由ATP直接激活乙酸,并通过转酰基酶形成(图2)。
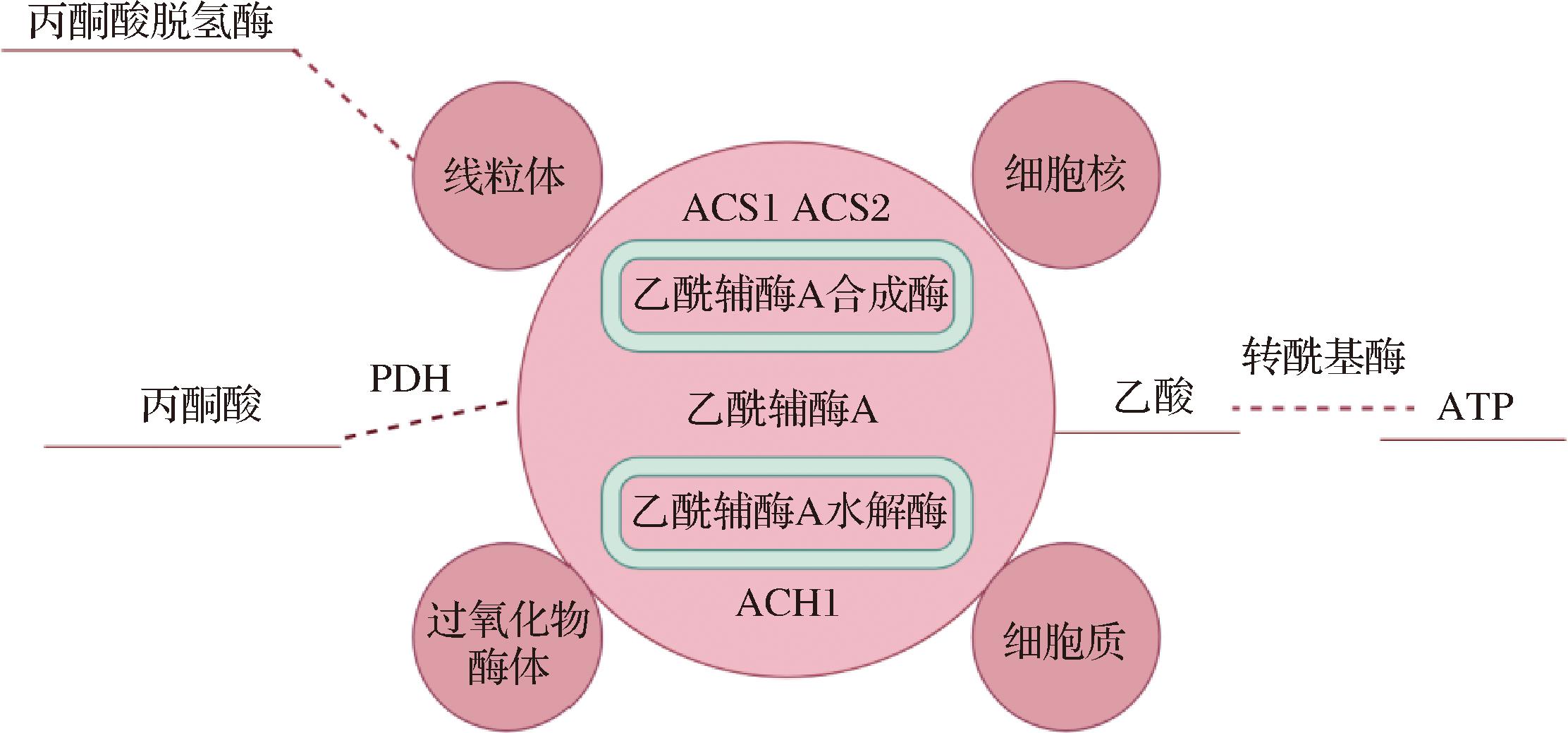
图2 乙酰辅酶A形成途径
Fig.2 Acetyl-CoA formation pathway
乙酰辅酶A合成酶由ACS1和ACS2基因编码,而乙酰辅酶A水解酶由ACH1基因编码,催化乙酰辅酶A水解为乙酸和辅酶A,调节细胞内乙酰辅酶A的水平[22]。通过调控这些基因,可以有效影响乙酰辅酶A的合成和降解,进而调节乙酸乙酯的生成。近年来,许多研究致力于通过基因工程提高酿酒酵母中乙酰辅酶A的含量,从而促进乙酸乙酯的合成。例如,SHI等[23]使用不同的终止子来优化乙酰辅酶A合成酶(ACS1/2)的表达,以增加酵母中乙酰-CoA的含量。郑楠等[21]通过敲除ACH1基因降低乙酰辅酶A的降解,并通过过表达ACS1和ACS2基因构建了工程菌株。结果显示,该工程菌株的乙酸乙酯的生成量分别比亲本菌株提高了26.12%和23.70%。CHEN等[24]发现基因工程酿酒酵母菌株过表达乙酰-CoA合成酶基因ACS1,可用于高产乙酸乙酯。
上述研究均围绕乙酰辅酶A的代谢调控展开,然而在具体实施上存在差异。SHI等[23]主要关注终止子的优化,通过调节ACS1/ACS2的转录水平提高乙酰辅酶A合成,而郑楠等[21]采用了更加直接的策略,通过敲除ACH1降低乙酰辅酶A的降解,结合过表达ACS1/ACS2来增强乙酸乙酯的合成能力。两者的研究均证明,提升乙酰辅酶A供给的策略是有效的,但各自的优化重点不同。尽管CHEN等[24]的研究同样通过ACS1过表达来提高乙酸乙酯产量,但相较于郑楠等[21]的研究,其方法更为单一,仅依赖于乙酰辅酶A的合成增强,而未结合降解抑制策略。因此,郑楠等[21]研究中的菌株在乙酸乙酯的提升幅度上更为显著。这说明,在提高乙酸乙酯合成时,仅增加乙酰辅酶A合成可能并不足够,还需配合减少其降解,以维持更高的胞内乙酰辅酶A水平。此外,由于乙酰辅酶A不仅参与酯类合成,还涉及脂肪酸代谢、三羧酸循环等关键代谢途径,过度调控其代谢流向可能会对酵母的生长状态和代谢平衡产生影响。因此,如何在维持细胞稳态的同时提高乙酸乙酯的合成,是未来研究需要关注的问题。可借助代谢工程、多组学技术,进一步优化乙酰辅酶A的代谢流,提高酒类产品的风味质量。
2.2 醇酰基转移酶及相关基因对酵母合成乙酯的影响
醇酰基转移酶的活性是酯类合成过程中的关键决定因素。乙酸酯,如乙酸异戊酯和乙酸乙酯,是酒精饮料的主要香气成分。它们是由乙酰辅酶A和相应的醇通过醇乙酰转移酶合成的,并对反应因素进行特定控制[25]。虽然这些因素的具体作用机制仍不完全清楚,但已有研究表明,乙酸盐产量的减少与ATF1基因的转录抑制相关,而ATF1基因编码的醇乙酰转移酶对酯类合成至关重要[26]。
研究发现,不同类型的乙酯合成涉及不同的关键基因。例如,乙酸乙酯的合成主要受ATF1和ATF2基因调控。范光森等[27]研究表明酿酒酵母中ATF1的敲除会显著降低乙酸乙酯的形成[28]。ZHANG等[29]过量表达ATF2基因,显著增加了黄米酒中的乙酸乙酯、乙酸异戊酯和乙酸异丁酯浓度,表明ATF2在乙酸酯生产中起着重要作用。从基因功能来看,ATF1和ATF2均编码醇乙酰基转移酶,但其表达水平、催化效率及底物亲和力可能不同。此外不同酵母菌株可能对ATF1和ATF2依赖程度不同,某些菌株可能主要依赖ATF1,而另一些可能对ATF2的贡献更加敏感。未来研究可以进一步探究ATF1和ATF2的催化机制、调控网络及工业发酵中的应用,以提升酒类产品的风味质量。
此外,从酵母Wickehamomyces anomalus中发现的一种新酶(Eat1),当在酿酒酵母和大肠杆菌中表达时,可以显著提高乙酸乙酯产量[30]。与其他酵母乙酰转移酶不同,Eat1位于酵母线粒体中,这表明其编码序列包含线粒体前序列[31]。纯化的Eat1在与乙醇和乙酰辅酶A共存时表现出酒精乙酰转移酶的活性。在包括酿酒酵母在内的已知乙酸乙酯生产酵母中,Eat1的同源蛋白被证实负责大部分乙酸乙酯的合成,并与现有的醇乙酰转移酶仅有一定亲缘关系。因此,Eat1被认为代表α/β水解酶超家族中的1个新型醇乙酰转移酶家族[32]。该新型酶家族的发现不仅是推动生物基乙酸乙酯生产的重要突破,也为改良酿酒酵母菌株提供了新的方向和工具。在K.marxianus中,乙酯的合成可能通过乙醇与乙酰辅酶A的缩合反应,由 ATF1活性催化完成,也可能通过EAT活性催化实现缩合反应[33]。LÖBS等[34]研究表明,敲除EAT1的菌株几乎完全抑制了乙酸乙酯的生物合成,同时显著减少了乙酸异戊酯和乙酸苯乙酯的合成量。Eat1作为一种新型线粒体定位的醇乙酰基转移酶,在乙酸乙酯合成中发挥了至关重要的作用。其敲除实验表明Eat1是某些酵母菌株乙酸乙酯合成的主要催化酶,并且可能影响其他乙酸酯的合成。与ATF1、ATF2相比,EAT1在结构、功能和代谢网络中的作用存在明显差异,为酵母代谢工程提供了新的研究方向。未来,通过优化EAT1表达、研究其催化机制、结合其他乙酯合成酶的代谢调控策略,可以进一步提升乙酸乙酯的生物合成效率,为酒类发酵工业和生物基化学品生产提供新的解决方案。
在基因工程方面,通过过表达或调控特定基因可以有效提高酯类产量。例如,MA等[35]通过在酿酒酵母中引入丁基辅酶A合成途径和不同的醇酰基转移酶,成功制备了丁酸乙酯。LI等[36]发现,ATF1、ATF2基因的过表达与BAT2基因的缺失组合调控,可以显著提高酯类生成,尤其是在过表达ATF1并缺失BAT2的情况下,进一步提高了酯醇比。CUI等[37]通过在酿酒酵母中过表达ATF1基因,成功获得了1株乙酸乙酯产量是亲本菌株的27.21倍的高产菌株。不同研究通过过表达ATF1/ATF2、缺失BAT2以及引入新代谢途径,成功提高了乙酸乙酯和其他酯类的产量。其中,过表达ATF1是最直接且有效的策略,而优化乙酰辅酶A供给、减少代谢竞争、引入新型酶也为未来的研究提供了重要方向。
2.3 醇脱氢酶及其相关基因影响酵母乙酯合成
醇脱氢酶是一类含锌或铁的酶,能够催化醛或酮还原为醇,并对半缩醛化合物进行氧化反应,参与体内的醇代谢。半缩醛是醇与醛反应生成的中间产物,其中,半缩醛的羟基会被氧化转化为酯类物质,而NAD(P)+作为氢受体在此反应中发挥作用。酿酒酵母中的醇脱氢酶具有多种半缩醛脱氢酶活性,能够催化甲酸甲酯、甲酸乙酯、乙酸甲酯和乙酸乙酯的合成[20]。醇脱氢酶的特异性决定了某些高级醇能够参与酯的合成。因此,醇脱氢酶可能在酵母的产酯过程中发挥间接且显著的作用。在酿酒酵母中,醇脱氢酶基因由ADH1到ADH7组成,编码不同类型的醇脱氢酶。醇脱氢酶的特异性决定了某些高级醇可作为底物参与酯的合成。因此,醇脱氢酶的活性可能对酵母的乙酯生成过程产生间接而显著的影响。刘港等[38]通过用IDHL1替换酿酒酵母丙酮酸脱羧酶基因PDC1构建了改良菌株,显著提高了乳酸乙酯的产量。VAN RIJSWIJCK等[39]研究了3种不同酵母菌体外醇脱氢酶和醇乙酰转移酶的活性,结果表明,这些酶的活性与酯的形成没有显著的相关性。相较之下,这3种酵母的乙酸酯水解酶活性与乙酸酯的生产量之间存在显著的负相关关系。
综上所述,醇脱氢酶在酵母的酯类合成中可能间接发挥作用,主要通过影响高级醇的生成,进而影响酯化底物的供给。然而,醇脱氢酶活性与酯生成的相关性并不稳定,可能受底物竞争、代谢流向、酯水解等多种因素调控。乙酸酯水解酶的活性可能是限制酯积累的关键因素,未来的研究需要在酯的合成与水解之间找到优化的平衡点,从而确保酯的有效积累并提高产量。
2.4 乙酯合成水解酶及其相关基因影响酵母乙酯合成
在酯的合成过程中,酯可能会发生水解反应,这对于最终产物的积累有着重要影响。已有研究表明,由IAH1基因编码的酶负责催化酯的水解,在酿酒过程中起着关键作用。酯的合成与水解之间的平衡,决定了酯类物质的最终含量。SCHNEIDERBANGER等[40]对啤酒生产中最常用的5种小麦啤酒酵母菌株进行了乙酸酯生产能力的评估,研究表明,基因ATF1、ATF2和IAH1在初级发酵期间与乙酸酯的形成有着密切的关联。大多数酵母菌株在24~48 h内ATF1的表达水平显著上升,并伴随酯类产量的增加。在这一过程中,乙酸异戊酯和乙酸乙酯不仅合成量增加,还出现了降解现象,同时IAH1的表达水平也有所提高,通过调控这些基因的表达,可以在合成和水解之间达到理想的平衡。在基因工程方面,通过过表达ATF1基因和敲除IAH1基因,可以显著增加酒中乙酸酯的含量,同时减少异戊醇的含量[41]。这一策略为优化酿酒过程中酯类物质的积累提供了新的途径,也为未来的研究和应用奠定了基础。
综上所述,酯的最终含量受合成与水解的动态平衡调控,ATF1促进合成,而IAH1促进降解。上述研究表明,ATF1在前期表达增强,IAH1在后期表达增加,导致酯类的部分降解。通过过表达ATF1并敲除IAH1,可以有效提高最终乙酸酯的积累量,同时减少异戊醇含量。未来研究可结合基因工程与酿酒工艺优化,通过调控ATF1和IAH1的动态表达,找到酯合成与水解的最优平衡点,提高酒体风味和酯类积累量。
3 酵母菌株选育及协同培养对乙酯合成的影响
除上述的调控关键酶和基因还可以通过筛选酵母菌株及共培养技术提高乙酯产量。FAN等[42]用酿酒酵母Y3401和异常酵母Y3604为原料,对2种酵母混合发酵产生的乙酸乙酯比单一发酵产生的乙酸乙酯多。因此,酿酒酵母与异常酵母的共培养不仅有助于提高乙酸乙酯的产量,还能改善酒的香气和风味。ZHAO等[43]筛选了1株己酸乙酯产率较高的功能菌株发现,在最佳发酵条件下,其合成的己酸乙酯含量高达170.56 mg/L,为酒类产品的实际工业生产提供了优质菌株资源。进一步的研究中,XU等[44]通过获得乙酰-CoA合成酶表达水平提高的进化菌株,实现了乙酸乙酯产量的大幅增加,展现出良好的工业应用前景。程伟等[45]在清香型酒醅中筛选得到1株高产乙酸乙酯的酵母菌株,该菌株的乙酸乙酯产量达248.9 mg/L;许银等[46]将筛选到的酵母菌Y87与麸皮按质量比3∶100添加到酒曲中,乙酸乙酯含量提高36.6%;刘小改等[47]将筛选到的酵母菌J-4用于发酵,结果显示乙酸乙酯的含量提高了50.7%。
除此之外,转基因技术可以提高酿酒酵母乳酸乙酯的产量[48],通过引入丙酰辅酶A转移酶和醇酰基转移酶在酿酒酵母中建立了乳酸乙酯的生物合成途径,结果显示此菌株产生的乳酸乙酯产量达到了(239.53±5.45) mg/L。
综上所述,酵母菌株的筛选与优化是提高乙酯产量的有效手段,不同菌株可能因代谢途径差异导致酯类合成能力不同;共培养技术能通过代谢互补和协同作用促进酯类积累,同时改善风味。结合筛选优质酵母菌株及共培养技术,可以显著提高酵母乙酯的产量。基因工程改造,如优化乙酰辅酶A供应和调整关键酶的表达,可以大幅提高乙酯产量。未来研究应结合合成生物学与工业发酵技术,构建高效酯类生产菌株,推动乙酯在酒类和生物化学工业中的应用。
4 细胞适应性与环境因素
4.1 酵母在不同环境条件下的乙酯产量调整
酵母对不同环境条件下的乙酯产量表现出显著的调整能力。例如,在氧气水平较低的厌氧条件下,酵母更倾向于通过乙醇发酵产生乙酯[49]。这是因为氧气缺乏会阻碍三羧酸循环和呼吸链的正常运作,导致代谢通路向乙醇生成途径转移。而在氧气充足的有氧条件下,酵母可能会减少乙酯产量,因为更多的乙醇被用于产生细胞能量。此外,温度、营养条件、碳源类型等因素也会对酵母乙酯产量产生影响。较高的温度通常会促进酵母的代谢活性,可能导致更高的乙酯产量。而不同类型的碳源(如葡萄糖、果糖、麦芽糖等)可能会对乙酯合成途径产生不同的影响,从而影响乙酯的最终产量。徐丽萍[50]对汉逊酵母的产酯条件进行研究表明,在麦芽汁培养基中添加10%葡萄糖、0.5%乙酸、5%乙醇(体积分数95%),发酵温度30 ℃,发酵时间为3 d,摇瓶转速120 r/min的条件下,酵母的产酯量最高可达1.479 g/L。秦立芹等[51]从酒曲中筛选获得1株高产己酸乙酯的酵母菌株Y9,在高粱酶解液培养基糖度为14°Brix,初始pH 5.0,乙醇体积分数为8%,己酸体积分数为0.04%,诱导温度为22 ℃时,己酸乙酯质量浓度可高达15.0 mg/L,是优化前的3.6倍。
综上所述,不同酵母菌株对环境条件的适应性不同,需针对性优化。并且酵母能够根据不同的环境条件显著调整乙酯的产量,在厌氧条件下,由于氧气缺乏导致代谢途径向乙醇发酵转移,酵母倾向于增加乙酯的生成。而在有氧条件下,酵母更可能将乙醇用于细胞能量的产生,从而减少乙酯的产量。此外,温度、营养条件和碳源类型等因素也对乙酯的生产有重要影响。例如,较高的温度可促进酵母代谢活性,提高乙酯产量;不同碳源类型则会通过影响代谢途径,改变乙酯的最终产量。未来研究应结合环境调控与基因工程手段,以提高乙酯产量,实现工业化应用。
4.2 微生物群体效应对乙酯生产的影响
微生物群体效应指的是不同微生物种群之间的相互作用,该作用会影响酵母的生理特性从而影响乙酯的合成。自2006年在酿酒酵母中发现群体感应以来,这种细胞间的通讯过程开始受到越来越多研究人员的关注,其中,苯乙醇、色醇和酪醇已被证实是酿酒酵母的主要法定量感应分子[52]。在混合发酵过程中,其他微生物的代谢产物和代谢产物的相互作用可能会影响酵母乙酯合成途径的通量,从而改变乙酯的产量和组成。此外,微生物群体中的竞争、共生和拮抗关系也可能影响酵母的生长和代谢,进而影响乙酯的合成。例如,研究发现,在发酵过程中混合使用异常毕赤酵母和植物乳植杆菌能够通过协同代谢效应显著提高包括乙酸乙酯在内的风味化合物的产量[53]。这种微生物间的相互作用增强了与酯类合成相关的酶活性,从而提高了风味化合物的浓度。此外,醋酸菌和酵母在食品发酵中的协作也被证实可以通过生态和酶学动态调节,优化酯类产量[54]。
微生物群体效应对乙酯合成有显著影响,信号分子可调节酵母代谢,提高乙酯合成效率。混合发酵体系中的微生物相互作用(协同、拮抗、共生)可优化乙酯产量,合理选择菌株组合可提升酒体风味。生态调控策略(如优化微生物比例、调控发酵环境)结合合成生物学,可进一步提高乙酯积累,优化工业发酵工艺。未来,应结合合成生态学、代谢工程和智能发酵技术,进一步优化微生物发酵体系,提高乙酯产量,实现更高效的工业应用。
5 结语
本文综述了葡萄糖发酵过程中乙酯的代谢途径,强调了代谢途径中的核心部分。关键酶及基因部分系统性地介绍了醇酰基转移酶、醇脱氢酶等参与乙酯合成的关键因子,以及它们在酒类酿造中乙酯产生中的调控作用。探讨了酵母乙酯合成在生物制造和工业生产中的前景,基因工程和代谢工程对提高乙酯产量的潜在贡献,细胞适应性和环境因素方面突出了酵母乙酯合成在不同环境条件下的调整能力,以及微生物群体效应对乙酯产量的影响。本综述为酒类酿造中酵母乙酯合成代谢研究提供了深入洞察,为未来的研究和应用奠定了基础。
总体上看,酒类酿造中酵母乙酯合成代谢的研究取得了显著的进展,但仍面临着许多挑战和机遇。如代谢途径的复杂性与交互调控机制、酯合成与水解之间的动态平衡、微生物群体效应与共培养策略、环境调控及智能发酵技术,未来的研究应该紧密结合生物工程、代谢工程和环境科学等领域的最新技术和方法,深入探索乙酯合成的调控机制和应用潜力,推动这一领域的发展,为人类社会的可持续发展做出更大的贡献。
[1] 魏亚楠. 酿酒酵母中酯合成酶功能的研究[D].天津:天津科技大学, 2021.WEI Y N.Study on the function of ester synthase in Saccharomyces cerevisiae[D].Tianjin:Tianjin University of Science and Technology,2021.
[2] 郭学武, 范恩帝, 马冰涛, 等.中国白酒中微量成分研究进展[J].食品科学, 2020, 41(11):267-276.GUO X W, FAN E D, MA B T, et al.Recent progress in micro components of Chinese Baijiu[J].Food Science,2020, 41(11):267-276.
[3] XU Y Q, ZHAO J R, LIU X, et al.Flavor mystery of Chinese traditional fermented Baijiu:The great contribution of ester compounds[J].Food Chemistry, 2022, 369:130920.
[4] 赵禄强, 朱桂生, 王忠华, 等.离子液体及其催化合成乙酸乙酯研究进展[J].山东化工, 2018, 47(5):69-70.ZHAO L Q, ZHU G S, WANG Z H, et al.Ionic liquids and their catalytic synthesis of ethyl acetate[J].Shandong Chemical Industry, 2018, 47(5):69-70.
[5] 汪萍, 赵蒙蒙, 易承学, 等.化学实验技术竞赛中乙酸乙酯合成实验的思考[J].山东化工, 2024, 53(6):192-194.WANG P,ZHAO M M,YI C X, et al.Reflection on the experiment of ethyl acetate synthesis in chemical experimental technology competition[J].Shandong Chemical Industry, 2024, 53(6):192-194.
[6] 鲍文亮, 林美凤, 刘丽君.水浴条件下乙酸乙酯制备实验的改进[J].化学教学, 2019(10):64-66.BAO W L,LIN M F, LIU L J. Improvement of the experiment of preparing ethyl acetate under the condition of water bath[J].Education in Chemistry, 2019(10):64-66.
[7] CHEN C, XIONG Y, XIE Y H, et al.Metabolic characteristics of lactic acid bacteria and interaction with yeast isolated from light-flavor Baijiu fermentation[J].Food Bioscience, 2022, 50:102102.
[8] 陈雪, 孟勤燕, 齐欢, 等.高产乙酸乙酯酵母菌株的筛选[J].酿酒科技, 2020(1):96-102.CHEN X, MENG Q Y, QI H, et al.Screening of yeast strains with high-yield of ethyl acetate[J].Liquor-Making Science &Technology, 2020(1):96-102.
[9] DONG J, WANG P F, FU X M, et al.Increase ethyl acetate production in Saccharomyces cerevisiae by genetic engineering of ethyl acetate metabolic pathway[J].Journal of Industrial Microbiology &Biotechnology, 2019, 46(6):801-808.
[10] COMITINI F, AGARBATI A, CANONICO L, et al.Yeast interactions and molecular mechanisms in wine fermentation:A comprehensive review[J].International Journal of Molecular Sciences, 2021, 22(14):7754.
[11] 肖冬光. 白酒酿造过程中酯类物质形成机理探讨[J].酿酒科技, 2022(9):17-24.XIAO D G.Discussion on the formation mechanism of ester compounds in the production process of Baijiu[J].Liquor-Making Science &Technology, 2022, (9):17-24.
[12] 王晓程, 徐友强, 李秀婷, 等.中国传统发酵食品来源典型小分子脂肪酸酯合成微生物及酶的研究进展[J].中国食品学报, 2021, 21(4):345-355.WANG X C, XU Y Q, LI X T, et al.Research progress in microorganisms and enzymes for synthesis of typical small molecule fatty acid esters from traditional Chinese fermented foods[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(4):345-355.
[13] KRUIS A J, BOHNENKAMP A C, PATINIOS C, et al.Microbial production of short and medium chain esters:Enzymes, pathways, and applications[J].Biotechnology Advances, 2019, 37(7):107407.
[14] LI W, WANG J H, ZHANG C Y, et al.Regulation of Saccharomyces cerevisiae genetic engineering on the production of acetate esters and higher alcohols during Chinese Baijiu fermentation[J].Journal of Industrial Microbiology &Biotechnology, 2017, 44(6):949-960.
[15] 马文瑞. 石川中泽酵母GDMCC 60786产乙酸乙酯机制的解析及其应用研究[D].天津:天津科技大学, 2023.MA W R.Study on metabolic mechanism and application of ethyl acetate production by Nakazawaea ishiwadae GDMCC 60786[D].Tianjin:Tianjin University of Science and Technology,2023.
[16] LÖSER C, URIT T, KEIL P, et al.Studies on the mechanism of synthesis of ethyl acetate in Kluyveromyces marxianus DSM 5422[J].Applied Microbiology and Biotechnology, 2015, 99(3):1131-1144.
[17] 郑树炀, 曹彦军, 吕玉柱, 等.山河陈醋生产中酵母菌产酒产酯特性研究[J].中国调味品, 2018, 43(4):21-27.ZHENG S Y,CAO Y J,LV Y Z, et al.Study on the characteristics of alcohol and ester production of yeast in Shanhe vinegar[J].China Condiment, 2018, 43(4):21-27.
[18] ZHOU W H, KONG W B, YANG C, et al.Alcohol acyltransferase is involved in the biosynthesis of C6 esters in apricot (Prunus armeniaca L.) fruit[J].Frontiers in Plant Science, 2021, 12:763139.
[19] 石文琪. 高产风味酯酿酒酵母菌株的选育[D].天津:天津科技大学, 2021.SHI W Q.Breeding of flavor esters high-producing Saccharomyces cerevisiae strains[D].Tianjin:Tianjin University of Science and Technology,2021
[20] 彭立影, 刘功良, 费永涛, 等.产酯酵母及其产酯关键酶的研究进展[J].食品与发酵工业, 2020, 46(14):275-282.PENG L Y,LIU G L,FEI Y T, et al.Research progress of ester-producing yeast and its key enzymes for esters synthesis[J].Food and Fermentation Industries, 2020, 46(14):275-282.
[21] 郑楠, 郭庆焕, 何亚辉, 等.乙酰辅酶A含量对酿酒酵母乙酸乙酯合成的影响[J].中国酿造, 2018, 37(5):150-156.ZHENG N, GUO Q H, HE Y H, et al.Effect of acetyl-Co A content on ethyl acetate synthesis in Saccharomyces cerevisiae[J].China Brewing, 2018, 37(5):150-156.
[22] ZHANG S J, GUO F, YAN W, et al.Perspectives for the microbial production of ethyl acetate[J].Applied Microbiology and Biotechnology, 2020, 104(17):7239-7245.
[23] SHI W Q, LI J, CHEN Y F, et al.Metabolic engineering of Saccharomyces cerevisiae for ethyl acetate biosynthesis[J].ACS Synthetic Biology, 2021, 10(3):495-504.
[24] CHEN Y, SHI W, ZHANG G, et al.New genetically engineered Saccharomyces cerevisiae strain useful in high-yield ethyl acetate comprising engineered strain heterologous overexpresses acetaldehyde dehydrogenase gene, acetyl-CoA synthase gene and alcohol acyltransferase gene:China, CN113416664A[P].2025-3-20.
[25] 康新玥. 酿酒酵母中合成巴豆酸乙酯的研究[D].天津:天津科技大学, 2022.KANG X Y.Biosynesis of ethyl crotonate in Saccharomyces cerevisiae[D].Tianjin:Tianjin University of Science and Technology,2022.
[26] YOSHIMOTO H, BOGAKI T.Mechanisms of production and control of acetate esters in yeasts[J].Journal of Bioscience and Bioengineering, 2023, 136(4):261-269.
[27] 范光森, 王允中, 刘朋肖, 等.醇酰基转移酶催化合成白酒中的乙酸乙酯研究进展[J].中国食品学报, 2020, 20(11):294-304.FAN G S, WANG Y Z, LIU P X, et al.Research progress in catalytic synthesis of ethyl acetate in Baijiu by alcohol acyltransferase[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(11):294-304.
[28] 李秋晓, 庞泽敏, 张茹, 等.高产乙酸乙酯酵母的筛选鉴定及发酵条件优化[J].中国酿造, 2024, 43(6):80-87.LI Q X,PANG Z M,ZHANG R, et al.Screening and identification and fermentation conditions optimization of high yield ethyl acetate yeast[J].China Brewing, 2024, 43(6):80-87.
[29] ZHANG J, ZHANG C, QI Y, et al.Acetate ester production by Chinese yellow rice wine yeast overexpressing the alcohol acetyltransferase-encoding gene ATF2[J].Genetics and Molecular Research, 2014, 13(4):9735-9746.
[30] KRUIS A J, LEVISSON M, MARS A E, et al.Ethyl acetate production by the elusive alcohol acetyltransferase from yeast[J].Metabolic Engineering, 2017, 41:92-101.
[31] KRUIS A J, BOHNENKAMP A C, NAP B, et al.From Eat to trEat:Engineering the mitochondrial Eat1 enzyme for enhanced ethyl acetate production in Escherichia coli[J].Biotechnology for Biofuels, 2020, 13:76.
[32] PATINIOS C, LANZA L, CORINO I, et al.Eat1-like alcohol acyl transferases from yeasts have high alcoholysis and thiolysis activity[J].Frontiers in Microbiology, 2020, 11:579844.
[33] LÖSER C,URIT T,KEIL P,et al.Studies on the mechanism of synthesis of ethyl acetate in Kluyveromyces marxianus DSM 5422[J].Applied Microbiology and Biotechnology,2015,99(3):1131-1144.
[34] LÖBS A K, SCHWARTZ C, THORWALL S, et al.Highly multiplexed CRISPRi repression of respiratory functions enhances mitochondrial localized ethyl acetate biosynthesis in Kluyveromyces marxianus[J].ACS Synthetic Biology, 2018, 7(11):2647-2655.
[35] MA Y R, DENG Q B, DU Y J, et al.Biosynthetic pathway for ethyl butyrate production in Saccharomyces cerevisiae[J].Journal of Agricultural and Food Chemistry, 2020, 68(14):4252-4260.
[36] LI W, CUI D Y, WANG J H, et al.Overexpression of different alcohol acetyltransferase genes with BAT2 deletion in Saccharomyces cerevisiae affects acetate esters and higher alcohols[J].European Food Research and Technology, 2018, 244(3):555-564.
[37] CUI D Y, GE J L, SONG Y M, et al.Regulating the ratio of higher alcohols to esters by simultaneously overexpressing ATF1 and deleting BAT2 in brewer’s yeast Saccharomyces pastorianus[J].Food Bioscience, 2021, 43:101231.
[38] 刘港, 李洁, 任津莹, 等.产乳酸乙酯酿酒酵母菌株的构建[J].中国酿造, 2018, 37(7):72-77.LIU G,LI J,REN J Y, et al.Construction of ethyl lactate-producing Saccharomyces cerevisiae[J].China Brewing, 2018, 37(7):72-77.
[39] VAN RIJSWIJCK I M H, KRUIS A J, WOLKERS-ROOIJACKERS J C M, et al.Acetate-ester hydrolase activity for screening of the variation in acetate ester yield of Cyberlindnera fabianii, Pichia kudriavzevii and Saccharomyces cerevisiae[J].LWT, 2019, 104:8-15.
[40] SCHNEIDERBANGER H, KOOB J, POLTINGER S, et al.Gene expression in wheat beer yeast strains and the synthesis of acetate esters[J].Journal of the Institute of Brewing, 2016, 122(3):403-411.
[41] ZHANG J W, ZHANG C Y, DAI L H, et al.Effects of overexpression of the alcohol acetyltransferase-encoding gene ATF1 and disruption of the esterase-encoding gene IAH1 on the flavour profiles of Chinese yellow rice wine[J].International Journal of Food Science &Technology, 2012, 47(12):2590-2596.
[42] FAN G S, TENG C, XU D, et al.Enhanced production of ethyl acetate using co-culture of Wickerhamomyces anomalus and Saccharomyces cerevisiae[J].Journal of Bioscience and Bioengineering, 2019, 128(5):564-570.
[43] ZHAO H, DU B H, ZHAO P J, et al.Analysis of ester-producing performance in high-yield ethyl hexanoate yeast and the effect on metabolites in bio- enhanced Daqu, the starter for Baijiu and other traditional fermented foods[J].Journal of Applied Microbiology, 2024, 135(4):lxae081.
[44] XU X, NIU C T, LIU C F, et al.Screening lager yeast with higher ethyl-acetate production by adaptive laboratory evolution in high concentration of acetic acid[J].World Journal of Microbiology and Biotechnology, 2021, 37(7):125.
[45] 程伟, 彭兵, 汪焰胜, 等.清香型酒醅中一株产乙酸乙酯酵母菌的筛选及其应用性能分析[J].酿酒, 2018, 45(5):43-47.CHENG W, PENG B, WANG Y S, et al.Screening of one yeast strain with high-yield of ethyl acetate from Fen-flavor liquor fermenting-grains and analysis of its application performance[J].Liquor Making, 2018, 45(5):43-47.
[46] 许银, 杨强, 张龙, 等.高产乙酸乙酯酵母菌的筛选及其在清香型小曲白酒生产中的应用[J].中国酿造, 2021, 40(8):76-80.XU Y, YANG Q, ZHANG L, et al.Screening of high-yield ethyl acetate yeast and its application in the light-flavor Xiaoqu Baijiu production[J].China Brewing, 2021, 40(8):76-80.
[47] 刘小改, 马美荣, 周林艳, 等.高产乙酸乙酯酵母菌筛选及固态发酵应用研究[J].中国酿造, 2020, 39(10):79-83.LIU X G,MA M R,ZHOU L Y, et al.Screening of yeast with high-yield of ethyl acetate and its application in the solid-state fermentation[J].China Brewing, 2020, 39(10):79-83.
[48] REN J Y, LIU G, CHEN Y F, et al.Enhanced production of ethyl lactate in Saccharomyces cerevisiae by genetic modification[J].Journal of Agricultural and Food Chemistry, 2020, 68(47):13863-13870.
[49] 龚瑞. 酿酒酵母中链脂肪酸乙酯的合成调控研究[D].天津:天津科技大学, 2017.GONG R.Study on synthesis regulation of medium chain fatty acid ethyl esters in Saccharomyces cerevisiae[D].Tianjin:Tianjin University of Science and Technology, 2017.
[50] 徐丽萍. 泸型大曲中产酯酵母的筛选鉴定及产酯条件优化[J].中国酿造, 2016, 35(2):74-78.XU L P.Screening and identification of ester-producing yeast in Luzhou Daqu and optimization of ester production conditions[J].China Brewing, 2016, 35(2):74-78.
[51] 秦立芹, 殷欢, 成柳洁, 等.一株高产己酸乙酯酵母菌株的筛选、鉴定及发酵条件优化[J].食品与发酵工业, 2022, 48(1):55-61.QIN L Q,YIN H,CHENG L J, et al.A yeast isolate with high yield of ethyl caproate:Screening, identification and fermentation optimization[J].Food and Fermentation Industries, 2022, 48(1):55-61.
[52] LI L B, PAN Y R, ZHANG S S, et al.Quorum sensing:Cell-to-cell communication in Saccharomyces cerevisiae[J].Frontiers in Microbiology, 2023, 14:1250151.
[53] FAN P X, LIANG X Y, FEI Y T, et al.Effect of mixed strains on microbial community and flavor metabolites in fermentation process of Chi-flavor Baijiu[J].Foods, 2024, 13(21):3497.
[54] HAN D, YANG Y S, GUO Z T, et al.A review on the interaction of acetic acid bacteria and microbes in food fermentation:A microbial ecology perspective[J].Foods, 2024, 13(16):2534.