糖基化是自然界有机生命体内一类普遍且重要的修饰反应,参与细胞信号传递和免疫应答等多种生命过程。糖基化对生物大分子(如蛋白质、脂质和核酸)和小分子(如激素、代谢产物等)的生理功能和活性均有调控作用[1-2]。在动物、植物、微生物等多种生物体内,糖基化在维持细胞功能、器官发育以及应对环境压力等方面发挥着关键作用[3]。例如,癌症、免疫性疾病等与蛋白的异常糖基化相关[4]。另一方面,糖基化可以改善小分子的溶解度、稳定性和生物活性。例如,通过糖基化修饰大豆苷元,生成的大豆苷元7-O-三葡萄糖苷溶解度提高了7.5×103倍;用甘露糖对紫杉醇胶束进行糖基修饰,修饰后的紫杉醇在移植瘤小鼠肝脏中的积存量较高,表现出更高的靶向性[5-6]。
在生物体内,糖供体在糖基转移酶的催化下将糖基转移至受体形成糖苷键,从而实现糖基化修饰[7]。常见的糖供体包括尿苷二磷酸(uridine diphosphate,UDP)-糖、鸟苷二磷酸-糖、胸腺苷二磷酸糖等,其中UDP-糖最为丰富,约占核苷酸糖的55%以上[8]。常见的UDP-糖主要有UDP-葡萄糖、UDP-半乳糖、UDP-鼠李糖、UDP-木糖、UDP-阿拉伯糖、UDP-芹糖、UDP-N-乙酰葡糖胺和UDP-N-乙酰半乳糖胺。
UDP-糖作为一类最常见的糖基供体,参与多种糖基化过程,广泛存在于植物、动物、微生物中。不同生物体中UDP-糖主要参与的生理过程存在显著差异:微生物以细胞壁合成及抗逆响应为主,植物侧重次生代谢物糖基化,而动物则集中于糖蛋白与糖脂的合成。随着合成生物学的快速发展,通过异源途径构建不同UDP-糖的合成路线,已经能够用于合成多种糖基化产物,既包括体外酶法,也包括胞内合成。本文将重点综述UDP-糖的生物合成研究进展,并讨论其体内外合成现状,为UDP-糖的高效合成提供参考。
1 UDP-糖天然合成途径
目前UDP-糖天然合成途径主要涉及3个途径:糖-1-磷酸途径、合酶途径与转化途径,如图1所示。
1.1 糖-1-磷酸途径
UDP-糖是由UDP与特定单糖通过磷酸酯键连接形成的核苷酸糖类,广泛存在于各种生物体内,参与糖基化反应、细胞信号传导等关键生物学过程。尽管UDP-葡萄糖、UDP-半乳糖、UDP-氨基葡萄糖、UDP-葡萄糖醛酸等在生物中普遍存在,但是由于不同生物体代谢需求、细胞结构和生理功能的差异,其合成途径和下游代谢存在差异。在微生物系统中,UDP-糖主要参与细胞壁生物合成、糖基转移酶催化反应以及抗性调控等关键生物学过程,其生物合成通常以葡萄糖-1-磷酸等糖代谢中间体为前体,再在焦磷酸化酶催化下形成UDP-葡萄糖,随后经糖核苷酸差向异构酶、脱氢酶等酶系修饰,生成UDP-半乳糖、UDP-葡萄糖醛酸等衍生物。植物系统表现出更复杂的UDP-糖代谢网络,除参与细胞壁纤维素/半纤维素合成外,还介导黄酮糖苷化、植物激素活化等次级代谢过程。由于其具备一些特有的酶,可合成UDP-木糖、UDP-阿拉伯糖等稀有的UDP-糖。动物体内的UDP-糖代谢则聚焦于糖复合物合成,利用UDP-糖合成糖蛋白、糖脂神经节苷脂组装以及糖胺聚糖等。微生物、植物和动物的UDP-糖代谢均以糖-1-磷酸与UDP反应为中心,差异则体现在下游修饰酶系的物种特异性分化。
UDP-葡萄糖是细胞内最重要的UDP-糖之一,它作为糖基供体,参与多种糖基转移反应,主要用于细胞壁合成、淀粉合成、糖蛋白和糖脂的合成等。UDP-葡萄糖通过以下3步反应合成:(1)葡萄糖在葡萄糖激酶或己糖激酶(hexokinase,Hk)催化下,被ATP磷酸化生成葡萄糖-6-磷酸(glucose-6-phosphate,G-6-P);(2)G-6-P在磷酸葡萄糖变位酶(phosphoglucomutase,PGM)催化下,转化为葡萄糖-1-磷酸(glucose-1-phosphate,G-1-P);(3)G-1-P在UDP-焦磷酸化酶(UDP-sugar pyrophosphorylase,USP)催化下转化为UDP-葡萄糖,同时释放焦磷酸(inorganic pyrophosphate,PPi),PPi迅速被焦磷酸酶水解为无机磷酸(inorganic phosphate,Pi),推动反应正向进行。其中葡萄糖可以来源于细胞内的游离糖,或通过补救途径回收来自多糖降解的单糖。
其他UDP-糖的合成也采用类似的3步反应,参与的相关激酶包括葡萄糖激酶、半乳糖激酶、N-乙酰己糖胺激酶和阿拉伯糖激酶等。半乳糖激酶(galactokinase,GalK)具有较强的底物杂泛性,例如来自嗜粘蛋白阿克曼氏菌ATCC BAA-835的GalK,除了催化半乳糖生成半乳糖-1-磷酸,还能催化半乳糖胺、半乳糖醛酸、葡萄糖、木糖、N-乙酰葡萄糖胺、N-乙酰甘露糖胺等形成相应的糖-1-磷酸[9]。USP是合成UDP-糖的重要酶,催化糖-1-磷酸与UDP结合生成各种UDP-糖,是多种糖类代谢途径的基础。常见的USP包括UDP-葡萄糖焦磷酸化酶(UDP-glucose pyrophosphorylase,UGPase)、UDP-半乳糖焦磷酸化酶、UDP-N-乙酰葡糖胺焦磷酸化酶等。最初,在酵母体内发现了UGPase,该酶能催化G-1-P和尿苷三磷酸(uridine triphosphate,UTP)形成UDP-葡萄糖和PPi[10]。此后,研究还发现了其他类型的USP,例如来自肠道沙门氏菌的重组UDP-木糖焦磷酸化酶和UDP-阿拉伯糖焦磷酸化酶,分别催化木糖-1-磷酸和阿拉伯糖-1-磷酸生成UDP-木糖和UDP-阿拉伯糖[11]。
1.2 合酶途径
UDP-葡萄糖还可通过合酶途径生成,通过合酶将二糖中的一分子糖转移到UDP上形成UDP-糖,该反应为可逆反应。目前,已有多种合酶能生成UDP-糖,包括蔗糖合酶(sucrose synthase,SUS)、乳糖合酶、纤维二糖合酶和海藻糖合酶[12]。然而,出于可逆反应平衡常数和对UDP亲和力的限制以及底物成本的考虑,目前仅有SUS可在体外用于UDP-葡萄糖的合成。提高蔗糖浓度可以促进SUS催化蔗糖和UDP反应,生成果糖和UDP-葡萄糖。通过重组表达来自植物和细菌中的SUS,UDP-葡萄糖的产率已达80%以上[13]。蔗糖不仅价格低廉,与糖基转移酶联用时,还可以实现UDP重复利用,从而克服反应混合物中UDP积累所带来的热力学限制。
1.3 转化途径
不同的UDP-糖可通过脱氢酶、脱羧酶、差向异构酶相互转化获得。由于UDP-葡萄糖最易从磷酸化途径或合酶途径中获得,因此常作为生产各种UDP-糖的前体物,例如,利用UDP-葡萄糖可以通过一步反应直接合成UDP-半乳糖、UDP-葡萄糖醛酸和UDP-鼠李糖,UDP-葡萄糖醛酸作为六碳糖向五碳糖转化的中间体,进一步生成UDP-芹糖、UDP-木糖和UDP-阿拉伯糖。
UDP-葡萄糖醛酸是关键的中间产物,可通过UDP-葡萄糖脱氢酶(UDP-glucose 6-dehydrogenase,UGDH)催化UDP-葡萄糖脱羧生成。该反应在2个NAD+存在下进行,经历两步连续氧化,是一种双分子亲核取代反应(SN2)[14]。UGDH广泛存在于动物、植物、真菌和细菌中,通常具有严格的底物专一性,仅以UDP-葡萄糖为底物,然而甘草来源的UGDH可以利用UDP-N-乙酰基叠氮葡糖胺和UDP-N-乙酰基葡糖胺作为底物[15]。
脱羧反应实现了六碳糖向五碳糖的转化,UDP-葡萄糖醛酸脱羧后生成UDP-芹糖和UDP-木糖。UDP-芹糖/UDP-木糖合酶(UDP-apiose/UDP-xylose synthase,UAS/UXS)催化UDP-葡糖醛酸的脱羧反应,生成为UDP-芹糖和UDP-木糖,该反应经历开环、脱羧、重排和闭合过程。由于UDP-木糖的构象为椅式更稳定,因此反应更倾向于生成UDP-木糖[16]。UDP-木糖还可通过UDP-木糖合酶催化UDP-葡萄糖醛酸脱羧获得。UDP-木糖是植物细胞壁多糖合成的重要糖供体,多个植物基因,如拟南芥、烟草中的UXS基因,已被鉴定用于UDP-木糖的合成[17]。
UDP-葡萄糖和UDP-半乳糖是一对同分异构体,其相互转化通过UDP-葡萄糖/半乳糖-4-差向异构酶(UDP-glucose/galactose-4-epimerase,GalE)催化完成。GalE的N-末端结合NAD+,C-末端与UDP-糖结合。NAD+和UDP-糖的核苷酸部分通过相互作用稳定酶-底物复合物,而糖部分在酶催化下发生翻转,在“翻转”构象中,酸催化的氢化物从NADH转移到C4-酮中间体的相对面,形成差向异构体[18]。此外,UDP-N-乙酰葡糖胺和UDP-N-乙酰半乳糖胺是组成生物大分子的重要结构单元,传递营养和代谢信号,同样是一对同分异构体,可通过GalE相互转化[18]。
UDP-阿拉伯糖和UDP-木糖是另一对五碳糖的同分异构体,其相互转化通过UDP-木糖-4-差向异构酶(UDP-xylose-4-epimerase,UXE)催化实现。由于UDP-阿拉伯糖与植物细胞壁的独特组成和生理需求密切相关,目前已报道的UXE主要来源于植物,如大麦、虎眼万年青、杨树等,而来自微生物的UXE相对较少。尽管如此,来自苜蓿中华根瘤菌的UXE不仅具备异构化UDP-阿拉伯糖和UDP-木糖的功能,还能异构化UDP-葡萄糖和UDP-半乳糖[19]。
UDP-鼠李糖的获得则可以通过鼠李糖合酶(UDP-rhamnose synthase,RHM)催化UDP-葡萄糖生成。RHM是一种多功能酶,催化三步连续反应,N-末端负责催化脱氢反应,具备UDP-葡萄糖4,6-脱氢酶活性,C-末端负责顺序进行差向异构和还原反应,具备3,5-差向异构酶和4-酮-还原酶活性[20]。
1.4 UDP-糖生物合成途径的比较
由上节可知,UDP-糖合成3个主要来源途径:糖-1-磷酸途径、合酶途径与转化途径(图1)。从底物来源与功能特性来看,这3种途径在UDP-糖代谢网络中各具特色。糖-1-磷酸途径以单糖(如葡萄糖)为前体,通过磷酸化反应生成相应的UDP-糖(如UDP-葡萄糖),该过程依赖ATP等高能磷酸化合物,是生物体内规模化合成UDP-糖的核心途径,适用于细胞壁构建、糖原合成等需大量糖基供体的场景;合酶途径则利用二糖(如蔗糖)作为糖基供体,高效生成UDP-葡萄糖,其底物利用效率高、反应条件温和,在体外酶催化合成中具有独特优势;转化途径以现有UDP-糖为前体,通过脱氢、脱羧、差向异构化等酶促反应生成多样化的UDP-糖(如UDP-半乳糖、UDP-葡萄糖醛酸),能够动态调控UDP-糖库的组成,满足抗逆响应、信号转导等过程对特殊糖型的需求。
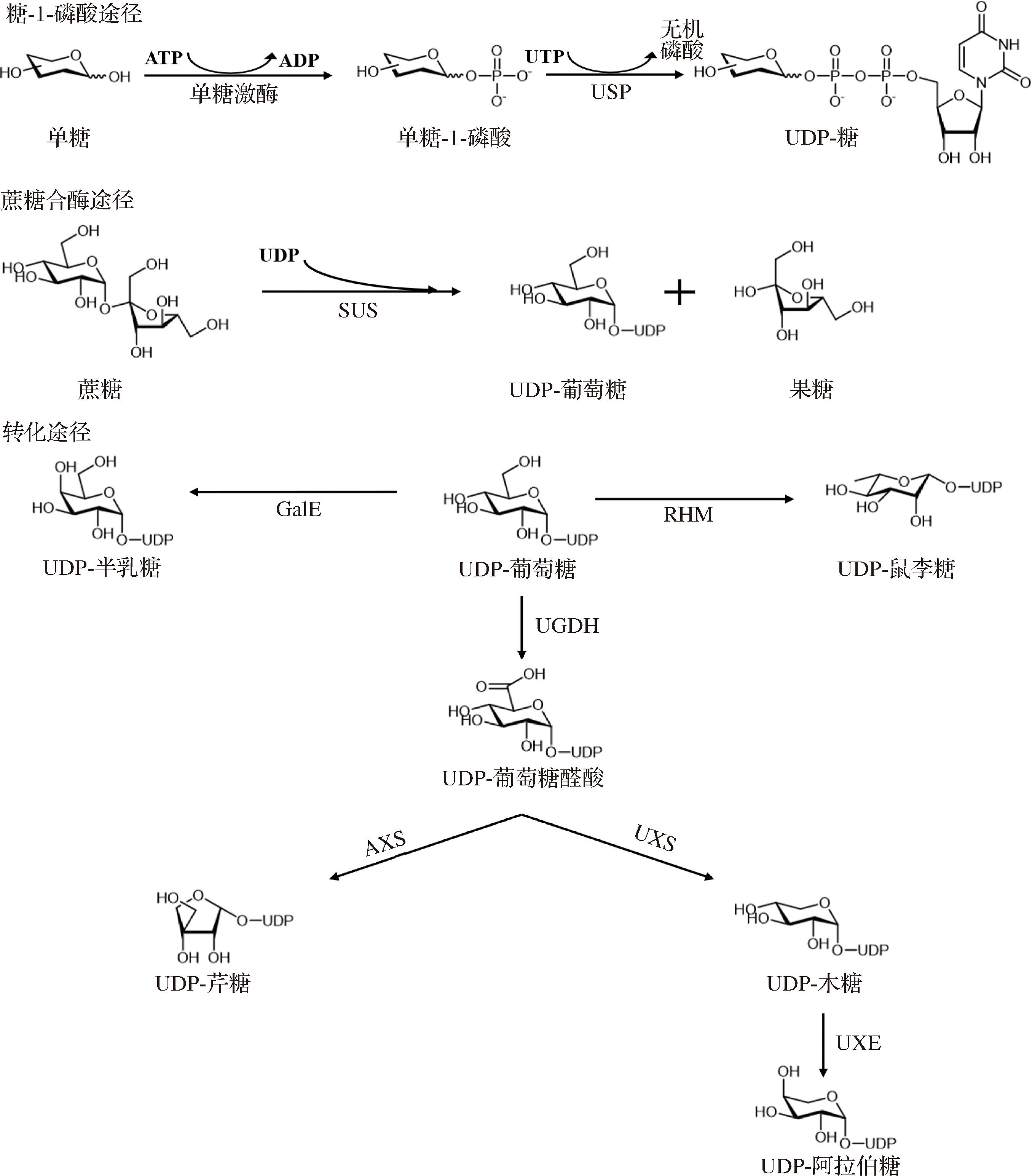
图1 UDP-糖天然合成途径
Fig.1 The natural synthesis pathway of UDP-sugar
2 体外酶法合成UDP-糖的策略
在自然界中,UDP-糖通常是在细胞内通过复杂的酶促反应合成。这些反应在细胞的代谢过程中起着关键作用,涉及到特定酶的催化及一系列的化学反应。由于天然合成的过程复杂且受细胞环境、酶活性等因素的限制,往往难以实现高效、可控的合成。因此,在体外合成这些UDP-糖成为一个重要的研究领域。构建多酶级联反应实现UDP-糖的可控合成,具有反应条件温和、产物纯度高的优势。本文总结了参与UDP-糖合成的关键酶,展示了不同酶在合成过程中的重要性和应用潜力(表1)。
2.1 UDP-葡萄糖的高效合成
已有多种酶促方法用于合成UDP-葡萄糖。最初,采用四酶法从葡萄糖合成UDP-葡萄糖,包括使用Hk、PGM、UGPase和无机焦磷酸酶(inorganic pyrophosphatase,PPase)。其中,Hk催化葡萄糖和ATP反应生成葡萄糖-6-磷酸,PGM催化葡萄糖-1-磷酸和葡萄糖-6-磷酸之间可逆转化,PPase用于水解正向反应的副产物PPi,促进正向平衡,提高合成效率。四酶法虽可高效合成UDP-葡萄糖,但Hk的Mg2+抑制PGM活性,影响产率。随后,报道了采用三酶的一锅法,即利用GalK、UGPase、PPase从葡萄糖及其衍生物合成UDP-葡萄糖,在毫克级的反应规模下,UDP-葡萄糖的产率仅为24%[21],三酶法虽然简化了步骤,但产率较低。
SUS以蔗糖为底物合成UDP-葡萄糖。通过重组表达植物或细菌来源的SUS,并进行酶改造,可以实现UDP-葡萄糖的高效合成。例如,来源于多形亚硝化螺旋菌的SUS突变体,最大UDP-葡萄糖产率达到83%,时空产率为70 g/(L·h)[13]。这种方法不仅简化了反应步骤,还提高了UDP-葡萄糖的产率。由于蔗糖价格低廉,该方法无需昂贵的辅因子,为UDP-葡萄糖的工业化生产提供了有力支持。此外,可将SUS与糖基转移酶偶联构建UDP循环系统,不仅提高了产物浓度,并且解决了UDP抑制的问题。例如,本课题组将甘草来源的SUS突变体与糖基转移酶UGT73C11偶联,底物甘草次酸的转化率提高了7倍[22]。相比之下,SUS法以蔗糖为底物,成本低、产率高,且可与糖基转移酶偶联形成UDP循环,提高产物收率,适用于工业化生产。
2.2 UDP-糖的定向转化
UDP-葡萄糖是一个重要的代谢中间体,通过特定酶的催化转化为其他UDP-糖。不同的UDP-糖合成途径通常依赖于不同的酶,这些酶对特定的底物具有高选择性。以下总结6种典型的UDP-糖的反应途径。
UDP-半乳糖可通过GalE催化UDP-葡萄糖生成,然而,该方法的产率仅为30%,且获得的是UDP-葡萄糖和UDP-半乳糖的混合物,难以分离纯化。若要获得纯的UDP-半乳糖,可通过UDP-半乳糖焦磷酸化酶、PGM和葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase,G6PD)的联用,产率可达40%,时空产率为7.1 g/(L·h)[23]。利用GalK的磷酸化途径可显著提高转化率,GalK将半乳糖转化为半乳糖-1-P,随后与UTP生成途径相关酶[尿苷-胞苷激酶、尿苷单磷酸激酶和多磷酸激酶(polyphosphate kinase 3,PPK3)]共同作用,结合UDP-半乳糖焦磷酸化酶的催化作用,从低成本的尿苷、半乳糖和多磷酸盐合成UDP-半乳糖,产率可达到71%[24]。采用GalK、UGPase、PPase的三酶一锅法,UTP转化率可达87.4%,时空产率为6.36 g/(L·h),且通过反复分批可实现UDP-半乳糖的克级合成[25]。GalE法操作简单但产率低,且产物难以分离。UDP-半乳糖焦磷酸化酶联用PGM和G6PD可提高产率,但仍有限。GalK磷酸化途径显著提升转化率,成本较低,产率可达71%。最新的三酶一锅法UTP转化率高(87.4%),可用于克级合成,适合规模化生产。
UDP-鼠李糖的合成主要依赖于RHM催化UDP-葡萄糖转化生成,该过程需要NAD+和NADPH的参与。目前,已从拟南芥、茶树、桃等植物中鉴定了多个RHM,可催化UDP-葡萄糖生成UDP-鼠李糖,但其产率尚未报道[26]。另一种方法采用一锅两步策略,引入NADPH再生系统,将UDP-葡萄糖与来自绿色刺囊藻病毒的UGDH孵育,进行脱氢反应,该酶不需要外源性的NAD+;然后,再加入来自富克葡萄孢盘菌的多功能UDP-4-酮-6-脱氧葡萄糖-3,5-差向异构酶/-4-还原酶(UDP-4-keto-6-deoxyglucose-3,5-epimerase/-4-reductase,NRS/ER)将其转化为UDP-鼠李糖,最终以73%的产率获得2.13 g UDP-鼠李糖[27]。类似地,有研究将UDP-鼠李糖合成酶与拟南芥的NRS/ER双功能酶(RHM-NRS/ER)融合,并与SUS偶联,实现了0.29 g/L的UDP-鼠李糖产量,但却面临热稳定性不足的挑战[28]。RHM法可催化UDP-葡萄糖生成UDP-鼠李糖,但需辅因子NAD+/NADPH,且产率未报道。一锅两步法结合NADPH再生系统,避免外源NAD+需求。RHM-NRS/ER融合酶与SUS偶联可提高合成效率,但产量较低(0.29 g/L)。综合来看,一锅两步法在产率和规模化应用方面更具优势。
UDP-葡萄糖醛酸可以通过UDP-葡萄糖在UGDH催化下,利用2个激活的NAD+分子生成。通过偶联SUS与化脓链球菌的UGDH,UDP-葡萄糖醛酸的产率可达87%,最终获得了2.76 g的UDP-葡萄糖醛酸[27]。此外,UDP-葡萄糖醛酸的合成也可通过磷酸化途径实现,葡萄糖醛酸激酶(glucuronic acid kinase,GlcAK)将葡萄糖醛酸磷酸化为葡萄糖醛酸-1-磷酸。采用拟南芥的GlcAk和UGPase,以及鲁氏彭美尔氏菌的多磷酸激酶2-3(polyphosphate kinase 2-3,PPK2-3),可将葡萄糖醛酸100%转化为UDP-葡萄糖醛酸,时空产率为3 g/L/h[29]。综上,UGDH法利用UDP-葡萄糖转化,辅因子需求高,产率达87%。相比之下,磷酸化途径转化效率更优,通过GlcAK与UGPase作用,实现100%转化,时空产率更高。
UDP-葡萄糖醛酸的C-6脱羧,可通过UXS重排或还原反应生成UDP-芹糖和UDP-木糖,其中UDP-芹糖高度不稳定。目前,已鉴定和纯化出来自智人、长双歧杆菌、太平洋牡蛎和化脓性链球菌等的UXS,其中化脓性链球菌的UXS对UDP-葡萄糖醛酸的活性最高。通过UGDH和UXS两步反应,以75%的产率由UDP-葡萄糖制备UDP-木糖,且可实现克级规模的合成[27]。近年来,发现来自细菌的半乳糖激酶能够将木糖磷酸化为木糖-1-磷酸,与细菌的UGPase一锅反应,需添加NAD+,最终生成UDP-木糖,其产率为40%[30]。
UDP-阿拉伯糖的合成途径较长,以UDP-葡萄糖为底物,需经过脱氢、脱羧和异构3个步骤。虽然UXE被报道可催化UDP-木糖转化为UDP-阿拉伯糖,但由于其膜结合特性,UXE可溶性表达较为困难。本课题组采用UDP-葡萄糖-4-差向异构酶(UDP-glucose-4-epimerase,UGE)将UDP-木糖转化为UDP-阿拉伯糖,并通过级联SUS、UGDH和UXS,实现从蔗糖合成UDP-阿拉伯糖[31]。
UDP-N-乙酰葡糖胺是一种在体内外易形成的核心代谢物。N-乙酰己糖胺1-激酶(N-acetylglucosamine 1-kinase,NahK)是高度混杂的糖-1-磷酸激酶,可用于磷酸化乙酰葡糖胺。通过5种酶[NahK、葡萄糖-1-磷酸尿苷酰转移酶(glucose-1-phosphate uridylyltransferase,GalU)、尿苷单磷酸激酶(uridine monophosphate kinase 6,URA6)、PPK3和PPase]的级联,可以从多磷酸盐、尿苷单磷酸和N-乙酰葡萄糖胺中以一锅法合成UDP-N-乙酰葡糖胺,产率接近100%,时空产率约为0.81 g/(L·h)[32]。此外,利用NahK、葡糖胺-1-磷酸焦磷酸化酶(glucosamine-1-phosphate uridyltransferase,GlmU)和PPase,与廉价底物蔗糖和乙酰葡糖胺可在体外进行一锅合成,转化率为98%,时空产率约为5.95 g/(L·h)[33]。UDP-N-乙酰半乳糖胺的获得可通过将GalE转化UDP-N-乙酰葡糖胺。此外,通过NahK、GlmU和PPase的酶联反应,可将N-乙酰葡萄糖胺转化为UDP-乙酰半乳糖胺,200 mL规模下可获得95.6%的产率,时空产率为0.24 g/(L·h)[34]。最近,NahK、GalU、GlmU和PPase四酶体系进一步提高了UDP-N-乙酰半乳糖胺的时空产率,达到4.2 g/(L·h)[35]。
2.3 技术瓶颈与解决策略
目前,UDP-糖的酶催化合成路径已取得显著进展,稀有UDP-糖的途径已经打通,但不同底物与酶的组合在产率、时空产率及经济性方面存在显著差异。表1总结了参与UDP-糖合成的酶及其产率。总体而言,尽管部分路径已实现高时空产率[如70 g/(L·h)]和廉价底物利用(如蔗糖),仍需克服辅因子成本(如UTP)、酶稳定性、产物抑制及系统复杂性等核心挑战:(1)多数关键酶对环境条件变化(如温度、pH以及底物浓度等)十分敏感,造成合成过程难以控制,通常可以通过固定化酶法来改善酶的稳定性,也可以通过蛋白质工程改造得到热稳定性增强的突变体;(2)由于酶具有高度专一性,自然界能产生某种酶的微生物也仅局限于某几个属或某个物种内,并且每种酶都有一定的产量限度,局限了UDP-糖的工业制备规模;(3)酶催化的UDP-糖合成一般为多步连续反应过程,需保证各步骤之间相互协调,同时,很多UDP-糖合成的关键酶还需要消耗大量的辅助物质(ATP、NAD+等)。为此可建立ATP/NAD(P)H再生系统,既可以循环利用辅因子,还可以降低UDP-糖的生产成本;4)产物抑制效应也是影响UDP-糖体外合成效率的重要因素,可采用膜分离技术或原位产物移除策略减少产物积累,从而缓解反馈抑制,提高反应体系的整体转化率。综上所述,未来研究应聚焦于优化酶工程策略、开发辅因子再生技术,并平衡产率与工业化可行性,以推动UDP-糖合成技术的规模化应用。
表1 参与UDP-糖合成的酶的总结
Table 1 Summary of enzymes involved in the synthesis of UDP-sugars

底物产物酶产率时空产率/[g/(L·h)]葡萄糖UDP-葡萄糖Hk、PGM、UGPase、PPase——[36]葡萄糖UDP-葡萄糖GalK、UGPase、PPase24%0.03蔗糖UDP-葡萄糖SUS83%70UDP-葡萄糖UDP-半乳糖GalE30%—[37]半乳糖UDP-半乳糖GalU、PGM、G6PD40%7.1半乳糖UDP-半乳糖GalK等7种酶71%1.02半乳糖UDP-半乳糖GalK、UGPase、PPase87.4%6.36UDP-葡萄糖UDP-鼠李糖UGDH、NRS/ER73%—蔗糖UDP-鼠李糖SUS和RHM-NRS/ER—59.3蔗糖UDP-葡萄糖醛酸SUS和UGDH87%—葡萄糖醛酸UDP-葡萄糖醛酸GlcAK和RpPPK2-3100%3UDP-葡萄糖UDP-木糖UGDH和UXS75%—[27,38]木糖UDP-木糖GalK和UGPase40%2.1蔗糖UDP-阿拉伯糖SUS、UGDH、UXS、UGE——乙酰葡糖胺UDP- N-乙酰葡糖胺NahK、GalU、URA6、PPK3、PPase100%0.81蔗糖和乙酰葡糖胺UDP- N-乙酰葡糖胺NahK、GlmU、PPase98%5.95乙酰葡糖胺UDP-N-乙酰半乳糖胺NahK、GlmU、PPase95.6%0.24乙酰半乳糖胺UDP-N-乙酰半乳糖胺NahK、GalU、GlmU、PPase80%4.2
注:“—”表示无数据;RpPPK2-3:玫瑰杆菌来源的NDP多磷酸磷酸转移酶3(NDP polyphosphate phosphotransferase 3 of Ruegeria pomeroyi)。
3 高效合成UDP-糖的微生物细胞工厂的构建与优化
微生物细胞工厂是一种高效、可持续的生物制造平台,广泛用于天然产物、生物燃料和大宗化学品等的合成。以UDP-糖为糖基供体,可在微生物细胞工厂内合成天然产物糖苷、人乳寡糖等重要化合物。由于UDP-糖可以相互转化,如图2所示,利用异源或非天然途径可合成各种UDP-糖。微生物合成UDP-糖的核心挑战在于平衡内源代谢途径与异源合成途径的兼容性。
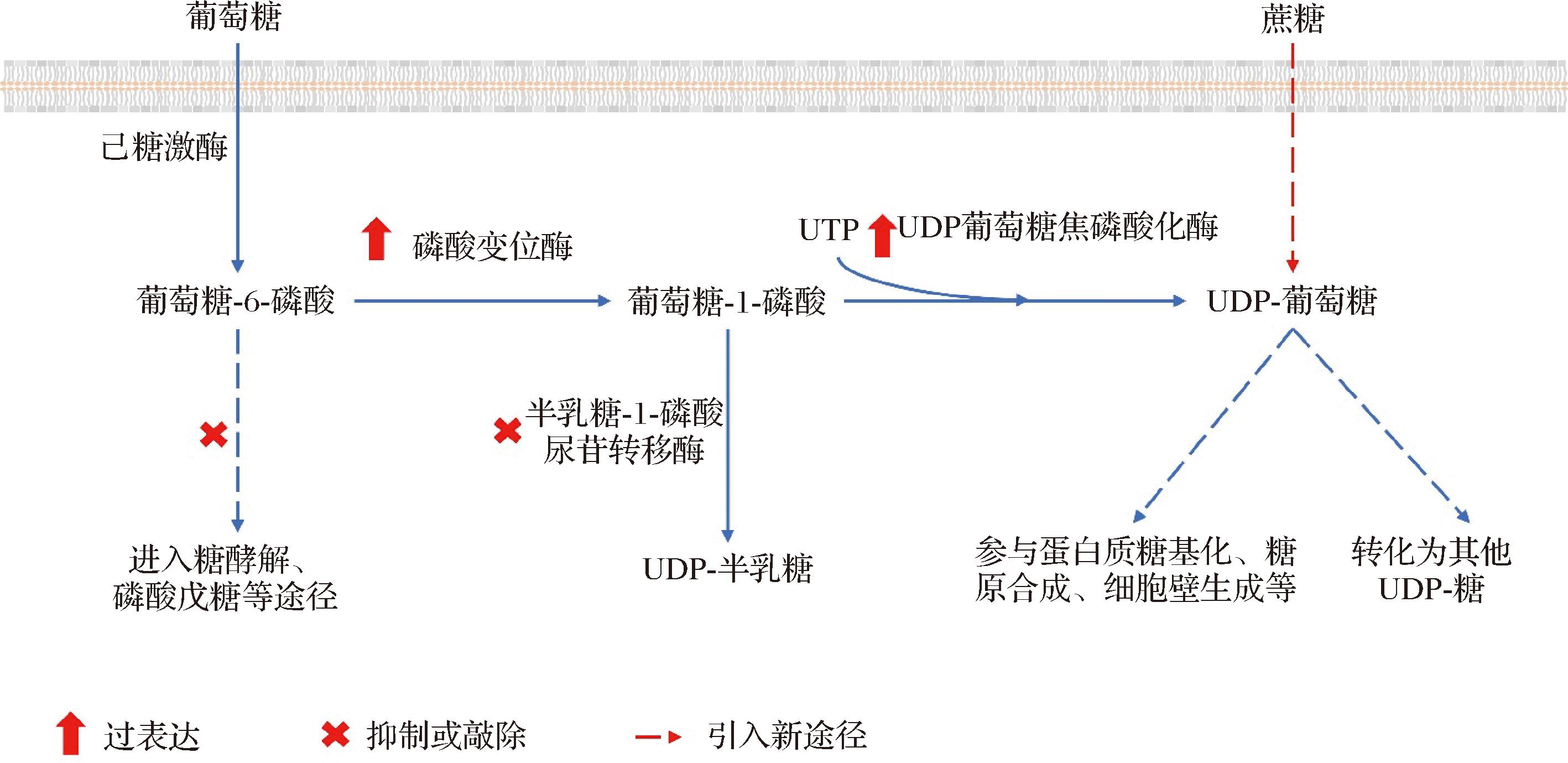
图2 微生物中UDP-糖合成途径总结
Fig.2 Summary of the UDP-sugar biosynthetic pathway in microorganisms
3.1 内源UDP-糖合成途径强化
UDP-葡萄糖作为宿主内源的基础代谢物,参与糖酵解、细胞壁合成、蛋白质糖基化等多个过程,导致胞内的UDP-葡萄糖代谢通量水平较低。为了增强UDP-葡萄糖的供应并突破天然调控网络的限制,目前常用的调控方案包括:(1)强化天然合成途径关键基因表达。例如,过表达磷酸葡萄糖变位酶1和UDP-葡萄糖焦磷酸化酶1使UDP-葡萄糖的合成水平提高,下游糖苷产物葛根素产量提高了61%[39];(2)加强UDP的回收利用。例如,通过过表达促进UDP合成的核苷二磷酸激酶1和URA6,并联合PGM1和UGP1,提升UDP再生效率,使下游糖苷产物黄芩苷的产量提高了70%[40];(3)抑制或敲除消耗UDP-葡萄糖的的竞争性消耗途径。例如,在酿酒酵母中敲除半乳糖-1-磷酸尿苷转移酶,促进G-1-P向UDP-葡萄糖的转化,下游糖苷产物甜茶苷产量增加了19.4%[41];在大肠杆菌BL21中敲除糖酵解途径关键基因磷酸葡萄糖异构酶(phosphoglucose isomerase,pgi)及戊糖磷酸途径的关键基因葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase,G6PD,zwf),改变代谢平衡来间接影响UDP-葡萄糖的供应,使下游糖苷产物牡荆素产量增加710%[42]。
大肠杆菌和酿酒酵母天然具备合成UDP-半乳糖的能力,过表达途径基因可增强UDP-半乳糖的合成。例如,分别过表达GalK和UDP-半乳糖焦磷酸化酶促进UDP-半乳糖的生成,过表达GalE将UDP-葡萄糖异构获得UDP-半乳糖,最终使UDP-半乳糖的产量达到44 g/L[43]。通过T7强启动子促进基因表达并引入GalE进行差向异构化,可以提高UDP-半乳糖的积累,使乳糖-N-四糖产量增加290%[44]。
3.2 异源途径整合强化UDP-糖合成
异源途径整合是提高UDP-糖合成效率的一种重要策略。例如,引入SUS途径可以水解蔗糖提高UDP-葡萄糖的供应,从酪醇高效合成红景天苷[45];蔗糖磷酸途径可将蔗糖分解为G-1-P,增加UDP-葡萄糖供应,使异荭草素产量提高300%[46]。
由于许多微生物不具备UDP-鼠李糖、UDP-木糖和UDP-阿拉伯糖的合成途径,因此需要引入异源酶对UDP-葡萄糖进行转化。例如,利用鼠李糖合成酶(如来源于拟南芥的RHM)可以在微生物中合成UDP-鼠李糖,重组菌株的最大UDP-鼠李糖产量可达82.2 mg/L[47]。为了进一步提高UDP-鼠李糖的供应,构建了NADPH非依赖性融合酶,增强了UDP-鼠李糖的供应,促进槲皮苷、淫羊藿苷等鼠李糖苷化合物的生产,槲皮苷和淫羊藿苷的的最高产量分别达到7 627 mg/L和130 μg/L[47-48]。
此外,UDP-葡萄糖也可通过UGDH催化脱氢转化为UDP-葡萄糖醛酸,进一步拓展了UDP-糖的应用范围。在大肠杆菌中,共表达来源于谷氨酸棒状杆菌的UDP-葡萄糖-6-脱氢酶和来源于毕赤酵母的L-谷氨酰胺-D-果糖-6-磷酸转氨酶可有效增强UDP-乙酰半乳糖胺和UDP-葡萄糖醛酸的积累,促进软骨素的合成,其最大产量可达到9.2 g/L[49]。类似地,UDP-木糖可以通过UDP-葡萄糖醛酸脱羧反应合成,常用的酶包括拟南芥的UDP-葡萄糖-6-脱氢酶1和UDP-葡萄糖醛酸脱羧酶3。在酵母中共表达这2种酶,可以高效合成人参皂苷K,产量高达1 g/L,同样的方法可应用于米曲霉中合成猴头菌素[50]。
通过UDP-木糖的异构化,还可以进一步生成UDP-阿拉伯糖。利用来源于茂原链霉菌或拟南芥的UXE,可在大肠杆菌或酿酒酵母中合成UDP-阿拉伯糖,进而用于合成络塞维和疫苗佐剂沙棘树皂苷21等阿拉伯糖苷化合物[51]。此外,通过引入白假丝酵母的L-阿拉伯糖激酶和拟南芥来源的UDP糖焦磷酸化酶,可以直接从L-阿拉伯糖获得UDP-阿拉伯糖,其最高产量为1.2 g/L[52]。进一步地,酿酒酵母还可利用类似途径合成UDP-岩藻糖,采用UDP-4-酮基-6-脱氧-葡萄糖作为中间体,通过硫古菌46DH株的UDP-4-酮基-6-脱氧葡萄糖脱氢酶和酮还原酶进行转化,最终合成UDP-岩藻糖,产量可达到125.6 mg/L[52]。
综上所述,通过引入合适的异源途径,不仅能够显著提升UDP-糖的生产效率,还能促进多种高价值糖基化产物的生产,进一步拓展其在生物合成中的应用潜力。
3.3 细胞工厂合成UDP-糖合成的挑战
目前,通过内源途径强化、异源途径整合以及代谢流动态调控等策略,已实现了在微生物细胞工厂合成各类 UDP-糖及其相应糖苷化合物。但是当前产率仍然较低,主要原因有以下3个方面:(1)UDP-糖前体物质供应不足而造成各步反应限速;(2)微生物细胞代谢负担较重,一定程度上抑制了代谢产物的积累;(3)合成途径中的关键酶活性不足或受抑制,影响了最终产量的提升。
尽管在微生物细胞工厂中合成UDP-糖已经取得了一定进展,但要实现经济可行的大规模生产,仍面临诸多挑战,特别是在高效利用底物、提高UDP-糖合成途径的整体通量和减少副产物积累等方面。因此,在未来的研究中需要进一步优化代谢通路,精准调控基因表达水平,合理改进代谢流分配,并深入研究如何合理增强基因表达、微生物共培养等策略,这些方法有望提高微生物细胞的生产效率。
4 结论与展望
目前,体外酶催化技术与微生物合成平台已能规模化制备多种UDP-糖及其衍生物,但仍存在改进空间:酶催化体系需解决酶分子稳定性不足、多酶级联效率偏低及产物得率受限等问题;微生物合成系统则面临代谢网络适配性不理想、存在竞争途径消耗某些前体物质、关键酶活性不足等问题。随着合成生物学与蛋白质定工程等技术的发展和完善,UDP-糖的生物合成途径将得到更合理的设计和更精细的调控,微生物细胞工厂将在更多下游糖苷化合物的高效生产中发挥重要作用。改善酶的稳定性和选择性、优化微生物代谢途径、强化UDP的回收利用及引入新的代谢途径等手段,都是未来提高UDP-糖的生产效率的有效方法。
[1] RAI A, UMASHANKAR S, RAI M, et al.Coordinate regulation of metabolite glycosylation and stress hormone biosynthesis by TT8 in Arabidopsis[J].Plant Physiology, 2016, 171(4):2499-2515.
[2] HE M Y, ZHOU X X, WANG X.Glycosylation:Mechanisms, biological functions and clinical implications[J].Signal Transduction and Targeted Therapy, 2024, 9(1):194.
[3] LEE C E, KIM T, NILO-POYANCO R, et al.Genomic signatures of specialized metabolism in plants[J].Science, 2014, 344(6183):510-513.
[4] THOMAS D, RATHINAVEL A K, RADHAKRISHNAN P.Altered glycosylation in cancer:A promising target for biomarkers and therapeutics[J].Biochimica et Biophysica Acta (BBA)-Reviews on Cancer, 2021, 1875(1):188464.
[5] ZOU Y, SONG Y, YANG W J, et al.Galactose-installed photo-crosslinked pH-sensitive degradable micelles for active targeting chemotherapy of hepatocellular carcinoma in mice[J].Journal of Controlled Release, 2014, 193:154-161.
[6] HUANG F C, EFFENBERGER I, FISCHER T, et al.Comparative physicochemical and biochemical characterization of small-molecule glucosides[J].Journal of Agricultural and Food Chemistry, 2022, 70(50):15972-15980.
[7] REXER T, LAAF D, GOTTSCHALK J, et al.Advances in Glycobiotechnology[M].Cham:Springer International Publishing, 2021.
[8] WAGNER K G, BACKER A I.International Review of Cytology[M].New York:Academic Press, 1992.
[9] ZHANG X L, SHENG W H, LI K, et al.Substrate specificity of the galactokinase from the human gut symbiont Akkermansia muciniphila ATCC BAA-835[J].Enzyme and Microbial Technology, 2020, 139:109568.
[10] KALCKAR H M.Biochemical mutations in man and microorganisms[J].Science, 1957, 125(3238):105-108.
[11] WANG J J, GREENWAY H, LI S S, et al.Facile and stereo-selective synthesis of UDP-α-D-xylose and UDP-β-L-arabinose using UDP -sugar pyrophosphorylase[J].Frontiers in Chemistry, 2018, 6:163.
[12] ZHANG Y Y, TANG B, DU G C.Self-induction system for cellulase production by cellobiose produced from glucose in Rhizopus stolonifer[J].Scientific Reports, 2017, 7:10161.
[13] ZHAO L T, MA Z B, WANG Q, et al.Highly efficient production of UDP-glucose from sucrose via the semirational engineering of sucrose synthase and a cascade route design[J].Journal of Agricultural and Food Chemistry, 2023, 71(33):12549-12557.
[14] CHEN J, YU Y, GAO J J, et al.UDP-glucose dehydrogenase:The first-step oxidation is an NAD+-dependent bimolecular nucleophilic substitution reaction (SN2)[J].International Journal of Biological Sciences, 2019, 15(2):341-350.
[15] LI Y, SUN Y F, REN G X, et al.Functional characterization and substrate promiscuity analysis of UDP-glucose dehydrogenases from licorice (Glycyrrhiza uralensis)[J].Journal of Molecular Structure, 2022, 1265:133355.
[16] WANG Y J, LI X Y, WEI J J, et al.Mechanism of sugar ring contraction and closure catalyzed by UDP -d-apiose/ UDP -d-xylose synthase (UAXS)[J].Journal of Chemical Information and Modeling, 2022, 62(3):632-646.
[17] LI Z M, CHEN R P, WEN Y F, et al.Comprehensive analysis of the UDP-glucuronate decarboxylase (UXS) gene family in tobacco and functional characterization of NtUXS16 in Golgi apparatus in Arabidopsis[J].BMC Plant Biology, 2023, 23(1):551.
[18] FUSHINOBU S.Molecular evolution and functional divergence of UDP-hexose 4-epimerases[J].Current Opinion in Chemical Biology, 2021, 61:53-62.
[19] SCH PER S, WENDT H, BAMBERGER J, et al.A bifunctional UDP-sugar 4-epimerase supports biosynthesis of multiple cell surface polysaccharides in Sinorhizobium meliloti[J].Journal of Bacteriology, 2019, 201(10):e00801-18.
PER S, WENDT H, BAMBERGER J, et al.A bifunctional UDP-sugar 4-epimerase supports biosynthesis of multiple cell surface polysaccharides in Sinorhizobium meliloti[J].Journal of Bacteriology, 2019, 201(10):e00801-18.
[20] ZHANG S, WANG Y Y, CUI Z R, et al.Functional characterization of a flavonol 3-O-rhamnosyltransferase and two UDP-rhamnose synthases from Hypericum monogynum[J].Plant Physiology and Biochemistry, 2023, 197:107643.
[21] ZOU Y, XUE M Y, WANG W J, et al.One-pot three-enzyme synthesis of UDP-Glc, UDP-Gal, and their derivatives[J].Carbohydrate Research, 2013, 373:76-81.
[22] ZHANG L, GAO Y N, LIU X F, et al.Mining of sucrose synthases from Glycyrrhiza uralensis and their application in the construction of an efficient UDP-recycling system[J].Journal of Agricultural and Food Chemistry, 2019, 67(42):11694-11702.
[23] BÜLTER T, ELLING L.Enzymatic synthesis of UDP-galactose on a gram scale[J].Journal of Molecular Catalysis B:Enzymatic, 2000, 8(4-6):281-284.
[24] MAHOUR R, LEE J W, GRIMPE P, et al.Cell-free multi-enzyme synthesis and purification of uridine diphosphate galactose[J].ChemBioChem, 2022, 23(2):e202100361.
[25] LI Y J, CHEN Q, LIU S Y, et al.Efficient one-pot synthesis of uridine diphosphate galactose employing a trienzyme system[J].Journal of Agricultural and Food Chemistry, 2024, 72(7):3644-3653.
[26] JIANG N, DILLON F M, SILVA A, et al.Rhamnose in plants - from biosynthesis to diverse functions[J].Plant Science, 2021, 302:110687.
[27] WANG S S, ZHANG J B, WEI F Y, et al.Facile synthesis of sugar nucleotides from common sugars by the cascade conversion strategy[J].Journal of the American Chemical Society, 2022, 144(22):9980-9989.
[28] PEI J J, CHEN A N, SUN Q, et al.Construction of a novel UDP-rhamnose regeneration system by a two-enzyme reaction system and application in glycosylation of flavonoid[J].Biochemical Engineering Journal, 2018, 139:33-42.
[29] GOTTSCHALK J, BLASCHKE L, AßMANN M, et al.Integration of a nucleoside triphosphate regeneration system in the one-pot synthesis of UDP-sugars and hyaluronic acid[J].ChemCatChem, 2021, 13(13):3074-3083.
[30] SHI J M, WU T T, ZHOU H, et al.Substrate promiscuities of a bacterial galactokinase and a glucose-1-phosphate uridyltransferase enable xylose salvaging[J].Green Chemistry, 2022, 24(9):3717-3722.
[31] SUN Q Y, GUO F, REN S C, et al.Construction of a UDP-arabinose regeneration system for efficient Arabinosylation of pentacyclic triterpenoids[J].ACS Synthetic Biology, 2023, 12(8):2463-2474.
[32] MAHOUR R, KLAPPROTH J, REXER T F T, et al.Establishment of a five-enzyme cell-free cascade for the synthesis of uridine diphosphate N-acetylglucosamine[J].Journal of Biotechnology, 2018, 283:120-129.
[33] EISELE A, ZAUN H, KUBALLA J, et al.In vitro one-pot enzymatic synthesis of hyaluronic acid from sucrose and N-acetylglucosamine:Optimization of the enzyme module system and nucleotide sugar regeneration[J].ChemCatChem, 2018, 10(14):2969-2981.
[34] FISCHÖDER T, WAHL C, ZERHUSEN C, et al.Repetitive batch mode facilitates enzymatic synthesis of the nucleotide sugars UDP-Gal, UDP-GlcNAc, and UDP-GalNAc on a multi-gram scale[J].Biotechnology Journal, 2019, 14(4):boit.201800386.
[35] LI S, WANG S S, WANG Y Q, et al.Gram-scale production of sugar nucleotides and their derivatives[J].Green Chemistry, 2021, 23(7):2628-2633.
[36] TAN H.A simplified method for the preparation of pure UDP[14C]glucose[J].Biochimica et Biophysica Acta (BBA) General Subjects, 1979, 582(3):543-547.
[37] CHUNG S K, RYU S I, LEE S B.Characterization of UDP-glucose 4-epimerase from Pyrococcus horikoshii:Regeneration of UDP to produce UDP-galactose using two-enzyme system with trehalose[J].Bioresource Technology, 2012, 110:423-429.
[38] SONG H B, ZHAO G H, ZHANG M, et al.Optimization of the UDP-Xyl biocatalytic synthesis from Crassostrea gigas by orthogonal design method[J].Protein Expression and Purification, 2022, 190:106002.
[39] LIU Q L, LIU Y, LI G, et al.De novo biosynthesis of bioactive isoflavonoids by engineered yeast cell factories[J].Nature Communications, 2021, 12:6085.
[40] KANG Y J, QIAN Z L, YU H S, et al.Programmable biosynthesis of plant-derived 4′-deoxyflavone glycosides by an unconventional yeast consortium[J].Small Methods, 2024, 8(8):2301371.
[41] XU Y M, WANG X L, ZHANG C Y, et al.De novo biosynthesis of rubusoside and rebaudiosides in engineered yeasts[J].Nature Communications, 2022, 13:3040.
[42] LIU S K, LI D, QIN Z J, et al.Enhancing glycosylation of flavonoids by engineering the uridine diphosphate glucose supply in Escherichia coli[J].Journal of Agricultural and Food Chemistry, 2023, 71(46):17842-17851.
[43] KOIZUMI S, ENDO T, TABATA K, et al.Large-scale production of UDP-galactose and globotriose by coupling metabolically engineered bacteria[J].Nature Biotechnology, 1998, 16(9):847-850.
[44] LIAO Y X, LAO C W, WU J Y, et al.High-yield synthesis of lacto-N-neotetraose from glycerol and glucose in engineered Escherichia coli[J].Journal of Agricultural and Food Chemistry, 2024, 72(10):5325-5338.
[45] ZHOU X J, ZHANG X X, WANG D, et al.Efficient biosynthesis of salidroside via artificial in vivo enhanced UDP-glucose system using cheap sucrose as substrate[J].ACS Omega, 2024, 9(20):22386-22397.
[46] PEI J J, SUN Q, ZHAO L G, et al.Efficient biotransformation of luteolin to isoorientin through adjusting induction strategy, controlling acetic acid, and increasing UDP-glucose supply in Escherichia coli[J].Journal of Agricultural and Food Chemistry, 2019, 67(1):331-340.
[47] GU N, QIU C, ZHAO L G, et al.Enhancing UDP-rhamnose supply for rhamnosylation of flavonoids in Escherichia coli by regulating the modular pathway and improving NADPH availability[J].Journal of Agricultural and Food Chemistry, 2020, 68(35):9513-9523.
[48] AN T, LIN G Y, LIU Y, et al.De novo biosynthesis of anticarcinogenic icariin in engineered yeast[J].Metabolic Engineering, 2023, 80:207-215.
[49] ZHAO C L, LI X M, GUO L, et al.Reprogramming metabolic flux in Escherichia coli to enhance chondroitin production[J].Advanced Science, 2024, 11(10):2307351.
[50] WANG D, WANG J H, SHI Y S, et al.Elucidation of the complete biosynthetic pathway of the main triterpene glycosylation products of Panax notoginseng using a synthetic biology platform[J].Metabolic Engineering, 2020, 61:131-140.
[51] LIU Y Z, ZHAO X X, GAN F, et al.Complete biosynthesis of QS-21 in engineered yeast[J].Nature, 2024, 629(8013):937-944.
[52] CROWE S A, ZHAO X X, GAN F, et al.Engineered Saccharomyces cerevisiae as a biosynthetic platform of nucleotide sugars[J].ACS Synthetic Biology, 2024, 13(4):1215-1224.