牛乳能够提供人类营养所需的蛋白质、矿物质、维生素以及免疫活性物质等营养成分,但乳中的一些蛋白化合物容易导致机体产生过敏反应[1-2],限制了人们对乳制品的营养追求。近年来,为了满足人们对乳的营养需求,反应温和且副产物较少的蛋白酶得到了广泛的应用,它不仅能够通过改变蛋白的构象和线性表位来改善其致敏性[3],同时还能够将其酶解为低分子质量的生物活性肽或氨基酸,进而使得蛋白更容易被肠道吸收[1]。而越来越多的研究表明,乳蛋白的酶解产物能够通过维持细胞活力、增加谷胱甘肽含量、诱导过氧化氢酶活性增强和减少脂质过氧化等来增强机体的抗氧化能力[4]。
目前,常用水解度来衡量蛋白酶酶解蛋白的程度,而较高的水解度能够增加乳中抗氧化活性肽的含量,并增强机体对乳中营养物质的消化和吸收[5-6];同时还能够促进乳的乳化和凝胶,赋予其良好的加工特性[7]。但是随着水解度的升高,乳蛋白水解物中的苦味肽和苦味氨基酸含量也会随之增加[8-9],容易引起乳的苦味,降低了其在口感上的可接受性。目前常用苦味掩蔽、美拉德反应等方法来降低蛋白水解物的苦味[10],虽然这些方法的反应条件温和[11],但效果较差限制了其在食品生产中的广泛应用[12]。
有研究表明,乳酸菌发酵能够通过降低皂苷、黄酮类化合物及组氨酸、精氨酸等苦味物质的含量,来改善食品的苦味[13];而其代谢产生的乳酸、乙酸和多糖及自身具有的β-半乳糖苷酶和氨基肽酶等物质,也有助于食品形成良好的风味和质地[12]。同时,乳酸菌还能够通过在发酵过程中代谢产生的酚、没食子酸、肽及氨基酸等生物活性物质来提高食品的抗氧化能力[14]。然而,乳酸菌发酵在改善酶解脱脂抗氧化能力的同时[15],对于其苦味和挥发性风味物质的影响尚不清楚,相关研究较少。
因此,本文首先筛选出了水解脱脂乳能力较强的蛋白酶,并进一步优化酶添加量、酶解温度及脱脂乳pH等水解条件;然后以优化后的酶解脱脂乳为底物,研究了不同乳酸菌菌株发酵对酶解脱脂乳的DPPH自由基清除率、羟自由基的抑制率及超氧化物歧化酶(superoxide dismutase,SOD)活性等抗氧化能力的影响;最后探究抗氧化能能力较强的乳酸菌菌株对酶解脱脂乳的苦味评价值、苦味响应值及挥发性风味物质的改善作用,以期为开发具有抗氧化能力的发酵乳饮料等产品提供理论支撑。
1 材料与方法
1.1 材料与试剂
植物乳植杆菌 (Lactiplantibacillus plantarum) B107-1、L. plantarum 97、L. plantarum 84D-1、L. plantarum Y-7、L. plantarum B84-2,发酵粘液乳杆菌(Limosilactobacillus fermentum) 53M-1、L. fermentum 632、L. fermentum 79、L. fermentum 52,鼠李糖乳酪杆菌(Lacticaseibacillus rhamnosus) LY2,副干酪乳酪杆菌(Lacticaseibacillus paracasei) W125、L. paracasei 71,乳酸乳球菌乳亚种(Lactococcus lactis subsp. lactis) g21、L. lactis subsp. lactis g13,长双歧杆菌长亚种 (Bifidobacterium longum subsp. longum) S5等15株乳酸菌,由益生菌与乳品深加工省高校重点实验室(扬州大学)提供,分离自广西长寿人群肠道及云南传统发酵食品中。
MRS肉汤、M17肉汤、莫匹罗星、L-半胱氨酸盐酸盐溶液、2.5 L微需氧产气包、2.5 L圆底立式厌氧培养袋,青岛海博生物技术有限公司;盐酸、氢氧化钠、氯化银、无水乙醇、无水甲醇(分析纯),国药集团化学试剂有限公司;氢氧化钠(食品级),山东滨化东瑞化工有限责任公司;中性蛋白酶(neutrase,0.8 AU-N/g)、风味蛋白酶(flavorzyme,1 000 LAPU/g)、复合蛋白酶(protamex,1.6 AU-N/g),诺维信(中国)生物技术有限公司;脱脂乳粉,新西兰恒天然集团;奎宁(食品级),上海皓元生物医药科技有限公司;DPPH自由基清除能力试剂盒、羟自由基测定试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)活性测定试剂盒,南京建成生物工程研究所。
双歧杆菌液体培养基:取10 mL灭菌后的MRS液体培养基,在厌氧工作站中,添加100 μL过滤除菌后的莫匹罗星和200 μL 灭菌后的L-半胱氨酸盐酸盐溶液,配制成双歧杆菌液体培养基。
1.2 仪器与设备
X-500高压灭菌锅,日本TOMY公司;Bug box 厌氧工作站,英国Ruskinn科技有限公司;Millipore Direct 8超纯水仪,美国Milliport公司;HH-6数显恒温水浴锅,国华电器有限公司;pHS-3B精密型pH计,上海雷磁仪器厂;SA402B电子舌,日本Insent公司;DNP-9272恒温培养箱,上海精宏实验设备有限公司;Legendmach1.6R高速冷冻离心机、1510多功能酶标仪,美国Thermo Scientific公司;固相微萃取纤维头(solid-phase microextraction,SPME),美国Supelco公司;Agilent 7890B气相色谱仪,美国安捷伦科技有限公司。
1.3 实验方法
1.3.1 不同蛋白酶对脱脂乳水解度的影响
配制12%(质量分数)的脱脂乳溶液,并用0.5 mol/L食品级氢氧化钠调pH值至7.0,中性蛋白酶、风味蛋白酶和复合蛋白酶的酶解条件参照诺维信蛋白酶说明书和相关文献[16-17]进行,具体见表1。脱脂乳酶解4.5 h后,于105 ℃,5 min灭酶后置于4 ℃ 冰箱保存备用。
表1 蛋白酶的酶解条件
Table 1 Enzymatic hydrolysis conditions of proteases
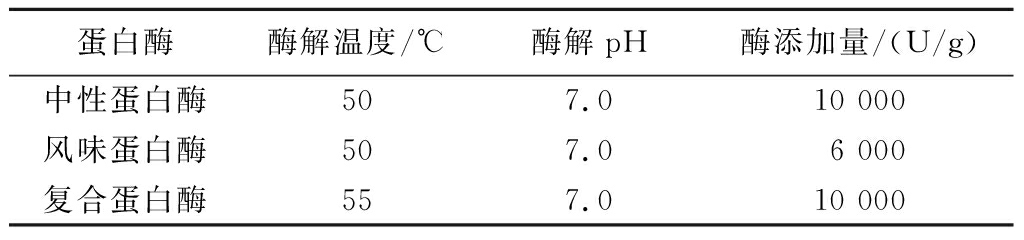
蛋白酶酶解温度/℃酶解pH酶添加量/(U/g)中性蛋白酶507.010 000风味蛋白酶507.06 000复合蛋白酶557.010 000
1.3.2 酶解脱脂乳水解度的测定
根据文献的方法[18]采用pH-Stat法测定酶解脱脂乳的水解度。取100 mL酶解脱脂乳,记录每次调至最适酶解pH所需食品级氢氧化钠的体积,利用公式(1)计算其水解度:
水解度![]()
(1)
式中:B为食品级氢氧化钠溶液体积,mL;Mb为NaOH溶液浓度,为0.5 mol/L;α为氨基的平均离解度,1/α为2.26;Mp为蛋白质的质量,为3.84 g;htot为对于酪蛋白,取值为8.2 mmol/g。
1.3.3 脱脂乳酶解条件的优化
根据1.3.1节的实验结果得到酶解脱脂乳水解度最大的蛋白酶,以水解度为评价指标,进一步优化其酶解条件。
1.3.3.1 酶解条件对酶解脱脂乳水解度的影响
酶解时间:蛋白酶的酶解温度为50 ℃,脱脂乳pH值为7.0,酶添加量为10 500 U/g,考察酶解时间(0.5、1.5、2.5、3.5、4.5、5.5、6.5、7.5 h)对酶解脱脂乳水解度的影响。
酶添加量:蛋白酶的酶解温度为50 ℃,脱脂乳pH值为7.0,酶解时间为4.5 h,考察蛋白酶添加量(1 500、4 500、7 500、10 500、13 500、16 500 U/g)对酶解脱脂乳水解度的影响。
酶解温度:脱脂乳pH值为7.0,蛋白酶的添加量为10 500 U/g,酶解时间4.5 h,考察酶解温度(45、50、55、60、65 ℃)对酶解脱脂乳水解度的影响。
脱脂乳pH:蛋白酶的酶解温度为50 ℃,酶添加量为10 500 U/g,酶解时间4.5 h,考察脱脂乳pH(6.5、7.0、7.5、8.0、8.5)对酶解脱脂乳水解度的影响。
1.3.3.2 脱脂乳酶解条件的正交试验优化
通过单因素试验,确定酶解温度、酶添加量及脱脂乳pH为主要影响因素,以水解度为评价指标,选用L9(33)正交试验对脱脂乳的水解条件进行优化,因素及水平设计见表2。
表2 PSM的条件因素水平
Table 2 The condition factors and levels for enzymatic hydrolyzed skim milk by Protamex
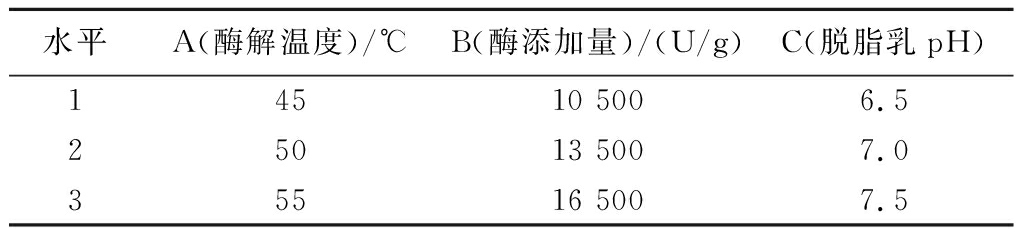
水平A(酶解温度)/℃B(酶添加量)/(U/g)C(脱脂乳pH)14510 5006.525013 5007.035516 5007.5
注:PSM为复合蛋白酶酶解脱脂乳(skim milk hydrolyzed with Protamex)(下同)。
1.3.4 乳酸菌发酵酶解脱脂乳
分别利用MRS、M17及双歧杆菌液体培养基培养活化乳酸菌菌株,其中双歧杆菌置于厌氧工作站中厌氧培养。将活化后的乳酸菌菌株于8 000×g离心10 min,收集菌体,无菌生理盐水洗涤2次,将浓度调至1×109 CFU/mL,以3%(体积分数)接菌量接种于1.3.3节中获得的酶解脱脂乳中,其中双歧杆菌于厌氧工作站中洗涤并接种至酶解脱脂乳中,37 ℃培养18 h,于4 ℃冰箱冷藏备用。
1.3.5 乳酸菌发酵酶解脱脂乳
1.3.5.1 DPPH自由基清除能力的测定
用80%(体积分数)的甲醇将发酵后的酶解脱脂乳稀释10倍,将样本、80%(体积分数)的乙醇及工作液按说明书依次加至1.5 mL离心管中混匀,对照管中加入0.4 mL样本和0.6 mL甲醇,测定管中加入0.4 mL样本和0.6 mL工作液,空白管中加入0.4 mL甲醇和0.6 mL工作液;25 ℃避光静置30 min,4 000×g离心5 min,吸取200 μL至96孔板中,于517 nm处测定吸光度值;具体操作方法参照试剂盒说明书和文献[19]的方法进行,并按照公式(2)计算样本的DPPH自由基清除率:
DPPH自由基清除率![]()
(2)
式中:OD测定、OD对照及OD空白分别为测定管、对照管及空白管中样本在波长为517 nm处的OD值。
1.3.5.2 羟自由基抑制率的测定
用双蒸水将发酵后的酶解脱脂乳稀释150倍,然后将配制好的应用液于37 ℃水浴3 min,并在水浴锅中将样本、双蒸水、0.3 g/L H2O2标准应用液、底物应用液及显色剂等按羟自由基测定试剂盒说明书依次加至离心管中;25 ℃放置20 min,取200 μL至96孔板中,测定550 nm处各管吸光度值,具体操作方法参照试剂盒说明书和文献[20]的方法进行,并按照公式(3)计算样本对羟自由基的抑制率:
羟自由基抑制率![]()
(3)
式中:OD对照、OD测定及OD空白分别为对照管、测定管及空白管中样本在波长为550 nm处的OD值。
1.3.5.3 SOD活性的测定
将样品加入到SOD试剂中,与反应混合物混匀后于37 ℃放置20 min后,取出混合物,用空白对照测量其在450 nm处的吸光度值,具体操作方法参照试剂盒说明书和文献[21]的方法进行。
1.3.6 酶解脱脂乳苦味的感官评价
选取10名初级评价员参与评价,年龄为22~26岁,其中男性和女性各5人;参与感官评价的人员无味觉异常报告,且经挑选、培训后具有一定的感官评价的能力和感官分析经验。配制5×10-5、1×10-4、2×10-4、4×10-4、8×10-4和1.6×10-3 g/mL的奎宁标准溶液,对应的感官评价分值为0、2、4、6、8、10分,苦味越低,得分越低[22],10位评价人员在室温下将样品与标准溶液进行对比,对待测样品按照标准分值进行打分。
1.3.7 酶解脱脂乳滋味的测定
利用电子舌对酶解脱脂乳的滋味进行测定,4根传感器分别包括酸味、苦味、咸味、鲜味。将80 mL样品混匀后置于电子舌专用烧杯中,样品采集与清洗交替进行;清洗液冲洗90 s,参比液清洗120 s,新参比液清洗120 s,传感器在平衡位置归零30 s,达到平衡条件后,开始测定样品,测试时间30 s,每个样品重复检测4次,具体操作方法参照文献[23]的方法进行。
1.3.8 酶解脱脂乳风味物质的测定
参考文献[24]的方法,将首次使用的SPME在250 ℃下插入气相色谱仪的进样口,直至无色谱峰出现;基线稳定后,将 SPME 纤维插入装有样品的气相瓶中萃取60 min。在250 ℃下解吸3 min,同时仪器开始收集数据。
采用程序升温法进行色谱分析:DB-WAX 色谱柱(30 m×0.25 mm,0.25 μm)初始温度为35 ℃,然后以4 ℃/min的速度升温至140 ℃,最后升温至250 ℃,并保持3 min;传输线温度设定为250 ℃。以氦气作为载气,流速为1 mL/min,未进行分流进样。
质谱分析:电子电离在70 eV下进行,离子源温度为230 ℃,质量扫描范围(m/z)为33~450 AMU,发射电流为100 μA。
定性定量方法:通过对各组分计算机检索,并与National Institute of Standards and Technoloy(NIST)质谱库提供的标准质谱图对照,报道匹配度最大的结果,通过峰面积归一化法得到每种挥发性风味物质相对含量,测试样品进行3次生物学重复实验,取平均值作为各风味物质相对含量。
1.4 数据统计与分析
所有处理组均进行3次生物学重复实验,实验结果以“平均值±标准差”表示,采用GraphPad Prism 10.0软件作图,并利用SPSS 26.0软件对数据进行单因素方差分析(Oneway ANOVA),采用Tukey检验进行显著性差异分析,P<0.05表示差异显著。
2 结果与分析
2.1 蛋白酶对酶解脱脂乳水解度的影响
水解度是衡量脱脂乳酶解程度的重要指标,3种蛋白酶酶解脱脂乳的水解度见图1。
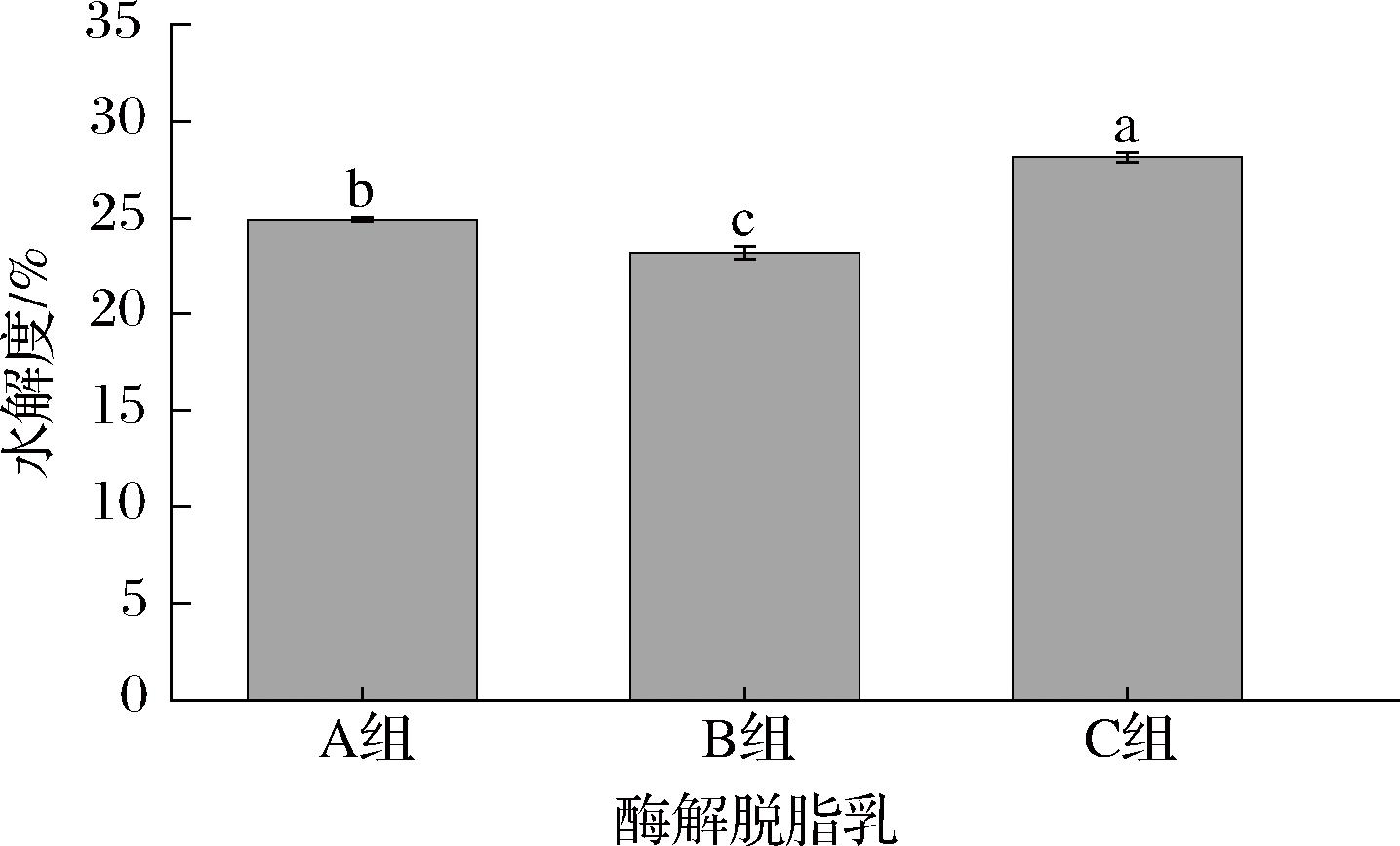
图1 酶解脱脂乳的水解度
Fig.1 Hydrolysis degree of enzymatic hydrolyzed skim milk
注:A组为中性蛋白酶酶解脱脂乳;B组为风味蛋白酶酶解脱脂乳;C组为PSM;不同字母表示差异显著(P<0.05)(下同)。
由图1可知,PSM的水解度显著高于中性蛋白酶和风味蛋白酶水解的脱脂乳(P<0.05),表明PSM的水解度较高。由于复合蛋白酶是由内切蛋白酶、外切肽酶以及风味蛋白酶复合而成,作用位点会比较广泛,其对乳中的酪蛋白、β-乳球蛋白、α-乳白蛋白等蛋白具有较好的酶解能力[25],而中性蛋白酶和风味蛋白酶对β-乳球蛋白的水解能力较差[26,27];因此,对不同种类蛋白水解能力的差异可能是PSM的水解度大于中性蛋白酶和风味蛋白酶的重要因素。
2.2 脱脂乳的酶解条件优化
2.2.1 复合蛋白酶的酶解条件对脱脂乳水解度的影响
不同复合蛋白酶酶解时间、添加量、酶解温度及脱脂乳pH对PSM水解度的影响分别见图2~图5。
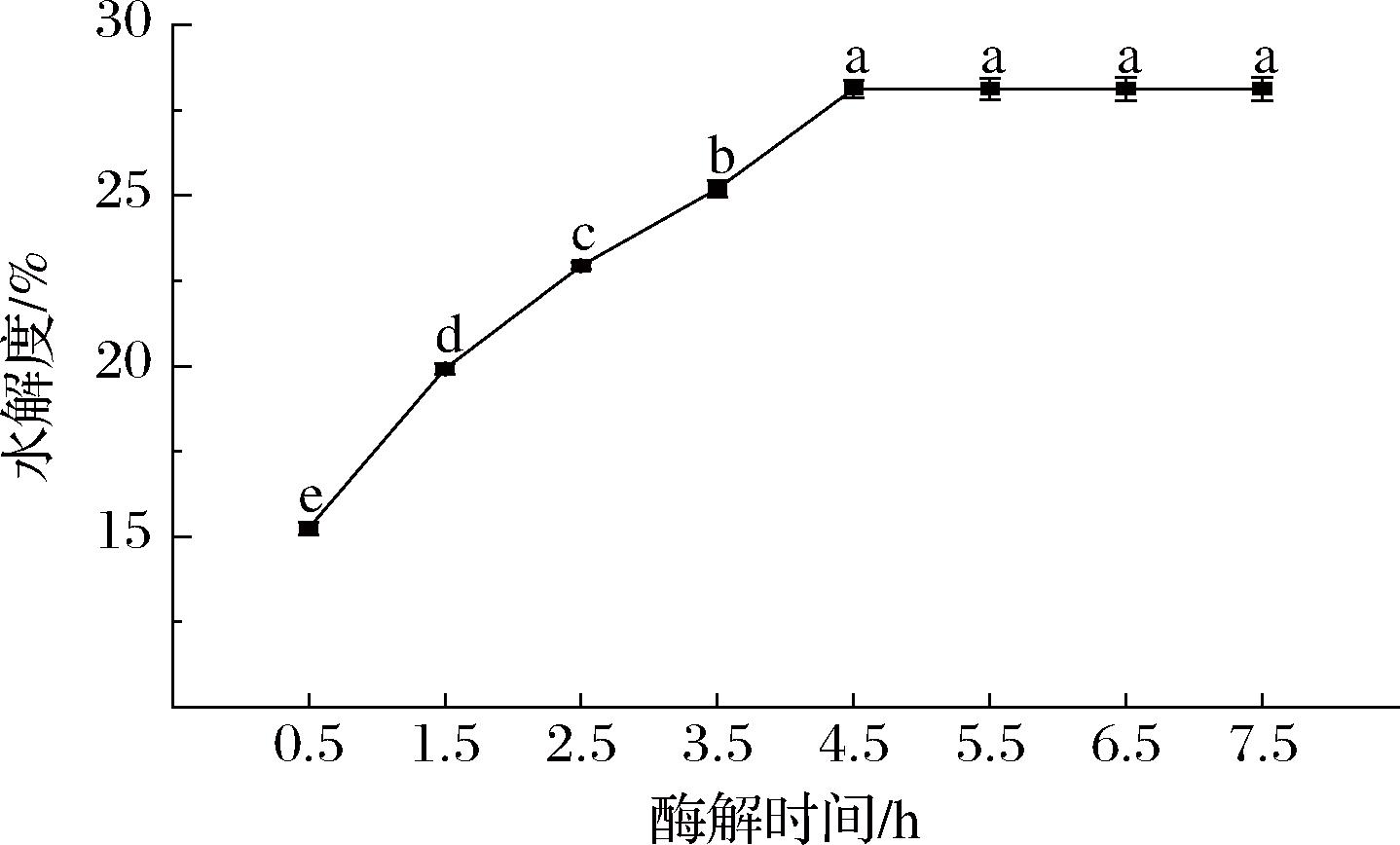
图2 不同复合蛋白酶酶解时间的脱脂乳水解度
Fig.2 Hydrolysis degree of skimmed milk with different Protamex hydrolysis time
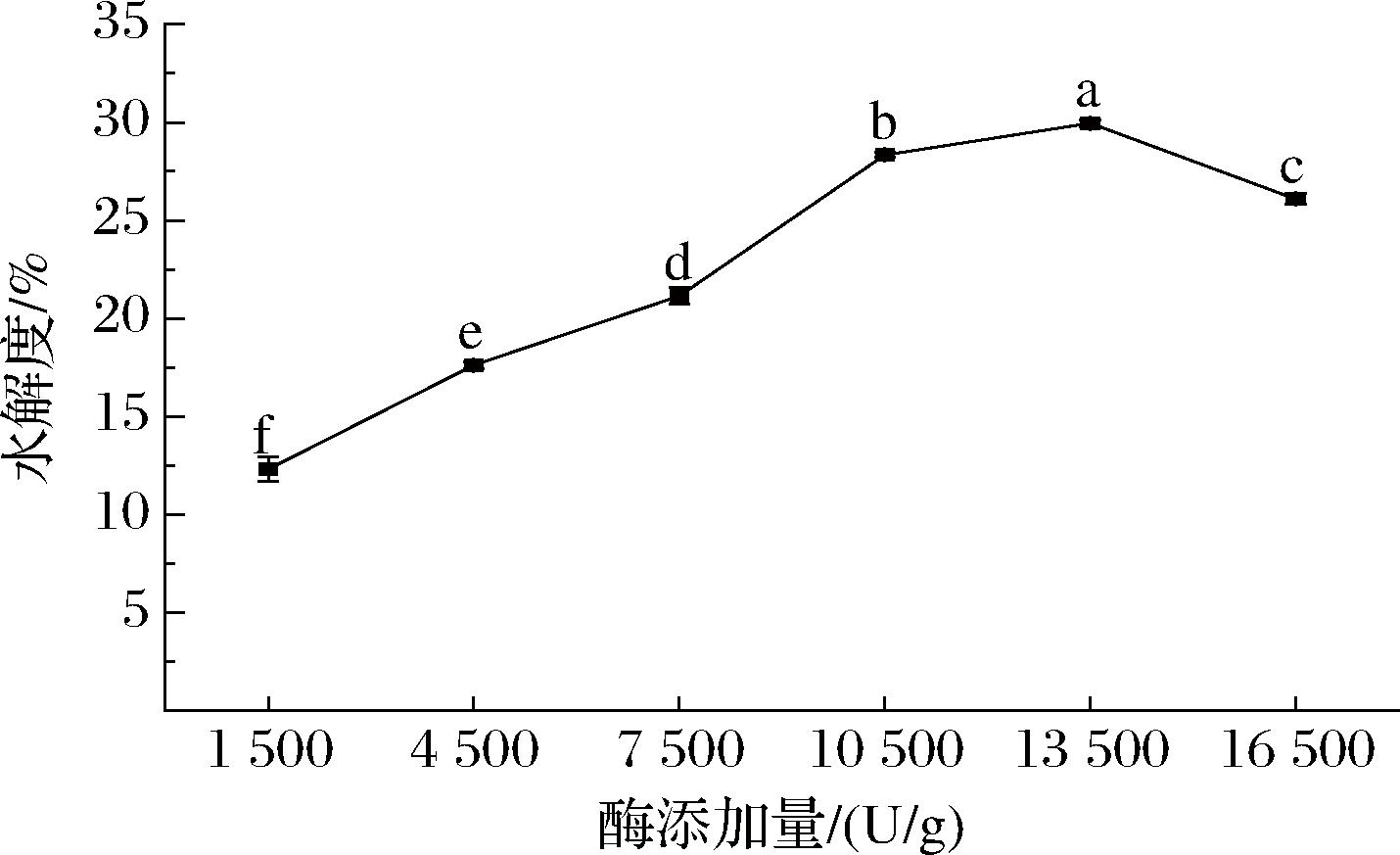
图3 不同复合蛋白酶添加量的脱脂乳水解度
Fig.3 Hydrolysis degree of skimmed milk with different addition amounts of Protamex
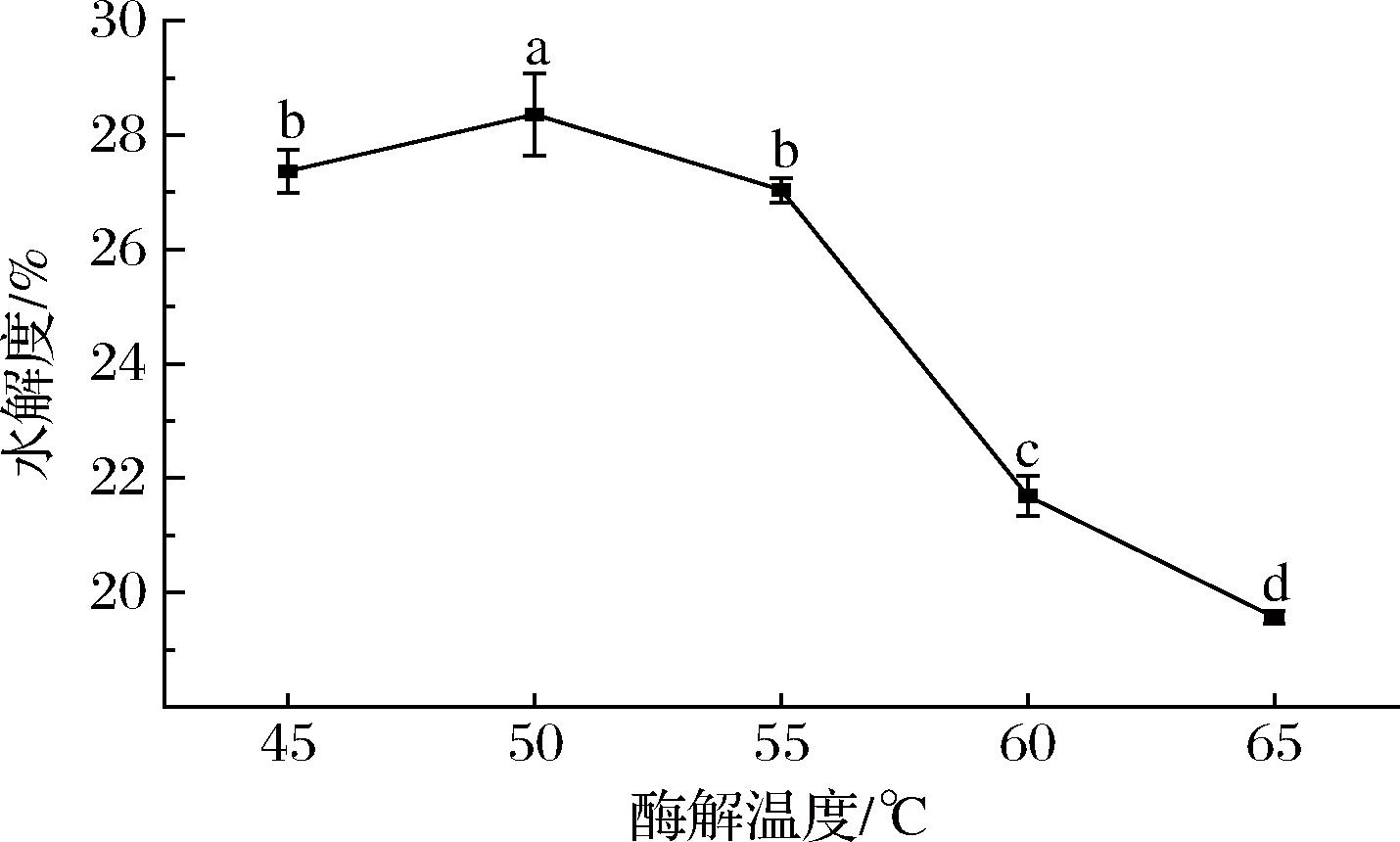
图4 不同复合蛋白酶酶解温度的脱脂乳水解度
Fig.4 Hydrolysis degree of skimmed milk with different Protamex hydrolysis temperatures
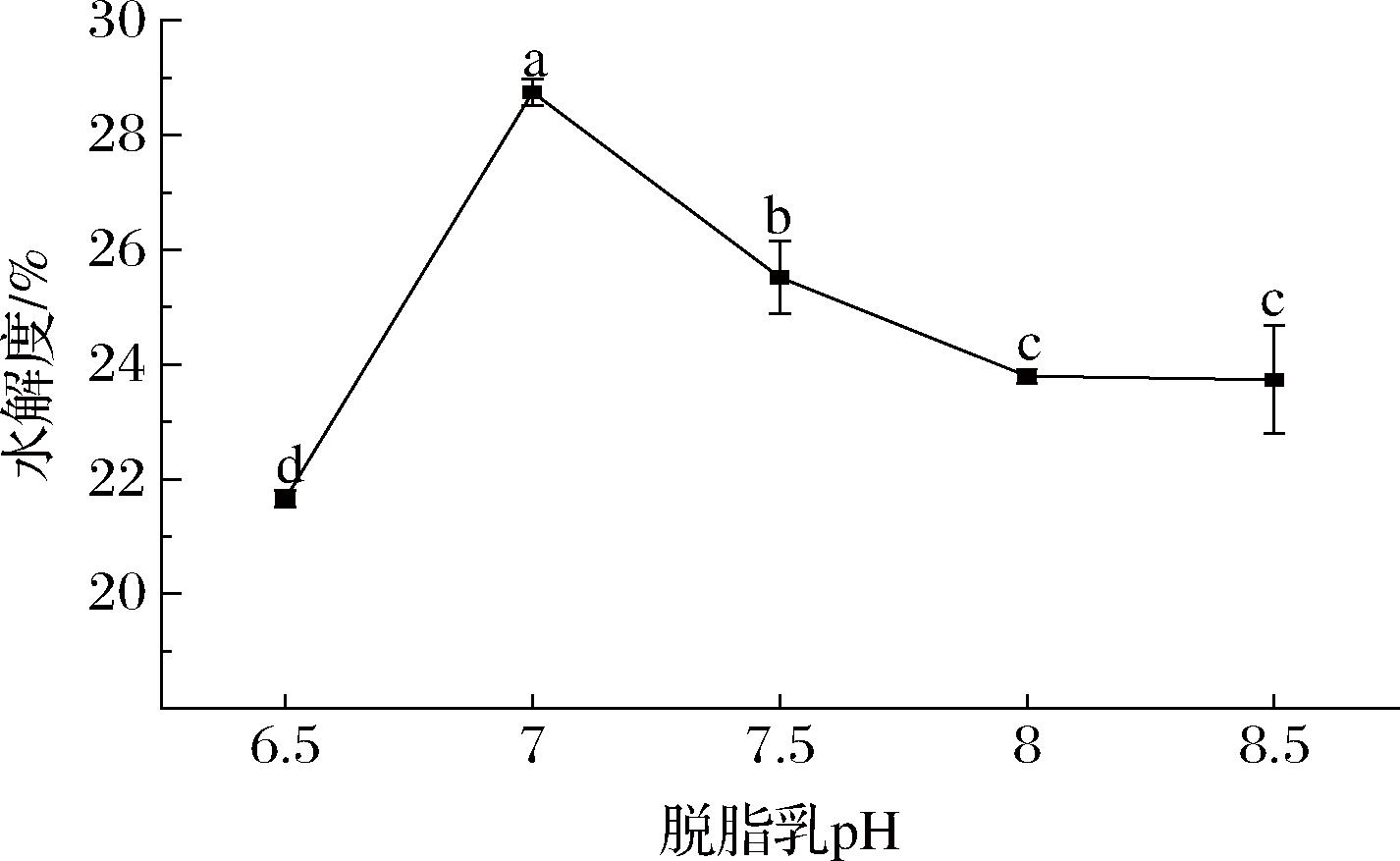
图5 不同pH的酶解脱脂乳水解度
Fig.5 Hydrolysis degree of enzymatic hydrolyzed skim milk with different pH values
如图2所示,PSM的水解度随酶解时间延长呈先上升后稳定的趋势。PSM在开始的4.5 h内,由于复合蛋白酶酶解反应的底物浓度及酶活力相对较高,有利于酶解的传质过程,因此水解度上升较快,4.5 h时达到最大值,为28%,显著高于3.5 h时的25%(P<0.05);当酶解时间大于4.5 h后,底物浓度及酶活力的降低使得酶促反应的速率逐渐下降,水解度的上升趋势渐缓,酶解曲线接近于平行,PSM在5.5、6.5、7.5 h时的水解度与4.5 h时无显著性差异(P>0.05)。
因此,在后续正交试验优化PSM的水解度时,选择4.5 h作为PSM的酶解时间。
如图3所示,当复合蛋白酶的添加量为0~13 500 U/g时,PSM的水解度随酶添加量的增加而上升;可能是较多的添加量提高了酶与脱脂乳蛋白质分子的接触机率,使得底物转化为产物的量增加[28],进而增加了PSM的水解度;在酶添加量为13 500 U/g时,PSM的水解度达到最大值,为30%,显著高于10 500 U/g时的28%(P<0.05);当酶添加量为16 500 U/g时,PSM的水解度开始下降,其水解度显著低于13 500 U/g时(P<0.05),这可能是由于复合蛋白酶的位阻效应阻止了酶与催化位点的蛋白质接触,降低了底物扩散和饱和反应速率[7,29],进而使得脱脂乳的水解度下降。
因此,选择10 500、13 500、16 500 U/g作为PSM的酶解添加量进行后续的优化实验。
如图4所示,PSM的水解度随酶解温度的增加呈先上升后下降的趋势。在酶解温度为50 ℃时,PSM的水解度达到最大值,为28%,显著高于45 ℃时的27%和55 ℃时的27%(P<0.05);当酶解温度大于50 ℃时,脱脂乳的水解度开始下降,可能是由于高温破坏了复合蛋白酶的结构,导致其变性失活[30]。
因此,选择45、50、55 ℃作为PSM的酶解温度进行后续的优化实验。
由图5可知,PSM的水解度随脱脂乳pH的增加呈先上升后下降的趋势,当复合蛋白酶在脱脂乳pH值为7.0时,PSM的水解度达到最大值,为29%,显著高于pH 6.5时的22%和pH 7.5时的26%(P<0.05),可能是由于pH 7.0是酶与乳蛋白的解离基团处于最易结合并转化成产物的解离状态[31],进而使得PSM的水解度显著高于其他pH时的水解度(P<0.05)。当pH值增加到8和8.5时,PSM的水解度进一步下降,可能是pH的增加使得蛋白酶的蛋白质结构发生变性或干扰了底物的离子特性,降低了底物与酶结合的能力[29],进而降低了PSM的水解度。
因此,选择脱脂乳pH 6.5、7.0、7.5作为进行后续的优化实验。
2.2.2 正交试验优化结果分析
酶解脱脂乳的水解受到蛋白酶酶解时间、添加量、酶解温度及脱脂乳pH等多种因素的影响,而正交试验不仅可以揭示多种酶解因素间的交互作用对酶解脱脂乳水解度的影响,还可以降低试验次数、量化各因素的主效应及交互效应,并确定最优酶解条件,为进一步的中试生产等放大试验提供数据支撑。因此,利用正交试验进一步优化最优酶解条件。
通过单因素试验发现,PSM的水解度在4.5 h时达到最大,在5.5、6.5、7.5 h时与4.5 h时无显著性差异(P>0.05);因此,试验以4.5 h作为PSM的酶解时间,并以酶解温度、酶添加量和脱脂乳pH为自变量,进行正交试验优化,结果见表3。
表3 PSM条件的正交试验结果
Table 3 Results of the orthogonal experiment for PSM conditions
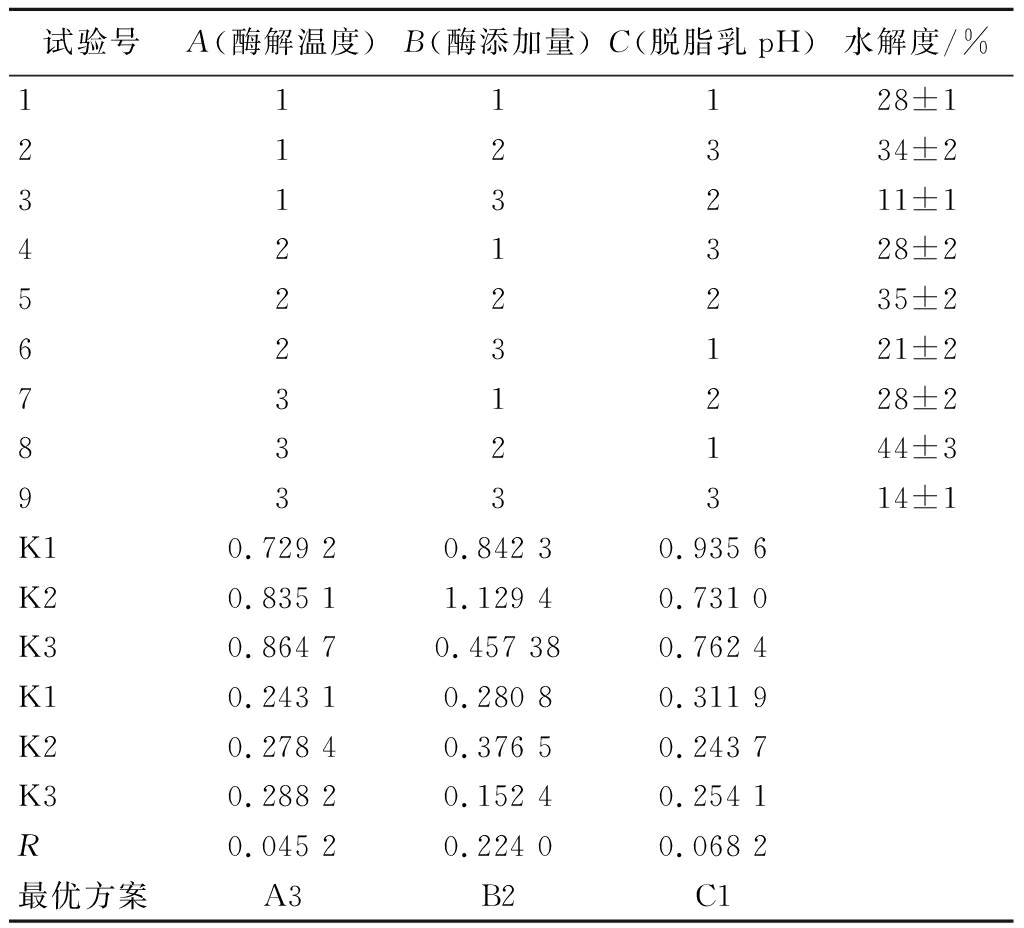
试验号A(酶解温度)B(酶添加量)C(脱脂乳pH)水解度/%111128±1212334±2313211±1421328±2522235±2623121±2731228±2832144±3933314±1K10.729 20.842 30.935 6K20.835 11.129 40.731 0K30.864 70.457 380.762 4K10.243 10.280 80.311 9K20.278 40.376 50.243 7K30.288 20.152 40.254 1R0.045 20.224 00.068 2最优方案A3B2C1
由表3可知,影响酶解脱脂乳参数大小顺序(即R值大小顺序)为:酶添加量>脱脂乳pH>酶解温度;酶解脱脂乳的最佳参数组合为A3B2C1,即参数值为:复合蛋白酶酶解温度55 ℃,酶添加量13 500 U/g,脱脂乳pH 6.5。利用最佳参数组合进行验证,得到PSM的水解度为44%,与正交试验结果差异较小,表明使用该模型优化得到的参数可靠。
2.3 乳酸菌发酵酶解脱脂乳的抗氧化能力
以未发酵的PSM为对照,研究15株乳酸菌菌株发酵对PSM的DPPH自由基清除率、羟自由基抑制率和SOD活性等抗氧化能力的影响,结果如表4所示。
表4 乳酸菌发酵PSM的抗氧化能力
Table 4 Antioxidant capacity of PSM fermented by lactic acid bacteria (LAB)
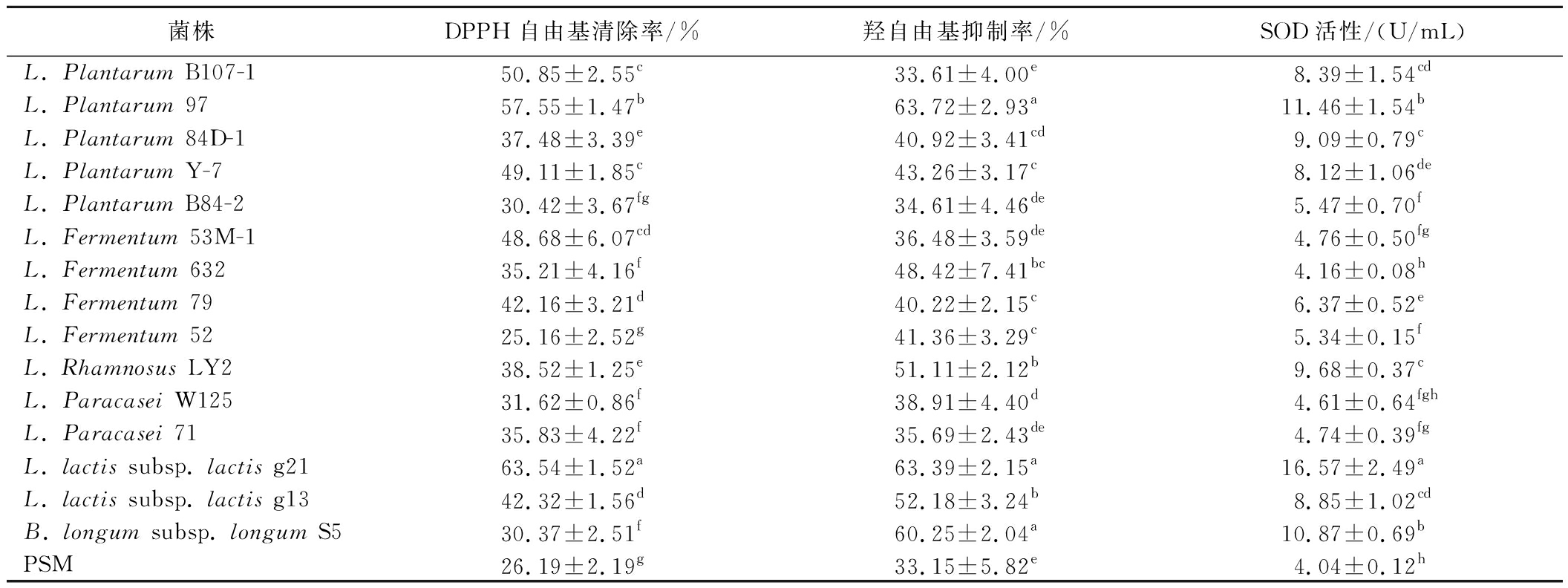
菌株DPPH自由基清除率/%羟自由基抑制率/%SOD活性/(U/mL)L. Plantarum B107-150.85±2.55c33.61±4.00e8.39±1.54cdL. Plantarum 9757.55±1.47b63.72±2.93a11.46±1.54bL. Plantarum 84D-137.48±3.39e40.92±3.41cd9.09±0.79cL. Plantarum Y-749.11±1.85c43.26±3.17c8.12±1.06deL. Plantarum B84-230.42±3.67fg34.61±4.46de5.47±0.70fL. Fermentum 53M-148.68±6.07cd36.48±3.59de4.76±0.50fgL. Fermentum 63235.21±4.16f48.42±7.41bc4.16±0.08hL. Fermentum 7942.16±3.21d40.22±2.15c6.37±0.52eL. Fermentum 5225.16±2.52g41.36±3.29c5.34±0.15fL. Rhamnosus LY238.52±1.25e51.11±2.12b9.68±0.37cL. Paracasei W12531.62±0.86f38.91±4.40d4.61±0.64fghL. Paracasei 7135.83±4.22f35.69±2.43de4.74±0.39fgL. lactis subsp. lactis g2163.54±1.52a63.39±2.15a16.57±2.49aL. lactis subsp. lactis g1342.32±1.56d52.18±3.24b8.85±1.02cdB. longum subsp. longum S530.37±2.51f60.25±2.04a10.87±0.69bPSM26.19±2.19g33.15±5.82e4.04±0.12h
注:同列比较,不同上标字母表示数据具有显著性差异(P<0.05)。
由表4可知,大部分乳酸菌菌株的发酵能够显著提升PSM对DPPH自由基的清除率、羟自由基的抑制率和SOD的活性的影响(P<0.05),但存在菌株差异性。15株乳酸菌菌株发酵酶解脱脂乳的DPPH自由基清除率为25.16%~63.54%,羟自由基抑制率为33.61~63.72%,SOD活性为4.16~16.57 U/mL。
L. plantarum 97和L. lactis subsp. lactis g21发酵的PSM对DPPH自由基的清除率分别为57.55%及63.54%,显著高于脱脂乳、PSM和其他菌株(P<0.05);L. plantarum 97、L. lactis subsp. lactis g21及长双歧杆菌S5发酵的PSM对·OH的抑制率分别为63.72%、63.39%及60.25%,显著高于脱脂乳、PSM和其他菌株(P<0.05);L. plantarum 97和L. lactis subsp. lactis g21的SOD活性分别为11.46 和16.57 U/mL,显著高于脱脂乳、PSM和其他菌株(P<0.05);表明L. plantarum 97和L. lactis subsp. lactis g21的发酵能够较好地提升PSM的抗氧化能力。
由于乳酸菌不仅能够代谢产生有机酸和氨基酸等抗氧化物质[32],同时代谢产生的酶类也会进一步水解脱脂乳中的蛋白质,增加水解产物中具有疏水氨基酸残基的肽等抗氧化物质的含量[33-34],从而提高PSM清除DPPH自由基、抑制羟自由基的能力,并增加其SOD活性[14,35-36];而乳酸菌在发酵过程中代谢产物的差异可能是试验的乳酸菌菌株增强PSM抗氧化能力具有差异性的重要因素。
2.4 乳酸菌发酵对酶解脱脂乳苦味的影响
2.4.1 乳酸菌发酵对酶解脱脂乳苦味评价值的影响
苦味对食品的感官产生了重要的影响。本文以未发酵的PSM为对照,研究了L. plantarum 97和L. lactis subsp. lactis g21发酵对PSM苦味评价值的影响,结果见图6。

图6 乳酸菌发酵PSM的苦味评价值
Fig.6 Bitterness evaluation value of PSM fermented by LAB
注:A组为PSM; B组为L. plantarum 97发酵的PSM;C组为L. lactis subsp. lactis g21发酵的PSM。
由图6可知,植物乳植杆菌97发酵的PSM的苦味评价值为5.05,显著低于乳酸乳球菌乳亚种g21的6.10(P<0.05);虽然植物乳植杆菌97发酵的PSM的苦味评价值并未显著低于PSM(P>0.05),但也在一定程度上降低了PSM的苦味,而乳酸乳球菌乳亚种g21的发酵则显著增加了PSM的苦味评价值(P<0.05)。
2.4.2 乳酸菌发酵对酶解脱脂乳苦味响应值的影响
苦味响应值表达的是瞬时最强苦味强度。本文研究了植物乳植杆菌97和乳酸乳球菌乳亚种g21发酵对PSM苦味响应值的影响,结果见图7。

图7 乳酸菌发酵PSM的电子舌滋味
Fig.7 Electronic tongue taste profiles of PSM fermented by LAB
由图7可知,L. plantarum 97发酵的PSM的苦味响应值为5.21,低于L. lactis subsp. lactis g21的7.80和未发酵的5.73,这与苦味评价值的研究结果较为一致;而鲜味则高于L. lactis subsp. lactis g21。L. lactis subsp. lactis g21发酵的PSM的涩味响应值高于L. plantarum 97和PSM,而涩味对酶解脱脂乳的风味产生了重要的影响,表明L. plantarum 97发酵能够改善PSM的风味,而L. lactis subsp. lactis g21的发酵可能导致了酶解脱脂乳的苦味和涩味。
有研究表明,酪氨酸、苯丙氨酸等苦味氨基酸是L. plantarum在乳中生长的必需氨基酸[38];因此,L. plantarum 97在发酵过程中可能通过代谢酪氨酸、苯丙氨酸等苦味氨基酸来降低其在酶解脱脂乳中的含量,进而改善酶解脱脂乳的苦味;而植物乳植杆菌发酵还能够将苦味氨基酸变成鲜味的乙酰基衍生物[39],这可能是L. plantarum 97发酵的PSM的鲜味要高于L. lactis subsp. lactis g21,但苦味要低于L. lactis subsp. lactis g21的因素。乳酸乳球菌在代谢过程中容易产生内肽酶,而内肽酶含量的增加会使得多肽末端疏水性氨基酸暴露,进一步增加酶解脱脂乳的苦味[40],这也可能导致L. lactis subsp. lactis g21发酵的PSM苦味高于L. plantarum 97。
2.5 乳酸菌发酵对酶解脱脂乳挥发性风味物质的影响
以未发酵的PSM为对照,研究了L. plantarum 97和L. lactis subsp. lactis g21发酵对PSM挥发性风味物质的影响,结果如表5所示。
表5 乳酸菌发酵对PSM挥发性风味物质的影响
Table 5 Effect of LAB fermentation on volatile flavor substances in PSM

种类物质相对含量/%PSML.plantarum 97发酵PSML.lactis subsp.Lactis g21发酵PSM醛类(8种)庚醛0.27±0.03 ——异戊醛——0.60±0.04癸醛0.22±0.01a0.19±0.02a0.10±0.01b天然壬醛1.07±0.05a0.21±0.03b0.10±0.02c苯乙醛——1.09±0.032,4-二甲基苯甲醛1.29±0.08b1.79±0.01a0.59±0.03c苯甲醛5.68±0.16a0.50±0.02c1.56±0.08b小计8.53±0.12a2.69±0.06c 4.04±0.05b醇类(17种)1-辛烯-3-醇—0.11±0.02 —十六醇—0.05±0.01b0.13±0.02a顺-3-癸醇—0.06±0.01a0.08±0.01a(E)-癸-3-烯-1-醇—0.13±0.02 —β-苯乙醇——0.52±0.03 2-癸烯-1-醇—0.12±0.03b0.28±0.02a正己醇—0.36±0.03a0.17±0.04b3,4-二甲基苯甲醇—0.12±0.04b0.40±0.05a十一醇—0.33±0.06 —1-癸醇——0.40±0.031-庚醇—0.98±0.07 —1-戊醇——3.09±0.08 壬醇—1.63±0.09a1.79±0.11a辛醇1.34±0.09c3.40±0.30b5.12±0.60a小计1.34±0.09c7.29±0.27b11.98±0.55a 酮类(6种)2-十三烷酮—0.05±0.01b0.13±0.06a2-壬酮0.34±0.03b0.15±0.04c0.62±0.02a2,3-庚烷二酮——0.67±0.04 2-庚酮0.30±0.03c0.38±0.03b0.66±0.02a2-癸酮1.19±0.09a0.38±0.05b0.28±0.02c异佛尔酮0.26±0.02c2.45±0.13a1.99±0.08b小计2.09±0.07c3.41±0.12b4.35±0.07a酯类(11种)辛酸乙酯——0.19±0.04 8,11-十八碳二烯酸甲酯0.25±0.02 ——12,15-十八碳二烯酸甲酯—0.07±0.01—2,2,4-三甲基-3-羟基戊酸异丁基酯——0.26±0.02甲酸庚酯——0.74±0.04 7,10-十八碳二烯酸甲酯0.90±0.03——棕榈酸甲酯2.53±0.09a0.05±0.02c0.18±0.02b9,12-十八碳二烯酸(Z,Z)-甲酯——0.99±0.08 硬脂酸甲酯4.90±0.07 ——2,2,4-三甲基-1,3-戊二醇二异丁酸酯5.13±0.10a0.30±0.03c0.67±0.05b亚油酸甲酯33.90±2.03a0.61±0.05b—小计47.61±1.36a 1.03±0.03c 3.03±0.08b酸类(1种)辛酸——0.37±0.04 小计——0.37±0.04杂环类(11种)辛烷—0.13±0.02 —长叶烯0.14±0.02a0.09±0.01b0.08±0.02b间异丙基甲苯—0.63±0.06 —十二烷—0.12±0.04 —2-十一烷—0.11±0.03b0.26±0.02a2,4-二叔丁基苯酚—0.17±0.02a0.18±0.01a甘菊蓝0.19±0.02b0.50±0.04a—十四烷—0.17±0.04a0.15±0.03a均三甲苯——1.12±0.09 丁基羟基甲苯2.68±0.09a1.13±0.08b1.06±0.05b小计3.01±0.07a 3.05±0.06a2.85±0.08b
注:同行同一物质比较,不同上标字母表示数据具有显著性差异(P<0.05);“—”表示未检测到。
由表5可知,L. plantarum 97和L. lactis subsp. lactis g21发酵的PSM与未发酵的PSM中挥发性风味成分主要由醛类、醇类、酮类、酯类、酸类和杂环类等组成。
L. plantarum 97和L. lactis subsp. lactis g21发酵显著降低了PSM中醛类物质的相对含量(P<0.05),其中,L. plantarum 97发酵的PSM中醛类物质的相对含量显著低于L. lactis subsp. lactis g21(P<0.05);而醛类物质对腥味贡献较大,会产生不愉快的气味,如具有牛油味的壬醛和具有蜡味的癸醛。2株乳酸菌发酵还显著增加了PSM中醇类和酮类物质的相对含量(P<0.05),醇类和酮类物质对香味贡献较大;醇类物质如具有甜而微有草香味的辛醇、具有蘑菇香和草香味的1-辛烯-3-醇及具有青苹果香味的正己醇[41],酮类物质如异佛尔酮主要呈现薄荷香味[42],而L. plantarum 97发酵的PSM中正己醇和异佛尔酮的相对含量显著高于L. lactis subsp. lactis g21(P<0.05)。有研究表明,L. plantarum能够催化发酵产物中醛类物质的氧化还原转化,将具有不良风味的醛类物质转化为具有良好风味的醇类物质[43],这也可能使得L. plantarum 97发酵的PSM中醛类物质的相对含量较低,而醇类物质的相对含量较高。
由表5还发现,在醛类物质中,L. plantarum 97发酵的PSM中苯甲醛的相对含量显著低于L. lactis subsp. lactis g21发酵的PSM和PSM(P<0.05),而苯甲醛是由苯丙氨酸通过Strercker途径降解产生,具有苦杏仁味[44];在酮类物质中,L. lactis subsp. lactis g21发酵的PSM中2-庚酮的相对含量显著高于L. plantarum 97发酵的PSM和PSM(P<0.05),而2-庚酮能与苦味肽共同作用产生一定的苦味[45],表明相对含量较低的苯甲醛和2-庚酮可能是L. plantarum 97发酵的PSM苦味较低的因素。
因此,综合苦味和挥发性风味试验结果表明,L. plantarum 97发酵对PSM具有良好的脱苦和改善风味的作用。
3 结论
PSM的水解度显著高于中性蛋白酶和风味蛋白酶(P<0.05),当脱脂乳pH值为6.5,复合蛋白酶的添加量为13 500 U/g,55 ℃酶解4.5 h时,PSM水解度达到最大。本研究的L. plantarum, L. fermentum、L. lactis subsp. lactis等菌株的发酵能够在一定程度上增强PSM的抗氧化能力,而L. plantarum 97发酵对PSM抗氧化能力的增强效果要高于其他菌株,并能够改善PSM的苦味和挥发性风味物质。研究将为开发具有益生功能的、风味良好的发酵乳饮料及相关的后生元产品提供理论依据。
[1] RYAN G, NONGONIERMA A B, O’REGAN J, et al. Functional properties of bovine milk protein isolate and associated enzymatic hydrolysates[J]. International Dairy Journal, 2018, 81:113-121.
[2] KAUR S, HUPPERTZ T, VASILJEVIC T. Plant proteases and their application in dairy systems[J]. International Dairy Journal, 2024, 154:105925.
[3] ZHOU H, WANG C Z, YE J Z, et al. Effects of enzymatic hydrolysis assisted by high hydrostatic pressure processing on the hydrolysis and allergenicity of proteins from Ginkgo Seeds[J]. Food and Bioprocess Technology, 2016, 9(5):839-848.
[4] HU X M, WANG Y M, ZHAO Y Q, et al. Antioxidant peptides from the protein hydrolysate of monkfish (Lophius litulon) muscle: Purification, identification, and cytoprotective function on HepG2 cells damage by H2O2[J]. Marine Drugs, 2020, 18(3):153.
[5] CHEN L, LV Y, ZHONG F. Enhancing bioavailability of soy protein isolate (SPI) nanoparticles through limited enzymatic hydrolysis: Modulating structural properties for improved digestion and absorption[J]. Food Hydrocolloids, 2024, 147:109397.
[6] CUI Q, SUN Y X, CHENG J J, et al. Effect of two-step enzymatic hydrolysis on the antioxidant properties and proteomics of hydrolysates of milk protein concentrate[J]. Food Chemistry, 2022, 366:130711.
[7] 范梦珠, 郭婷, 林文珍, 等. 响应面法优化乳源蛋白水解工艺[J]. 中国乳品工业, 2020, 48(1): 18-22.FAN M Z, GUO T, LIN W Z, et al. Optimization of hydrolysis process of milk protein by response surface methodology[J]. Chinese Journal of Dairy Industry, 2020, 48(1): 18-22.
[8] CHEISON S C, WANG Z, XU S-Y. Use of macroporous adsorption resin for simultaneous desalting and debittering of whey protein hydrolysates[J]. International Journal of Food Science&Technology, 2007, 42(10):1228-1239.
[9] SPELLMAN D, OCUINN G, FITZGERALD R. Bitterness in Bacillus proteinase hydrolysates of whey proteins[J]. Food Chemistry, 2009, 114(2):440-446.
[10] 李梦卓, 段雪妍, 王俊娟, 等. 蛋白质水解物的苦味形成机制及其酶解脱苦和风味改善的研究进展[J]. 食品工业科技, 2025, 46(6): 417-426.LI M Z, DUAN X Y, WANG J J, et al. Research progress on the mechanism of astringency formation in protein hydrolysates and the enzymatic relief of astringency and flavor improvement[J]. Food Industry Science and Technology, 2025, 46(6): 417-426.
[11] LIU B Y, LI N N, CHEN F S, et al. Review on the release mechanism and debittering technology of bitter peptides from protein hydrolysates[J]. Comprehensive Reviews in Food Science and Food Safety, 2022, 21(6):5153-5170.
[12] 赵普瑛, 曾小英, 覃瑞, 等. 脱苦风味蛋白酶的研究进展[J]. 中国食物与营养, 2021, 27(10): 29-34.ZHAO P Y, ZENG X Y, QIN R, et al. Research progress on de-salted flavor proteinase[J]. China Food and Nutrition, 2021, 27(10): 29-34.
[13] 吴江娜, 魏冠棉, 毛娜, 等. 不同乳酸菌发酵对雪花梨汁营养成分、抗氧化活性及挥发性风味物质的影响[J]. 中国食品学报, 2024, 24 (9): 310-321.WU J N, WEI G M, MAO N, et al. Effects of different lactic acid bacteria fermentation on nutritional components, antioxidant activity and volatile flavor compounds of snowflake pear juice[J]. Chinese Journal of Food Science, 2024, 24(9): 310-321.
[14] ZHANG X, ZHANG S, XIE B J, et al. Influence of lactic acid bacteria fermentation on physicochemical properties and antioxidant activity of chickpea yam milk[J]. Journal of Food Quality, 2021, 2021:5523356.
[15] 候智兴. 乳酸菌发酵乳蛋白水解物对溃疡性结肠炎小鼠的影响与机制分析[D]. 无锡: 江南大学, 2023.HOU Z X. Effects and mechanism analysis of lactic acid bacteria-fermented milk protein hydrolysate on mice with ulcerative colitis[D]. Wuxi: Jiangnan University, 2023.
[16] 程娇. 酶解处理对脱脂牛乳功能特性及品质的影响[D]. 沈阳: 沈阳农业大学, 2020. CHENG J. Effects of enzymatic treatment on functional properties and quality of skimmed milk[D]. Shenyang: Shenyang Agricultural University, 2020.
[17] 叶孟亮. 牦牛骨胶原蛋白肽抗骨质疏松作用机制研究[D]. 北京: 中国农业科学院, 2019. YE M L. Research on the mechanism of anti-osteoporosis effect of Yaks’ collagen peptides[D]. Beijing: Chinese Academy of Agricultural Sciences, 2019.
[18] 彭奎耀. 嗜热链球菌937发酵剂制备技术的研究[D]. 扬州: 扬州大学, 2023.PENG K Y. Research on the preparation technology of Streptococcus salivarius subsp. Thermophilus fermentation agent[D]. Yangzhou: Yangzhou University, 2023.
[19] ZHANG Y, XU M, HU C X, et al. Sargassum fusiforme fucoidan SP2 extends the lifespan of Drosophila melanogaster by upregulating the Nrf2-mediated antioxidant signaling pathway[J]. Oxidative Medicine and Cellular Longevity, 2019, 2019:8918914.
[20] ZHANG D Y, TANG Q J, HE X Z, et al. Antimicrobial, antioxidant, anti-inflammatory, and cytotoxic activities of Cordyceps militaris spent substrate[J]. PLoS One, 2023, 18(9): e0291363.
[21] JIANG H C, WANG M H, ZHENG Y, et al. Dietary laminarin administration to enhance the immune responses, promote growing and strengthen physique in Ictalurus punctatus[J]. Aquaculture Nutrition, 2021, 27(4):1181-1191.
[22] SUGIMORI E, KAWASAKI Y. Cross-modal correspondence between visual information and taste perception of bitter foods and drinks[J]. Food Quality and Preference, 2022, 98:104539.
[23] FAGUNDES G A, BENEDETTI S, PAGANI M A, et al. Electronic sensory assessment of bread enriched with cobia (Rachycentron canadum)[J]. Journal of Food Process Engineering, 2022, 45(7): e13656.
[24] LU L, HU Z Q, FANG C Y, et al. Characteristic flavor compounds and functional components of fragrant rice with different flavor types[J]. Foods, 2023, 12(11):2185.
[25] 钱冠林, 孙敬, 杨慧, 等. 碱性及复合蛋白酶复配水解对脱脂牛乳致敏性的影响[J]. 中国食品学报, 2024, 24(6): 97-106.QIAN G L, SUN J, YANG H, et al. The effect of alkaline and compound protease hydrolysis on the allergenicity of skim milk[J]. Journal of Chinese Food Science, 2024, 24(6): 97-106.
[26] 李红娟, 李梦凡, 曹洪宇, 等. 羊乳清蛋白部分和深度水解工艺、水解物致敏性及肽谱分析[J]. 食品科学技术学报, 2024, 42(3): 81-91.LI H J, LI M F, CAO H Y, et al. Partial and deep hydrolysis processes of sheep milk whey protein, allergenicity of hydrolysates and peptide profile analysis[J]. Journal of Food Science and Technology, 2024, 42(3): 81-91.
[27] 钱冠林, 孙敬, 刘微, 等. 双酶水解对脱脂牛乳致敏性的影响[J]. 乳业科学与技术, 2022, 45(4): 36-44.QIAN G L, SUN J, LIU W, et al. The effect of double enzyme hydrolysis on the allergenicity of skim milk[J]. Dairy Science and Technology, 2022, 45(4): 36-44.
[28] 李建杰, 荣瑞芬. 复合酶解制备核桃多肽工艺条件的优化[J]. 中国油脂, 2011, 36(1): 22-26. LI J J, RONG R F. Optimization of process conditions for preparing walnut peptides by enzymatic hydrolysis[J]. Chinese Oil, 2011, 36(1): 22-26.
[29] NOMAN A, XU Y S, AL-BUKHAITI W Q, et al. Influence of enzymatic hydrolysis conditions on the degree of hydrolysis and functional properties of protein hydrolysate obtained from Chinese sturgeon (Acipenser sinensis) by using papain enzyme[J]. Process Biochemistry, 2018, 67:19-28.
[30] HABEEBULLAH S F K, ALAGARSAMY S, SATTARI Z, et al. Effect of enzymatic hydrolysis on the antioxidant activity of red and green seaweeds and characterization of the active extracts[J]. Journal of the American Oil Chemists’ Society, 2021, 98(2):185-200.
[31] WILK S, ORLOWSK M. Evidence that pituitary cation-sensitive neutral endopeptidase is a multicatalytic protease complex. Journal of Neurochemistry, 40(3): 842-849.
[32] OU C C, LU T M, TSAI J J, et al. Antioxidative effect of lactic acid bacteria: Intact cells vs. intracellular extracts[J]. Journal of Food and Drug Analysis, 2010, 17(3). https://doi.org/10.38212/2224-6614.2609.
[33] MARULO S, DE CARO S, NITRIDE C, et al. Bioactive peptides released by lactic acid bacteria fermented pistachio beverages[J]. Food Bioscience, 2024, 59:103988.
[34] 高玥雯, 董晓宇, 候文静, 等. 耐低温高产氨肽酶乳酸菌株的筛选及氨肽酶提取方法的优化[J]. 中国乳品工业, 2023, 51(3): 12-17. GAO Y W, DONG X Y, HOU W J, et al. Screening of low-temperature-tolerant and high-yield aminopeptidase-producing lactic acid bacteria and optimization of aminopeptidase extraction method[J]. China Dairy Industry, 2023, 51(3): 12-17.
[35] SARMADI B H, ISMAIL A. Antioxidative peptides from food proteins: A review[J]. Peptides, 2010, 31(10):1949-1956.
[36] LIU Y, ZHONG Z M, BAO L L, et al. The preparation and antioxidant activities of four 2-aminoacyl-chitooligosaccharides[J]. Carbohydrate Research, 2022, 521:108667.
[37] MA C J, CHENG G J, LIU Z M, et al. Determination of the essential nutrients required for milk fermentation by Lactobacillus plantarum[J]. LWT, 2016, 65:884-889.
[38] XIE H, GAO P Y, LU Z M, et al. Changes in physicochemical characteristics and metabolites in the fermentation of goji juice by Lactiplantibacillus plantarum[J]. Food Bioscience, 2023, 54:102881.
[39] GUILLOT A, BOULAY M, CHAMBELLON É, et al. Mass spectrometry analysis of the extracellular peptidome of Lactococcus lactis: Lines of evidence for the coexistence of extracellular protein hydrolysis and intracellular peptide excretion[J]. Journal of Proteome Research, 2016, 15(9):3214-3224.
[40] HUANG Y Y, SUN Y, MEHMOOD A, et al. Unraveling the temporal changes of Maillard reaction products and aroma profile in coffee leaves during hot-air drying[J]. Journal of Food Composition and Analysis, 2024, 128:106055.
[41] 杨志超, 郑选东, 孙天择, 等. 冠突曲霉发酵对夏秋茶理化指标及风味的影响[J].食品工业科技, 2025 ,46 (17): 35-46. YANG Z C, ZHENG X D, SUN T Z, et al. Effect of fermentation of Aspergillus cristatuson physicochemical indexes and flavors of summer and autumn tea[J]. Science and Technology of Food Industry, 2025 ,46 (17): 35-46.
[42] TANGYU M, FRITZ M, TAN J P, et al. Flavour by design: Food-grade lactic acid bacteria improve the volatile aroma spectrum of oat milk, sunflower seed milk, pea milk, and faba milk towards improved flavour and sensory perception[J]. Microbial Cell Factories, 2023, 22(1):133.
[43] 张爱萍, 李杨, 翟玉秀, 等. 顶空固相微萃取结合气质联用技术结合相对气味活度值对甘肃细毛羊肉特征挥发性风味物质的研究[J]. 畜牧兽医杂志, 2020, 39(3): 5-10. ZHANG A P, LI Y, ZHAI Y X, et al. Analysis of volatile flavor compounds in Gansu alpine fine-wool sheep meat by combining HS-SPME and GC-MS and ROAV[J]. Journal of Animal Science and Veterinary Medicine, 2020, 39(3): 5-10.
[44] 杨万龄, 沈兴旺, 崔凤怡, 等. 蓝纹牦牛干酪成熟特性及其风味分析[J]. 食品科学技术学报, 2023, 41(6): 52-64. YANG W L, SHEN X W, CUI F Y, et al. Maturation characteristics and flavor analysis of blue-striped yak cheese[J]. Journal of Food Science and Technology, 2023, 41(6): 52-64.