抗菌肽(antimcrobial peptides,AMPs)是具有显著抑菌活性的小分子多肽类物质,具有广谱抑菌活性、抑菌活性高、稳定性好、酶耐受性好和生物安全性高等优点。传统抗生素常基于单一酶靶点介入抑菌调控,易产生耐药性,抗菌肽因来源广泛,结构多样,具有多重抑菌机理,存在单个或多个抑菌效应靶点而不易产生耐药性,广泛应用于食品抗菌保鲜[1]。截止2025年9月,抗菌肽数据库(antimicrobial peptide database, APD3)(https://aps.unmc.edu/AP/)共收录5 099条抗菌肽,包括天然抗菌肽、化学合成抗菌肽和预测抗菌肽,主要来源于细菌、原生动物、真菌、植物和动物等。目前,抗菌肽制备方法主要有生物提取法、化学合成法和基因工程菌异源表达法三类方法[2]。生物提取法因制备原料本底含量低、提取步骤繁琐,收率相对较低。化学合成法制备成本高,收率较低,且难以确保合成目标肽空间结构与生物学活性与天然抗菌肽一致,特别是多种天然抗菌肽掺入和长序列抗菌肽控制方面存在诸多亟待解决的难题。微生物异源表达法是借助基因工程技术构建重组载体并导入合适微生物宿主菌体进行目标抗菌肽异源表达,相比生物提取法和化学合成法,可大幅降低生产成本和易于实现规模化生产,具有制备成本经济、表达过程可控和技术成熟等优势,成为抗菌肽规模化生产最具潜力的生产方法[2]。如李云露[3]采用基因工程异源融合表达策略构建了抗菌肽LL-37大肠杆菌原核异源表达系统,并采用启动子优化、融合蛋白优选和诱导条件优化等策略对抗菌肽LL-37的大肠杆菌异源表达系统进行优化,同时,对异源表达培养基组分和规模化生产关键参数也进行了优化并实现规模化生产,生产成本降至2.07元/mg。本文系统综述了抗菌肽异源表达系统发展现状,并对异源表达策略的发展进行了系统分析,以期为抗菌肽微生物异源表达和规模化生产提供理论指导。
1 抗菌肽微生物异源表达系统
当前,抗菌肽微生物异源表达系统主要包括原核生物、真核生物和杆状病毒三类表达系统。原核生物表达系统主要包括大肠杆菌(Escherichia coli)表达系统、枯草芽孢杆菌(Bacillus subtilis)表达系统和乳酸杆菌(Lactobacillus)系统,真核表达系统主要包括毕氏酵母(Pichia pastoris)表达系统、酿酒酵母(Saccharomyces cerevisiae)表达系统和微藻表达系统,而病毒表达系统主要是杆状病毒表达系统。抗菌肽异源表达以原核与真核异源表达系统为主要表达体系,其中,细菌与酵母是抗菌肽最主要的宿主,占抗菌肽异源表达系统的97.4%[2],抗菌肽微生物异源表达系统如图1所示。
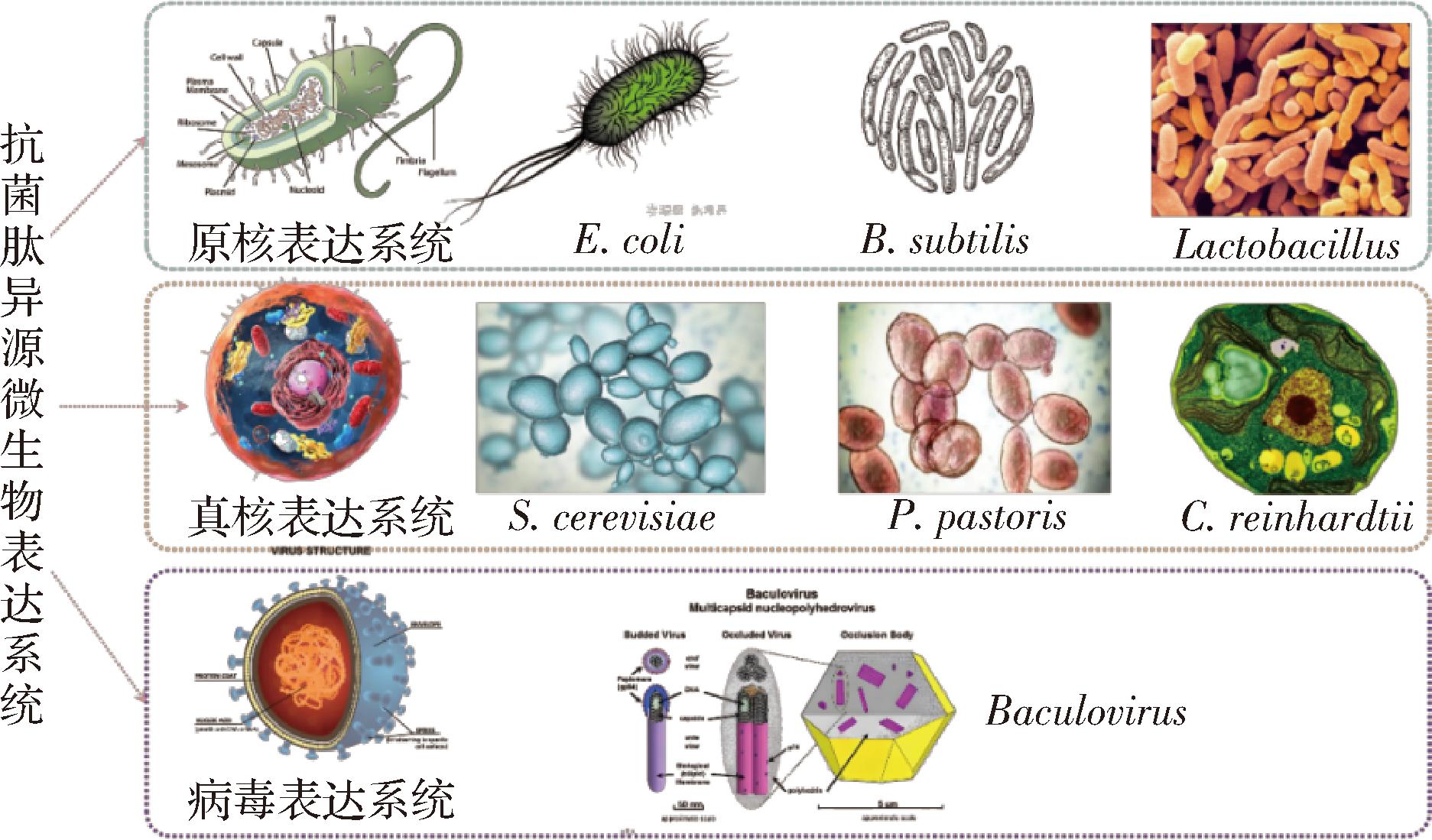
图1 抗菌肽微生物异源表达系统
Fig.1 Microbial heterogeneous expression systems of AMPs
不同微生物异源表达系统优缺点如表1所示。
表1 不同异源表达系统优缺点
Table 1 Advantages and disadvantages of various heterogeneous expression systems

表达系统微生物优点缺点原核表达系统E.coli短期内可获得高表达产物,制备成本较低,遗传背景清晰、易于培养,培养成本低和增殖速度快翻译后加工修饰系统不完善,目标产物产量低,易产生内毒素和包涵体,须变性和复性处理,纯化操作困难B.subtilis安全性高,生长快,遗传背景清晰,遗传操作简单,能分泌及不分泌表达,可避免形成包涵体,纯化简单,成本低,能表达多种异源蛋白质表达水平过低,分泌蛋白错误折叠,分泌蛋白胞外易降解,降低了表达产物稳定性,重组蛋白量和适用载体低于E.coli表达系统Lactobacillus无致病性,安全性高,无内毒素,不分泌本源蛋白,有较好耐受性,胞外分泌能力强,纯化操作简单,降低重组蛋白降解风险,基因可调控性强易受温度影响,可能导致机体免疫耐受,基因表达水平相对较低,培养条件苛刻,基因转化效率低,诱导成本高(如Nisin诱导系统),系统构建与优化复杂真核表达系统P.pastoris营养需求低,易遗传操作,可糖基化高效分泌表达,产物与天然结构相近,不产生包涵体分泌蛋白易被自身分泌的蛋白酶酶解,甲醇诱导时由于甲醇存在毒性,需控制表达条件S.cerevisiae繁殖速度快,工艺简单,不产生包涵体和内毒素,具有一定的蛋白质翻译后修饰功能,能高效表达规模发酵产生乙醇影响菌体增殖,存在过度糖基化修饰,外源蛋白基因过大时表达量偏低,信息肽加工不完善Microalgae生长周期短,安全性高,结构简单,易工业化集成,外源蛋白表达量高,污染少,可再生表达系统尚不完善,表达产物稳定性不足,作为新型真核表达载体还有许多基础研究需突破病毒表达系统Baculovirus安全性高,操作简单,有蛋白翻译修饰功能,能容纳多基因或大基因插入,成本低表达不稳定,翻译修饰速度与表达速度不匹配,表达时效短,末端缺乏糖基化修饰,影响产物水溶性和稳定性
1.1 原核微生物异源表达系统
1.1.1 大肠杆菌异源表达系统
E.coli表达系统是抗菌肽首选异源表达系统,具有遗传背景清晰、表达水平高、培养成本低和操作简单等优势,但存在翻译后修饰不足,易产生包涵体和受内毒素污染等不足,常采取融合蛋白标签方式表达,常用载体有pGEX、pRSET和pET等,特别是pET[2]。2027年E.coli重组表达蛋白全球市场规模预计将达240亿美元。CHENG等[4]在E.coli BL21(DE3)中建立小泛素样修饰物(small ubiquitin-like modifier,SUMO)融合表达系统,经蛋白酶切割纯化,新型重组杂合肽CLP产率为27.56 mg/L;NING等[5]通过融合人β-defensin3和4设计新型人β-defensin(H4),基于密码子偏好性进行结构优化并将其克隆到载体pET32a上,引入硫氧还蛋白A(thioredoxin A,TrxA)融合标签和肠激酶切割位点,转染至E.coli BL21并成功表达高纯度重组H4(rH4);ZHANG等[6]将抗菌肽AA139基因克隆到质粒pET28a载体并构建多聚组氨酸标签(6×histidine,6×His)和SUMO融合标签,高密度培养后,重组表达蛋白在E.coli BL21(DE3)异源表达收率提升54%,产物含量达到56 mg/L;基于氨基酸序列和密码子偏好性构建ALFPm10基因序列,采用SUMO融合策略构建重组载体并在E.coli BL21(DE3)异源表达,经异丙基-β-D-硫代半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG)诱导9 h后,重组蛋白含量高达335 mg/L;刘晨斌[7]通过同源克隆获得褐鳟抗菌肽LEAP-2的ORF序列,构建的pET32a-mLEAP-2成熟肽的E.coli BL21(DE3)异源表达系统能显著降低宿主细胞毒性和增强重组蛋白稳定性。
1.1.2 枯草芽孢杆菌异源表达系统
B.subtilis为革兰氏阳性菌(G+),不产生内毒素,相比E.coli表达系统安全性更高,但也存在缺少蛋白质翻译后修饰、目标蛋白构象和生物活性受影响等不足。ZHANG等[8]以B.subtilis WB800 N作为宿主菌,将T9W和融合SPsacB信号肽的抗菌肽Cecropin AD分别与6×His-SUMO基因连接并克隆至麦芽糖诱导载体,重组T9W、Cecropin AD表达量分别为32 mg/L和26.4 mg/L。ZHANG等[9]将MccJ25和MccY构建重组质粒pHT43-MccJ25和pHT43-MccY,通过启动子优化、在宿主菌B.subtilis 168中异源表达,分别获得2.827 μmol/L和1.481 μmol/L的重组蛋白表达量。
1.1.3 乳酸杆菌异源表达系统
Lactobacillus是一种新兴的异源表达系统,对乙醇、盐、低pH和宽温度范围具有较好耐受性,不产生内毒素,生物安全性高,不分泌本源蛋白,只产生一种分泌蛋白和一种膜结合胞外蛋白酶,且易被敲除,纯化操作简单,可降低重组蛋白被内源蛋白降解风险,还能定植肠道并与肠黏膜屏障结合,是重组蛋白异源表达的理想载体。GOR等[10]将环状细菌素plantacyclin B21AG基因族克隆至pCycB21质粒载体并在L.plantarum WCFS1中成功异源表达;ZHANG等[11]将富含脯氨酸的抗菌肽PR39合成片段插入分泌表达载体质粒pPG:612中,在重组菌株L.casei 393异源成功表达,该重组表达系统具有干酪乳酪杆菌(Lacticaseibacillus casei)和PR39有益特性;于慧等[12]根据密码子偏好性合成抗菌肽Plf成熟肽编码序列,将其连接到表达载体pPG612.1的Xho I/BamH I位点,通过电穿孔分别转入L.casei ATCC393、L.pentosus KLDS1.0413、L.plantarum KLDS1.0344和L.paracasei KLDS1.0652,木糖诱导后,表达量分别为9.6、10.8、12.5、9.9 μg/mL;胡明阳等[13]将氯离子诱导型启动子和基于密码子偏好性优化的抗菌肽Stomoxyn基因克隆至载体pUC57中,将启动子和抗菌肽基因插入pNZ8048质粒中,重组蛋白达最高水平(24 μg/L)。
1.2 真核微生物异源表达系统
1.2.1 真核微生物异源表达系统
P.pastoris遗传背景清晰,营养需求低,生长速度快,具有相对完整的翻译后修饰功能,可克服原核表达体系包涵体需变性和复性的缺点,具有胞内外分泌能力,蛋白不易过度糖基化,抗原性较弱,适合高密度发酵和无病原体重组蛋白安全生产,可通过信号肽辅助分泌表达,细胞毒害作用低,是最常用的真核异源表达系统,但也存在产物复杂,不易纯化和表达成本高等不足[14]。P.pastoris表达抗菌活性更高,如抗菌肽hispidalin原核表达对供试株无抑菌活性,而P.pastoris表达对5种供试株表现较好抗菌活性[2]。抗菌肽Fowlicidin-2在E.coli BL21(DE3)表达时重组蛋白表达量为6 mg/L,而在P.pastoris X-33表达时,重组蛋白表达量高达85.6 mg/L,是E.coli系统的14.27倍[15],说明Fowlicidin-2在P.pastoris系统中表达水平更高;ZHANG等[16]构建了pPIC9K-UBLF1-3重组载体并在P.pastoris GS115(K.phaffii)异源表达,用密码子偏好性、启动子选择(AOX1)和发酵条件优化等策略进行优化,实现抗菌肽高效表达;WANG等[17]利用抗菌肽数据库和蛋白质分析软件对抗菌肽LfcinB基因进行优化设计并获得衍生肽LfcinBD,插入pPIC9K-His质粒获得重组表达载体,电穿孔法转染至P.pastoris GS115(K.phaffii)并经甲醇诱导表达发现,衍生肽抑菌活性更高;赵震等[18]将Mytimacin成熟肽基因5′端添加Xho I限制性酶切位点和信号肽酶识别位点、3′端添加Xba I限制性酶切位点和6×His,获得目的基因“CsMm”,构建P.pastoris X-33/pPICZαA-CsMm重组载体,1.5%(体积分数)甲醇诱导72 h,获得25.6 mg/L重组蛋白。
1.2.2 酿酒酵母异源表达系统
S.cerevisiae表达系统除具有真核异源表达系统本身优点外,还具有安全无污染,可用强启动子获得高通量表达等优点,但存在发酵过程中产生的乙醇影响菌体增殖导致目标蛋白表达量下降、过度糖基化修饰、外源蛋白分子质量过大而表达量偏低及信息肽加工不完善等不足,不如P.pastoris应用广泛。ROSSOUW等[19]将抗菌肽基因plaA和munST4SA基因转移至E.coli DH5α质粒菌株,并在S.cerevisiae Y294中分别异源表达plantaricin 423和mundticin ST4SA,重组表达蛋白具有较好抑菌活性;杜婕等[20]将EsCrustin的ORF克隆到质粒载体pHAC181中,通过同源重组技术整合到S.cerevisiae GAL1-ScRCH1的GAL1启动子下游以启动表达,重组蛋白具有较高抑菌活性;融合牛乳铁蛋白LfcinB和红色荧光蛋白(mApple)基因连接片段LfcinB-mApple插入质粒pYES2-α并将构建的重组质粒pYES2-α-LfcinB-mApple转入S.cerevisiae W303,半乳糖诱导表达后重组蛋白高效表达且具有较高抑菌活性。
1.2.3 微藻异源表达系统
微藻具有繁殖速度快、外源目标蛋白表达量高、污染少和可再生等优点,是继酵母表达系统的新型真核异源表达系统,在抗菌肽异源表达中已有先行探索。如DONG等[21]将3个串联Mytichitin-A重复序列基因转移到衣藻体内,可溶性蛋白收率达到0.28%且持续6个月以上,表明微藻可作为新型异源表达系统用于抗菌肽规模化生产;潘玉芳等[22]根据密码子偏好性将抗菌肽Cath-1a基因进行优化,在两端加上His标签编码序列并连到pPhaT1载体的Kpn I和 Hind III酶切位点之间,将pPha-His+Cath-1a质粒经Sca I线性化后转入Phaeodactylum tricornutum CCAP 1055/1中,重组蛋白表现良好抑菌活性;莱茵衣藻(C.reinhardtii)与S.cerevisiae和P.pastori相比,重组蛋白异源表达更为稳定,如王慧[23]以C.reinhardtii作为抗菌肽制备细胞工厂,成功构建杂合抗菌肽Mytichitin-CB-Hispidalin藻类异源表达系统,表达的抗菌肽具有较好抑菌活性和稳定性,且对宿主细胞具有较低细胞毒性,表明微藻表达系统可作为抗菌肽真核异源表达的新选择。目前,微藻表达系统作为一种新型真核表达载体还有许多基础性关键问题亟待突破。
1.3 杆状病毒表达系统
杆状病毒表达系统(baculovirus expression system,BEVS)是一种新型外源蛋白表达系统,具有操作简单、容纳外源基因大、表达后修饰和安全性高、成本低等优势,但也存在一些不足,如杆状病毒-昆虫细胞表达系统是一个瞬时表达系统,且杆状病毒表达载体启动子为晚期启动子,重组蛋白高水平表达时间短,末端缺乏复杂糖基化修饰,翻译后修饰速度与表达速度不匹配等。ALMASIA等[24]通过优化杆状病毒表达系统密码子,将Snakin-1(StSN1)在S.frugiperda Sf9昆虫细胞中成功表达,表达的重组StSN1(rSN1)具有较好可溶性;YE等[25]使用AnpeNPV杆状病毒系统成功异源表达抗菌肽Anpe-MLP1,重组Anpe-MLP1对溶藻弧菌、河流弧菌和副溶血性弧菌具有较好抑菌活性;FUKUSHIMA等[26]利用家蚕杆状病毒蛋白表达系统成功制备了人β-防御素(β-defensin,DEFB1、DEFB2和DEFB3),重组DEFB2对E.coli和P.aeruginosa等菌体具有较好抑菌活性。目前,基于杆状病毒表达系统表达的抗菌肽种类较少,与杆状病毒宿主范围狭窄有关。
抗菌肽异源表达系统如表2所示。
表2 部分抗菌肽异源表达系统
Table 2 Heterologous expression system of some antimicrobial peptides

表达系统宿主菌株抗菌肽名称融合蛋白标签表达载体产量/(mg/L)文献大肠杆菌表达系统E.coli BL21H4TrxApET32a/[5]E.coli BL21(DE3)AA39SUMOpET28a56[6]E.coli DH5αMytimacin-4/pET-28a200~400[27]E.coli BL21(DE3)SE-33-A2P6×HispET30a(+)/[28]E.coli SHuffle T7(DE3)ScygonadinSmbPpET30a(+)42.35[29]枯草芽孢杆菌表达系统B.subtilis 168Trilenodin/pDR111/[30]B.subtilis BS34A SacP23/pDLL202/[31]B.subtilis 168MccJ25和MccYpHT43[9]乳酸杆菌表达系统L.plantarum WCFS1B21AG/pCycB21/[10]L.casei 393PR39pPG:612[11]L.lactis NZ9000Stomoxyn/pNZ80480.024[13]毕氏酵母表达系统P.pastoris X33Cathelicidin-BF/pICZα-A500.00[32]P.pastoris GS155(K.phaffii)LIG6×HispPIC9K5.90[33]P.pastoris GS115(K.phaffii)Thanatin/pGAP420[34]P.pastoris X-33Lactoferricin/pPICZαA193.9[35]P.pastoris X-33pANG4/pPICZαA1 200[36]P.pastoris GS115(K.phaffii)BLF/pPIC9K40.62[16]P.pastoris GS115(K.phaffii)turgencin A6×HispPICZαA11.23[37]酿酒酵母表达系统S.cerevisiae Y294Munticin ST4SA/pRSF-GFP-MunX20.9[19]S.cerevisiae GAL1-ScRCH1CrustinpHAC181/[20]杆状病毒表达系统Baculovirus AnpeNPVAnpe-MLP1///[25]Silkworm baculovirusβ-defensin///[26]
注:SmbP是指小分子金属结合蛋白(small metal-binding protein);/表示无数据。
2 抗菌肽微生物异源表达优化策略
2.1 融合蛋白标签的优化选择
抗菌肽直接表达可产生潜在宿主细胞毒性,融合蛋白标签作为纯化标签可降低细胞毒性、提高表达蛋白溶解度和增强表达效率,其优化选择是抗菌肽高水平可溶性表达的关键,特别是原核表达系统,常见如谷胱甘肽转移酶(glutathione s-transferase,GST)、麦芽糖结合蛋白(maltose-binding protein,MBP)、绿色荧光蛋白(green fluorescent protein,GFP)、SUMO和TrxA等[2]。RIEGEROV 等[38]应用N-末端GST融合标签纯化Azurin,并依此构建了一种在E.coli中高效异源表达策略和单步纯化新方法;GARDIJAN等[39]在原始载体上引入6×His标签和MBP标签下游的肠激酶切割位点(Ek)以及Xa切割位点,纯化细胞质(pMALc5HisEk)和周质(pMALp5HisEk)肽表达,发现新的载体和融合标签能显著提高Nisin A和人β-defensin异源表达效率;AHMED等[40]采用GFP融合蛋白标签策略成功实现β-defensins大规模表达,并构建了一种产生具有生物活性的正确翻译后加工新方法;ROSTINAWATI等[41]将LL-37表达为N端His-SUMO与C端LL-37通过因子Xa切割位点连接的融合蛋白,重组蛋白表达量达0.144 mg/mL。
等[38]应用N-末端GST融合标签纯化Azurin,并依此构建了一种在E.coli中高效异源表达策略和单步纯化新方法;GARDIJAN等[39]在原始载体上引入6×His标签和MBP标签下游的肠激酶切割位点(Ek)以及Xa切割位点,纯化细胞质(pMALc5HisEk)和周质(pMALp5HisEk)肽表达,发现新的载体和融合标签能显著提高Nisin A和人β-defensin异源表达效率;AHMED等[40]采用GFP融合蛋白标签策略成功实现β-defensins大规模表达,并构建了一种产生具有生物活性的正确翻译后加工新方法;ROSTINAWATI等[41]将LL-37表达为N端His-SUMO与C端LL-37通过因子Xa切割位点连接的融合蛋白,重组蛋白表达量达0.144 mg/mL。
2.2 添加共表达分子伴侣
分子伴侣可促进蛋白折叠和维持蛋白稳态,能协助蛋白质正确折叠并能提升重组蛋白可溶表达水平,如分子伴侣pGro7可使葡萄糖苷酶可溶表达量提高2.6倍,分子伴侣RrGroEL和RrGroES可使氰化酶可溶表达量提高4.8倍,GroEL-GroES可使β-1,4葡聚糖酶可溶表达量提高1.44倍。BAE等[42]开发了一种新的全基因组优化转化融合伴侣筛选系统,成功表达了人白细胞介素(hIL)-2和hIL-32,蛋白分泌量高达数克每毫升,该系统可为难以表达的抗菌肽重组蛋白表达提供一种新方法;赵难难等[27]基于密码子优化成功构建pET-28a-mytimacin-4,并分别和含不同组合分子伴侣表达载体pG-KJE8、pKJE7、pGro7、pG-Tf2和pTf16共转化到E.coli BL21(DE3)宿主诱导表达,共表达分子伴侣可显著提高Mytimacin-4可溶性表达水平,产量可达200~400 mg/L。上述研究表明,添加共表达分子伴侣能显著增强抗菌肽重组蛋白的表达。
2.3 采用杂交表达策略
虽然融合蛋白标签和添加共表达分子伴侣能增强重组蛋白表达水平,但抗菌肽细胞毒性和对蛋白酶敏感可降低重组蛋白表达量,杂交表达策略是将2种或多种抗菌肽串联表达,可显著增加表达效率和产生新型杂合抗菌肽,是提升抗菌肽表达水平及综合肽段功能特性的创新方法[2]。ZHANG等[43]将抗菌肽PRW4前16个残基与Fowlicidin-2后15个残基结合组建新型抗菌肽PR-FO,选择AmyQ和SacB信号肽在MBP诱导的B.subtilis中表达,获得纯度90%的PR-FO 3~4 mg/L;LI等[44]将PlnE与PlnF杂交形成杂合肽PlnEF-1并在P.pastoris中成功异源表达,杂合肽收率为32.65 mg/L,杂合肽不仅保留亲本肽特性,还新获细胞质膜破膜能力;KIM等[45]将靶向肽PA2与强效抗菌肽GNU7构建杂合肽,杂合肽PA2-GNU7表现出强效抗菌活性和无细胞毒性。
2.4 增加基因拷贝数量策略
多拷贝策略是通过优化插入外源基因数量,在宿主细胞中构建高效表达重组表达系统以增加目的基因拷贝数量,从而提高转录数量和表达水平,是规模化生产的重要策略[2]。WANG等[46]在A.niger成功构建了CRISPR/Cas9系统介导的碱性丝氨酸蛋白酶AoproS8多拷贝表达系统发现,AoproS8 3.0(三拷贝)菌株产量是AoproS8 1.0(单拷贝)菌株的2.1倍;PENG等[47]使用多拷贝表达质粒(CDA1/2/3/4)构建菌株PCDA(1-3)-AGα1,发现4拷贝菌株重组蛋白表达是单拷贝的3.86倍。需注意的是,当拷贝数超过特定阈值时,目的基因表达量反而出现下降趋势,可能是因为蛋白质表达水平升高影响宿主菌株代谢,需根据目的基因多拷贝时重组蛋白表达情况合理选择基因拷贝数。
2.5 基于密码子偏好性优化目的基因
基于宿主密码子偏好性优化抗菌肽基因被证明可显著提升表达量。如TAI等[48]将抗菌肽罗非鱼鱼苷4(TP4)基于密码子偏好进行优化获得TP4序列并引入pPICZαA载体,转到至P.pastoris菌体中,甲醇诱导培养实现重组TP4(rTP4)规模表达;王艳慧等[49]基于抗菌肽PtCrustin2成熟肽cDNA序列,根据密码子偏好性进行优化,合成了5′端含XhoⅠ限制性位点和Kex2信号肽酶切位点、3′端含XbaⅠ限制性位点和标签的目的基因“smPtCrustin2”,并将重组表达载体pPICZαA-smPtCrustin2转入P.pastoris X33宿主细胞,PtCrustin2表达量提高了4倍;赵难难等[27]对mytimacin-4进行密码子优化并将构建的pET-28a-mytimacin-4重组载体在含不同组合分子伴侣表达载体共转化到E.coli BL21(DE3)中,产量可达200~400 mg/L,是目前最高产量。
2.6 启动子的优化选择
启动子是决定基因表达效率和基因表达状态的关键元件,P.pastoris有甲醇诱导型和组成型两类启动子,以葡萄糖、甘油为碳源时,乙醇氧化酶基因(pAOX1)被抑制表达,当培养基其他碳源消耗殆尽并添加甲醇时,可激活pAOX1表达,在信号肽协助下能高效表达抗菌肽重组蛋白,如MP1102衍生新型肽NZ2114启动子优选发现,使用pGAP启动子最终表达量为807.42 mg/L,而使用AOX1启动子,重组蛋白表达量达到2 390 mg/L,是pGAP启动子组的1.96倍。甲醇诱导能控制外源基因表达和提升表达效率,相比IPTG诱导的原核表达系统成本更低。由于甲醇存在一定的细胞毒性和安全隐患,可选用其他诱导型启动子来促进重组蛋白表达,如强组成型启动子(pGAP)或pAOX1变体可在无甲醇诱导条件高效表达抗菌肽重组蛋白。SHEN等[50]在P.pastoris中寻找新型可替代性其他新表达系统,研究发现,由PFDH800驱动的GFPuv表达水平增加到由pAOX1单拷贝驱动的含有GFPuv菌株的约2.5倍,表明FDH启动子有可能成为取代pAOX1启动子的新表达系统。启动子PsrfA具有广泛宿主范围,可在B.subtilis和E.coli中构建自诱导表达系统。GUAN等[51]将GFP插入PsrfA下游的质粒分别转化到L.casei 5257、植物乳植杆菌(Lactiplantibacillus plantarum)97、发酵粘液乳杆菌(Limosilactobacillus fermentum)087等菌株并发现,PsrfA可作为一种有吸引力启动子候选者;LIU等[52]采用合理设计策略重新连接甲醇诱导型pAOX1上游调控序列,筛选出强启动子并发现,新开发的甲醇诱导型PA13和乙醇诱导型PsynⅣ-5表达水平明显高于商业pAOX1系统。
2.7 信号肽的优化选择
信号肽是一段能够被信号识别颗粒识别的短肽,关系蛋白质转运与细胞定位,α-factor是P.pastoris最常见外源信号肽,是影响异源蛋白表达的关键因素,可介导新生抗菌肽跨膜转运至内质网腔正确折叠和翻译修饰后分泌至胞外。如LV等[35]为增强Lactoferricin在P.pastoris中异源表达效率,以pAOX1为启动子,将0030信号肽与α-factor分泌信号肽融合构建杂交信号肽,摇瓶发酵产量达28.8 mg/L;黄家强[53]将抗菌肽Adelin、CecropinAD、PMAP-36、LFALFC、SUBA基因序列与pPIC9K中构建重组质粒并分别导入到P.pastoris X33中,得到1株具有抗G+的枯草芽孢杆菌素(subtilisin,SUBA)表达菌株P.pastoris/pPIC9K- SUBA-2,与改造后α信号肽连接组成基因片段插入到pPICZα中并转化P.pastoris X33,实现抗菌肽SUBA的高效表达。
2.8 外源蛋白表达条件优化
外源蛋白表达关键参数主要有表达温度、pH、溶氧、接种量、补料方式和培养基组分等。E.coli最适生长温度为37 ℃,异源表达最佳温度常低于37 ℃;P.pastoris最适生长温度为28~30 ℃,异源表达温度过高会加速细胞自溶并释放内源蛋白酶,对目标蛋白可能产生潜在降解;E.coli和P.pastoris表达系统最适pH值常为7.0~7.2和3.0~7.0,异源表达最佳pH值因菌株类型和重组蛋白种类不同而发生变化。溶氧也是关键参数,特别是高密度培养时需保持溶氧在合理水平。培养基组分、接种量和补料方式也是关键影响因素,可通过优化接种量和分批补料等方式来维持高密度培养营养所需。此外,诱导物种类、诱导时间和诱导物浓度对异源表达也有重要影响。如调控IPTG诱导剂浓度和诱导时间可改变基因表达强度,过长诱导时间和过高浓度诱导物有可能产生负面影响。ZHAN等[54]将PRW4与6×His-Trx融合并构建重组载体在P.pastoris GS115(K.phaffii)表达,诱导条件优化发现,在pH 6.0、1%(体积分数)甲醇诱导96 h后,最优条件下1 L发酵培养物获得15 mg/L重组PRW4;WANG等[55]应用响应面优化法对depcidin在E.coli Arctic Express(DE3)菌株的培养条件和诱导条件优化发现,诱导温度是最关键参数,诱导温度为18.81 ℃,IPTG浓度和诱导时间分别为0.21 mmol/L和16.01 h,His-SUMO-Hepcidin最优产量为(27.81±2.32) mg/L;温耀安等[56]采用3因素3水平正交试验对IPTG浓度、诱导时间和诱导温度优化发现,30 ℃,0.05 mmol/L IPTG诱导6 h,Plectsin融合蛋白表达量最大;李云露[3]应用单因素试验和响应面优化对LL-37异源表达诱导条件和培养基组分进行优化发现,5 L发酵罐每升发酵液可获得28.8 mg MBP-LL-37,是摇瓶生产的3.5倍,抗菌肽生产成本骤降至2.07元/mg,仅为市售价格(400元/mg)的0.52%,表明通过外源蛋白表达条件综合优化可显著降低生产成本。
3 研究展望
通常认为,抗菌肽生产成本低于10美元/g才具有商业化价值,如何通过异源表达系统选择和表达策略优化来降低生产成本是抗菌肽规模生产前亟需解决的关键科学问题。本研究认为,可以从以下几个方面进行优化:
a)在融合标签选择方面,可通过优化融合标签或使用多融合标签来提升抗菌肽可溶表达水平和减弱细胞毒性。如王智豪等[57]对比分析了MBP、SUMO、NusA和GST等4个不同促溶标签对抗菌肽可溶表达影响并发现,MBP标签融合gD蛋白可溶表达最好。使用双融合标签能更高效富集重组蛋白复合物从而提升表达水平,选择合适融合标签还能减弱对宿主的细胞毒性;
b)优选共表达分子伴侣可增强融合蛋白表达。如蔡逸安等[58]优化分子伴侣Ssa1、Erj5、Sil1、Hac1、Kar2、Lhs1和Ydj1对重组蛋白表达量影响发现,过表达分子伴侣Ssa1能有效提升重组蛋白表达量;
c)杂合肽抑菌效果明显优于天然肽且降低细胞毒性和溶血性。如刘子琦等[59]研究发现,杂合肽具有比亲本更高的抑菌活性、更好的稳定性和更低的细胞毒性;
d)多拷贝克隆或串联基因表达能增加重组蛋白表达[60];
e)基于宿主密码子偏好性合理设计抗菌肽编码基因可提高融合蛋白表达率。如李国强等[61]根据密码子偏好性优化设计carcininPm3基因,其重组蛋白质表达可达195 μg/mL;
f)新型启动子优选也能大幅提升抗菌肽表达水平。如SHEN等[50]研究发现,新型强启动子甲酸脱氢酶启动子(pFDH800)拷贝数达到4时,重组蛋白表达量是原有菌株的2.5倍,可用于构建取代pAOX1启动子的新表达系统。对启动子基因结构改造也能提升重组蛋白表达效率,如LIU等[52]对甲醇诱导型pAOX1启动子上游调控序列进行优化,筛选出的新型甲醇诱导型PA13和乙醇诱导型PsynIV-5的表达水平明显高于商业pAOX1系统;
g)信号肽能引导重组蛋白转运至周质空间正确折叠,并平衡蛋白翻译速度与转运速度。抗菌肽原核表达时常形成包涵体,若通过信号肽选择将重组蛋白分泌至周质空间可解决包涵体形成问题,同一信号肽对不同异源蛋白分泌效率存在显著差异,不存在通用信号肽,需进行信号肽优选。可基于信息肽数据库(http://signalpeptide.de/)利用计算机筛选最优信号肽,如SignalP软件可完成绝大多数信号肽的评分与预测。将密码子变为稀有密码子也能增强表达效率,因为稀有密码子使蛋白质翻译与折叠速度下降,信号肽和转运途径有充足时间完成蛋白质转运;
h)抗菌肽微生物异源表达系统是一个灰色系统,与异源表达系统选择和融合表达参数优化等有重要关系,优化表达参数能提升表达效率和降低生产成本。谷欣悦等[62]采用单因素和响应面试验优化诱导表达条件,重组蛋白表达提高123.145%;张宇等[63]单因素试验优化后,目的蛋白表达量最高达0.363 g/L,响应面优化后较单因素试验提高了17.25%;
i)基因编辑技术与AI辅助可增强抗菌肽异源表达效率。如LI等[64]使用碱基编辑器和CRISPR-Cas9构建了具有T7 RNAP不同RBS序列的E.coli BL21(DE3)衍生变体菌株库,变异菌株库靶基因表达水平最高为亲本菌株的2.22倍,抗菌肽产量达到亲本菌株的35.29倍;或通过AI精准设计宿主细胞基因组DNA开关来增强融合基因表达、产物稳定性和降低宿主细胞毒性[65];或基于AI技术在线实时监测融合蛋白生产参数;或AI结合合成生物学优化融合蛋白合成与调控途径,构建定制化的高效抗菌肽异源表达系统[66];亦或AI辅助CRISPR-Cas9优化宿主基因并增强抗菌肽规模化生产效率[67]。
上述策略单独使用可提升重组蛋白融合表达水平,还可通过上述策略优化组合来进一步提升抗菌肽基因表达水平和降低生产成本,从而为抗菌肽规模化生产和商业化应用提供理论与实践支持。
[1] 李玉珍,肖怀秋,王斌,等.抗菌肽的抑菌机制及其在食品防腐保鲜中的应用[J].食品科学,2025,46(15): 415-425.LI Y Z, XIAO H Q, WANG B, et al.Mechanism of action of antibacterial peptides and their application in food antibacterial preservation[J].Food Science,2025,46(15): 415-425.
[2] LOU M X, JI S Q, WU R N, et al. Microbial production systems and optimization strategies of antimicrobial peptides: A review[J]. World Journal of Microbiology and Biotechnology, 2025, 41(2):66.
[3] 李云露.抗菌肽LL-37大肠杆菌表达系统的构建、优化及其应用[D].扬州:扬州大学,2024.LI Y L.Antimicrobial peptide LL-37 E.coli expression system Construction, optimisation and application[D].Yangzhou,Yangzhou University,2024.
[4] CHENG J H, AHMAT M, GUO H N, et al. Expression, purification and characterization of a novel hybrid peptide CLP with excellent antibacterial activity[J]. Molecules, 2021, 26(23):7142.
[5] NING N Z, YAN H, CAO B W, et al. Recombinant expression of a new antimicrobial peptide composed of hBD-3 and hBD-4 in Escherichia coli and investigation of its activity against multidrug-resistant bacteria[J]. Probiotics and Antimicrobial Proteins, 2025: (prepublish):1-9.
[6] ZHANG Y, WANG Y P, LU J G, et al. High-yield and cost-effective biosynthesis process for producing antimicrobial peptide AA139[J]. Protein Expression and Purification, 2024, 219:106475.
[7] 刘晨斌.褐鳟抗菌肽LEAP-2基因ORF的克隆和原核表达[D].哈尔滨:哈尔滨师范大学,2020.LIU C B. Cloning and prokaryotic expression of leap-2 gene ORF from salmo trutta[D].Harbin:Harbin Normal University,2020.
[8] ZHANG L C, LI X D, ZHAN N, et al. Maltose induced expression of cecropin AD by SUMO technology in Bacillus subtilis WB800N[J]. The Protein Journal, 2020, 39(4):383-391.
[9] ZHANG G W, LIN M, QIN M M, et al. Establishing heterologous production of microcins J25 and Y in Bacillus subtilis[J]. Journal of Agricultural and Food Chemistry, 2023, 71(14):5600-5613.
[10] GOR M C, GOLNESHIN A, VAN T T H, et al. Cloning and functional expression of a food-grade circular bacteriocin, plantacyclin B21AG, in probiotic Lactobacillus plantarum WCFS1[J]. PLoS One, 2020, 15(8): e0232806.
[11] ZHANG L, GUO D, LIU Y X, et al. Probiotic Lactobacillus casei expressing porcine antimicrobial peptide PR39 elevates antibacterial activity in the gastrointestinal tract[J]. Canadian Journal of Microbiology, 2016, 62(11):961-969.
[12] 于慧,姜艳平,崔文,等.猪乳铁蛋白在4种重组乳杆菌中的表达及抑菌活性比较[J].生物工程学报,2014,30(9): 1372-1380.YU H,JIANG Y P,CUI W,et al.Comparison of expression and antibacterial activities of recombinant porcine lactoferrin expressed in four Lactobacillus species[J]. Chinese Journal of Biotechnology, 2014, 30(9): 1372-1380.
[13] 胡明阳,李毓雯,赵璐,等.抗菌肽Stomoxyn的重组乳酸菌表达及抑菌活性研究[J].中国畜牧杂志,2025, 61(7):388-394.HU M Y,LI Y W,ZHAO L,et al.Expression and antibacterial activity of recombinant lactic acid bacteria containing antimicrobial peptide Stomoxyn[J]. Chinese Journal of Animal Science,2025, 61(7):388-394.
[14] KARBALAEI M, REZAEE S A, FARSIANI H. Pichia pastoris: A highly successful expression system for optimal synthesis of heterologous proteins[J]. Journal of Cellular Physiology, 2020, 235(9):5867-5881.
[15] XING L W, TIAN S X, GAO W, et al. Recombinant expression and biological characterization of the antimicrobial peptide fowlicidin-2 in Pichia pastoris[J]. Experimental and Therapeutic Medicine, 2016, 12(4):2324-2330.
[16] ZHANG X Y, XI Z W, ZHAO H T, et al. Efficient heterologous expression of bovine lactoferrin in Pichia pastoris and characterization of antibacterial activity[J]. Systems Microbiology and Biomanufacturing, 2025, 5(1):237-248.
[17] WANG L, WANG Y L, LV Z L, et al. Design of bovine lactoferricin-derived peptide and its expression and activity in Pichia pastoris[J]. Biochemical and Biophysical Research Communications, 2021, 534:822-829.
[18] 赵震,王莎莎,吕星星,等.重组毕赤酵母产青蛤Mytimacin抗菌肽的表达研究[J].生物技术通报,2020,36(5):150-158.ZHAO Z,WANG S S,LÜ X X,et al.Heterologous expression of Cyclina sinensis mytimacin antibacterial peptide based on recombinant Pichia pastoris[J].Biotechnology Bulletin,2020,36(5):150-158.
[19] ROSSOUW M, CRIPWELL R A, VERMEULEN R R, et al. Heterologous expression of plantaricin 423 and mundticin ST4SA in Saccharomyces cerevisiae[J]. Probiotics and Antimicrobial Proteins, 2024, 16(3):845-861.
[20] 杜婕,张容彬,徐浩鹏,等.酿酒酵母表达中华绒鳌蟹甲壳肽及其抗菌功能研究[J].当代化工研究,2021(22):1-6.DU J, ZHANG R B,XU H P,et al.Eriocheir sinensis crustin expressed in Saccharomyces cerevisiae and study on its antibacterial function[J].Modern Chemical Research,2021(22):1-6.
[21] DONG B, CHENG R Q, LIU Q Y, et al. Multimer of the antimicrobial peptide Mytichitin-a expressed in Chlamydomonas reinhardtii exerts a broader antibacterial spectrum and increased potency[J]. Journal of Bioscience and Bioengineering, 2018, 125(2):175-179.
[22] 潘玉芳,杨欢,陈怡雯,等.利用饵料微藻表达抗菌肽及其初步应用[J].热带亚热带植物学报,2023,31(5):667-678.PAN Y F, YANG H, CHEN Y W,et al.Expression of antimicrobial pepetides in microalgae for aquaculture and its preliminary application[J].Journal of Tropical and Subtropical Botany,2023,31(5):667-678.
[23] 王慧.抗菌肽Mytichitin-CB-Hispidalin在莱茵衣藻中的表达、纯化及活性研究[D].天津:天津科技大学,2020.WANG H. Expression, purification and activity of two antimicrobial peptide Mytichitin-CB-Hispidalin in Chlamydomonas reinhardtii[J]. Tianjin:Tianjin University of Science and Technology,2020.
[24] ALMASIA N I, MOLINARI M P, MARONICHE G A, et al. Successful production of the potato antimicrobial peptide Snakin-1 in baculovirus-infected insect cells and development of specific antibodies[J]. BMC Biotechnology, 2017, 17(1):75.
[25] YE B, LI S L, FAN Q, et al. Antimicrobial activity of a novel moricin-like peptide from the Chinese oak silkworm against Vibrio pathogens in sea cucumbers[J]. Aquaculture Reports, 2024, 35:102010.
[26] FUKUSHIMA M, IIYAMA K, YAMASHITA J, et al. Production of small antibacterial peptides using silkworm-baculovirus protein expression system[J]. Preparative Biochemistry and Biotechnology, 2013, 43(6):565-576.
[27] 赵难难,黄佳苹,崔金明,等.抗菌肽Mytimacin-4在大肠杆菌中的高效表达及其活性鉴定[J].现代食品科技,2025,41(5): 114- 123.ZHAO N N,HUANG J P, CUI J M,et al.High-level expression of antimicrobial peptide mytimacin-4 in Escherichia coli and identification of its activity[J].Modern Food Science and Technology,2025,41(5): 114-123.
[28] GASANOV V, VOROTELYAK E, VASILIEV A. Expression of the antimicrobial peptide SE-33-A2P, a modified analog of cathelicidin, and an analysis of its properties[J]. Antibiotics, 2024, 13(2):190.
[29] GOMEZ-LUGO J J, CASILLAS-VEGA N G, GOMEZ-LOREDO A, et al. High-yield expression and purification of scygonadin, an antimicrobial peptide, using the small metal-binding protein SmbP[J]. Microorganisms, 2024, 12(2):278.
[30] PULLIAM C, XUE D, CAMPBELL A, et al. Discovery and heterologous expression of trilenodin, an antimicrobial lasso peptide with a unique tri-isoleucine motif[J]. ChemBioChem, 2024, 25(24): e202400586.
[31] KH NH C M, VAN QUYEN D, VAN T T H, et al. Heterologously expressed SacP23, a novel bacteriocin fromPaenibacillus polymyxa#23, is active against methicillin resistantStaphylococcus aureus[J]. Royal Society Open Science, 2023, 10(12):231119.
NH C M, VAN QUYEN D, VAN T T H, et al. Heterologously expressed SacP23, a novel bacteriocin fromPaenibacillus polymyxa#23, is active against methicillin resistantStaphylococcus aureus[J]. Royal Society Open Science, 2023, 10(12):231119.
[32] DONG X F, SHAN H, WANG S B, et al. High expression of antimicrobial peptides cathelicidin-BF in Pichia pastoris and verification of its activity[J]. Frontiers in Microbiology, 2023, 14:1153365.
[33] ZHAO L, LI L, HU M Y, et al. Heterologous expression of the novel dimeric antimicrobial peptide LIG in Pichia pastoris[J]. Journal of Biotechnology, 2024, 381:19-26.
[34] PIPIYA S O, KUDZHAEV A M, MIRZOEVA N Z, et al. Bioengineering the antimicrobial activity of yeast by recombinant thanatin production[J]. Antibiotics, 2023, 12(12):1719.
[35] LV X Q, ZHANG Y T, WANG L R, et al. Expression and antimicrobial activity of the recombinant bovine lactoferricin in Pichia pastoris[J]. Synthetic and Systems Biotechnology, 2024, 9(1):26-32.
[36] XU S Y, CHEN S R, LIU Y L, et al. Generation of porcine angiogenin 4-expressing Pichia pastoris and its protection against intestinal inflammatory injury[J]. Journal of Agricultural and Food Chemistry, 2024, 72(1):153-165.
[37] 张瑞.抗菌肽Turgencin A在毕赤酵母中重组表达及其抗菌活性特性研究[D].天津:天津科技大学,2025.ZHANG R.Recombinant Expression of antimicrobial peptide turgencin A in Saccharomyces Cerevisiae and characterization of its antibacterial activity[D].Tianjin:Tianjin University of Science and Technology,2025.
[38] RIEGEROV P, HORV
P, HORV TH M,
TH M,  EBESTA F, et al. Single-step purification and characterization of Pseudomonas aeruginosa azurin[J]. Protein Expression and Purification, 2024, 224:106566.
EBESTA F, et al. Single-step purification and characterization of Pseudomonas aeruginosa azurin[J]. Protein Expression and Purification, 2024, 224:106566.
[39] GARDIJAN L, MILJKOVIC M, OBRADOVIC M, et al. Redesigned pMAL expression vector for easy and fast purification of active native antimicrobial peptides[J]. Journal of Applied Microbiology, 2022, 133(2):1001-1013.
[40] AHMED S, TAO J, WANG M C, et al. An improved lentiviral system for efficient expression and purification of β-defensins in mammalian cells[J]. Biotechnology Journal, 2021, 16(9):2100023.
[41] ROSTINAWATI T, WICAKSONO I A, SITINJAK B D P, et al. Construction and expression of recombinant LL-37 as histag-SUMO fusion protein with factor xa cleavage site[J]. HAYATI Journal of Biosciences, 2024, 31(6):1181-1189.
[42] BAE J H, SUNG B H, KIM H J, et al. An efficient genome-wide fusion partner screening system for secretion of recombinant proteins in yeast[J]. Scientific Reports, 2015, 5:12229.
[43] ZHANG L C, WEI D D, ZHAN N, etal. Heterologous expression of the novel α-helical hybrid peptide PR-FO in Bacillus subtilis. Bioprocess and Biosystems Engineering, 2020,43(9):1619-1627.
[44] LI Z X, CHENG Q, GUO H N, et al. Expression of hybrid peptide EF-1 in Pichia pastoris, its purification, and antimicrobial characterization[J]. Molecules, 2020, 25(23):5538.
[45] KIM H, JANG J H, KIM S C, et al. Development of a novel hybrid antimicrobial peptide for targeted killing of Pseudomonas aeruginosa[J]. European Journal of Medicinal Chemistry, 2020, 185:111814.
[46] WANG S N, XUE Y B, ZHANG P, et al. CRISPR/Cas9 system-mediated multi-copy expression of an alkaline serine protease in Aspergillus niger for the production of XOD-inhibitory peptides[J]. Journal of Agricultural and Food Chemistry, 2023, 71(41):15194-15203.
[47] PENG Y H, WANG Y P, LIU X Y, et al. Expression and surface display of an acidic cold-active chitosanase in Pichia pastoris using multi-copy expression and high-density cultivation[J]. Molecules, 2022, 27(3):800.
[48] TAI H M, YOU M-F, LIN C H, et al. Scale-up production of and dietary supplementation with the recombinant antimicrobial peptide tilapia piscidin 4 to improve growth performance in Gallus gallus domesticus[J]. PLoS One, 2021, 16(6): e0253661.
[49] 王艳慧,陶妍.三疣梭子蟹PtCrustin2抗菌肽基因优化及其在毕赤酵母中高效表达[J].生物学杂志,2019,36(4): 42-46.WANG Y H, TAO Y.Gene optimization for swimming crab PtCrustin2 antimicrobial peptide and its efficient expression in Pichia pastoris[J].Journal of Biology,2019,36(4): 42-46.
[50] SHEN Q, CUI J, WANG Y, et al. Identification of a novel growth-associated promoter for biphasic expression of heterogenous proteins inPichia pastoris[J]. Applied and Environmental Microbiology, 2024, 90(2): e01740-23.
[51] GUAN C R, YUAN Y, MA Y, et al. Development of a novel expression system in lactic acid bacteria controlled by a broad-host-range promoter P(srfA)[J]. Microbial Cell Factories, 2022, 21(1):23.
[52] LIU Q, LI Y H, TAO L F, et al. Rational design and characterization of enhanced alcohol-inducible synthetic promoters in Pichia pastoris[J]. Applied and Environmental Microbiology, 2025, 91: e02191-24.
[53] 黄家强.抗菌肽在毕赤酵母中高效表达及其抗菌性能研究[D].无锡:江南大学,2021.HUANG J Q. Study on high-level expression and antibacterial activity of antimicrobial peptides in Pichia pastoris[D].Wuxi:Jiangnan University,2021.
[54] ZHAN N, WANG T Y, ZHANG L C, et al. A eukaryotic expression strategy for producing the novel antimicrobial peptide PRW4[J]. Brazilian Journal of Microbiology, 2020, 51(3):999-1008.
[55] WANG P X, LIN Z J, LIN S L, et al. Prokaryotic expression, purification, and antibacterial activity of the hepcidin peptide of crescent sweetlips (Plectorhinchus cinctus)[J]. Current Issues in Molecular Biology, 2023, 45(9):7212-7227.
[56] 温耀安,朱哲,石羽,等.抗菌肽Plectasin原核表达条件的正交试验优化研究[J].药物生物技术,2014,21(5): 424- 428.WEN Y A,ZHU Z,SHI Y,et al.Research on optimization expression conditions of plectasin prokaryotic expressions by the orthogonal experiment[J]. Pharmaceutical Biotechnology,2014,21(5): 424- 428.
[57] 王智豪, 张冬萱, 乔岩, 等. 促伪狂犬病毒gD蛋白可溶性表达标签的筛选及融合蛋白生物学活性的检测[J]. 中国预防兽医学报, 2024, 46(6): 614-620.WANG Z H,ZHANG D X,QIAO Y,et al.Screening of soluble expression tags for pseudorabies virus gD proteins and detection of biological activity of fusion proteins[J].Chinese Journal of Preventive Veterinary Medicine,2024, 46(6): 614-620.
[58] 蔡逸安,张轶群,杨子璇,等.分子伴侣增强蛋白酶K在毕赤酵母中的表达及对羊毛鳞片层的作用分析[J].生物技术通报, 2024, 40(7):307-313.CAI Y A,ZHANG Y Q,YANG Z X,et al.Enhanced expression of protease K in Pichia pastoris through molecular chaperones and analysis of its effect on wool scale layer[J].Biotechnology Bulletin, 2024,40(7):307-313.
[59] 刘子琦,刘正宇,郭银虹,等.杂合抗菌肽NK-LPd的设计、表达及抑菌活性评价[J].食品工业科技,2023,44(18): 173-180.LIU Z Q, LIU Z Y, GUO Y H, et al. Design, expression and evaluation of bacteriostatic activity of hybrid antimicrobial peptide NK-LPd[J]. Science and Technology of Food Industry,2023,44(18): 173-180.
[60] 乔莹,王军,马笑晚,等.大黄鱼与美国红鱼抗菌肽Piscidin串联基因的构建、酵母表达及抗菌活性鉴定[J].厦门大学学报(自然科学版),2020,59(1):43-48;149-150.QIAO Y,WANG J,MA X W,et al. Construction, yeast expression and antimicrobial activity identification of antimicrobial peptide Piscidin tandom gene from Pseudosciaena crocea and Sciaenops ocellatus[J].Journal of Xiamen University(Natural Science),2020, 59(1):43-48;149-150.
[61] 李国强,周亮,李安国,等.斑节对虾carcininPm3的表达及其无标签多肽的获得[J].深圳大学学报(理工版),2020, 37(1):9-16.LI G Q,ZHOU L,LI A G,et al.Expression of tag-free carcininPm3 of Penaeus monodon[J].Journal of Shenzhen University (Science and Engineering), 2020, 37(1):9-16.
[62] 谷欣悦, 赵奎, 李蕊兵, 等. 枯草芽孢杆菌源氯氰菊酯降解酯酶 Est13 在酿酒酵母中的表达及条件优化[J]. 食品与发酵工业, 2025: 10.13995/j.cnki.13911-11802/ts.042483.GU X Y, ZHAO K,LI R B.et al.Expression and optimization of Bacillus subtilis-derived cypermethrin-degrading esterase Est13 in Saccharomyces cerevisiae[J].Food and Fermentation Industries,2025: 10.13995/j.cnki.13911-11802/ts.042483.
[63] 张宇, 郭通, 陈浩, 等. 响应面法优化产H因子结合蛋白的重组大肠埃希菌发酵条件[J]. 微生物学免疫学进展, 2024, 52(2): 43-51.ZHANG Y,GUO T,CHEN H,et al. Optimization of fermentation conditions for recombinant Escherchia Coli producing factor H-binding protein by response surface methodology[J].Progress in Microbial Immunology,2024, 52(2): 43-51.
[64] LI Z J, ZHANG Z X, XU Y, et al. CRISPR-based construction of a BL21 (DE3)-derived variant strain library to rapidly improve recombinant protein production[J]. ACS Synthetic Biology, 2022, 11(1):343-352.
[65] GOSAI S J, CASTRO R I, FUENTES N, et al. Machine-guided design of cell-type-targeting cis-regulatory elements[J]. Nature, 2024, 634(8036):1211-1220.
[66] LU H Z, XIAO L C, LIAO W B, et al. Cell factory design with advanced metabolic modelling empowered by artificial intelligence[J]. Metabolic Engineering, 2024, 85:61-72.
[67] BARRANGOU R. AI and SynBio meet CRISPR heralding a new genome editing era[J]. The CRISPR Journal, 2024, 7(4):179.