当母乳喂养不足或无法实现时,婴儿配方奶粉是有效替代品。羊乳具有易消化、致敏性低、抗氧化等特点,是婴幼儿配方奶粉的优质原料[1]。然而羊乳中酪蛋白组成与人乳组成仍有较大差距,羊乳酪蛋白主要由κ、β、αs1、αs2亚组分构成,配比为12∶46∶24∶18,而母乳酪蛋白主要由κ、β、αs1亚组分构成,配比为20∶68∶12,酪蛋白亚组分配比的不同会导致羊乳基婴儿配方奶粉与母乳在消化与吸收等方面存在差异[2]。研究表明,乳中αs-酪蛋白的存在会影响酪蛋白胶束结构,使在婴儿胃消化过程形成坚硬的凝块[3]。ZHANG等[4]研究发现,将β-酪蛋白和κ-酪蛋白浓缩物混合后得到的比例为68∶20的复配酪蛋白具有比普通牛乳更好的消化性。母乳几乎不含αs-酪蛋白,在婴儿胃消化阶段几乎不会形成凝块。为了让婴儿配方奶粉的成分更接近母乳,需要减少其中αs-酪蛋白的含量,提高κ-酪蛋白和β-酪蛋白组分的占比。这要求开发一种从传统酪蛋白配料中分离κ-酪蛋白和β-酪蛋白组分的方法。
酪蛋白亚组分的分离主要通过选择性沉淀法来实现。选择性沉淀法利用各酪蛋白亚组分对温度、pH、钙离子敏感性的差异,实现酪蛋白亚组分的分离[5]。SCHUBERT等[5]通过选择性沉淀法从牛乳酪蛋白胶束中分离得到的各组分纯度和得率如下:αs-酪蛋白为39.6%和96.1%,β-酪蛋白为92.1%和27.5%,κ-酪蛋白为39.2%和54.1%。现有研究主要利用选择性沉淀法针对牛乳酪蛋白的单个蛋白组分进行分离,产物得率和纯度相对较低,从羊乳中分离κ-酪蛋白和β-酪蛋白组分的研究较少,且均在强碱性条件下进行解离,可能会导致灰分过高或形成有害物质形成,因此,需要对现有分离方法进行改进,并对相应的工艺参数进行调整优化。
本研究采用条件温和的选择性沉淀分离工艺,对提取过程的关键工艺参数进行优化,实现从山羊乳中分离得到组分比例接近母乳、高纯度、高得率的κ-酪蛋白和β-酪蛋白,并进行放大规模生产,同时降低灰分以获得更适用于婴配粉生产的新型酪蛋白配料,为羊乳基婴幼儿配方奶粉的开发提供支持。
1 材料与方法
1.1 材料与试剂
山羊酪蛋白胶束(micellar casein concentrates,MCC),澳优乳业股份有限公司;柠檬酸、乳酸、乙酸、盐酸、氢氧化钠、氯化钙、分析纯级别,国药集团化学试剂有限公司;甲醇、乙腈(HPLC级),赛默飞世尔科技(中国)有限公司;三氟乙酸,美国Sigma公司;L-亮氨酸、柠檬酸三钠二水、尿素、1,3-双(三羟甲基)甲基氨基丙烷,生工生物工程(上海)技术服务有限公司。
1.2 仪器与设备
赫锐斯Multifuge XIR台式高速冷冻离心机,赛默飞世尔科技(中国)有限公司;Waters E2695高效液相色谱分析仪,美国Waters公司;岛津UV-2700紫外分光光度计,日本Shimadzu公司;Agilent ZORBAX 300SB-C8色谱柱(250 nm×4.6 nm, 5 μm),美国Agilent公司;W-O-VI-9恒温加热/制冷循环槽,无锡申科仪器有限公司;JTG-120 L夹套罐,河北鼎腾逸机械设备有限责任公司;OS20-Pro顶置式电子搅拌器,大龙兴创实验仪器(北京)股份公司;IKAT10BS25分散机和RO10高效多点磁力搅拌器,德国IKA集团;PSC5碟片式离心机,基伊埃韦斯伐里亚分离机有限公司;马弗炉,上海精学科学仪器有限公司。
1.3 实验方法
1.3.1 蛋白含量测定
参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》测定MCC粉体中总蛋白质含量,氮系数为6.38。
1.3.2 酪蛋白沉淀的制备
将MCC粉复溶于去离子水中,25 ℃下搅拌30 min,升温至50 ℃搅拌1 h,得到质量浓度为30 g/L的酪蛋白复溶液。在25 ℃下加入HCl溶液调pH值至4.3,升温至45 ℃后搅拌平衡30 min,然后于25 ℃、5 000×g离心10 min,去除乳清,收集酪蛋白沉淀。
1.3.3 κ-酪蛋白和β-酪蛋白提取工艺
参考并改进POST等[6]提取β-酪蛋白的方法,从MCC中分离κ-酪蛋白和β-酪蛋白,工艺路线如图1所示,主要包括以下步骤:
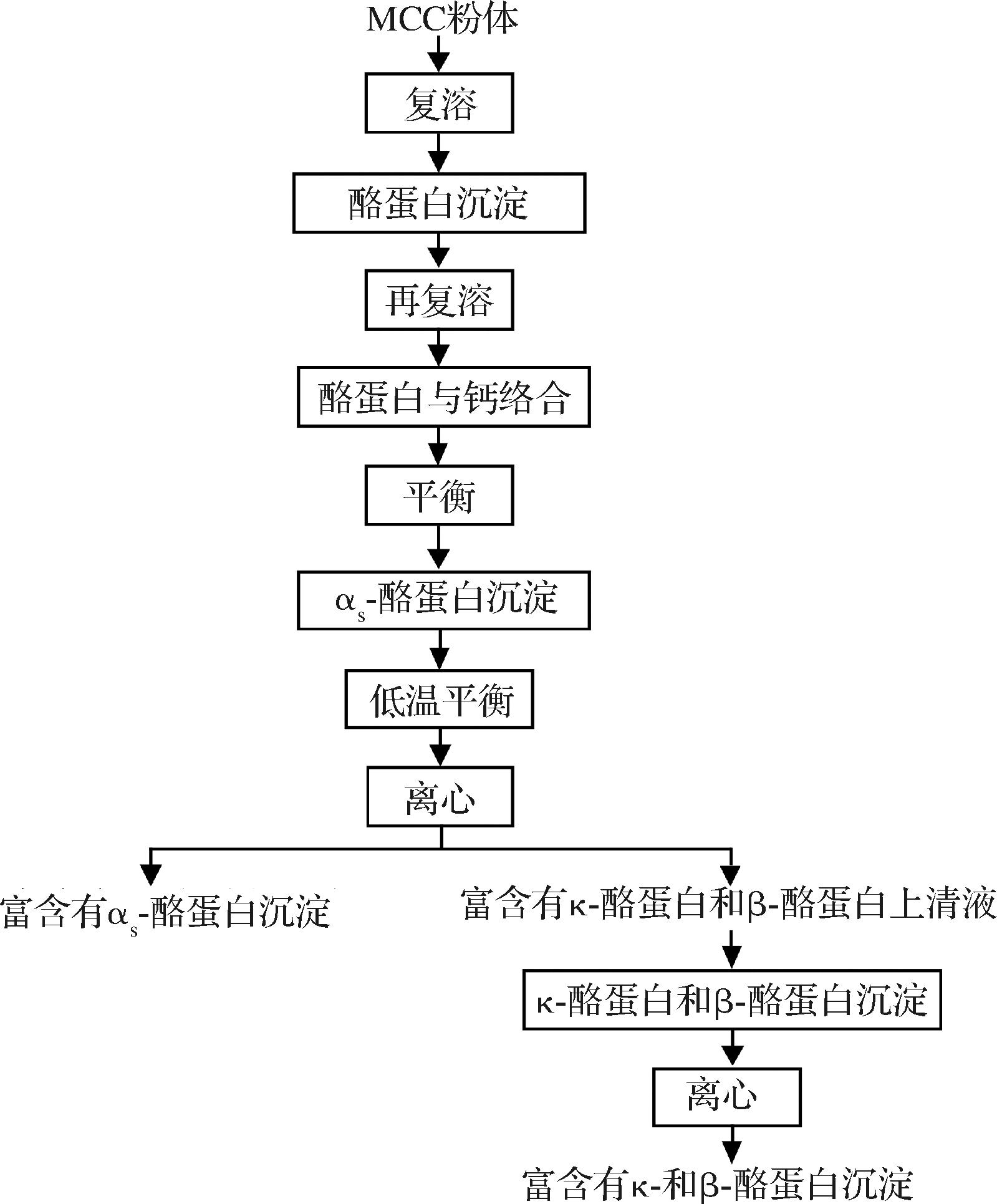
图1 山羊乳κ酪蛋白和β-酪蛋白提取工艺流程图
Fig.1 Flow-chart for the fractionation of κ-and β-casein from goat MCC
选择性沉淀法是基于不同酪蛋白对钙、pH、温度敏感性的差异。通过等电点沉淀和中性pH复溶,使酪蛋白胶束解离。αs-酪蛋白、β-酪蛋白、κ-酪蛋白的磷酸化程度逐渐降低,钙敏感性逐渐降低[7],通过加钙可诱导αs-酪蛋白以及β-酪蛋白部分沉淀;κ-酪蛋白含糖基对低pH敏感性低,β-酪蛋白疏水性最强,降温可减弱疏水缔合[8],促使其从沉淀中溶出,进而实现κ-酪蛋白和β-酪蛋白的共分离。
1.3.4 κ-酪蛋白和β-酪蛋白提取单因素试验
1.3.4.1 再复溶步骤中溶解pH和时间对κ-酪蛋白和β-酪蛋白提取的影响
将1.3.2节制得的酪蛋白沉淀加入纯水,配制成30 g/L的酪蛋白再复溶液。选择在25 ℃下加入NaOH溶液调节pH值分别为6.5、7.0、7.5、8.0、8.5、9.0;溶解时间设为0、15、30、45、60、75、90 min。以κ-酪蛋白和β-酪蛋白的提取率和纯度为参数评估提取效果。
1.3.4.2 低温位置对κ-酪蛋白和β-酪蛋白提取的影响
分别在酪蛋白与钙络合前、αs-酪蛋白沉淀前以及αs-酪蛋白沉淀后将酪蛋白再复溶液快速冷却至4 ℃。以κ-酪蛋白和β-酪蛋白的提取率和纯度为参数评估提取效果。
1.3.4.3 酪蛋白与钙络合步骤对κ-酪蛋白和β-酪蛋白提取的影响
在酪蛋白与钙络合步骤中,钙离子浓度分别设为30、35、40、45、50、55、60、65 mmol/L;平衡温度设为10、15、20、25、30、40 ℃;平衡时间为0、15、30、45、60、90、120 min。以κ-酪蛋白和β-酪蛋白的提取率和纯度为参数评估提取效果。
1.3.4.4 αs-酪蛋白沉淀步骤对κ-酪蛋白和β-酪蛋白提取的影响
在αs-酪蛋白沉淀步骤中,分别采用乙酸、盐酸、乳酸和柠檬酸调节pH值至4.2、4.4、4.6、4.8、5.0、5.2、5.4;平衡温度设为10、15、20、25、30、35、40 ℃;平衡时间为0、15、30、60、90、120 min。以κ-酪蛋白和β-酪蛋白的提取率和纯度为参数评估提取效果。
1.3.4.5 低温平衡步骤对κ-酪蛋白和β-酪蛋白提取的影响
在低温平衡步骤中,将酪蛋白再复溶液分别冷却至0、2、4、8、12 ℃;低温处理时间设为0、1、2、4、8、12、24 h。然后以3 000×g离心10 min,得到富含κ-酪蛋白和β-酪蛋白的上清液和富含αs-酪蛋白的沉淀。以κ-酪蛋白和β-酪蛋白的提取率和纯度为参数评估提取效果。
1.3.4.6 蛋白浓度放大提取步骤对κ-酪蛋白和β-酪蛋白提取的影响
为了提高蛋白浓度以提高生产效率,在固定钙/酪蛋白比例条件下,将酪蛋白沉淀分别复溶至质量浓度(下同)为10~70 g/L的酪蛋白再复溶液,步长为10 g/L,然后按钙/酪蛋白摩尔比15∶1添加氯化钙溶液。在固定钙添加浓度条件下,同样将酪蛋白沉淀复溶至10~70 g/L,步长为10 g/L,然后向酪蛋白再复溶液滴加氯化钙溶液至其浓度为45 mmol/L。以κ-酪蛋白和β-酪蛋白的提取率和纯度为参数评估提取效果。
1.3.4.7 κ-酪蛋白和β-酪蛋白沉淀步骤对κ-酪蛋白和β-酪蛋白提取的影响
收集1.3.4.6节优化后得到的富含κ-酪蛋白和β-酪蛋白的上清液,分别调节pH值为3.2、3.4、3.6、3.8、4.0、4.2、4.4,平衡温度为25、30、35、40、45、50、55 ℃,平衡时间为0、10、20、30、40、50 min。最后,以10 000×g离心10 min,获得富含κ-酪蛋白和β-酪蛋白的沉淀和缺乏κ-酪蛋白和β-酪蛋白的上清液,以κ-和β-酪蛋白的沉淀率为参数评估提取效果。
1.3.5 κ-酪蛋白和β-酪蛋白配料放大生产
根据提取工艺的优化结果,本研究进行了放大生产。在25 ℃下将酪蛋白沉淀置于夹套罐中,加NaOH调pH值至7.5,搅拌不低于60 min至充分复溶,制成40 g/L酪蛋白再复溶液。加氯化钙溶液至钙离子浓度45 mmol/L,搅拌60 min,再加乙酸调pH值至5.0。接恒温加热-制冷循环槽调至0 ℃,搅拌12 h,之后用碟式离心机(进料流速100 L/h、转速13 000 r/min、排渣时间120 s,通冰水预冷)离心,获取富含κ-酪蛋白和β-酪蛋白的上清液与αs-酪蛋白沉淀。收集上清液至夹套储罐,加盐酸调pH值至4.0,低温加热-制冷循环槽调至55 ℃,45 ℃搅拌30 min,碟式离心机(进料流速100 L/h、转速13 000 r/min、排渣时间120 s)离心,收集富含κ-酪蛋白和β-酪蛋白的沉淀。κ-酪蛋白和β-酪蛋白沉淀于去离子水中调pH值至7复溶,冻干,得κ-酪蛋白和β-酪蛋白配料。
1.3.6 沉淀清洗
为降低灰分,将κ-酪蛋白和β-酪蛋白沉淀加入纯水至180~200 g/L,水洗0~3次,每次加水润洗后经剪切机均质、搅拌、复调pH,静置离心倒掉洗涤液。最后加去离子水复溶沉淀,用NaOH调pH值至7.0并充分复溶,冻干后测定水分和灰分含量。
1.3.7 反相高效液相色谱法(reversed-phase HPLC,RP-HPLC)分析
样品溶液与含0.1 mol/L 1,3-双(三羟甲基)甲基氨基丙烷、8 mol/L尿素、20 mmol/L二硫苏糖醇、13 g/L柠檬酸钠(pH=7)的缓冲液1以1∶1体积比混合后,取上清液与含6 mol/L尿素的乙腈-水-三氟乙酸(90∶950∶1,体积比)缓冲液2以1∶3体积比混合,过0.45 μm有机膜。流动相A由水-乙腈-三氟乙酸(950∶50∶1,体积比)配制,流动相B由水-乙腈-三氟乙酸(200∶800∶1,体积比)配制。采用C8色谱柱,柱温40 ℃,流速0.8 mL/min,检测波长220 nm,用Empower软件积分。
1.3.8 水分和灰分含量测定
κ-酪蛋白和β-酪蛋白配料的水分含量测定参考GB 5009.3—2016《食品安全国家标准 食品中水分的测定》,将扁称量瓶于105 ℃烘至恒重并称量,加入2.0 g样品后记录总质量,经105 ℃烘干4 h后再次称量,按公式(1)计算水分含量:
水分含量/%
(1)
灰分含量测定参考GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》。称样后电热炉小火炭化至无烟,于(550±25) ℃灼烧4 h;冷却至200 ℃后干燥器冷却30 min,残渣含炭粒时滴水润湿、蒸干复灼至无炭粒;重复灼烧至恒重(2次称量差≤0.5 mg)。灰分含量计算如公式(2)所示:
灰分含量![]()
(2)
式中:m1,坩埚和灰分的质量,g;m2,坩埚的质量,g;m3,坩埚和试样的质量,g。
1.4 数据处理
试验结果采用SPSS 20.0进行统计分析,采用One-Way ANOVA方法进行方差分析,采用Duncan’s test比较均值之间的差异,显著差异水平设定为P<0.05。
2 结果与分析
2.1 MCC粉的基本组成
山羊乳MCC的基本组成为粗蛋白含量为61.5%,水分含量为4.2%,灰分含量为9.1%。
酪蛋白再复溶液中含有14.3%的κ-酪蛋白、18.8%的αs2-酪蛋白、17.2%的αs1-酪蛋白和49.7%的β-酪蛋白,而在其pH 4.3酸沉上清液中未检测到乳清蛋白组分(图2)。
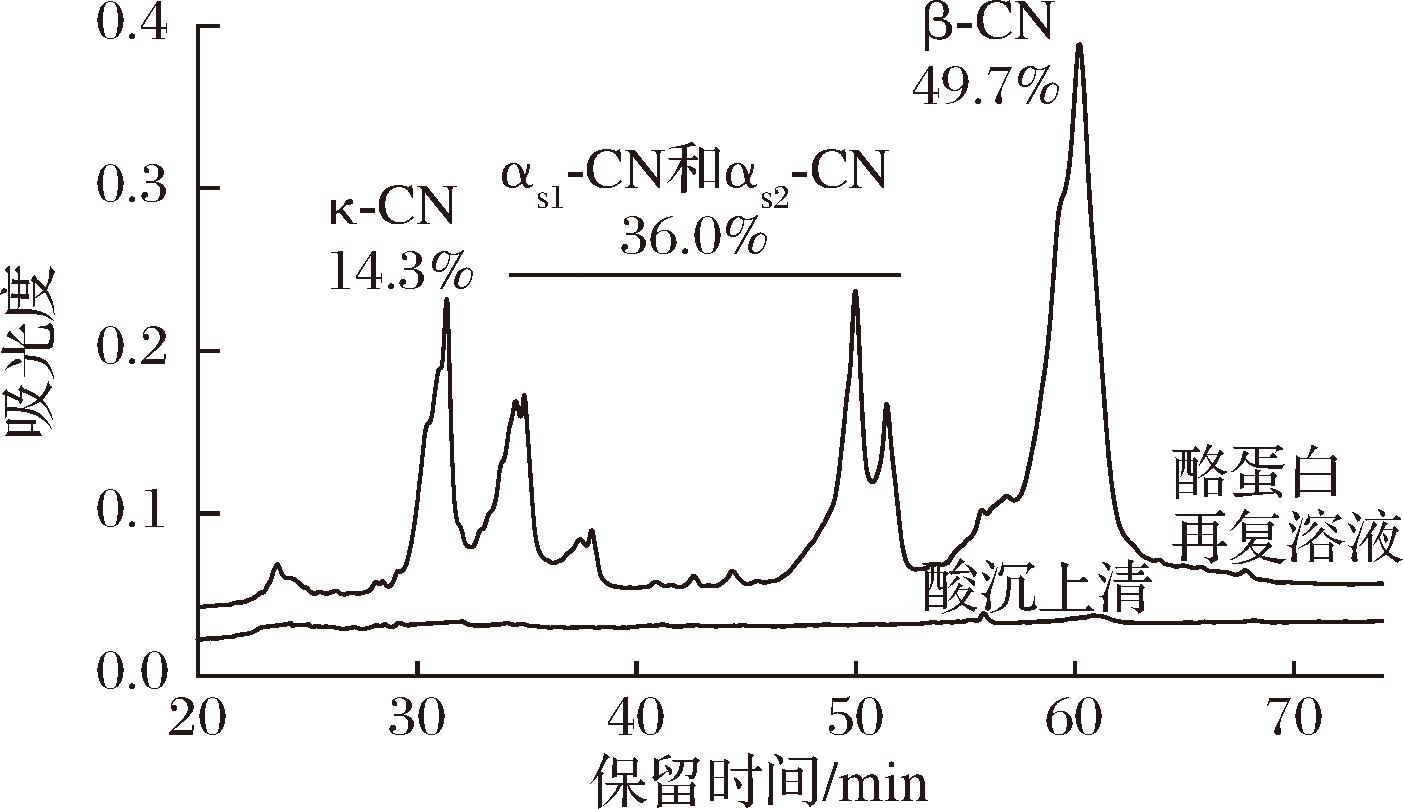
图2 酪蛋白再复溶液和酸沉上清液的反相高效液相色谱图
Fig.2 RP-HPLC chromatograms of reconstituted casein solution and its supernatant prepared by acid precipitationfrom
注:CN为酪蛋白(casein)(下图同)。
2.2 κ-酪蛋白和β-酪蛋白配料提取工艺各因素影响
2.2.1 再复溶步骤对κ-酪蛋白和β-酪蛋白提取的影响
在提取过程中,不同溶解pH和时间对酪蛋白组分提取率和纯度的影响如图3所示。pH 6.5~7.5时,κ-酪蛋白和β-酪蛋白的提取率和纯度随pH升高而增加,但超过pH 7.5后则出现下降。溶解时间在0~60 min内,κ-酪蛋白和β-酪蛋白提取率随溶解度增加而上升,而κ-酪蛋白纯度略有下降;60 min后提取率和纯度变化不大。因此,优选条件为pH 7.5、溶解时间60 min。罗桂心[9]和SCHUBERT等[5]均采用pH 11强碱性环境下进行酪蛋白亚组分提取。富含蛋白质的食品及食品原料在碱处理过程中,极易产生赖丙氨酸(lysinoalanine,LAL)。即便处于室温环境,LAL也会缓慢生成,从而使必需氨基酸减少并发生外消旋化,导致食品的营养价值降低[10],弱碱性环境中LAL生成量极低,需结合高温或长时间加热才能被检测到。
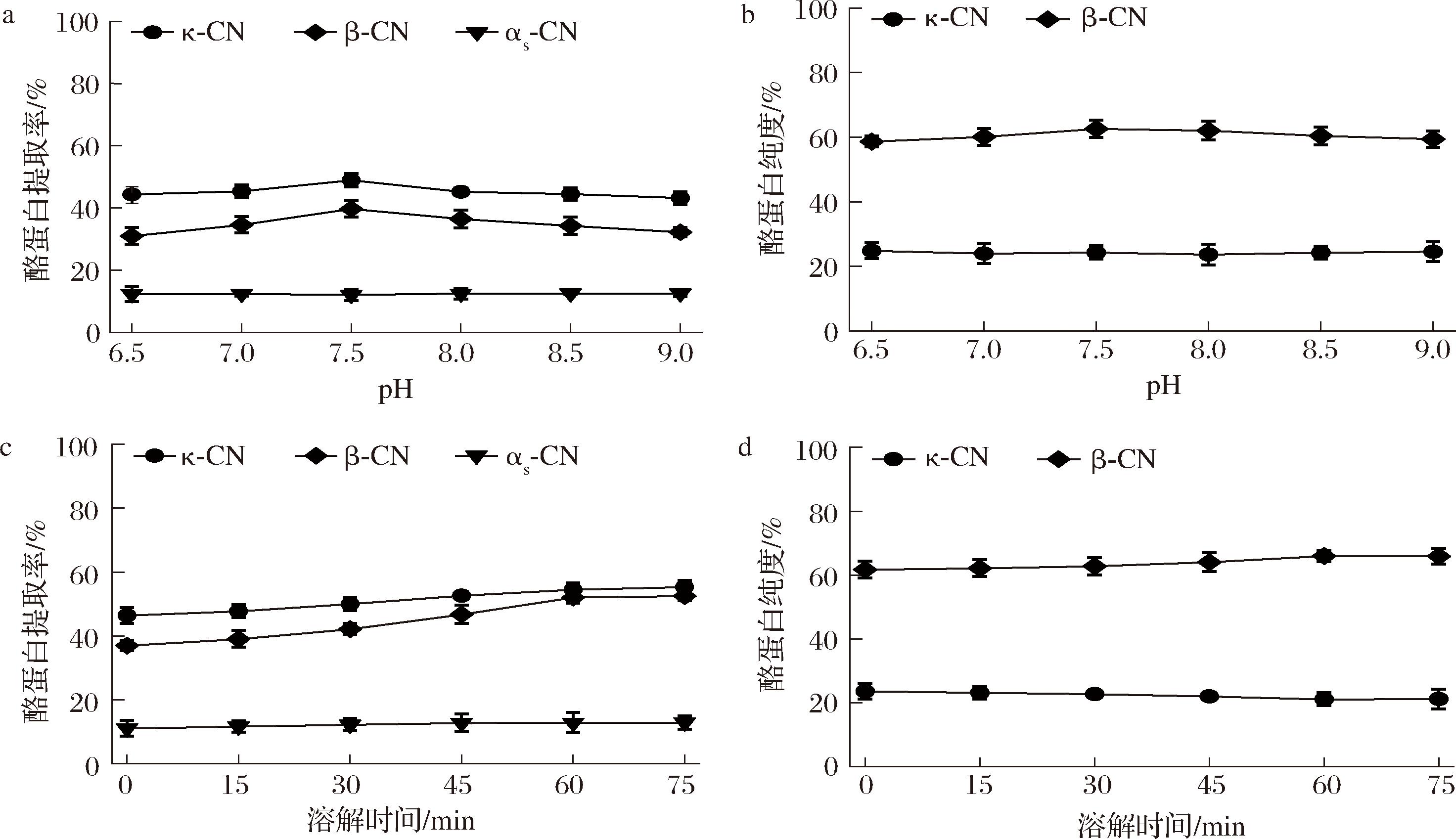
a-不同溶解pH的酪蛋白提取率;b-不同溶解pH的酪蛋白纯度;c-不同溶解时间的酪蛋白提取率;d-不同溶解时间的酪蛋白纯度
图3 再复溶步骤中不同溶解pH和时间下得到富含κ-酪蛋白和β-酪蛋白上清液中的κ-、β-和αs-酪蛋白的提取率和κ-酪蛋白和β-酪蛋白的纯度
Fig.3 Yield of κ-, β- and αs-caseins and purity of κ- and β-caseins in the κ-and β-casein enriched supernatant obtained using different pH and time in the redissolution step
2.2.2 低温位置对κ-酪蛋白和β-酪蛋白提取的影响
低温位置对κ-酪蛋白和β-酪蛋白提取也有重要影响(图4)。将低温处理从酪蛋白与钙络合前移至αs-酪蛋白沉淀前,κ-酪蛋白和β-酪蛋白提取率和纯度几乎无变化;而将低温处理移至αs-酪蛋白沉淀后,κ-酪蛋白和β-酪蛋白提取率显著降低,纯度则显著升高。在酪蛋白与钙络合前及αs-酪蛋白沉淀前进行低温处理时,αs-酪蛋白提取率超过80%,不利于κ-酪蛋白和β-酪蛋白的提取,这可能与αs-酪蛋白与钙的结合力随温度升高而增强有关[11]。从纯度角度看,αs-酪蛋白沉淀后的低温处理可获得纯度最高的κ-酪蛋白和β-酪蛋白。因此,确定低温步骤的最佳位置为αs-酪蛋白沉淀之后。
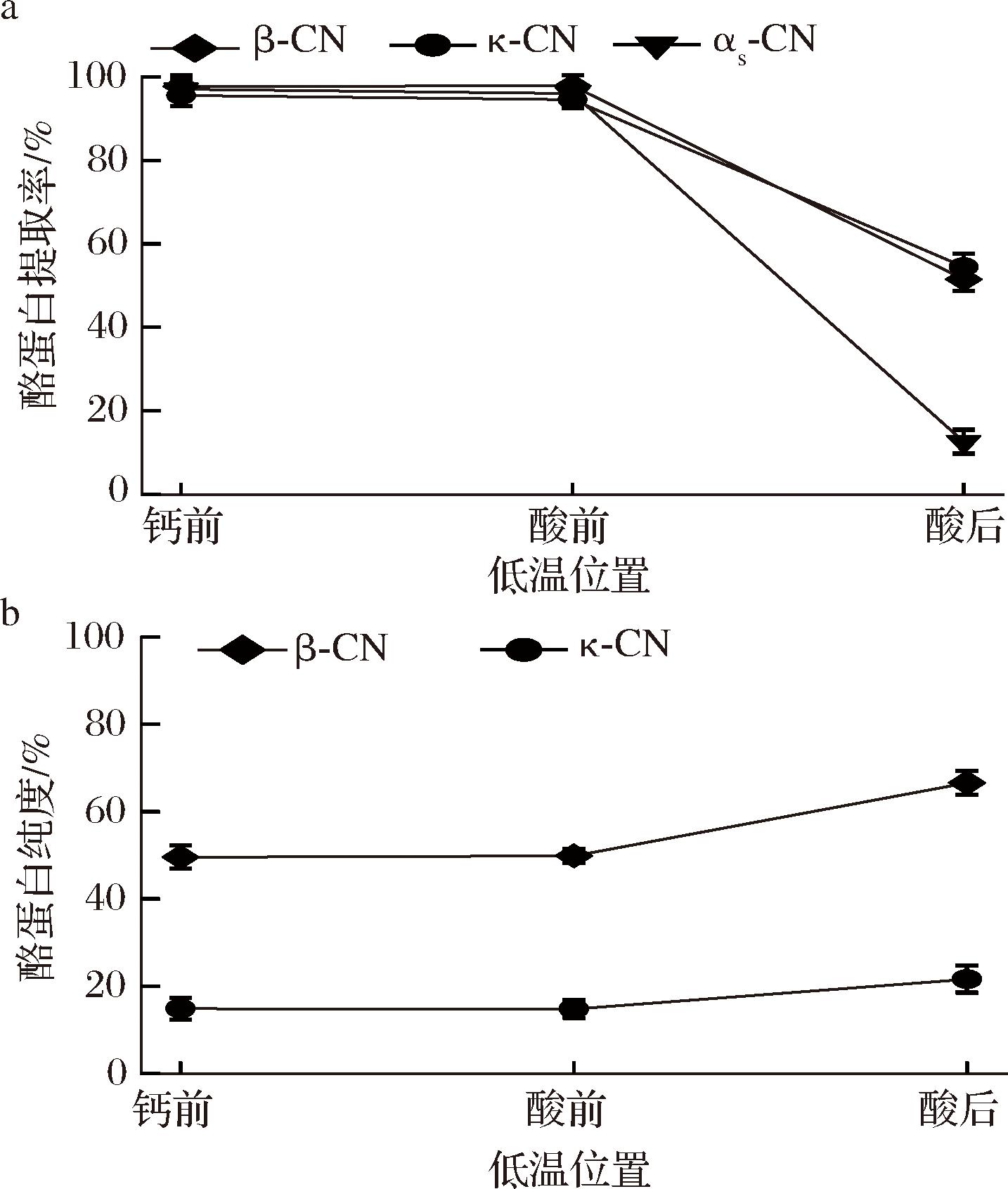
a-不同低温位置的酪蛋白提取率;b-不同低温位置的酪蛋白纯度
图4 不同低温位置下得到富含κ-酪蛋白和β-酪蛋白上清液中的κ-酪蛋白、β酪蛋白和αs-酪蛋白的提取率和κ-酪蛋白和β-酪蛋白的纯度
Fig.4 Yield of κ-, β- and αs-caseins and purity of κ- and β-caseins in the κ-and β-casein enriched supernatant obtained after cooling at different positions
2.2.3 酪蛋白与钙络合步骤中对κ-酪蛋白和β-酪蛋白提取的影响
如图5所示,在酪蛋白与钙络合过程中,钙浓度、温度和平衡时间对提取率和纯度有显著影响。随着钙浓度从30 mmol/L增至45 mmol/L,κ-酪蛋白和β-酪蛋白提取率上升,纯度略有下降;进一步增至70 mmol/L时,κ-酪蛋白和β-酪蛋白提取率显著上升,但αs-酪蛋白提取率也随之上升。综合考虑纯度和提取率,45 mmol/L被选为较优钙浓度。如图5-b所示,温度升高(尤其超过15 ℃)导致各酪蛋白组分提取率下降,其中αs-酪蛋白变化最为显著。温度升高增强了酪蛋白的疏水作用,促进其与钙结合,减少静电排斥,从而降低提取率。此外,温度升高还会形成大的聚集体,捕获更多酪蛋白,导致各组分提取率降低[3,12]。而κ-酪蛋白和β-酪蛋白纯度随温度上升而升高,在25 ℃后变化不大。如图5-c所示,随平衡时间延长,κ-酪蛋白、β酪蛋白和α-酪蛋白提取率降低,κ-酪蛋白、β-酪蛋白纯度升高,至90 min后,κ-、β-酪蛋白提取率和纯度基本不再变化。综上所述,最佳实验条件为25 ℃、45 mmol/L钙离子浓度、平衡90 min。

a-添加不同钙离子浓度的酪蛋白提取率;b-添加不同钙离子浓度的酪蛋白纯度;c-不同温度的酪蛋白提取率;d-不同温度的酪蛋白纯度;e-不同时间的酪蛋白提取率;f-不同时间的酪蛋白纯度
图5 酪蛋白与钙络合步骤中不同钙离子浓度、温度及时间下得到富含κ-酪蛋白和β-酪蛋白上清液中的κ-酪蛋白、β-酪蛋白和αs-酪蛋白的提取率和κ-酪蛋白和β-酪蛋白的纯度
Fig.5 Yield of κ-, β- and αs-caseins and purity of κ- and β-caseins in the κ-and β-casein enriched supernatant obtained using different calcium concentrations, temperatures, and times in the casein-Ca complexation step
2.2.4 αs-酪蛋白沉淀步骤对κ-酪蛋白和β-酪蛋白提取的影响
图6展示了αs-酪蛋白沉淀过程中,不同酸化剂、pH及平衡时间对提取上清液中κ-酪蛋白和β-酪蛋白提取的影响。在酸化剂方面,酪蛋白提取率排序为:乙酸>乳酸>盐酸>柠檬酸;纯度排序为:柠檬酸>乙酸>乳酸>盐酸>柠檬酸。柠檬酸对钙具有高亲和力,会与酪蛋白竞争钙并形成络合物[13],导致与酪蛋白络合的钙离子浓度降低,从而降低了低钙离子浓度下酪蛋白组分的提取率。盐酸导致提取率低的原因可能是酸水解引发敏感性沉淀,高浓度盐酸使局部pH大幅下降,导致酪蛋白水解或沉淀[14];而乙酸酸性较弱,能均匀酸化溶液,减少局部酪蛋白聚集和沉淀[15]。因此选定乙酸溶液对αs-酪蛋白进行酸化沉淀。
采用乙酸沉淀αs-酪蛋白后,如图6-b所示,随pH值从4.2升至5.0,κ-酪蛋白和β-酪蛋白提取率显著上升,在pH 5.0~5.4略微下降。研究证实,酸化剂在酪蛋白组分提取中调控至pH 5.0时,对各组分的分离效率存在显著影响[16]。

a-不同酸化剂的酪蛋白提取率;b-不同酸化剂的酪蛋白纯度;c-不同酸沉淀pH的酪蛋白提取率;d-不同酸沉淀pH的酪蛋白纯度;e-不同平衡温度的酪蛋白提取率;f-不同平衡温度的酪蛋白纯度;g-不同平衡时间的酪蛋白提取率;h-不同平衡时间的酪蛋白纯度
图6 αs-酪蛋白沉淀步骤中不同酸化剂、温度、pH及平衡时间下得到富含κ-酪蛋白和β-酪蛋白上清液中的κ-酪蛋白、β-酪蛋白和αs-酪蛋白的提取率和κ-酪蛋白和β-酪蛋白的纯度
Fig.6 Yield of κ-, β-, and αs-caseins and purity of κ- and β-caseins in the κ-and β-casein enriched supernatant obtained using different acidulants, pH, temperature, and equilibration time in the αs-casein precipitation step
对于温度的影响,在10~30 ℃,κ-酪蛋白和β-酪蛋白的提取率缓慢下降。当温度超过30 ℃时,β-酪蛋白和αs-酪蛋白的提取率骤降。这可能是由于升高温度会增强疏水相互作用,使分子更易聚集,从而导致其溶解度进一步降低[12],而此温度下κ-和β-酪蛋白纯度最高,继续升温纯度变化不大。
在平衡时间方面,当时间从10 min延长至30 min时,κ-酪蛋白和β-酪蛋白的提取率下降,而αs-酪蛋白的提取率下降更快。在30 min时,κ-酪蛋白和β-酪蛋白的纯度达到最高。随着时间的进一步延长,二者的提取率和纯度继续下降。
综上所述,选定以乙酸溶液调节pH值至5.0,并在30 ℃下平衡30 min的条件,以便筛选后续实验条件。
2.2.5 低温平衡步骤对κ-酪蛋白和β-酪蛋白提取的影响
在低温平衡步骤中,研究了不同温度和时间对κ-酪蛋白和β-酪蛋白提取过程中各酪蛋白组分提取率和纯度的影响(图7)。在温度方面,0~4 ℃时,κ-酪蛋白和β-酪蛋白提取率随温度升高轻微下降但变化不大,而αs-酪蛋白提取率降低,这可能是因为低温促使疏水键形成,降低疏水相互作用,使β-酪蛋白从沉淀物中解离[17]。温度升高至12 ℃时,β-酪蛋白提取率显著降低。POST等[18]和SCHIFFER等[19]也发现,在采用选择性沉淀法分离牛乳β-酪蛋白的过程中,采用低温预冷处理可有效促进β-酪蛋白的后续溶出效果。在时间方面,将低温时间从0延长至12 h,κ-酪蛋白和β-酪蛋白提取率显著增加,随后基本保持稳定,而二者纯度几乎无变化,罗桂心[9]也证实延长时间有利于β-酪蛋白的提取及酪蛋白单体从胶束中解离,且对β-酪蛋白的影响较为显著。综合来看,优选条件为4 ℃下低温12 h,后续将在此基础上筛选其他实验条件。
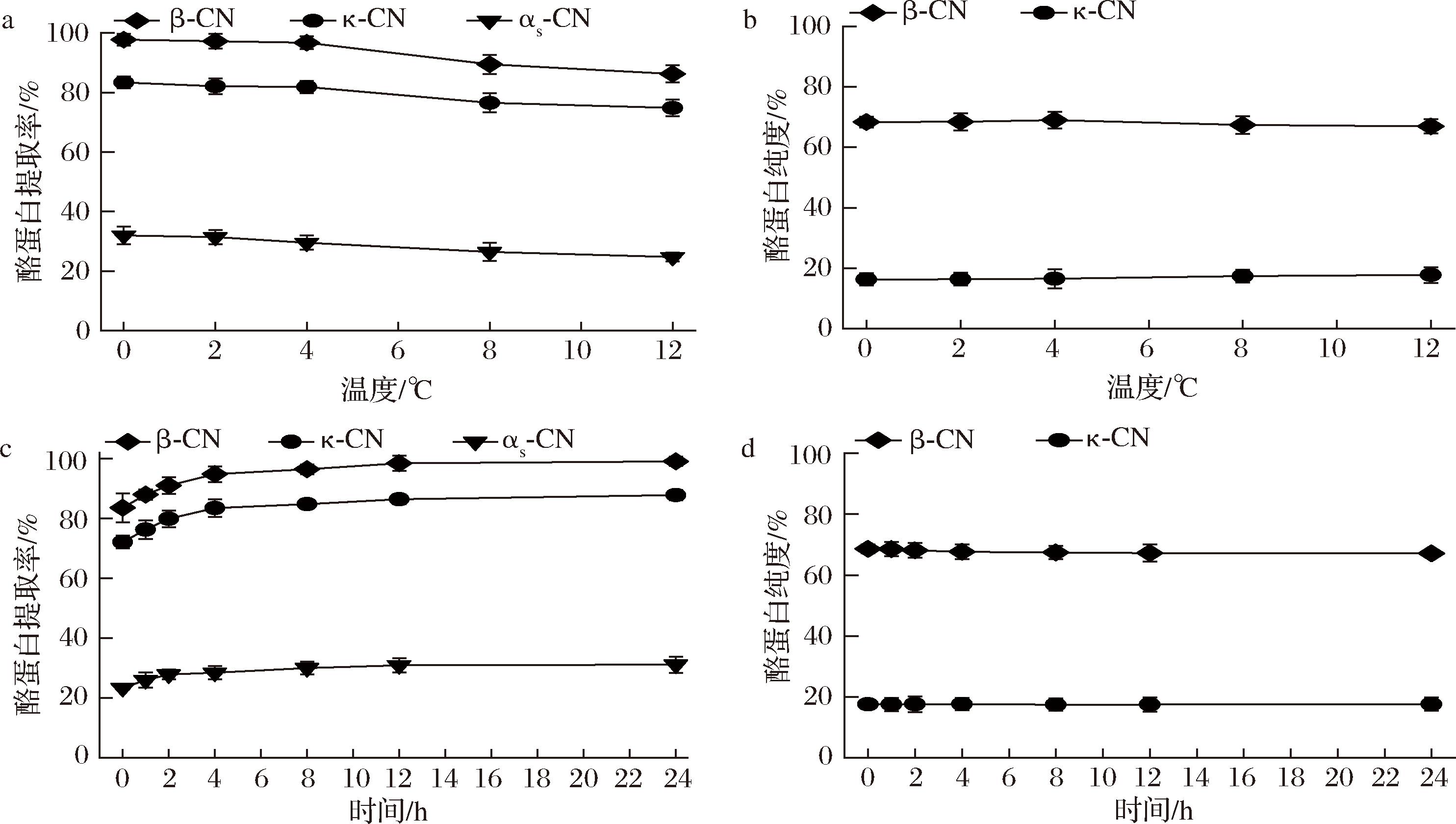
a-不同低温温度的酪蛋白提取率;b-不同低温温度的酪蛋白纯度;c-不同低温时间的酪蛋白提取率;d-不同低温时间的酪蛋白提取率
图7 低温平衡步骤中不同温度、时间下得到富含κ-酪蛋白和β-酪蛋白上清液中的κ-酪蛋白、β-酪蛋白和αs-酪蛋白的提取率和κ-酪蛋白和β-酪蛋白的纯度
Fig.7 Yield of κ-, β- and αs-caseins and purity of κ- and β-caseins in the κ-and β-casein enriched supernatant obtained using different temperatures and times in the low-temperature equilibration step
2.2.6 蛋白浓度放大对κ-酪蛋白和β-酪蛋白提取的影响
前期研究显示钙离子浓度是影响选择性沉淀法提取κ-酪蛋白和β-酪蛋白的核心因素。鉴于其在分离过程中的重要作用及其与其他参数的协同效应,当提升酪蛋白浓度以优化提取效率时,需重新评估钙离子的最佳添加量,以确保κ-酪蛋白和β-酪蛋白的得率和纯度。如图8-a所示,在最佳钙与酪蛋白比例(15∶1,摩尔比)时,随着酪蛋白添加量从10 g/L增至80 g/L,κ-酪蛋白和β-酪蛋白提取率逐渐上升,但αs-酪蛋白也显著增加,不利于κ-酪蛋白和β-酪蛋白的分离。同时,κ-酪蛋白和β-酪蛋白纯度呈下降趋势。综合比较,30 g/L酪蛋白可获得κ-酪蛋白和β-酪蛋白最大提取率和较高纯度,因此选择30 g/L酪蛋白,45 mmol/L的钙离子添加浓度用于后续优化实验。如图8-b所示,在最佳钙离子添加浓度45 mmol/L下,随着酪蛋白从30 g/L增至40 g/L,κ-酪蛋白和β-酪蛋白提取率和纯度稳步上升,而αs-酪蛋白提取率显著下降;当添加量从40 g/L增至80 g/L时,αs-酪蛋白提取率显著提升,不利于κ-酪蛋白和β-酪蛋白的分离。综上所述,优选酪蛋白添加量40 g/L、钙离子添加浓度45 mmol/L用于酪蛋白放大提取及后续优化实验。
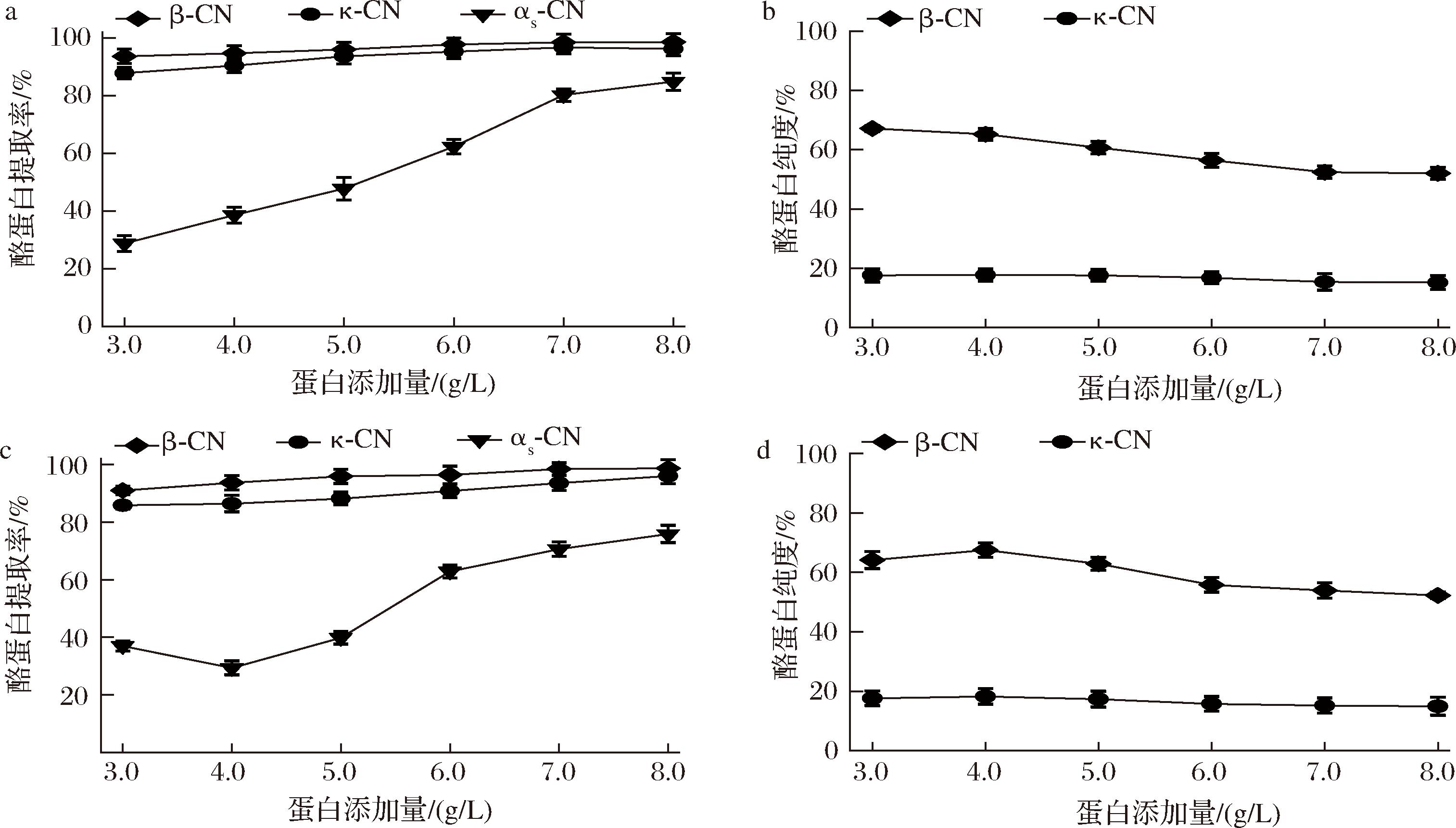
a-固定钙离子与酪蛋白比例(15∶1,摩尔比)的酪蛋白提取率;b-固定钙离子与酪蛋白比例(15∶1,摩尔比)的酪蛋白纯度;c-固定钙离子添加浓度,不同蛋白添加量的酪蛋白提取率;d-固定钙离子添加浓度,不同蛋白添加量的酪蛋白纯度
图8 蛋白浓度放大中固定钙/酪蛋白比例和固定钙离子添加浓度下得到富含κ-酪蛋白和β-酪蛋白上清液中的κ-酪蛋白、β酪蛋白和αs-酪蛋白的提取率和κ-β-酪蛋白的纯度
Fig.8 Yield of κ-, β- and αs-caseins and purity of κ- and β-caseins in the κ-and β-casein enriched supernatant obtained using fixed Ca/casein ratio and fixed Ca addition concentration when increasing protein concentration
2.2.7 κ-酪蛋白和β-酪蛋白沉淀步骤中pH、温度和时间对沉淀率的影响
在κ-酪蛋白和β-酪蛋白沉淀步骤中,pH、温度和时间会影响沉淀率。如图9-a所示,在25 ℃时,随着pH值从3.2调节至4.0,κ-酪蛋白和β-酪蛋白沉淀率持续上升,并在pH 4.0达到最高点;而继续提高pH会导致沉淀率下降,因此选取pH 4.0为最优沉淀pH。这一研究结果与THIENEL等[20]在pH 4.6条件下回收牛乳β-酪蛋白的报道存在差异,可能源于羊乳与牛乳β-酪蛋白磷酸化程度的不同。钙离子与酪蛋白结合可屏蔽负电荷,降低Zeta电位,从而影响分离效果[21]。如图9-b所示,在pH调节至4.0的条件下,κ-酪蛋白和β-酪蛋白沉淀率随着温度从25 ℃升高至45 ℃而逐渐提升,这是由于温度升高增强了β-酪蛋白的疏水相互作用,促进其聚集沉淀[6];而在45 ℃以上时,κ-酪蛋白和β-酪蛋白沉淀率的变化则不显著。此外,图9-c探究了不同反应时间对κ-酪蛋白和β-酪蛋白沉淀的影响,结果表明,κ-酪蛋白和β-酪蛋白的沉淀率在30 min时达到峰值,之后趋于平稳。因此,最佳反应时间选择为30 min。
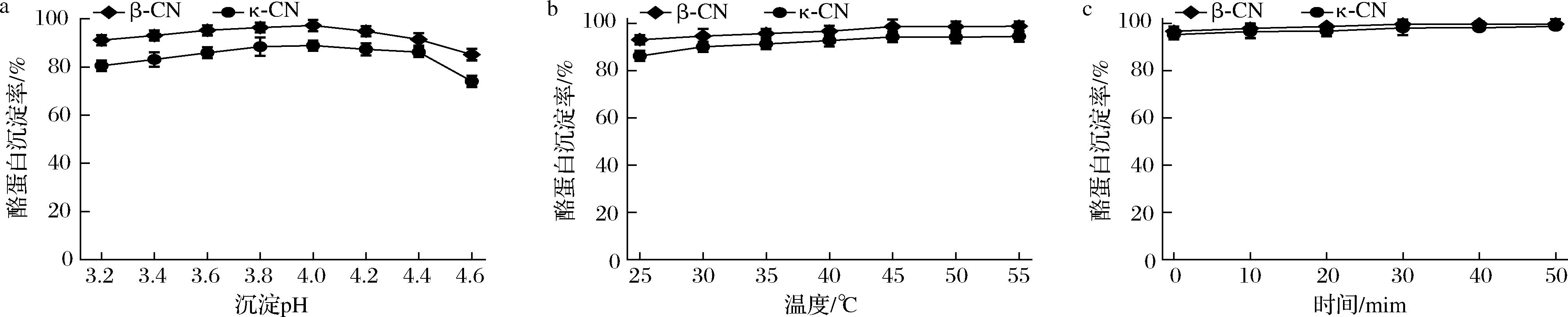
a-不同沉淀pH;b-不同温度;c-不同时间
图9 κ-酪蛋白和β-酪蛋白沉淀步骤中不同pH、温度和时间下得到的κ-酪蛋白和β-酪蛋白的沉淀率
Fig.9 Precipitation rate of κ- and β-caseins obtained using different pH, temperatures and times in the κ-and β-casein precipitation step
在最优沉淀条件即pH 4.0、45 ℃下沉淀30 min,κ-酪蛋白和β-酪蛋白的沉淀率分别达到96.7%和99.7%,结合富含κ-酪蛋白和β-酪蛋白上清液中的最高提取率进行计算以及RP-HPLC(图10)分析显示,可得κ-酪蛋白和β-酪蛋白的最优得率分别为85.7% 和97.3%。κ-酪蛋白和β-酪蛋白的纯度分别为18.0%和68.7%。而SCHUBERT等[5]在强碱性条件下采用选择性沉淀法分离得到的κ-酪蛋白和β-酪蛋白的得率分别为54.1%和92.1%,纯度分别为39.2%和27.5%。THIENEL等[20]同样在强碱性条件下分离出的κ-酪蛋白和β-酪蛋白的得率分别为4%和10.2%,纯度分别为43%和39.2%。综上,本研究采用的弱碱性条件相较于前人强碱性条件提取更加温和,且所得的κ-酪蛋白和β-酪蛋白的综合得率和纯度均高于前人报道。且本研究是对κ-酪蛋白和β-酪蛋白进行共同提取,前人主要集中于提取单一组分的酪蛋白。
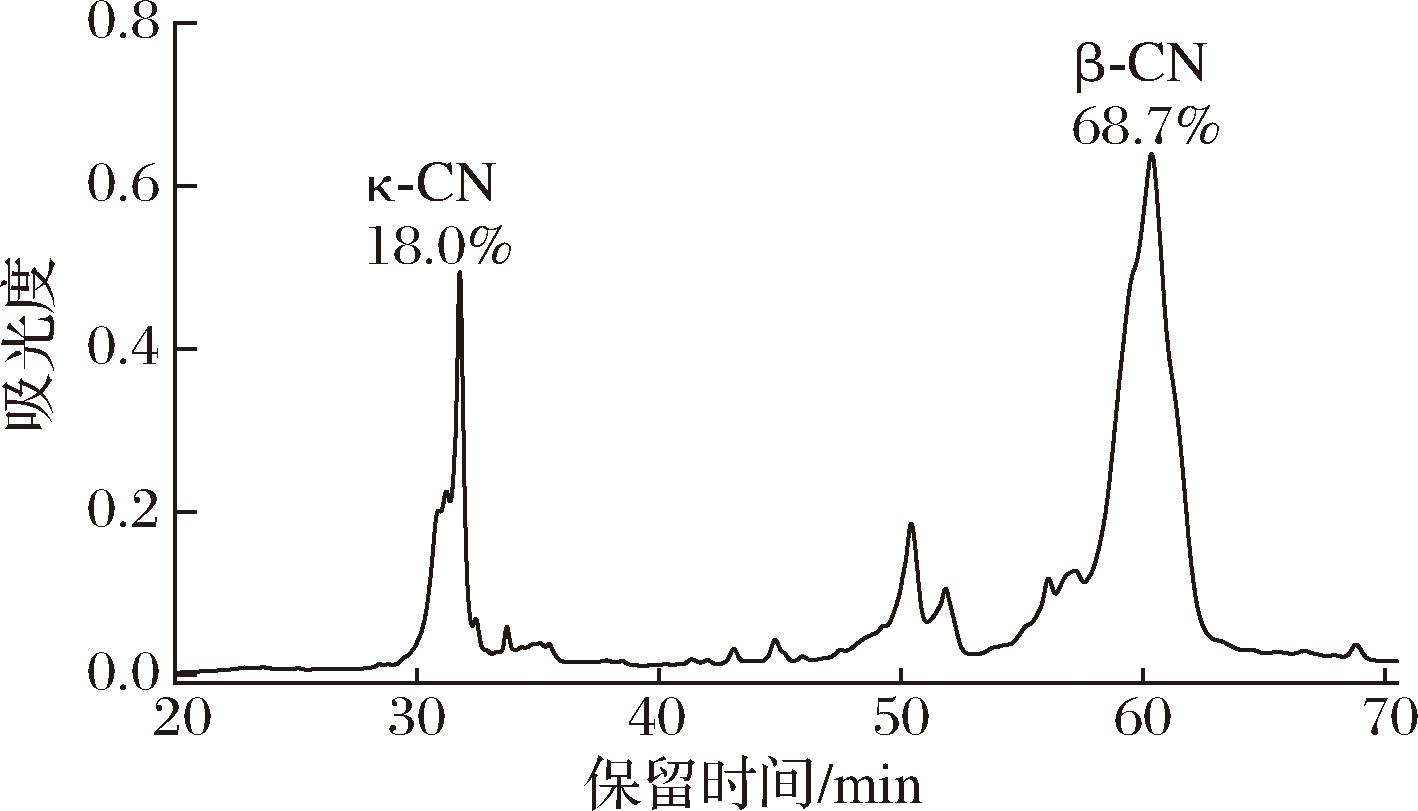
图10 κ-酪蛋白和β-酪蛋白配料的反相高效液相色谱图
Fig.10 RP-HPLC chromatograms the κ-and β-casein ingredient
2.3 κ-酪蛋白和β-酪蛋白配料放大生产
本部分基于2.2节中的最优工艺路线并进行放大生产,κ-酪蛋白和β-酪蛋白的沉淀率分别达到93.9%和99.0%,结合富含κ-酪蛋白和β-酪蛋白上清液的最高提取率进行计算,可得κ-酪蛋白和β-酪蛋白的最优得率分别为76.4%和88.7%。根据图11中RP-HPLC分析表明,κ-酪蛋白和β-酪蛋白配料中κ-酪蛋白和β-酪蛋白的纯度分别为18.0%和67.6%。从实验室规模放大到工业生产时,得率和纯度通常会有所下降,主要是由于工艺体积损失。此外,随着工艺体积增加,温度和时间等条件控制较难[5, 22]。尤其在低温步骤,保持低温对避免β-酪蛋白沉淀至关重要。温度过高会导致β-酪蛋白得率降低,并影响其纯度。
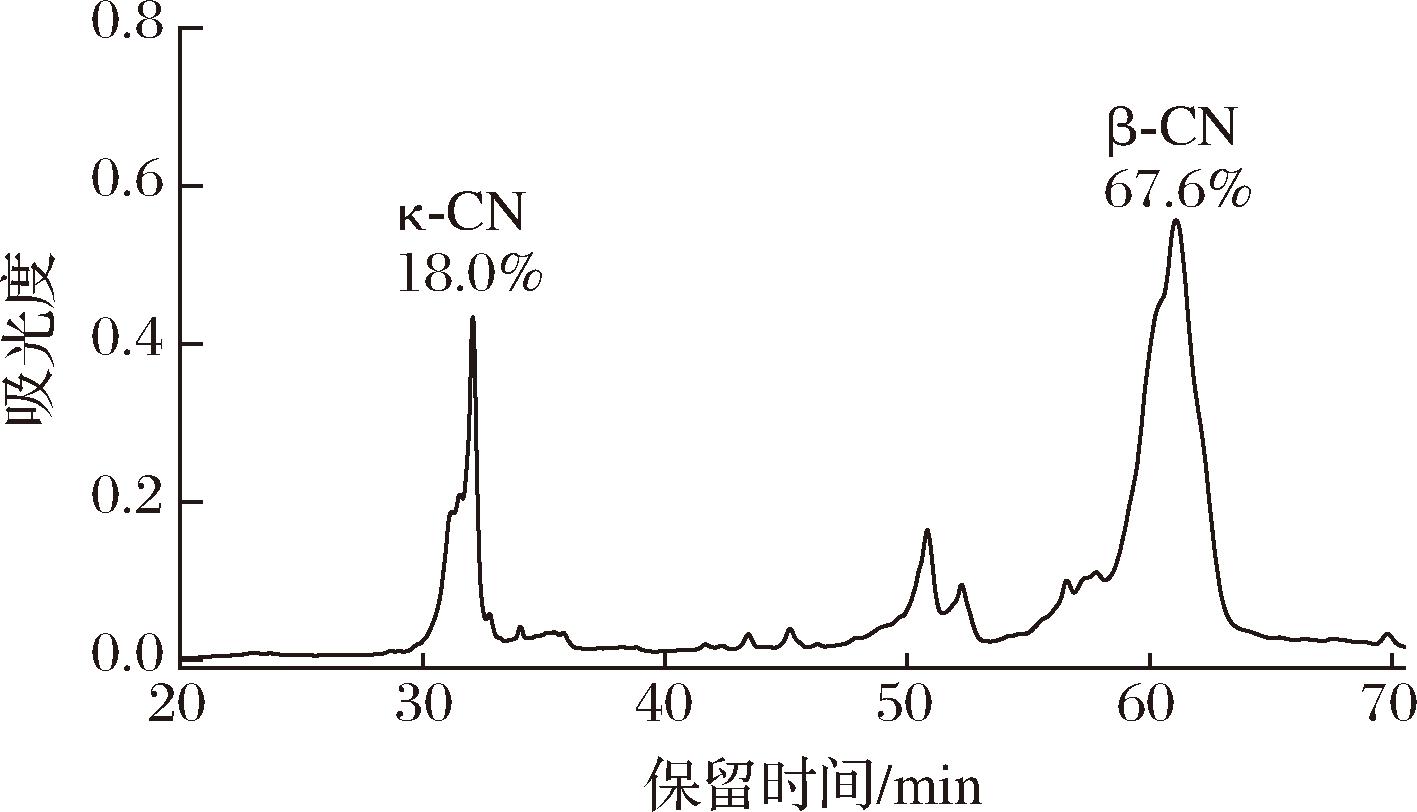
图11 放大生产所获得的κ-酪蛋白和β-酪蛋白配料的反相高效液相色谱图
Fig.11 RP-HPLC chromatograms of the κ-and β-casein ingredient obtained from the scaled-up production
2.4 κ-酪蛋白和β-酪蛋白沉淀降低灰分
为降低灰分,对κ-酪蛋白和β-酪蛋白沉淀进行水洗处理。如表1所示,随着水洗次数增加,灰分含量明显下降。未经水洗时灰分含量为7.85%,水洗1次后降至4.94%,表明水洗过程有效去除了κ-酪蛋白和β-酪蛋白配料中的灰分。这有利于提升产品品质,更适用于婴配粉生产。
表1 κ-酪蛋白和β-酪蛋白配料水分和灰分含量 单位:%
Table 1 Moisture and ash content of the κ-and β-casein ingredients
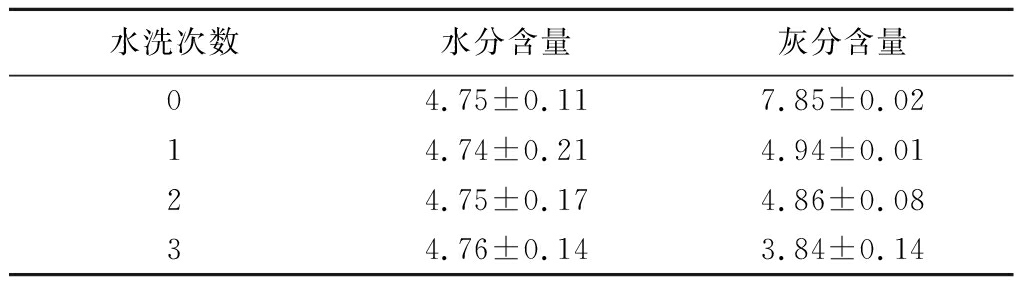
水洗次数水分含量灰分含量04.75±0.117.85±0.0214.74±0.214.94±0.0124.75±0.174.86±0.0834.76±0.143.84±0.14
3 结论
本研究通过优化选择性沉淀法中再复溶、酪蛋白与钙络合、αs-酪蛋白沉淀及低温平衡等关键工艺参数,在温和弱碱性条件下从山羊MCC中分离出接近母乳比例的κ-酪蛋白和β-酪蛋白,最优工艺如下:将制得的酪蛋白沉淀配制成40 g/L的酪蛋白再复溶液,25 ℃下调节pH值为7.5,搅拌60 min。然后25 ℃下添加氯化钙至45 mmol/L,搅拌90 min。之后使用乙酸调节pH值至5.0,升温至30 ℃反应30 min。再冷却至4 ℃;低温处理12 h。以3 000×g离心10 min,得到富含κ-酪蛋白和β-酪蛋白的上清液和富含αs-酪蛋白的沉淀。将富含κ-酪蛋白和β-酪蛋白的上清液在pH 4.0、45 ℃沉淀 30 min。再以10 000×g离心10 min,获得富含κ-酪蛋白和β-酪蛋白的沉淀,通过水洗沉淀1次及以上,最后加水复溶沉淀,用NaOH调pH值至7.0并充分复溶,干燥成粉。在实验级条件下,κ-酪蛋白和β-酪蛋白的得率分别为85.7% 和97.3%,纯度分别为18.0%和68.7%。放大至60 L规模后,κ-酪蛋白和β-酪蛋白配料仍保持较高的得率和纯度,且水洗后灰分≤5%。目前,我国婴配粉母乳化的研究主要集中在调节乳清蛋白和酪蛋白比例方面,并没有考虑酪蛋白组成的差异,而该方法大大降低了乳中高比例的αs-酪蛋白,使羊乳酪蛋白组分接近于母乳酪蛋白比例,未来可用于羊乳基婴幼儿配方奶粉的开发。该方法在弱碱性环境下进行选择性提取,条件较为温和。过往研究采用强碱性提取工艺虽可富集酪蛋白,但在强碱条件下会诱导生成LAL等有害副产物,还会引发糖基化反应。
[1] NEHIR EL S, KARAKAYA S, SIMSEK S, et al.In vitro digestibility of goat milk and kefir with a new standardised static digestion method (INFOGEST cost action) and bioactivities of the resultant peptides[J].Food &Function, 2015, 6(7):2322-2330.
[2] MAATHUIS A, HAVENAAR R, HE T, et al.Protein digestion and quality of goat and cow milk infant formula and human milk under simulated infant conditions[J].Journal of Pediatric Gastroenterology and Nutrition, 2017, 65(6):661-666.
[3] 张静, 洪欣慧紫, 陶秀梅, 等.羊乳酪蛋白κ和β亚组分的共富集及婴幼儿体外消化性研究[J].食品与发酵工业, 2025, 51(4):75-82.ZHANG J, HONG X H Z, TAO X M, et al.Study on co-enrichment of caprine casein κ and β subfractions and in vitro digestibility of infants[J].Food and Fermentation Industries, 2025, 51(4):75-82.
[4] ZHANG J P, DU X Y, JIANG S L, et al.Formulation of infant formula with different casein fractions and their effects on physical properties and digestion characteristics[J].Food &Function, 2022, 13(2):769-780.
[5] SCHUBERT T, ERGIN I, PANETTA F, et al.Application of a temperature-controlled decanter centrifuge for the fractionation of αs-, β- and κ-casein on pilot scale[J].International Dairy Journal, 2021, 122:105148.
[6] POST A, EBERT M, HINRICHS J.β-casein as a bioactive precursor-processing for purification[J].Australian Journal of Dairy Technology, 2009, 64(1):84-88.
[7] ATAMER Z, POST A E, SCHUBERT T, et al.Bovine β-casein:Isolation, properties and functionality.A review[J].International Dairy Journal, 2017, 66:115-125.
[8] MARKOSKA T, DANILOSKI D, VASILJEVIC T, et al.Structural changes of β-casein induced by temperature and pH analysed by nuclear magnetic resonance, Fourier-transform infrared spectroscopy, and chemometrics[J].Molecules, 2021, 26(24):7650.
[9] 罗桂心. 山羊乳酪蛋白组分的分离及消化性研究[D].无锡:江南大学, 2023.LUO G X.Study on fractionation and digestibility of caprine casein fractions[D].Wuxi:Jiangnan University, 2023.
[10] RENZONE G, ARENA S, SCALONI A.Cross-linking reactions in food proteins and proteomic approaches for their detection[J].Mass Spectrometry Reviews, 2022, 41(5):861-898.
[11] LIU X C, JIANG Y, AHRNÉ L M, et al.Temperature effects on calcium binding to caseins[J].Food Research International, 2022, 154:110981.
[12] POST A E, ARNOLD B, WEISS J, et al.Effect of temperature and pH on the solubility of caseins:Environmental influences on the dissociation of αS- and β-casein[J].Journal of Dairy Science, 2012, 95(4):1603-1616.
[13] MEKMENE O, GAUCHERON F.Determination of calcium-binding constants of caseins, phosphoserine, citrate and pyrophosphate:A modelling approach using free calcium measurement[J].Food Chemistry, 2011, 127(2):676-682.
[14] KERN L, FABRE O, SCHER J, et al.Chemical fractionation of caseins by differential precipitation:Influence of pH, calcium addition, protein concentration and temperature on the depletion in α- and β-caseins[J].International Journal of Food Science &Technology, 2020, 55(2):542-552.
[15] MELNYCHYN P, WOLCOTT J M.Simple procedure for isolation of alphas-casein[J].Journal of Dairy Science, 1967, 50(12):1863-1867.
[16] THEKKILAVEEDU S, KRISHNASWAMI V, MOHANAN D P, et al.Lactic acid‐mediated isolation of alpha-, beta- and kappa-casein fractions by isoelectric precipitation coupled with cold extraction from defatted cow milk[J].International Journal of Dairy Technology, 2020, 73(1):31-39.
[17] DOWNEY W K, MURPHY R F.The temperature-dependent dissociation of β-casein from bovine casein micelles and complexes[J].Journal of Dairy Research, 1970, 37(3):361-372.
[18] POST A E, HINRICHS J.Suitability of commercial caseinates in comparison to micellar casein as raw material for isolation of food-grade β-casein[J].Milchwissenschaft, 2010, 65(2):195-198.
[19] SCHIFFER S, SCHEIDLER E, KIEFER T, et al.Effect of temperature, added calcium and pH on the equilibrium of caseins between micellar state and milk serum[J].Foods, 2021, 10(4):822.
[20] THIENEL K J F, HOLDER A, SCHUBERT T, et al.Fractionation of milk proteins on pilot scale with particular focus on β-casein[J].International Dairy Journal, 2018, 79:73-77.
[21] ANEMA S G, KLOSTERMEYER H.ζ-Potentials of casein micelles from reconstituted skim milk heated at 120 ℃[J].International Dairy Journal, 1996, 6(7):673-687.
[22] POST A E, HINRICHS J.Large-scale isolation of food-grade β-casein[J].Milchwissenschaft, 2011, 66(4):361-364.