N-乙酰神经氨酸(N-acetylneuraminic acid,Neu5Ac)是一类含有9个碳的带负电荷的α-酮酸,具有促进大脑发育、增强免疫力、抵抗和预防高血压等多种生物学功能,是哺乳动物体内含量最丰富的一类唾液酸[1]。Neu5Ac在自然界中分布广泛,尤其在可食用燕窝(edible bird’s nest,EBN)中最为丰富,另外在牛奶来源的酪蛋白糖巨肽(casein glycomacropeptide, CGMP)中含量也较高。近年来许多研究发现,EBN在改善神经退行性疾病[2]、促进肠道健康[3]、美白抗衰老[4]等方面有重要作用,其生物活性与结合态Neu5Ac息息相关[5]。蛋白酶处理可从EBN中提取获到分子质量较小、水溶性的唾液酸糖肽,同时也提高了其生物利用度[6-7]。CGMP是一种从牛奶中提取的生物活性糖肽,其特点是仅含有O-糖基化,唾液酸含量为7%~9%,具有调节肠道菌群、促进矿物质吸收等多种生物学功能[8]。
糖基化修饰是一种常见的蛋白质翻译后修饰,包括N-糖基化和O-糖基化,对于发挥蛋白质的生理功能有重要作用[9]。糖蛋白因聚糖组成、糖基化位点以及蛋白质骨架的可变性而具有多样性的结构,因而在不同生物环境发挥不同的生物学功能[10]。蛋白的N-糖基化影响着糖蛋白的折叠、运输、分子识别等[11]。许多治疗性蛋白和酶[如免疫球蛋白G(immunoglobulin G,IgG)、促红细胞素等]都含有N-糖基化修饰,其溶解度、稳定性、安全性、免疫原性和疗效与N-糖基化水平和唾液酸化结构直接相关[12]。另外,人类饮食来源的一些膳食糖蛋白(如卵黏蛋白、鸡蛋免疫球蛋白Y)富含唾液酸,也含有N-糖基化修饰[13]。然而,N-糖基化修饰在膳食糖蛋白生物学功能中所起的作用仍有待研究。
白色念珠菌(Candida albicans)是人类胃肠道和口腔中的一种重要的条件性致病菌[14]。研究表明,粘蛋白O-糖基化位点的糖分子可以与白色念珠菌表面蛋白结合,并干扰其对宿主细胞的附着和入侵过程[15]。幽门螺杆菌(Helicobacter pylori)感染是世界上常见的细菌感染之一,可引起消化性溃疡、胃炎和黏膜相关淋巴组织(mucosa-associated lymphoid tissue, MaLT)淋巴瘤等疾病[16]。幽门螺杆菌可以与口腔和胃黏膜表面的粘蛋白结合并定植,其中的唾液酸结合粘附素发挥重要作用[17]。已有研究发现,儿茶素和唾液酸组合可以通过减弱胃上皮细胞的Caspase-1信号通路,从而根除幽门螺杆菌的感染[18]。
唾液酸在禽流感病毒(avian influenza virus,AIV)入侵机体方面起重要作用[19]。现有治疗AIV感染的药物包括奥司他韦、扎那米韦等都是唾液酸的结构类似物,可以作用于神经氨酸酶。研究表明,膳食唾液酸聚糖对AIV具有良好的抑制作用,主要是唾液酸化糖蛋白或糖肽的唾液酸能结合病毒表面的血凝素[20]。另外,人类肠道菌群稳态对维持人体健康有重要作用,而存在于胃肠道黏膜屏障上的唾液酸影响着肠道菌群的组成和病原体定植[21]。与年轻人相比,老年人肠道菌群丰度下降,包括益生菌如双歧杆菌(Bifidobacterium)的丰度下降,导致老年人对代谢紊乱和慢性炎症的易感性更高[22]。早期研究发现,CGMP可以改善老人肠道菌群,而EBN可以增加高龄孕妇肠道菌群中益生菌的丰度[3]。
本研究主要比较了燕窝唾液酸糖肽和CGMP对白色念珠菌、幽门螺杆菌和AIV的抑制以及对老年人肠道菌群的调节作用,探讨不同糖基化修饰的唾液酸糖肽对其生物学功能的影响。
1 材料与方法
1.1 实验材料
燕窝,厦门燕之屋生物工程有限公司;链霉蛋白酶,上海源叶生物科技有限公司;胰蛋白酶,上海科雅生物科技有限公司;碱性蛋白酶,北京索莱宝科技有限公司;Bradford蛋白测定试剂盒,上海碧云天生物技术有限公司;怀槐凝集素Ⅱ(Maackia amurensis lectin Ⅱ,MAL-Ⅱ),深圳欣博盛生物科技有限公司;酪蛋白糖巨肽,阿拉食品原料;3′-唾液酸乳糖(3′-sialyllactose,3′-SL),科汉森(中国)有限公司。
白色念珠菌ATCC 10231、幽门螺杆菌ATCC 43504,广东省微生物菌种保藏中心;脑心浸液粉、哥伦比亚血琼脂,赛默飞世尔科技公司;犬肾(Madin-Darby Canine Kidney, MDCK)细胞,武汉普诺赛生命科技有限公司;最低必需培养基(minimum essential medium, MEM)(Hyclone),美国Cytiva公司;胎牛血清,美国GIBCO公司。用于粪菌体外发酵的基础营养培养基的成分参考文献[23]。其余试剂均购自国药集团化学试剂有限公司。
1.2 仪器与设备
FreeZone 4.5L冷冻干燥机,美国Labconco公司;SPX-150B-Z生化培养箱、GI80T立式自动压力蒸汽灭菌锅,上海博讯实业有限公司医疗设备厂;Synergy H4多功能酶标仪,美国伯腾仪器有限公司;XD-101 CO2培养箱,日本SANYO;Agilent-1260高效液相色谱仪和7890A气相色谱仪,美国Agilent科技有限公司;HJ-M2恒温磁力搅拌浴,江苏新春兰科学仪器有限公司;SW-CJ-2FD超净工作台,苏州工业园区三兴净化科技有限公司;TY-SBA-40E生物传感分析仪,山东省科学院生物研究所;HYQX-Ⅱ厌氧培养箱,上海跃进医疗器械有限公司;Glycome316 DNA测序仪,南京溯远基因科技有限公司。
1.3 实验方法
1.3.1 燕窝唾液酸糖肽的制备
EBN预处理的方法参考文献[24]并有所改动,将干燕窝冲洗3次后浸泡在去离子水中(5 g燕窝/300 mL水),放置过夜,煮沸30 min,冷冻干燥。
EBN冻干粉的酶解分2个阶段。为了获得较高含量的可溶性蛋白,进行第一阶段酶解,方法参考文献[25-27]并有所改动,包括双酶酶解和单酶酶解,每一种酶的添加量为1%(质量分数),反应时间均为2 h,酶解后的样品为E1(sialoglycopeptide-E1)。双酶酶解组合包括胃蛋白酶+胰蛋白酶、胰酶+碱性蛋白酶、链霉蛋白酶+胰蛋白酶,其中涉及到的5种酶即单酶酶解所用的酶。为了获得更多分子质量较小的燕窝糖肽,进行第二阶段酶解,方法参考文献[28]。第二阶段酶解是在第一阶段条件下再加入一种酶,酶解样品为E2,加入的酶分别是木瓜蛋白酶、碱性蛋白酶、胰酶和胃蛋白酶。
1.3.2 燕窝去唾液酸糖肽的制备
选用高碘酸钠氧化法破坏EBN糖肽末端唾液酸,具体方法参考文献[29],获得样品为Desia-E1(desialoglycopeptide-E1)和Desia-E2(desialoglycopeptide-E2)。
1.3.3 唾液酸含量测定
采用HPLC测定燕窝糖蛋白中的唾液酸含量,具体方法参考文献[9,30]。用4 mol/L乙酸在80 ℃下水浴酸解燕窝糖蛋白3 h释放其中的唾液酸,用邻苯二胺(1,2-phenylenediamine,OPD)对唾液酸衍生,衍生条件为避光、80 ℃金属浴40 min。唾液酸含量测定采用HPLC(荧光检测器),色谱柱为Agilent Unitary C18(4.6 mm×150 mm,5 μm),FLD激发波长为373 nm,发射波长为448 nm,流动相为V(超纯水)∶V(乙腈)∶V(甲醇)=85∶8∶7,流速为0.9 mL/min,样品进样体积为10 μL。
1.3.4 燕窝唾液酸糖蛋白理化性质
燕窝酶解样品中可溶性蛋白含量测定采用Bradford蛋白浓度测定试剂盒,参考文献[31]。总糖含量采用苯酚-硫酸法测定[32]。酶解率按公式(1)计算,即第一阶段酶解的样品质量与酶解前的样品质量之比。分子质量分布采用高效凝胶排阻色谱(gel permeation chromatography,GPC)检测[33]。
酶解率![]()
(1)
1.3.5 唾液酸糖肽对白色念珠菌的抑制作用
探究不同糖基化修饰的唾液酸糖肽对白色念珠菌生长的抑制作用的方法参考文献[34]并有所改动。取一个无菌的96孔板,各孔依次加入准备好的菌悬液100 μL。一部分孔分别加入100 μL不同浓度的E2,使其终质量浓度分别为0.5、1、5、10 mg/mL;另一部分孔分别加入100 μL的E1、Desia-E1、Desia-E2、E2-LW、E2-HW、Neu5Ac、3′-SL和CGMP,使其终质量浓度为10 mg/mL;在剩下的各孔加入100 μL无菌水作为空白对照,每个样品设置3个重复。每个孔加完样品混匀后,将96孔板置于37 ℃、120 r/min的恒温摇床培养,24 h后用多功能酶标仪在600 nm处测得各孔OD值。
1.3.6 唾液酸糖肽对幽门螺杆菌的抑制作用
不同糖基化修饰的唾液酸糖肽对幽门螺杆菌生长的抑制作用参考文献[35]并有所改动。在无菌的96孔板每孔加入100 μL准备好的菌悬液,再加入100 μL添加有样品和未加样品的布氏肉汤培养基,其中未添加样品的培养基组为空白对照,每个样品设置3个重复。将96孔板置于37 ℃、微需氧、160 r/min条件下培养72 h。培养结束后,用酶标仪在600 nm处测得各孔的OD值,抑菌率按公式(2)计算:
抑菌率![]()
(2)
1.3.7 唾液酸糖肽抑制AIV的研究
由于AIV识别受体结构与MAL-Ⅱ识别唾液酸聚糖结构类似,因此以MAL-Ⅱ为AIV的模拟物,研究不同糖基化修饰的唾液酸糖肽对AIV的抑制作用。具体方法参考文献[36],MDCK细胞在MEM完全培养液中,在37 ℃下、5%(体积分数)CO2培养箱培养。待MDCK细胞培养至融合度为80%时,消化、离心、重悬,将其密度调整至104个/mL,接种至共聚焦培养皿,待细胞融合度至60%~70%时,用PBS洗涤,加入1 mL 0.04 g/mL的多聚甲醛固定,在室温下加入含有0.05g/mL的BSA的PBS封闭细胞1 h。将花青素系列染料琥珀酰亚胺酯(cyanine 5 succinimidyl esters, Cy5-NHS)标记的MAL-Ⅱ和不同浓度的样品加入培养皿中,在4 ℃下避光振荡孵育过夜。然后加入4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole, DAPI)染色液对MDCK细胞染色,用激光共聚焦显微镜在DAPI和Cy5通道下拍照,用Image J软件分析荧光强度。
1.3.8 老人肠道菌群体外发酵
1.3.8.1 体外模拟消化
唾液酸糖肽的体外模拟消化方法参考文献[37],取E1、Desia-E1和CGMP冻干粉各1 g进行体外模拟唾液、胃液和肠液消化,最终消化液中终质量浓度为10 mg/mL。根据单一变量原则,将Neu5Ac、3′-SL以10 mg/mL的质量浓度溶解在空白消化液中,即为Neu5Ac和3′-SL消化液样品。
1.3.8.2 志愿者粪便收集和处理
粪便捐赠志愿者需要满足2个月没有服用过益生元、抗生素等可能会影响肠道微生物菌群的生物制剂,没有胃肠道以及慢性基础病,年龄在60周岁以上。使用无菌粪便收集管收集6名健康老人捐赠者的粪便样本,将收集到的粪便样本立即保存在放置有厌氧产气袋的冰盒中,在6 h以内采用匀浆法处理粪便[38]。
1.3.8.3 体外厌氧发酵
老人肠道菌群体外发酵的方法参考文献[39]。将E1、Desia-E1和CGMP消化液以5 mg/mL的终质量浓度添加到基础培养基,将Neu5Ac和3′-SL消化液同样以5 mg/mL的终质量浓度添加到基础培养基,将空白消化液添加到基础营养培养基作为空白对照(Blank),未经发酵的初始肠道菌群组作为Initial。每组样本设置3个平行,粪便匀浆液接种量为10%(体积分数),置于37 ℃厌氧培养箱中培养24 h。
1.3.8.4 有机酸含量分析
取1 mL粪菌体外厌氧发酵上清液,依次加入10 μL内标(100 mmol/L 2-甲基丁酸)、250 μL盐酸和1 mL无水乙醚,充分混合均匀,收集上层透明有机层,用无水硫酸钠脱水,用0.22 μm滤膜过滤。采用气相色谱系统检测滤液中短链脂肪酸(short-chain fatty acids,SCFAs)含量。用生物传感分析仪检测乳酸含量。
1.3.8.5 肠道微生物16S rRNA测序分析
从发酵液中提取样本基因组DNA,采用带有barcode的特异引物341F和806R扩增16S rRNA的V3和V4区。使用DNA文库制备试剂盒构建测序文库。使用ABI StepOnePlus 实时定量PCR系统(Life Technologies,USA)进行文库质量检测,最后上机测序得到有效数据,即扩增子序列变体(amplicon sequence variant, ASV)序列和ASV丰度信息,基于此进行后续的结果分析。
1.3.9 燕窝唾液酸糖肽的N-糖链谱图
采用DNA测序仪的荧光糖电泳技术(DNA sequencer-assisted fluorophore-assisted carbohydrate electrophoresis, DSA-FACE)可以实现无创、快速的对N-糖链结构的高通量检测分析[40]。本研究通过DSA-FACE技术对EBN水解物中的N-糖链结构进行分析。
1.4 统计分析
每个样品均设置3个重复,使用Origin(2021)软件进行绘图分析,使用IBM SPSS Statistics 26软件以Waller-Duncan检验进行显著性分析。采用单因素方差分析,以P<0.05为差异具有统计学意义,并用a、b等字母表示。实验数据以“平均值±标准差”表示。
2 结果与分析
2.1 燕窝唾液酸糖肽的制备及表征
EBN糖肽常用蛋白酶水解来制备,但降解往往不彻底[41]。通过预实验发现可以通过两阶段蛋白酶降解处理获得EBN糖肽。如图1-a所示,单一蛋白酶处理时,不同的酶对燕窝的降解效果有显著差异,采用胃蛋白酶、胰蛋白酶、胰酶降解EBN可以获得较多水溶性蛋白;采用链霉蛋白酶和胰蛋白酶组合处理EBN时,水溶性蛋白含量最高,为65.20%。因此,选择链霉蛋白酶+胰蛋白酶组合进行第一阶段酶解,水解产物为E1。通过公式(1)计算出第一阶段酶解率为90.25%。E1的唾液酸含量为11.57%,总糖含量为16.57%。燕窝的产地、品种等都会影响其化学组成含量。研究表明燕窝中蛋白质质量分数为59.8%~66.9%,唾液酸质量分数为10%左右,E1中的化学成分与文献报道一致[42]。
通过高效凝胶排阻色谱测定E1中的糖蛋白分子质量分布,结果如图1-c、图1-d所示,E1分子质量小于10 kDa的糖肽含量较少,约为20%。为了获得更多低分子质量的糖肽,对E1进行第二阶段酶解。如图1-c所示,E1经碱性蛋白酶处理后,低分子质量的糖肽含量更高。由图1-d分子质量组成可看出,碱性蛋白酶处理组中分子质量小于10 kDa的糖肽占比最高,为64.25%。因此,选择碱性蛋白酶对E1进行第二阶段酶解,获得EBN糖肽为E2。通过10 kDa的超滤离心管对E2进行超滤离心,分离其中分子质量小于10 kDa糖肽部分,为E2-LW,剩余部分为E2-HW。通过高碘酸钠氧化法,破坏E1、E2中的唾液酸,获得去唾液酸样品Desia-E1、Desia-E2。如图1-b所示,高碘酸钠几乎完全破坏了唾液酸。
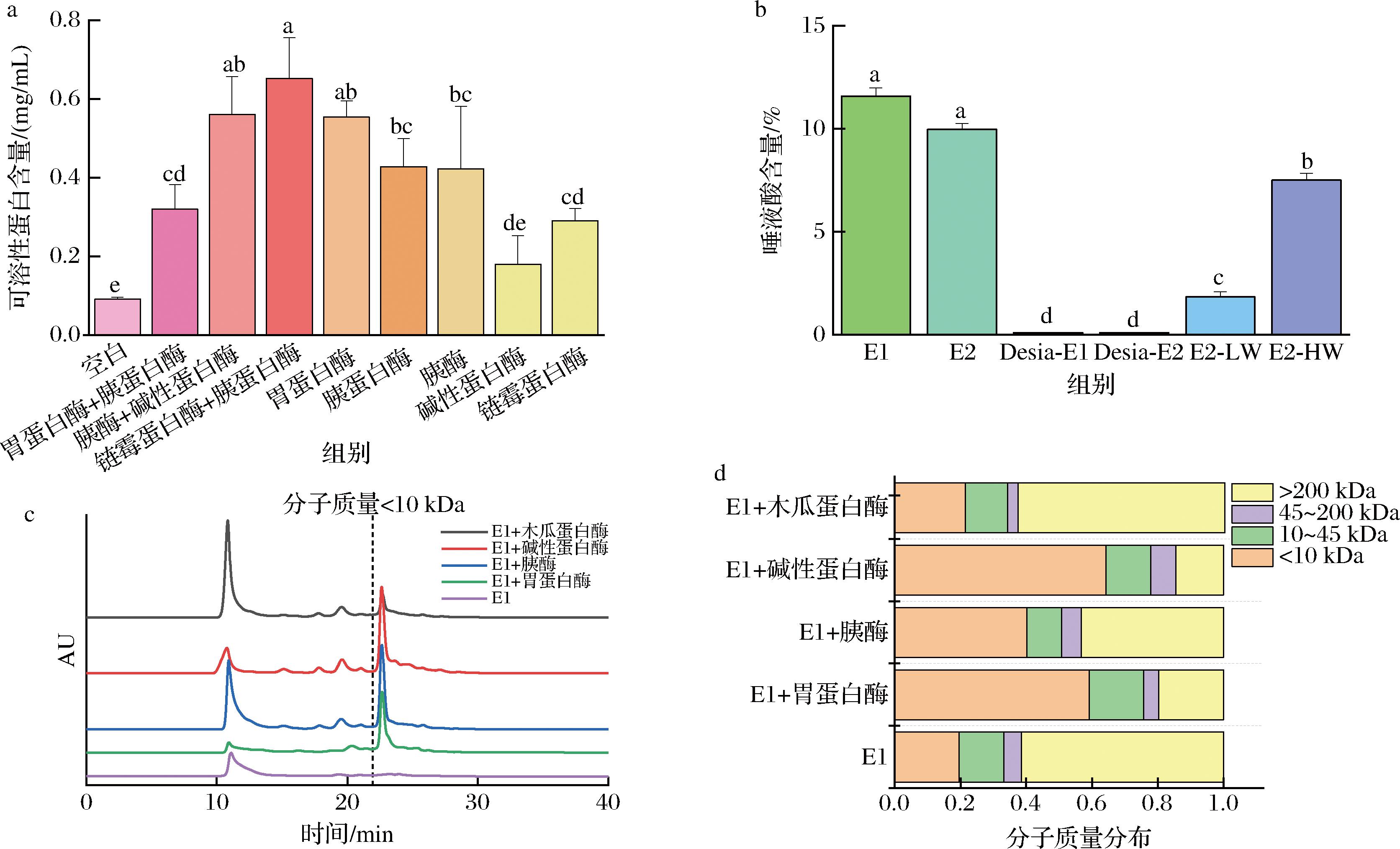
a-可溶性蛋白含量;b-唾液酸含量;c-分子质量分布;d-分子质量组成
图1 不同蛋白酶对燕窝水解的影响
Fig.1 Effect of different proteinases on the hydrolysis of EBN
注:不同小写字母表示组间存在显著性差异,显著性分析用Waller-Duncan检验(P<0.05,n=3)(下同)。
2.2 燕窝唾液酸糖肽的N-糖基化分析
EBN的主要成分是Muc5AC黏蛋白,其中含有唾液酸化的O-聚糖和N-聚糖。如图2-a所示,通过DSA-FACE技术鉴定EBN糖蛋白的N-糖谱,以血浆糖蛋白中的N-聚糖为标准品,并通过软件分析得到电泳峰图。EBN糖蛋白的N-糖链谱图中出现的可鉴别的糖峰有10种,部分已知的糖链结构已在图2-b中标出。其中有3个糖峰不同于血浆糖链图谱,经推测,5号糖峰可能为A2BG2S1,6号位置糖峰可能为FA2BG2S1或FA2G2S1,7号可能为A2G1。
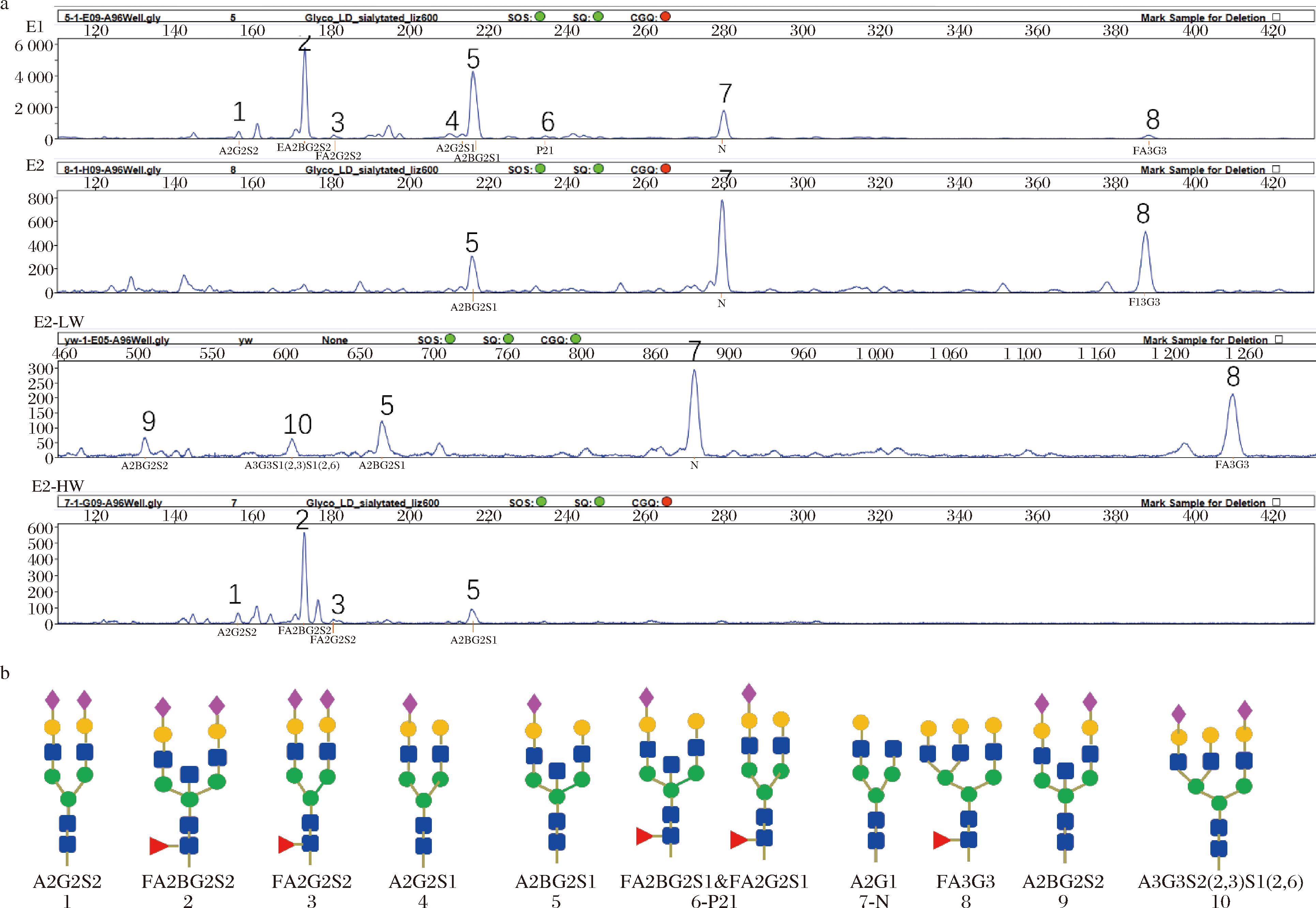
a-N-聚糖图谱;b-糖链结构
图2 EBN水解物的N-聚糖图谱及糖链结构
Fig.2 N-glycan profiles of EBN hydrolysates and the structures of the N-glycans
EBN的糖蛋白中出现的10种糖峰中,大部分带有唾液酸结构,部分带有岩藻糖基化结构。在E1和E2-HW的糖峰中,峰值最高的为2号FA2BG2S2,E2和E2-LW中峰值最高的为7号A2G1。值得注意的是,E1中带有唾液酸结构的N-糖链峰含量较高,而E2中靠近后面的7、8号糖峰含量较高。
2.3 唾液酸糖肽对白色念珠菌及幽门螺杆菌的抑制作用
唾液酸聚糖可以通过与病原菌表面的受体结合从而抑制病原菌,本研究比较了EBN糖肽和CGMP对白色念珠菌生长的影响,结果如图3-a、图3-b所示。在相同浓度条件下,E2-LW组对白色念珠菌抑制作用最显著,而当EBN水解物末端唾液酸去除后(Desia-E1组、Desia-E2组),其抑制作用被显著削弱(P<0.05)。此外,在一定浓度范围内,EBN糖肽E2对白色念珠菌的生长有浓度依赖性的抑制作用,并且不同浓度的E2对白色念珠菌都有显著抑制作用(P<0.05)。
进一步探究EBN糖肽和CGMP对幽门螺杆菌的抑制作用,结果如图3-c、图3-d所示。可以看出,不同浓度的燕窝糖肽均对幽门螺杆菌的生长呈浓度依赖性递增的抑制作用,且E2抑制作用最显著(P<0.05)。在相同浓度下,E2-LW的抑制作用最强,当EBN水解物去除唾液酸后,其对幽门螺杆菌的抑制作用几乎消失。
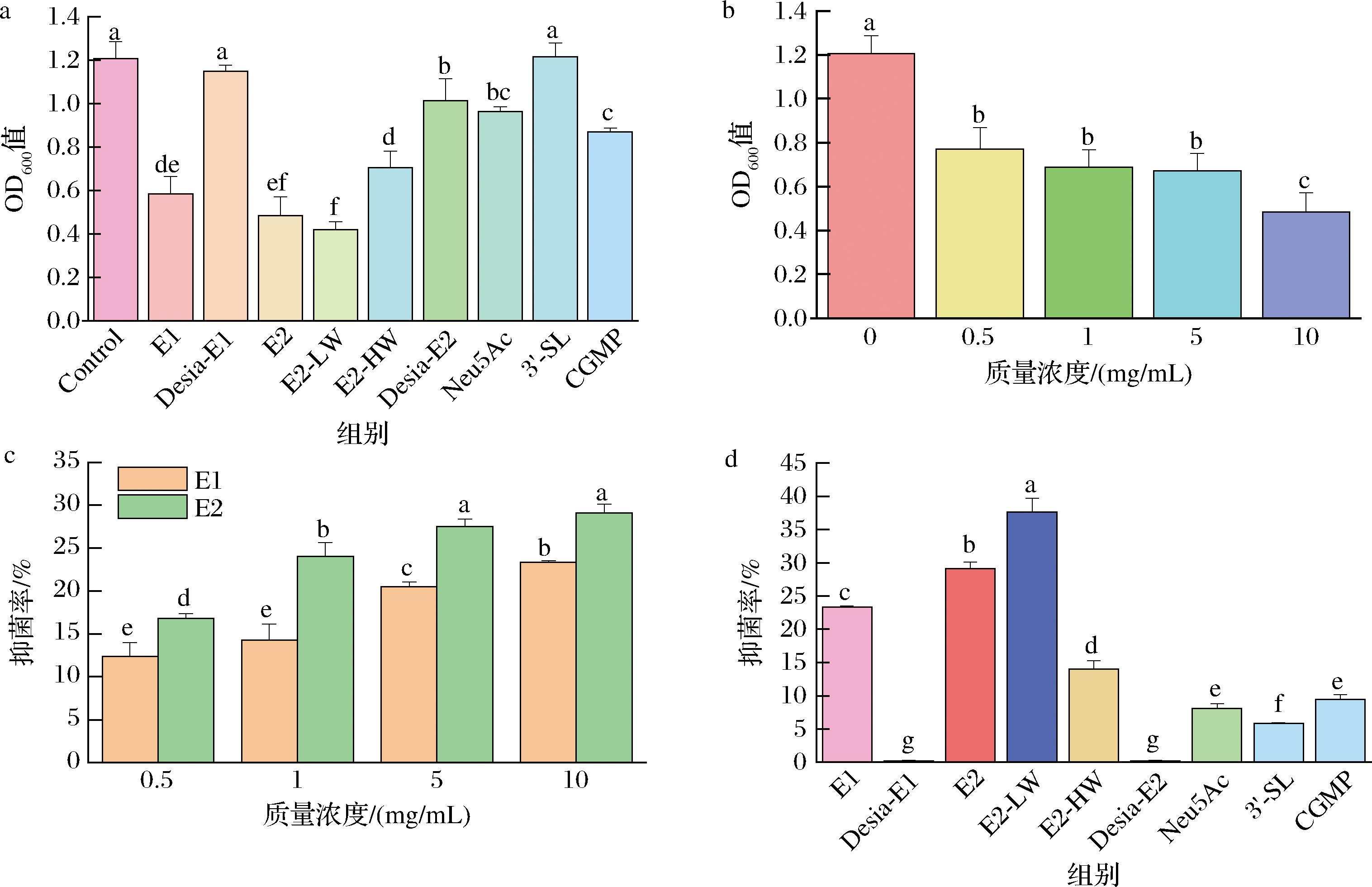
a-唾液酸糖肽对白色念珠菌的抑制作用;b-E2对白色念珠菌的抑制作用;c-E1和E2对幽门螺杆菌的抑制作用;d-唾液酸糖肽对幽门螺杆菌的抑制作用
图3 不同糖基化修饰的唾液酸糖肽对白色念珠菌及幽门螺杆菌的抑制作用
Fig.3 Inhibition of Candida albicans and Helicobacter pylori by sialoglycopeptides with different glycosylation modifications
可见,在一定浓度范围内,EBN糖肽对白色念珠菌和幽门螺杆菌有显著抑制作用,其末端唾液酸起决定性作用。然而,同样含有唾液酸的Neu5Ac、3′-SL和CGMP对二者的抑制作用明显减弱,说明EBN唾液酸糖肽带有唾液酸结构的N-糖链对其功能具有重要作用。
2.4 唾液酸糖肽抑制AIV的研究
唾液酸可以充当AIV感染宿主的受体,在AIV入侵机体方面起重要作用[19]。由于AIV识别受体结构与MAL-Ⅱ识别聚糖结构类似,因此,本研究以MAL-Ⅱ作为AIV的模拟物,比较EBN糖肽和CGMP对AIV的抵抗力,结果如图4所示。当不加样品时(Control组),MAL-Ⅱ可以明显与MDCK细胞结合。当加入0.5 mg/mL EBN糖肽时,MAL-Ⅱ与MDCK细胞的结合被显著抑制,E2抑制作用没有E1显著,当末端的唾液酸去除以后,抑制作用显著减弱。由图4-f可知,在相同浓度条件下,E1对MAL-Ⅱ与MDCK细胞结合的抑制作用最显著(P<0.05),而来源于牛奶的CGMP抑制效率与E2接近。以上结果说明,相较于其他唾液酸聚糖,来源于燕窝的糖肽E1对MAL-Ⅱ与MDCK细胞结合抑制作用最强,其中唾液酸修饰的N-聚糖结构起关键作用。

a~c-唾液酸糖肽作用下Cy5荧光标记的MAL-Ⅱ与MDCK细胞的结合;d~f-唾液酸糖肽作用下MAL-Ⅱ与MDCK细胞结合的相对荧光强度
图4 不同糖基化修饰的唾液酸糖肽对MAL-Ⅱ结合MDCK细胞的抑制作用
Fig.4 Inhibition of MAL-Ⅱ binding to MDCK cells by sialoglycopeptides with different glycosylation modifications
注:E1-1、E1-2、E1-3、E1-4分别为0.5、1、5、10 mg/mL的EBN唾液酸糖肽E1;E2-1、E2-2、E2-3、E2-4分别为0.5、1、5、10 mg/mL的EBN唾液酸糖肽E2。
2.5 唾液酸糖肽对老人肠道菌群的调节作用
2.5.1 有机酸含量分析
SCFAs,如乙酸、丙酸、丁酸等,在维持人体健康方面具有重要作用,粪便中的SCFAs浓度与结肠SCFAs状态以及肠道菌群组成密切相关[43]。EBN糖肽和CGMP对老年人粪便体外厌氧发酵产有机酸的影响如图5所示,乙酸产量是最高的。无论是乳酸还是SCFAs,E1组产量均高于空白组和其他唾液酸聚糖组。由图5-a可知,当E1末端唾液酸去除后与空白组并无显著差异,说明唾液酸对于糖蛋白促进肠道微生物发酵和乳酸生成有重要作用。值得注意的是,同样是带有唾液酸但聚糖结构为O-糖基化的CGMP组,乳酸产量显著低于E1组(P<0.05),小分子结构的3′-SL和Neu5Ac并未表现良好的乳酸促进作用。由图5-b和图5-c可知,CGMP同样能促进乙酸和丁酸的产生,但效果不如EBN糖肽E1。异戊酸在此次发酵中产量较低,但与其他组相比,E1组仍表现出良好的促进作用(图5-d)。以上结果说明,不同唾液酸化和不同糖基化结构对老年人肠道菌群产生有机酸的影响不同,相较于O-糖基化的CGMP和小分子的3′-SL以及唾液酸单体Neu5Ac,具有完整唾液酸化N-聚糖结构的E1更有利于促进有机酸产生。
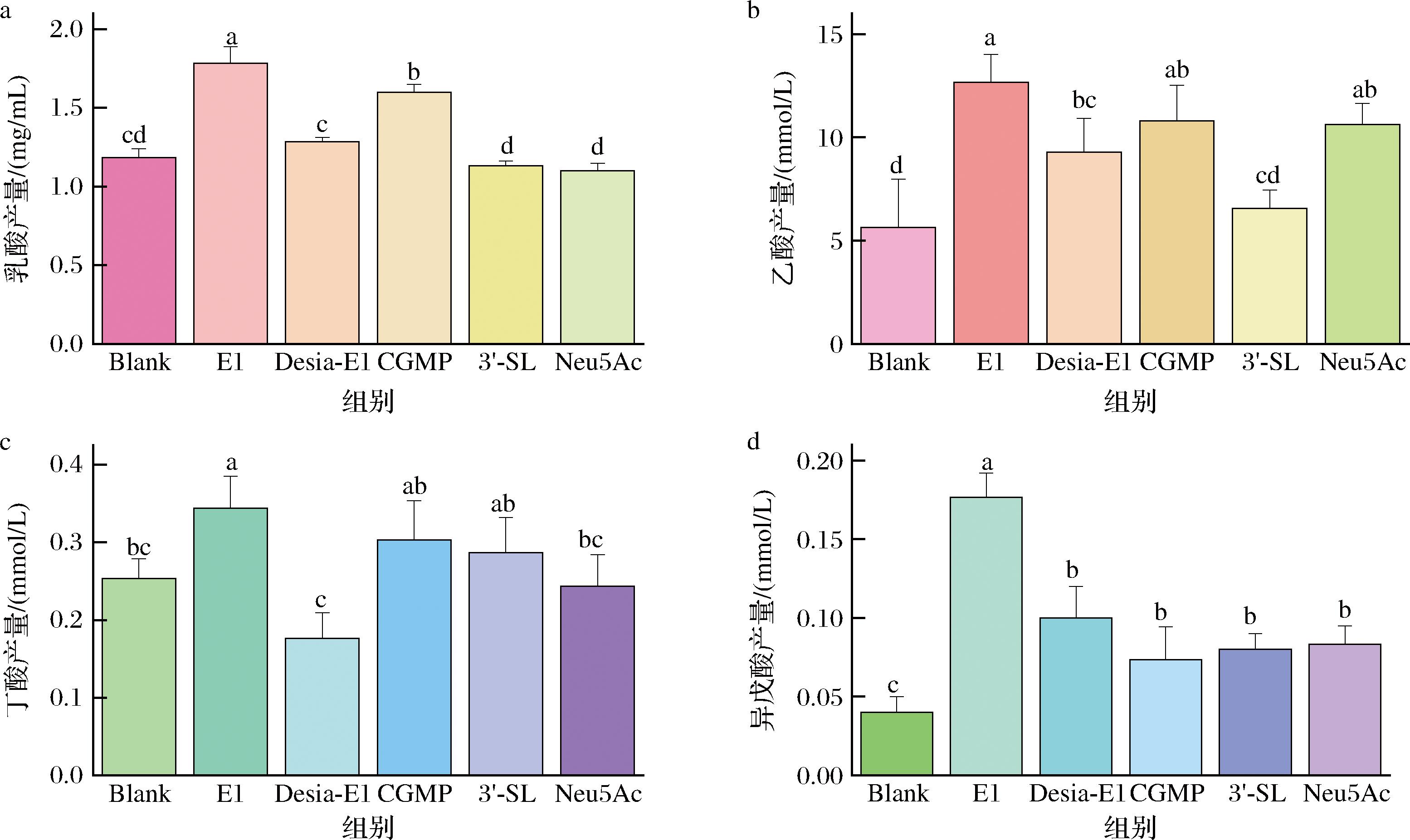
a-乳酸;b-乙酸;c-丁酸;d-异戊酸
图5 老年人粪菌体外发酵24 h的有机酸产量
Fig.5 Accumulation of organic acids after 24 h of in vitro fermentation of fecal samples from elderly individuals
2.5.2 肠道菌群物种丰度分析
肠道菌群通常指人类胃肠道多种微生物群落,影响着人类健康和疾病产生。唾液酸及其衍生物在人类胃肠道分配及可获得性可以调节胃肠道微生物和宿主对炎症和感染的易感性,影响胃肠道菌群组成和丰度以及病原体的定植[21]。本研究通过体外发酵结合16S rRNA高通量测序比较了EBN糖肽和CGMP对老年人肠道菌群的调节作用,结果如图6所示。
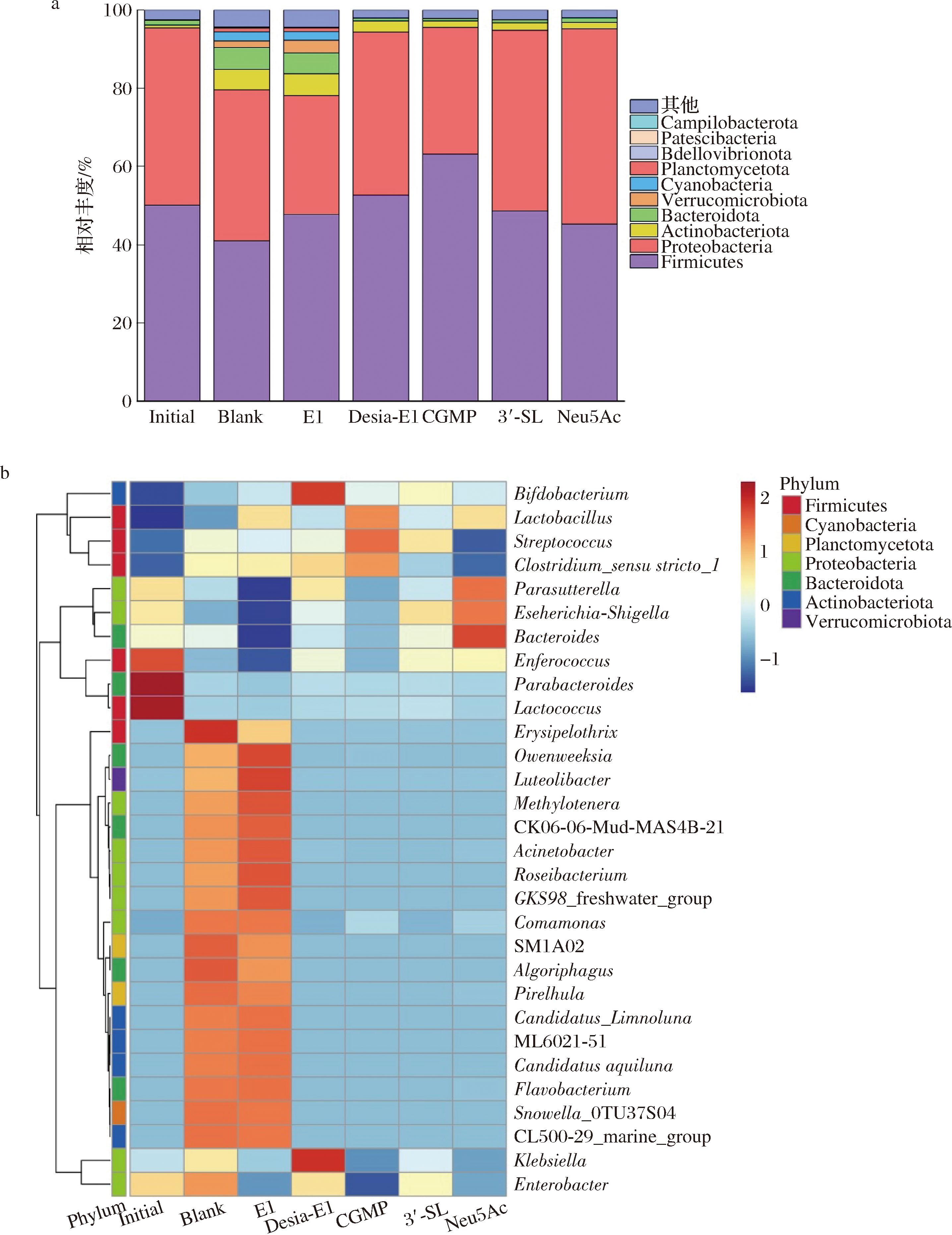
a-门水平相对丰度堆叠图(top10);b-属水平相对丰度热图(top30)
图6 老年人粪菌体外发酵24 h的肠道菌群组成
Fig.6 The composition of the gut microbiota after 24 h of in vitro fecal fermentation from elderly individuals
注:Phylum表示门水平类。
在门水平上,与空白组相比,各组均增加了厚壁菌门(Firmicutes)的相对丰度,E1和CGMP组降低了变形菌门(Proteobacteria)的相对丰度,Desia-E1、3′-SL和Neu5Ac则表现出相反趋势。此外,E1组还增加了放线菌门(Actinobacteria)的丰度,放线菌门是许多具有生物活性的天然产物生产者,可用于产生抗癌药物、免疫抑制剂、抗病毒药物等,是临床药物的重要来源[44]。在属水平上,与空白组相比,E1组能显著增加甲基营养菌(Methylotenera)、玫瑰杆菌(Roseibacterium)等相对丰度,同时也增加了乳酸杆菌(Lactobacillus)的相对丰度,显著降低了有害菌大肠杆菌-志贺氏菌(Escherichia-Shigella)和克雷伯氏菌(Klebsiella)的相对丰度。甲基营养菌能利用一碳甲基化合物作为碳源和能源进行生长,是一种新型益生菌[45]。玫瑰杆菌能分泌次生代谢物抑制病原菌,同样具有益生效果[46]。大肠杆菌-志贺氏菌和克雷伯氏菌是已被报道的有害菌,具有促炎和致病性,在酒精肝硬化患者中丰度显著增加[47]。然而去唾液酸化的Desia-E1同样富集到常见益生菌双歧杆菌,但是也显著增加了克雷伯氏菌丰度。Neu5Ac组增加了如大肠杆菌-志贺氏菌等有害菌丰度。以上结果说明游离Neu5Ac水平升高可能导致肠道微生态失调,同时加剧炎症和感染的风险[48]。而结合态的Neu5Ac表现出优良的益生特性,E1和CGMP中带有唾液酸结构的N-聚糖和O-聚糖可能更有助于增加益生菌的丰度,降低有害菌丰度。
2.5.3 α-多样性分析
α-多样性又称单样品复杂性,可以反映微生物群落的丰富度和多样性的显著性差异(P<0.05)。本研究选择反映微生物菌种丰富度的ACE(abundance-based coverage estimator)指数和反映微生物多样性的Shannon指数来探究不同糖基化修饰的唾液酸糖肽对老年人肠道微生物菌群的影响,结果如图7所示。老年人粪菌体外发酵24 h后,E1组肠道菌群物种丰富度和多样性较初始菌群都显著增加(P<0.05),而去唾液酸的Desia-E1组与初始菌群的丰富度和多样性接近,说明保持完整唾液酸结构的糖肽E1维持老年人肠道菌群丰富度和多样性能力最好。而Neu5Ac组菌群多样性较初始菌群组有所下降。
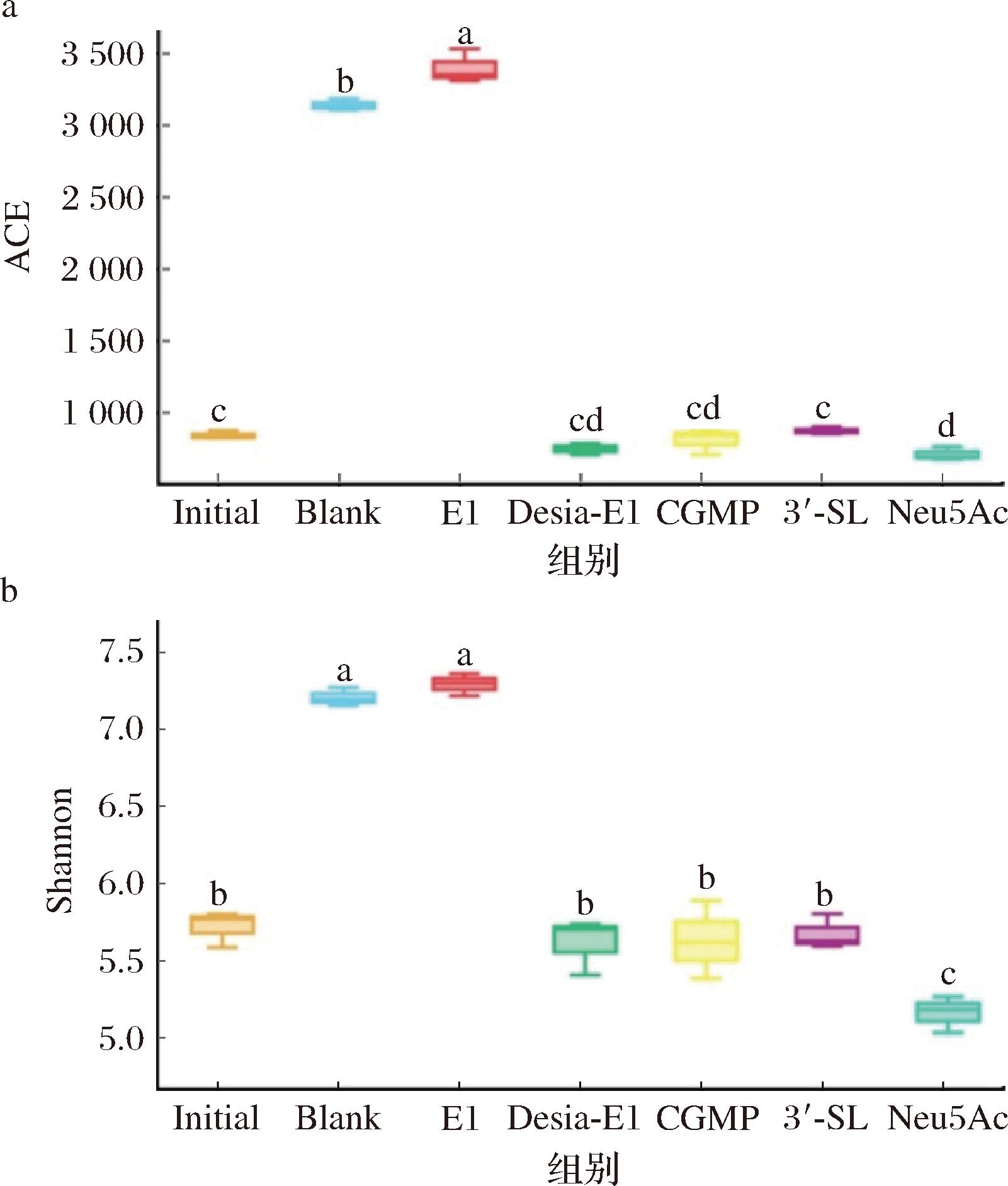
a-ACE指数;b-Shannon指数
图7 老年人粪菌体外发酵24 h肠道菌群的α-多样性分析
Fig.7 Alpha diversity analysis of intestinal microbiota after 24 h of in vitro fecal fermentation from elderly individuals
2.5.4 肠道菌群线性判别分析(linear discriminant analysis effect size,LEfSe)
LEfSe是对不同种群间丰富度差异较大的物种的分析。图8-a显示了不同组间存在显著性差异的物种菌群(LDA值>4),图8-b显示了差异物种的进化分支图。E1组显示出了较高丰度的放线菌门(Actinobacteria),放线菌门在维持肠道稳态中起着关键作用[49]。CGMP组虽然富集到了乳酸杆菌(Lactobacillus),同时也富集到了有害菌梭菌属(Clostridia)。唾液酸单体Neu5Ac富集到了有害菌大肠杆菌-志贺氏菌。

a-LDA值分布直方图;b-进化分支图
图8 老人粪菌体外发酵24 h肠道菌群的LEfSe分析
Fig.8 LEfSe analysis of the gut microbiota after 24 h of in vitro fecal fermentation from elderly individuals
3 讨论
AIV含有初级糖蛋白抗原,即血凝素和神经氨酸酶。早期研究表明AIV利用唾液酸通过α-2,3-糖苷键与半乳糖结合作为细胞受体[50]。本研究表明,EBN水解物对AIV具有较强的抑制作用,较高分子质量的E1比E2效果更好。然而,当唾液酸被去除后,其对病毒的抑制活性显著降低。基于N-聚糖谱推测含有更多唾液化N-聚糖的E1在抑制AIV方面可能更有效。另外,E2对AIV的抑制能力与CGMP糖肽相似,CGMP含有5个O-糖基化位点,其中约1~3 个聚糖具有唾液酸末端[8]。可能由于E2是由3种蛋白酶处理EBN获得,分子质量更小,导致其唾液化的O-聚糖暴露增加,这可能掩盖唾液化的N-聚糖所致。此外,文献表明3′-SL对13种AIV具有有效的抗病毒活性[51]。本研究发现,3′-SL对AIV模拟物同样具有抑制作用,尽管其抑制效果不是最佳。以上结果表明EBN糖肽在抑制AIV方面具有更大的潜力,可能与其自身唾液酸化结构有关。然而,EBN水解物的抗流感活性尚未与达菲和扎那米韦等已建立的抗流感疗法进行比较。因此,未来有必要进一步深入研究。
唾液聚糖能够与病原菌表面的特异性受体结合,从而产生抑制作用。CGMP是具有O-聚糖修饰的唾液酸糖肽,能抑制细菌和病毒的黏附[8]。本研究发现,相较于CGMP,EBN水解产物对白色念珠菌和幽门螺杆菌具有显著的抑制活性。其中E2-LW抑制作用最强,EBN糖肽的低分子质量可能会暴露更多的O-聚糖,使它们更容易拉伸并与病原体表面的受体结合。肠道菌群是肠道微生态的核心组成,参与合成必需营养素和碳水化合物代谢等重要过程,是连接饮食和宿主健康的重要中间体[52]。EBN中富含多糖和低聚糖,可被肠道微生物代谢产生短链脂肪酸和神经递质等重要代谢物,改善宿主健康[53]。在之前的研究中已证实了鸡蛋中的卵黏蛋白可以提高老年人肠道菌群的多样性[32]。本研究中EBN同样可以增加老年人肠道菌群的丰富度和多样性,增加有益菌丰度,降低有害菌群。其中,N-聚糖结构发挥了重要作用。
目前,关于EBN的N-糖基化结构分析的报道有限。早期研究发现,EBN主要由具有3天线和4天线结构的N-聚糖链组成[54]。本研究中图2的8号糖峰3天线结构可能是由于前处理过程末端唾液酸丢失;另外,本研究首次在EBN鉴定出大量复杂、平分型GlcNAc结构的唾液酸化N-糖链(2号糖峰)。岩藻糖基化的N-聚糖对病原微生物有抑制作用,当岩藻糖去除以后,N-聚糖的抗致病菌活性显著下降[55]。唾液酸化的N-聚糖被证明不仅能够预防AIV引起的血细胞凝集[56],而且还能抑制致病性大肠杆菌对上皮细胞的黏附[57]。本研究从EBN糖肽中鉴定出10个不同的聚糖峰,其中,8种具有唾液酸化修饰,4种具有岩藻糖基化修饰,3种同时具有唾液酸化和岩藻糖基化修饰。在E1中,唾液酸化修饰的N-聚糖含量更高,而E2-LW中,岩藻糖基化修饰的N-聚糖含量更高。
4 结论
本研究主要比较了EBN糖肽和CGMP两种唾液酸糖肽的生物活性,并以唾液酸单体和寡糖3’-唾液酸乳糖作为对照。相较于CGMP,EBN来源的唾液酸糖肽显示了较好的抗病原菌和抗禽流感病毒的能力,且唾液酸化结构起重要作用,其中唾液酸糖肽E2-LW 对这2种病原菌表现出更强的抑制作用,E1对禽流感病毒表现出更强的抑制作用。在调节肠道菌群方面,E1具有显著增加老人肠道菌群在体外发酵过程中产有机酸的能力,能够显著促进肠道菌群物种丰富度和多样性,提高有益菌如乳酸杆菌等的相对丰度,降低了有害菌如大肠杆菌-志贺氏菌等的相对丰度。与O-糖基化的CGMP相比,含有N-糖基化和O-糖基化的EBN糖肽能更有效抑制病原微生物,对老人肠道菌群的调节作用更强。这些发现有助于更好地理解糖蛋白/糖肽的糖基化结构与生物功能之间关系。
[1] LING A J W, CHANG L S, BABJI A S, et al.Review of sialic acid’s biochemistry, sources, extraction and functions with special reference to edible bird’s nest[J].Food Chemistry, 2022, 367:130755.
[2] YEW M Y, KOH R Y, CHYE S M, et al.Neurotrophic properties and the de novo peptide sequencing of edible bird’s nest extracts[J].Food Bioscience, 2019, 32:100466.
[3] WU J R, LU P H, ZHANG H T, et al.Comparison of prebiotic activity of dietary sialoglycoprotein and N-acetylneuraminic acid:Sialylation is a key factor[J].Food Bioscience, 2023, 56:103397.
[4] WANG J, PATEL P, MINEROFF J, et al.The potential cutaneous benefits of edible bird’s nest[J].Archives of Dermatological Research, 2024, 316(3):91.
[5] ZHANG T T, WU J R, ZHAN X B.Dietary sialic acids:Distribution, structure, and functions[J].Critical Reviews in Food Science and Nutrition, 2024, 64(24):8609-8632.
[6] YAN T H, MOHD NOOR H S, RAMACHANDRAN R, et al.Recovery of glycopeptides by enzymatic hydrolysis of edible bird’s nest:The physicochemical characteristics and protein profile[J].Journal of Food Measurement and Characterization, 2020, 14(5):2635-2645.
[7] YAN T H, LIM S J, BABJI A S, et al.Enzymatic hydrolysis:Sialylated mucin (SiaMuc) glycoprotein of edible swiftlet’s nest (ESN) and its molecular weight distribution as bioactive ESN SiaMuc-glycopeptide hydrolysate[J].International Journal of Biological Macromolecules, 2021, 175:422-431.
[8] LU Y, LIU J, LI Z H, et al.Comparative mass spectrometry analysis and immunomodulatory effects of casein glycomacropeptide O-glycans in bovine and caprine whey powder[J].Journal of Agricultural and Food Chemistry, 2022, 70(28):8746-8754.
[9] YOU Y Y, CAO Y, GUO S, et al.Purification and identification of α 2-3 linked sialoglycoprotein and α 2-6 linked sialoglycoprotein in edible bird’s nest[J].European Food Research and Technology, 2015, 240(2):389-397.
[10] ![]() T, HECK A J R, REIDING K R.Meta-heterogeneity:Evaluating and describing the diversity in glycosylation between sites on the same glycoprotein[J].Molecular &Cellular Proteomics, 2021, 20:100010.
T, HECK A J R, REIDING K R.Meta-heterogeneity:Evaluating and describing the diversity in glycosylation between sites on the same glycoprotein[J].Molecular &Cellular Proteomics, 2021, 20:100010.
[11] ZHANG L B, LI Y H, LI R Y, et al.Glycoprotein in vitro N-glycan processing using enzymes expressed in E.coli[J].Molecules, 2023, 28(6):2753.
[12] DELOBEL A. Glycosylation of Therapeutic Proteins: A Critical Quality Attribute. Mass Spectrometry of Glycoproteins. New York, NY: Springer US, 2021:1-21.
[13] UNAL K I, CHANG L S, WAN MUSTAPHA W A, et al.Extraction, structural analysis and biological activities of edible bird’s nest sialylated mucin (SiaMuc) glycoproteins:A review[J].Food Bioscience, 2024, 61:104791.
[14] RAMAGE G, SAVILLE S P, THOMAS D P, et al.Candida Biofilms:An update[J].Eukaryotic Cell, 2005, 4(4):633-638.
[15] TAKAGI J, AOKI K, TURNER B S, et al.Mucin O-glycans are natural inhibitors of Candida albicans pathogenicity[J].Nature Chemical Biology, 2022, 18(7):762-773.
[16] CHANG C S, LIU J F, LIN H J, et al.Synthesis and bioevaluation of novel 3,4,5-trimethoxybenzylbenzimidazole derivatives that inhibit Helicobacter pylori-induced pathogenesis in human gastric epithelial cells[J].European Journal of Medicinal Chemistry, 2012, 48:244-254.
[17] LINDÉN S K, WICKSTRÖM C, LINDELL G, et al.Four modes of adhesion are used during Helicobacter pylori binding to human mucins in the oral and gastric niches[J].Helicobacter, 2008, 13(2):81-93.
[18] YANG J C, YANG H C, SHUN C T, et al.Catechins and sialic acid attenuate Helicobacter pylori-triggered epithelial caspase-1 activity and eradicate Helicobacter pylori infection[J].Evidence-Based Complementary and Alternative Medicine, 2013, 2013:248585.
[19] SPACKMAN E. A Brief Introduction to Avian Influenza Virus. Animal Influenza Virus. New York, NY: Springer New York, 2014:61-68.
[20] HAGHANI A, MEHRBOD P, SAFI N, et al.Edible bird’s nest modulate intracellular molecular pathways of influenza a virus infected cells[J].BMC Complementary and Alternative Medicine, 2017, 17(1):22.
[21] BELL A, SEVERI E, OWEN C D, et al.Biochemical and structural basis of sialic acid utilization by gut microbes[J].Journal of Biological Chemistry, 2023, 299(3):102989.
[22] YU H J, JING C, XIAO N, et al.Structural difference analysis of adult’s intestinal flora basing on the 16S rDNA gene sequencing technology[J].European Review for Medical and Pharmacological Sciences, 2020, 24(24):12983-12992.
[23] YU D, ZHU L, GAO M J, et al.A comparative study of the effects of whole cereals and refined cereals on intestinal microbiota[J].Foods, 2023, 12(15):2847.
[24] GUO C T, TAKAHASHI T, BUKAWA W, et al.Edible bird’s nest extract inhibits influenza virus infection[J].Antiviral Research, 2006, 70(3):140-146.
[25] GHASSEM M, ARIHARA K, MOHAMMADI S, et al.Identification of two novel antioxidant peptides from edible bird’s nest (Aerodramus fuciphagus) protein hydrolysates[J].Food &Function, 2017, 8(5):2046-2052.
[26] KHUSHAIRAY E S I, AYUB M K, BABJI A S.Effect of enzymatic hydrolysis of pancreatin and alcalase enzyme on some properties of edible bird’s nest hydrolysate[C].AIP Conference Proceedings, 2014, 1614(1):427-432.
[27] ODA M, OHTA S, SUGA T, et al.Study on food components:The structure of N-linked asialo carbohydrate from the edible bird’s nest built by Collocalia fuciphaga[J].Journal of Agricultural and Food Chemistry, 1998, 46(8):3047-3053.
[28] NG C H, TANG P L, ONG Y Y.Enzymatic hydrolysis improves digestibility of edible bird’s nest (EBN):Combined effect of pretreatment and enzyme[J].Journal of Food Measurement and Characterization, 2023, 17(1):549-563.
[29] KIM D S, HOSMILLO M, ALFAJARO M M, et al.Both alpha 2,3-and alpha 2,6-linked sialic acids on O-linked glycoproteins act as functional receptors for porcine Sapovirus[J].PLoS Pathogens, 2014, 10(6):e1004172.
[30] MART N M J, V
N M J, V ZQUEZ E, RUEDA R.Application of a sensitive fluorometric HPLC assay to determine the sialic acid content of infant formulas[J].Analytical and Bioanalytical Chemistry, 2007, 387(8):2943-2949.
ZQUEZ E, RUEDA R.Application of a sensitive fluorometric HPLC assay to determine the sialic acid content of infant formulas[J].Analytical and Bioanalytical Chemistry, 2007, 387(8):2943-2949.
[31] YAN T H, MUN S L, LEE J L, et al.Bioactive sialylated-mucin (SiaMuc) glycopeptide produced from enzymatic hydrolysis of edible swiftlet’s nest (ESN):Degree of hydrolysis, nutritional bioavailability, and physicochemical characteristics[J].International Journal of Food Properties, 2022, 25(1):252-277.
[32] FANG S, WU J R, NIU W X, et al.Sialylation of dietary mucin modulate its digestibility and the gut microbiota of elderly individuals[J].Food Research International, 2024, 184:114246.
[33] WANG K, LUO Q W, HONG H, et al.Novel antioxidant and ACE inhibitory peptide identified from Arthrospira platensis protein and stability against thermal/pH treatments and simulated gastrointestinal digestion[J].Food Research International, 2021, 139:109908.
[34] KIM Y G, LEE J H, PARK S, et al.Hydroquinones including tetrachlorohydroquinone inhibit Candida albicans biofilm formation by repressing hyphae-related genes[J].Microbiology Spectrum, 2022, 10(5):e02536-22.
[35] WANG J X, YANG R J, XIAO Z C, et al.Dihydrochalcones in Malus inhibit bacterial growth by reducing cell membrane integrity[J].Food &Function, 2020, 11(7):6517-6527.
[36] WANG X L, YUE L X, DANG L Y, et al.Role of sialylated glycans on bovine lactoferrin against influenza virus[J].Glycoconjugate Journal, 2021, 38(6):689-696.
[37] BRODKORB A, EGGER L, ALMINGER M, et al.INFOGEST static in vitro simulation of gastrointestinal food digestion[J].Nature Protocols, 2019, 14(4):991-1014.
[38] AGUIRRE M, ECK A, KOENEN M E, et al.Evaluation of an optimal preparation of human standardized fecal inocula for in vitro fermentation studies[J].Journal of Microbiological Methods, 2015, 117:78-84.
[39] XU J J, LIU W B, WU J R, et al.Metabolic profiles of oligosaccharides derived from four microbial polysaccharides by faecal inocula from type 2 diabetes patients[J].International Journal of Food Sciences and Nutrition, 2021, 72(8):1083-1094.
[40] LAROY W, CONTRERAS R, CALLEWAERT N.Glycome mapping on DNA sequencing equipment[J].Nature Protocols, 2006, 1(1):397-405.
[41] NAJAFIAN L, BABJI A S.A review of fish-derived antioxidant and antimicrobial peptides:Their production, assessment, and applications[J].Peptides, 2012, 33(1):178-185.
[42] DAUD N, MOHAMAD YUSOP S, BABJI A S, et al.Edible bird’s nest:Physicochemical properties, production, and application of bioactive extracts and glycopeptides[J].Food Reviews International, 2021, 37(2):177-196.
[43] YAMAMURA R, NAKAMURA K, KITADA N, et al.Associations of gut microbiota, dietary intake, and serum short-chain fatty acids with fecal short-chain fatty acids[J].Bioscience of Microbiota, Food and Health, 2020, 39(1):11-17.
[44] VAN BERGEIJK D A, TERLOUW B R, MEDEMA M H, et al.Ecology and genomics of Actinobacteria:New concepts for natural product discovery[J].Nature Reviews Microbiology, 2020, 18(10):546-558.
[45] KWAK M J, JEONG H, MADHAIYAN M, et al.Genome information of Methylobacterium oryzae, a plant-probiotic methylotroph in the phyllosphere[J].PLoS One, 2014, 9(9):e106704.
[46] HOU Q C, ZHAO F Y, LIU W J, et al.Probiotic-directed modulation of gut microbiota is basal microbiome dependent[J].Gut Microbes, 2020, 12(1):1736974.
[47] BALTAZAR-D AZ T A, GONZ
AZ T A, GONZ LEZ-HERN
LEZ-HERN NDEZ L A, ALDANA-LEDESMA J M, et al.Escherichia/Shigella, SCFAs, and metabolic pathways:The triad that orchestrates intestinal dysbiosis in patients with decompensated alcoholic cirrhosis from western Mexico[J].Microorganisms, 2022, 10(6):1231.
NDEZ L A, ALDANA-LEDESMA J M, et al.Escherichia/Shigella, SCFAs, and metabolic pathways:The triad that orchestrates intestinal dysbiosis in patients with decompensated alcoholic cirrhosis from western Mexico[J].Microorganisms, 2022, 10(6):1231.
[48] LIANG Q C, MA C X, CROWLEY S M, et al.Sialic acid plays a pivotal role in licensing Citrobacter rodentium’s transition from the intestinal lumen to a mucosal adherent niche[J].Proceedings of the National Academy of Sciences of the United States of America, 2023, 120(28):e2301115120.
[49] BINDA C, LOPETUSO L R, RIZZATTI G, et al.Actinobacteria:A relevant minority for the maintenance of gut homeostasis[J].Digestive and Liver Disease, 2018, 50(5):421-428.
[50] OLOFSSON S, KUMLIN U, DIMOCK K, et al.Avian influenza and sialic acid receptors:More than meets the eye?[J].The Lancet Infectious Diseases, 2005, 5(3):184-188.
[51] PANDEY R P, KIM D H, WOO J, et al.Broad-spectrum neutralization of avian influenza viruses by sialylated human milk oligosaccharides:In vivo assessment of 3’-sialyllactose against H9N2 in chickens[J].Scientific Reports, 2018, 8:2563.
[52] ZHOU B L, YUAN Y T, ZHANG S S, et al.Intestinal flora and disease mutually shape the regional immune system in the intestinal tract[J].Frontiers in Immunology, 2020, 11:575.
[53] JANA U K, SURYAWANSHI R K, PRAJAPATI B P, et al.Prebiotic mannooligosaccharides:Synthesis, characterization and bioactive properties[J].Food Chemistry, 2021, 342:128328.
[54] YAGI H, YASUKAWA N, YU S Y, et al.The expression of sialylated high-antennary N-glycans in edible bird’s nest[J].Carbohydrate Research, 2008, 343(8):1373-1377.
[55] WANG W L, WANG W, DU Y M, et al.Comparison of anti-pathogenic activities of the human and bovine milk N-glycome:Fucosylation is a key factor[J].Food Chemistry, 2017, 235:167-174.
[56] KAWASAKI Y, ISODA H, SHINMOTO H, et al.Inhibition by κ-casein glycomacropeptide and lactoferrin of influenza virus hemagglutination[J].Bioscience, Biotechnology, and Biochemistry, 1993, 57(7):1214-1215.
[57] MU C L, CAI Z P, BIAN G R, et al.New insights into porcine milk N-glycome and the potential relation with offspring gut microbiome[J].Journal of Proteome Research, 2019, 18(3):1114-1124.