2001年,联合国粮农组织(Food and Agriculture Organization, FAO)和世界卫生组织(World Health Organization, WHO)将益生菌定义为:当摄取足够数量时,对宿主健康产生有益作用的活的微生物[1]。2020年,中国食品科学技术学会发布了《益生菌的科学共识(2020年版)》[2],进一步明确了益生菌的3个核心特征,即:足够数量、活菌状态及有益健康功能。肠道是人体重要的消化器官和免疫器官,是益生菌发挥作用的主要场所,大量科学研究表明,益生菌对宿主的健康作用与摄入量有关[3-6]。因此,探讨益生菌的摄入量与肠道健康之间的关系,对于发挥益生菌健康功效至关重要。
许多临床研究显示,益生菌对多种疾病具有治疗效果,然而部分临床研究失败的原因可能是益生菌到达肠道的活菌数不足[7]。因此,口服摄入的益生菌数量不等于到达肠道的益生菌数量。为了最大程度地提高益生菌的体内存活率,研究者不断改进益生菌包埋技术和递送技术[8-11],然而现有技术仍然无法有效保证足够数量的益生菌通过严苛的消化道环境[12-13]。
晶球是一种独特的益生菌包埋技术,能够最大程度地保护益生菌不受胃酸、胆盐和消化酶等的侵蚀,直达肠道发挥作用[14]。晶球通常包含3层结构,外层为耐酸胶皮,可以有效抵御胃酸;中间保护层为植物油脂配方,形成固态硬壳,起到隔绝氧气与水的作用;核心层为惰性油脂与益生菌的混合物,更大程度保护益生菌活性。然而,晶球中间保护层存在分布不均匀的技术难点,导致晶球易漏油或成型效果差,影响核心层益生菌的稳定性。
为近一步改善晶球成型,本研究对中间保护层的配方进行优化,并通过建立综合评价指标来筛选最佳配方比例,确保晶球的完整性和益生菌的货架稳定性。同时,通过仿生胃肠道消化模型,探究萃益球®益生菌晶球与常规益生菌粉剂2种剂型的产品在消化过程中的活菌数变化,从而为晶球中益生菌的体内存活率及肠道定向释放提供科学证据。
1 材料与方法
1.1 材料与试剂
MRS琼脂培养基、半胱氨酸盐酸盐、莫匹罗星锂盐,青岛海博生物技术有限公司;胃蛋白酶、胰酶、胆盐,Sigma-Aldrich(上海)贸易有限公司;蛋白胨,北京鸿润宝顺科技有限公司;吐温-80、Na2HPO4·12H2O、75%乙醇、NaCl、NaHCO3、盐酸、KCl、KH2PO4、MgCl2、(NH4)2CO3、CaCl2·2H2O,国药集团化学试剂有限公司;果胶,嘉吉投资(中国)有限公司;明胶,罗赛洛广东明胶有限公司;甘油,中孚油脂(广州)集团有限公司;起酥油、代可可脂,益海嘉里金龙鱼食品集团股份有限公司。
萃益球®益生菌晶球和粉剂样品,由仙乐健康科技股份有限公司提供。2种产品中包含相同的菌株和比例(动物双歧杆菌乳亚种和鼠李糖乳酪杆菌的活菌数为1∶1),添加量均为1×109 CFU/g。
1.2 仪器与设备
DHSI-IV动态仿生人胃肠消化系统,晓东宜健(苏州)仪器设备有限公司;SPX-50B生化培养箱,上海坤天实验仪器有限公司;ZY-100F高压蒸汽灭菌锅,浙江新丰医疗器械有限公司;MS1602TS电子分析天平,梅特勒-托利多国际贸易(上海)有限公司;DHG-9070A鼓风干燥箱,上海精宏实验设备有限公司;Milli-Q Advantage A10超纯水机,Millipore(美国)公司;MS-H280-B500磁力搅拌器、MX-S涡旋振荡器、移液枪,大龙先创实验仪器(北京)股份公司;HH-2数显恒温水浴锅,上海力辰邦西仪器科技有限公司;BBS-SDS医用洁净工作台,济南鑫贝西生物技术有限公司;CPV-900光学显微镜,上海荼明光学仪器有限公司;胶丸机,烟台百药泰中药科技有限公司。
1.3 实验方法
1.3.1 晶球制备方法
a)胶皮溶液配制:先将明胶、果胶和甘油预混分散均匀,搅拌下加入到适量水中,在70 ℃下加热搅拌至胶体溶解;除去气泡即得胶皮溶液。胶皮配方质量比为:明胶∶果胶∶甘油∶水=160∶24∶24∶592。
b)中间保护层溶液配制:将起酥油与代可可脂在85 ℃下融化完全,搅拌均匀,除去气泡后得到中间保护层溶液;配方比例根据实验设计进行调整。
c)核心层溶液配制:将起酥油在85 ℃下融化完全,降温至45 ℃,加入益生菌粉,充分搅拌均匀,除去气泡即可得到核心层溶液。核心层配方质量比为:益生菌粉∶起酥油=1∶4。
d)滴制:使用胶丸机,选用3层滴头进行滴制,得到晶球颗粒。
e)干燥:采用转笼进行干燥,直至晶球胶皮水分低于10%。晶球直径约为2.5 mm。
1.3.2 晶球理化指标测定
中间保护层厚度均匀性:用光学显微镜,在4×10倍下进行观察,同时用LISSCAPTURE软件进行测量,记录中间层最薄处厚度与最厚处厚度,按公式(1)计算中间保护层厚度均匀性。
中间保护层厚度均匀性![]()
(1)
外观形变不合格率:随机取样1 000粒,观察出现明显非球形晶球,如长条、拉丝、不规则多边形等,记录为不合格品数,按公式(2)计算外观形变不合格率。
外观形变不合格率![]()
(2)
通常对于晶球的评价,以中间保护层厚度均匀性表征成型稳定性能;以外观形变率表征其收率或成品合格率。为了更好地评价晶球质量,按照表1所示权重和评分计算晶球综合评分指标。
表1 晶球综合评分指标
Table 1 Comprehensive scoring indicators for probiotic crystal balls

评价指标权重评分5分4分3分2分1分0分中间保护层厚度均匀性(Y)60%0.9
注:若晶球无法成型,则综合评分直接界定为0分。
同时,考虑到晶球承载的益生菌需要以活菌形式存在于产品中,因此需要考察益生菌存活率。产品加速稳定性:在(37±2) ℃,(75±5)%相对湿度(relative humidity,RH)下对产品进行加速,按照GB 4789.35—2023《食品安全国家标准 食品微生物学检验 乳酸菌检验》检测活菌数。按公式(3)计算存活率。每个样品平行测定3次。
存活率![]()
(3)
1.3.3 仿生消化试剂配制
1.3.3.1 MRS琼脂培养基
称取66.2 g MRS琼脂培养基于1 L去离子水中,完全溶解后121 ℃灭菌15 min,取出后往内径9 cm的培养皿中倒入约15 mL的MRS培养基,冷却凝固后待用。
1.3.3.2 半胱氨酸改良版MRS培养基
称取66.2 g MRS琼脂培养基于1 L去离子水中,溶解完全后121 ℃灭菌15 min,降温至48 ℃按商品操作说明加入半胱氨酸盐酸盐和莫匹罗星锂盐,混匀倒板,冷却凝固后待用。
1.3.3.3 样品稀释液
样品稀释液配方如下:蛋白胨10.0 g、NaCl 5.0 g、Na2HPO4·12H2O 9.0 g、KH2PO4 1.5 g、吐温-80 0.8 g,加去离子水定容至1 L。溶解完全后,置于121 ℃灭菌15 min,冷却后待用。
1.3.3.4 梯度稀释液
不加吐温-80,其余同1.3.3.3节。
1.3.3.5 模拟消化液
模拟消化液主要由电解质储备液、酶、CaCl2·2H2O和水组成。依据文献[15],模拟胃液、肠液中电解质的成分如表2所示。
表2 模拟胃液、模拟肠液中电解质的浓度
Table 2 The concentration of electrolytes in simulated gastric and intestinal fluid
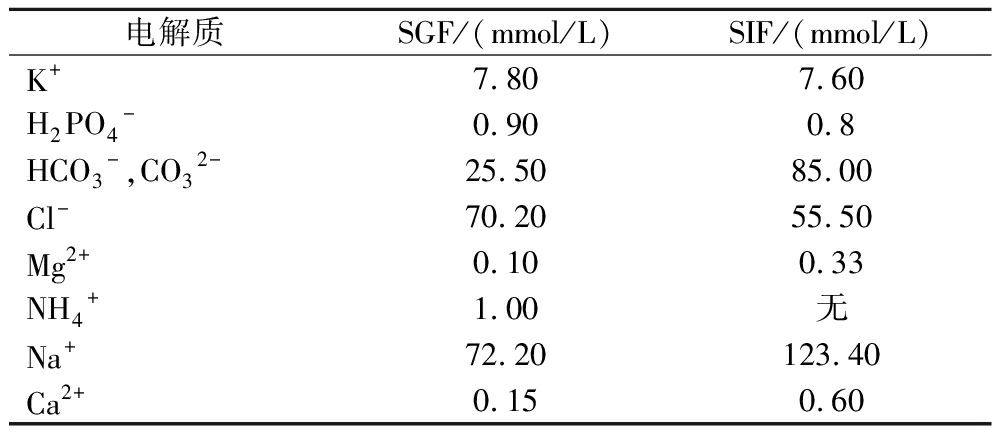
电解质SGF/(mmol/L) SIF/(mmol/L) K+7.80 7.60 H2PO4-0.90 0.8 HCO3-,CO32-25.50 85.00 Cl-70.20 55.50 Mg2+0.10 0.33 NH4+1.00 无 Na+72.20 123.40 Ca2+0.15 0.60
模拟胃液(simulated gastric fluid,SGF):胃液模拟液电解质溶液+CaCl2·2H2O+6 mol/L HCl+去离子水+胃蛋白酶(调节pH值至1.57±0.02,然后用0.22 μm的无菌滤膜过滤后,再加入胃蛋白酶。胃蛋白酶在模拟胃液中的最终浓度为4 000 U/mL)。
模拟肠液(simulated intestinal fluid,SIF):肠液模拟液电解质溶液+CaCl2·2H2O+6 mol/L HCl+去离子水+胰酶+胆盐(调节pH值至6.80±0.02,然后用0.22 μm的无菌滤膜过滤后,再加入胰酶和胆盐。胰酶在模拟肠液中的最终浓度为200 U/mL,胆盐最终浓度为20 mmol/L)。
1.3.4 动态体外胃肠消化
动态人胃肠体外消化设备(dynamic human stomach-intestine IV,DHSI-IV)主要包括仿生食管、胃、幽门、十二指肠、小肠等部分(图1),其工作原理及细节已由WANG等[16]详细描述。具体步骤如下:

图1 动态仿生人胃肠消化系统
Fig.1 Dynamic human stomach-intestine IV
a)正确安装胃肠模型和一次性针筒,并将当天配制的模拟消化液吸入针筒内与模型正确连接;
b)设置设备运行参数如表3所示,所有样品使用同样的运行参数;
表3 动态体外胃肠消化系统运行参数
Table 3 Operation parameters of dynamic human stomach-intestine system

控制指标运行参数系统温度37 ℃ 进样量100 g水+1 g样品进样方式一次性进样进样时间0.5 min 胃蠕动频率3 次/min 幽门开口大小8^13 mm 幽门开口频率即胃蠕动1次,幽门打开1次空腹胃液10 mL胃液分泌速率0.5 mL/min肠液分泌速度1 mL/min
c)进样:将1 g晶球或益生菌粉剂与100 mL无菌水混合后,从模拟食管一次性进入,即开始模拟动态胃肠消化;
d)取样(取样位置如图1所示):在消化30、60、90、120、150、180、210 min,分别从胃部及小肠末端取晶球或液体食糜,用于检测晶球内和消化道中的活菌数。
1.3.5 活菌检测
1.3.5.1 晶球活菌检测
无菌操作取出1粒晶球,记录晶球样品质量,置于无菌均质袋中,加入5 mL 45 ℃的样品稀释液,45 ℃水浴1 min,过程中将晶球轻轻捏碎至完全溶解,反复颠倒混匀。取100 μL样品溶液于900 μL无菌生理盐水中进行梯度稀释,按照GB 4789.34—2016《食品安全国家标准 食品微生物学检验 双歧杆菌检验》和GB 4789.35—2023《食品安全国家标准 食品微生物学检验 乳酸菌检验》,分别检测双歧杆菌和乳酸菌活菌数。
1.3.5.2 液体食糜活菌检测
每隔30 min从胃内、小肠末端收集器的消化食糜中分别取100 μL液体食糜(不含晶球),加入900 μL 45 ℃的样品稀释液,45 ℃水浴1 min,过程中反复颠倒混匀。检测方法同1.3.5.1节。
1.4 数据处理
益生菌活菌检测,每个样品平行检测3次,结果表示为“平均值±标准差”。采用GraphPad Prism 8.0.2软件对数据进行单因素方差分析,显著性水平设定为0.05。不同小写字母表示P<0.05。
2 结果与分析
2.1 益生菌晶球理化指标测试
晶球具有3层结构,分布均匀的固体油脂形态形成的中间保护层,能够减少局部保护层薄、容易破裂漏油及无法成型的问题,并改善产品中益生菌的稳定性。为保证晶球滴制成型的生产过程顺利进行,中间保护层需要具备以下特性:a)在滴制阶段初期具备良好的流动性;b)在滴制阶段中后期迅速冷却成型。起酥油与代可可脂满足在较高温度保持流动性,低温凝固成型的特点,因此选择这2款油脂进行试验。并且,特别针对中间保护层的配方比例进行研究,结果如表4所示。
表4 不同中间保护层配方与各项指标评分
Table 4 Different intermediate protective layer formulations and evaluation indicators

指标方案1方案2方案3方案4方案5方案6方案7方案8代可可脂/mg050180195210225280300起酥油/mg3002501201059075200中间保护层厚度均匀性评分02445540外观形变测定评分24555410综合评分0.82.84.44.454.62.80
结果显示,代可可脂和起酥油的比例对于晶球成型具有重要影响。比例过大或过小,都会影响内部结构,导致成型效果较差。当中间保护层厚度均匀性评分、外观形变评分较高时,即综合评分通常在4分及以上,此时晶球形态较好,产品各部位可以均匀受力,中间保护层对核心层包封完整,因而产品极少出现漏油现象。当中间保护层厚度均匀性、外观形变的任一评分低于3分时,制备的晶球出现漏油情况较多。当起酥油占比较高时,中间保护层冷却成型速度较慢。过慢的冷却成型速度,容易导致中间保护层在晶球下端沉积,导致下端厚上端薄,即分布不均匀。当代可可脂占比过高时,形成的脂肪颗粒结构更粗糙,由于滴制成型初期胶皮脆弱,粗糙的脂肪颗粒易使得胶皮发生形变,甚至破坏胶皮结构而形成破漏。为解决上述问题,代可可脂与起酥油需在一定比例范围内,才能形成厚度均匀,且外观完整的合格产品。实验结果显示,在210 mg代可可脂和90 mg起酥油的配比条件下,中间保护层厚度均匀,有助于形成紧密的固体油脂形态分布,以及规则的外观形态,综合评分最佳。
进一步考察了不同晶球产品中的益生菌存活率,结果如表5所示。中间保护层的固体油脂及晶球外观处于最佳形态时,产品稳定性最好。在加速3个月时,能够达到78.3%的益生菌存活率。因此按照方案5的配方,制备萃益球®益生菌晶球,用于动态体外胃肠消化实验研究。
表5 不同晶球产品在加速实验中的益生菌存活率 单位:%
Table 5 Probiotic survival rates of different seamless capsules in accelerated experiments
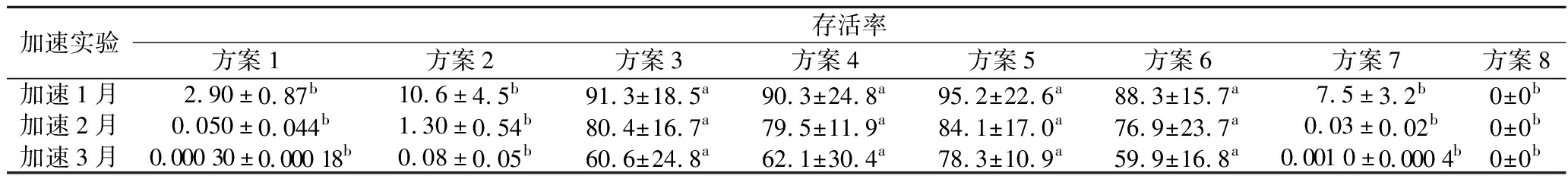
加速实验存活率方案1方案2方案3方案4方案5方案6方案7方案8加速1月2.90±0.87b10.6±4.5b91.3±18.5a90.3±24.8a95.2±22.6a88.3±15.7a7.5±3.2b0±0b加速2月0.050±0.044b1.30±0.54b80.4±16.7a79.5±11.9a84.1±17.0a76.9±23.7a0.03±0.02b0±0b加速3月0.000 30±0.000 18b0.08±0.05b60.6±24.8a62.1±30.4a78.3±10.9a59.9±16.8a0.001 0±0.000 4b0±0b
注:不同小写字母表示同一时间不同方案间差异显著(P<0.05)。
2.2 消化过程中pH变化
体外仿生消化系统是对人或动物的消化道及其消化环境、消化道内的流体动态行为等进行模拟的装置。与静态模拟消化相比,具有连续性、实时性、效率高、可视化等优点,能够更好地模拟和监测真实消化过程,准确性更高[17-18]。
本研究在消化过程中,对胃部pH进行实时监测,结果如图2所示。刚进样的瞬间,含水样品与空腹胃液混合后,pH值升至6.5左右。随着消化进行,胃内pH迅速降低,消化约2 min,胃内pH值已降至2~3,随后逐渐接近空腹胃液(pH 1.6),与常规静态模拟消化模型存在较大差距[19]。
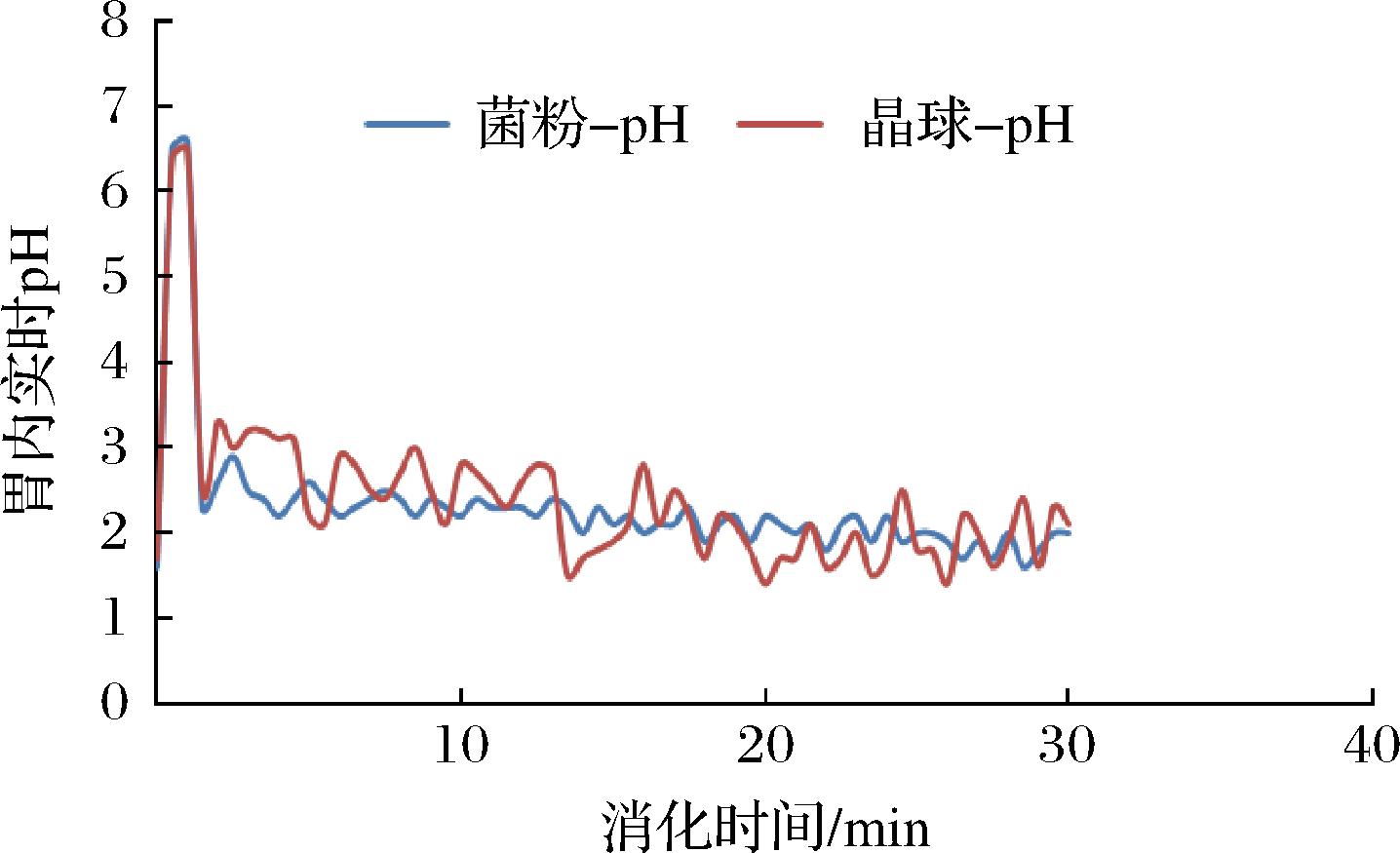
图2 消化过程中胃内实时pH变化
Fig.2 Changes of gastric pH during digestion
消化过程中,不同部位取出的晶球或益生菌粉剂食糜的pH随消化时间的变化如图3所示(G代表胃部采样,I代表肠道采样)。消化初始阶段取出的食糜,其pH与胃内实时监测数值接近。小肠末端取到的样品的pH值在8左右,符合人体小肠pH环境[20],说明模型准确性较高。
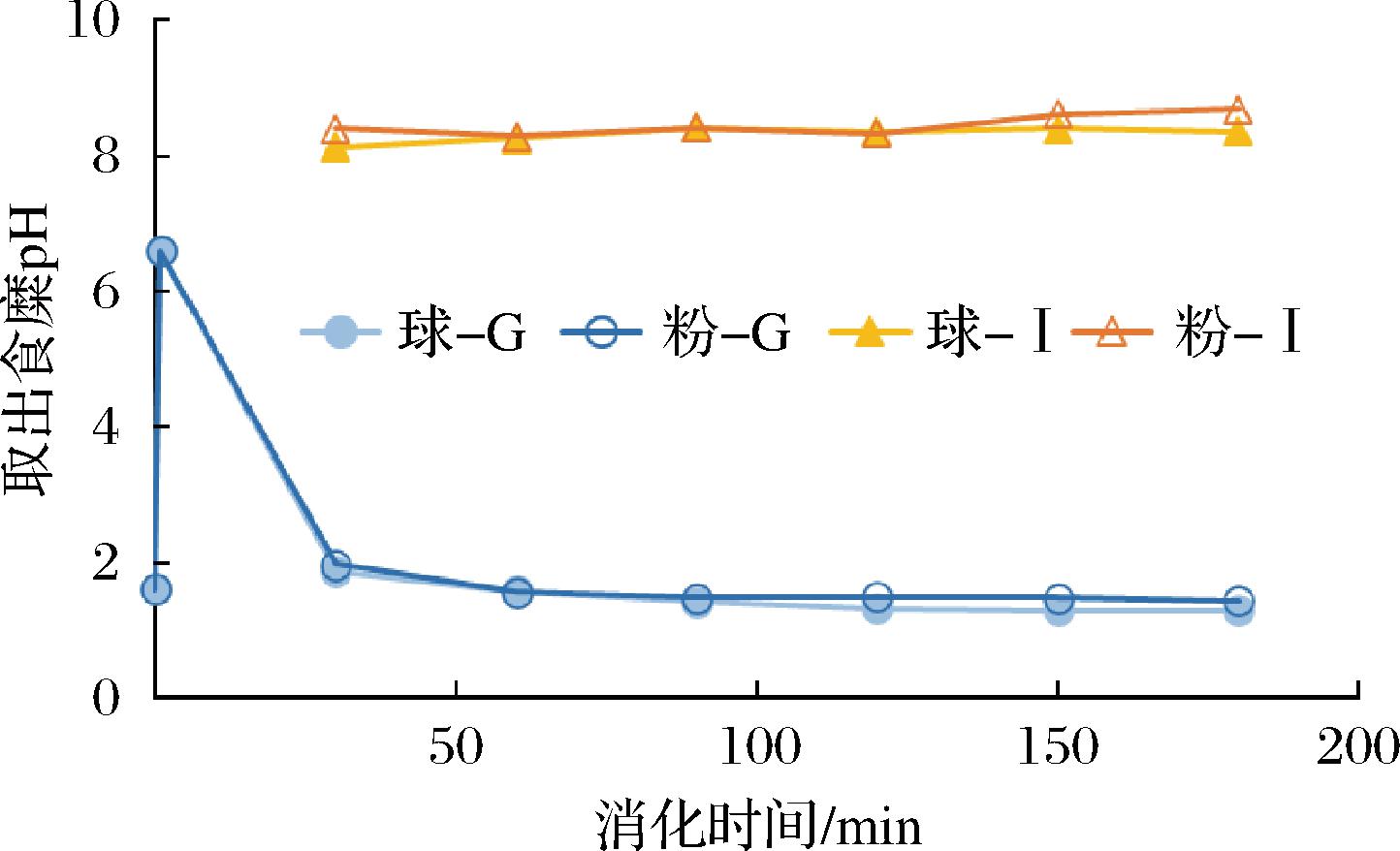
图3 消化过程中食糜pH的变化
Fig.3 Changes of pH of digestive juice during digestion
2.3 消化产物的表观形态
开发晶球剂型的目的是阻隔胃酸与益生菌接触,从而起到保护作用。因此,晶球的完整性是产品是否有效的重要指标。人体进食后,胃部排空时间一般从0.5~4 h不等,为了观察萃益球®晶球在消化过程中的形态变化,在不同的时间点通过摄像头实时观察并拍照记录,结果如图4所示。

图4 不同益生菌产品在动态仿生胃肠道消化过程中的表观形态
Fig.4 Morphology of different probiotic products in dynamic simulation of gastrointestinal digestion process
注:红色方框内晶球较为完整,黄色方框内晶球发生破裂。
根据实时观察,晶球在胃部始终保持完整形态。随着消化时间的延长,晶球颗粒逐渐从胃部排出,因而数量越来越少,90 min内完全排空。结合静态模拟消化实验,即使在pH 1.2、消化120 min后,晶球仍然保持完整形态,说明晶球结构的最外层的确起到耐酸保护作用。
从肠道取样可以看到,晶球最快在60 min内通过小肠。起初能够观察到较完整颗粒,随着消化时间延长,逐渐看到破碎的晶球,直至完全消失,说明晶球在小肠环境中逐渐溶解,释放出益生菌。
2.4 消化过程中活菌数与存活率
益生菌晶球与液体食糜在胃内和小肠末端收集器实测活菌数如表6所示。由于晶球具有较好的耐酸性,因此在胃内保持完整形态,晶球样品组在胃液中未检测到活菌。胃部消化1 h后,晶球内益生菌存活率为90.7%。随着消化进行,晶球在小肠内逐渐溶解并释放出活菌,所以在小肠末端监测到晶球中益生菌活菌数持续下降,而液体食糜中活菌数先升高再降低。
表6 益生菌晶球消化过程中活菌浓度变化 单位:CFU/mL
Table6 Changes of viable bacterial concentration of probiotic seamless capsules during digestion
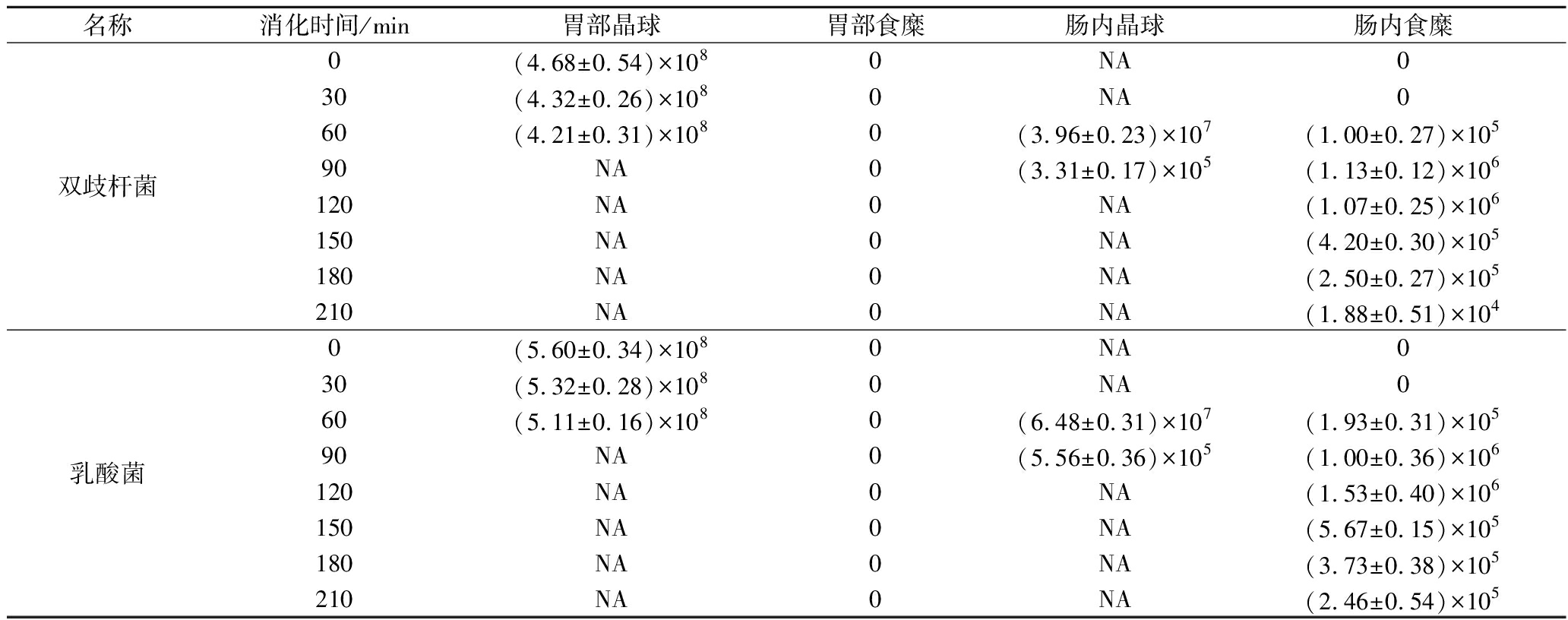
名称消化时间/min胃部晶球胃部食糜肠内晶球肠内食糜双歧杆菌0(4.68±0.54)×1080NA030 (4.32±0.26)×1080NA060(4.21±0.31)×1080(3.96±0.23)×107(1.00±0.27)×10590 NA0(3.31±0.17)×105(1.13±0.12)×106120 NA0NA(1.07±0.25)×106150NA0NA(4.20±0.30)×105180 NA0NA(2.50±0.27)×105210 NA0NA(1.88±0.51)×104乳酸菌0 (5.60±0.34)×1080NA030 (5.32±0.28)×1080NA060 (5.11±0.16)×1080(6.48±0.31)×107(1.93±0.31)×10590NA0(5.56±0.36)×105(1.00±0.36)×106120 NA0NA(1.53±0.40)×106150 NA0NA(5.67±0.15)×105180NA0NA(3.73±0.38)×105210NA0NA(2.46±0.54)×105
注:检测限为102 CFU/mL;NA代表缺失值(下同)。
益生菌粉剂在胃内和小肠末端收集器实测活菌数如表7所示。由于粉剂不存在包裹作用,进入消化道后迅速溶解,因此在胃内前60 min检测到活菌数,但浓度迅速下降,至90 min已完全检测不到活菌;并且在小肠末端食糜中都未检测到活菌的存在(低于检测限102 CFU/mL),说明粉剂中的益生菌无法在空腹情况下抵御胃酸、胆盐和消化酶的侵袭。
表7 益生菌粉剂消化过程中活菌浓度变化 单位:CFU/mL
Table7 Changes of viable bacterial concentration of probiotic powders during digestion
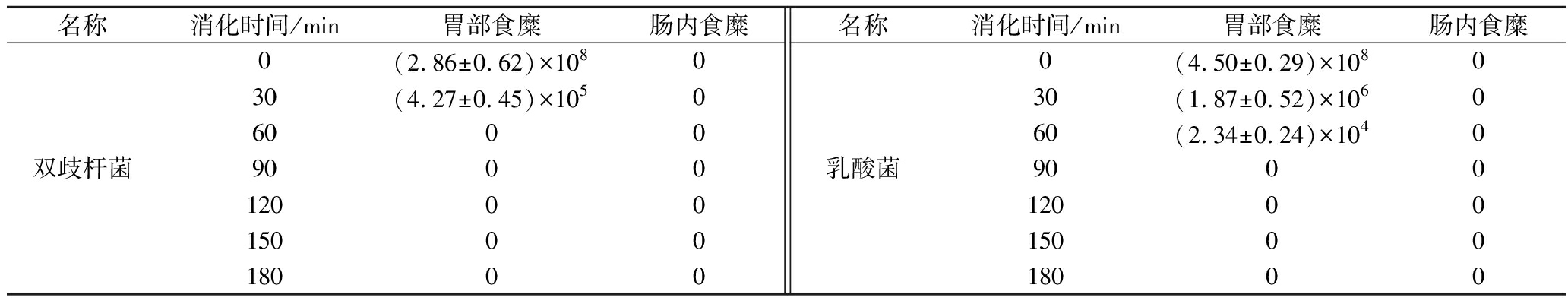
名称消化时间/min胃部食糜肠内食糜名称消化时间/min胃部食糜肠内食糜双歧杆菌0(2.86±0.62)×108030 (4.27±0.45)×105060 0090 0012000150 0018000乳酸菌0 (4.50±0.29)×108030(1.87±0.52)×106060(2.34±0.24)×10409000120001500018000
3 结论与讨论
“足够数量”是益生菌的三大核心特征之一,通常认为益生菌的摄入量是其发挥健康作用的关键因素[21]。但实际真正活着到达肠道的益生菌数量,才是发挥健康功效的保证。目前国际上,益生菌的推荐摄入量主要在108~1011 CFU/d[22-23],并且建议在餐后0.5 h内服用,此时胃部pH较高,益生菌存活率更高,然而人体大部分时间胃部pH值小于2,使得益生菌产品的服用效果大打折扣[24]。随着益生菌包埋及靶向递送技术的发展,晶球逐渐成为提高益生菌体内存活率的有效方法,然而是否具备完整的多层包埋结构,成为评判技术优劣的关键。本研究建立了晶球综合评价体系,通过优化油脂配方比例,开发了结构均匀、形态完整的萃益球®益生菌晶球,具备3层结构,最外层的胶皮具有耐酸性和肠溶性,能够保证其到达胃部环境时结构完整,减少胃酸和消化酶等与益生菌接触造成的损伤,大大提高益生菌的体内存活率,即使在模拟空腹情况下,仍能保留90%以上的胃部存活率,明显优于常规包埋的益生菌原料菌粉,确保更多的益生菌到达肠道,更好的发挥功效。经过油脂配方比例的优化,中间保护层具有较好的厚度均匀性,有效保障了晶球颗粒的外观形态完整。同时,晶球的多层包埋结构为核心层的益生菌提供了阻水隔氧等有效保护,确保货架期内的高存活率。
益生菌晶球在提高消化存活率、肠道靶向释放和货架期稳定性方面,已展现出独特的优势。未来,在以下3个方面需要进一步开展深入研究:a)在晶球制备工艺中,需要通过加热来融化油脂,这一过程对于益生菌有一定损伤,如何选择基质载体和优化配比是减少工艺损失的关键;b)目前的晶球颗粒无法应用于高水活环境,如何改进包埋技术,增强晶球的阻水能力,是拓展晶球应用范围的重要瓶颈;c)某些食品原料或功能性植提成分具有一定的抑菌作用[25],因而无法在产品中与益生菌长期共存。晶球可以有效地区隔益生菌和抑菌成分,因此筛选与益生菌晶球适配的功能性成分,在保证益生菌货架期稳定性的同时,到体内发挥协同增效作用,是发挥晶球剂型优势的重要体现。
[1] Food and Agriculture Organization of the United Nations, World Health Organization.Probiotics in food- Health and Nutritional Properties and Guidelines for Evaluation[M].Food and Agriculture Organization of the United Nations, 2006:1-3.
[2] 中国食品科学技术学会益生菌分会. 益生菌的科学共识(2020年版)[J].中国食品学报, 2020, 20(5):303-307.Probiotics Society of the Chinese Institute of Food Science and Technology.Scientific consensus of probiotics (2020)[J].Journal of Chinese Institute Food Science and Technology, 2020, 20(5):303-307.
[3] BERNI CANANI R, PAPARO L, NOCERINO R, et al.Gut microbiome as target for innovative strategies against food allergy[J].Frontiers in Immunology,2019, 10:191.
[4] TAO Y W, GU Y L, MAO X Q, et al.Effects of probiotics on type II diabetes mellitus:A meta-analysis[J].Journal of Translational Medicine, 2020, 18(1):30.
[5] OUWEHAND A C.A review of dose-responses of probiotics in human studies[J].Beneficial Microbes, 2017, 8(2):143-151.
[6] 李楠, 刘振民.益生菌与功能发酵乳开发研究进展[J].乳业科学与技术, 2020, 43(3):31-38.LI N, LIU Z M.Probiotics and development of functional yogurt:A review of recent progress[J].Journal of Dairy Science and Technology, 2020, 43(3):31-38.
[7] 中国食品科学技术学会益生菌分会.益生菌“量效关系”的科学综述[J].中国食品学报, 2022, 22(7):443-454.Probiotics Society of the Chinese Institute of Food Science and Technology.A scientific review of the ‘dose-response relationship’ of probiotics[J].Journal of Chinese Institute Food Science and Technology, 2022, 22(7):443-454.
[8] 朱荻, 陈莎男, 梅晓宏, 等.提高益生菌耐加工贮藏稳定性和体内存活率的递送系统研究进展[J].食品科学, 2023, 44(21):1-13.ZHU D, CHEN S N, MEI X H, et al.Advances in the delivery systems for improving the processing stability, storage stability and in vivo survival rate of probiotics[J].Food Science, 2023, 44(21):1-13.
[9] 刘艳凤, 乌日娜, 李默, 等.益生菌微胶囊包埋及靶向递送体系研究进展[J].中国食品学报, 2023, 23(5):400-410.LIU Y F, WU R N, LI M, et al.Research progress of probiotic microcapsule embedding and targeted delivery system[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(5):400-410.
[10] YAO M F, WU J, LI B, et al.Microencapsulation of Lactobacillus salivarious Li01 for enhanced storage viability and targeted delivery to gut microbiota[J].Food Hydrocolloids, 2017, 72:228-236.
[11] VENEMA K, VERHOEVEN J, VERBRUGGEN S, et al.Probiotic survival during a multi-layered tablet development as tested in a dynamic, computer-controlled in vitro model of the stomach and small intestine (TIM-1)[J].Letters in Applied Microbiology, 2019, 69(5):325-332.
[12] MILLETTE, NGUYEN, AMINE, et al.Gastrointestinal survival of bacteria in commercial probiotic products[J].International Journal of Probiotics &Prebiotics, 2013, 8(4):149-156.
[13] AFZAAL M, KHAN A U, SAEED F, et al.Survival and stability of free and encapsulated probiotic bacteria under simulated gastro intestinal conditions and in ice cream[J].Food Science &Nutrition, 2020, 8(3):1649-1656.
[14] 曹珺, 刘绒梅, 罗力文, 等.益生菌包埋晶球的体外耐受性及其应用特性研究[J].中国乳品工业, 2022, 50(6):22-27.CAO J, LIU R M, LUO L W, et al.Researching on the tolerance and application characteristics of probiotic-embedded crystal spheres in vitro[J].China Dairy Industry, 2022, 50(6):22-27.
[15] MINEKUS M, ALMINGER M, ALVITO P, et al.A standardised static in vitro digestion method suitable for food—an international consensus[J].Food &Function, 2014, 5(6):1113-1124.
[16] WANG J J, WU P, LIU M H, et al.An advanced near real dynamic in vitro human stomach system to study gastric digestion and emptying of beef stew and cooked rice[J].Food &Function, 2019, 10(5):2914-2925.
[17] WU P, CHEN X D.On designing biomimic in vitro human and animal digestion track models:Ideas, current and future devices[J].Current Opinion in Food Science, 2020, 35:10-19.
[18] 伍鹏, 王娟, 王晶晶, 等.基于仿生胃肠道模型的发酵乳中益生菌存活率评价[J].食品与发酵工业, 2021, 47(12):147-153.WU P, WANG J, WANG J J, et al.Evaluation of probiotics viability in fermented milk based on a biomimetic gastrointestinal model[J].Food and Fermentation Industries, 2021, 47(12):147-153.
[19] BRODKORB A, EGGER L, ALMINGER M, et al.INFOGEST static in vitro simulation of gastrointestinal food digestion[J].Nature Protocols, 2019, 14(4):991-1014.
[20] 王艳芝, 李中原, 刘丛巍, 等.国产无线动力胶囊对健康受试者全消化道动力评估试验[J].解放军医学院学报, 2015, 36(3):220-222;275.WANG Y Z, LI Z Y, LIU C W, et al.Investigation of whole gut transit with domestic wireless motility capsule in healthy subjects[J].Academic Journal of Chinese PLA Medical School, 2015, 36(3):220-222;275.
[21] MINELLI E B, BENINI A.Relationship between number of bacteria and their probiotic effects[J].Microbial Ecology in Health and Disease, 2008, 20(4):180-183.
[22] BINDA S, HILL C, JOHANSEN E, et al.Criteria to qualify microorganisms as “probiotic” in foods and dietary supplements[J].Frontiers in Microbiology, 2020, 11:1662.
[23] World Gastroenterology Organization.World Gastroenterology Organization Global Guidelines:Probiotics and prebiotics[EB/OL].(2017-02).[2024-09-24].https://www.worldgastroenterology.org/guidelines/global-guidelines/probiotics-and-prebiotics/probiotics-and-prebiotics.
[24] 中华预防医学会微生态学分会. 中国微生态调节剂临床应用专家共识(2020版)[J].中国微生态学杂志, 2020, 32(8):953-965.Chinese Society of Microecology, Chinese Preventive Medicine Association.Expert consensus on clinical application of microecological regulators in China (2020 edition)[J].Chinese Journal of Microecology, 2020, 32(8):953-965.
[25] FLACH J, VAN DER WAAL M B, VAN DEN NIEUWBOER M, et al.The underexposed role of food matrices in probiotic products:Reviewing the relationship between carrier matrices and product parameters[J].Critical Reviews in Food Science and Nutrition, 2018, 58(15):2570-2584.