结直肠癌(colorectal cancer,CRC)是最常见的恶性肿瘤之一,现已成为世界第三大恶性肿瘤,发病率和死亡率居高不下,且呈年轻化趋势,对人类健康构成巨大威胁[1]。据报道,CRC的发病机制复杂多样,包括环境和饮食因素、个人习惯、家族性和遗传性等[2]。而慢性炎症被公认为是多种癌症的重要危险因素,且肠道慢性炎症的程度与肠道肿瘤的发生呈正相关,对炎症相关性CRC的发展具有促进作用[3-4]。为探究CRC的病理机制,模拟人类CRC病理进程,开发了多种CRC实验动物模型,其中,氧化偶氮甲烷(azoxymethane,AOM)/硫酸葡聚糖钠(dextran sodium sulfate,DSS)模型是一种方法简单且可重复性高的CRC动物模型[5]。作为一种致癌物,AOM能够引发肿瘤的形成,而DSS则是一种类似肝素的多糖,可对结肠上皮细胞造成损伤,从而导致肠道炎症的发生[6]。AOM/DSS模型的主要特点在于其建模的高精度和短周期,肠道肿瘤的发展可以在短至10周内发生。此外,AOM/DSS 诱导的肿瘤组织病理学能对人类CRC的发生和发展过程进行高度模拟[7]。
CRC的病理生理机制复杂,其发展是一个多阶段的过程,而核因子κB(nuclear factor κB,NF-κB)信号通路在CRC的病理生理中发挥着关键作用,影响肿瘤的起始、进展和转移[8]。当前证据表明,NF-κB作为炎症和癌症的主要联系,其介导的转录在CRC的发生发展中起关键作用。NF-κB信号通路的激活推动了CRC中促炎性肿瘤微环境的建立,并调控细胞增殖、细胞凋亡、转移、血管生成、耐药性和炎症相关靶基因的表达[9]。同时,NF-κB被认为是一种主要的抗凋亡因子,不仅能够激活抗凋亡蛋白[如B细胞淋巴瘤2(B-cell lymphoma 2,Bcl-2)]和B细胞淋巴瘤超大蛋白(B-cell lymphoma-extra-large,Bcl-xL),也会使促凋亡蛋白(Bid、Bax、Bak)的表达失活,降低半胱天冬氨酸酶(caspases)的活性,进而抑制CRC肿瘤细胞凋亡[10]。
目前,CRC患者常用的治疗药物包括氟尿嘧啶、伊立替康、奥沙利铂和雷替曲塞,但它们通常伴随着一定的副作用[11]。由于CRC与炎症的密切关联,临床上的一种抗炎药——阿司匹林受到了高度关注,大量证据表明,阿司匹林对癌症,特别是CRC具有预防作用[12]。美国预防服务工作组也于2015年发布了关于在CRC一级预防中使用阿司匹林的建议草案[13],因此,阿司匹林也被选择作为干预炎症相关性CRC的药物。然而,临床研究发现,阿司匹林会引起一系列胃肠道副作用,尤其会导致上消化道的损伤,包括消化不良、消化性溃疡出血甚至死亡[14]。而相比于具有多种副作用的药物治疗,从饮食角度对CRC的发生发展进行干预成为了关注热点,其中,从发酵乳制品中分离筛选益生菌菌株来开发对CRC更有效果的功能性食品具有重要意义。
研究显示,益生菌可以维持宿主肠道健康,从一定程度上减缓消化道癌症的发生[15]。我国新疆聚居着众多的少数民族,依赖于其独特的地理、环境、气候条件,多样的畜牧养殖业、丰富的原奶为牧民手工加工各种乳制品提供了充足的原料,特别是新疆地区生活着世代游牧的民族群体,保留着自制酸乳的习惯,手工酸乳具有鲜明的地域特色和独特的风味[16]。这些发酵乳制品中含有丰富的乳酸菌,作为益生菌菌株的天然来源,具有巨大的研究和应用价值。植物乳植杆菌作为乳酸菌的一大类别,广泛存在于发酵乳制品、肉类及蔬菜中,同时其作为人体胃肠道内的益生菌群,对人体健康具有极大的促进作用[17]。作为一类可食用菌种,植物乳植杆菌对机体和正常细胞提供了一定程度的保护作用,同时,在干预CRC方面也显示出巨大潜力[18]。据研究报道,植物乳植杆菌通过减少促炎细胞因子干扰素-γ(interferon-γ,IFN-γ)、TNF-α和髓过氧化物酶的产生,发挥对肠上皮屏障的保护作用[19]。此外,植物乳植杆菌能够通过降低黏膜IL-12、IFN-γ和免疫球蛋白G2a水平来减轻小鼠体内免疫介导的结肠炎[20],而结肠炎与CRC的发生发展密不可分。另一方面,植物乳植杆菌也可通过调节免疫、调节细胞应激反应、抑制炎症、调节细胞增殖、凋亡、焦亡及转移来直接干预CRC的发生发展[21]。有研究表明,植物乳植杆菌上清液联合5-氟尿嘧啶能够阻止对5-氟氧嘧啶治疗无反应的CRC细胞(HT-29和HCT-116)的生长,从而增加CRC细胞的化疗敏感性,它还可以阻止或预防癌症干细胞中的CD44、CD133、CD166和ALDH1,这种联合治疗通过使caspase-3更活跃并阻止化疗耐药CRC细胞中的Wnt/β-catenin信号传导导致CRC细胞死亡[22]。
因此,本研究通过化学诱导剂AOM/DSS建立小鼠炎症相关性CRC模型,从小鼠疾病表征、组织病理学分析、促炎细胞因子,以及炎症和细胞凋亡信号通路对LP-KSFY01干预CRC的作用效果及具体机制进行深入研究,为开发针对CRC的益生菌类功能性食品筛选候选菌株,并提供科学依据。
1 材料与方法
1.1 材料与试剂
植物乳植杆菌KSFY01分离自新疆维吾尔自治区喀什地区牧民家中自然发酵酸乳,保藏于中国普通微生物菌种保藏管理中心,保藏编号为CGMCC NO.15654。
AOM,西格玛奥德里奇(上海)贸易有限公司;DSS,美国MP生物医疗公司;阿司匹林肠溶片,拜耳医药保健有限公司;IL-6、IL-1β、TNF-α、NF-κB和诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)ELISA试剂盒,上海酶联生物科技有限公司;RNase-Free water,北京索莱宝科技有限公司;qPCR SYBR Green Master Mix,上海翊圣生物科技有限公司;TRIzol Reagent、RevertAid First Strand cDNA Synthesis Kit,美国赛默飞世尔科技公司,其余试剂均为国产生化试剂。
1.2 仪器与设备
6D45415正置显微镜,日本奥林巴斯仪器有限公司;Bioprep-24生物样品均质仪、Nano-300微量分光光度计,杭州奥盛仪器有限公司;A200梯度PCR仪,杭州朗基科学仪器有限公司;VLBL0TD1多功能酶标仪、StepOnePlus实时定量PCR仪,赛默飞世尔科技(苏州)有限公司。
1.3 实验方法
1.3.1 动物实验设计
从湖南斯莱克景达实验动物有限公司[动物资格许可证编号:SCXK (湘) 2019-0004]购买C57BL/6小鼠(SPF级,雄性,6周龄),在恒温恒湿的环境中适应性喂养7 d后随机分为5组:正常组、模型组、阿司匹林组、LP-KSFY01低浓度(LP-KSFY01L)组和LP-KSFY01高浓度(LP-KSFY01H)组。实验过程中小鼠自由摄食、饮水,实验造模第1天对模型组、阿司匹林组、LP-KSFY01组按照10 mg/kg的浓度进行AOM腹腔注射,并分别在第2周、第5周、第8周喂饲2.5% DSS水溶液。正常组小鼠除每日灌胃无菌生理盐水外不做特殊处理;模型组小鼠每日灌胃无菌生理盐水;阿司匹林组小鼠按67 mg/kg灌胃阿司匹林溶液;LP-KSFY01L组和LP-KSFY01H组小鼠分别按1×108 CFU/kg和1×109 CFU/kg的剂量灌胃LP-KSFY01菌悬液,持续10周。在实验过程中观察各组小鼠状态,每周称量并记录小鼠的体重。造模结束后,通过眼球取血并脱脊椎处死小鼠,解剖取小鼠大肠、脾脏和肝脏组织待测。
1.3.2 脏器指数测定
取实验小鼠大肠、脾脏和肝脏组织称重,通过公式(1)计算小鼠脏器指数[23],同时测量小鼠结直肠长度并观察肠道肿瘤发生情况。
脏器指数![]()
(1)
式中:脏器质量,mg;小鼠体重,g。
1.3.3 直肠组织病理学观察
将长度约0.5 cm的直肠组织浸入体积分数为4%多聚甲醛固定溶液中48 h,用乙醇脱水后包埋在石蜡中,用切片机切成2~3 μm的切片,利用苏木精-伊红(hematoxylin-eosin, HE)染色并固定在载玻片上,即制成小鼠直肠病理组织切片,在正置显微镜下观察形态变化。
1.3.4 小鼠血清和结肠组织中炎症相关因子水平测定
收集小鼠全血样本于4 ℃下,4 000 r/min离心10 min获得血清。根据酶联免疫吸附实验(enzyme linked immunosorbent assay, ELISA)试剂盒说明书,测定小鼠血清和结肠组织中IL-6、IL-1β、TNF-α、NF-κB和iNOS的水平。
1.3.5 小鼠结肠组织中炎症和细胞凋亡通路相关基因的表达水平测定
称取小鼠结肠组织50 mg,通过TRIzol试剂提取总RNA,并按照cDNA合成试剂盒中提供的说明将RNA逆转录为cDNA,使用微量光度计测定RNA和cDNA的浓度和纯度。使用StepOnePlus Real-Time PCR系统在以下条件下进行扩增40个循环:95 ℃持续15 s,60 ℃变性30 s,95 ℃持续15 s,60 ℃持续60 s,95 ℃变性15 s。以Eef2为内参基因,按2-ΔΔCt法计算各基因的相对表达强度。表1为本实验中用到的引物序列。
表1 引物序列
Table 1 Primer sequences

引物名登录号引物序列(5′-3′)Eef2NM_007907.2F:TGTCAGTCATCGCCCATGTGR:CATCCTTGCGAGTGTCAGTGAIκBβNM_010546.2F:GACATCGCATCGGCTCTTAGAR:AACGGTCACGGTGTACTTCTGp65NM_009045.4F:ACTGCCGGGATGGCTACTATR:TCTGGATTCGCTGGCTAATGGp50NM_008689.3F:AGAGGGGATTTCGATTCCGCR:CCTGTGGGTAGGATTTCTTGTTCp52NM_001177370.1F:TGGCATCCCCGAATATGATGAR:TGACAGTAGGATAGGTCTTCCGBidNM_007544.4F:CCAGTCACGCACCATCTTTGR:GTCCATCTCGTTTCTAACCAAGTBcl-2NM_177410.3F:GAGAGCGTCAACAGGGAGATGR:CCAGCCTCCGTTATCCTGGABcl-xLNM_009743.5F:AGCGTAGACAAGGAGATGCAGR:CCAAGGCTCTAGGTGGTCATTCcaspase-8NM_009812.2F:CAACTTCCTAGACTGCAACCGR:TCCAACTCGCTCACTTCTTCT
1.4 数据分析
所有数据均表示为“平均值±标准偏差”,采用SPSS 2中的one-way ANOVA进行显著性分析,GraphPad Prism 8.0.2用于绘图,图表中不同小写字母表示经Duncan多量程检验差异有统计学意义(P<0.05)。
2 结果与分析
2.1 LP-KSFY01对小鼠体重和脏器指数的影响
使用化学诱导剂AOM/DSS构建的CRC小鼠模型能可靠地重现肠道肿瘤发生和发展的阶段,高度模拟人体CRC的病理情况,此模型可导致患癌小鼠体重减轻以及脏器的炎症与水肿[24]。造模过程中观察到正常组小鼠体格健康,进食饮水均正常,无腹泻及便血,而其余4组小鼠出现不同程度的大便不成形、便血、甚至脱肛等症状,同时出现活动能力下降,毛色稀疏欠光泽,体重下降等情况(数据未显示)。如图1-a所示,正常组小鼠体重呈递增趋势,其余4组在每次喂饲DSS水溶液后,小鼠体重均呈下降趋势,且各组小鼠体重均具有显著差异(P<0.05),而经阿司匹林和LP-KSFY01干预后,小鼠体重病理性减轻的趋势得到明显缓解。脏器质量和脏器指数是生物医学研究的基本指标之一,也是研究的重要依据,炎症和水肿可导致脏器质量和脏器指数的升高[25-26]。本实验结果(图1-b、图1-c)显示,模型组小鼠脾脏指数和肝脏指数与正常组相比显著增加(P<0.05)。而相较于模型组,阿司匹林组和LP-KSFY01组脾脏指数和肝脏指数均显著降低(P<0.05),表明药物阿司匹林和菌株LP-KSFY01均可改善CRC小鼠的脾脏炎症和水肿症状。
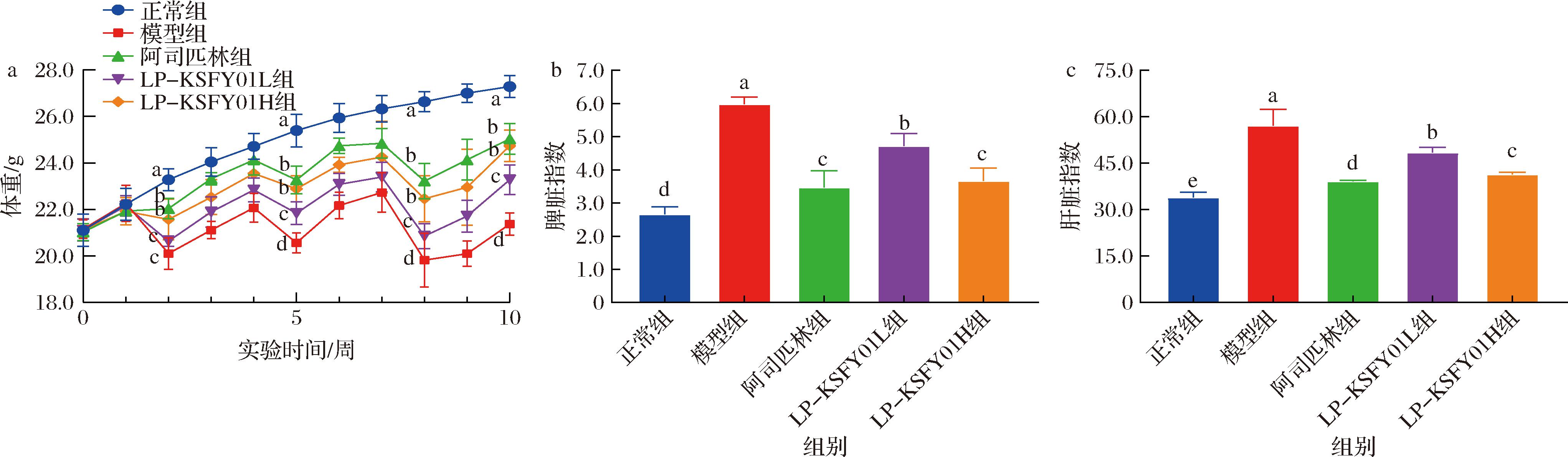
a-各组小鼠体重变化;b-脾脏指数;c-肝脏指数
图1 LP-KSFY01对小鼠体重和脏器指数的影响
Fig.1 Effects of LP-KSFY01 on body weight and organ indices in mice
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.2 LP-KSFY01对小鼠结直肠长度、结直肠指数和肠道肿瘤发生率的影响
结肠长度是用于表征DSS诱发结肠炎炎症程度的指标之一[27]。在本研究中(图2-a),正常组小鼠结直肠长度为(7.98±0.16) cm,模型组为(5.88±0.23) cm,阿司匹林组为(6.97±0.05) cm,LP-KSFY01L和LP-KSFY01H组分别为(6.38±0.37) cm和(6.77±0.38) cm。其中,模型组小鼠结直肠长度与正常组相比明显缩短(P<0.05),而LP-KSFY01干预可缓解小鼠结直肠的缩短,结果具有显著性差异(P<0.05),其发挥的作用效果与阿司匹林组相似。同时,图2-c表示,正常组、阿司匹林组、LP-KSFY01L组和LP-KSFY01H组的结直肠质量/长度比具有相似性,且都与模型组的结直肠质量/长度比差异显著(P<0.05)。此外,本实验中使用的AOM不仅可以诱导肿瘤,甚至可以促进肿瘤活性[28]。本实验中,正常组小鼠未见肠道肿瘤,模型组、阿司匹林组和LP-KSFY01组结直肠段可见数个大小不一的肿瘤,其中以模型组肿瘤数最多(10±1.92)个,阿司匹林组、LP-KSFY01L组和LP-KSFY01H组明显减少,分别为(3±0.99)、(4±1.31)和(2±1.06)个(图2-d)。由此可知,LP-KSFY01可以有效缓解肠道炎症水肿导致的结直肠缩短,降低小鼠结直肠指数,减少小鼠肠道肿瘤发生率。
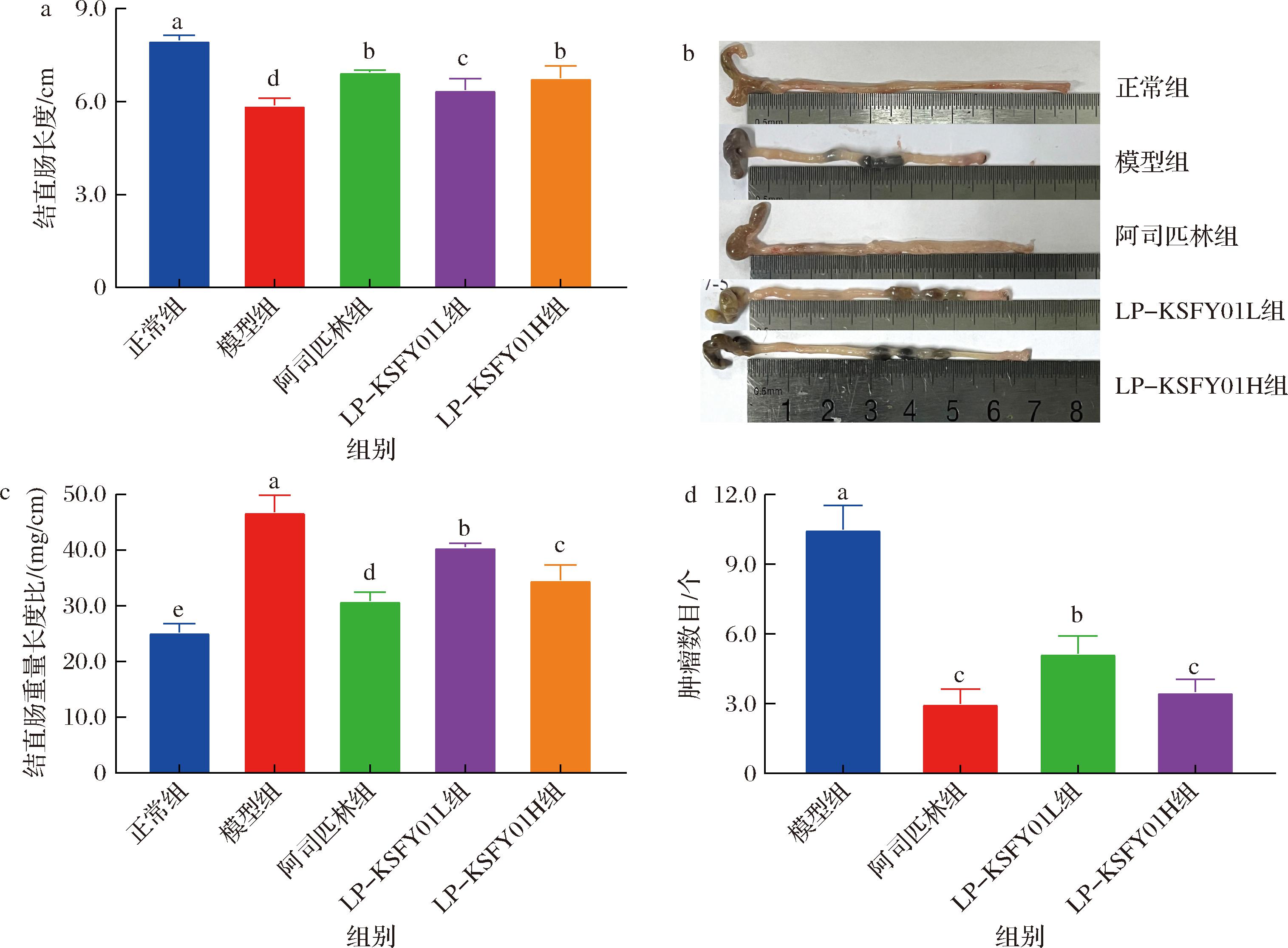
a-结直肠长度;b-结直肠图片;c-结直肠重量长度比;d-结直肠肿瘤数目
图2 LP-KSFY01对小鼠结直肠组织的影响
Fig.2 Effects of LP-KSFY01 on colorectal tissue in mice
2.3 LP-KSFY01对小鼠直肠组织病理学的影响
小鼠在炎症和癌症的影响下,机体各脏器都受到不同程度的影响,其中以肠道病理情况最为显著,包括隐窝结构异常、肠腺瘤的生成和发展[29]。由HE染色分析可知(图3),正常组小鼠的直肠组织黏膜上皮细胞完整,隐窝正常,腺体排列整齐,无溃疡;模型组小鼠的肠道受到大量炎症细胞浸润,出现多处坏死病灶和隐窝脓肿;阿司匹林组炎症细胞浸润程度较低,隐窝结构破坏少;LP-KSFY01组虽可见轻微的炎症浸润,但隐窝结构相对完整,相较于低浓度的LP-KSFY01,高浓度的LP-KSFY01更大程度地改善了由AOM/DSS引起的直肠组织的病理损伤。
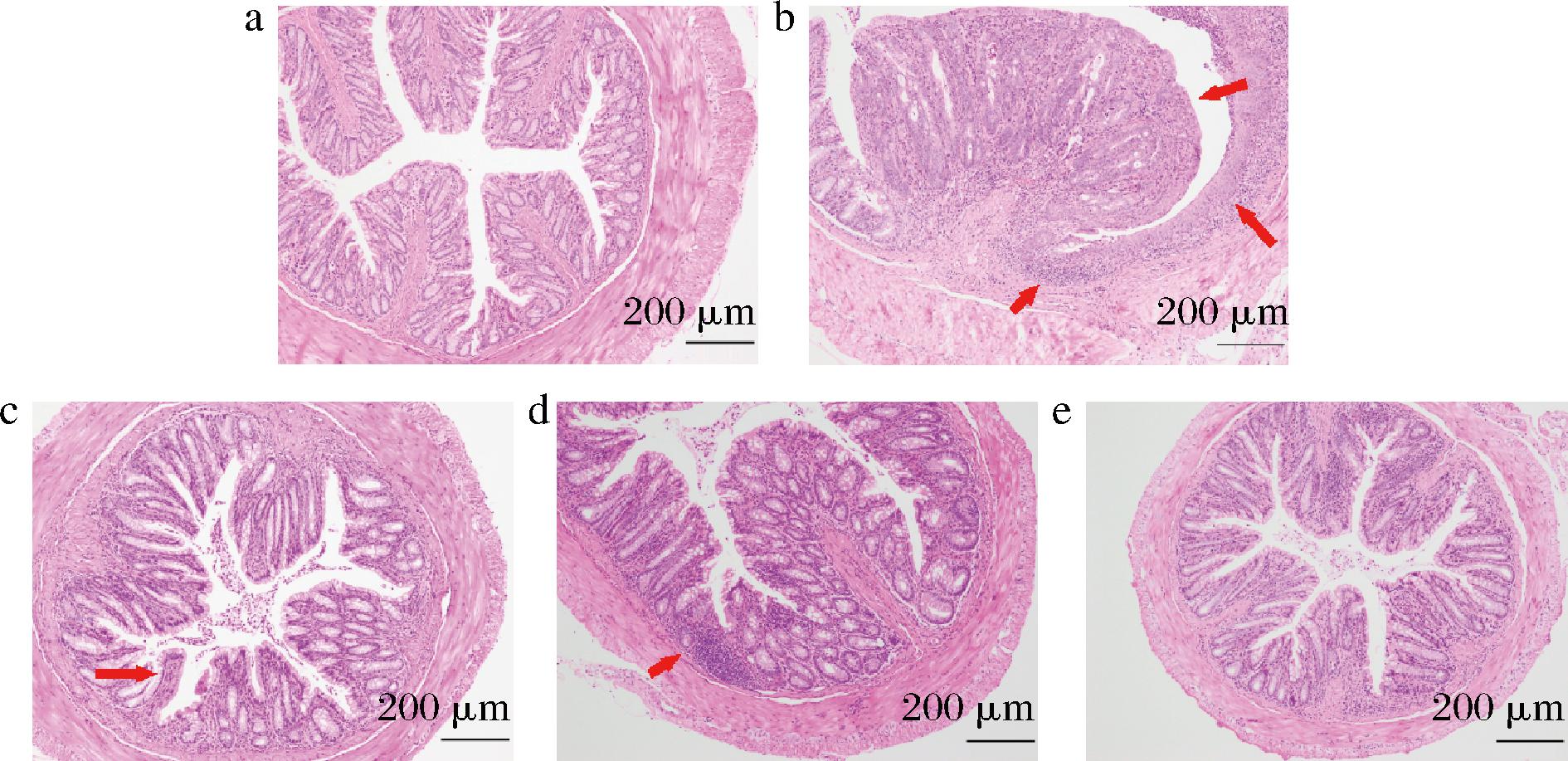
a-正常组;b-模型组;c-阿司匹林组;d-LP-KSFY01L组;e-LP-KSFY01H组
图3 LP-KSFY01对小鼠直肠组织病理学的影响(×100)
Fig.3 Effects of LP-KSFY01 on rectal histopathology in mice
2.4 LP-KSFY01对小鼠血清和结肠组织炎症细胞因子水平的影响
细胞因子是炎症细胞释放的主要信号分子,参与多种功能,其中主要的促炎细胞因子包括IL-1β、IL-6和TNF-α等[30]。它们参与的慢性炎症是炎症相关性CRC的促进因素,研究显示慢性炎症导致肿瘤发生主要与各种炎症细胞因子及其炎症相关途径有关[31]。本研究评估了LP-KSFY01的抗肿瘤活性是否与其促炎细胞因子的表达有关,利用ELISA实验分析了小鼠血清和结肠组织中IL-1β、IL-6、TNF-α、NF-κB和iNOS的表达水平。促炎细胞因子IL-6可激活NF-κB信号通路并促进细胞间黏附分子的表达[32]。同时,它作为白介素家族中最有代表性的一员,参与炎症反应、免疫调节介导癌症发生[33]。而同为炎性细胞因子的IL-1β,通过自分泌和旁分泌机制刺激炎症细胞进入肠道,损伤肠道组织并引起炎症[34]。结果显示(图4-a~图4-c、图5-a~图5-c),经AOM/DSS造模后,模型组小鼠血清和结肠中IL-1β、IL-6和TNF-α水平显著升高,阿司匹林和LP-KSFY01可有效降低其在血清和结肠组织中的浓度,且LP-KSFY01H组血清IL-1β、IL-6和TNF-α水平明显低于LP-KSFY01L组(P<0.05),表明高浓度的LP-KSFY01可更显著地降低CRC小鼠血清中促炎细胞因子水平。同时,近期的报道也称植物乳植杆菌L15可显著降低细胞因子IL-1β的水平[35],侧面提供了植物乳植杆菌可降低炎症因子水平的证据。另外,TNF-α作为调节经典炎症通路NF-κB活化的关键炎症因子,不仅是NF-κB的活化剂,也是其活化的产物[33,36]。因此,TNF-α和NF-κB通常被同时研究。NF-κB作为炎症反应的关键介质,是癌症最常见的调节因子之一,研究表明该因子的水平变化可反映CRC患者病情[37]。当前的实验结果揭示了LP-KSFY01通过降低炎性细胞因子IL-1β、IL-6和TNF-α在CRC小鼠血清和结肠组织中的浓度,发挥抗炎作用的具体机制,阐明了LP-KSFY01通过对炎症反应的调节发挥干预小鼠CRC发展的作用途径。

a-IL-1β含量;b-IL-6含量;c-TNF-α含量;d-NF-κB含量;e-iNOS含量
图4 LP-KSFY01对小鼠血清炎症细胞因子水平的影响
Fig.4 Effects of LP-KSFY01 on serum inflammatory cytokines in mice
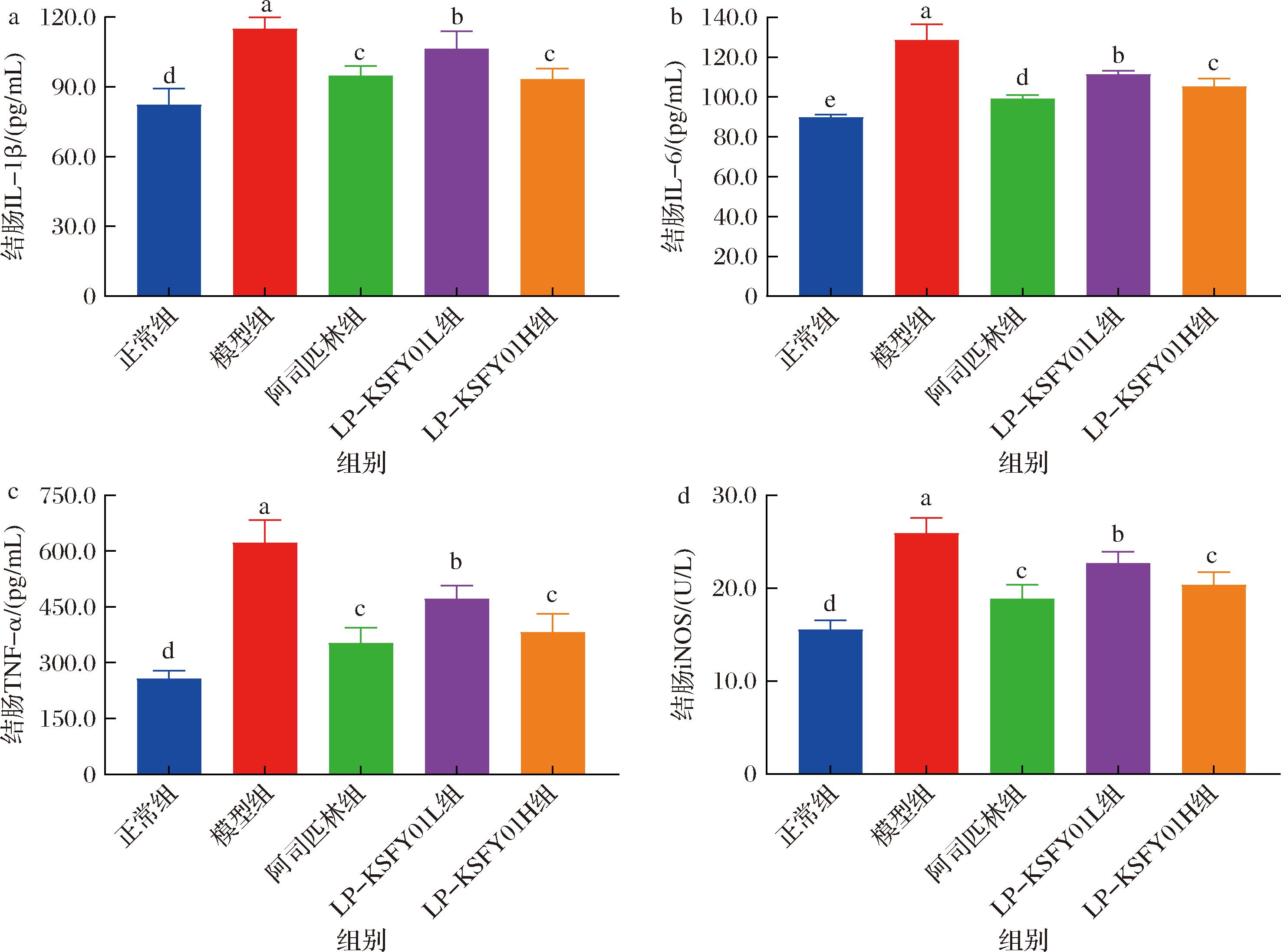
a-IL-1β含量;b-IL-6含量;c-TNF-α含量;d-iNOS含量
图5 LP-KSFY01对小鼠结肠炎症细胞因子水平的影响
Fig.5 Effects of LP-KSFY01 on colon inflammatory cytokines in mice
另一方面,杨晓东等[38]的研究证实,CRC患者的病变组织中NF-κB浓度高于未病变组织。与其研究结果相似,本研究中模型组小鼠血清中的NF-κB浓度最高(图4-d),正常组、阿司匹林组和LP-KSFY01组小鼠血清中的NF-κB浓度均低于模型组,且存在显著差异(P<0.05)。此外,NF-κB被激活时,可以观察到iNOS水平的增加,同时,TNF-α也可以在炎症反应中激活iNOS[30]。研究表明,iNOS与肿瘤的发生、发展有关,是肿瘤防治的新靶点[39]。本实验结果显示(图4-e和图5-d),iNOS在模型组小鼠血清和结肠组织中的高表达,正常组、阿司匹林组和LP-KSFY01组小鼠血清中的iNOS浓度均低于模型组,且存在显著性差异(P<0.05)。本研究的数据揭示了AOM/DSS的处理可诱导小鼠体内促炎细胞因子(IL-1β、IL-6和TNF-α)和iNOS的高表达,同时激活NF-κB炎症通路,引起机体内持续的炎症反应。小鼠血清和结肠组织中的实验结果具有一致性,共同揭示了植物乳植杆菌LP-KSFY01的灌胃处理可有效降低CRC小鼠体内促炎细胞因子的水平,下调NF-κB和iNOS的表达,缓解小鼠体内持续性炎症的病理状态,改善诱发肿瘤的病理环境。
2.5 LP-KSFY01对小鼠结肠组织中炎症通路相关因子mRNA表达水平的影响
在AOM/DSS诱导下,小鼠NF-κB信号通路被激活,导致炎症水平升高。因此,通过抑制NF-κB信号通路,可保护小鼠免受炎症刺激,干预CRC的发生和发展。NF-κB由5种转录因子组成,包括RelA/p65、RelB、c-Rel、NF-κB1(p50/p105)和NF-κB2(p52/p100)。这些转录因子调节涉及多种生物过程的各种基因的表达,包括炎症、细胞发育和分化,细胞周期进程和细胞迁移[40-41]。作为IκB蛋白的一员,IκBβ对NF-κB具有双重调节作用,其更倾向于与p65:cRel结合形成IκBβ:p65:cRel复合物,此复合物可促进靶基因的转录,导致NF-κB通路的持续激活[42-43]。而游离的NF-κB在细胞质和细胞核之间发挥重要的调节作用,其中磷酸化亚基p65通过触发某些基因的转录发挥重要作用,如TNF-α、IL-1β和IL-6,随后,这些细胞因子将进一步促进TLR4介导的通路激活,从而进一步增强和放大炎症反应[44]。同时,研究表明p65和p50作为NF-κB的2个重要亚基,是CRC诊断和预后的重要生物标志物,而p52与RelB的二聚体则可以通过核移位促进炎症相关基因转录[8]。在本研究中,实时荧光定量PCR被用于分析小鼠结肠组织中IκBβ、p65、p50和p52的基因表达水平,结果显示(图6),模型组小鼠结肠组织中IκBβ、p65、p50和p52的表达水平最高,阿司匹林组和LP-KSFY01组均显著降低(P<0.05),且高浓度LP-KSFY01灌胃组的效果更为显著,表明植物乳植杆菌LP-KSFY01可通过降低IκBβ基因的表达,阻断NF-κB炎症信号通路的持续激活。同时,它还通过下调p65、p50和p52基因的表达,抑制炎症反应的增强和放大效应,从而发挥抑制炎症反应的作用,干预CRC发展的效果。
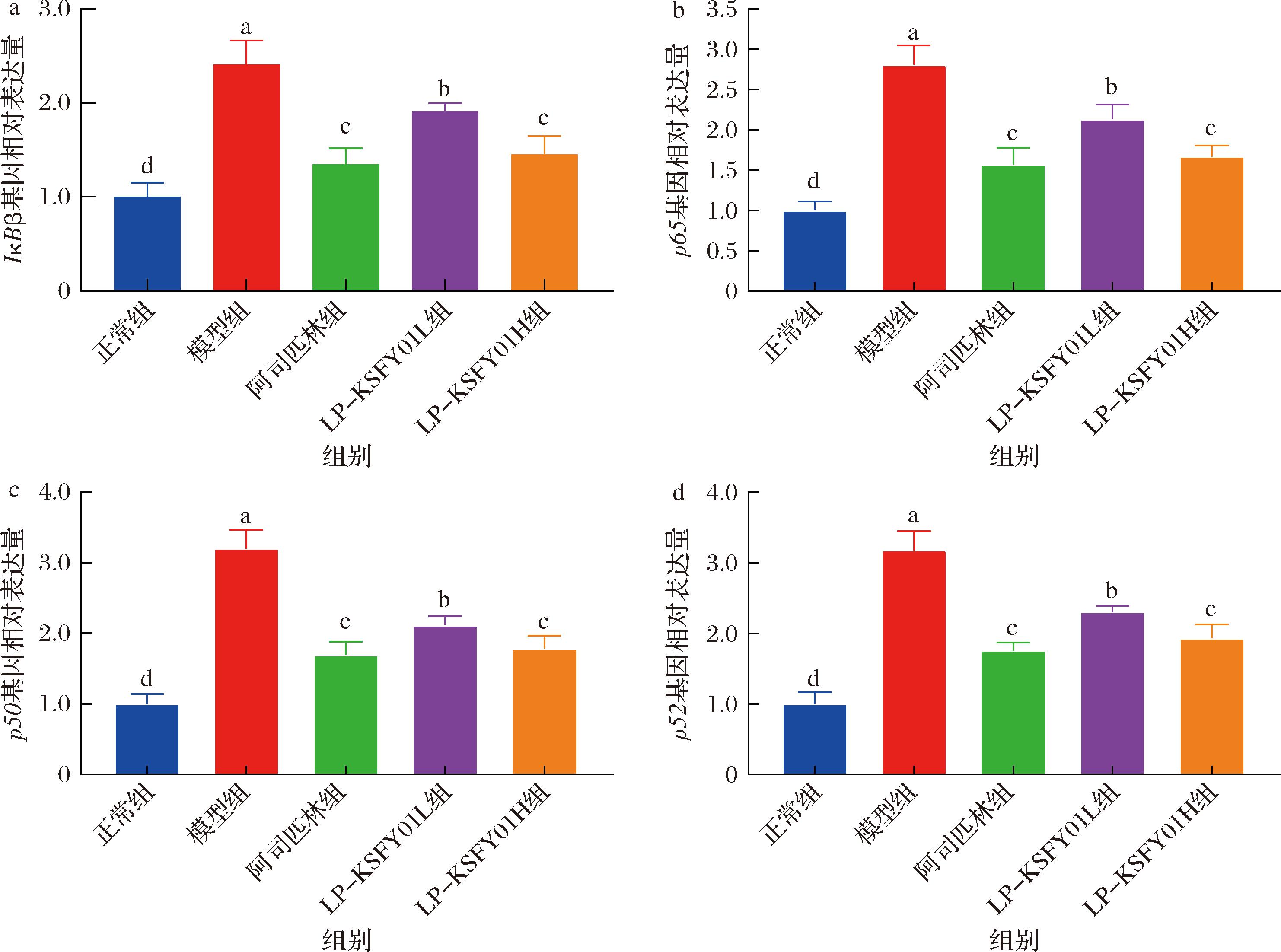
a-IκBβ相对表达量;b-p65相对表达量;c-p50相对表达量;d-p52相对表达量
图6 LP-KSFY01对小鼠结肠组织炎症因子mRNA相对表达量的影响
Fig.6 Effects of LP-KSFY01 on the relative expression of inflammatory factor mRNA in mice colon
2.6 LP-KSFY01对小鼠结肠组织中细胞凋亡通路相关因子mRNA表达水平的影响
据报道,NF-κB信号转导可促进CRC中炎性肿瘤微环境的建立,该微环境可作为增加细胞存活、增殖、转移和血管生成等多种肿瘤标志物的来源。在肿瘤微环境中,NF-κB上调抗凋亡蛋白的表达,如Bcl-2和Bcl-xL[8]。Bid是Bcl-2家族的促凋亡成员,能诱导CRC细胞线粒体凋亡[45]。Bcl-2和Bcl-xL的表达可抑制肿瘤细胞正常的凋亡程序,促进其生存与发展,因此,以细胞凋亡相关因子为靶点干预CRC是一条有效的途径。实验结果显示(图7-a),相较于正常组,模型组中的促凋亡因子Bid基因表达水平显著降低(P<0.05),经阿司匹林和LP-KSFY01干预后,CRC小鼠中Bid基因的相对表达量较之于模型组均显著上调(P<0.05),且高浓度的LP-KSFY01效果优于低浓度。同时,抗凋亡因子Bcl-2和Bcl-xL在模型组中高表达(图7-b和图7-c),而在阿司匹林组和LP-KSFY01组中的表达明显降低(P<0.05),因此,推测植物乳植杆菌LP-KSFY01通过上调促凋亡基因Bid表达水平,下调抗凋亡基因Bcl-2和Bcl-xL表达水平,在CRC小鼠体内激活了细胞凋亡的信号通路。另有研究表明,植物乳植杆菌提取物通过特异性下调Caco-2细胞中抗凋亡基因Bcl-2和Bcl-xL的表达,同时上调促凋亡基因Bak、Bad和Bax的表达,特异性诱导结直肠肿瘤细胞内源性细胞凋亡途径的靶向抗癌治疗[46]。此外,作为在死亡受体介导的程序性细胞死亡激活的调节和启动中不可缺少的一部分,caspase-8与内源性和外源性凋亡途径高度相关,有报道称caspase-8的功能失调可能有助于小鼠和人类恶性肿瘤发展[47]。本实验结果显示(图7-d),相较于正常组,模型组小鼠在AOM/DSS的诱导下,结肠组织caspase-8基因的相对表达水平显著降低(P<0.05),而阿司匹林和LP-KSFY01的干预可明显改善因小鼠患癌导致的caspase-8基因的低表达,且与模型组相比,LP-KSFY01高、低浓度组的caspase-8基因表达水平均具有显著差异(P<0.05)。SUN等[48]的研究表明,植物乳植杆菌胞外多糖可通过上调促凋亡蛋白Bax、Cyt C、caspase-3、caspase-8和caspase-9的表达,下调抗凋亡蛋白Bcl-2的表达,抑制人结肠癌细胞系HT-29通过线粒体途径的增殖。当前的实验结果表明,LP-KSFY01可显著上调促凋亡因子Bid和caspase-8的基因表达水平,同时降低抗凋亡因子Bcl-2和Bcl-xL的基因表达,通过诱导细胞线粒体凋亡的途径,发挥干预CRC发生发展的作用。

a-Bid相对表达量;b-Bcl-2相对表达量;c-Bcl-xL相对表达量;d-caspase-8相对表达量
图7 LP-KSFY01对小鼠结肠组织细胞凋亡相关因子mRNA相对表达量的影响
Fig.7 Effects of LP-KSFY01 on the relative expression of apoptosis related factors mRNA in mice colon
3 结论
本实验通过AOM/DSS诱导的小鼠炎症相关CRC模型,从小鼠体质量、脏器指数、结直肠长度、结直肠重量/长度、肠道肿瘤数、直肠组织病理学分析、血清和结肠组织炎症相关细胞因子分析、结肠组织NF-κB和细胞凋亡信号通路相关基因表达分析等方面,对分离自新疆传统发酵酸乳的LP-KSFY01干预炎症相关性CRC的效果和作用机制进行了深入研究。实验结果表明,LP-KSFY01显著改善小鼠因患癌导致的体重下降、脏器指数升高、结肠缩短和结直肠重量/长度升高的症状,有效减少患癌小鼠的肠道肿瘤发生率,改善直肠组织病理损伤(P<0.05)。同时,LP-KSFY01的干预显著降低小鼠血清和结肠组织中炎症细胞因子IL-1β、IL-6、TNF-α、NF-κB和iNOS的表达水平(P<0.05)。此外,LP-KSFY01还可在基因层面显著下调结肠组织中促炎因子IκBβ、p65、p50、p52和抗凋亡因子Bcl-2和Bcl-xL的mRNA表达,上调促凋亡因子Bid和caspase-8的表达(P<0.05)。本研究首次提示了LP-KSFY01在干预小鼠炎症相关性CRC发生发展中发挥的显著效果,揭示了其通过缓解直肠组织病理损伤,基于NF-κB途径改善血清和肠道炎症,促进肠道肿瘤细胞线粒体途径的细胞凋亡来发挥减缓CRC发生发展的具体机制,为LP-KSFY01对肠道的健康功能性提供了科学证据,为从饮食方面对CRC的预防和辅助治疗提供更多的科学依据,未来可从临床方面进行深入研究。
[1] SUNG H, FERLAY J, SIEGEL R L, et al.Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA:A Cancer Journal for Clinicians, 2021, 71(3):209-249.
[2] THANIKACHALAM K, KHAN G.Colorectal cancer and nutrition[J].Nutrients, 2019, 11(1):164.
[3] PANG Y J, KARTSONAKI C, GUO Y, et al.Adiposity and risks of colorectal and small intestine cancer in Chinese adults:A prospective study of 0.5 million people[J].British Journal of Cancer, 2018, 119(2):248-250.
[4] AXELRAD J E, LICHTIGER S, YAJNIK V.Inflammatory bowel disease and cancer:The role of inflammation, immunosuppression, and cancer treatment[J].World Journal of Gastroenterology, 2016, 22(20):4794-4801.
[5] CLARK C R, STARR T K.Mouse models for the discovery of colorectal cancer driver genes[J].World Journal of Gastroenterology, 2016, 22(2):815-822.
[6] PARANG B, BARRETT C W, WILLIAMS C S.AOM/DSS model of colitis-associated cancer[J].Methods in Molecular Biology, 2016, 1422:297-307.
[7] EICHELE D D, KHARBANDA K K.Dextran sodium sulfate colitis murine model:An indispensable tool for advancing our understanding of inflammatory bowel diseases pathogenesis[J].World Journal of Gastroenterology, 2017, 23(33):6016-6029.
[8] MARTIN M, SUN M Y, MOTOLANI A, et al.The pivotal player:Components of NF-κB pathway as promising biomarkers in colorectal cancer[J].International Journal of Molecular Sciences, 2021, 22(14):7429.
[9] HU R T, CHANTANA W, PITCHAKARN P, et al.Ficus dubia latex extract induces cell cycle arrest and apoptosis by regulating the NF-κB pathway in inflammatory human colorectal cancer cell lines[J].Cancers, 2022, 14(11):2665.
[10] WANG S, LIU Z J, WANG L S, et al.NF-κB signaling pathway, inflammation and colorectal cancer[J].Cellular &Molecular Immunology, 2009, 6(5):327-334.
[11] DUAN B J, ZHAO Y N, BAI J, et al.Colorectal cancer:An overview[M].Gastrointestinal Cancers.Brisbane:Exon Publications, 2022.
[12] BOSETTI C, SANTUCCI C, GALLUS S, et al.Aspirin and the risk of colorectal and other digestive tract cancers:An updated meta-analysis through 2019[J].Annals of Oncology, 2020, 31(5):558-568.
[13] DREW D A, CAO Y, CHAN A T.Aspirin and colorectal cancer:The promise of precision chemoprevention[J].Nature Reviews Cancer, 2016, 16(3):173-186.
[14] LI Z Y, WANG Z, SHEN B L, et al.Effects of aspirin on the gastrointestinal tract:Pros vs.cons[J].Oncology Letters, 2020, 20(3):2567-2578.
[15] 刘利军, 张晓桐, 靳奇文, 等.益生菌对结直肠癌的改善作用与机制的研究进展[J].食品工业科技, 2022, 43(21):405-413.LIU L J, ZHANG X T, JIN Q W, et al.Research progress on the improvement effect and mechanism of probiotics on colorectal cancer[J].Science and Technology of Food Industry, 2022, 43(21):405-413.
[16] 陈欢. 新疆哈萨克族传统奶酪中乳酸菌发酵剂的筛选及对奶酪风味影响的研究[D].石河子:石河子大学, 2019.CHEN H.Screening of lactic acid bacteria starter in Xinjiang Kazakh traditional cheese and its effect on cheese flavor[D].Shihezi:Shihezi University, 2019.
[17] GARCIA-GONZALEZ N, BATTISTA N, PRETE R, et al.Health-promoting role of Lactiplantibacillus plantarum isolated from fermented foods[J].Microorganisms, 2021, 9(2):349.
[18] JAVID H, ORYANI M A, AKBARI S, et al.L.plantarum and L.lactis as a promising agent in treatment of inflammatory bowel disease and colorectal cancer[J].Future Microbiology, 2023, 18:1197-1209.
[19] LIU Z H, ZHANG P, MA Y L, et al.Lactobacillus plantarum prevents the development of colitis in IL-10-deficient mouse by reducing the intestinal permeability[J].Molecular Biology Reports, 2011, 38(2):1353-1361.
[20] SCHULTZ M, VELTKAMP C, DIELEMAN L A, et al.Lactobacillus plantarum 299V in the treatment and prevention of spontaneous colitis in interleukin-10-deficient mice[J].Inflammatory Bowel Diseases, 2002, 8(2):71-80.
[21] 黄学红, 王领, 倪敏.植物乳杆菌对结直肠癌作用及机制的研究进展[J].甘肃医药, 2023, 42(1):7-10.HUANG X H, WANG L, NI M.Research progress on the effect and mechanism of Lactobacillus plantarum on colorectal cancer[J].Gansu Medical Journal, 2023, 42(1):7-10.
[22] AN J, HA E M.Combination therapy of Lactobacillus plantarum supernatant and 5-fluouracil increases chemosensitivity in colorectal cancer cells[J].Journal of Microbiology and Biotechnology, 2016, 26(8):1490-1503.
[23] LI C, SI J, TAN F, et al.Lactobacillus plantarum KSFY06 prevents inflammatory response and oxidative stress in acute liver injury induced by D-Gal/LPS in mice[J].Drug Design, Development and Therapy, 2021, 15:37-50.
[24] DE ROBERTIS M, MASSI E, POETA M L, et al.The AOM/DSS murine model for the study of colon carcinogenesis:From pathways to diagnosis and therapy studies[J].Journal of Carcinogenesis, 2011, 10:9.
[25] MICHAEL B, YANO B, SELLERS R S, et al.Evaluation of organ weights for rodent and non-rodent toxicity studies:A review of regulatory guidelines and a survey of current practices[J].Toxicologic Pathology, 2007, 35(5):742-750.
[26] 田小芸, 恽时锋, 周森妹, 等.C57BL/KsJ-db/db,+/db小鼠主要脏器重量及脏器系数的测定[J].中国比较医学杂志, 2006, 16(4):220-222.TIAN X Y, YUN S F, ZHOU S M, et al.The weight of main organs and organ coefficient in db/db and +/db mice[J].Chinese Journal of Comparative Medicine, 2006, 16(4):220-222.
[27] MIN J K, LEE C H, JANG S E, et al.Amelioration of trinitrobenzene sulfonic acid-induced colitis in mice by liquiritigenin[J].Journal of Gastroenterology and Hepatology, 2015, 30(5):858-865.
[28] BISSAHOYO A, PEARSALL R S, HANLON K, et al.Azoxymethane is a genetic background-dependent colorectal tumor initiator and promoter in mice:Effects of dose, route, and diet[J].Toxicological Sciences, 2005, 88(2):340-345.
[29] ERBEN U, LODDENKEMPER C, DOERFEL K, et al.A guide to histomorphological evaluation of intestinal inflammation in mouse models[J].International Journal of Clinical and Experimental Pathology, 2014, 7(8):4557-4576.
[30] ZHAO H K, WU L, YAN G F, et al.Inflammation and tumor progression:Signaling pathways and targeted intervention[J].Signal Transduction and Targeted Therapy, 2021, 6:263.
[31] 李文彬. 炎症因子和益生菌在溃疡性结肠炎癌变中的作用与相关机制研究[D].北京:北京协和医学院, 2017.LI W B.The role and mechanism of inflammatory factors and probiotics in the carcinogenesis of ulcerative colitis[D].Beijing:Peking Union Medical College, 2017.
[32] OSHIMA H, OSHIMA M.The inflammatory network in the gastrointestinal tumor microenvironment:Lessons from mouse models[J].Journal of Gastroenterology, 2012, 47(2):97-106.
[33] 曾心雨. 双歧杆菌制剂对ERAS路径下老年结直肠癌患者术后恢复的影响研究[D].湖南:湖南师范大学, 2022.ZENG X Y.Study on the effect of Bifidobacterium preparationon postoperative recovery of elderly patients with colorectal cancer under ERAS pathway[D].Hunan:Hunan Normal University, 2022.
[34] LOPETUSO L R, CHOWDHRY S, PIZARRO T T.Opposing functions of classic and novel IL-1 family members in gut health and disease[J].Frontiers in Immunology, 2013, 4:181.
[35] 贾前生, 左锋.植物乳杆菌L15对过度运动引起大鼠骨骼肌损伤的改善作用[J].食品科学, 2023, 44(13):79-87.JIA Q S, ZUO F.Ameliorative effect of Lactobacillus plantarum L15 on excessive exercise-induced skeletal muscle injury in rats[J].Food Science, 2023, 44(13):79-87.
[36] WANG Y J, PASZEK P, HORTON C A, et al.A systematic survey of the response of a model NF-κB signalling pathway to TNFα stimulation[J].Journal of Theoretical Biology, 2012, 297(2-12):137-147.
[37] 师鑫鹏, 罗晓勇, 李朝萍, 等.西妥昔单抗联合化疗治疗对耐药晚期结直肠癌患者近期疗效及血清NF-κB、EGFR、HER-2水平的影响[J].实用中西医结合临床, 2021, 21(19):92-93.SHI X P, LUO X Y, LI C P, et al.Short-term effect of cetuximab combined with chemotherapy on patients with drug-resistant advanced colorectal cancer and its influence on serum NF-κB, EGFR and HER-2 levels[J].Practical Clinical Journal of Integrated Traditional Chinese and Western Medicine, 2021, 21(19):92-93.
[38] 杨晓东, 王杉, 于永祥, 等.细胞核因子NFkB在人大肠癌组织中的表达及意义[J].中华普通外科杂志, 2000, 15(6):367-369.YANG X D, WANG S, YU Y X, et al.Expression of nuclear factor-kB(NF-kB) in human colorectal cancer[J].Chinese Journal of General Surgery, 2000, 15(6):367-369.
[39] WANG H, WANG L Y, XIE Z X, et al.Nitric oxide (NO) and NO synthases (NOS)-based targeted therapy for colon cancer[J].Cancers, 2020, 12(7):1881.
[40] WEI H, PRABHU L, HARTLEY A V, et al.Methylation of NF-κB and its role in gene regulation[M].Gene Expression and Regulation in Mammalian Cells- Transcription From General Aspects.Rijeka:InTech, 2018
[41] THOMS H C, STARK L A.The NF-κB nucleolar stress response pathway[J].Biomedicines, 2021, 9(9):1082.
[42] KAMATA H, TSUCHIYA Y, ASANO T.IκBβ is a positive and negative regulator of NF-κB activity during inflammation[J].Cell Research, 2010, 20(11):1178-1180.
[43] MALEK S, HUANG D B, HUXFORD T, et al.X-ray crystal structure of an IkappaBbeta x NF-kappaB p65 homodimer complex[J].Journal of Biological Chemistry, 2003, 278(25):23094-23100.
[44] TAKEUCHI O, AKIRA S.Pattern recognition receptors and inflammation[J].Cell, 2010, 140(6):805-820.
[45] HUANG G L, CHEN X J, CAI Y F, et al.miR-20a-directed regulation of BID is associated with the TRAIL sensitivity in colorectal cancer[J].Oncology Reports, 2017, 37(1):571-578.
[46] AMIN M, NAVIDIFAR T, SAEB S, et al.Tumor-targeted induction of intrinsic apoptosis in colon cancer cells by Lactobacillus plantarum and Lactobacillus rhamnosus strains[J].Molecular Biology Reports, 2023, 50(6):5345-5354.
[47] TUMMERS B, GREEN D R.Caspase-8:Regulating life and death[J].Immunological Reviews, 2017, 277(1):76-89.
[48] SUN M Y, LIU W W, SONG Y L, et al.The effects of Lactobacillus plantarum-12 crude exopolysaccharides on the cell proliferation and apoptosis of human colon cancer (HT-29) cells[J].Probiotics and Antimicrobial Proteins, 2021, 13(2):413-421.