甾体化合物又称类固醇,是一种结构复杂的多烯类化合物。作为自然界中广泛存在的重要生物活性物质,甾体化合物几乎存在于所有动植物及微生物体内,并在生命活动中发挥关键作用。在药物领域,甾类化合物具有多种生理活性和药用价值[1-6],是仅次于抗生素的第二大类药物。甾体药物因其抗炎、抗过敏作用在制药工业引起人们的巨大关注。甾体化合物微生物合成由于污染朊病毒和病毒风险低,制造模式绿色,为化学合成和动物衍生产品提供了更好的选择[7]。孕烯醇酮(pregnenolone,化学名3-羟基孕固烯-20-酮,分子式C21H32O2)为熔点193 ℃的白色结晶粉末。此化合物在水中溶解度较低,但稍溶于有机溶剂。孕烯醇酮作为所有甾体药物的关键前体,在合成糖皮质素、盐皮质激素和性激素过程中具有不可替代的作用,因而在制药领域应用价值巨大。然而,目前孕烯醇酮的前体转化率较低,制约了其高效生产和应用[8]。
通过表达成熟形式无N端线粒体靶向序列P450 scc蛋白(mCYP11A1、mAdx和mAdR),孕烯醇酮已经在几个微生物平台上实现生产。MAKEEVA等[9]通过使用大肠杆菌宿主细胞和牛P450 scc系统从500 μmol/L(193 mg/L)胆固醇中获得420 μg/L孕烯醇酮。与大肠杆菌相比,酿酒酵母作为更成功的平台,有研究从葡萄糖中获得60 mg/L孕烯醇酮[10]和11.5 mg/L氢化可的松[11]。ZHANG等[12]通过解脂耶氏酵母高密度发酵中获得78.0 mg/L的孕烯醇酮产量,表明了孕烯醇酮微生物生产的巨大潜力。MAUERSBERGER等[13]通过在重组二倍体解脂耶氏酵母中乙醇诱导表达人来源的P450 scc系统,50 μmol/L胆固醇转化率为8%。
甾体化合物的生物合成过程与细胞色素P450系统催化的氧化还原反应密切相关[14]。通常情况下,P450系统由1个单加氧酶和1个或2个氧化还原伴侣蛋白组成,这些组分共同构成电子传递链,从而驱动甾体化合物的生物转化反应[15]。与其他独立的单加氧酶不同,P450单加酶的活性高度依赖于与氧化还原伴侣的相互作用。因此需要对细胞色素P450系统的多组分进行组合工程,以实现更紧密的耦合。细胞色素P450侧链裂解(P450 scc)系统是由P450单加氧酶CYP11A1及其天然氧化还原伴侣AdX和肾上腺氧化还原酶AdR组成。P450 scc系统在甾体化合物合成过程中起着关键作用,它能够催化甾醇中间体菜油甾醇转化为孕烯醇酮。这一转化过程不仅是甾体合成的起始步骤,也是整个合成途径中的第一个限速步骤。
酿酒酵母作为一种经典真核模式微生物,在研究合成甾体化合物方面具有独特的优越性。其中,酿酒酵母细胞中含有最多的甾体化合物——麦角甾醇,这也是其细胞膜的重要成分[16]。目前基于合成途径抑制真菌麦角甾醇的抗真菌药物,其作用机理大多为抑制合成途径的多种酶[17]。然而,酿酒酵母体内的麦角固醇合成过程极为复杂,涉及约30种由ERG基因编码的酶,这些酶共同调控着麦角固醇的生物合成途径[18]。除此之外酿酒酵母合成麦角固醇仅在有氧条件下进行,并且会耗费大量的能量,在反应过程中需要大量ATP的消耗。酿酒酵母由于不能合成甾体而转变为甾体营养缺陷型细胞,在无氧条件下,必须依赖外源甾体的摄取,才能维持正常的生理机能[19-20]。因此,要想在酿酒酵母中合成孕烯醇酮,首先需要对ERG5基因进行敲除,将DHCR7进行整合,构建出一条酿酒酵母胞内菜油甾醇合成的途径。然后导入细胞色素P450 scc系统中单加氧酶CYP11A1降解菜油甾醇侧链,最后生成孕烯醇酮(图1)[21]。此外,酿酒酵母中天然存在的甲羟戊酸(mevalonate,MVA)途径可以提供直接的前体物质,用于合成甾体化合物[22]。受惠于这一特性,酿酒酵母中合成甾体化合物的反应步骤较少,且转化效率较高,这为其细胞工厂合成甾体化合物提供了便利。
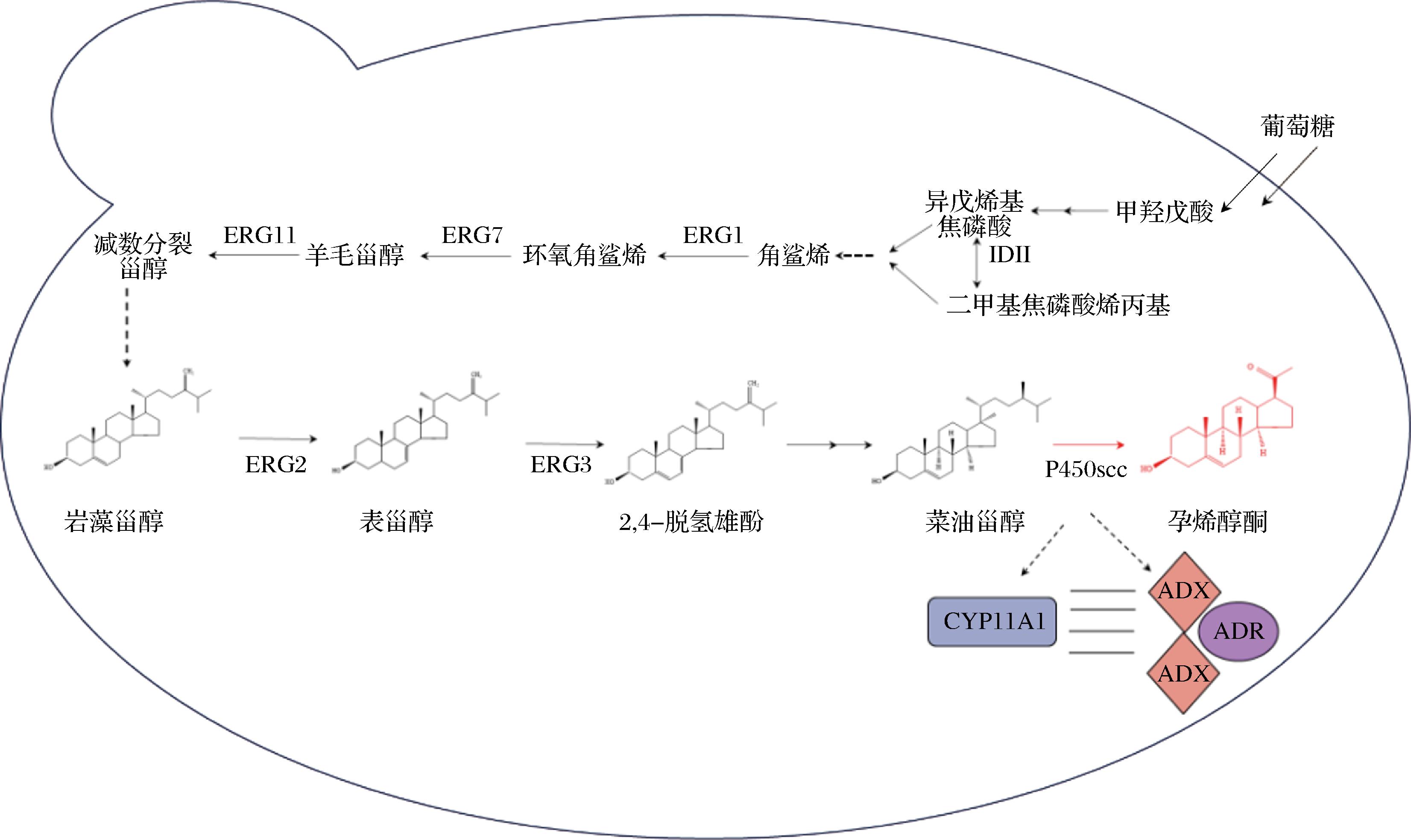
图1 酿酒酵母孕烯醇酮生物合成途径
Fig.1 Biosynthesis pathway of pregnenolone in the Saccharomyces cerevisiae
以实验室之前获得高产菜油甾醇的酿酒酵母Zw523菌株[7]为初始菌株,本研究通过构建细胞色素侧链降解系统P450 scc系统,运用CRISPR/Cas9基因编辑技术以及合成生物学策略,使酿酒酵母能够高效合成孕烯醇酮。
1 材料和方法
1.1 材料
1.1.1 菌株、质粒和培养基
大肠杆菌生长用LB培养基(g/L):蛋白胨10,酵母粉5,NaCl 10;酿酒酵母筛选用尿嘧啶营养缺陷型培养基(g/L):SC-URA培养基7.9,葡萄糖20;YPD培养基(g/L):蛋白胨20,酵母粉10,葡萄糖20;YPG培养基:蛋白胨20,酵母粉10,半乳糖20。配成固体培养基时加入质量分数1%的琼脂粉,培养大肠杆菌时向LB培养基中加入氨苄青霉素使其终质量浓度为100 μg/mL。
实验所用菌株和质粒见表1。
表1 本研究的菌株和质粒
Table 1 Strains and plasmids in this study

菌株与质粒性质来源菌株S.cerevisiaeZw523erg5::TEF1p-PhDHCR7-ADH1t实验室保藏CP601607b::GAL10-SsCYP11A1-GAL1-BtADX-TEF2-BtADR本研究构建CP602607b::GAL10-HakCYP11A1-GAL1-BtADX-TEF2-BtADR本研究构建CP603607b::GAL10-BtCYP11A1-GAL1-BtADX-TEF2-BtADR本研究构建CP604607b::GAL10-LrCYP11A1-GAL1-BtADX-TEF2-BtADR本研究构建CP605607b::GAL10-UtjCYP11A1-GAL1-BtADX-TEF2-BtADR本研究构建CP606607b::GAL10-PmCYP11A1-GAL1-BtADX-TEF2-BtADR本研究构建CP607607b::GAL10-BtlCYP11A1-GAL1-BtADX-TEF2-BtADR本研究构建CP608607b::GAL10-LrCYP11A1-GAL1-YlADX-TEF2-YlADR本研究构建CP609607b::GAL10-LrCYP11A1-GAL1-AtADX-TEF2-AtADR本研究构建CP610607b::GAL10-LrCYP11A1-GAL1-HsADX-TEF2-HsADR本研究构建CP611607b::PGKL1p-LrCYP11A1-GAL1-HsADX-TEF2-HsADR本研究构建CP612607b::GPM1p-LrCYP11A1-GAL1-HsADX-TEF2-HsADR本研究构建CP613607b::TDH3p-LrCYP11A1-GAL1-HsADX-TEF2-HsADR本研究构建CP614607b::TEF1p-LrCYP11A1-GAL1-HsADX-TEF2-HsADR本研究构建CP615607b::TPI1p-LrCYP11A1-GAL1-HsADX-TEF2-HsADR本研究构建CP616607b::GPD1p-LrCYP11A1-GAL1-HsADX-TEF2-HsADR本研究构建CP617607b::ACT1p-LrCYP11A1-GAL1-HsADX-TEF2-HsADR本研究构建CP618607b::TDH2p-LrCYP11A1-GAL1-HsADX-TEF2-HsADR本研究构建CP619CP614(1021b::TEF1p-Erg1)本研究构建CP620CP619(106a::TEF1p-Erg7)本研究构建CP621CP620(911b::TEF1p-Erg11)本研究构建CP622CP621(308a::TEF1p-Erg2)本研究构建CP623CP622(1622b::TE1p-Erg3)本研究构建Escherichia coliDH5α用于本研究中质粒的构建与克隆质粒pCUT-607b表达Cas9蛋白,URA3筛选标记,AmpRKEASLING教授惠赠[23]pCUT-1114a表达Cas9蛋白,URA3筛选标记,AmpRKEASLING教授惠赠[23]pCUT-1014a表达Cas9蛋白,URA3筛选标记,AmpRKEASLING教授惠赠[23]pCUT-911b表达Cas9蛋白,URA3筛选标记,AmpRKEASLING教授惠赠[23]pCUT-308a表达Cas9蛋白,URA3筛选标记,AmpRKEASLING教授惠赠[23]pCUT-1622b表达Cas9蛋白,URA3筛选标记,AmpRKEASLING教授惠赠[23]pTE28a-BtCYP11A1携带来源于家牛(Bos taurus)的CYP11A1基因,KanR金唯智合成pTE28a-LrCYP11A1携带来源于短尾猫(Lynx rufus)的CYP11A1基因,KanR金唯智合成pTE28a-HakCYP11A1携带来源于河马(Hippopotamus amphibius kiboko)的CYP11A1基因,KanR金唯智合成pTE28a-SsCYP11A1携带来源于野猪(Sus scrofa)的CYP11A1基因,KanR金唯智合成pTE28a-UtjCYP11A1携带来源于亚洲黑熊(Ursus thibetanus japonicus)的CYP11A1基因,KanR金唯智合成pTE28a-PmCYP11A1携带来源于抹香鲸(Physeter macrocephalus)的CYP11A1基因,KanR金唯智合成pTE28a-BtlCYP11A1携带来源于羚牛(Budorcas taxicolor)的CYP11A1基因,KanR金唯智合成pTE28a-BtADX携带来源于B. taurus的ADX基因,KanR金唯智合成pTE28a-YlADX携带来源于解脂耶氏酵母(Yarrowia lipolytica)的ADX基因,KanR金唯智合成pTE28a-AtADX携带来源于拟南芥(Arabidopsis thaliana)的ADX基因,KanR金唯智合成pTE28a-HsADX携带来源于智人(Homo sapiens)的ADX基因,KanR金唯智合成pTE28a-BtADR携带来源于B. taurus的ADR基因,KanR金唯智合成pTE28a-YlADR携带来源于Y.lipolytica的ADR基因,KanR金唯智合成pTE28a-AtADR携带来源于A.thaliana的ADR基因,KanR金唯智合成pTE28a-HsADR携带来源于H.sapiens的ADR基因,KanR金唯智合成
1.1.2 引物
本研究的引物由上海生工生物科技有限公司合成,引物见表2。
表2 本研究的引物
Table 2 Primers for this study

引物序列(5’→3’)F-GAL10TATAGTTTTTTCTCCTTGACGTTAAAGTATAGR-GAL10TTATATTGAATTTTCAAAAATTCTTACTTTTTTTTTGGF-BtCYP11A1CATAAATCATAAGAAATTCGATTTCTACAAAGACACCAAGACCGTATTCCR-BtCYP11A1AGTAACTTAAGGAGTTAAATCGCTTGGGGCGGATCTTGF-HakCYP11A1CATAAATCATAAGAAATTCGATTAGTACAAAAACACCAAGGCCATTCAACR-HakCYP11A1AGTAACTTAAGGAGTTAAATAGCTTGTGGTGGATCCTGATTAAAAGGF-SsCYP11A1CATAAATCATAAGAAATTCGGCTTGCAGCGGATCTTGGTTGR-SsCYP11A1AGTAACTTAAGGAGTTAAATATGATTTCAACGAAAACCCCTAGACCF-LrCYP11A1CATAAATCATAAGAAATTCGATTAGCACGCAAATCCCAAGACCR-LrCYP11A1AGTAACTTAAGGAGTTAAATTACTTGTGGTGGGTCTTGGGAGF-UtjCYP11A1CATAAATCATAAGAAATTCGATATCCACCCAAATACCAAGACCATTTTCR-UtjCYP11A1AGTAACTTAAGGAGTTAAATCACCTGGGGTGGGTCTTGF-PmCYP11A1CATAAATCATAAGAAATTCGATCTCCACTAAAACGCCAAGATCTTTCR-PmCYP11A1AGTAACTTAAGGAGTTAAATGGCTTGTGGTGGATCTTGGTTAAATGF-BtlCYP11A1CATAAATCATAAGAAATTCGATCAGTACCCGTACACCAAGACCTTATAGR-BtlCYP11A1AGTAACTTAAGGAGTTAAATAGCTTGAGGAGGATCCTGATTAAAGGF-BtADRATCTAAGTTTTAATTACAAAATGGCTCCTCGATGTTGGCR-BtADRACAAAGGAAAAGGGGCCTGTTTAGTGTCCCAGCAGTCGCF-YlADRATCTAAGTTTTAATTACAAAATGATCCGATCCGTGCGACR-YlADRACAAAGGAAAAGGGGCCTGTTTACTGTCGAGCAATCTCCAGCF-AtADRATCTAAGTTTTAATTACAAAATGTCTCGATACCTGGCCCGR-AtADRACAAAGGAAAAGGGGCCTGTTTAGTTGGCAGCGGCAGCF-HsADRATCTAAGTTTTAATTACAAAATGGCCTCTCGATGTTGGCR-HsADRACAAAGGAAAAGGGGCCTGTTTAGTGGCCCAGCAGTCGF-BtADXGTCAAGGAGAAAAAACTATAATGTCTCGATACCTGGCCCGR-BtADXCATAAATCATAAGAAATTCGTTAGTTGGCAGCGGCAGCF-YlADXGTCAAGGAGAAAAAACTATAATGCTGCGAACCTTCTCTCGR-YlADXCATAAATCATAAGAAATTCGTTAGTTGAAGTCGGAAGCCTGCF-AtADXGTCAAGGAGAAAAAACTATAATGATCGGTCACCGAATTTCTCGR-AtADXCATAAATCATAAGAAATTCGTTAGTGGGGCTTGGGGACGF-HsADXGTCAAGGAGAAAAAACTATAATGGCCGCTGCCGGTR-HsADXCATAAATCATAAGAAATTCGTTAAGAGGTCTTTCCCACGTCGATG
1.1.3 主要试剂和仪器
DNA聚合酶,诺唯赞生物科技股份有限公司;琼脂糖凝胶DNA回收试剂盒、小量质粒提取试剂盒,上海生工生物有限公司;葡萄糖、KOH等常规试剂,国药集团药业股份有限公司;孕烯醇酮标品,上海源叶生物科技有限公司;聚乙二醇PEG3350,索莱宝生物科技有限公司;醋酸锂,阿拉丁生化科技有限公司;N-甲基-N-(三甲基甲硅烷基)三氟乙酰胺[bis(trimethylsilyl)trifluoroacetamide,BSTFA],美国Sigma Aldrich公司。
BG-50隔水式恒温培养箱,上海博迅实业有限公司医疗设备厂;CR22N冷冻离心机,日本Hitachi公司;CS150NX台式高速离心机,德国Eppendorf公司;高效液相色谱仪、TUS-200P恒温振荡金属浴,美国Thermo scientific公司;TC-96/G/H(b)B基因扩增仪,杭州博日科技有限公司;Sigma-1-14K低温离心机,Sigma(德国)公司;DK-8D电热恒温水箱,上海精密设备有限公司;ZQZY-88C振荡培养箱,上海知楚仪器;Tanon 1600凝胶成像仪,南京麦高德生物科技有限公司;UV-1000紫外分光光度计,翱艺仪器(上海)有限公司;LDZX-75L-I立式压力蒸汽灭菌器,上海申安医疗器械厂;GC-2010 PLUS气相色谱质谱联用仪,日本岛津公司;NanoDrop One 7500 2720 qubit4DNA浓度测定仪,Gene Company Limited。
1.2 方法
1.2.1 遗传操作方法
首先,利用Casdesigner设计引物,然后PCR各个模板得到指定片段组成基因表达盒。该基因表达盒包含启动子、目标基因序列、终止子和2个1 kb的侧翼同源区。其中,1 kb的侧翼同源区域能够精确地靶向基因组中的特定位点,并与针对目标基因的Cas9/gRNA质粒(pCUT)转化进酵母细胞。
1.2.2 感受态的制备和转化
先在30 ℃、200 r/min的2倍浓度YPD 培养基中接种新鲜隔夜培养的酵母细胞,培养至OD600值达到 0.2,再继续同等条件下培养至OD600值到1.0;接下来通过8 000 r/min 离心5 min培养液采集细胞沉淀5 mL,用2.5 mL无菌水洗涤细胞沉淀,反复2次,确保除去培养基;然后在含有供体DNA片段(2 μg)和pCUT质粒(0.25 ng)的50 μL去离子水中,重新悬洗细胞沉淀,再将这种重悬液加入到转化反应液中。反应液中含有 260 μL 50%的聚乙二醇3350、36 μL 1 mol/L LiAc、10 μL 单链DNA和4 μL的无菌水,充分混合后放置于 42 ℃温育40 min;温育后6 000 r/min离心1 min,收集细胞沉淀重悬于500 μL无菌水内;最后,在SC-URA选择性琼脂平板上,取100 μL重悬液均匀涂布,在温度为30 ℃的恒温培养箱内平板培养3~5 d,直至形成可见菌落;在消除质粒后,通过测序验证结果,挑出正确菌落。
1.2.3 重组菌株发酵实验
在10 mL YPD培养基中接种平板上活化得到的单克隆重组菌株,30 ℃、200 r/min培养24 h;然后在初始菌体浓度OD600值为0.2时转接到50 mL YPD培养基中,同等条件下连续培养24 h;之后离心收集细胞转入50 mL YPG培养基;在发酵过程中,每24 h取样1次,连续发酵96 h。
1.2.4 重组菌株产物的提取
将1.5 mL培养物以12 000 r/min离心2 min,收集上清液并将其重新悬浮在1.5 mL乙醚中,然后通过涡流混合10 min,以提取细胞外孕烯醇酮。通过12 000 r/min离心1 min收集乙酸醚相,然后干燥。同时,将收集的细胞用1 mL去离子水洗涤2次,然后悬浮在1 mL 3 mol/L HCl溶液中煮沸10 min。之后,将细胞样品以12 000 r/min离心1 min。用1 mL 去离子水洗涤细胞碎片,再悬浮在300 μL 200 g/L KOH-甲醇溶液,并在60 ℃皂化6 h。然后将300 μL正己烷加入管中,10 min涡流提取孕烯醇酮。离心后,收集正己烷相,并用离心真空蒸发器干燥。用100 μL BSTFA在30 ℃下进行4 h衍生化干燥样品。
1.2.5 产物的含量测定
在进行GC-MS分析前,每个样品用100 μL己烷稀释。GC-MS仪(带有岛津GCMS-QP2020检测器的岛津GC-2010 PLUS)与岛津SH-Rxi-5Sil MS柱一起使用。喷油器温度为290 ℃。柱温最初保持在70 ℃下1 min,然后在30 ℃/min的温度梯度下升高到250 ℃并保持在250 ℃下2 min,随后在20 ℃/min温度梯度下升至280 ℃,最后在280 ℃下保持20 min,分离比为50∶1。
2 结果和分析
2.1 合成孕烯醇酮细胞工厂的构建
2.1.1 单加氧酶CYP11A1生物多样性分析
CYP11A1属于细胞色素P450单加氧酶家族,在类固醇类生物合成中起关键作用,主要通过催化胆固醇侧链羟基化和裂解作用生成孕烯醇酮。作为大部分类固醇激素的前体物质,孕烯醇酮在生物体内的地位举足轻重。CYP11A1催化的反应过程中包含3个连续的氧化步骤:首先是将胆固醇C22位羟基化,随后,胆固醇C20位发生羟基化反应,形成20R, 22R-二羟基胆固醇。该中间产物在C20和C22位之间发生裂解,生成孕烯醇酮,同时产生副产物4-甲基戊醛。从反应机制来看,这一过程的最终产物分子中插入了一个氧原子,而另一个氧原子则被还原为水。整个电子传递系统依赖于NADPH提供的电子,这些电子通过一个由黄素蛋白FDXR(即肾上腺铁氧还蛋白还原酶)与非血红素铁硫蛋白FDX1或FDX2(即肾上腺铁氧还蛋白)共同形成的一个双蛋白质复合体在线粒体内完成转移。
通过多样物种来源的酶筛选是扩大酵母细胞异源表达的常用策略。而不同物种的CYP11A1有着不同的氨基酸序列和蛋白质结构,可能导致密码子偏好性和底物结合能力不同,影响所催化目标产物的前体物质菜油甾醇的侧链裂解反应。因此不同物种CYP11A1的酶活性和表达水平不一样,影响酿酒酵母合成孕烯醇酮的能力。据报道,野猪(Sus scrofa)来源的CYP11A1是目前产量最高的孕烯醇酮外源合成酶。以SsCYP11A1为模板进行生物信息学分析及同源比对(图2)。最后,选择了相似度较高的河马(Hippopotamus amphibius kiboko)(同源性91.48%)、家牛(Bos taurus)(同源性85.06%)、短尾猫(Lynx rufus)(同源性84.20%)、亚洲黑熊(Ursus thibetanus japonicus)(同源性85.65%)、抹香鲸(Physeter macrocephalus)(同源性92.10%)和羚牛(Budorcas taxicolor)(同源性84.82%)的7种不同物种来源的CYP11A1进行实验。
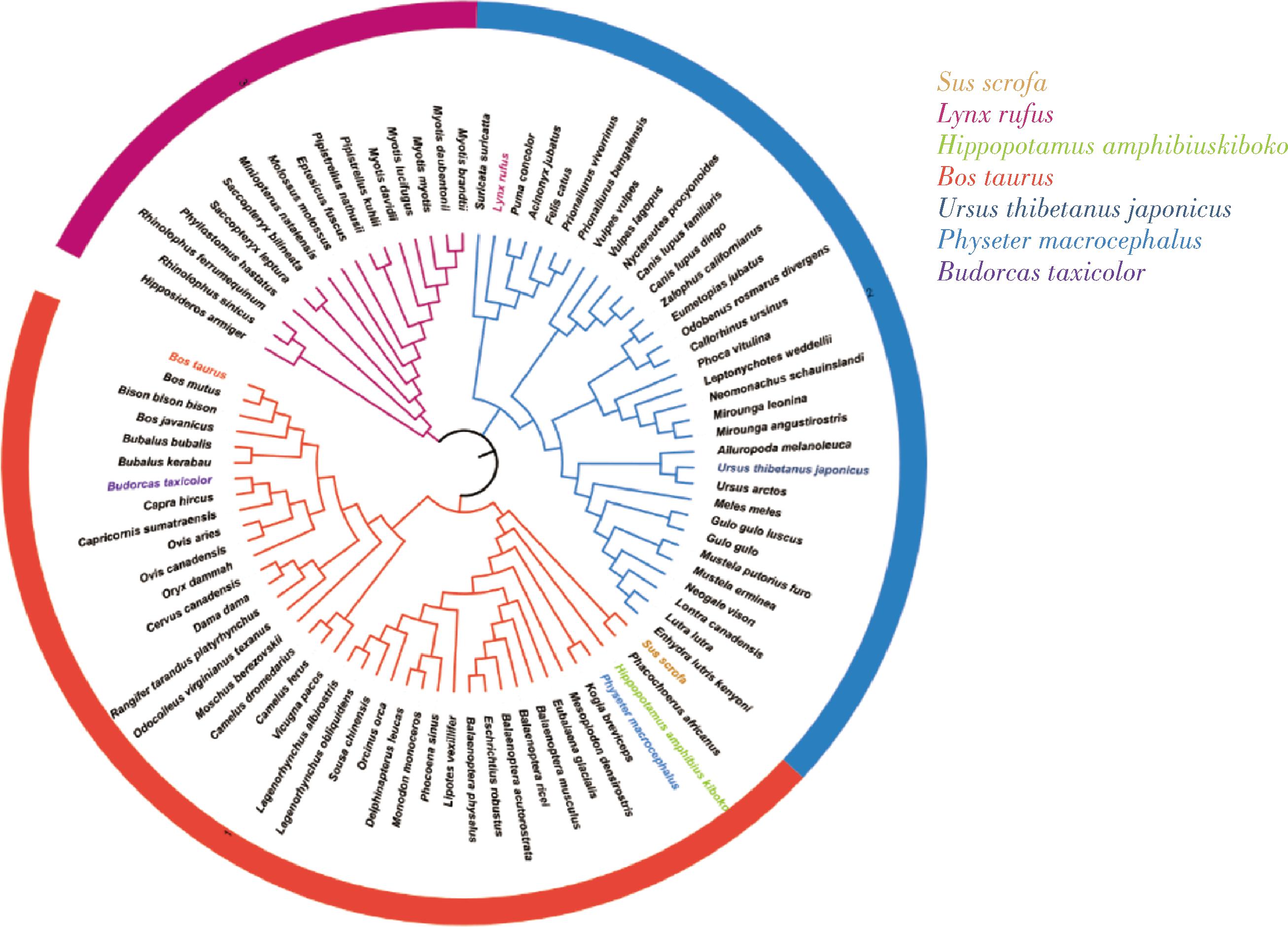
图2 不同来源的CYP11A1进化树
Fig.2 Evolutionary tree of CYP11A1 from diverse sources
2.1.2 孕烯醇酮合成途径的构建
作为一种直接的前体物质,在酿酒酵母孕烯醇酮合成途径中,菜油甾醇在生物合成类甾醇中发挥关键作用。鉴于其在代谢路径中的地位,本研究选择了一株高效生产菜油甾醇的酵母菌株Zw523作为实验的基础菌株。[7]。重组菌株以酿酒酵母GTy23为基础,通过敲除ERG5基因,插入外源基因DHCR7,从而消除麦角甾类的分支途径,奠定了高水平合成孕烯醇酮的基础。在酿酒酵母基因组中使用CRISPR/Cas9基因编辑系统技术来整合目的基因,选择了携带表达Cas9蛋白基因和靶向相应位点sgRNA的pCUT-607b质粒,确保了基因编辑的高效性和精确性。首先,将来自家牛(B. taurus)的AdX和AdR基因结合不同的启动子和不同来源按照酿酒母密码子偏好性优化的CYP11A1 (按照SsCYP11A1、HakCYP11A1、BtCYP11A1、LrCYP11A1、UtjCYP11A1、PmCYP11A1、BtlCYP11A1次序) 融合成一个片段后,再把基因表达盒整合到菌株Zw523的607b位点,最后获得生产孕烯醇酮的重组菌株。YPG摇瓶发酵验证后,含有LrCYP11A1的菌株CP604表现最高的孕烯醇酮产量,为64 μg/L。其次是含有PmCYP11A1的CP606菌株,孕烯醇酮产量为41 μg/L(图3)。最终,选择了经过上述改造的菌株CP604进行后续实验。
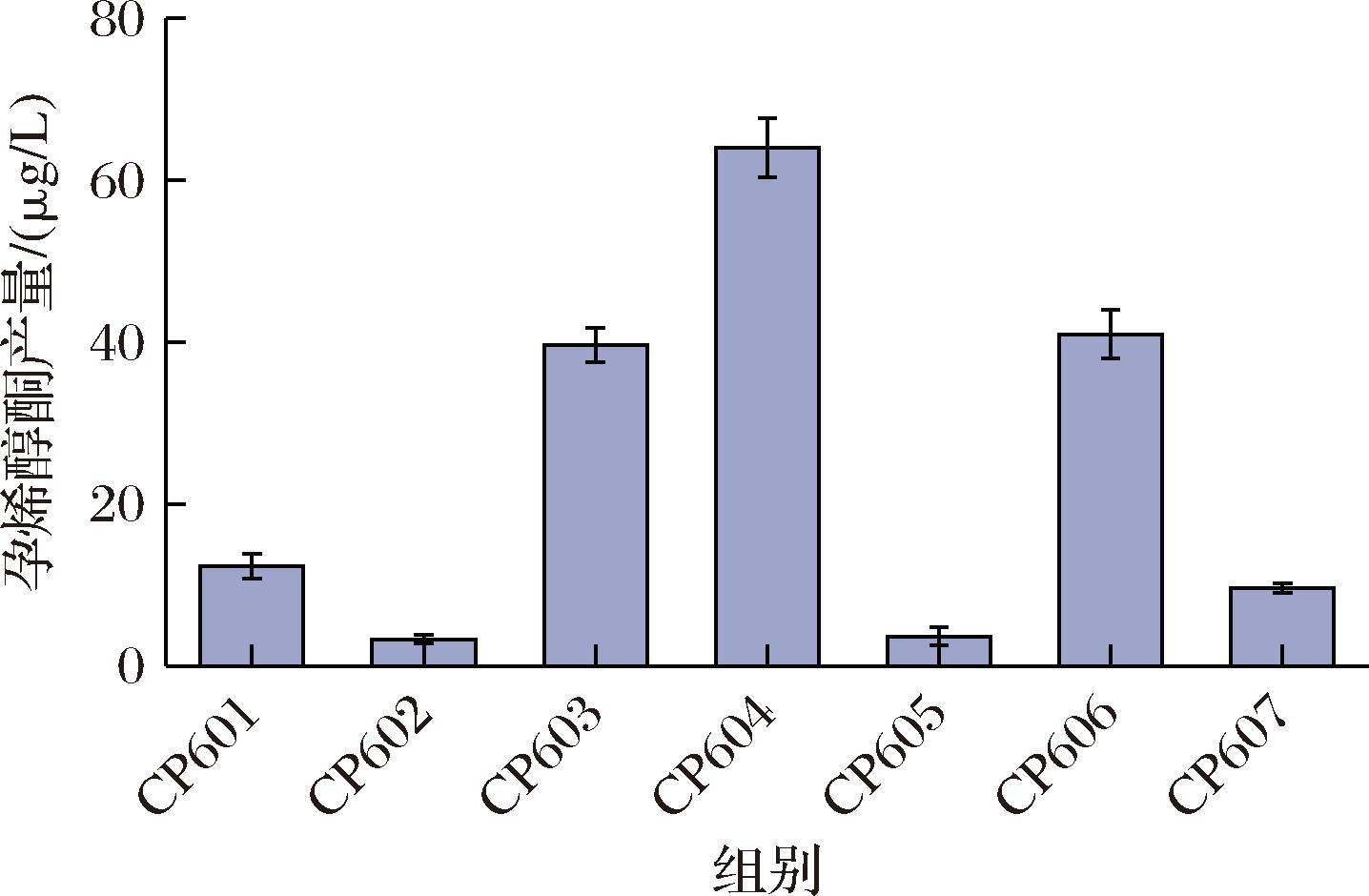
图3 不同物种来源CYP11A1的孕烯醇酮产量
Fig.3 Pregnenolone production by CYP11A1from different species
2.2 不同策略提高酿酒酵母的孕烯醇酮产量
2.2.1 氧化还原伴侣AdX/AdR的筛选
在构建好孕烯醇酮生产菌并筛选出最佳CYP11A1后,继续进行P450 scc系统氧化还原伴侣的筛选。选择家牛(B. taurus)、解脂耶氏酵母(Y.lipolytica)、拟南芥(A.thaliana)和智人(H.sapiens)的氧化还原伴侣AdX/AdR。上述基因按照酿酒酵母密码子偏好性进行优化。整合不同来源的AdX/AdR后,YPG摇瓶发酵结果显示整合解脂耶氏酵母(Y.lipolytica)AdX/AdR的菌株CP605产量最高,为183 μg/L。除此之外其他组合产量都有增加,整合家牛(B. taurus)的AdX/AdR基因的菌株CP604的产量最少仅为64 μg/L。而来自拟南芥(A.thaliana)和智人(H.sapiens)的AdX/AdR的孕烯醇酮产量为84 μg/L和142 μg/L(图4)。因此,认为酿酒酵母生产孕烯醇酮的P450 scc系统最佳组合是短尾猫(L. rufus)来源的单加氧酶CYP11A1和解脂耶氏酵母(Y.lipolytica)来源的电子传递链AdX/AdR。
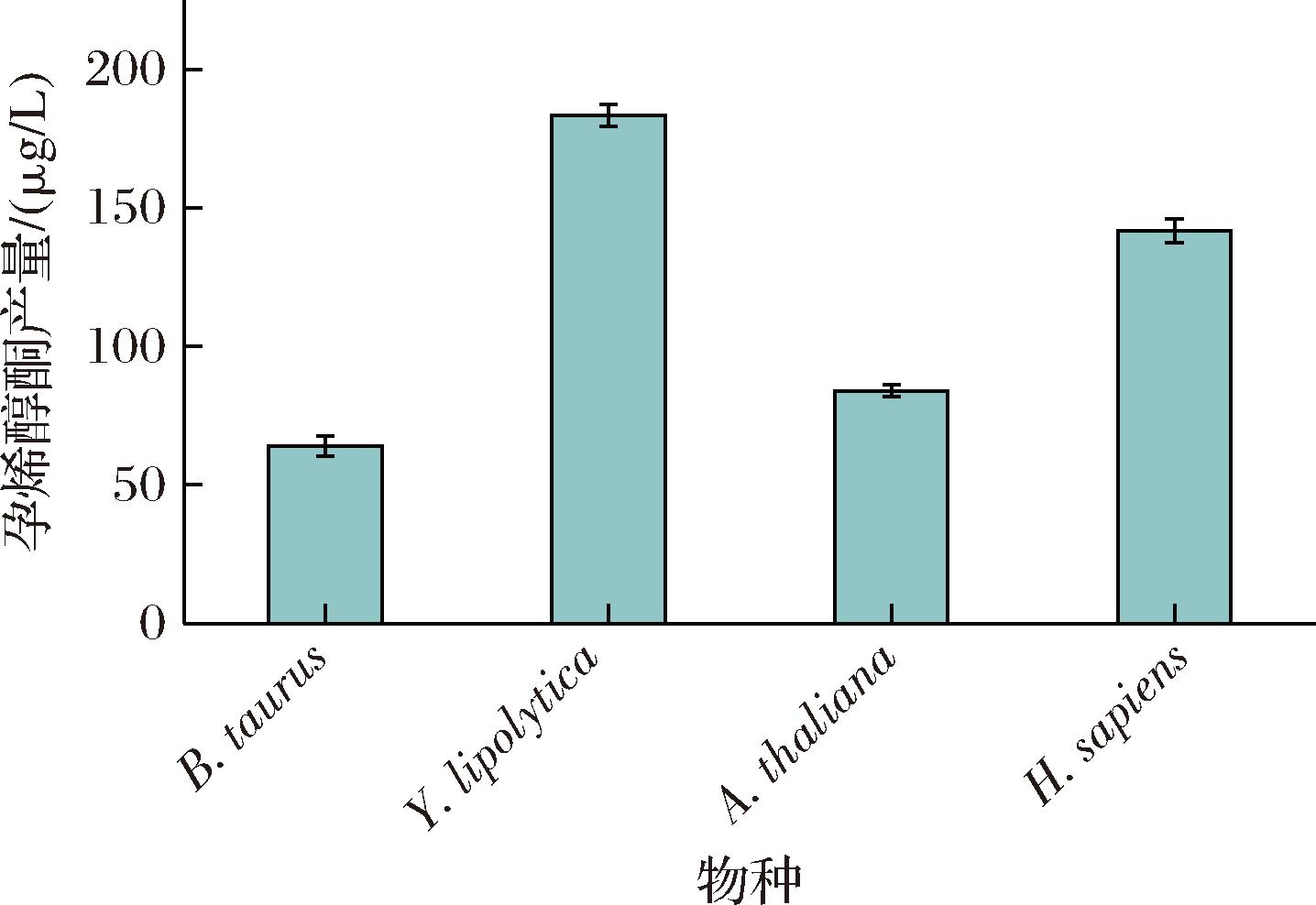
图4 不同物种来源AdX/AdR的孕烯醇酮产量
Fig.4 Pregnenolone production by AdX/AdRfrom different species
2.2.2 通过启动子筛选增加孕烯醇酮的产量
启动子是控制基因表达的关键元件,不同的启动子类型会导致转录强度的不同,进而影响目标基因的表达量。选取了8种酿酒酵母强启动子PGK1p、GPM1p、TDH3p、TEF1p、TPI1p、GPD1p、ACT1p和TDH2p,结合LrCYP11A1基因,精确调控LrCYP11A1的相对表达水平。通过荧光定量 PCR 技术检测各组合的转录水平,显示LrCYP11A1在原始诱导型启动子GAL10p的控制下,呈现极低的转录水平。相比之下,在强启动子TEF1p控制下,CYP11A1的转录水平提升很大,菌株CP614的孕烯醇酮产量达到12.28 mg/L,产量比对照菌株CP605(GAL10P启动子控制) 的CYP11A1基因表达量提高68.2倍。YPG摇瓶发酵的结果也显示,LrCYP11A1的转录水平与孕烯醇酮产量呈正相关。此外,菌株CP612和菌株CP615的孕烯醇酮产量也分别比对照菌株提高47.9 倍和40.7 倍(图5)。最终菌株CP614被选用于后续的实验。
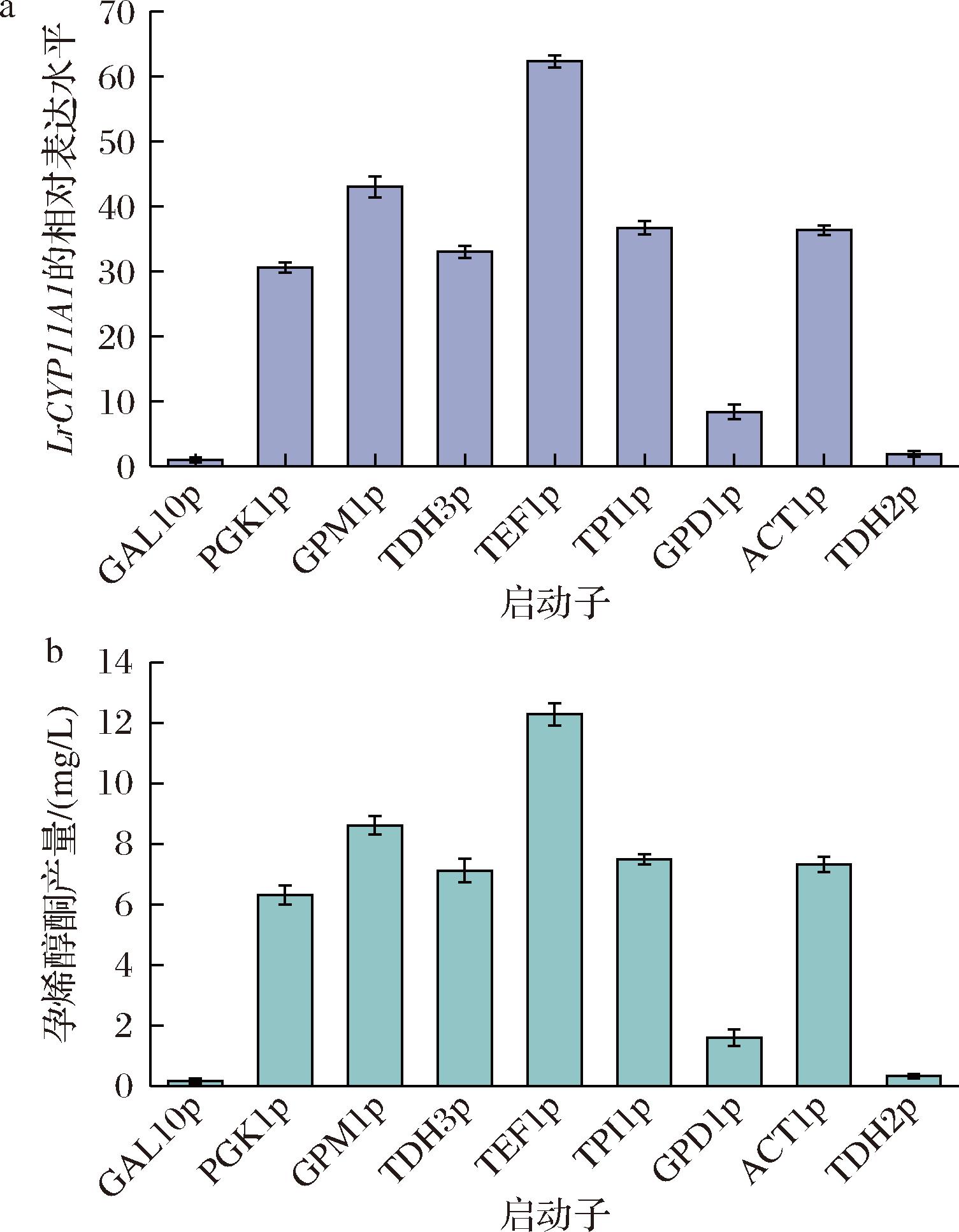
a-LrCYP11A1基因的相对表达量;b-孕烯醇酮产量
图5 不同启动子的影响
Fig.5 Effects of different promoters
2.2.3 增强酿酒酵母孕烯醇酮合成途径的前体供应
由于酿酒酵母甾醇途径下游物质的产量较低且结构高度相似,选择性表达一些ERG基因以增强孕烯醇酮的前体供应。根据报道,ERG1和ERG11是角鲨烯下游代谢的关键酶[24],同时还选择ERG7和靠近孕烯醇酮前体途径的ERG2和ERG3。在菌株CP614上过表达ERG1得到重组菌株CP619,在菌株CP619基础上过表达ERG7得到菌株CP620,以此类推过表达ERG11、ERG2和ERG3得到菌株CP621、CP622和CP623。摇瓶发酵96 h后孕烯醇酮的产量分别是18.96、21.15、31.34、38.75、34.54 mg/L(图6)。除了过表达ERG3导致孕烯醇酮产量下降外,其他ERG基因的过表达均显著提高了孕烯醇酮的产量。ERG3的过表达可能使代谢流转向其他甾醇合成途径,从而减少了孕烯醇酮的生成。基于上述结果,选择菌株CP622进行后续的发酵优化。
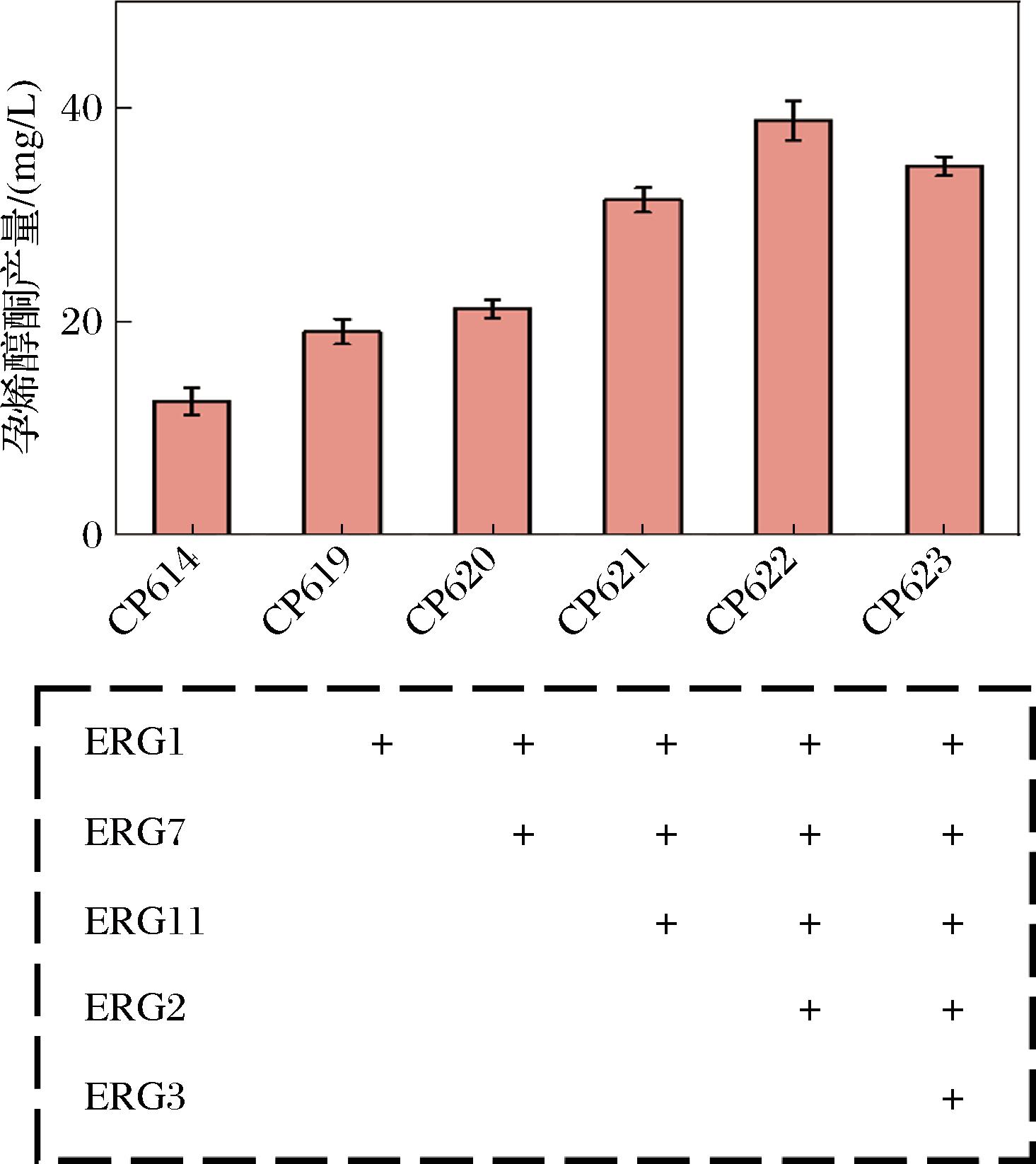
图6 过表达不同ERG基因孕烯醇酮的产量
Fig.6 Effects of overexpressing different ERG genes on pregnenolone production
2.3 重组酿酒酵母CP622的高密度发酵
采用补料批量发酵策略进行菌株CP622高细胞密度发酵,反应在5 L生物发酵罐内进行。整个发酵过程分为2个阶段:第一阶段,以50 g/L葡萄糖为初始碳源,30 h后葡萄糖几乎完全消耗;接着进入第二阶段,加入半乳糖,诱导菌株内源酶表达MVA途径,促使孕烯醇酮在葡萄糖耗尽后合成。在半乳糖添加后,持续补充补料培养基,并在每24 h半乳糖接近耗尽时进行补加,以维持发酵体系的稳定性和高效性。最终经过120 h的连续发酵,重组菌株CP622的孕烯醇酮产量达到116.43 mg/L,收率为0.11%(以葡萄糖和半乳糖的原料总量计算),生产速率为0.97 mg/(L·h)(图7)。与先前研究相比,本研究为目前微生物法生产孕烯醇酮的最高产量,对比见表3。
表3 目前国内外微生物法生产孕烯醇酮研究对比
Table 3 Comparative study on microbial production of pregnenolone in domestic and international research
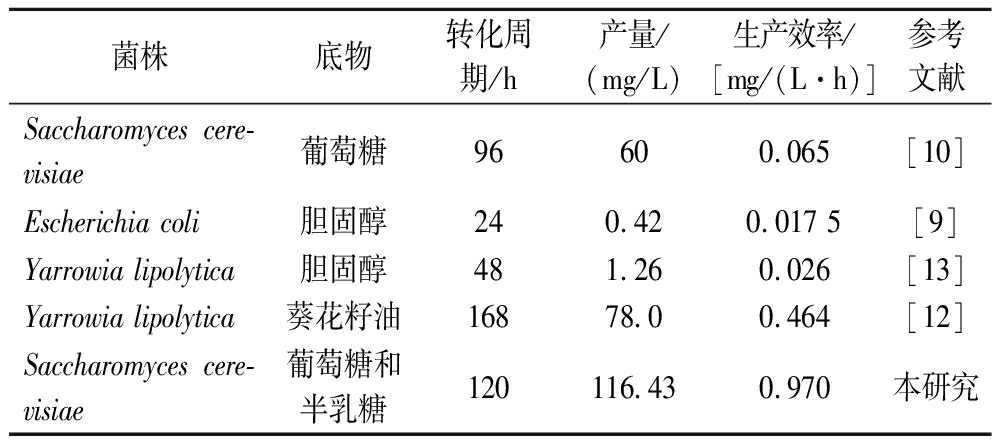
菌株底物转化周期/h产量/(mg/L)生产效率/[mg/(L·h)]参考文献Saccharomyces cere-visiae葡萄糖96600.065[10]Escherichia coli胆固醇240.420.017 5[9]Yarrowia lipolytica胆固醇481.260.026[13]Yarrowia lipolytica葵花籽油16878.00.464[12]Saccharomyces cere-visiae葡萄糖和半乳糖120116.430.970本研究
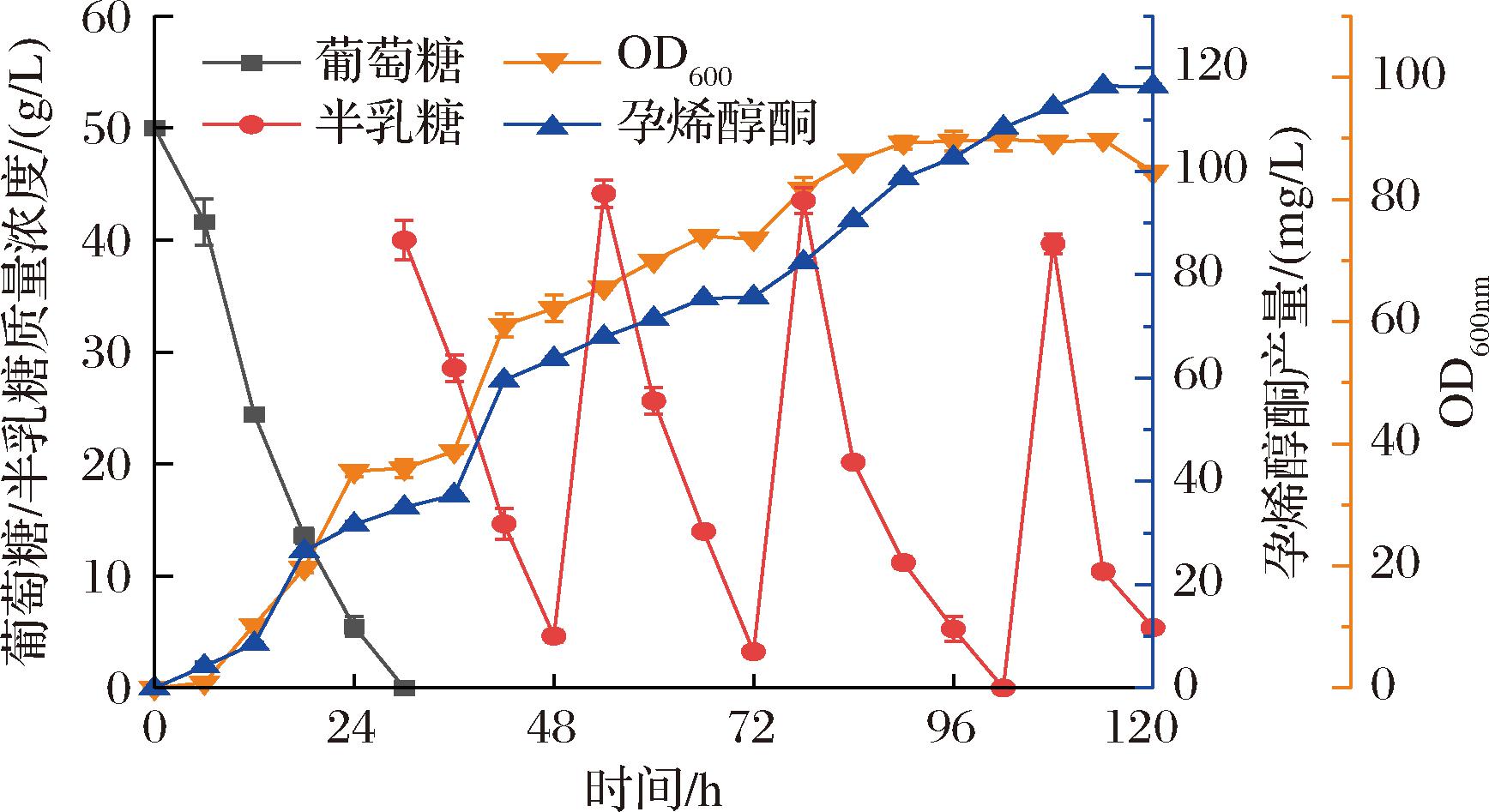
图7 重组酿酒酵母CP622的分批补料发酵
Fig.7 Fed-batch fermentation of recombinantS. cerevisiae CP622
3 讨论
目前孕烯醇酮主要通过化学合成法制取,污染环境效率低。本研究采用常见的模式微生物酿酒酵母作为底盘细胞,通过生物信息学检索,整合不同来源的7种CYP11A1和4种AdR/AdX组合搭配的P450 scc系统,选出最佳组合短尾猫(L. rufus)来源的CYP11A1和解脂耶氏酵母(Y.lipolytica)来源的AdR/AdX,重组菌株CP605孕烯醇酮产量为183 μg/L。
在初始的启动子GAL10p中单加氧酶CYP11A1显示较差的表达水平,于是为提升孕烯醇酮产量进行启动子筛选,选择8种酿酒酵母强启动子替换原本的诱导型启动子GAL10p。通过摇瓶发酵以及荧光定量PCR分析,确定TEF1p表达水平最高,菌株CP614的孕烯醇酮产量达到12.28 mg/L。为了进一步提高孕烯醇酮产量,强化了甾醇合成途径以提供更多的前体。通过选择性过表达了孕烯醇酮前体供应的关键酶ERG1、ERG11、ERG7和ERG2,构建出孕烯醇酮工程菌株CP622,产量达到38.75 mg/L。最终,通过5 L发酵罐对工程菌株CP622进行分批补料发酵,孕烯醇酮的产量达到了116.43 mg/L。
考虑到甾体化合物对微生物细胞有一定的毒性,可能会抑制细胞生长并影响生产效率,可以采用区室化表达、添加表面活性剂等策略来缓解甾体化合物对细胞的毒性作用,进一步提高酿酒酵母合成甾体化合物的产量。综上本研究成功构建了一株高效合成孕烯醇酮的酿酒酵母重组菌株CP622,该菌株为后续甾体药物的生物合成提供了前体物质,同时也为甾体化合物的生物合成机制研究提供了理论依据。
[1] 王钰, 武陶, 樊旭倩, 等.酵母甾醇转运蛋白研究进展[J].生物工程学报, 2023, 39(8):3204-3218.WANG Y, WU T, FAN X Q, et al.Sterol transport proteins in yeast:A review[J].Chinese Journal of Biotechnology, 2023, 39(8):3204-3218.
[2] DAHLIN P, RUTHES A C.Loss of sterol biosynthesis in economically important plant pests and pathogens:A review of a potential target for pest control[J].Biomolecules, 2024, 14(11):1435.
[3] GIRARDI PIVA G, CASALTA E, LEGRAS J L, et al.Characterization and role of sterols in Saccharomyces cerevisiae during white wine alcoholic fermentation[J].Fermentation, 2022, 8(2):90.
[4] WINKLER M B L, NEL L, FRAIN K M, et al.Sterol uptake by the NPC system in eukaryotes:A Saccharomyces cerevisiae perspective[J].FEBS Letters, 2022, 596(2):160-179.
[5] NES W D, CHAUDHURI M, LEAVER D J.Druggable sterol metabolizing enzymes in infectious diseases:Cell targets to therapeutic leads[J].Biomolecules, 2024, 14(3):249.
[6] DER C, COURTY P E, RECORBET G, et al.Sterols, pleiotropic players in plant-microbe interactions[J].Trends in Plant Science, 2024, 29(5):524-534.
[7] 周武林, 高惠芳, 吴玉玲, 等.重组酿酒酵母生物合成菜油甾醇[J].化工学报, 2021, 72(8):4314-4324.ZHOU W L, GAO H F, WU Y L, et al.Engineering of Saccharomyces cerevisiae for biosynthesis of campesterol[J].CIESC Journal, 2021, 72(8):4314-4324.
[8] 张羽. 菜油甾醇和孕烯醇酮在耶氏解脂酵母中的合成与优化[D].天津:天津大学, 2017.ZHANG YU. De novo synthesis and optimization of campesterol and pregnenolone in Yarrowia lipolytica[D].Tianjin:Tianjin University, 2017.
[9] MAKEEVA D S, DOVBNYA D V, DONOVA M V, et al.Functional reconstruction of bovine P450 scc steroidogenic system in Escherichia coli[J].American Journal of Molecular Biology, 2013, 3(4):173-182.
[10] DUPORT C, SPAGNOLI R, DEGRYSE E, et al.Self-sufficient biosynthesis of pregnenolone and progesterone in engineered yeast[J].Nature Biotechnology, 1998, 16(2):186-189.
[11] SZCZEBARA F M, CHANDELIER C, VILLERET C, et al.Total biosynthesis of hydrocortisone from a simple carbon source in yeast[J].Nature Biotechnology, 2003, 21(2):143-149.
[12] ZHANG R S, ZHANG Y, WANG Y, et al.Pregnenolone overproduction in Yarrowia lipolytica by integrative components pairing of the cytochrome P450 scc system[J].ACS Synthetic Biology, 2019, 8(12):2666-2678.
[13] MAUERSBERGER S, NOVIKOVA L A, SHKUMATOV V M.Cytochrome P450 expression in Yarrowia lipolytica and its use in steroid biotransformation[M].Yarrowia lipolytica:Biotechnological Applications.Berlin, Heidelberg:Springer Berlin Heidelberg, 2013:171-226.
[14] MALHOTRA K, FRANKE J.Cytochrome P450 monooxygenase-mediated tailoring of triterpenoids and steroids in plants[J].Beilstein Journal of Organic Chemistry, 2022, 18:1289-1310.
[15] HU B D, ZHAO X R, WANG E D, et al.Efficient heterologous expression of cytochrome P450 enzymes in microorganisms for the biosynthesis of natural products[J].Critical Reviews in Biotechnology, 2023, 43(2):227-241.
[16] JIA Y P, ZHANG Q Y, DAI J, et al.Ergosterol supplementation improves furfural tolerance of Saccharomyces cerevisiae to produce ethanol and its underlying mechanism[J].BioResources, 2023, 18(1):228-246.
[17] VISHWAKARMA M, HAIDER T, SONI V.Update on fungal lipid biosynthesis inhibitors as antifungal agents[J].Microbiological Research, 2024, 278:127517.
[18] HU Z H, HE B, MA L, et al.Recent advances in ergosterol biosynthesis and regulation mechanisms in Saccharomyces cerevisiae[J].Indian Journal of Microbiology, 2017, 57(3):270-277.
[19] JACQUIER N, SCHNEITER R.Mechanisms of sterol uptake and transport in yeast[J].The Journal of Steroid Biochemistry and Molecular Biology, 2012, 129(1-2):70-78.
[20] HARIKRISHNA J A, BLACK S M, SZKLARZ G D, et al.Construction and function of fusion enzymes of the human cytochrome P450 scc system[J].DNA and Cell Biology, 1993, 12(5):371-379.
[21] VINOGRADOVA A A, LUZIKOV V N, NOVIKOVA L A.Comparative study of topogenesis of cytochrome P450 scc (CYP11A1) and its hybrids with adrenodoxin expressed in Escherichia coli cells[J].Biochemistry (Moscow), 2007, 72(2):208-214.
[22] VARGHESE R, BURAGOHAIN T, BANERJEE I, et al.The apocarotenoid production in microbial biofactories:An overview[J].Journal of Biotechnology, 2023, 374:5-16.
[23] REIDER APEL A, D’ESPAUX L, WEHRS M, et al.A Cas9-based toolkit to program gene expression in Saccharomyces cerevisiae[J].Nucleic Acids Research, 2017, 45(1):496-508.
[24] QIN Z J, ZHANG Y L, LIU S, et al.Combining metabolic engineering and lipid droplet assembly to achieve campesterol overproduction in Saccharomyces cerevisiae[J].Journal of Agricultural and Food Chemistry, 2024, 72(9):4814-4824.