急性酒精中毒(acute alcoholism,AAH)是由单次过量摄入酒精引发的一种病理状态,其典型表现包括头晕、恶心、呕吐、甚至昏迷,通常伴随肝脏和肠胃等多器官的损伤,对个体健康构成严重威胁[1]。随着生活水平的提升及饮酒习惯的转变,AAH的发病率显著上升,已成为继心血管疾病和肿瘤之后的全球第三大公共卫生挑战[2]。肝脏作为乙醇代谢的主要器官,酒精性肝病是AAH的常见临床表现[3]。研究揭示,酒精引起肝损伤的主要机制包括氧化应激和脂质过氧化反应,酒精能够削弱机体的抗氧化能力,并诱发肝脏脂质过氧化,从而导致肝细胞损伤。
近年来,植物多糖因其高安全性和无副作用的特性,受到广泛关注,因此许多研究开始集中于其在缓解酒精中毒方面的功效。研究发现,沙棘叶多糖、山药多糖、魔芋葡甘聚糖(konjac glucomannan,KGM)、桃胶多糖等都具有一定的解酒功效[4]。其中KGM已被证明具有较好解酒功效[5-7],并能减轻酒精引起的大脑、肝脏及胃部损伤。但由于其相对分子质量大,水溶液黏度高,加工和应用受限。研究高效降低KGM溶液黏度的方法,并探索其在解酒产品中的潜在应用,成为了一个迫切需要解决的问题。目前鲜有研究报道低黏魔芋葡甘聚糖(low-viscosity konjac glucomannan,LVKGM)的解酒功效。
本研究探究LVKGM对急性酒精中毒小鼠的解酒作用,以KGM为阳性对照,通过行为学观察、生化指标测定、病理学检查探讨评估其解酒及抗醉效果,并初步揭示其潜在机制。该研究旨在为魔芋粉的增值利用及相关预防和缓解酒精毒性产品的开发应用提供试验基础和科学依据。
1 材料与方法
1.1 动物、材料与试剂
雄性C57BL/6小鼠由湖南斯莱克景达试验动物有限公司提供,体质量20~24 g,生产许可证号:SCXK(湘)2019-0004。
珠芽魔芋粉(葡甘聚糖含量≥84%,干基计),四川沐川森态源生物科技有限公司提供;30%(体积分数,下同)H2O2,食品级,重庆跃翔化工有限公司;无水乙醇,食品级,重庆市钛新化工有限公司;白酒(乙醇体积分数56%),北京红星股份有限公司;40 g/L多聚甲醛,广州硕谱生物科技有限公司;乙醇脱氢酶(alcoholdehydrogenase,ADH)测试盒、乙醛脱氢酶(acetaldehyde dehydrogenase,ALDH)测试盒、谷丙转氨酶(alanine aminotransferase,ALT)测试盒、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)测试盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)测试盒、总超氧化物歧化酶(superoxide dismutase,SOD)、TNF-α测试盒、IL测试盒,南京建成生物工程研究所。
1.2 仪器与设备
SX-500高压灭菌锅,日本TOMY公司;SQP电子分析天平,赛多利斯科学仪器有限公司;5804R冷冻离心机,德国Eppendorf公司;UV5100紫外可见光分光光度计,上海元析仪器有限公司;TU-1900酶标仪,美国伯腾仪器有限公司;HD-650超净工作台,上海沪净医疗器械有限公司;9720气相色谱仪,浙江福立分析仪器股份有限公司。
1.3 实验方法
1.3.1 LVKGM的制备
参照实验室前期方法制备[8]。称取20.00 g珠芽魔芋粉,以液料比0.75∶1(mL∶g)均匀喷洒加入3%的H2O2溶液,快速搅拌均匀,于700 W条件下微波处理3 min。待反应结束后,将反应产物加入到体积分数为50%乙醇溶液搅匀并静置沉淀,所得沉淀物置于40 ℃真空干燥箱干燥,干燥物经粉碎过100目筛得到的粉末即为LVKGM,密封,于阴凉、干燥处存放待用。经测定该制备方法下低黏魔芋粉黏度为(53.33±5.77) mPa·s,较未处理魔芋粉降低99.16%。
1.3.2 急性酒精中毒小鼠AAH模型建立
60只雄性小鼠,随机分为6组,分别命名为空白(NC)组,模型(AM)组,LVKGM低剂量(L-LVKGM)组(332 mg/kg)、中剂量(M-LVKGM)组(664 mg/kg)、高剂量(H-LVKGM)组(996 mg/kg),KGM阳性(PC)组(332 mg/kg),根据小鼠体重给药。试验前,对小鼠进行禁食不禁水处理12 h,然后对LVKGM不同剂量组分别以0.2 mL/10 g体重灌胃不同剂量低黏度的LVKGM,对PC组灌胃等体积高黏度的KGM,NC组和AM组灌胃等体积生理盐水。30 min后,除NC组给予等量生理盐水外,其他5组均按照0.14 mL/10 g体重灌胃白酒以建立AAH模型。所有动物实验均在西南大学药学院SPF级动物试验室[中国重庆,SYXK(渝)2020-0006]进行,实验全程在西南大学实验动物伦理审查委员会的监督下进行,伦理编号为IACUU-20231115-01。
1.3.3 小鼠酒后状态和行为学观察
灌胃酒精后立即将小鼠放在垂直的金属网上,观察各组小鼠活动情况,记录攀附时间。同时记录小鼠翻正反射消失/恢复时间,计算醉酒潜伏时间、睡眠时间、醒酒时间。
1.3.4 组织样本采集与处理
行为学数据测定后,所有动物禁食12 h,吸入乙醚进行麻醉。通过摘除眼球采集血液,然后颈椎脱臼处死小鼠。将胃、肝脏和大肠取出,用预冷的生理盐水冲洗干净并称重。部分肝脏和胃组织立即用4%多聚甲醛固定,以便进行组织学分析。剩余部分及盲肠样本用液氮冷冻,并保存在-80 ℃以备进一步分析。收集的血液于4 ℃、3 000 r/min离心15 min得到血清,保存至4 ℃冰箱待用。
1.3.5 血清生化参数测定
使用试剂盒检测血清中AST、ALT、TNF-α和IL-1β水平。并在波长450 nm处使用酶标仪测定吸光度。根据试剂盒提供的标准曲线和计算公式,计算各样品中AST、ALT、TNF-α和IL-1β的浓度。
1.3.6 肝组织酶活力测定
将肝脏组织在4 ℃预冷的生理盐水中冲洗干净,剪取适量肝脏组织,用滤纸轻拭干水分,加入9倍体积的生理盐水进行匀浆离心,严格按照相应试剂盒操作,检测肝脏组织中ADH、ALDH、SOD、GSH-Px的活性。
1.3.7 组织切片病理学分析
参照XIE等[9]的方法,将新鲜的小鼠胃、肝脏在浸泡在40 g/L多聚甲醛中48 h固定,直至进一步处理。经脱水、包埋、切片及苏木精-伊红(hematoxylin-eosin staining,HE)染色处理后,使用光学显微镜在不同放大倍数(100×、200×、400×)下观察各组小鼠胃和肝脏的组织形态。
1.3.8 结肠短链脂肪酸(short-chain fatty acids,SCFAs)
准确称取0.1 g结肠内容物,放入1.5 mL离心管中,然后加入0.6 mL纯水。使用组织破碎仪在60 Hz条件下破碎30 s,此步骤重复3~5次,直至无大颗粒。4 ℃条件下静置20 min后,然后在4 ℃条件下以5 000 r/min离心20 min,小心吸取0.5 mL上清液,向上清液中分别加入0.5 mL体积分数为50%乙醇,3 μL浓盐酸,涡旋振荡3 min,接着,将混合液以40 W的功率进行超声波处理20 min,处理后再次以5 000 r/min离心20 min,取上清液过0.22 μm有机滤膜,经气相色谱测定SCFAs含量。以乙酸、丙酸、丁酸标准品绘制标准曲线。气相色谱条件如下:DB-FFAP气相色谱柱,进样口温度200 ℃,离子源温度220 ℃,传输线温度250 ℃。升温程序:起始温度30 ℃,保持3.5 min;以5 ℃/min升温至40 ℃;以15 ℃/min升温至150 ℃;以30 ℃/min升温至280 ℃,保持15 min。载气为N2,流速1.0 mL/min,注射的标准SCFA和样品进样量1 μL。总SCFAs含量为乙酸、丙酸、丁酸含量的总和。
1.3.9 盲肠微生物分析
委托广州基迪奥生物科技有限公司从样本中提取基因组DNA后,用带有barcode的特异引物扩增细菌16S rDNA的V3~V4区。引物序列为341F:CCTACGGGNGGCWGCAG;806R:GGACTACHVGGGTATCTAAT。将纯化后的扩增产物(扩增子)连接测序接头,构建测序文库,Illumina上机测序,进行微生物多样性分析。
1.4 数据处理
实验结果用“平均值±标准偏差”表示,采用Excel 2019、SPSS 22软件进行数据处理,采用Origin 2018分析作图。通过Duncan法进行显著性分析,P<0.05为显著性差异。
2 结果与分析
2.1 LVKGM对AAH小鼠酒后行为的影响
表1显示了LVKGM和KGM对AAH小鼠攀附时间和醉酒时间的影响。NC组的攀附时间显著较长,表明NC组未受到酒精中毒的影响。L-LVKGM组小鼠攀附时间与AM组相比无显著差异,而M-LVKGM、H-LVKGM组小鼠攀附时间显著延长(P<0.05),说明LVKGM在一定剂量下能有效延长小鼠的攀附时间,可能是其覆盖在消化系统表面延缓其对酒精的吸收,和KGM同样具备抗醉的潜在效能[7]。
表1 LVKGM对AAH小鼠攀附时间和醉酒时间的影响
Table 1 Effect of LVKGM on climbing time and duration of intoxication in AAH mice
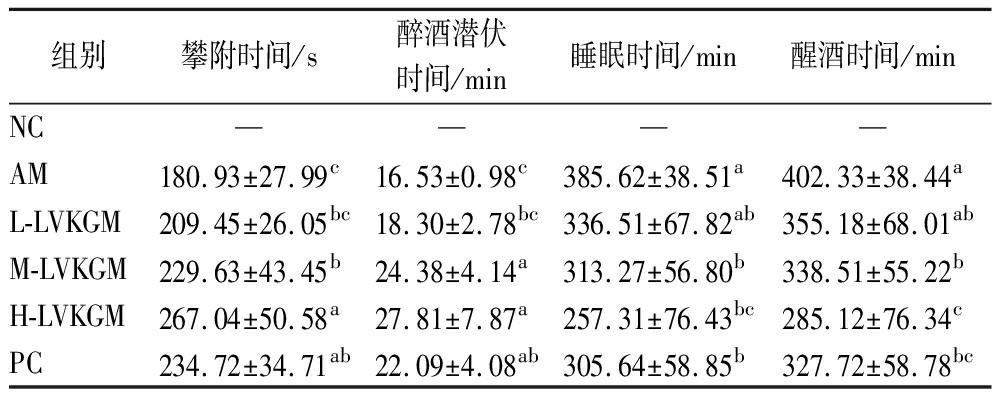
组别攀附时间/s醉酒潜伏时间/min睡眠时间/min醒酒时间/minNC————AM180.93±27.99c16.53±0.98c385.62±38.51a402.33±38.44aL-LVKGM209.45±26.05bc18.30±2.78bc336.51±67.82ab355.18±68.01abM-LVKGM229.63±43.45b24.38±4.14a313.27±56.80b338.51±55.22bH-LVKGM267.04±50.58a27.81±7.87a257.31±76.43bc285.12±76.34cPC234.72±34.71ab22.09±4.08ab305.64±58.85b327.72±58.78bc
注:同一列中不同的小写字母代表具有显著性差异(P<0.05)。—表示NC未受到酒精中毒影响。
醉酒潜伏期方面,AM组的醉酒潜伏期最短,表明酒精迅速导致了中毒。与此相比,LVKGM处理组的醉酒潜伏期显著增加(P<0.05),PC组的醉酒潜伏期显著长于AM组,但短于H-LVKGM组,显示出PC在延迟醉酒方面的作用较H-LVKGM稍弱。这表明LVKGM能够延迟酒精中毒的发生,可能通过干扰酒精的吸收或促进其代谢实现这一效果。在睡眠时间方面,NC组没有显示任何睡眠时间,而AM组的睡眠时间最长,反映了酒精的镇静作用。LVKGM处理组和PC组睡眠时间有所减少(P<0.05),其中PC组的睡眠时间显著低于AM组,但高于H-LVKGM组,这表明LVKGM和KGM均能够减轻酒精的镇静作用,可能是通过调节中枢神经系统的活性[10]。醒酒时间的结果显示,AM组的醒酒时间最长。与AM组相比,LVKGM处理组的醒酒时间显著减少(P<0.05),其中H-LVKGM组表现出最显著的减少,PC组的醒酒时间也显著短于AM组,但长于H-LVKGM组,显示出PC在加速酒精清除方面的效果较H-LVKGM稍弱。
综上所述,与AM组相比,LVKGM组和PC组可延长AAH小鼠的攀附时间和醉酒潜伏时间,缩短睡眠时间和醒酒时间,LVKGM的抗酒精中毒作用显示出明显的剂量效应关系,且H-LVKGM组抗酒精中毒作用效果比PC组更好,表明LVKGM能够加速酒精的代谢清除,促进小鼠更快地恢复。但L-LVKGM、M-LVKGM组抗酒精中毒作用效果不如PC组,研究发现,微波辅助过氧化氢处理并没有改变KGM化学基团组成[8],可能是由于低黏度的KGM在一定剂量下可能无法形成足够的凝胶结构,导致其在胃肠道中的物理作用不如高黏度的KGM明显[11]。因此,L-LVKGM可能不足以有效减缓酒精的吸收,导致解酒效果降低。尽管LVKGM在较低剂量时解酒效果不如同剂量的KGM,但LVKGM的抗酒精中毒作用显示出明显的剂量效应关系,且在高剂量下,其解酒效果显著提升,表现出良好的解酒特性。这表明,LVKGM在达到一定剂量后,仍然能够充分发挥解酒效果,尤其是在缓解酒精吸收和改善醉酒症状方面具有潜力。
2.2 LVKGM对AAH小鼠肝组织氧化应激水平的影响
如图1所示,NC组小鼠的SOD和GSH-Px活性最高,而AM组的这些酶活性显著降低。L-LVKGM组和M-LVKGM组的酶活性有所提高,但未达到显著水平。H-LVKGM组和PC组的小鼠SOD和GSH-Px活性显著高于AM组,与NC组无显著差异。这些结果表明,LVKGM处理显著改善了AAH小鼠肝脏中的抗氧化酶活性。SOD和GSH-Px是关键的抗氧化酶,能够清除活性氧(reactive oxygen species, ROS),减少氧化应激对肝细胞的损伤[12]。酒精中毒会导致ROS积累,降低抗氧化酶活性,进而损伤肝细胞。研究表明,ROS的积累不仅会导致细胞膜脂质过氧化,还会损伤蛋白质和DNA,诱发细胞凋亡和坏死[13]。LVKGM可能通过多种机制发挥其保护作用。首先,LVKGM作为一种降解KGM,具有优异的抗氧化性能,可以有效清除体内的ROS。此外,LVKGM通过激活核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)信号通路,增加抗氧化酶的表达,从而增强细胞的抗氧化能力。Nrf2作为一种转录因子,当细胞受到氧化应激时,会转移到细胞核中促进抗氧化酶基因的表达[14]。H-LVKGM的效果尤为显著,其低黏度特性使其更易被肠道吸收并发挥作用,从而显著提高肝脏中SOD和GSH-Px的活性。这表明H-LVKGM具有显著的肝脏保护作用。PC组的小鼠也表现出较高的SOD和GSH-Px活性,KGM作为一种多糖,具有显著的抗氧化和抗炎特性,能够减轻氧化应激和炎症反应,从而对肝细胞起到保护作用[15]。总结来看,LVKGM,尤其是H-LVKGM,可以显著改善酒精引起的氧化应激,增强肝脏抗氧化能力,体现出其在减轻酒精性肝损伤中的潜在应用价值。
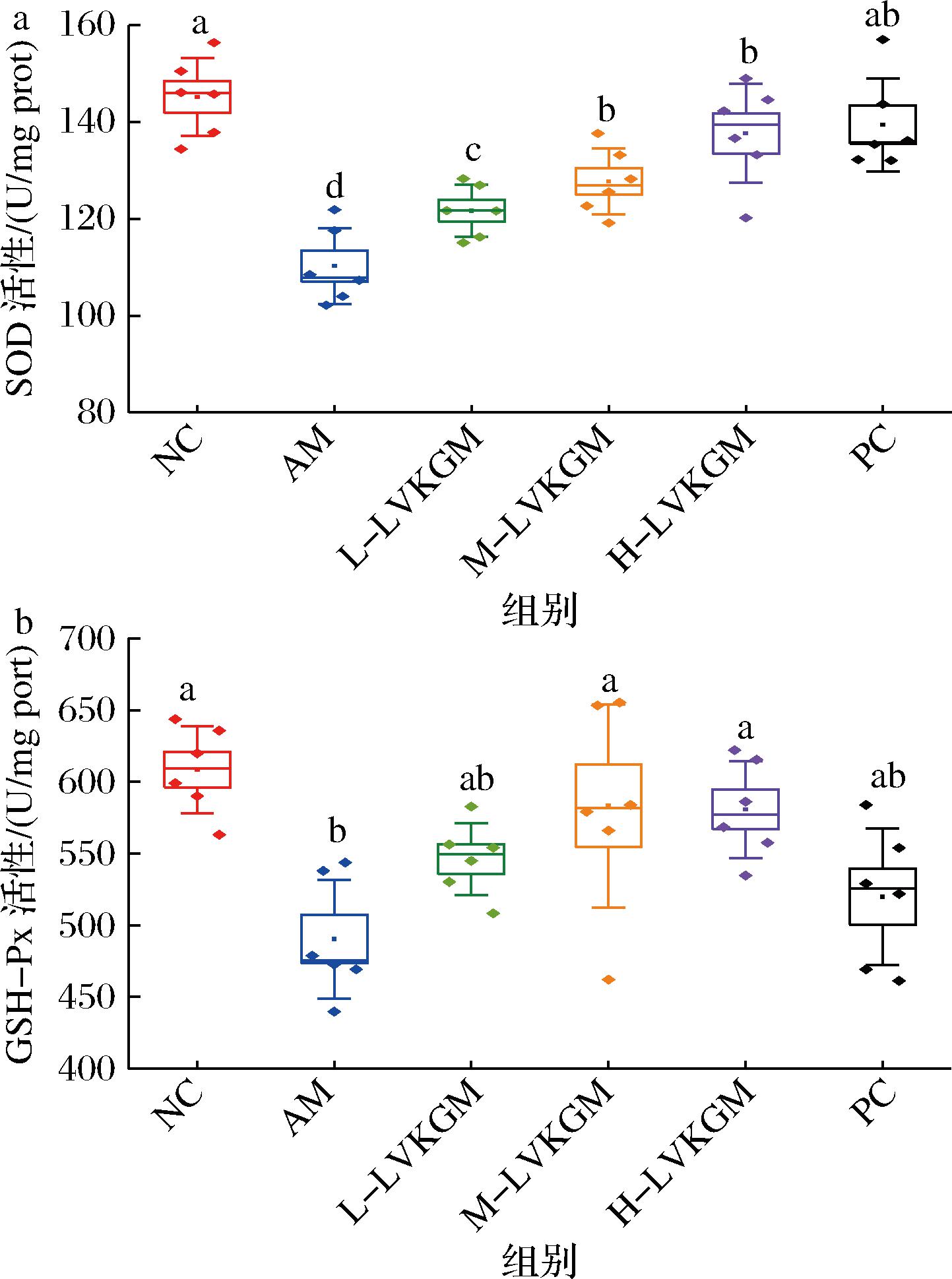
a-SOD;b-GSH-Px
图1 LVKGM对AAH小鼠肝脏SOD和GSH-Px的影响
Fig.1 Effect of LVKGM on hepatic SOD and GSH-Px in AAH mice
注:同一指标中不同的小写字母代表具有显著性差异(P<0.05)(下同)。
2.3 LVKGM对AAH小鼠炎症因子的影响
如图2所示,与对照组相比,AM组小鼠的TNF-α和IL-1β水平显著升高(P<0.05),表示模型小鼠存在严重的炎症反应。PC、LVKGM各组相较AM组TNF-α、IL-1β水平均显著降低(P<0.05)。PC组效果最好,M-LVKGM、H-LVKGM组IL-1β水平与PC组无显著差异,这表明,LVKGM能够减少TNF-α和IL-1β,且效果随剂量增加而增强,中、高剂量LVKGM对炎症因子的影响效果接近阳性对照组,与杨佳等[16]、周兴念等[17]的研究结果一致。这些结果表明,LVKGM在减轻AAH小鼠的炎症反应方面具有显著的作用。TNF-α和IL-1β是2种关键的促炎细胞因子,其水平的升高与急性酒精性肝炎的病理进程密切相关。LVKGM干预处理后,这2种细胞因子水平显著降低,尤其是在H-LVKGM组,表明LVKGM具有显著的抗炎作用。低分子质量的KGM具有较高的生物活性,因为它们具有较低的表观黏度、更简单的结构和良好的水溶性。这使得它们容易被体内吸收和利用,从而具有较好的抗炎效果[18]。超声波降解的KGM(U-OKGM)在体外模型中能够显著抑制脂多糖(lipopolysaccharide,LPS)诱导的RAW264.7细胞的TNF-α和IL-1β分泌,并且抑制iNOS和IL-6的mRNA表达。低分子质量的KGM可作为益生元,促进肠道内有益菌的生长和代谢活性,这些有益菌通过产生SCFAs等代谢产物,维持肠道屏障的完整性并抑制炎症因子的生成,从而发挥抗炎作用。低分子质量KGM能够被某些模式识别受体(pattern recognition receptors,PRRs)识别,进而引发免疫反应。这种免疫反应可以调节炎症因子的表达,减轻炎症反应。研究发现,U-OKGM通过抑制iNOS的mRNA表达,有效减少NO的产生,从而减轻炎症反应[15]。此外,在不同剂量的LVKGM组,TNF-α水平随着剂量增加而降低,这进一步支持了剂量依赖性的炎症干预效果。
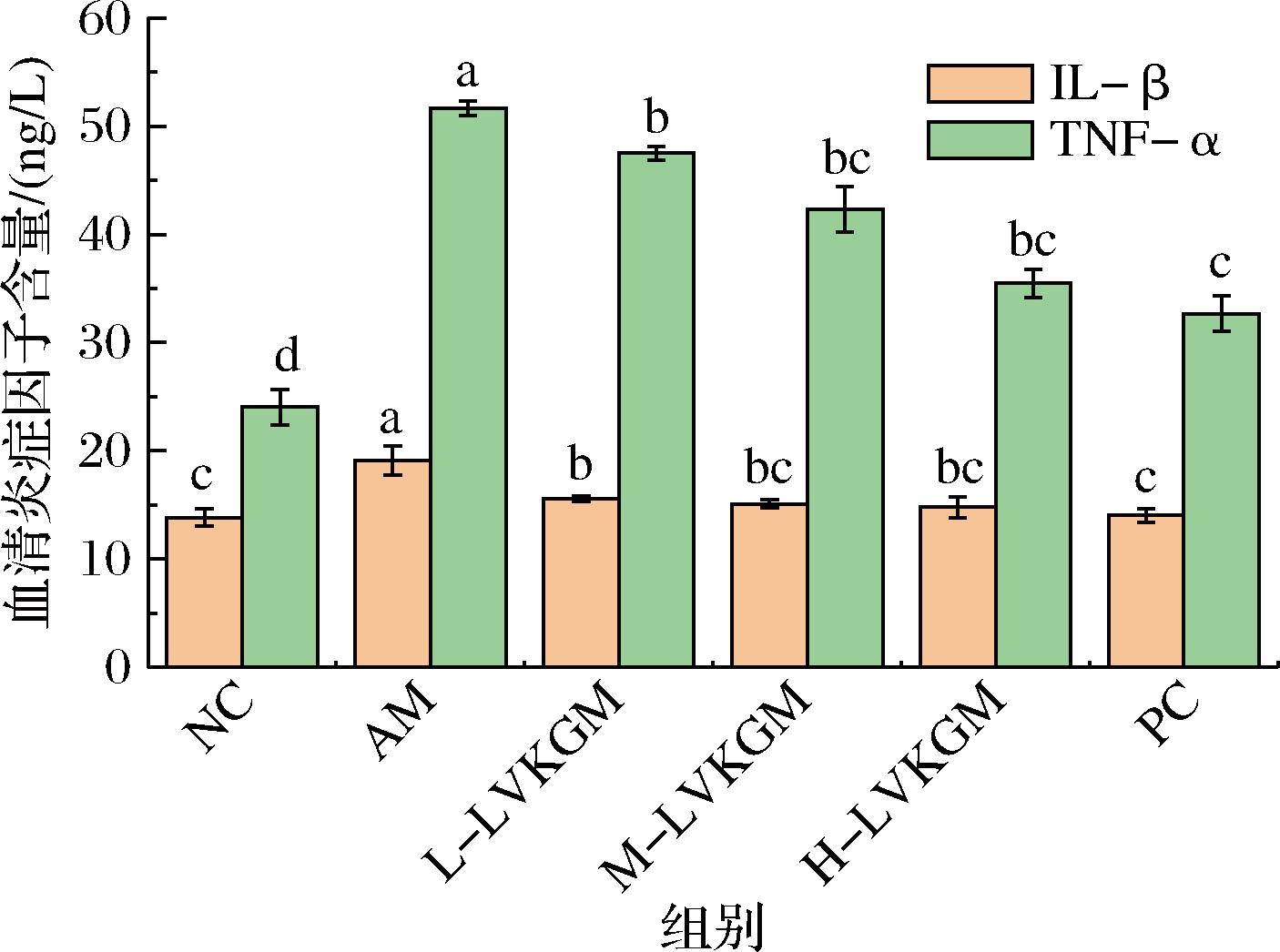
图2 LVKGM对AAH小鼠血清TNF-α、IL-1β含量的影响
Fig.2 Effect of LVKGM on serum TNF-α and IL-1β levels in AAH mice
综上所述,LVKGM,特别是H-LVKGM,通过显著降低血清中TNF-α和IL-1β水平,对肝脏炎症反应具有显著的抑制作用。这一发现不仅证实了LVKGM作为一种降解多糖在抗炎和肝脏保护方面的潜在应用价值,而且为其在干预急性酒精损伤中的进一步研究和应用提供了重要依据。
2.4 LVKGM对AAH小鼠血清转氨酶的影响
急性肝损伤诊断过程中,血清中AST、ALT是评估肝脏状况的关键酶学指标[3]。过度饮酒是导致肝脏损害的重要因素,会引起血清中AST、ALT显著增加。在健康人血清中,这2种酶浓度相对较低。当摄入酒精时,大量酒精通过肝脏代谢,对肝脏产生毒性作用。随着肝细胞损伤加重,其细胞膜屏障作用受到破坏引起通透性增加,AST和ALT会从受损的肝细胞中转移释放到血液循环中,导致血清中AST和ALT水平升高[19]。由图3可知,AM组小鼠的AST和ALT相较NC组均出现显著提升(P<0.05),表明酒精中毒诱发肝脏损伤,同时验证试验中急性酒精中毒小鼠模型的成功构建。与AM相比,M-LVKGM、H-LVKGM组处理及NC组小鼠血清中AST和ALT水平均显著下降(P<0.05),与苏林梁等[20]的研究结果相似。综上所述,该结果表明LVKGM能够对肝脏产生一定程度的保护作用,降低酒精引起的肝脏损伤标志物的水平,从而在急性酒精性肝损伤中表现出其潜在的肝脏保护效益。PC组和H-LVKGM组都有较好的效果,表明采用本方法制备的LVKGM与原KGM都具有改善肝脏酒精中毒的作用。
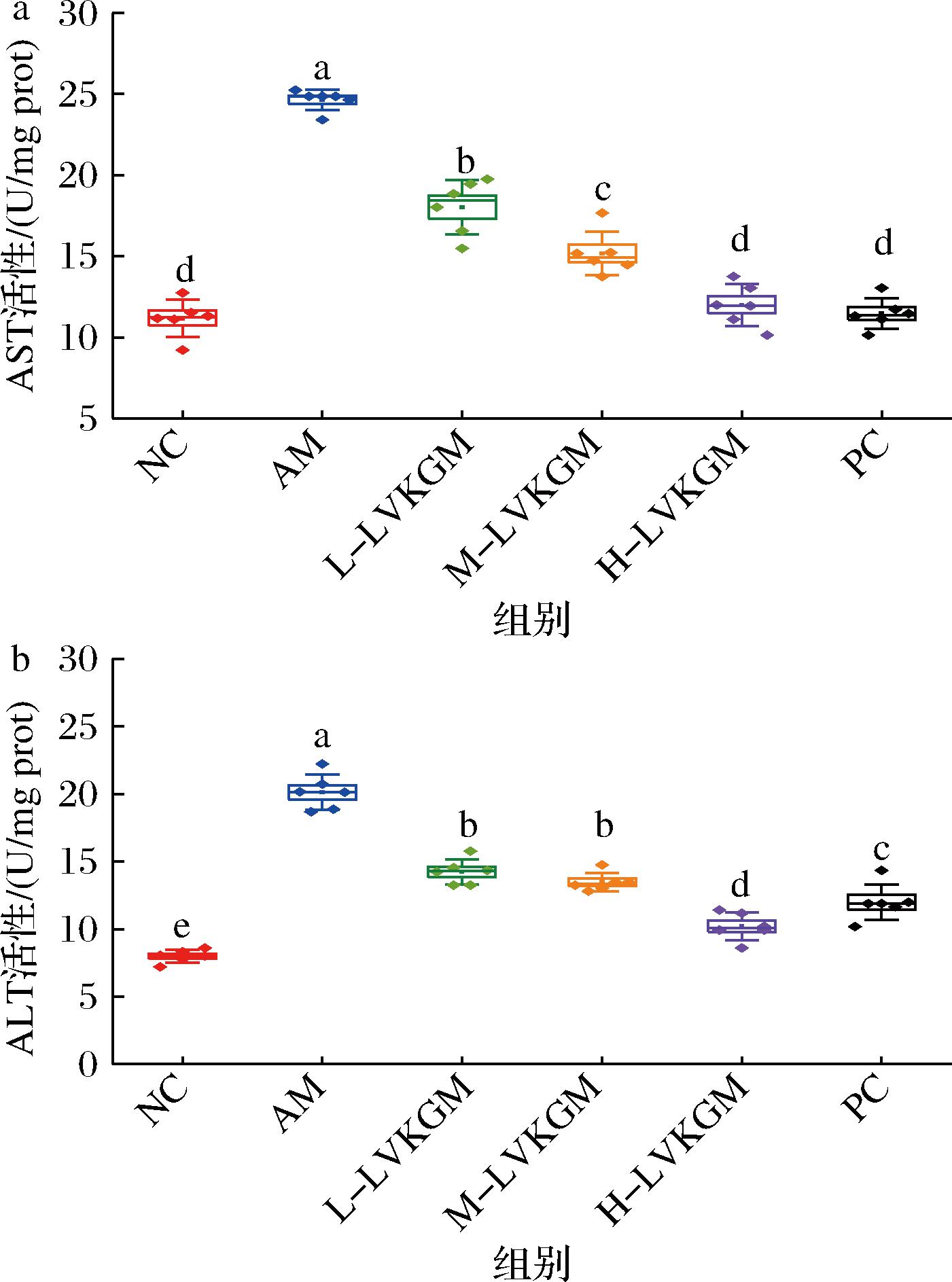
a-AST;b-ALT
图3 LVKGM对AAH小鼠血清AST和ALT的影响
Fig.3 Effect of LVKGM on serum AST and ALT in AAH mice
2.5 LVKGM对AAH小鼠肝组织酒精代谢酶的影响
ADH和ALDH是肝脏代谢乙醇和乙醛的重要酶类。ADH将乙醇转化为乙醛,而ALDH进一步将乙醛转化为乙酸。乙醇代谢过程中产生的乙醛是一种高度反应性和毒性的化合物,可引起肝细胞损伤和炎症反应[21]。因此,维持ADH和ALDH的活性对于减少乙醇引起的肝脏损伤至关重要。LVKGM处理显著提高了AAH小鼠肝脏中的ADH和ALDH活性,由于其低黏度特性使其更易被肠道吸收,并迅速作用于肝脏。LVKGM通过其抗氧化和抗炎特性,可以减轻乙醇代谢过程中产生的氧化应激和炎症反应,从而保护肝细胞,促进ADH和ALDH的恢复。H-LVKGM组在ADH和ALDH活性恢复方面的效果最为显著,表明剂量依赖性效应。H-LVKGM可能提供了更强的抗氧化和抗炎保护,从而更有效地维持和恢复肝脏酶活性。图4展示了LVKGM对AAH小鼠肝脏中ADH和ALDH活性的影响。与对照组相比,AAH模型组小鼠肝脏中的ADH活性显著降低(P<0.05)(图4-a)。经LVKGM处理后,ADH活性显著提高。特别是H-LVKGM组的恢复效果最为明显,接近正常对照组水平(P<0.05)。AAH模型组小鼠肝脏中的ALDH活性同样显著降低(P<0.05)(图4-b)。LVKGM处理后,ALDH活性显著恢复,且H-LVKGM组的ALDH活性提升最为显著,甚至超过了PC组的水平(P<0.05)。相较于NC,经乙醇灌胃的AM小鼠的肝脏中ADH与ALDH活性显著增加(P<0.05),揭示了大量饮酒能显著提升小鼠体内乙醇代谢酶的活性,与XIE等[9]的研究一致。与AM相比,LVKGM各组小鼠及PC组肝脏ADH活性均有显著提升(P<0.05),M-LVKGM、H-LVKGM组的ALDH活性显著增加(P<0.05),而在L-LVKGM组的ALDH活性变化较小。综上所述,LVKGM和高黏度KGM[5]均能有效促进ADH与ALDH的活性,加速乙醇的代谢过程达到解酒效果。
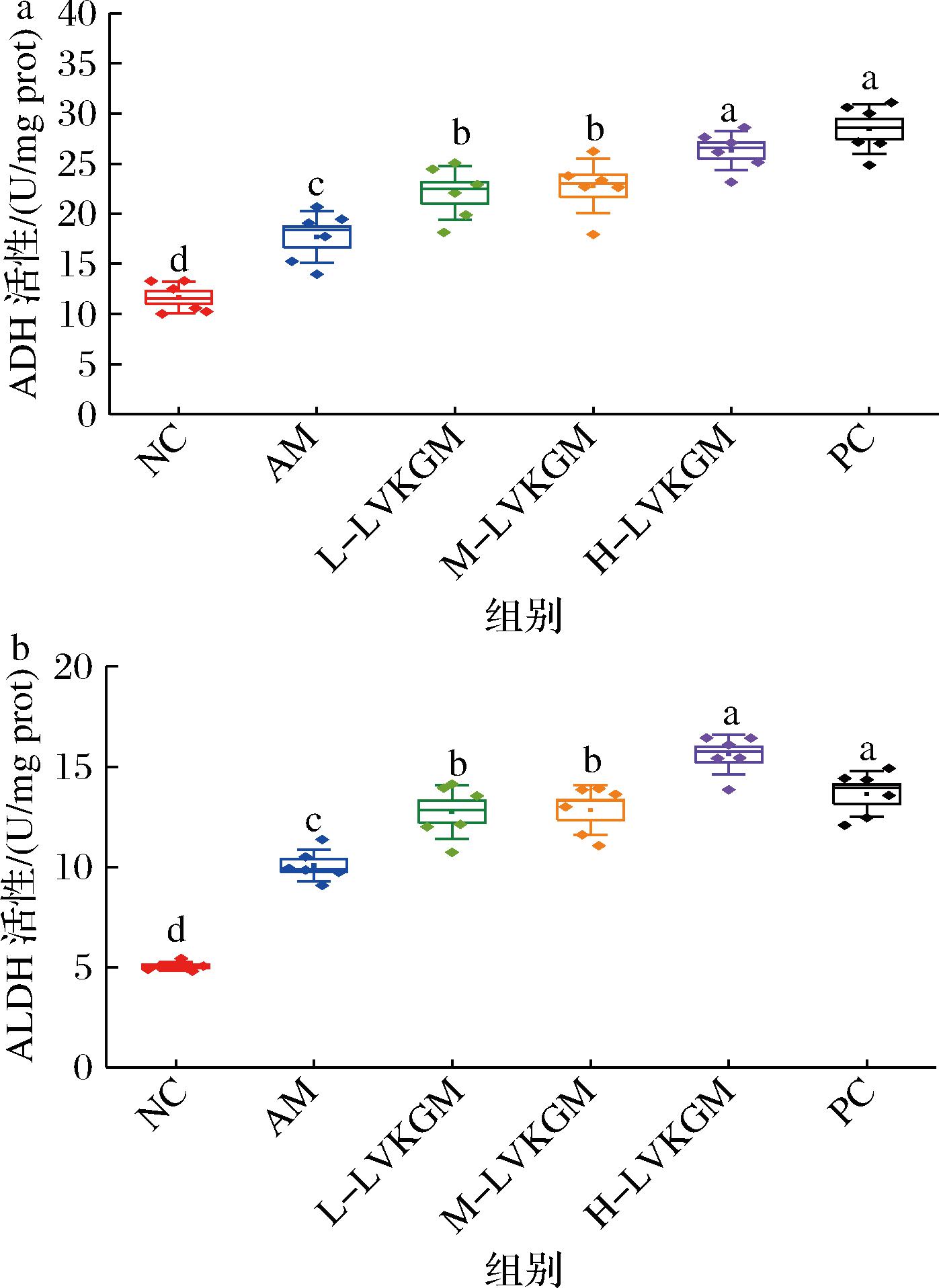
a-ADH;b-ALDH
图4 LVKGM对AAH小鼠肝脏ADH和ALDH的影响
Fig.4 Effect of LVKGM on hepatic ADH and ALDH in AAH mice
2.6 LVKGM对AAH小鼠胃组织病理学影响
胃作为酒精代谢路径中最初接触酒精的关键器官,对酒精的耐受性和代谢反应起着至关重要的作用[22]。过度饮酒或长期饮酒会导致胃黏膜遭受急性或慢性损害,这种损伤的机制复杂,涉及直接的细胞毒性作用、局部血流改变、炎症反应以及胃黏膜保护因素的减少等多个方面[23]。各组小鼠的胃腺体HE染色病理学观察结果如图5所示。NC组小鼠胃腺体各层结构清晰完整,腺细胞排列均匀,无明显出血和淋巴细胞浸润迹象。AM组小鼠胃黏膜损伤显著,表现为表面黏膜层腺体重度糜烂、缺失,大量黏液分泌,胃小凹细胞明显减少,结构排列紊乱、融合(黑色箭头),间质内血管中度出血(红色箭头),固有层内大量淋巴细胞浸润(蓝色箭头)。LVKGM处理组和PC组小鼠胃黏膜的损伤程度较AM组有所减轻,其中PC组和H-LVKGM组的小鼠胃组织状态接近NC组,腺细胞排列较为有序,间质内血管轻度出血,固有层少量淋巴细胞浸润。L-LVKGM组结构紊乱损伤仍较严重,这与沈玖君等[7]的研究结果一致。结果表明,LVKGM对胃黏膜具有保护作用,且效果随剂量增加而增强,H-LVKGM对胃组织的保护能力接近阳性对照组。

a-NC组;b-AM组;c-L-LVKGM组;d-M-LVKGM组;e-H-LVKGM组;f-PC组
图5 小鼠胃黏膜病理学变化(HE 染色,×200)
Fig.5 Pathological changes in the gastric mucosa of mice(HE staining, ×200)
胃部组织切片进一步揭示了LVKGM在保护胃黏膜免受酒精损伤中的潜在机制。首先,酒精直接接触胃黏膜细胞,导致细胞膜的脂质溶解和蛋白质变性,这一过程诱发了急性细胞毒性反应[24]。酒精还可通过促进ROS的生成,引发氧化应激,导致细胞膜脂质过氧化,从而损伤胃黏膜细胞[25]。炎症反应是酒精诱导胃黏膜损伤的另一个重要机制。酒精能够激活胃黏膜中的免疫细胞,导致大量促炎细胞因子如TNF-α和IL-1β的释放,这些细胞因子进一步破坏胃黏膜屏障,增加细胞凋亡和组织损伤[26]。LVKGM的抗炎特性可能通过抑制促炎细胞因子的表达和释放,从而减少炎症反应和组织损伤。此外,其抗氧化特性可能通过清除自由基,减少氧化应激,从而保护胃黏膜细胞。LVKGM还可能通过与肠道菌群的相互作用,增强有益菌的生长,间接影响胃黏膜的健康。有益菌能产生SCFAs,这些代谢产物具有抗炎和保护胃肠道黏膜的作用[27]。因此,LVKGM不仅通过直接的抗炎和抗氧化作用,还通过促进有益菌生长和代谢,提供多重机制的胃黏膜保护作用。综上所述,LVKGM特别是H-LVKGM,通过一系列复杂的生理机制,包括直接的抗炎和抗氧化作用以及间接的微生物调节,显著减轻了胃黏膜的损伤。
2.7 LVKGM对AAH小鼠肝脏组织病理学影响
各组小鼠肝脏组织HE染色病理学观察结果如图6所示。NC组小鼠肝细胞表现出良好的形态结构完整性,细胞排列整齐规则,围绕中央静脉呈放射状排列,且未观察到肝窦明显淤血与炎症现象。所有小鼠肝组织均未出现肝血窦、小静脉周围及小叶中心区明显纤维化。AM组小鼠肝细胞明显紊乱,排列不整齐,表现出重度水肿(黑色箭头),间质内血管重度扩张、充血(红色箭头),并伴有大量淋巴细胞浸润(蓝色箭头)。L-LVKGM组小鼠的肝组织形态与AM组相似,仍表现出重度水肿,结构分界模糊,间质内血管重度充血,并有较多淋巴细胞浸润。PC组、M-LVKGM组和H-LVKGM组的小鼠肝细胞损伤程度明显减轻,细胞排列较为整齐,仅表现出中度水肿和肝窦轻度扩张,少量肝细胞出现轻微的变性和坏死,伴有少量淋巴细胞浸润。这些结果表明,酒精对肝脏造成了严重损伤,验证了急性酒精中毒小鼠模型的成功建立。此外,LVKGM对酒精性肝损伤具有显著的保护作用,尤其是H-LVKGM组效果更为明显。这与上述生化指标的结果相一致,进一步支持了LVKGM在酒精性肝损伤中的潜在干预效果。
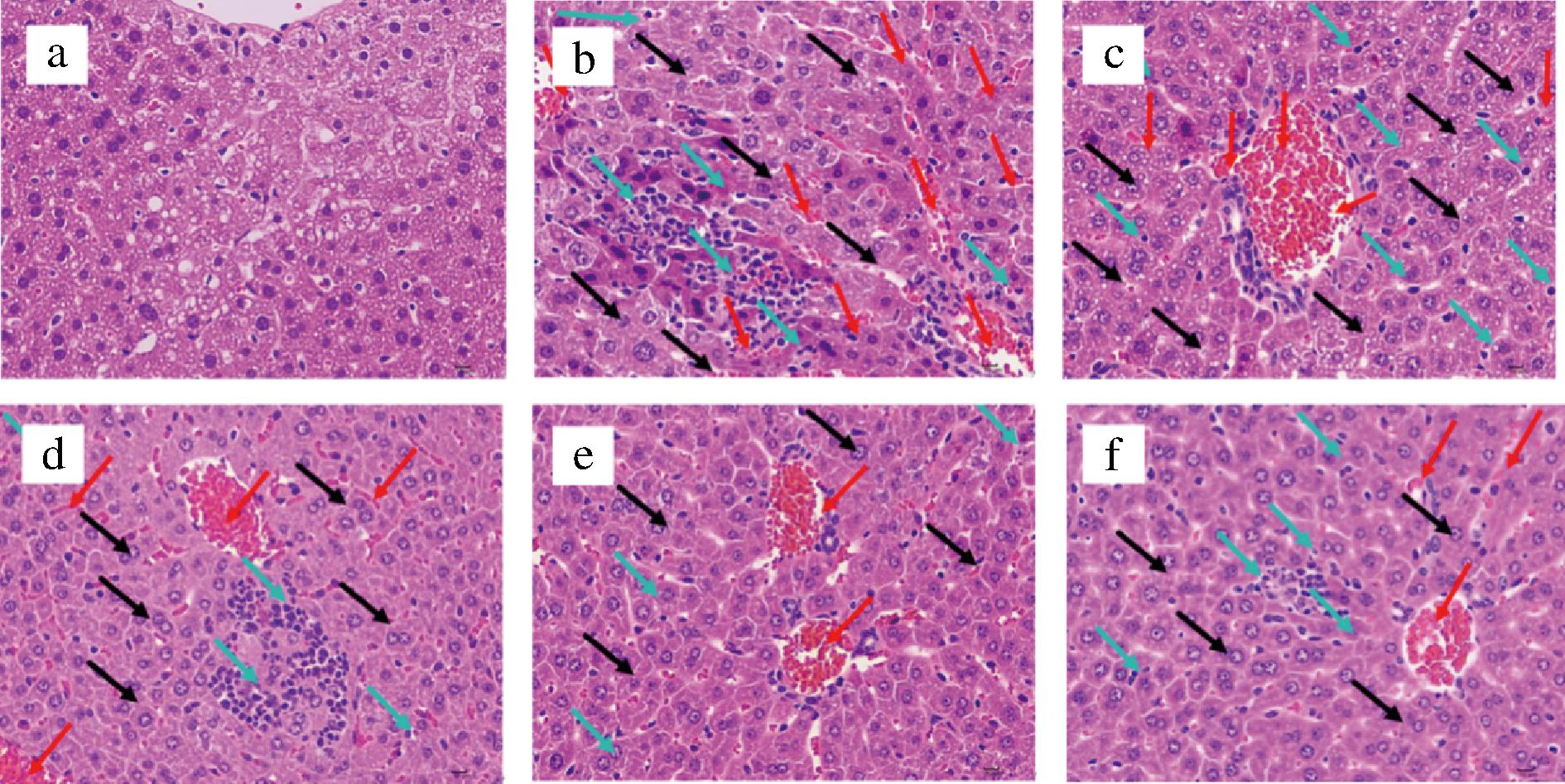
a-NC组;b-AM组;c-L-LVKGM组;d-M-LVKGM组;e-H-LVKGM组;f-PC组
图6 小鼠肝脏病理学变化
Fig.6 Pathological changes in mouse liver
2.8 LVKGM对AAH小鼠结肠内容物SCFAs的影响
图7展示了不同处理组小鼠粪便中的SCFAs水平,包括乙酸、丙酸、丁酸及其总量。NC组:乙酸(21.37±0.55) mmol/L、丙酸(2.55±0.25) mmol/L、丁酸(1.80±0.04) mmol/L。AM组:乙酸(18.53±0.14) mmol/L、丙酸(1.82±0.06) mmol/L、丁酸(1.84±0.11) mmol/L。H-LVKGM组:乙酸(20.26±0.16) mmol/L、丙酸(2.49±0.03) mmol/L、丁酸(2.70±0.01) mmol/L。这些结果表明,急性酒精摄入显著降低了小鼠体内SCFAs的水平,尤其是乙酸、丙酸和丁酸的浓度(AM组)。相比之下,LVKGM处理组显示出不同程度的SCFAs恢复,其中H-LVKGM组表现尤为显著,其SCFAs水平接近NC组和PC组水平。LVKGM的主要机制之一是通过调节肠道菌群来提高SCFAs的产量。研究表明,LVKGM能作为益生元,促进有益菌的生长和代谢,尤其是那些能够发酵膳食纤维产生SCFAs的菌群。SCFAs如乙酸、丙酸和丁酸是肠道微生物发酵纤维的代谢产物,它们在维持肠道健康和宿主免疫功能中起关键作用[28]。SCFAs不仅是重要的能量来源,还具有显著的抗炎和抗氧化作用。乙酸和丁酸能够抑制促炎细胞因子的表达,减少炎症反应,从而减轻酒精诱导的肠道和肝脏损伤[29]。H-LVKGM组显示的SCFAs水平显著增加,表明其在减少氧化应激和炎症反应方面具有强效。酒精摄入会破坏肠道屏障功能,导致肠道通透性增加,使得内毒素(如LPS)进入血液循环,进而引发肝脏炎症反应(肠-肝轴)。SCFAs在维持肠道屏障功能中发挥重要作用,促进肠上皮细胞紧密连接的形成和功能。因此,LVKGM通过提高SCFAs水平,可能增强肠道屏障功能,减少内毒素转移,减轻肝脏炎症和损伤。丁酸作为结肠上皮细胞的主要能量来源,能够促进细胞代谢和增殖,维持肠道上皮的完整性和功能[30]。H-LVKGM显著增加了丁酸的水平,进一步支持了其在保护肠道上皮细胞健康方面的作用。
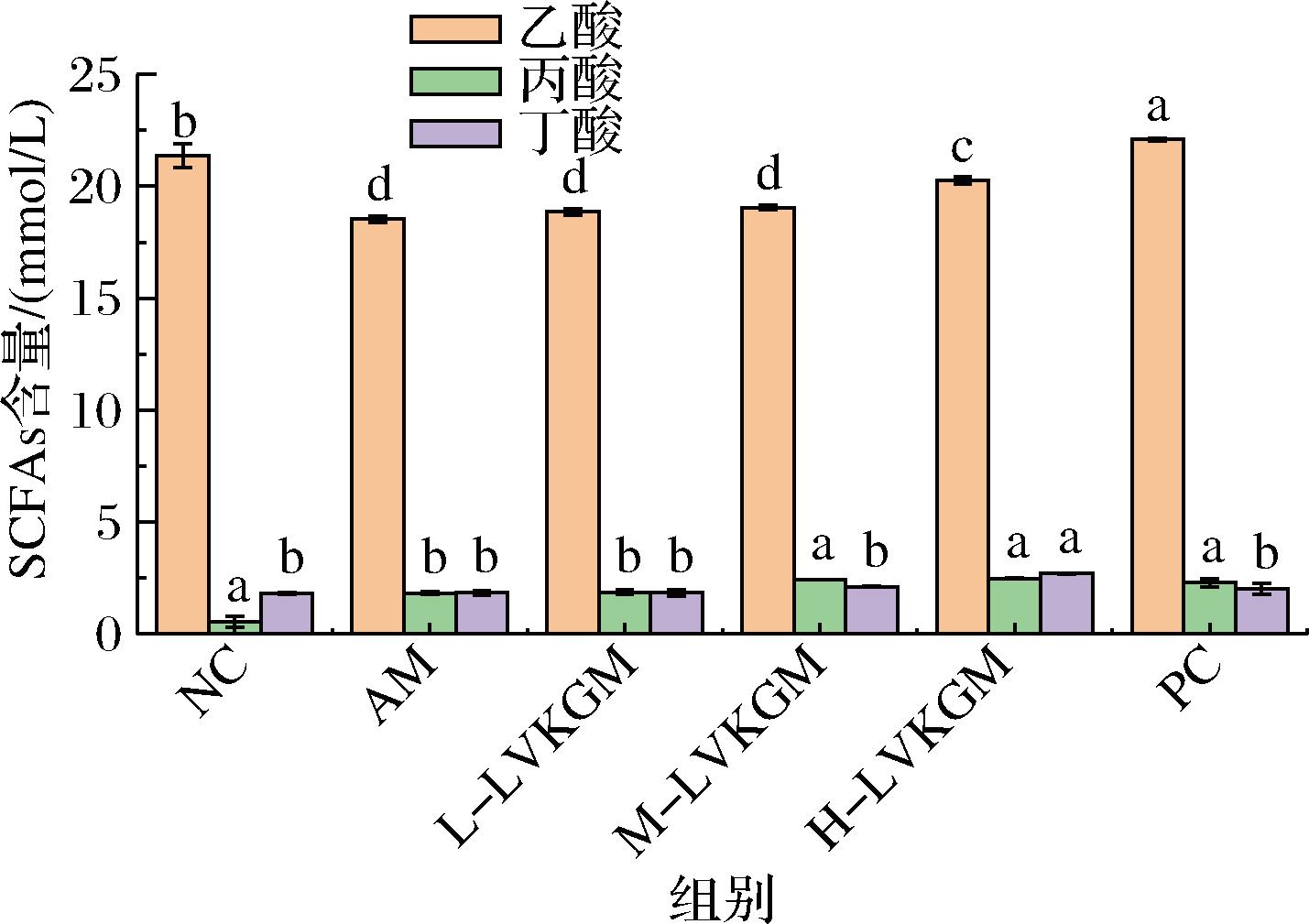
图7 LVKGM对不同各组小鼠SCFAs水平的影响
Fig.7 Effect of LVKGM on SCFAs levels in different groups of mice
综上所述,LVKGM,尤其是H-LVKGM,通过调节肠道菌群提高SCFAs的产量,发挥抗炎、抗氧化和肠-肝轴保护作用,显著减轻了酒精诱导的肝脏损伤。这些发现为LVKGM在酒精性肝病治疗中的潜在应用提供了理论依据和实验支持。
2.9 LVKGM对AAH小鼠盲肠内容物微生物水平的影响
酒精及其代谢产物可能会引发肝肠屏障功能出现障碍,改变肠道中的微生物组成,并且有可能通过肠-肝轴加重对肝脏的损害[31]。Sobs指数表示实际观测操作分类单元(operational taxonomic unit,OTU)数目。一般情况下,每个OTU对应于一个不同的细菌(微生物),从而可以确定待测样本中的菌群多样性和细菌丰度。由图8-a可知当序列数增加到30 000时,稀释曲线趋于平坦,表明测序数据量是合理的。

a-OTU稀释曲线;b-ACE指数;c-Chao 1指数;d-Simpson指数;e-PcoA;f-Circos图
图8 小鼠肠道菌群的多样性及物种分布
Fig.8 Diversity and species distribution of intestinal flora in mice
通过一系列统计学分析指数来估计肠道微生物群落中物种的丰富度和多样性,评估LVKGM对酒精诱导的AAH小鼠微生物群落丰富度和Alpha多样性的影响。Alpha多样性指数分析了不同组之间肠道菌群的多样性,其中ACE和Chao 1指数反映物种OTU水平的丰富度和多样性,Simpson指数可以反映物种均匀度的差异程度[32]。根据图8-b~图8-d分析Alpha多样性可知,6组间物种丰富度差异显著(P<0.05),但均匀度差异不显著(P>0.05)。与NC组相比,AM组物种丰富度显著降低(P<0.05),而LVKGM各组和PC组无明显差异。为进一步说明LVKGM对AAH小鼠的肠道菌群影响,对样本数据进行Beta多样性分析。Beta多样性可根据PcoA多元统计分析判断组内差异见图8-e。主坐标分析(principal coordinate analysis,PCoA)是观察样本聚类趋势和不同组之间分离程度的重要工具,在微生物研究中得到了广泛应用。从PCoA图中可以看出,不同组别的样本点分析,形成了几个不同的聚类区域,表明这些组之间的微生物组成存在显著差异。根据图8-f可知样本的肠道微生物群包括:拟杆菌门(Bacteroidota)、厚壁菌门(Firmicutes)、变形菌(Proteobacteria)、放线菌(Actinobacteriota)等[33]。相较AM,LVKGM各剂量组和PC适当提高了厚壁菌门的数量,膳食纤维能刺激厚壁菌门的生长,抑制致病菌,利用过程中产生大量短链脂肪酸且能够提升有益菌如厚壁菌门等的丰度,能改善人体屏障功能,增强免疫力,预防肠道疾病的发生[34]。其余物种差异较小,推测因本部分试验研究急性酒精中毒小鼠的肠道内容物,短期内LVKGM对肠道微生物的影响作用相对较小。结合上述分析可知,急性酒精中毒会降低小鼠肠道菌群的物种多样性,而PC和H-LVKGM组可能有改善这一现象的潜力。
3 结论
采用微波辅助过氧化氢(半干法工艺)制备的LVKGM具有良好的抗醉、解酒和护肝作用。LVKGM可延长醉酒小鼠的攀附时间和醉酒潜伏期,缩短醉酒小鼠的睡眠时间和醒酒时间,可改善因过量摄入酒精引起的醉酒症状、胃、肝组织切片病理状况。LVKGM中、高剂量组效果更为显著(P<0.05),且高剂量组与KGM对照组差异不显著(P>0.05),说明LVKGM相较KGM虽然黏度较小,但均具有抗醉解酒功效。其解酒机制可能是:LVKGM能降低急性酒精中毒小鼠血清转氨酶水平(ALT和AST);显著增强肝脏中ADH的活性(P<0.05),加快乙醇在体内的代谢;提升GSH-Px、SOD活性;下调肝脏中TNF-α等炎症因子表达,抑制炎症反应,同时增加酒精中毒小鼠结肠内容物SCFAs的浓度。这些因素共同作用促使LVKGM起到抗醉解酒作用。
[1] WU X, YANG L J, GAO P, et al.Effect of Xingnaojing injection for the treatment of acute alcoholism:A protocol of systematic review and meta-analysis[J].Medicine, 2020, 99(26):e20785.
[2] 刘怡菲. 软枣猕猴桃解酒护肝作用的研究[J].辽宁林业科技, 2019(3):14-16;75.LIU Y F.Studies on the function of Actinidia arguta in liver protection from the alcohol damage[J].Liaoning Forestry Science and Technology, 2019(3):14-16;75.
[3] 周宏炫, 黄颖, 谭书明, 等.刺梨多酚对急性酒精中毒大鼠的解酒和护肝作用[J].食品科学, 2021, 42(17):163-169.ZHOU H X, HUANG Y, TAN S M, et al.Anti-alcoholic and hepatoprotective effects of polyphenols from the fruit of Rosa roxburghii tratt.in rats with acute alcoholism[J].Food Science, 2021, 42(17):163-169.
[4] 周庆峰, 康洁, 马亢, 等.山药多糖对急性酒精中毒小鼠的解酒作用[J].食品研究与开发, 2019, 40(19):113-117.ZHOU Q F, KANG J, MA K, et al.Anti-alcoholism effects of rhizoma dioscoreae polysaccharide on acute alcohol intoxic mice[J].Food Research and Development, 2019, 40(19):113-117.
[5] 王敏. 魔芋粉对酒精首过代谢影响及对酒精性脑损伤保护作用的研究[D].重庆:西南大学, 2017.WANG M.Study on the effect of konjac powder on the first-pass metabolism of alcohol and its protective effect on alcoholic brain injury[D].Chongqing:Southwest University, 2017.
[6] 郑连姬, 邓利玲, 罗嘉妮, 等.魔芋葡甘聚糖抗醉解酒作用机理研究[J].食品与机械, 2017, 33(5):156-161.ZHENG L J, DENG L L, LUO J N, et al.The mechanism for anti-drunk and anti-inebriation of konjac glucomannan[J].Food &Machinery, 2017, 33(5):156-161.
[7] 沈玖君, 邓利玲, 帅天罡, 等.魔芋粉对小鼠急性酒精性胃黏膜损伤和慢性酒精性肠损伤的影响[J].食品科学, 2018, 39(9):163-169.SHEN J J, DENG L L, SHUAI T G, et al.Protective effect of konjac powder on acute alcoholic gastric mucosal injury and chronic alcoholic intestinal injury in mice[J].Food Science, 2018, 39(9):163-169.
[8] 杜宇明, 邓利玲, 汪娟, 等.微波辅助过氧化氢半干法降解魔芋葡甘聚糖工艺优化及其特性研究[J].食品工业科技, 2024, 45(23):189-197.DU Y M, DENG L L, WANG J, et al.Optimization of microwave-assisted semidry degradation of konjac glucomannan with hydrogen peroxide and its characteristics[J].Science and Technology of Food Industry, 2024, 45(23):189-197.
[9] XIE L, HUANG W G, LI J L, et al.The protective effects and mechanisms of modified Lvdou Gancao decoction on acute alcohol intoxication in mice[J].Journal of Ethnopharmacology, 2022, 282:114593.
[10] 冯杨梦晓, 德央, 任青兮, 等.酒精代谢的损伤防护和动物模型研究进展[J].食品与发酵工业, 2024, 50(9):298-306.FENG Y M X, DE Y, REN Q X, et al.Research progress on injury protection and animal models of alcohol metabolism[J].Food and Fermentation Industries, 2024, 50(9):298-306.
[11] CHEN M S, GUO L P, NSOR-ATINDANA J, et al.The effect of viscous soluble dietary fiber on nutrient digestion and metabolic responses Ⅰ:In vitro digestion process[J].Food Hydrocolloids, 2020, 107:105971.
[12] SHI D H, ZHOU J C, ZHAO L H, et al.Alleviation of mycotoxin biodegradation agent on Zearalenone and deoxynivalenol toxicosis in immature gilts[J].Journal of Animal Science and Biotechnology, 2018, 9:42.
[13] WANG X X, LIU M, ZHANG C, et al.Antioxidant activity and protective effects of enzyme-extracted Oudemansiella radiata polysaccharides on alcohol-induced liver injury[J].Molecules, 2018, 23(2):481.
[14] SILVA-LLANES I, SHIN C H, JIMÉNEZ-VILLEGAS J, et al.The transcription factor NRF2 has epigenetic regulatory functions modulating HDACs, DNMTs, and miRNA biogenesis[J].Antioxidants, 2023, 12(3):641.
[15] XIA P K, ZHAO M G, JIN H, et al.Konjac glucomannan-assisted curcumin alleviated dextran sulfate sodium-induced mice colitis via regulating immune response and maintaining intestinal barrier integrity[J].Food &Function, 2023, 14(19):8747-8760.
[16] 杨佳, 党凯, 薛美兰, 等.岩藻多糖对酒精暴露小鼠肝损伤的保护作用及机制[J].食品科学, 2023, 44(3):137-145.YANG J, DANG K, XUE M L, et al.Protective effect and mechanism of fucoidan on alcohol-induced liver injury in mice[J].Food Science, 2023, 44(3):137-145.
[17] 周兴念, 刘渝洪, 秦玉洁, 等.铁皮石斛叶发酵液对酒精性肝炎小鼠模型的影响及其作用机制[J].临床肝胆病杂志, 2024, 40(2):335-342.ZHOU X N, LIU Y H, QIN Y J, et al.Effect of Dendrobium officinale leaf fermentation fluid on a mouse model of alcoholic hepatitis and its mechanism of action[J].Journal of Clinical Hepatology, 2024, 40(2):335-342.
[18] ZHENG Q R, LI W F, LIANG S, et al.Effects of ultrasonic treatment on the molecular weight and anti-inflammatory activity of oxidized konjac glucomannan[J].CyTA- Journal of Food, 2019, 17(1):1-10.
[19] DOLGANIUC A, SZABO G.In vitro and in vivo models of acute alcohol exposure[J].World Journal of Gastroenterology, 2009, 15(10):1168-1177.
[20] 苏林梁, 黄业宇, 冯丁山, 等.槟榔花茶对大鼠亚急性酒精性肝损伤的保护作用[J].现代食品科技, 2017, 33(6):15-18;8.SU L L, HUANG Y Y, FENG D S, et al.Protective effects of Areca inflorescence tea on alcohol-induced hepatic injury in rats[J].Modern Food Science and Technology, 2017, 33(6):15-18;8.
[21] SANDOVAL C, MELLA L, GODOY K, et al.β-carotene increases activity of cytochrome P450 2E1 during ethanol consumption[J].Antioxidants, 2022, 11(5):1033.
[22] 陈湑慧. 生姜茎叶多糖的结构解析、体外消化酵解和保肝活性研究[D].重庆:西南大学, 2022.CHEN X H.Study on the structural analysis, in vitro digestive hydrolysis, and hepatoprotective activity of polysaccharides from ginger stems and leaves[D].Chongqing:Southwest University, 2022.
[23] TIAN B M, ZHAO Q, XING H Y, et al.Gastroprotective effects of Ganoderma lucidum polysaccharides with different molecular weights on ethanol-induced acute gastric injury in rats[J].Nutrients, 2022, 14(7):1476.
[24] MULEBA L, VAN WYK R, PIENAAR J, et al.Assessment of anti-bacterial effectiveness of hand sanitizers commonly used in South Africa[J].International Journal of Environmental Research and Public Health, 2022, 19(15):9245.
[25] 夏婷, 张瑾, 姚佳慧, 等.氧化应激在酒精性肝病中作用机制的研究进展[J].中国药理学通报, 2017, 33(10):1353-1356.XIA T, ZHANG J, YAO J H, et al.Research progress in mechanism of oxidative stress in alcoholic liver disease[J].Chinese Pharmacological Bulletin, 2017, 33(10):1353-1356.
[26] 巩子汉, 王强, 段永强, 等.白及多糖对胃溃疡模型大鼠胃组织TNF-α、IL-1β、IL-6及JNK、p38 MAPK基因蛋白表达水平的影响[J].中药药理与临床, 2019, 35(4):90-95.GONG Z H, WANG Q, DUAN Y Q, et al.Effects of Bletilla baicalensis polysaccharide on the expression levels of TNF-α, IL-1β, IL-6, JNK and p38 MAPK genes in gastric tissues of rats with gastric ulcer[J].Pharmacology and Clinics of Chinese Materia Medica, 2019, 35(4):90-95.
[27] YANG R R, LI J J, XU X G, et al.Preventive and therapeutic effects of Lactobacillus rhamnosus SHA113 and its culture supernatant on alcoholic gastric ulcers[J].Food &Function, 2021, 12(16):7250-7259.
[28] THIRUVENGADAM M, SUBRAMANIAN U, VENKIDASAMY B, et al.Emerging role of nutritional short-chain fatty acids (SCFAs) against cancer via modulation of hematopoiesis[J].Critical Reviews in Food Science and Nutrition, 2023, 63(6):827-844.
[29] 冯思敏, 宁可, 邵平, 等.β-谷甾醇和豆甾醇对小鼠急性结肠炎的治疗作用研究[J].中国粮油学报, 2018, 33(12):80-86;94.FENG S M, NING K, SHAO P, et al.Research on the β-sitosterol and stigmasterol therapeutic effect of acute colitis in mice[J].Journal of the Chinese Cereals and Oils Association, 2018, 33(12):80-86;94.
[30] 张荣彬, 杨懿, 周志磊, 等.甘露低聚糖和部分水解瓜尔胶对小鼠慢性酒精性肝损伤的保护作用[J].食品科学, 2023, 44(11):95-105.ZHANG R B, YANG Y, ZHOU Z L, et al.Protective effects of mannan oligosaccharides and partially hydrolyzed guar gum on chronic alcoholic liver injury in mice[J].Food Science, 2023, 44(11):95-105.
[31] BAJAJ J S.Alcohol, liver disease and the gut microbiota[J].Nature Reviews.Gastroenterology &Hepatology, 2019, 16(4):235-246.
[32] 岳文秀, 吴璐璐, 韩富亮.葡萄酒干物质和花色苷对人体肠道菌群的影响:基于体外模拟发酵法[J].食品科学, 2022, 43(11):121-129.YUE W X, WU L L, HAN F L.In vitro simulated fermentation evaluation of effects of dry matter and anthocyanins in red wine on intestinal microbiota[J].Food Science, 2022, 43(11):121-129.
[33] 刘溯. 雷公菌多糖对急性酒精性肝损伤的保护作用及其对肠道菌群的影响[D].长春:吉林农业大学, 2023.LIU S.Protective effect of Polysaccharides from Ganoderma lucidum on acute alcoholic liver injury and its impact on the gut microbiota[D].Changchun:Jilin Agricultural University, 2023.
[34] 苗昆, 刘艳, 王杰, 等.大蒜多糖结构及生物活性研究进展[J].食品与发酵工业, 2023, 49(18):322-331.MIAO K, LIU Y, WANG J, et al.Research progress on structure and bioactivity of garlic polysaccharide[J].Food and Fermentation Industries, 2023, 49(18):322-331.