紫苏桑叶金银花固体饮料是以紫苏、桑叶和金银花为主要活性成分制成的固体饮料。紫苏是唇形科紫苏属一年生草本植物,具有较高的营养价值[1]。紫苏叶中含有有机酸、氨基酸、类胡萝卜素和脂肪酸等营养素以及挥发油、黄酮类和酚酸类等活性成分,具有抗菌、抗氧化、抗过敏、消炎、抑制肿瘤等功效[2-3]。从紫苏叶中提取的挥发油可以有效调节血清中IL-12和IFN-γ的水平,并增强NK细胞活性,从而发挥免疫调节作用[4]。桑叶是桑科植物桑(Morus alba L.)的干燥叶,中医上俗称“铁扇子”,是国家卫生部1993年首批认定的药食同源中药材之一[5]。桑叶中不仅含有丰富的多酚类、黄酮类、生物碱类、黄烷醇类和多糖类等天然活性成分,还有氨基酸、维生素和钙、铁、锰、锌等矿物质[6]。现代药理学研究发现,桑叶具有降血糖、降血脂、免疫调节、抗炎和抗氧化等生理功能[7-8]。桑叶蛋白能够调节血清细胞因子的分泌,改善肠道健康从而减轻免疫抑制[9]。金银花是忍冬科忍冬属多年生藤本植物,又名忍冬花、银花、金银藤[10]。金银花富含黄酮类、多糖类、有机酸、挥发油、三萜皂苷类等活性物质,具有清热解热、抗菌消炎、抗病毒、保护肝损伤、降血糖、免疫调节等功能[11-13]。研究发现,金银花多糖可以调节血清免疫球蛋白水平以及增强NK细胞活性,从而有效提高机体的免疫力[14]。本研究通过建立小鼠免疫功能低下模型,利用紫苏桑叶金银花固体饮料进行干预,研究固体饮料的免疫调节活性;并通过Ames试验、小鼠骨髓微核试验和小鼠睾丸染色体畸变试验探讨固体饮料的抗突变作用。
1 材料与方法
1.1 材料与试剂
紫苏桑叶金银花固体饮料,由某生物工程有限公司提供;血常规检测试剂,希森美康医用电子(上海)有限公司;酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)试剂盒,武汉华美生物工程有限公司;鼠伤寒沙门氏菌突变型菌株TA97a、TA98、TA100和TA102,美国Moltox公司;S9肝匀浆,江苏齐氏生物科技有限公司;环磷酰胺(cyclophosphamide,CTX),美国Sigma公司;丝裂霉素C(mitomycin C,MMC),浙江海正药业股份有限公司;秋水仙素,国药集团化学试剂有限公司。
1.2 仪器
PL203型电子天平,梅特勒托利多仪器(上海)有限公司;XN系列全自动模块式血液体液分析仪,希森美康医用电子(上海)有限公司;LRH-400型生化培养箱,韶关市泰宏医疗器械有限公司;SpectraMax® Paradigm®型酶标仪,美国Molecular Devices公司;OLYMPUS CX41RF型生物显微镜,日本奥林巴斯公司;Panoramic MIDI型数字切片扫描仪,匈牙利3DHISECH公司。
1.3 试验动物
健康SPF级ICR小鼠,体重25.5~30.0 g,由南京医科大学提供,动物生产许可证号:SCXK(苏)2021-0001,合格证号:202319408。实验动物屏障环境设施使用许可证号:SYXK(苏)2022-0034。灭菌鼠饲料和无菌水自由食用。动物实验通过江苏省疾病预防控制中心实验动物福利伦理委员会批准,意见书编号为2023012。
1.4 实验方法
1.4.1 免疫调节作用研究试验
1.4.1.1 动物分组与给药
将50只雄性ICR小鼠随机分入1个空白对照组、1个模型对照组和833、1 667、5 000 mg/kg·BW 3个剂量组,每组10只。空白对照组和模型对照组经口给予纯水,样品组经口给予紫苏桑叶金银花固体饮料,每天1次,连续灌胃30 d。试验第25天和第26天,样品组及模型对照组腹腔注射CTX,剂量为40 mg/kg·BW,空白对照组腹腔注射等量生理盐水,腹腔注射1 h后再进行灌胃。
1.4.1.2 小鼠免疫器官指数测定
试验结束后,称量小鼠体质量,取出胸腺和脾脏,用生理盐水清洗后擦干称重,胸腺指数和脾脏指数的计算如公式(1)、公式(2)所示。
胸腺指数![]()
(1)
脾脏指数![]()
(2)
1.4.1.3 小鼠血常规指标测定
试验结束后,摘眼球取血200 μL于EDTA-K2抗凝EP管中,利用全自动血液分析仪进行血常规检测,检测指标包括白细胞(white blood cell,WBC)、红细胞(red blood cell,RBC)、血红蛋白(hemoglobin,HGB)、血小板(blood platelet,PLT)、红细胞压积(hematokrit,HCT)、淋巴细胞(lymphocyte,LY)、单核细胞(monocyte,MO)、中性粒细胞(neutrophile granulocyte,NE)、嗜酸性粒细胞(eosinophilic granulocyte,EO)和嗜碱性粒细胞(basophilic granulocyte,BA)。
1.4.1.4 小鼠血清细胞因子测定
试验结束后,摘眼球取血于2.0 mL EP管中,室温静置1 h,3 000 r/min离心15 min取上清液于-80 ℃保存。按照ELISA试剂盒说明书检测小鼠血清中细胞因子TNF-α、INF-γ和IL-1β的水平。
1.4.2 抗突变作用研究试验
1.4.2.1 Ames试验
以GB 15193.4—2014《食品安全国家标准 细菌回复突变试验》中平板掺入法为基本方法,针对不同抗突变作用机制,修改为以下2种试验程序。
程序一:受试物与阳性物同时作用的Ames试验,0.1 mL阳性物、0.1 mL受试物与0.1 mL增菌液同时加入0.5 mL磷酸盐缓冲液或0.5 mL S9混合液,于37 ℃水浴预培养20 min,取0.1 mL该悬液做细菌存活试验后,其余一同加入2 mL(45 ℃水浴)顶层培养基,迅速倾入底层培养基,平放固化,37 ℃培养48 h,计数回变菌落数。各剂量组每个菌株加S9和不加S9两种条件下各做3个平行皿。
程序二:受试物预处理阳性物后的Ames试验,0.1 mL阳性物与0.1 mL受试物加入0.5 mL磷酸盐缓冲液或0.5 mL S9混合液,于37 ℃水浴预培养20 min,再加入0.1 mL增菌液混匀,取0.1 mL该悬液做细菌存活试验后,其余一同加入2 mL(45 ℃水浴)顶层培养基,迅速倾入底层培养基,平放固化,37 ℃培养48 h,计数回变菌落数。各剂量组每个菌株加S9和不加S9两种条件下各做3个平行皿。
1.4.2.2 小鼠骨髓微核试验
ICR小鼠100只,雌雄各半,体重25.5~29.8 g,随机分入833、1 667、5 000 mg/kg·BW 3个剂量组、1个阴性对照组(纯水)和1个阳性对照组(CTX 40 mg/kg·BW),每组10只。阴性对照组和阳性对照组经口给予纯水,受试物组经口给予受试物,每天1次,连续灌胃30 d。试验最后2 d,受试物组及阳性对照组经口给予阳性物2次(间隔24 h),受试物组给予阳性物1 h后再给予受试物。第2次给予阳性物后6 h,取股骨骨髓悬于小牛血清中直接涂片、固定、染色。镜检嗜多染红细胞(polychromatophile,PCE)1 000个/鼠,计数含微核的细胞数,计算微核率和抑制率,每只动物观察200个PCE的同时计数所见到的正染红细胞(normochromatic erythrocyte,NCE)数,计算两者的比率(PCE/NCE)。
1.4.2.3 小鼠睾丸染色体畸变试验
雄性ICR小鼠50只,体重26.3~30.0 g,随机分入833、1 667、5 000 mg/kg·BW 3个剂量组、1个阴性对照组(纯水)和1个阳性对照组(MMC 2 mg/kg),每组10只。阴性对照组和阳性对照组经口给予纯水,受试物组经口给予受试物,每天1次,连续灌胃30 d。取材前第13天受试物组和阳性组腹腔注射MMC 1次,受试物组给予阳性物1 h后再给予受试物,动物处死前5 h腹腔注射秋水仙素(5 mg/kg)。颈椎脱臼法处死小鼠,取两侧睾丸,去净脂肪,撕开被膜,轻轻地分离曲细精管,室温下低渗,固定液固定,离心后60%(体积分数)冰醋酸软化,制片,Giemsa液染色,数字切片扫描仪扫描后阅片。
1.5 数据分析
试验结果以“平均值±标准差”表示,采用SPSS 19.0统计软件对数据进行统计分析。用卡方检验对小鼠骨髓微核试验和精母细胞染色体畸变试验结果进行分析,其余计量资料均采用单因素方差分析,P<0.05为差异具有统计学意义。
2 结果与分析
2.1 紫苏桑叶金银花固体饮料对小鼠体重和免疫器官指数的影响
由表1可见,各组小鼠的初始体重和终末体重均无统计学差异。与空白对照组相比,模型对照组小鼠胸腺指数和脾脏指数均显著降低,差异具有统计学意义(P<0.05,P<0.01),提示CTX可以抑制小鼠的免疫功能,小鼠免疫低下模型构建成功。与模型对照组相比,固体饮料各剂量组胸腺指数和脾脏指数均有不同程度的升高,且呈现剂量效应关系,中、高剂量组小鼠胸腺指数差异显著(P<0.05,P<0.01),高剂量组小鼠脾脏指数差异显著(P<0.05)。结果表明,固体饮料能够有效促进小鼠的免疫器官发育。
表1 各组小鼠体重和免疫器官指数
Table 1 body weight and immune organ index of mice in each group
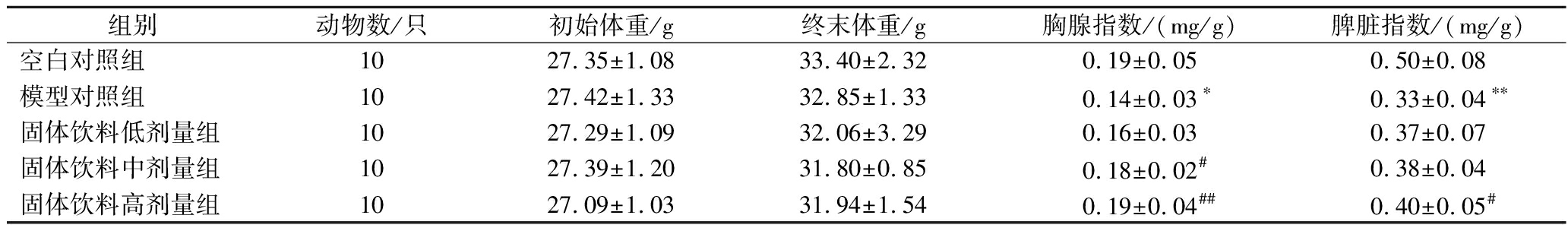
组别动物数/只初始体重/g终末体重/g胸腺指数/(mg/g)脾脏指数/(mg/g)空白对照组1027.35±1.0833.40±2.320.19±0.050.50±0.08模型对照组1027.42±1.3332.85±1.330.14±0.03∗0.33±0.04∗∗固体饮料低剂量组1027.29±1.0932.06±3.290.16±0.030.37±0.07固体饮料中剂量组1027.39±1.2031.80±0.850.18±0.02#0.38±0.04固体饮料高剂量组1027.09±1.0331.94±1.540.19±0.04##0.40±0.05#
注:与空白对照组相比,*P<0.05,**P<0.01;与模型对照组相比,#P<0.05,##P<0.01(下同)。
2.2 紫苏桑叶金银花固体饮料对小鼠血常规的影响
由表2可见,与空白对照组相比,模型对照组小鼠血液中WBC、HGB和PLT含量均显著降低,差异具有统计学意义(P<0.05,P<0.01),提示小鼠免疫低下模型构建成功。与模型对照组相比,固体饮料各剂量组RBC、HGB、PLT和HCT含量均有不同程度的升高,高剂量组PLT和HCT差异显著(P<0.05),低、中、高剂量组RBC和HGB差异显著(P<0.05,P<0.01)。结果表明,固体饮料能够有效提升小鼠的免疫细胞水平。
表2 各组小鼠血细胞数目
Table 2 The number of blood cells of mice in each group
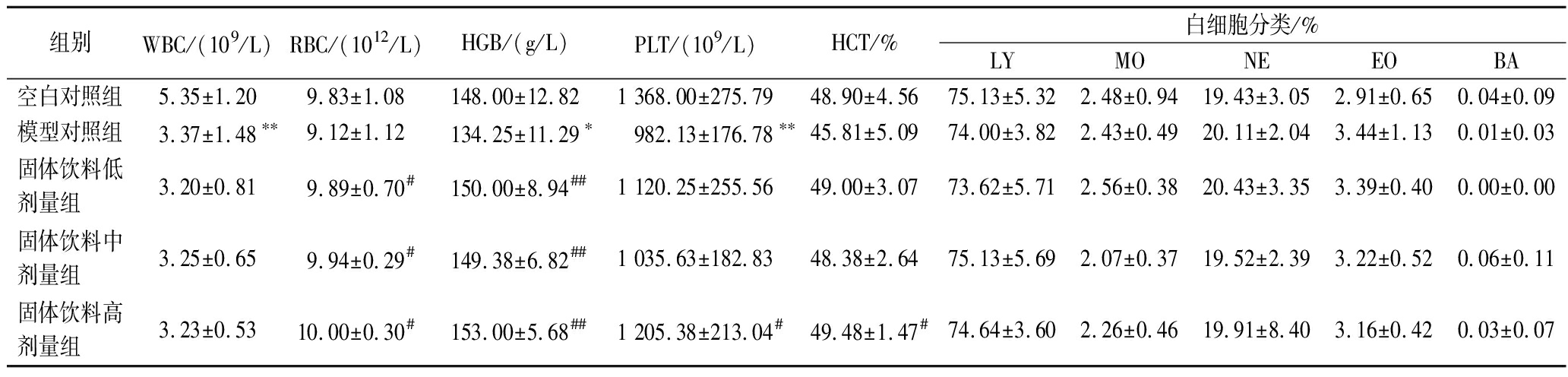
组别WBC/(109/L)RBC/(1012/L)HGB/(g/L)PLT/(109/L)HCT/%白细胞分类/%LYMONEEOBA空白对照组5.35±1.209.83±1.08148.00±12.821 368.00±275.7948.90±4.5675.13±5.322.48±0.9419.43±3.052.91±0.650.04±0.09模型对照组3.37±1.48∗∗9.12±1.12134.25±11.29∗982.13±176.78∗∗45.81±5.0974.00±3.822.43±0.4920.11±2.043.44±1.130.01±0.03固体饮料低剂量组3.20±0.819.89±0.70#150.00±8.94##1 120.25±255.5649.00±3.0773.62±5.712.56±0.3820.43±3.353.39±0.400.00±0.00固体饮料中剂量组3.25±0.659.94±0.29#149.38±6.82##1 035.63±182.8348.38±2.6475.13±5.692.07±0.3719.52±2.393.22±0.520.06±0.11固体饮料高剂量组3.23±0.5310.00±0.30#153.00±5.68##1 205.38±213.04#49.48±1.47#74.64±3.602.26±0.4619.91±8.403.16±0.420.03±0.07
2.3 紫苏桑叶金银花固体饮料对小鼠血清细胞因子的影响
由表3可见,与空白对照组相比,模型对照组小鼠血清中TNF-α、INF-γ和IL-1β的水平均显著升高,差异具有统计学意义(P<0.01)。与模型对照组相比,固体饮料各剂量组TNF-α、INF-γ和IL-1β的水平均有不同程度的下降,中剂量组TNF-α差异显著(P<0.05),高剂量组TNF-α、INF-γ和IL-1β均差异显著(P<0.05,P<0.01)。
表3 各组小鼠细胞因子水平
Table 3 Cytokine levels of mice in each group
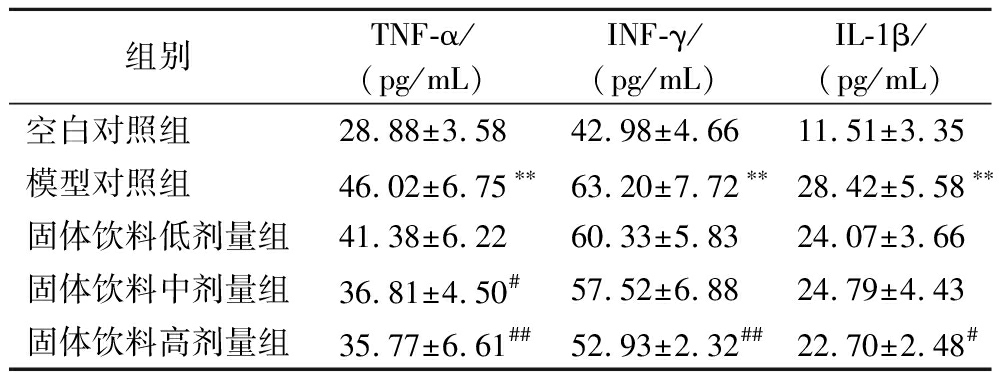
组别TNF-α/(pg/mL)INF-γ/(pg/mL)IL-1β/(pg/mL)空白对照组28.88±3.5842.98±4.6611.51±3.35模型对照组46.02±6.75∗∗63.20±7.72∗∗28.42±5.58∗∗固体饮料低剂量组41.38±6.2260.33±5.8324.07±3.66固体饮料中剂量组36.81±4.50#57.52±6.8824.79±4.43固体饮料高剂量组35.77±6.61##52.93±2.32##22.70±2.48#
2.4 Ames试验
由表4可见,在加S9条件下,受试物与阳性物2-氨基芴同时作用,剂量5.00 mg/皿以上对TA98菌株回复突变有抑制作用,剂量10.00 mg/皿以上对TA100菌株回复突变有抑制作用;在加S9条件下,受试物预处理阳性物2-氨基芴,剂量10.00 mg/皿以上对2-氨基芴诱导的TA98、TA100菌株回复突变均有抑制作用。结果表明,固体饮料对阳性物诱导的Ames菌株回复突变具有拮抗作用。
表4 Ames试验结果
Table 4 Results of Ames test
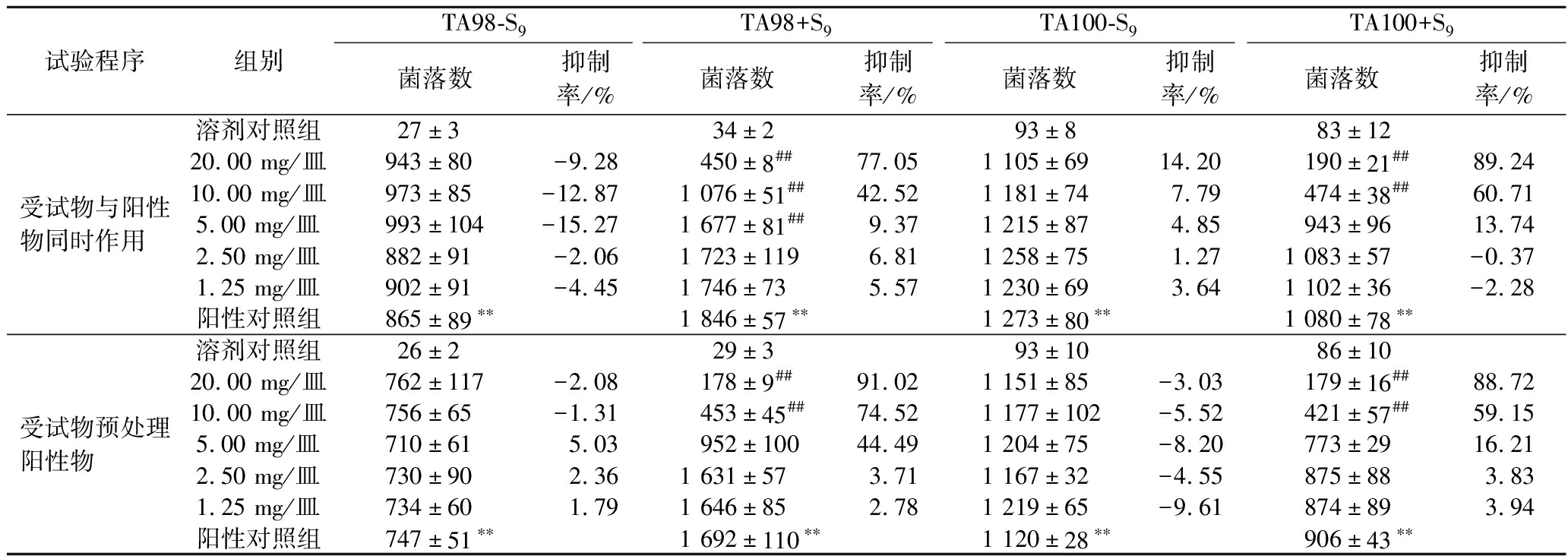
试验程序组别TA98-S9TA98+S9TA100-S9TA100+S9菌落数抑制率/%菌落数抑制率/%菌落数抑制率/%菌落数抑制率/%受试物与阳性物同时作用溶剂对照组27±334±293±883±1220.00 mg/皿943±80-9.28450±8##77.051 105±6914.20190±21##89.2410.00 mg/皿973±85-12.871 076±51##42.521 181±747.79474±38##60.715.00 mg/皿993±104-15.271 677±81##9.371 215±874.85943±9613.742.50 mg/皿882±91-2.061 723±1196.811 258±751.271 083±57-0.371.25 mg/皿902±91-4.451 746±735.571 230±693.641 102±36-2.28阳性对照组865±89∗∗1 846±57∗∗1 273±80∗∗1 080±78∗∗受试物预处理阳性物溶剂对照组26±229±393±1086±1020.00 mg/皿762±117-2.08178±9##91.021 151±85-3.03179±16##88.7210.00 mg/皿756±65-1.31453±45##74.521 177±102-5.52421±57##59.155.00 mg/皿710±615.03952±10044.491 204±75-8.20773±2916.212.50 mg/皿730±902.361 631±573.711 167±32-4.55875±883.831.25 mg/皿734±601.791 646±852.781 219±65-9.61874±893.94阳性对照组747±51∗∗1 692±110∗∗1 120±28∗∗906±43∗∗
注:TA98-S9阳性物为敌克松,50 μg/皿;TA100-S9阳性物为叠氮钠,1.5 μg/皿;TA98+S9和TA100+S9阳性物均为2-氨基芴,10 μg/皿;**与溶剂对照组相比,超过溶剂对照组2倍以上;与阳性对照组相比,#P<0.05,##P<0.01。
2.5 小鼠骨髓微核试验
由表5可见,与阴性对照组相比,阳性对照组小鼠骨髓微核率显著升高,差异具有统计学意义(P<0.01),表明40 mg/kg·BW剂量的CTX能够诱发小鼠骨髓微核形成。与阳性对照组相比,固体饮料各剂量组小鼠骨髓细胞微核率均显著下降,差异具有统计学意义(P<0.01),表明固体饮料对CTX诱导的小鼠骨髓细胞微核率具有抑制作用。雌性小鼠低、中、高3个剂量组的微核抑制率分别为30.4%、46.4%和60.5%,雄性小鼠低、中、高3个剂量组的微核抑制率分别为30.5%、46.9%和59.1%;随着剂量的增加抑制率增强,其中5 000 mg/kg时的抑制作用最强。结果表明,固体饮料可以抑制CTX对小鼠骨髓细胞的致突变作用,并且存在明显的剂量-反应关系。
表5 小鼠骨髓微核试验结果
Table 5 Results of mouse bone marrow erythrocyte micronucleus test

性别组别动物数/只观察PCE数/个含微核PCE数/个微核细胞率/‰抑制率/%PCE/NCE细胞数/个PCE/NCE比例雌性阴性对照组1010 000141.4±0.842 122/2 2760.93±0.05固体饮料低剂量组1010 00020620.6±2.46##30.42 074/2 3570.88±0.04固体饮料中剂量组1010 00016216.2±2.25##46.42 111/2 3110.92±0.05固体饮料高剂量组1010 00012312.3±1.49##60.52 132/2 3730.90±0.03阳性对照组1010 00029029.0±2.00∗∗2 173/2 6070.83±0.03雄性阴性对照1010 000121.2±0.792 131/2 2580.95±0.05固体饮料低剂量组1010 00019219.2±1.93##30.52 076/2 3010.91±0.06固体饮料中剂量组1010 00014414.4±1.51##46.92 139/2 4060.89±0.04固体饮料高剂量组1010 00011811.8±1.32##59.12 143/2 2910.94±0.07阳性对照1010 00027127.1±1.29∗∗2 106/2 4590.86±0.05
注:与阴性对照组相比,**P<0.01;与阳性对照组相比,#P<0.05,##P<0.01(下同)。
2.6 小鼠睾丸染色体畸变试验
由表6可见,与阴性对照组相比,阳性对照组小鼠睾丸染色体畸变率显著升高,差异具有统计学意义(P<0.01)。与阳性对照组相比,固体饮料中、高剂量组小鼠睾丸染色体畸变率均显著下降,差异具有统计学意义(P<0.05,P<0.01),表明受试物对MMC诱导的小鼠睾丸染色体畸变率具有抑制作用。低、中、高3个剂量组的抑制率分别为8.9%、25.9%和65.2%,随着剂量的增加抑制率增强,其中5 000 mg/kg时的抑制作用最强。结果表明,固体饮料可以抑制MMC对小鼠睾丸染色体的致突变作用,并且存在明显的剂量-反应关系。
表6 小鼠睾丸染色体畸变试验结果
Table 6 Results of mouse testicular chromosome aberration test

组别动物数/只观察细胞数/个裂隙/个性染色体单价体/%常染色体单价体/%染色体畸变类型/个断片易位微小体断裂畸变细胞数/个畸变细胞率/%抑制率/%阴性对照组101 00001.1±0.62.4±0.7600060.6±0.7阳性对照组101 00002.1±1.03.6±1.1590302911811.8±1.8∗∗固体饮料低剂量组101 00000.9±0.71.2±1.0650291410810.8±1.68.9固体饮料中剂量组101 00001.1±0.92.0±0.8540269898.9±1.5#25.9固体饮料高剂量组101 00000.7±0.71.6±0.532076454.5±0.8##65.2
3 讨论
免疫是人体正常的生理功能,能够识别并清除进入机体的抗原物质或机体自身产生的衰老、损伤、死亡以及突变细胞等,从而维持机体内环境稳态,保证人体健康[15]。脾脏是最大的外周淋巴器官,是发生免疫应答的主要场所。胸腺作为中枢免疫器官,是T淋巴细胞发育、分化、成熟和向外周输出的场所。胸腺指数和脾脏指数可以提示淋巴细胞增殖分化的水平[16]。本研究中,CTX组小鼠的胸腺指数和脾脏指数较空白组显著降低,固体饮料不同剂量的干预后,两者均出现了不同程度的改善,提示免疫功能增强。CTX作为广泛使用的细胞毒性药物,会对骨髓功能造成抑制作用。而骨髓是WBC、RBC、HGB和PLT发育分化的部位,当骨髓受到抑制时,血细胞的数量和比例会发生改变,造成免疫能力的降低[17]。本研究中,CTX组小鼠血液中WBC、HGB和PLT含量均显著降低,表明免疫低下模型建立成功,这一结果与何嘉桃等[18]的动物模型结果相吻合。而固体饮料不同剂量的干预后,血液中RBC、HGB、PLT和HCT含量均有不同程度的升高,高剂量组PLT和HCT差异显著,低、中、高剂量组RBC和HGB差异显著,提示固体饮料可以改善CTX导致的小鼠血细胞指标异常和免疫力下降的症状。细胞因子是由免疫细胞和某些非免疫细胞经刺激而分泌、合成的小分子蛋白质,可以参与并调节机体免疫应答、细胞分化和肿瘤免疫等生理和病理过程[19-20]。TNF-α、INF-γ和IL-1β均为促炎性免疫细胞因子,炎症反应加剧时促炎因子的分泌量会增多,从而影响体液免疫功能的发挥[21]。本研究中,CTX组小鼠血清中TNF-α、INF-γ和IL-1β的含量均显著升高,提示CTX对小鼠的免疫系统造成损伤。经固体饮料干预后,高剂量组小鼠TNF-α、INF-γ和IL-1β的含量均显著下降,起到了调节小鼠免疫功能的作用。以上结果均表明,紫苏桑叶金银花固体饮料能够有效调节小鼠的免疫力。
为进一步检测紫苏桑叶金银花固体饮料的抗突变作用,本文参考已有的文献方法[22-23],进行了Ames试验、骨髓微核试验和睾丸染色体畸变试验。Ames试验是最为广泛应用的基因突变检测方法,鼠伤寒沙门氏菌组氨酸缺陷型菌株TA98可检测移码突变,TA100可检测碱基置换,是当前遗传毒性评价方法中对致癌物预测度最高的实验[24]。骨髓微核试验是从细胞水平检测染色体损伤或有丝分裂器损伤的试验方法,睾丸染色体畸变试验是通过观察睾丸细胞染色体畸变情况,判断雄性生殖细胞遗传突变的可能性[25]。本研究结果显示,紫苏桑叶金银花固体饮料具有较高的抗突变活性。在加S9条件下,受试物与阳性物2-氨基芴同时作用,剂量5.00 mg/皿以上对TA98菌株回复突变有抑制作用,剂量10.00 mg/皿以上对TA100菌株回复突变有抑制作用,剂量为20.00 mg/皿时,对TA98、TA100菌株的抑制率分别为77.05%和89.24%;在加S9条件下,预处理阳性物2-氨基芴,样品剂量10.00 mg/皿以上,对2-氨基芴诱导的TA98、TA100菌株回复突变均有抑制作用,剂量为20.00 mg/皿时,对TA98、TA100菌株的抑制率分别为91.02%和88.72%。骨髓微核试验结果显示,与CTX组相比,固体饮料各剂量组小鼠骨髓细胞微核率均显著下降,5 000 mg/kg时的抑制作用最强。由此可见,固体饮料对CTX引起的染色体损伤具有拮抗作用。睾丸染色体畸变试验显示,与MMC组相比,固体饮料中、高剂量组小鼠睾丸染色体畸变率均显著下降,5 000 mg/kg时的抑制作用最强。表明固体饮料对小鼠生殖细胞具有一定的保护作用。其可能的机制为:①增强免疫功能。本研究中,固体饮料可以有效恢复骨髓造血功能,抑制促炎因子TNF-α、INF-γ和IL-1β的分泌,从而提高机体免疫力,这可能与其抗突变机制有关;②清除自由基,抗氧化活性。自由基的过量产生会诱导氧化应激反应,造成DNA氧化损伤[26]。研究表明,紫苏叶、桑叶和金银花均具有良好的抗氧化活性,可以有效清除自由基[27-29]。因此,固体饮料可能通过清除自由基增强机体抗氧化能力从而抑制DNA损伤。关于紫苏桑叶金银花固体饮料的抗突变作用机制仍需进一步研究。综上所述,紫苏桑叶金银花固体饮料不仅可以调节机体的免疫力,还可以修复诱变剂引起的遗传损伤。
[1] 魏颖, 郭颖, 李明亮, 等.紫苏籽肽抗疲劳功效及其作用机理[J].中国食品学报, 2021, 21(7):157-162.WEI Y, GUO Y, LI M L, et al.Anti-fatigue activity and mechanisms of peptides derived from Perilla frutescens seeds[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(7):157-162.
[2] HUANG S C, NAN Y, CHEN G Q, et al.The role and mechanism of Perilla frutescens in cancer treatment[J].Molecules, 2023, 28(15):5883.
[3] 程琳杰, 吴荣书.茉莉紫苏复合浓缩液对高血糖小鼠血糖影响的研究[J].食品研究与开发, 2020, 41(19):36-40.CHENG L J, WU R S.Effect of jasmine perilla complex concentrate on blood glucose in hyperglycemic mice[J].Food Research and Development, 2020, 41(19):36-40.
[4] JUNG S J, BAEK H I, PARK E O, et al.Immunomodulatory effects of supercritical CO2 extracted oils from Portulaca oleracea and Perilla frutescens (PPCE) in healthy individuals:A randomized double-blind clinical trial[J].Food &Function, 2025, 16(5):1708-1719.
[5] 林闪闪, 王梦娇, 许金国, 等.桑叶化学成分与药理作用研究进展及其质量标志物预测分析[J].中草药, 2023, 54(15):5112-5127.LIN S S, WANG M J, XU J G, et al.Predictive studies of quality markers in Mori Folium based on chemical constituents and pharmacological mechanism[J].Chinese Traditional and Herbal Drugs, 2023, 54(15):5112-5127.
[6] MA G Q, CHAI X Y, HOU G G, et al.Phytochemistry, bioactivities and future prospects of mulberry leaves:A review[J].Food Chemistry, 2022, 372:131335.
[7] 黄慧, 夏鑫, 周应军, 等.不同提取方法的桑叶提取物对小鼠生长性能、抗氧化和免疫功能的作用研究[J].动物营养学报, 2022, 34(4):2702-2711.HUANG H, XIA X, ZHOU Y J, et al.Effects of mulberry leaf extracts with different extraction methods on growth performance, antioxidant and immune function in mice[J].Chinese Journal of Animal Nutrition, 2022, 34(4):2702-2711.
[8] HAN X Y, SONG C Y, FENG X X, et al.Isolation and hypoglycemic effects of water extracts from mulberry leaves in Northeast China[J].Food &Function, 2020, 11(4):3112-3125.
[9] SHAN Y W, SUN C Z, LI J S, et al.Characterization of purified mulberry leaf glycoprotein and its immunoregulatory effect on cyclophosphamide-treated mice[J].Foods, 2022, 11(14):2034.
[10] 马懿, 熊蓉, 肖雄峻, 等.金银花叶乳酸杆菌发酵凉茶的研制及其抗氧化活性分析[J].食品工业科技, 2023, 44(9):254-261.MA Y, XIONG R, XIAO X J, et al.Preparation of herbal tea fermented by Lactobacillus from Lonicera japonica leaves and analysis of its antioxidant activity[J].Science and Technology of Food Industry, 2023, 44(9):254-261.
[11] 戴丛书, 柴晶美, 林长青.金银花黄酮提取物的降血糖作用[J].食品工业科技, 2022, 43(24):386-393.DAI C S, CHAI J M, LIN C Q.Hypoglycemic effect of flavonoid extract from Lonicera japonica Thunb[J].Science and Technology of Food Industry, 2022, 43(24):386-393.
[12] 张钰明, 夏士程, 张淋淋, 等.金银花提取物对小鼠阿霉素肝脏损伤的保护作用[J].南方医科大学学报, 2024, 44(8):1571-1581.ZHANG Y M, XIA S C, ZHANG L L, et al.Protective effect of Lonicerae japonicae flos extract against doxorubicin-induced liver injury in mice[J].Journal of Southern Medical University, 2024, 44(8):1571-1581.
[13] WU S X, XIONG R G, CHENG J, et al.Preparation, antioxidant activities and bioactive components of kombucha beverages from golden-flower tea (Camellia petelotii) and honeysuckle-flower tea (Lonicera japonica)[J].Foods, 2023, 12(16):3010.
[14] ZHANG T, LIU H P, MA P C, et al.Immunomodulatory effect of polysaccharides isolated from Lonicera japonica Thunb.in cyclophosphamide-treated BALB/c mice[J].Heliyon, 2022, 8(11):e11876.
[15] LONGEVITY M C.Retracted:Antioxidant indexes and immune function of the intestinal flora of compound microecological preparations[J].Oxidative Medicine and Cellular Longevity, 2024, 2024:9780381.
[16] 赵佩佩, 殷欣, 夏雪奎, 等.复方蜂胶提取物提高小鼠的免疫力[J].现代食品科技, 2021, 37(11):144-150.ZHAO P P, YIN X, XIA X K, et al.Enhancing the immune function of mice using propolis extract mixtures[J].Modern Food Science and Technology, 2021, 37(11):144-150.
[17] 李丹, 王文千, 李明亮, 等.蜂王浆对免疫功能低下小鼠免疫功能的影响[J].食品与发酵工业, 2022, 48(1):139-145.LI D, WANG W Q, LI M L, et al.Effect of royal jelly on mice with immunodeficiency[J].Food and Fermentation Industries, 2022, 48(1):139-145.
[18] 何嘉桃, 苏泽椿, 孙东方, 等.贻贝粗多糖对环磷酰胺致小鼠免疫低下及生殖遗传毒性的保护作用[J].安徽农业科学, 2022, 50(3):170-173.HE J T, SU Z C, SUN D F, et al.Protective effects of mussel crude polysaccharides on immunodeficiency and reproductive genotoxicity induced by cyclophosphamide in mice[J].Journal of Anhui Agricultural Sciences, 2022, 50(3):170-173.
[19] 史涵旭, 周雅琳, 赵润茏, 等.川牛膝水提物对环磷酰胺诱导的免疫抑制小鼠免疫功能的影响[J].食品安全质量检测学报, 2022, 13(11):3566-3574.SHI H X, ZHOU Y L, ZHAO R L, et al.Effects of water extract of Cyathulae Radix on immune function in immunosuppressed mice induced by cyclophosphamide[J].Journal of Food Safety &Quality, 2022, 13(11):3566-3574.
[20] LAN T X, CHEN L, WEI X W.Inflammatory cytokines in cancer:Comprehensive understanding and clinical progress in gene therapy[J].Cells, 2021, 10(1):100.
[21] ZOU Y C, YAN L M, GAO Y P, et al.miR-21 may act as a potential mediator between inflammation and abnormal bone formation in ankylosing spondylitis based on TNF-α concentration-dependent manner through the JAK2/STAT3 pathway[J].Dose-response, 2020, 18(1):1559325819901239.
[22] 王虹, 刘敏玲, 邵蕾.猪苓多糖抗突变作用研究[J].西北农业学报, 2014, 23(2):35-38.WANG H, LIU M L, SHAO L.Antimutagenic effects of polysaccharide in Polyporus[J].Acta Agriculturae Boreali-Occidentalis Sinica, 2014, 23(2):35-38.
[23] 李雪, 金乾坤, 李晓东, 等.长白山野生食用菌多糖抗突变作用的研究[J].食品研究与开发, 2015, 36(14):139-142.LI X, JIN Q K, LI X D, et al.Study on the anti-mutation effect of changbai mountain wild edible fungus polysaccharide[J].Food Research And Development, 2015, 36(14):139-142.
[24] 刘玉明, 蒋定文, 李珂娴, 等.银参胶囊遗传毒性研究[J].中国药业, 2020, 29(3):17-19.LIU Y M, JIANG D W, LI K X, et al.Genotoxicity of Yinshen capsule[J].China Pharmaceuticals, 2020, 29(3):17-19.
[25] 马会, 高梅, 李雪, 等.三七红曲复方制剂遗传毒性评价[J].食品与药品, 2022, 24(1):21-25.MA H, GAO M, LI X, et al.Genotoxicity evaluation of Sanqi and Hongqu compound preparation[J].Food and Drug, 2022, 24(1):21-25.
[26] WU H, LIU Q H, YANG N X, et al.Polystyrene-microplastics and DEHP co-exposure induced DNA damage, cell cycle arrest and necroptosis of ovarian granulosa cells in mice by promoting ROS production[J].Science of The Total Environment, 2023, 871:161962.
[27] 张婉萍, 陈婕, 王恒, 等.紫苏叶的活性成分及生物活性研究进展[J].食品与发酵工业, 2023, 49(20):361-368.ZHANG W P, CHEN J, WANG H, et al.Progress in research and development on active ingredients and biological activities from Perilla leaves[J].Food and Fermentation Industries, 2023, 49(20):361-368.
[28] LIN Z W, GAN T T, HUANG Y Z, et al.Anti-inflammatory activity of mulberry leaf flavonoids in vitro and in vivo[J].International Journal of Molecular Sciences, 2022, 23(14):7694.
[29] ZHENG S L, WANG Y M, CHI C F, et al.Chemical characterization of honeysuckle polyphenols and their alleviating function on ultraviolet B-damaged HaCaT cells by modulating the Nrf2/NF-κB signaling pathways[J].Antioxidants, 2024, 13(3):294.