Scale-down技术即规模缩小技术,是一种在生物制药、化工、食品加工等领域中常用的实验方法[1-2]。以生产规模进行实验性研究往往成本高昂、设置复杂且难以重现,因此scale-down技术的开发已成为必要。该技术的核心在于将实际生产过程中的工艺单元操作按比例缩小至实验室规模,便于研究和控制工艺参数,进而预测和优化大规模生产过程。Scale-down模型的建立通常需保持与大规模生产过程相似的理化参数。例如,在液态发酵生物反应器中,维持恒定的单位体积叶轮功率(P/V)或氧传递系数(KLa)是构建有效模型的关键因素[3]。验证scale-down模型与生产规模工艺的相似性,则需要比较各种输出参数包括生长曲线、生产速率以及与产品质量相关的属性。这些参数有助于评估模型的准确性和可靠性,确保实验室规模结果能够符合大规模生产的性能。
基于数学模型的过程,scale-down作为一种经典方法已被广泛应用于液态发酵研究[4]。FARRELL等[5]成功开发了一个缩小版的好氧发酵模型,通过保持恒定的体积氧传递系数(KLa)来调整不同规模发酵罐中的O2传递效率,从而在2、20 L和200 L规模上复现了重组蛋白疫苗生产过程。HARINGA等[6]基于底物浓度变化,采用Euler-Lagrange流体动力学方法对酿酒酵母工业规模好氧发酵成功进行了缩小模拟。HUANG等[7]通过保持恒定的单位体积叶轮功率(P/V),建立了一个能代表50 L Vero细胞培养疫苗生产过程的缩小模型,并通过多变量数据分析展示了细胞生长、代谢活性和产品质量在不同规模间的一致性。
然而,关于固态发酵体系的scale-down研究相对较少。固态发酵是一种特殊的生物加工过程,在缺乏自由水的环境中进行,微生物在惰性载体或水不溶性基质上进行生长和发酵[8]。以白酒生产为例,大曲清香型白酒通常以大麦或小麦、豌豆低温制成的大曲作为糖化发酵剂,并以高粱作为酿酒的单一原料[8-9],属于典型的混菌固态发酵。目前,传统固态发酵产业面临升级。物流、原料预处理、蒸馏和包装等过程已经基本实现自动化,但关键发酵环节大多仍采用传统的发酵方式,如地缸发酵,长期处于半受控条件。这是由于白酒固态发酵过程存在传质传热难题,且缺乏系统的过程工程学研究进行过程控制与反应器设计[10]。相关研究表明,热传递是固态发酵体系scale-down的关键[11-12]。实验室规模固态发酵通常具有体积小、产热少、热损高等特点,往往无法达到生产体系的发酵温度,与生产体系存在显著差异。这归因于不同规模体系为微生物提供的特定环境条件不同,从而导致热量传递在各体系中表现出差异性,最终影响发酵酒醅理化指标的特定演变[13-14]。
本研究旨在基于传热基本原理,对生产体系进行缩小,并通过实验室规模的工艺简化和在线测量,开发并验证一个大曲清香型白酒scale-down发酵体系,为实际生产发酵的调控优化提供解决思路。
1 材料与方法
1.1 材料与试剂
高粱、大曲、稻壳均由某白酒厂提供。乳酸、乙酸、乙醇、葡萄糖、叔戊醇、乙酸正戊醇、2-乙基丁酸、NaOH、H2SO4、碘、KI,国药集团(上海)有限公司;酒石酸钾钠、DNS,上海泰坦公司;FastDNATM SPIN Kit for Soil DNA Extraction 试剂盒,美国MP公司。
1.2 仪器与设备
Agilent 1200高效液相色谱仪、气相色谱仪6890,Agilent公司;Milli-Q超纯水机,Millipore公司;电子分析天平,Mettler Toledo公司;BXS400-SI恒温恒湿培养箱,上海博讯公司;HJ-4B恒温磁力搅拌器,常州苏瑞公司;冷冻离心机,Beckman Coulter 公司;INTERSAMRT 50 L馏酒系统,泸州智通自动化设备公司。
1.3 Scale-down体系设计
为了建立实验室规模反应器,需要确定反应器相关参数。首先对生产过程发酵容器进行分析,并为本研究的实验室规模系统选择相关配置。
1.3.1 生产规模反应器
生产规模发酵系统通常由4个不同的部分组成:发酵酒醅、地缸、顶盖和四周土壤。对于地缸发酵容器,通常使用深1.2 m、直径0.8 m的陶缸,体积大约为250 L。这些缸体被埋入土壤,缸口与地面持平,以实现酒醅与土壤的有效隔离。这种设计不仅确保了酒醅清洁卫生,而且还在酒醅发酵过程中起到重要传热作用。发酵缸顶盖通常是由质地均匀、无裂缝的石板制成,这些顶盖起到密封发酵缸的作用,防止外界杂菌的侵入,保持缸内发酵环境稳定。地缸四周土壤对酒醅温度有显著影响。在没有强制通风的厌氧发酵中,内部热量主要通过热传导传递给土壤。因此,温度是微生物产热和热传导共同的结果[11]。
1.3.2 实验室规模反应器设计
一般来说,发酵过程scale-down体系是基于生物反应器参数和发酵参数共同构建的[15]。这就取决于生物反应器的几何形状和发酵过程特征[16-17]。实验室规模反应器将地缸简化为圆柱形。如果反应器内基质热量积累不充分,则无法达到所需的发酵温度。一方面,产生热量与微生物数量和可利用的基质体积(V)成正比。另一方面,由傅里叶定律和Stefan-Boltzmann 定律[18],热传导和热辐射取决于外部交换面积(A)和发酵罐本身的导热性,具体按公式(1)、公式(2)计算:
(1)
Q′=σ×A×Fs×Fe(Ts4-Te4)
(2)
式中:A,总传热面积,m2;κ,导热系数,W/(m·K);Q,热传导,![]() 基底与外部介质之间的温度梯度,K/m;Q′,热辐射,W;σ,辐射常数,W/(m2·K4);Ts,Te分别为反应器温度和环境空气温度,K;Fs、Fe,常数。
基底与外部介质之间的温度梯度,K/m;Q′,热辐射,W;σ,辐射常数,W/(m2·K4);Ts,Te分别为反应器温度和环境空气温度,K;Fs、Fe,常数。
圆柱反应器高度为L,底部半径为R,器壁厚度为d,体积(V)和表面积(A)分别可用公式(3)、公式(4)表示:
(3)
(4)
式中采用与生产体系一致的径高比(d/H=2/3),可获得给定体积下的最小传热表面积,得到公式(5)、公式(6):
(5)
(6)
当传热表面积A最小时,可以延缓体系内部的散热。根据公式(1),通过减少与外部环境之间的温度差也可以有效降低热损失,可以通过将反应器放置在恒温培养箱、水浴中,或使用隔热材料来实现。这些措施有助于维持反应器内部的温度稳定性,从而提高模拟的准确性。
1.4 Scale-down体系发酵初始参数
Scale-down体系输入参数如下表1所示。根据1.3.2节中计算得反应器高度为0.306 m,底部半径为0.102 m。整个反应器包括均匀混合的固态发酵基质、顶空气体、反应器顶盖以及反应器壁。反应器顶盖液封,内部发酵基质占总体积90%,纽扣温度计置于基质中心位置。选择大曲清香型白酒固态发酵过程作为蓝本,初始原料为高粱、大曲和稻壳的混合物(质量比为10∶2∶1)[19]。
表1 Scale-down体系初始输入参数
Table 1 Input parameters of scale-down system
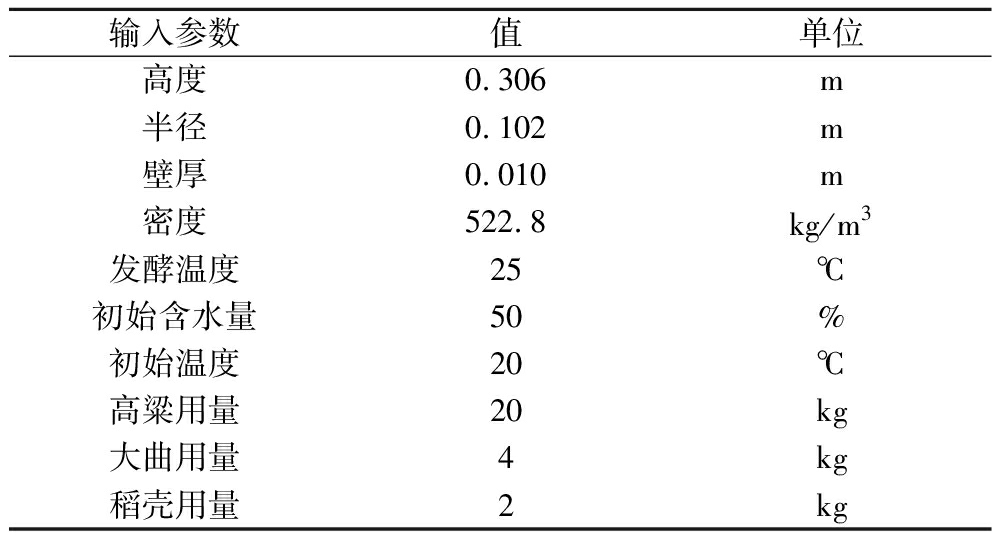
输入参数值单位高度0.306m半径0.102m壁厚0.010m密度522.8kg/m3发酵温度25℃初始含水量50%初始温度20℃高粱用量20kg大曲用量4kg稻壳用量2kg
1.5 实验室规模发酵实验
高粱和稻壳拌匀后上甑蒸粮,蒸粮2~3 h。蒸好后摊晾至30 ℃以下,拌曲发酵,发酵罐置于恒温恒湿培养箱(25 ℃,相对湿度70%)中发酵28 d。从发酵第0天开始,分别采集发酵0、3、7、10、15、21、23、28 d的酒醅,取样点如图1所示。a1、a2、a3点指示地缸发酵底部取样点,深度为1.0 m;b1、b2、b3点指示地缸发酵内部取样点,深度为0.6~0.7 m;c1、c2、c3点指示地缸发酵上层取样点,深度为0.1~0.2 m;d点指示实验室规模发酵中层取样点,深度为0.16 m。
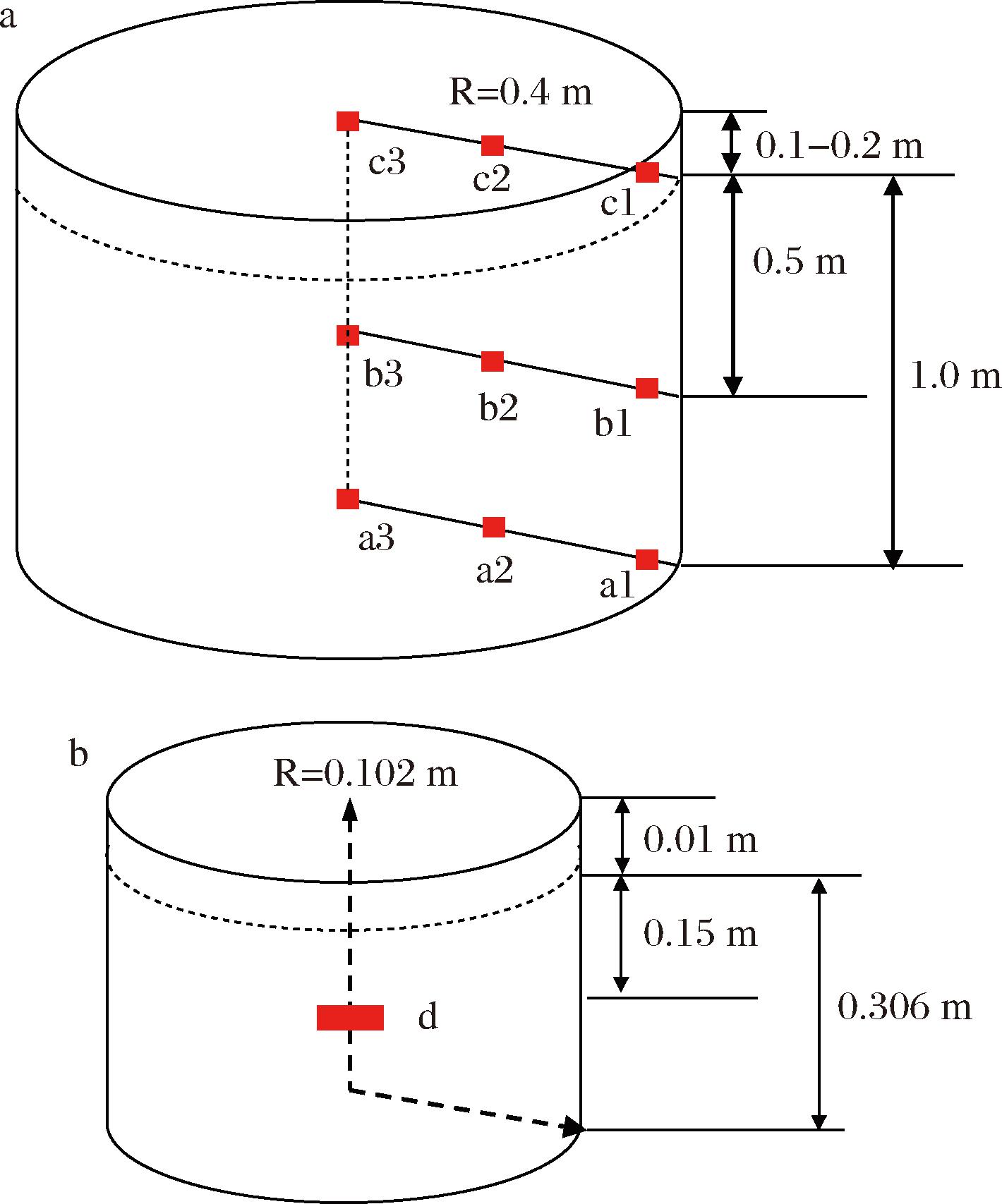
a-生产体系;b-实验室发酵体系
图1 生产体系和实验室发酵体系取样点示意图
Fig.1 Schema of the sampling positions during the pit fermentation and scale-down fermentation
1.6 理化指标检测
纽扣温度计每12 h自动记录温度。通过HPLC检测发酵液中葡萄糖、乳酸、乙醇含量[20]。色谱柱采用BioRad 300 mm Aminex HPX-87H(Bio-Rad,USA),柱温60 ℃,流动相5 mmol/L H2SO4溶液,流速0.5 mL/min,检测器采用Agilent G1362示差检测器,分析时间30 min。利用DNS法测定淀粉含量[21]。将5 g酒醅在80 ℃烘箱烘干12 h至恒重来计算酒醅含水量。
1.7 基酒风味物质检测
发酵完成将酒醅分层装入50 L智能馏酒设备并加盖密封,开始蒸馏,将出酒酒度设定65 ℃后开始接酒。气相色谱-火焰离子化检测方法如下:取1 mL酒样,在酒样中加入50 μL定量内标(2-甲基丁酸2.11 mg/L;叔戊醇2.33 mg/L;乙酸正戊酯2.64 mg/L),在分流模式(分流比=20∶1)下将样品直接注射到进样口中。使用CP-WAX色谱柱(50 m×0.25 mm×0.20 μm)进行化合物的分离。载气为高纯氦气,流速1 mL/min。初始柱温35 ℃,保持5 min,然后以4 ℃/min的速度升至100 ℃,保持2 min,然后再以8 ℃/min的速度升至150 ℃,最后以1 ℃/min的速度升至200 ℃,并保持25 min。进样口和检测器温度均设置为250 ℃。
1.8 酒醅微生物检测
按照FastDNATM SPIN Kit for Soil DNA Extraction 试剂盒说明书进行微生物群落总基因组DNA抽提。使用上游引物(5′-CCTACGGGNGGCWGCAG-3′)和下游引物(5′-GACTACHVGGGTATCTAATCC-3′)对扩增16S rRNA基因V3~V4可变区;使用上游引物(5′-GCATCGATGAAGAACGCAGC-3′)和下游引物(5′-TCCTCCGCTTATTGATATGC-3′)扩增ITS2可变区。将扩增产物送南京基序智谷生物科技有限公司测序。采用了QIIME2软件包中的cutadapt插件剔除可能存在的adapter序列和引物,通过DADA2插件对数据质量控制、去噪、序列拼接以及去除嵌合体,进而生成了Feature表和代表性序列。基于各标准品的已知浓度与检测数量建立标准曲线,根据每个样本中检测到的ASV数量,通过标准曲线推算出每个样本中各个ASV的绝对拷贝数。
1.9 统计学分析
本实验样品进行3次测定,数据以“平均值±标准偏差”表示。采用了双单侧t检验(two one-sided test, TOST)方法评估动力学参数的等效性,以P<0.05作为判断统计学显著性差异的标准。设定θ为生产体系数据的±3倍标准差,对于每个特定变量,若不同规模条件下平均差的95%置信区间(CI)完全位于可接受的范围(-θ,θ)内,则认为这2组性能参数在统计学上等效。
2 结果与分析
2.1 理化性质变化
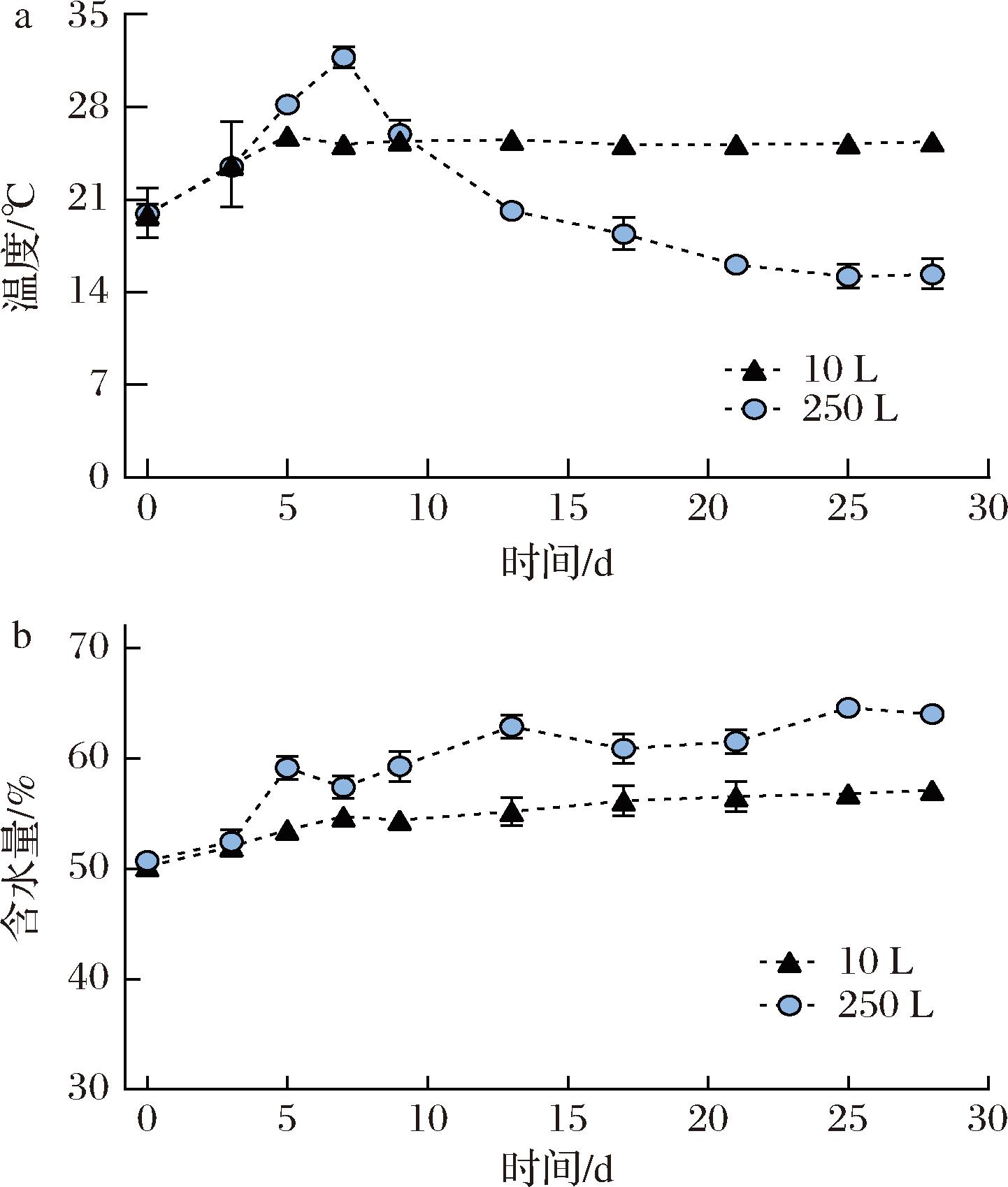
白酒发酵的本质是微生物将原料中的碳水化合物转化为酒精和一系列风味物质的生物化学反应过程,这一过程通常伴随着水分含量的增加和微生物代谢引起的温度变化[22]。2个体系内的温度变化情况如图2-a所示,发酵初期温度上升可能是微生物开始生长和繁殖导致的大量能量释放[23]。
a-酒醅温度;b-含水量
图2 发酵过程中酒醅温度和含水量随时间的变化
Fig.2 Dynamic changes of temperature and moisture in fermented grains
在10 L体系,温度曲线在初始阶段从较低温度[(19.87±0.81) ℃]逐渐上升到峰值[(25.36±0.06) ℃],之后在一个小范围内波动。相较于250 L体系,峰值更低且出现时间较早。这可能是由于大规模发酵体系体积较大,拥有更复杂的微生物群落结构,发酵过程中产生的热量较多,导致体系内部温度更高[24]。而小规模体系(10 L)的热交换面积与体积比更高,热量更容易散失到环境中,因此温度变化幅度不大。此外,生物代谢网络的多样性使得微生物能够适应不同的环境条件[25]。在较大的体系中,微生物可能需要更多的时间来适应环境变化,从而延后了峰值出现的时间。
酒醅水分变化受温度、原料特性和环境因素的综合影响。一方面,原料中本身含有较高的水分;另一方面,微生物通过代谢活动产生水分[26]。在密闭的发酵体系中,温度升高也会导致水分的蒸发,水蒸气可能会重新凝结回到原体系[8]。不同体系内含水量随时间变化如图2-b所示。随着发酵进行,2个体系内水分含量都逐渐增加。10 L体系内酒醅最大含水量为(57.13±0.09)%,250 L体系内酒醅最大含水量为(64.58±0.37)%。整体来看,250 L体系水分含量变化幅度较大,而10 L体系变化较为平稳。小体系由于体积小,热传递效率较高,使得体系内部温度分布更加均匀。这种温度的均匀性可能有助于维持微生物代谢活动的一致性,从而减小了含水量的变化幅度。
2.2 环境因子变化
在白酒发酵过程中,监测淀粉和还原糖含量对于了解发酵过程至关重要。不仅反映了微生物代谢活动,也是评估发酵效率和产品质量的重要参数。淀粉作为发酵过程中的主要碳源,通过酶的作用转化为可发酵的糖,其水解程度直接影响发酵效率和白酒产量。如图3-a所示,2个体系内淀粉含量都随着发酵进行而逐渐下降,且在3~9 d内快速降低。说明在发酵过程中2个体系内淀粉的消耗行为是相似的。发酵初期,淀粉分解主要依赖于原料和大曲中的淀粉酶。随着发酵过程中温度的升高和pH值的下降,淀粉酶的活性会逐渐减弱。但在发酵后期,微生物产生的淀粉酶又会进一步促进淀粉水解[27],这与酒精度在发酵后期达到最大值形成呼应。由图3-b可知,整个发酵过程淀粉含量的变化速率都呈现先下降后上升的趋势。
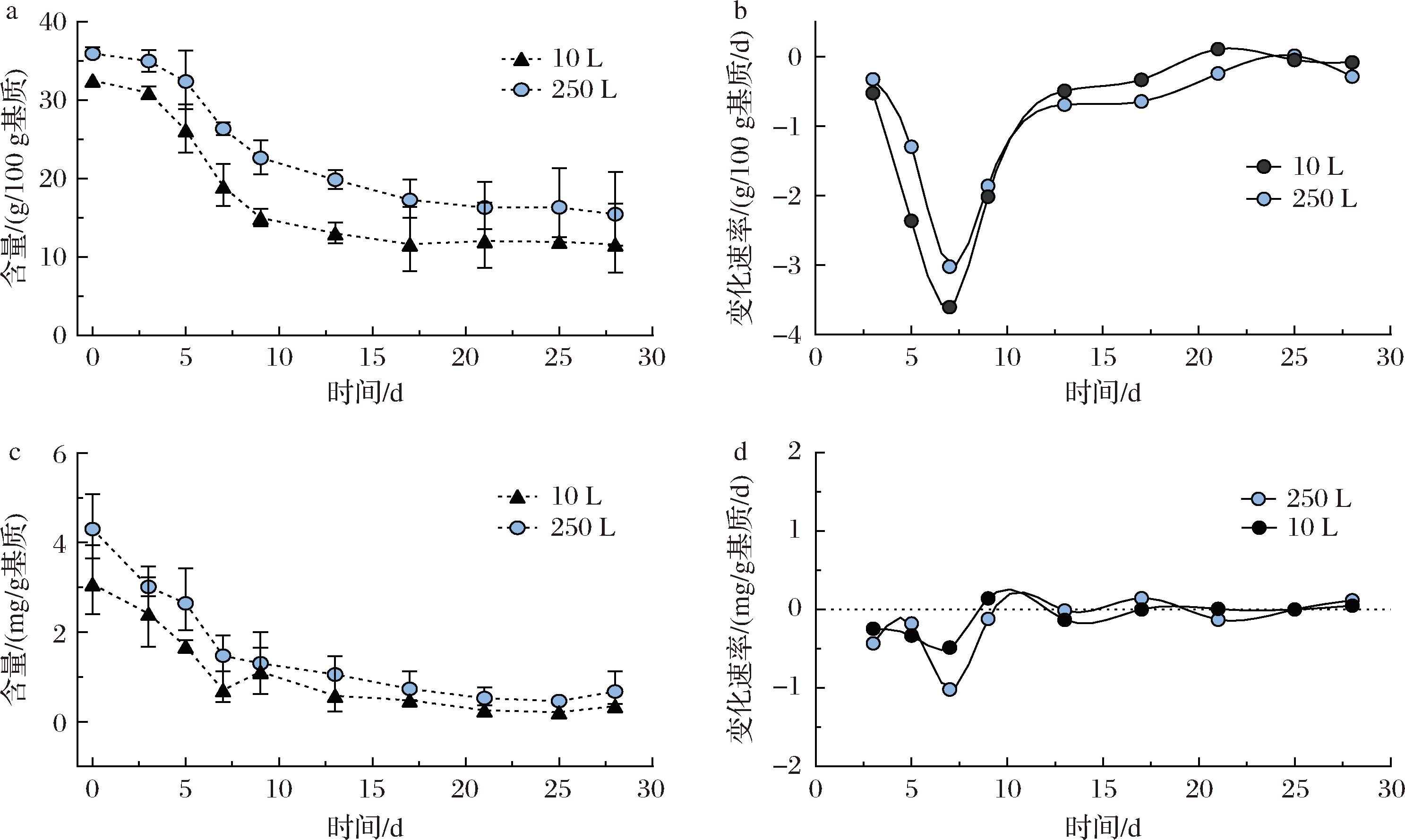
a-淀粉变化过程;b-淀粉变化速率;c-还原糖变化过程;d-还原糖变化速率
图3 发酵酒醅样品中的淀粉和还原糖含量的变化过程以及变化速率
Fig.3 Dynamic changes of content and production ratio with starch and glucose in fermented grains
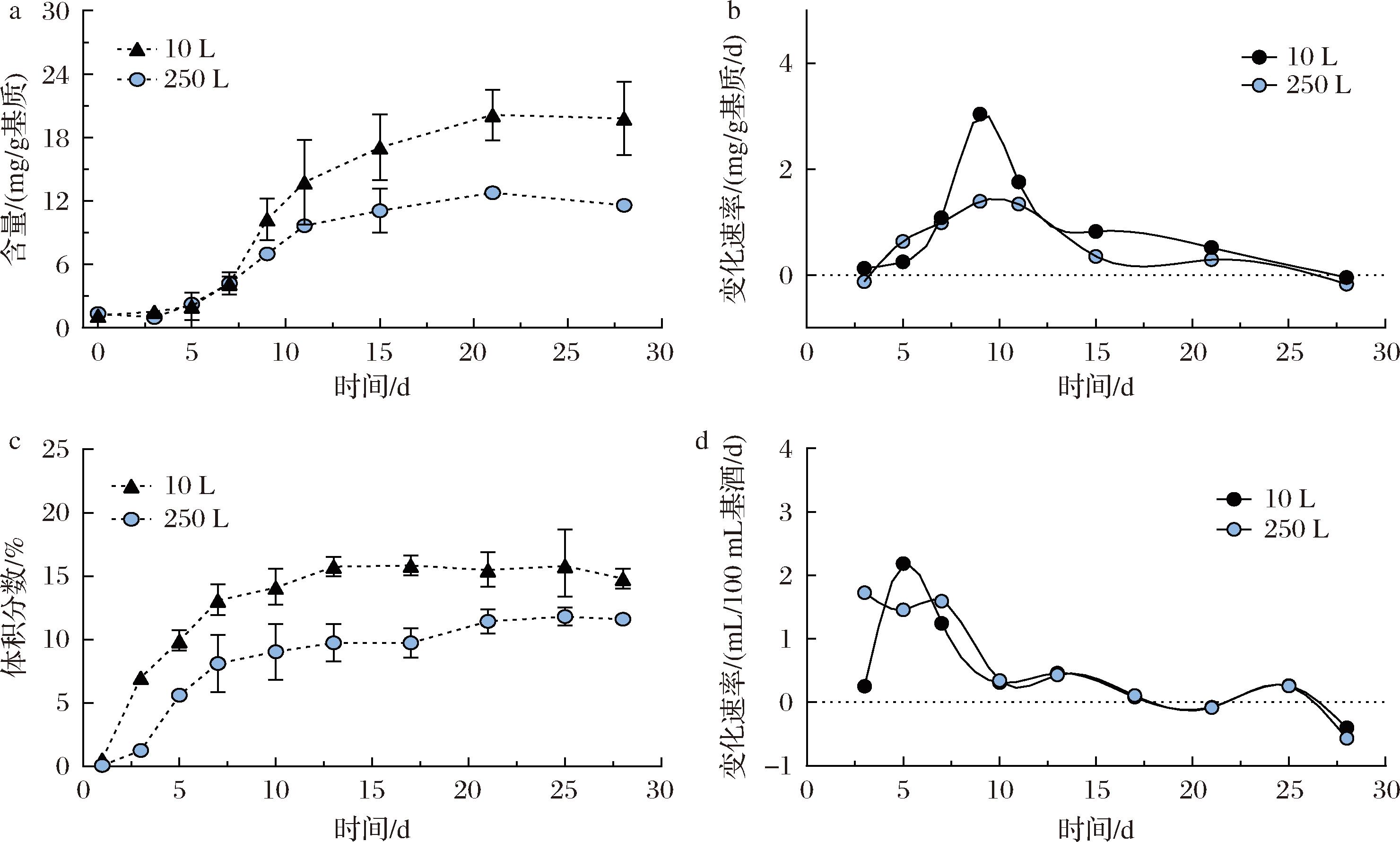
a-乳酸变化过程;b-乳酸变化速率;c-乙醇变化过程;d-乙醇变化速率
图4 发酵酒醅样品中的乙醇和乳酸含量的变化过程以及变化速率
Fig.4 Dynamic changes of content and production ratio with ethanol and lactate in fermented grains
如图3-c所示,在发酵过程中,2个体系内还原糖含量都随着酒精的产生而逐渐消耗至较低水平。还原糖含量的变化速率可直接关联淀粉被糖化酶分解成可发酵性糖的效率,反映了微生物尤其是酵母的代谢活性[28]。由图3-d可得,10 L体系还原糖变化速率与250 L体系还原糖变化速率趋势基本一致,但是10 L体系内变化幅度较小。这可能是因为在小体系中物质总量少且扩散距离相对较短。这导致还原糖等物质的扩散速度相对较快,淀粉分解产生的还原糖迅速被消耗,还原糖积累较少。
乳酸和乙醇是发酵过程中的两项关键产物。如图4-a所示,2个体系在发酵初期均表现出乳酸含量的逐渐增加。虽然2个体系在发酵过程中乳酸含量存在差异,但在整体趋势和关键变化点(如达到峰值的时间)上表现出了相似性。这可能与不同体系中微生物群落的适应性和代谢活动密切相关,这些因素共同作用于乳酸的产生和代谢过程[29]。图4-b揭示了2个体系内相似的乳酸变化速率趋势,很可能在发酵初期和发酵结束时,2个体系内微生物群落结构一致。
图4-c显示了10 L和250 L体系内乙醇含量随时间变化的曲线。在发酵初期(0~7 d),乙醇含量持续上升;在发酵中后期(8~28 d),2个体系内乙醇含量的变化曲线较为平稳。由图4-d可知,发酵第7天直至发酵终点期间,2个体系内乙醇变化速率保持一致,说明2个体系内微生物群落结构在此期间基本相同。
2.3 微生物群落演替
图5展示了基于扩增子测序的细菌和真菌在属水平上的相对丰度时序变化。由图5-a可知,发酵酒醅中优势真菌属(平均相对丰度>5%)为5个,包括酵母属(Saccharomyces)、复膜酵母属(Saccharomycopsis)、根霉属(Rhizopus)、毕赤酵母属(Pichia)和维克汉姆酵母属(Wickerhamomyces)。发酵15 d后,Saccharomyces成为优势菌,占绝对主导地位(相对丰度>94%)。先前的研究已证实,在清香型白酒的发酵过程中,Pichia是主要的优势菌群,被认为是具有乙醇和酯类物质生产能力的主要酵母属[30-31]。Pichia在4~8 d含量迅速上升,与图4-c乙醇含量的增长相呼应。随着发酵的进行,酒醅中高酸度和高乙醇浓度使酒醅中Aspergillus及Saccharomycopsis相对丰度降低。发酵终点(28 d)时,Aspergillus相对丰度降低至0.20%左右,Saccharomycopsis相对丰度降低至0.82%。这些结果与王雪山等[32]对大曲清香型白酒生产过程发酵酒醅的研究结果一致。因此,即使在不同的发酵规模下,清香型白酒的发酵过程中仍然由相同的优势微生物群落所主导,表现出微生物群落的稳定性。
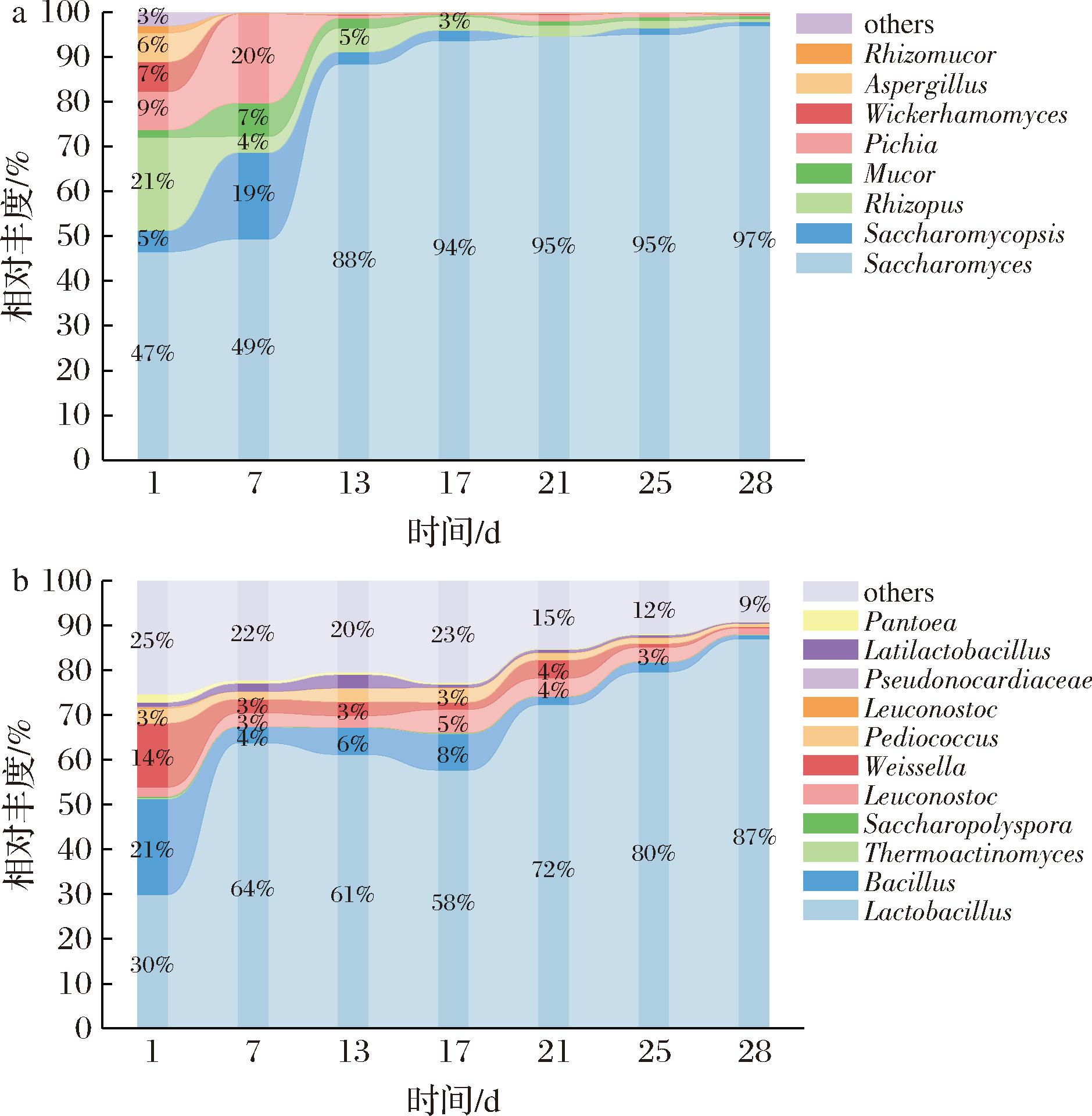
a-真菌;b-细菌
图5 发酵酒醅中真菌和细菌群落动态变化
Fig.5 Dynamic changes of fungal and bacterial communities in fermented grains
如图5-b所示,在细菌属水平上,乳杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)、明串珠菌属(Leuconostoc)、片球菌属(Pediococcus)和芽孢杆菌属(Bacillus)是优势菌属。在发酵第0天,酒醅中的微生物群落展现出较高的多样性,未观察到任何单一菌种占据显著优势。随着发酵过程的进行(第4~8天),酒醅中芽孢杆菌属相对丰度下降至1%以下,与此同时,Lactobacillus、Weissella和Leuconostoc的相对丰度则有所增加。这些菌属能够通过代谢途径产生乳酸、乙酸等有机酸,与图4-a对应。发酵后期,乳杆菌属成为主要菌群,超过细菌总量50%。这一结果与WANG等[33-35]研究结果一致。在清香型白酒的发酵过程中,尽管发酵前期不同酒醅细菌种群结构存在差异,但发酵后期酒醅中优势种群均为乳杆菌属。这一现象的出现是因为随着发酵进行,乳酸浓度逐渐升高,而乳杆菌属中的耐酸种类更适应在这种酸性环境中生长[32, 36]。这一现象不仅揭示了乳杆菌在大曲清香型白酒发酵过程中扮演的关键角色,并且指出了从多菌种共存向单一细菌属主导的发酵模式是白酒发酵过程中的一种典型模式。
尽管白酒发酵规模存在差异,但其内部发酵模式基本保持不变。这种一致性可能归因于参与发酵过程的微生物群落和酶途径与规模无关。在不同体积发酵体系中,基本的生化反应和微生物动态保持一致。这意味着,发酵过程内在机制(如底物转化为乙醇和其他关键风味化合物)具有普适性,发酵模式具有稳定性和一致性。
2.4 骨架风味成分分析
发酵结束后,对缩小体系与生产体系产出的基酒中骨架风味成分进行了分析。如图6所示,基酒中主要微量物质为醇类、酸类、酯类和醛类。2种体系中高丰度风味化合物包括乙酸乙酯、乳酸乙酯、异戊醇、乙缩醛、乙醛和异丁醇。清香型白酒的主体香味是乙酸乙酯和乳酸乙酯,且乙酯含量大于乳酯。由图6可知,显然,缩小体系产出基酒符合该特征,表明了scale-down体系与大曲清香型白酒体系的一致性。
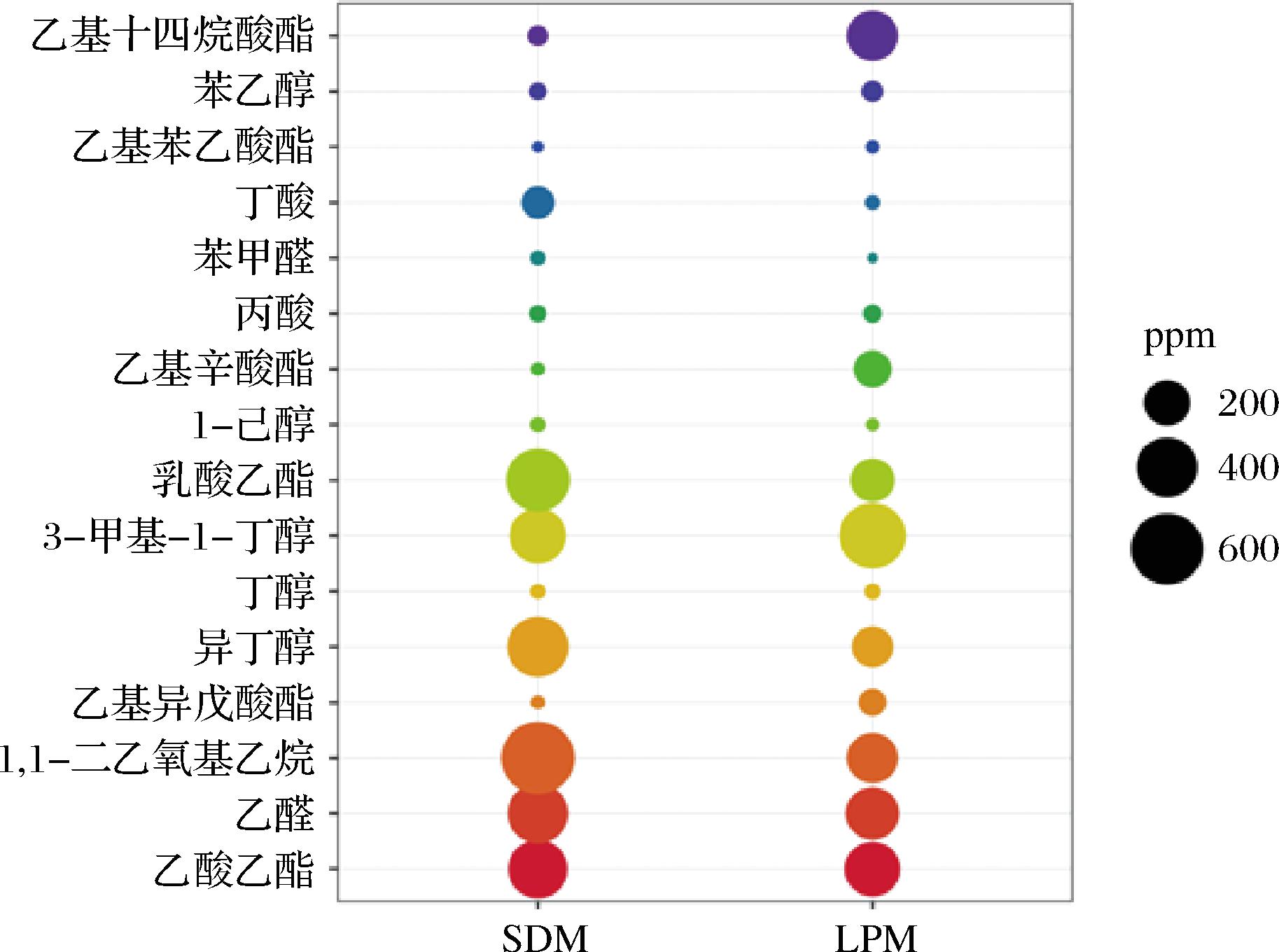
图6 缩小体系与生产体系发酵基酒中风味物质含量
Fig.6 Average concentration of flavor compounds in large production system (LPS) and scale down model (SDM)
风味物质含量和比例关系是影响白酒品质的关键因素,而发酵容器、操作条件和发酵环境的变化会导致风味组分浓度的不同[37]。尽管2种体系中化合物的浓度存在差异,但它们均在各自体系中显示出较高的丰度,凸显了其在白酒风味形成中的关键作用。这一结果验证了缩小规模研究的可行性,表明在不同的发酵条件下也能够保持主体风味物质的一致性。
2.5 TOST统计分析
TOST分析是一种统计学方法,用于评估2个独立样本的均值是否在预定义的等价区间内相等,即它们的差异是否在可接受的范围内。速率参数能够反映发酵过程中的动态变化,包括微生物生长、代谢活动和产物合成,这些是评估发酵过程成功与否的关键因素。因此,应用TOST分析来评估scale-down体系与生产体系间各个属性包括淀粉、还原糖、乳酸和乙醇速率变化的相似性。
表2展示了scale-down体系内淀粉、还原糖、乳酸和乙醇的浓度变化速率与生产规模内各结果的均值、标准误差和均值标准误差。由表3可以看出,scale-down体系各结果的均值差都在生产体系数值3倍标准差范围内。
表2 Scale-down体系和生产体系变化速率参数均值和标准差
Table 2 Mean and standard deviation of rate parameters between the scale-down and industrial systems
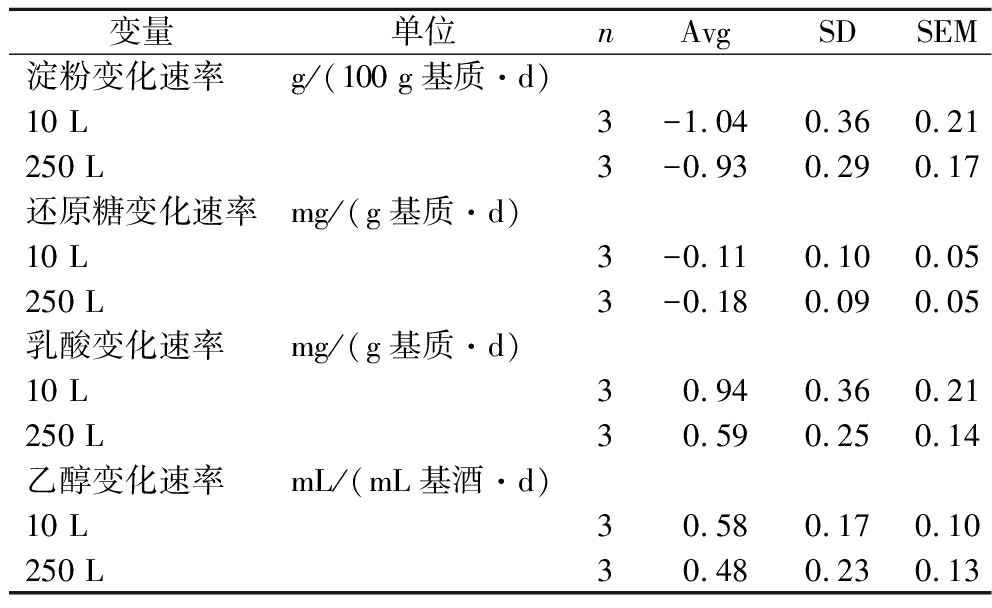
变量单位nAvgSDSEM淀粉变化速率g/(100 g基质·d)10 L3-1.040.360.21250 L3-0.930.290.17还原糖变化速率mg/(g基质·d)10 L3-0.110.100.05250 L3-0.180.090.05乳酸变化速率mg/(g基质·d)10 L30.940.360.21250 L30.590.250.14乙醇变化速率mL/(mL基酒·d)10 L30.580.170.10250 L30.480.230.13
注:Avg,平均值;SD,标准差;SEM,均值标准误差。
表3 Scale-down体系和生产体系TOST差值分析
Table 3 TOST analysis for equivalence between the scale-down and industrial systems
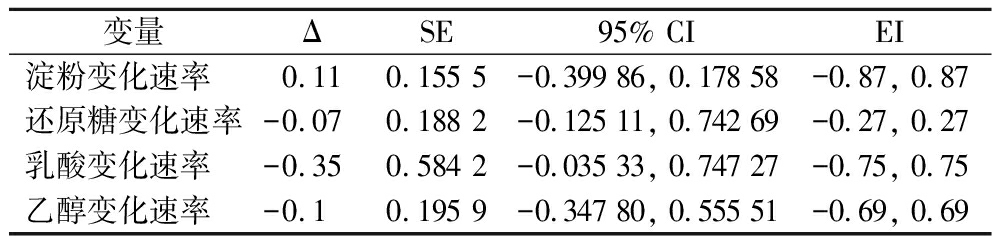
变量ΔSE95% CIEI淀粉变化速率0.110.155 5-0.399 86, 0.178 58-0.87, 0.87还原糖变化速率-0.070.188 2-0.125 11, 0.742 69-0.27, 0.27乳酸变化速率-0.350.584 2-0.035 33, 0.747 27-0.75, 0.75乙醇变化速率-0.10.195 9-0.347 80, 0.555 51-0.69, 0.69
注:Δ,差值;SE,标准误差;CI,置信区间,EI,等效范围。
原假设各参数变量在等价区间外。JMP软件分析显示(表4),淀粉、葡萄糖、乳酸、酒精浓度速率参数变量P值均<0.05,证明均拒绝原假设,即各参数变量均在等价区间内。因此,可认为建立的scale-down体系与生产体系之间存在统计相似性。
表4 Scale-down体系和生产体系TOST分析中P值和T值
Table 4 TOST analysis for equivalence between the scale-down and industrial systems
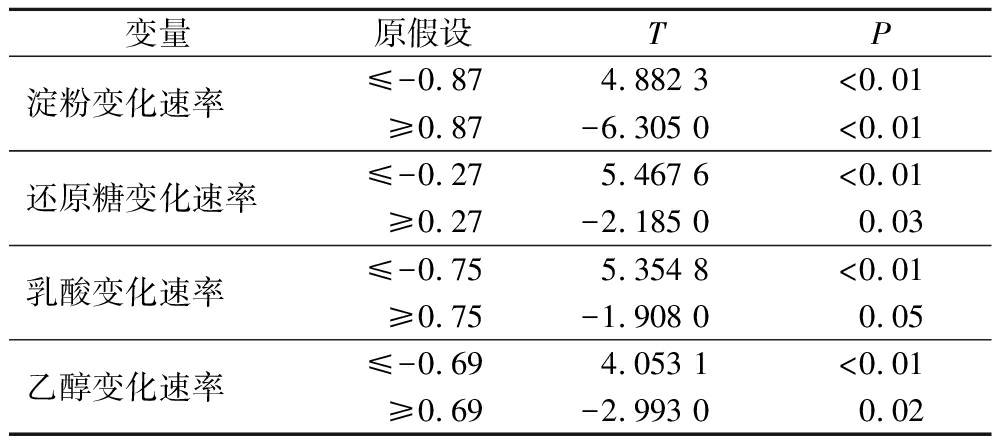
变量原假设TP淀粉变化速率≤-0.874.882 3<0.01≥0.87-6.305 0<0.01还原糖变化速率≤-0.275.467 6<0.01≥0.27-2.185 00.03乳酸变化速率≤-0.755.354 8<0.01≥0.75-1.908 00.05乙醇变化速率≤-0.694.053 1<0.01≥0.69-2.993 00.02
3 结论
本研究构建了一个10 L规模的白酒固态发酵scale-down模型,通过比较各理化指标变化趋势、优势微生物种群以及高丰度风味物质种类,scale-down体系展现了与大曲清香型白酒体系的一致性。通过TOST分析,进一步证实了scale-down体系与生产体系在4种速率参数(淀粉、还原糖、乳酸和乙醇的浓度变化速率)的统计学等效性,单侧检验P值均小于0.05。尽管由于生产规模参数收集的局限性,缩小体系内的发酵过程和产品质量参数未能与生产体系完全匹配,但本研究为后续研究奠定了基础。未来可以通过引入数学模型来进一步探索不同工艺参数的复现性,预测和优化发酵行为。这将有助于更深入地理解和控制发酵过程,推动白酒生产的技术创新和品质提升。
[1] T UBER S, GRÜNBERGER A.Microfluidic single-cell scale-down systems:Introduction, application, and future challenges[J].Current Opinion in Biotechnology, 2023, 81:102915.
UBER S, GRÜNBERGER A.Microfluidic single-cell scale-down systems:Introduction, application, and future challenges[J].Current Opinion in Biotechnology, 2023, 81:102915.
[2] SARTAS M, SCHUT M, PROIETTI C, et al.Scaling Readiness:Science and practice of an approach to enhance impact of research for development[J].Agricultural Systems, 2020, 183:102874.
[3] DELVIGNE F, TAKORS R, MUDDE R, et al.Bioprocess scale-up/down as integrative enabling technology:From fluid mechanics to systems biology and beyond[J].Microbial Biotechnology, 2017, 10(5):1267-1274.
[4] TAJSOLEIMAN T, MEARS L, KRÜHNE U, et al.An industrial perspective on scale-down challenges using miniaturized bioreactors[J].Trends in Biotechnology, 2019, 37(7):697-706.
[5] FARRELL P, SUN J, GAO M, et al.Development of a scaled-down aerobic fermentation model for scale-up in recombinant protein vaccine manufacturing[J].Vaccine, 2012, 30(38):5695-5698.
[6] HARINGA C, DESHMUKH A T, MUDDE R F, et al.Euler-Lagrange analysis towards representative down-scaling of a 22 m3 aerobic S.cerevisiae fermentation[J].Chemical Engineering Science, 2017, 170:653-669.
[7] HUANG R J, WANG K, FLAMM M H, et al.Development and qualification of 3 L scale-down model for large scale vaccine process on Vero cell culture using microcarriers[J].Biotechnology and Bioengineering, 2024, 121(11):3402-3414.
[8] JIN G Y, ZHU Y, XU Y.Mystery behind Chinese liquor fermentation[J].Trends in Food Science &Technology, 2017, 63:18-28.
[9] ZHUANSUN W W, XU J, LI Z Q, et al.Dynamic changes in the microbial community, flavour components in Jiupei of a novel Maotai-Luzhou-flavoured liquor under various daqu blending modes and their correlation analysis[J].LWT, 2022, 172:114167.
[10] 赵玉杰, 靳光远, 唐群勇, 等.基于热量平衡模型的大曲发酵升温机理研究[J].食品与发酵工业, 2024, 50(14):18-25.ZHAO Y J, JIN G Y, TANG Q Y, et al.The mechanism of heat transfer during Daqu fermentation based on heat balance modeling[J].Food and Fermentation Industries, 2024, 50(14):18-25.
[11] JIN G Y, UHL P, ZHU Y, et al.Modeling of industrial-scale anaerobic solid-state fermentation for Chinese liquor production[J].Chemical Engineering Journal, 2020, 394:124942.
[12] JIN G Y, ZHAO Y J, XIN S H, et al.Solid-state fermentation engineering of traditional Chinese fermented food[J].Foods, 2024, 13(18):3003.
[13] PETIOT C, DE GUARDIA A.Composting in a laboratory reactor:A review[J].Compost Science &Utilization, 2004, 12(1):69-79.
[14] WANG Y J, PANG L, LIU X Y, et al.Using thermal balance model to determine optimal reactor volume and insulation material needed in a laboratory-scale composting reactor[J].Bioresource Technology, 2016, 206:164-172.
[15] TIKHOMIROVA T S, TARASKEVICH M S, PONOMARENKO O V.The role of laboratory-scale bioreactors at the semi-continuous and continuous microbiological and biotechnological processes[J].Applied Microbiology and Biotechnology, 2018, 102(17):7293-7308.
[16] WANG G, XU X C, ZHOU L, et al.A pilot-scale study on the start-up of partial nitrification-anammox process for anaerobic sludge digester liquor treatment[J].Bioresource Technology, 2017, 241:181-189.
[17] WANG G, WU B F, ZHAO J F, et al.Power input effects on degeneration in prolonged penicillin chemostat cultures:A systems analysis at flux, residual glucose, metabolite, and transcript levels[J].Biotechnology and Bioengineering, 2018, 115(1):114-125.
[18] ENGINEERTOOLBOX.https://www.engineeringtoolbox.com/[Z].2001
[19] JIANG Z M, CHEN Y, WANG D L, et al.The influence of porosity of the grain medium on the flavour formation of Chinese liquor during solid-state fermentation[J].Journal of the Institute of Brewing, 2016, 122(3):468-472.
[20] LIU S Q, SKINNER-NEMEC K A, LEATHERS T D.Lactobacillus buchneri strain NRRL B-30929 converts a concentrated mixture of xylose and glucose into ethanol and other products[J].Journal of Industrial Microbiology &Biotechnology, 2008, 35(2):75-81.
[21] HAO M J, WU D, XU Y, et al.A novel endo-polygalacturonase from Penicillium rolfsii with prebiotics production potential:Cloning, characterization and application[J].Foods, 2022, 11(21):3469.
[22] WANG S L, XIONG W, WANG Y Q, et al.Temperature-induced annual variation in microbial community changes and resulting metabolome shifts in a controlled fermentation system[J].mSystems, 2020, 5(4):e00555-20.
[23] WU Q, ZHU Y, FANG C, et al.Can we control microbiota in spontaneous food fermentation? —Chinese liquor as a case example[J].Trends in Food Science &Technology, 2021, 110:321-331.
[24] VAURIS A, VALCAUDA S, HUSSON F, et al.A novel method to assess heat transfer and impact of relevant physicochemical parameters for the scaling up of solid state fermentation systems[J].Biotechnology Reports, 2022, 36:e00764.
[25] MART NEZ-ESPINOSA R M.Molecular advances in microbial metabolism 2.0[J].International Journal of Molecular Sciences, 2024, 25(2):1361.
NEZ-ESPINOSA R M.Molecular advances in microbial metabolism 2.0[J].International Journal of Molecular Sciences, 2024, 25(2):1361.
[26] REN Z Q, CHEN Q X, TANG T X, et al.Unraveling the water source and formation process of Huangshui in solid-state fermentation[J].Food Science and Biotechnology, 2025, 34(3):665-675.
[27] SAARNI A, MILLER K V, BLOCK D E.A multi-parameter, predictive model of starch hydrolysis in barley beer mashes[J].Beverages, 2020, 6(4):60.
[28] RECEK N, ZHOU R W, ZHOU R S, et al.Improved fermentation efficiency of S.cerevisiae by changing glycolytic metabolic pathways with plasma agitation[J].Scientific Reports, 2018, 8(1):8252.
[29] CHEN C, XIONG Y, XIE Y H, et al.Metabolic characteristics of lactic acid bacteria and interaction with yeast isolated from light-flavor Baijiu fermentation[J].Food Bioscience, 2022, 50:102102.
[30] HUANG Y H, YI Z L, JIN Y L, et al.New microbial resource:Microbial diversity, function and dynamics in Chinese liquor starter[J].Scientific Reports, 2017, 7:14577.
[31] XUE T D, ZHANG J H, WANG T R, et al.Reveal the microbial communities and functional prediction during the fermentation of Fen-flavor Baijiu via metagenome combining amplicon sequencing[J].Annals of Microbiology, 2023, 73(1):16.
[32] 王雪山, 杜海, 徐岩.清香型白酒发酵过程中微生物种群空间分布[J].食品与发酵工业, 2018, 44(9):1-8.WANG X S, DU H, XU Y.Spatial distribution of microbial community during Chinese light-flavor liquor fermentation[J].Food and Fermentation Industries, 2018, 44(9):1-8.
[33] WANG H Y, XU Y.Microbial succession and metabolite changes during the fermentation of Chinese light aroma-style liquor[J].Journal of the Institute of Brewing, 2019, 125(1):162-170.
[34] WANG H Y, GAO Y B, FAN Q W, et al.Characterization and comparison of microbial community of different typical Chinese liquor Daqus by PCR-DGGE[J].Letters in Applied Microbiology, 2011, 53(2):134-140.
[35] WANG H Y, XU Y.Effect of temperature on microbial composition of starter culture for Chinese light aroma style liquor fermentation[J].Letters in Applied Microbiology, 2015, 60(1):85-91.
[36] PANG X N, HAN B Z, HUANG X N, et al.Effect of the environment microbiota on the flavour of light-flavour Baijiu during spontaneous fermentation[J].Scientific Reports, 2018, 8:3396.
[37] WANG L L, WU L, XIANG D H, et al.Characterization of key aroma compounds in aged Qingxiangxing Baijiu by comparative aroma extract dilution analysis, quantitative measurements, aroma recombination, and omission studies[J].Food Chemistry, 2023, 419:136027.