紫甘薯俗称“黑红薯”或“紫番薯”,属于旋花科甘薯属草本植物[1]。紫薯富含多种营养物质,对人体健康有益[2],其富含花青素,具有较强的抗氧化、延缓衰老、降血糖等功能[3-4]。鲜紫薯含水量高,贮藏时容易出现脱水、萌芽、腐烂及风味改变等不良现象,且淀粉纤维含量较高,食用口感不佳,大部分制成紫薯全粉食用。开发紫薯深加工产品可显著提升其附加值,促进产业发展,具有重要意义。
以紫薯为原料酿造紫薯酒既可以解决紫薯储藏不当导致的浪费问题,又可以提高产品附加值。紫薯单一原料发酵酒存在口感欠佳、风味较为单一、储存过程中颜色不稳定等问题[5],火龙果、橙子、香蕉均为我国南方种植面积和产量较大的果品,具有丰富的营养价值和呈香物质,也存在产量大、加工利用有限的问题。因此,利用这些大宗类水果与紫薯混合发酵酿造低度且香味浓郁的果蔬酒产品,可以较大程度保留水果中的营养成分和风味物质[6]。目前对紫薯酒的研究主要集中于单一紫薯为原料发酵工艺优化及品质和风味分析等。对不同水果与紫薯混合发酵型果蔬酒的品质,功能活性及风味研究相对较少。研究水果与紫薯混合发酵酒的品质与风味特征,有助于紫薯发酵酒品质提升与品类创新,促进紫薯资源的精深加工与利用。
本研究以紫薯为主要原料,分别加入不同水果:红心火龙果、贡梨、红富士苹果、脐橙、香蕉,采用果酒酵母发酵制备紫薯果蔬酒,并对其理化指标和抗氧化活性进行测定。采用电子鼻结合气相离子迁移谱(gas chromatography ion mobility spectrometry, GC-IMS)、GC-MS对挥发性香气成分以及感官评价进行比较分析。以期筛选出一款相对于单一紫薯发酵酒风味更为丰富、口感较好的紫薯果蔬混合发酵酒,旨在为紫薯酒加工及市场应用提供更好的理论依据与新思路。
1 材料与方法
1.1 材料与试剂
紫薯,探味君旗舰店;香蕉、红富士苹果、红心火龙果、脐橙、贡梨,广东海洋大学校园超市;紫薯酒(金薯红姑娘),市售;果酒酵母RW,安琪酵母旗舰店;白砂糖,太古糖业有限公司;柠檬酸(食品级),河南万邦化工科技有限公司;0.1 mol/L NaOH标准溶液、ABTS、DPPH、福林酚、没食子酸、芦丁,上海麦克林生化科技有限公司;NaNO2、NaOH、L-抗坏血酸、水杨酸、KCl、Na2CO3、95%乙醇、无水乙醇,西陇科学股份有限公司;H2O2、盐酸,广东广试试剂科技有限公司;Tris-盐酸,上海源叶生物科技有限公司。
1.2 仪器与设备
恒温培养箱,常州金坛精达仪器制造公司;PHS-3E型pH计,上海雷磁仪器厂;酶标仪,Thermo Scientific公司;电子鼻,德国PEN3公司;GC-IMS、FlavourSpec®风味分析仪,德国GAS公司;TQ805050NX型GC-MS,日本岛津公司;Universal 320R高速冷冻离心机,德国Hettich公司;糖度计,深圳市流数科技有限公司;超净工作台,苏州净化设备有限公司;LDZX-50KBS型立式蒸汽灭菌器,上海申安医疗器械厂。
1.3 实验方法
1.3.1 紫薯酒的制备
1.3.1.1 果酒酵母活化
将安琪果酒专用酵母RW与50 g/L的糖水按质量比为1∶10均匀混合,35 ℃条件下活化30 min。
1.3.1.2 紫薯酒制备
准确称取100 g蒸熟的紫薯泥,以料水比1∶1(g∶mL)混合打浆后调糖度在22 °Brix左右,调酸度在pH 4左右,将活化后的安琪果酒专用酵母RW按1 g/L接入,于28 ℃培养箱培养,静止发酵6 d。6 d后取样,过滤,离心,巴氏灭菌,冷藏,测定指标。
1.3.1.3 不同水果与紫薯混合发酵酒制备
准确称取紫薯泥、果肉各50 g,以料水比1∶1(g∶mL)混合打浆后,其余步骤同紫薯酒制备,本研究共选择5种水果,相应制备的混合发酵酒命名为Z+H(紫薯+火龙果)、Z+L(紫薯+梨)、Z+P(紫薯+苹果)、Z+C(紫薯+脐橙)和Z+X(紫薯+香蕉)。
1.3.2 理化指标测定
1.3.2.1 发酵曲线
监测各发酵组1~6 d的质量损失,以g为单位绘制发酵曲线。
1.3.2.2 糖度、总酸、酒精度、甲醇含量测定
糖度:糖度计;总酸:GB 12456—2021《食品安全国家标准 食品中总酸的测定(含第一号修改单)》;酒精度:GB 5009.225—2023《食品安全国家标准 酒和食用酒精中乙醇浓度的测定》;甲醇:甲醇含量试剂盒测定。
1.3.2.3 花色苷、多酚、黄酮含量测定
花色苷:pH示差法[7];多酚:福林酚法[8],测定标准曲线为Y=9.617 67X-0.013 29,R2=0.993,没食子酸浓度(X)为横坐标,吸光度(Y)为纵坐标,结果以没食子酸计(mg GAE/mL);黄酮:芦丁法[8],测定标准曲线为Y=0.736 06X-0.003 12,R2=0.998,芦丁浓度(X)为横坐标,吸光度(Y)为纵坐标,结果以芦丁计(mg/mL)。每样品间平行测定3次,取平均值。
1.3.3 色差及褐变度、透过率测定
1.3.3.1 色差
分光测色仪测定,L*,a*,b*均为仪器给出的平均值。
1.3.3.2 褐变度[9]
取42 mL紫薯酒样品加5 mL体积分数为95%乙醇混匀,4 000 r/min离心10 min,取上清液于420 nm波长处测定吸光度,以95%乙醇为空白,重复测定3次,褐变度用重复3次取得的平均吸光值A420表示。
1.3.3.3 透过率[10]
以蒸馏水为空白对照,在680 nm 处分别测定过滤前后的酒液透过率。每样品间平行测定3次,取平均值。
1.3.4 感官评价
参考冯莉梅等[11]方法由10名经过培训的食品专业学生对产品进行感官评定,分别从外观、滋味、风味、典型性这4个方面对酒进行评分,满分100分,感官评价标准见表1。
表1 感官评价标准表
Table 1 Table of sensory evaluation criteria
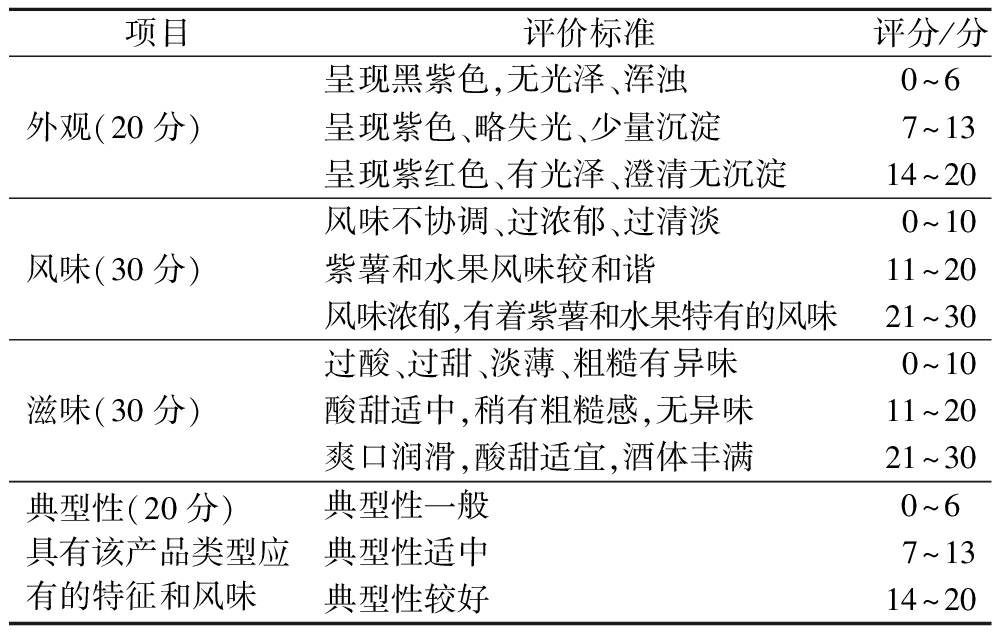
项目评价标准评分/分外观(20分)呈现黑紫色,无光泽、浑浊0^6呈现紫色、略失光、少量沉淀7^13呈现紫红色、有光泽、澄清无沉淀14^20风味(30分)风味不协调、过浓郁、过清淡0^10紫薯和水果风味较和谐11^20风味浓郁,有着紫薯和水果特有的风味21^30滋味(30分)过酸、过甜、淡薄、粗糙有异味0^10酸甜适中,稍有粗糙感,无异味11^20爽口润滑,酸甜适宜,酒体丰满21^30典型性(20分)具有该产品类型应有的特征和风味典型性一般0^6典型性适中7^13典型性较好14^20
1.3.5 电子鼻测定
将3 mL紫薯酒样品置于20 mL样品瓶中,在25 ℃条件下平衡30 min,插入电子鼻探头进行检测,每个样品至少测定8次。电子鼻检测的具体参数如下:样品检测时间80 s,清洗时间120 s,载气速度300 mL/min,进样流量300 mL/min,电子鼻传感器类型及性能如表2所示。
表2 电子鼻系统传感器类型及性能描述
Table 2 Description of the types and performance of electronic nose system sensors
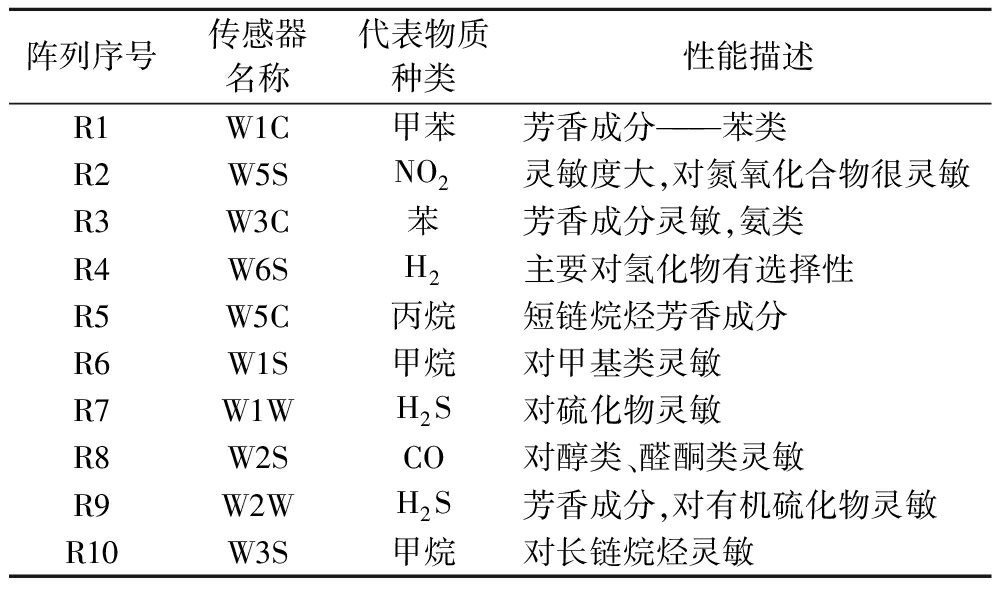
阵列序号传感器名称代表物质种类性能描述R1W1C甲苯芳香成分———苯类R2W5SNO2灵敏度大,对氮氧化合物很灵敏R3W3C苯芳香成分灵敏,氨类R4W6SH2主要对氢化物有选择性R5W5C丙烷短链烷烃芳香成分R6W1S甲烷对甲基类灵敏R7W1WH2S对硫化物灵敏R8W2SCO对醇类、醛酮类灵敏R9W2WH2S芳香成分,对有机硫化物灵敏R10W3S甲烷对长链烷烃灵敏
1.3.6 GC-IMS测定
量取0.5 mL样品置于20 mL顶空进样瓶中,在60 ℃下以500 r/min孵育20 min,通过1 mL气密加热注射器将500 μL顶空样品注入自动进样器中,进样温度:85 ℃,色谱柱:MTX-5(15 m×0.53 mm,美国RESTEK公司),载气/漂移气为N2(纯度≥99.999%),每个样品平行测5次,将检测出的挥发性有机物质的迁移时间与保留时间与GC-IMS中Library Search(内置NIST和IMS数据库)软件进行匹配,对紫薯酒挥发性风味化合物进行定性分析。
1.3.7 GC-MS测定
1.3.7.1 样品前处理
取5 mL不同品种的酒样(用去离子水稀释20倍)放入20 mL顶空瓶中,加入1 μL 0.1 g/L的仲辛醇作为内标,同时置于50 ℃恒温加热磁力搅拌器中萃取30 min,在GC进样口,230 ℃热解吸5 min。
1.3.7.2 GC条件升温程序
初始温度40 ℃,保持3 min,以5 ℃/min升至108 ℃,保持5 min,再以4 ℃/min升至230 ℃,保持2 min。载气为高纯He,流速1 mL/min,进样量1 μL,不分流进样。
1.3.7.3 质谱条件
离子源温度为230 ℃,电离方式为电子电离(electron ionization, EI)源,电子能量为70 eV,四级杆温度为150 ℃,质量扫描范围为40~450 u。
1.3.8 体外抗氧化活性测定
1.3.8.1 DPPH自由基清除能力测定
根据KILANI等[12]的方法测定,取0.5 mL的紫薯酒添加1 mL的DPPH(0.2 mmol/L)溶液,并于室温下避光30 min,以乙醇为空白,波长517 nm条件下测定其吸光度值,与维生素C溶液(50 μg/mL)作对比。DPPH自由基清除能力计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
式中:A,0.5 mL样品液加上1 mL DPPH自由基溶液的吸光度值;B,0.5 mL样品液加上1 mL乙醇的吸光度值;C,0.5 mL乙醇加上1 mL DPPH自由基溶液的吸光度值。
1.3.8.2 超氧阴离子自由基清除率
参考文献[8]的方法,将发酵酒进行6倍稀释,取1 mL的发酵酒于具塞试管中,加入5 mL浓度为0.05 mol/L的Tris-盐酸溶液(pH=8.2)和0.2 mL浓度为0.002 mol/L的邻苯三酚溶液,于25 ℃恒温水浴锅中反应5 min,结束后加入0.2 mL浓盐酸终止反应,取出后于320 nm处测定其吸光度值,并测定在相同条件下0.2 mg/mL 维生素C的清除率进行比较,通过公式(2)计算清除率。
超氧阴离子自由基清除率![]()
(2)
式中:A1,样品测定的吸光度;B1,去离子水代替邻苯三酚溶液测定的吸光度值;C1,去离子水代替样品测定的吸光度值。
1.3.8.3 ABTS阳离子自由基清除率
参考文献[8]的方法,将发酵酒进行6倍稀释,取2 mL的发酵酒于具塞试管中,加入8 mL ABTS工作液,于25 ℃恒温水浴锅中反应 6 min,取出后于734 nm处测定其吸光度值,并测定在相同条件下0.01 mg/mL 维生素C的清除率进行比较,通过公式(3)计算清除率。
ABTS阳离子自由基清除率![]()
(3)
式中:A1,样品测定的吸光度;B2,用浓度为0.2 mol/L的磷酸缓冲液(pH=7.4)代替ABTS工作液溶液测定的吸光度值;C1,去离子水代替样品测定的吸光度值。
1.4 数据处理
每项测试至少进行3次重复试验,采用Excel、SPSS 24软件进行数据处理,采用Origin 2021、prime 9、ChiPlot软件进行绘图。
2 结果分析
2.1 不同水果与紫薯混合发酵酒的发酵曲线
酵母在发酵过程中分解葡萄糖产生酒精并释放CO2,因此发酵液质量下降速度可作为发酵过程的监测指标[13]。由图1可知Z+H酒在第3天发酵速度达到最大,单日质量损失达到5.32 g。发酵时间>3 d,Z+H酒的单日质量损失逐渐下降;Z、Z+L、Z+P、Z+X、Z+C发酵酒在第2天发酵速度达到最大,发酵时间>2 d,单日质量损失逐渐下降;其中Z+C酒发酵速度最快,发酵效果优于其他组别发酵酒,橙子富含维生素C和多种有机酸,这些成分可能有助于提供微生物生长所需的营养物,促进微生物的生长和代谢,进而提高发酵效率。Z+P酒发酵速度最慢,Z、Z+X和Z+L发酵速度相似。
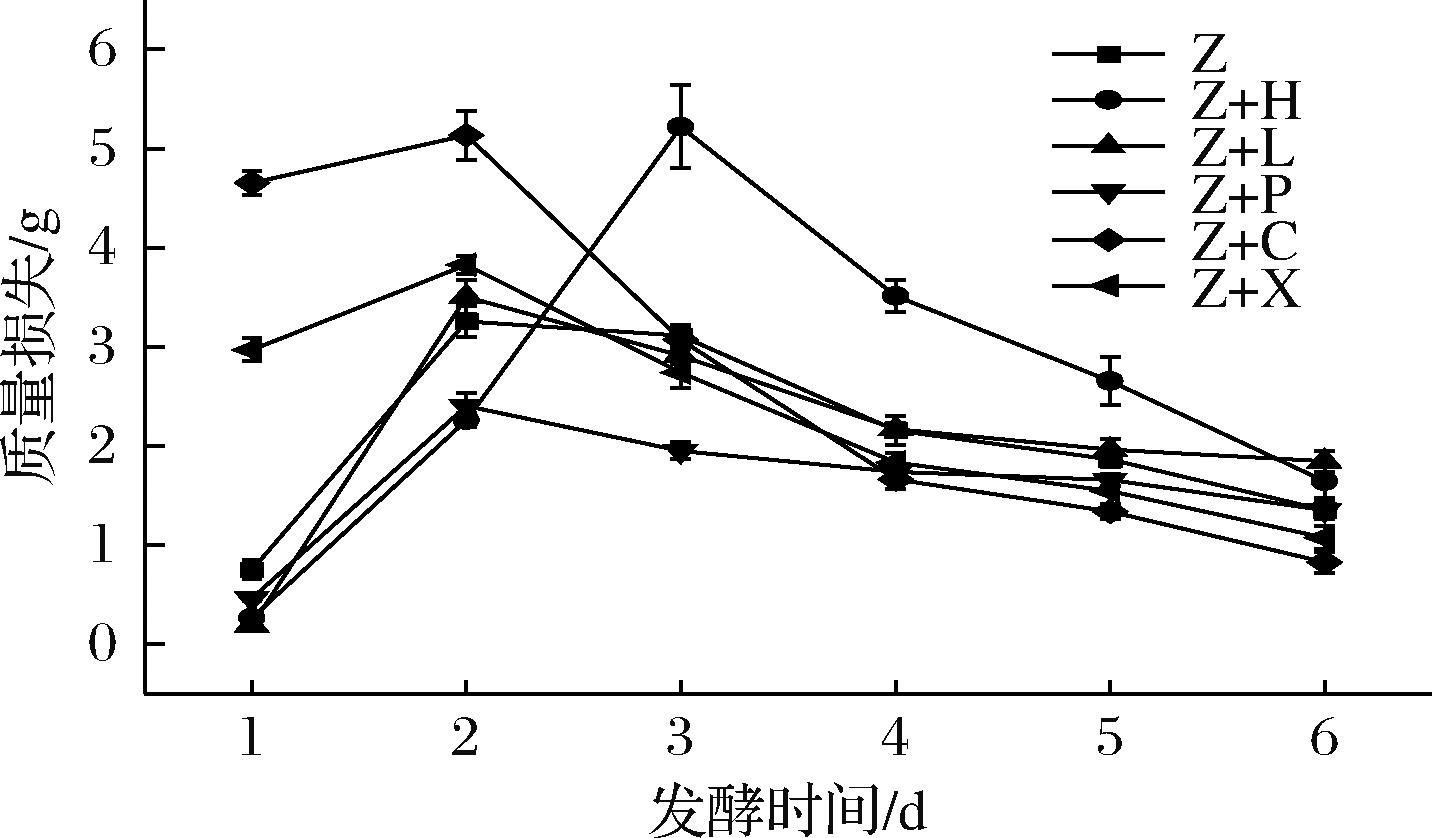
图1 不同水果紫薯混合酒的发酵曲线
Fig.1 Fermentation curves of mixed fermented wine of different fruits and purple sweet potato
2.2 不同水果与紫薯混合发酵酒的理化特征分析
由表3可知,各发酵组的糖度、总酸、甲醇含量差异显著(P<0.05)。各发酵组的甲醇含量均小于0.4 g/L,符合NY/T 1508—2017《绿色食品 果酒》标准要求,Z+H酒的酒精度为5.70%vol,低于《绿色食品 果酒》标准规定范围。且与单一紫薯酒相比,添加水果混合发酵能减少甲醇的含量。其中Z+X酒甲醇含量最低,总酸含量最高为7.49 g/L。总酸是表征果酒品质的重要指标,不仅影响果酒的口感、色泽,而且对发酵过程中微生物的生长代谢有较大影响[14]。适量的总酸可以增加酒的复杂性和平衡性,使酒体更加丰满,口感更加丰富[15]。
表3 不同水果与紫薯混合发酵酒的理化特征
Table 3 Physicochemical characteristics of mixed fermented wine of different fruits and purple sweet potato
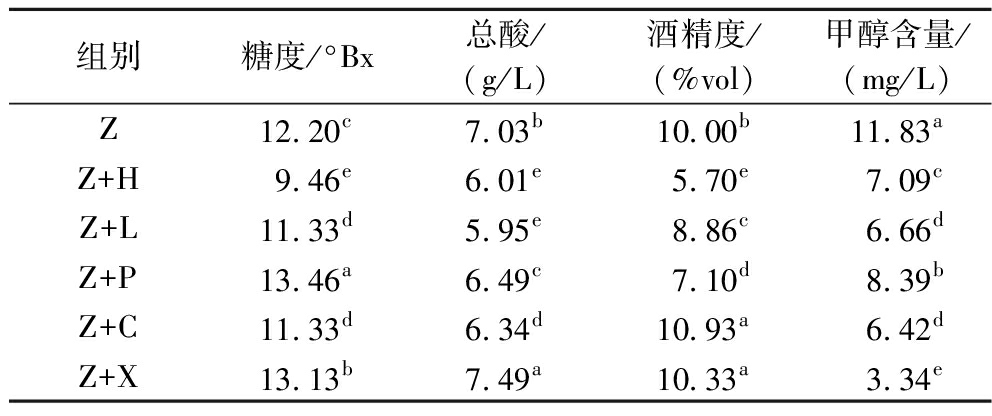
组别糖度/°Bx总酸/(g/L)酒精度/(%vol)甲醇含量/(mg/L)Z12.20c7.03b10.00b11.83aZ+H9.46e6.01e5.70e7.09cZ+L11.33d5.95e8.86c6.66dZ+P13.46a6.49c7.10d8.39bZ+C11.33d6.34d10.93a6.42dZ+X13.13b7.49a10.33a3.34e
注:同一列不同字母表示显著差异(P<0.05)(下同)。
2.3 不同水果与紫薯混合发酵酒的感官特征
2.3.1 不同水果与紫薯混合发酵酒的色差
颜色是影响果酒外观和消费者选择的重要指标,L*表示酒样明暗程度,a*表示酒样红绿程度,b*表示酒样蓝黄程度,总色差ΔE表征酒样间颜色总体差异程度,其值越大,差异越显著[16]。由表4可知Z+L酒发酵前后颜色变化最大,Z+C酒发酵前后颜色变化最小,L*值越大说明酒体光泽感更好,Z+X酒光泽感更好。Z+X酒的透过率最高,说明其澄清度最高。此外,Z+C酒的褐变度最高,Z+X酒的褐变度最低,这可能是紫薯组织中的多酚氧化酶与酚类物质接触,催化多酚类物质氧化成邻醌,再进一步氧化聚合成黑色素所致[17]。褐变度高,不仅影响酒体的颜色,而且对酒的风味也会产生一定程度的影响。
表4 不同水果与紫薯混合发酵酒色差值
Table 4 Color difference of mixed fermented wine with different fruits and purple sweet potato
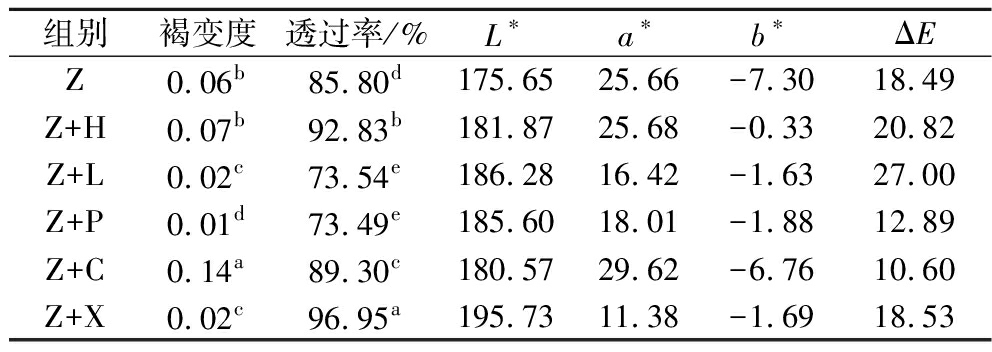
组别褐变度透过率/%L∗a∗b∗ΔEZ0.06b85.80d175.6525.66-7.3018.49Z+H0.07b92.83b181.8725.68-0.3320.82Z+L0.02c73.54e186.2816.42-1.6327.00Z+P0.01d73.49e185.6018.01-1.8812.89Z+C0.14a89.30c180.5729.62-6.7610.60Z+X0.02c96.95a195.7311.38-1.6918.53
2.3.2 不同水果与紫薯混合发酵酒的感官评价
为了更全面地揭示不同紫薯酒感官差异,选取了一款市售紫薯酒作为对照进行感官评价。分别从发酵酒外观、风味、滋味、典型性4个部分对不同组别的发酵酒进行感官评价,评分结果如图2所示。Z+X酒:79.4分,Z酒:50.1分,Z+H酒:51.1分,Z+L酒:46.1分,Z+P酒:40.5分,Z+C酒;40.3分,SZ酒:23.4分。添加水果混合发酵,对紫薯酒的感官评价有不同程度的改善。其中市售紫薯酒的感官评价总分最低,Z+X酒感官评价总分最高为79.4分。在风味评价中,Z+X酒具有更浓郁的果酒甜香味和果香味,可能与其丰富的酯类化合物有关。此外,Z+X酒的典型性风味突出,可能与其较多的挥发性物质有关(见风味分析部分)。综上,Z+X酒整体感官评价较高。
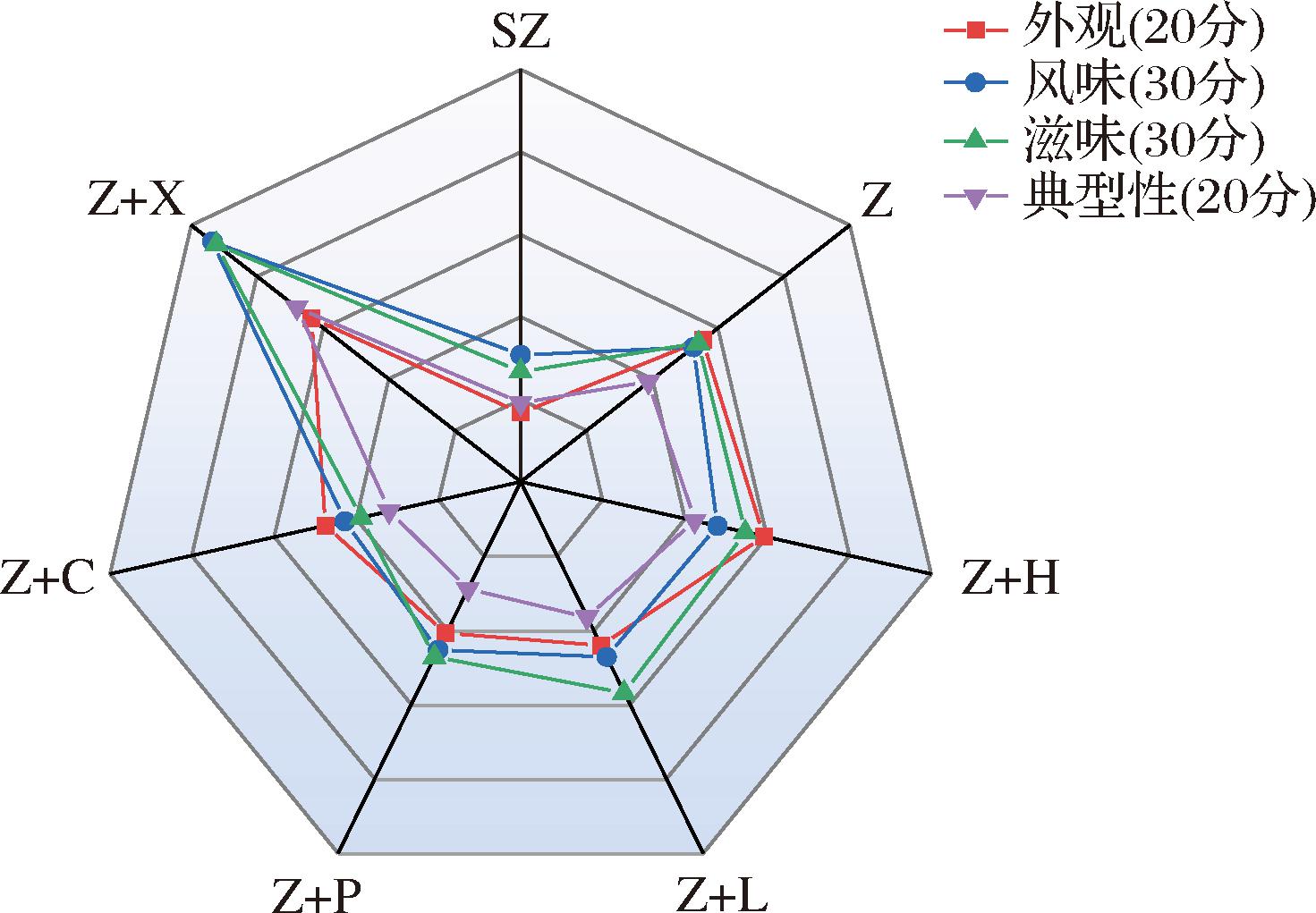
图2 不同水果与紫薯发酵酒、市售紫薯酒感官评价雷达图
Fig.2 Sensory evaluation radar of different fruits and purple potato fermented wine and commercially purple sweet potato wine
注:SZ表示市售紫薯酒(下同)。
2.4 不同水果与紫薯混合发酵酒的风味分析
2.4.1 电子鼻分析
对各发酵组别进行电子鼻雷达图分析,传感器的响应强度与样品中相应化合物的含量密切相关[18]。结果如图3所示:R8、R2、R1这3个感应器对酒的响应值较高,说明各酒样中有较多的醇和醛酮类、氮氧化合物、芳香成分——苯类。与其他发酵组相比,Z+X酒的R8、R2、R1这3个感应器的响应值最强的。表明添加香蕉与紫薯混合发酵有利于芳香族等香气化合物的形成。
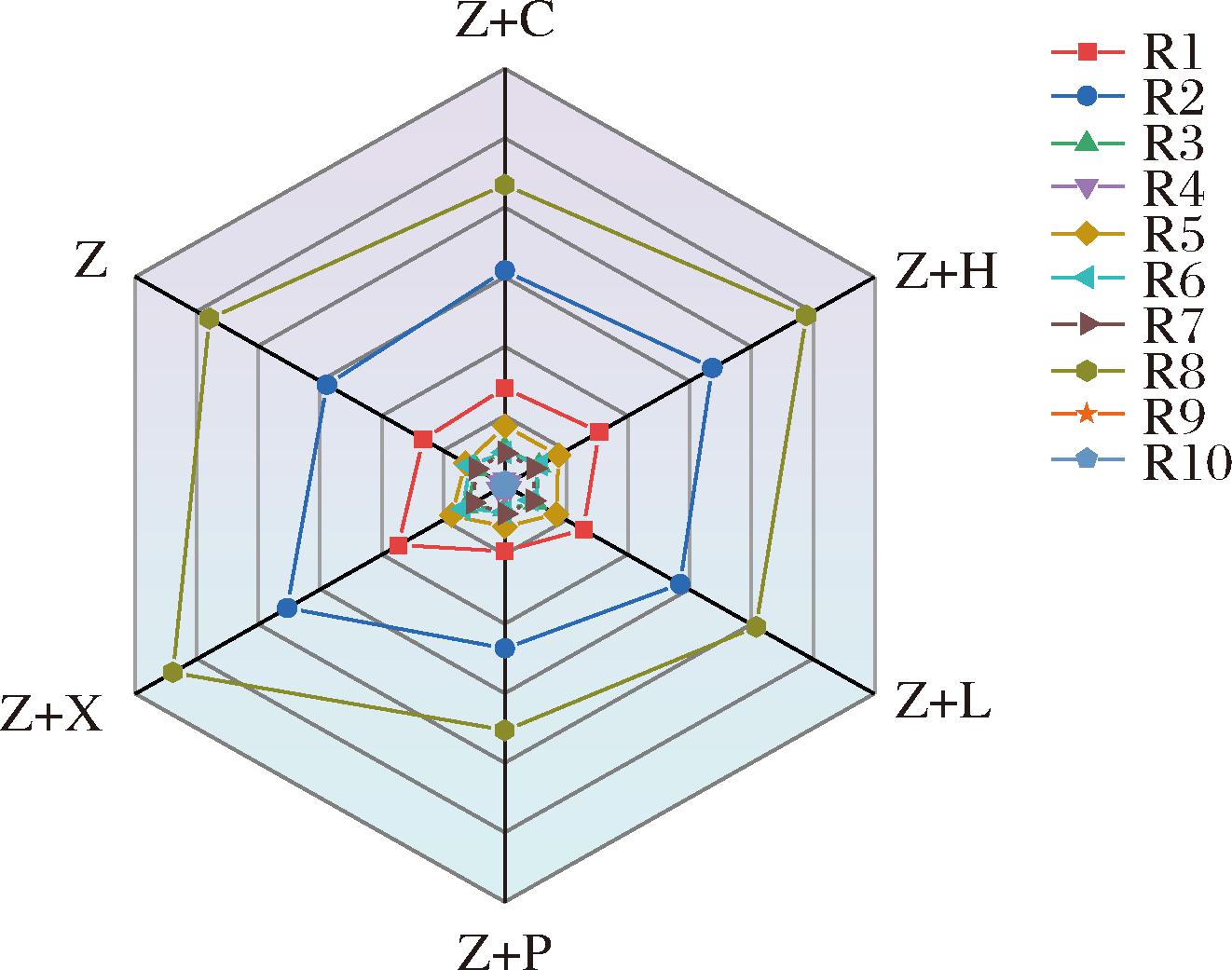
图3 不同水果与紫薯发酵酒电子鼻雷达图
Fig.3 Electronic nose radar diagram of different fruits and purple sweet potato fermented wine
2.4.2 GC-IMS分析
为了比较单一紫薯发酵酒与水果加紫薯混合发酵酒的挥发性化合物,采用GC-IMS分析,以单一紫薯酒发酵的迁移谱图为对照,生成差异对比图,扣除背景对比显示得到差异谱图。蓝色区域说明该物质浓度在此样品中较Z发酵酒样低,红色区域说明该物质浓度在此样品中较Z酒发酵酒样高。由图4可知,添加不同水果与紫薯发酵,挥发性化合物浓度呈不同程度增加,说明添加水果与紫薯混合发酵可以促进紫薯发酒酵过程中的挥发性有机化合物质生成,其中Z+P、Z+C、Z+X酒的挥发性化合物浓度较高。

图4 不同水果与紫薯发酵酒GC-IMS迁移图
Fig.4 GC-IMS migration diagram of different fruits and purple sweet potato fermented wine
单一紫薯发酵酒和不同水果与紫薯混合发酵酒样本谱图中物质信号峰形成指纹图谱如图5所示,每一列代表同一种挥发性物质在不同样品中的信号峰,每一行代表样品中所含有挥发性物质的全部信号峰,颜色深浅表示样品中挥发性有机化合物浓度的高低。由图可知,Z+X酒共检测出38种、Z+C酒27种、Z+P酒20种、Z+H酒22种、Z+L酒22种、Z酒21种。与Z酒相比,Z+X酒多生成了17种化合物,Z+C酒增加了6种化合物,其余3种水果添加与单一紫薯发酵酒检测出的化合物差异不大。主要增加了酯类、醛酮类、酸类。说明与添加其他水果相比,添加香蕉与紫薯混合发酵酿造酒能提供更多的风味化合物。
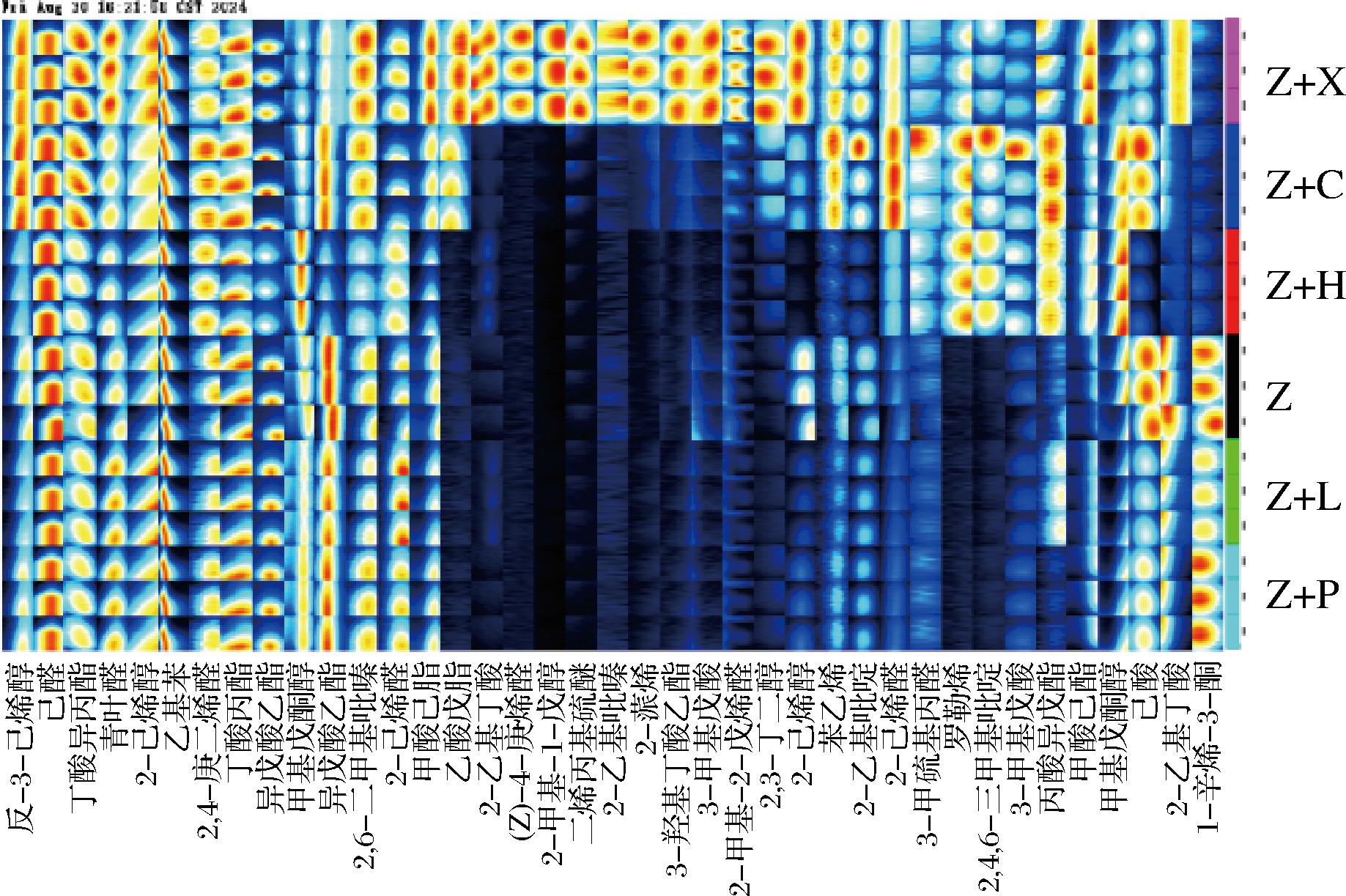
图5 不同水果与紫薯发酵酒GC-IMS指纹图谱
Fig.5 GC-IMS fingerprints of different fruits and purple sweet potato fermented wines
2.4.3 GC-MS分析
采用GC-MS技术对单一紫薯酒与紫薯与香蕉混合发酵酒挥发性有机化合物进行定量分析,并选择一款市售紫薯酒(SZ)作为对照。聚类热图将GC-MS分析得到的香气物质进行数据可视化,颜色的变化代表挥发性有机化合物浓度的大小[19]。由图6可知,Z、Z+X、SZ酒分别检测出63、70、73种化合物,从热图中来看,正己酸乙酯、异戊醇、乙酸异戊酯、乙酸苯乙酯、辛酸乙酯、苯乙醇等在样品间占主导地位。由图7可知,3种不同紫薯酒共同有20种香气成分,Z酒与Z+X酒共有的香气成分28种,Z酒与SZ酒共有的香气成分32种,Z+X酒与SZ酒共有香气成分25种,说明3种不同的紫薯酒的香气成分具有较大的差异。由图8可知,3种紫薯酒的挥发性香气物质的组成和含量存在差异。从分类上看,三者检测出最多的种类都是酯类,其中Z酒有17种、Z+X酒有29种、SZ酒有20种。与Z酒、SZ酒相比,Z+X酒的酯类增加了一半以上,其中增加的丁酸庚酯、丁酸-1-甲基丁酯、丁酸-3-丁酮-2-酯、异戊酸丁酯、异戊酸异丁酯、乙酸己酯、丁酸异丁酯、乙酸环己基乙酯赋予了紫薯酒更多的水果香味、花香味,为果酒增添复杂的风味和层次感[20]。
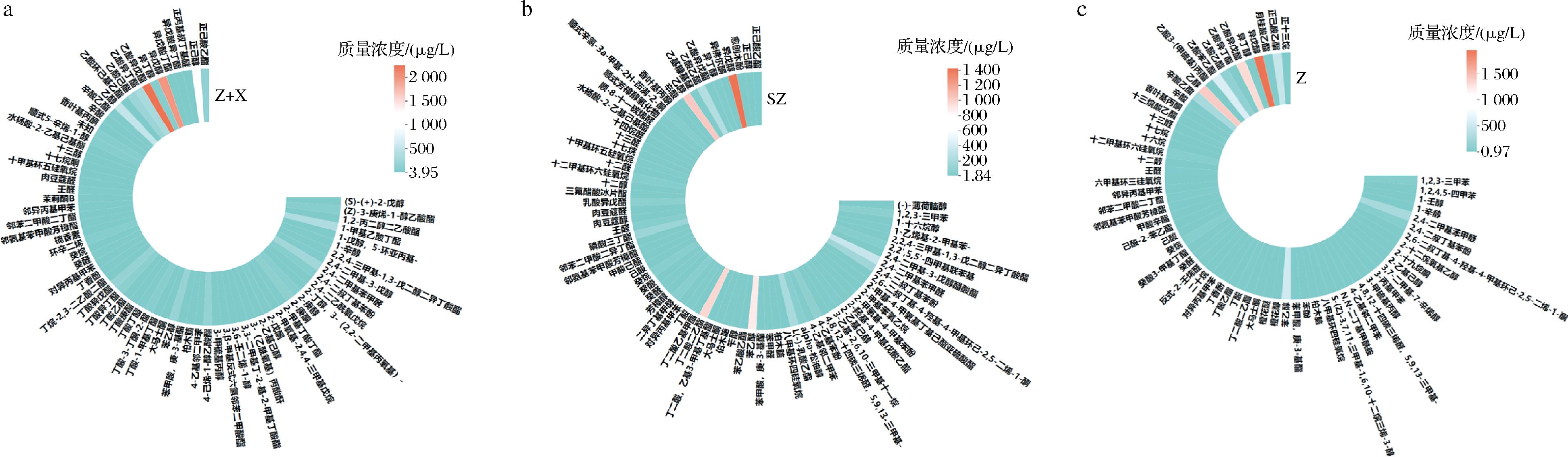
a-紫薯香蕉混合发酵酒;b-市售紫薯酒;c-单一发酵紫薯酒
图6 不同类型紫薯酒化合物聚类热图
Fig.6 Heat map of different kinds of purple sweet potato wine
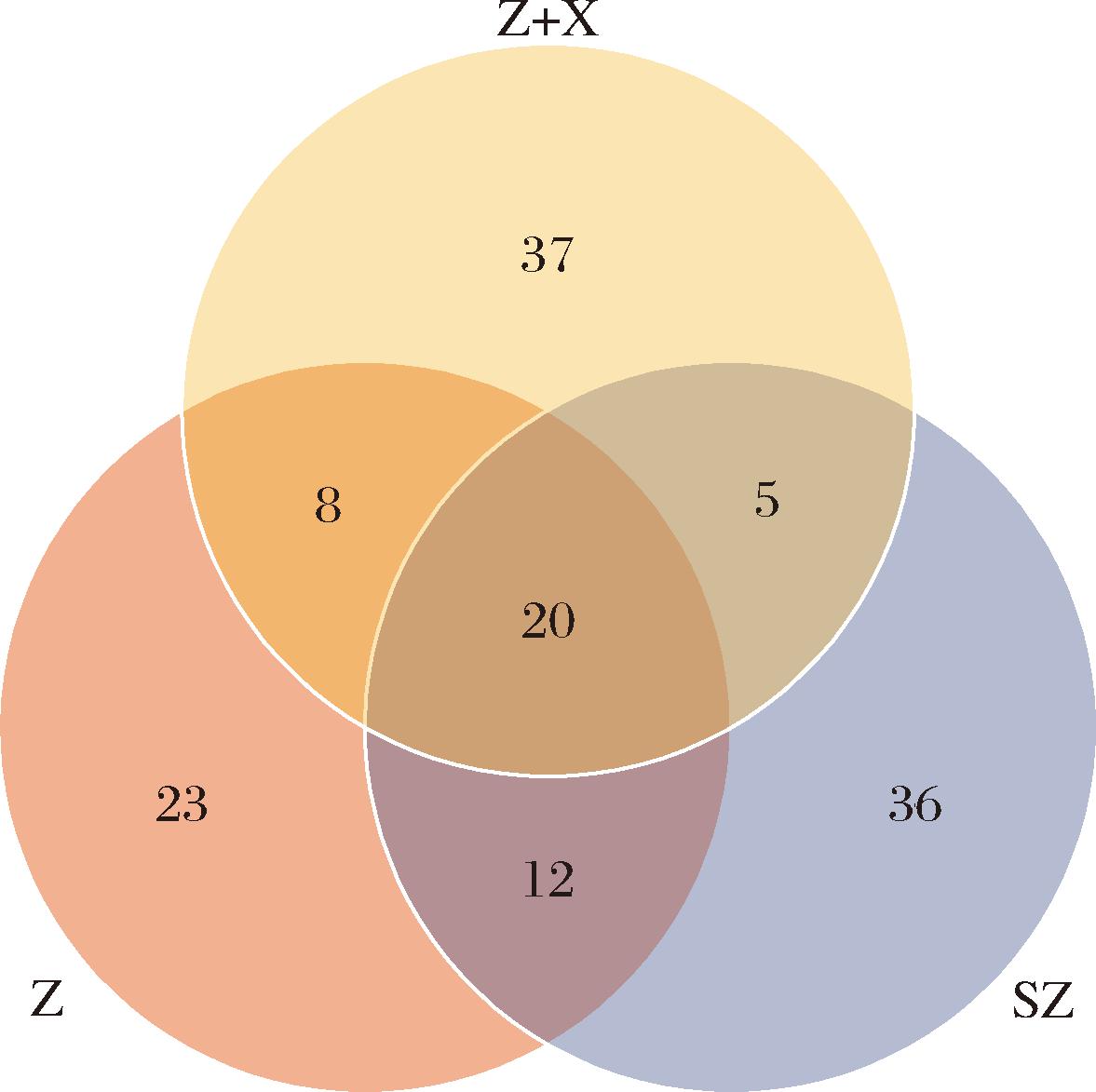
图7 紫薯香蕉混合发酵酒、市售紫薯酒、单一发酵紫薯酒化合物韦恩图
Fig.7 Venn diagram of different kinds of purple sweet potato wine
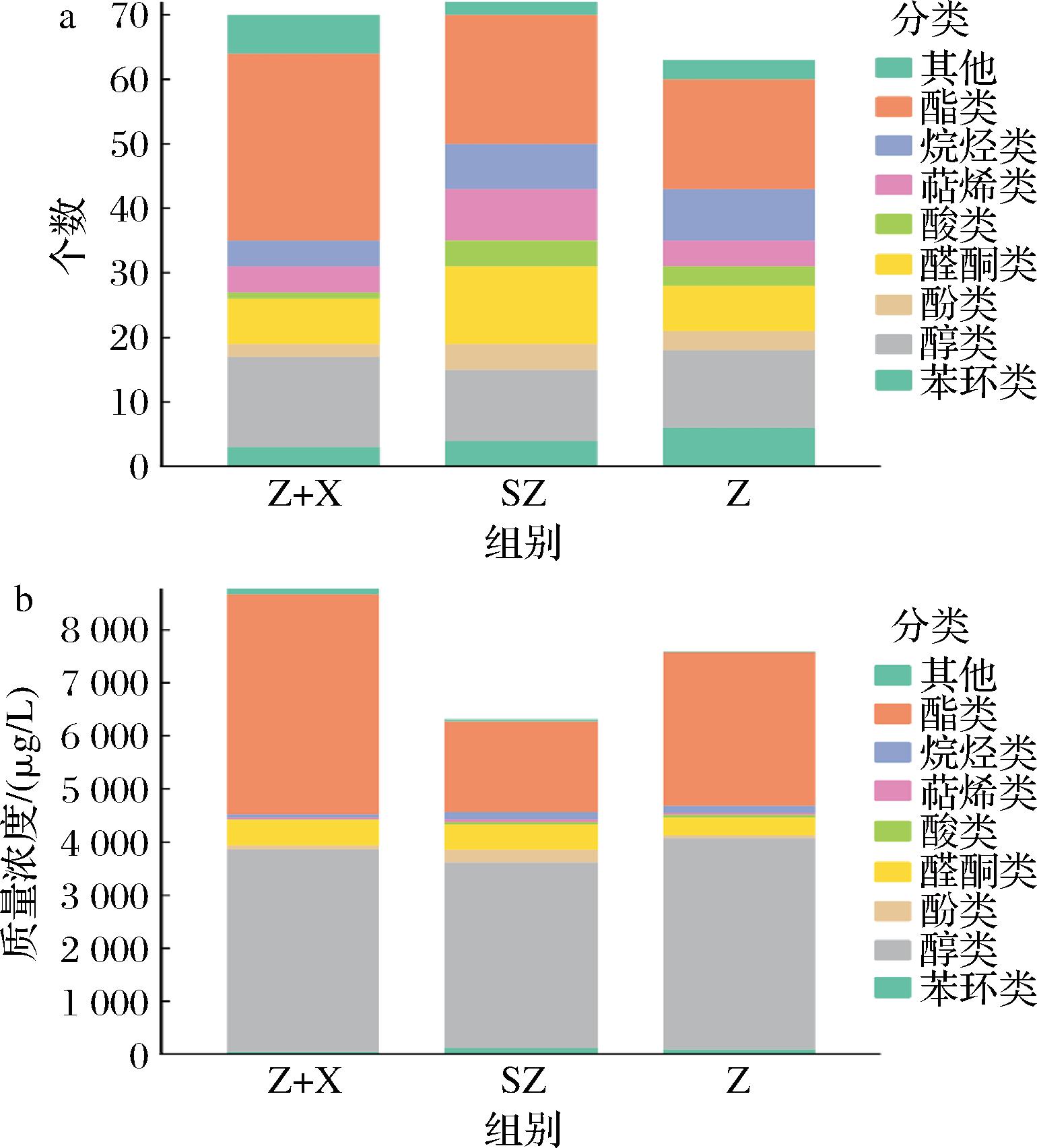
a-化合物分类个数;b-化合物分类浓度
图8 紫薯香蕉混合发酵酒、市售紫薯酒、单一发酵紫薯酒化合物分类个数及浓度堆叠柱状图
Fig.8 The number of compound classification and concentration stacking histogram of different kinds of purple sweet potato wine
2.5 不同水果与紫薯混合发酵酒的体外抗氧化活性分析
2.5.1 花色苷、黄酮、多酚含量变化
如表5所示,紫薯含有较高的抗氧化活性成分含量,随着底物中紫薯原料的减少,5种水果分别于紫薯混合发酵酒的花色苷、多酚、黄酮含量均有不同程度降低。其中Z+C酒的花色苷、多酚、黄酮减少量最小,Z+X酒减少量最大,这可能与橙子自身所含以上活性物质成分较多有关[21]。
表5 不同水果与紫薯混合发酵酒活性物质含量和抗氧化活性
Table 5 The content of active substances and antioxidant activity of fermented wine mixed with purple sweet potato in different fruits
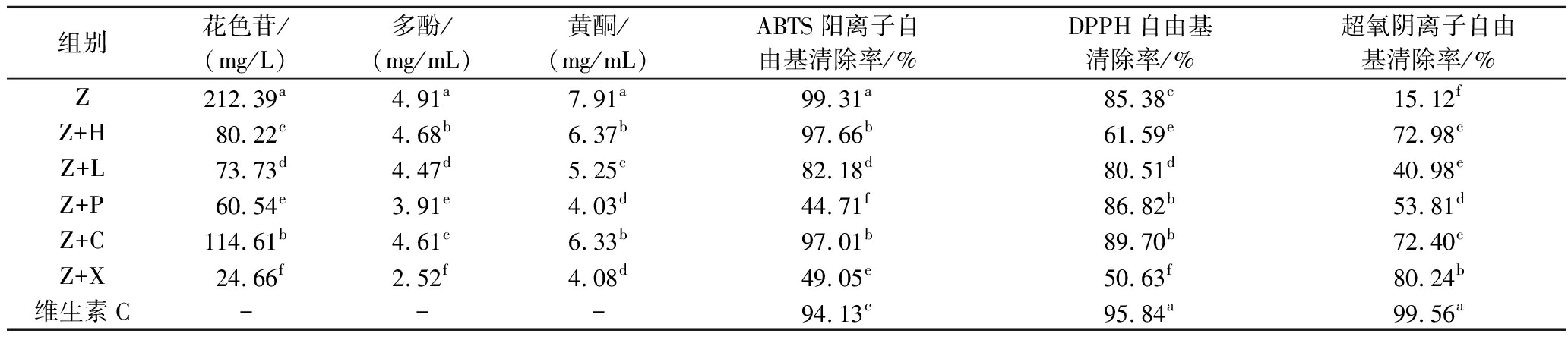
组别花色苷/(mg/L)多酚/(mg/mL)黄酮/(mg/mL)ABTS阳离子自由基清除率/%DPPH自由基清除率/%超氧阴离子自由基清除率/%Z212.39a4.91a7.91a99.31a85.38c15.12fZ+H80.22c4.68b6.37b97.66b61.59e72.98cZ+L73.73d4.47d5.25c82.18d80.51d40.98eZ+P60.54e3.91e4.03d44.71f86.82b53.81dZ+C114.61b4.61c6.33b97.01b89.70b72.40cZ+X24.66f2.52f4.08d49.05e50.63f80.24b维生素C---94.13c95.84a99.56a
注:-代表不存在;同一列不同字母表示差异显著(P<0.05)。
2.5.2 抗氧化能力分析
如表5所示,其中Z酒的ABTS阳离子自由基清除能力最高,这与花色苷、黄酮、多酚的含量趋势相同。这是由于多酚的多羟基结构,通过提供氢原子和电子转移使自由基变为稳定物质,或者螯合金属离子,阻止金属离子引发自由基反应[22]。江梦影等[23]研究发现,添加黑米酒糟的馒头ABTS阳离子自由基清除率增加趋势与黄酮与多酚实验结果一致。Z+C酒的DPPH自由基清除率最高。相关研究表明,花青素、总酚等含量与自由基的清除能力有关。而氧化能力的差异取决于酚类化合物的含量、结构组成以及酚类化合物之间的协同作用[24]。陈黄瞾等[25]通过测定湘珍珠红叶刺葡萄酚类物质的抗氧化活性发现,总酚、总黄酮和总花色苷对DPPH自由基清除能力贡献较大。
添加水果的发酵组别的超氧阴离子自由基的清除能力均高于单一紫薯发酵组,其原因是添加水果进行发酵增加了维生素C含量,有利于提高超氧阴离子自由基清除率。牛广财等[26]研究发现超氧阴离子自由基清除率与沙棘果酒中的维生素C含量之间呈正相关关系,而与总黄酮含量间的相关性不明显。并且发酵过程中,酵母利用果汁中的营养成分,如蛋白类,被利用水解,形成小肽类物质,具有抗氧化能力,协助抗氧化作用[27]。为进一步验证活性物质含量与体外抗氧化活性关联性,进行相关性分析,由图9可知,黄酮与花色苷含量存在显著性关系,多酚、黄酮含量与ABTS阳离子自由基清除率呈显著正相关,表明多酚和黄酮含量对紫薯酒的体外抗氧化活性具有显著影响,其中黄酮含量的影响力更高。
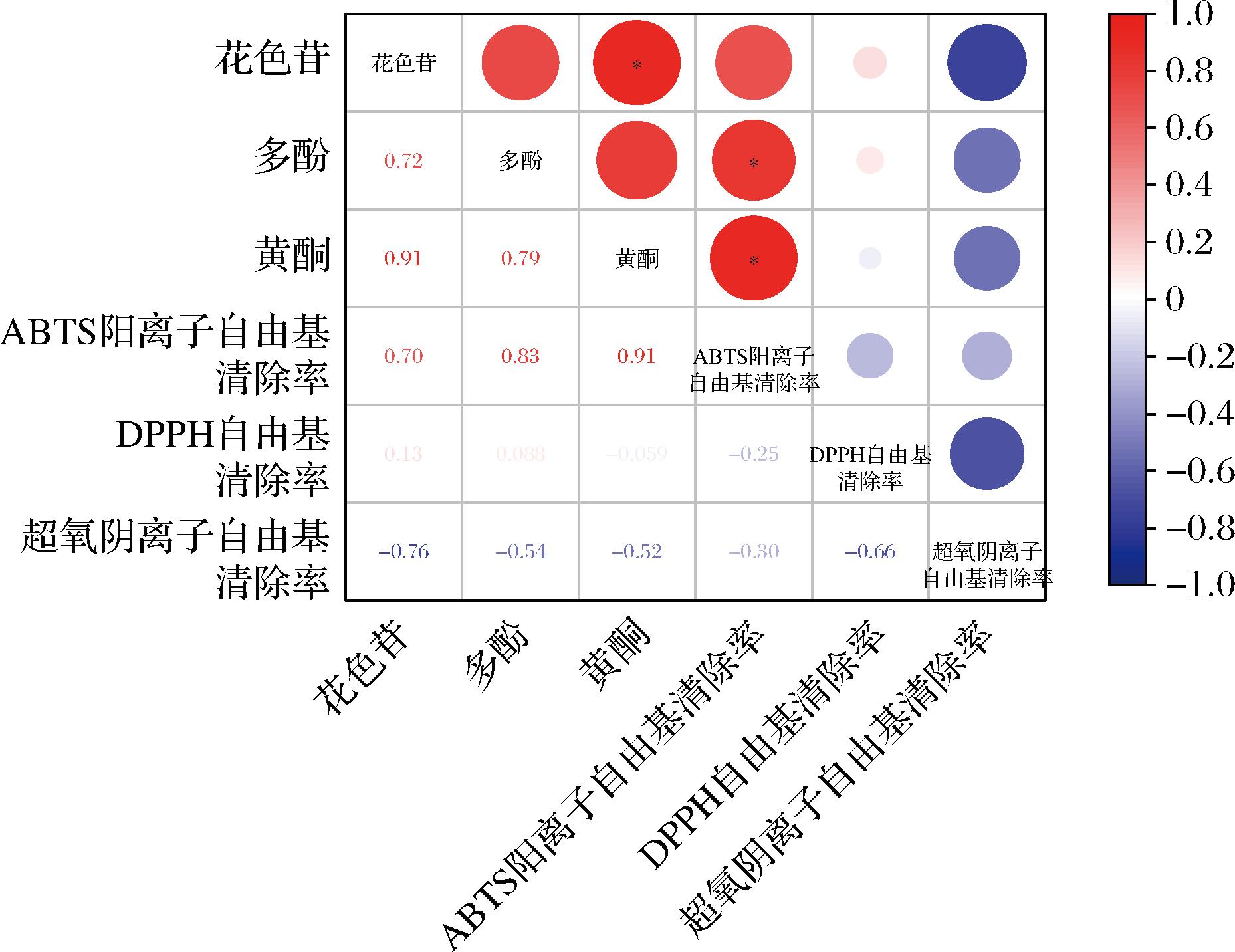
图9 不同水果与紫薯混合发酵过程中活性物质含量与体外抗氧化活性相关性分析
Fig.9 Correlation analysis of active substance content and antioxidant activity in vitro during mixed fermentation of different fruits and purple sweet potato
注:*表示在0.05水平上差异显著。
3 结论
该研究比较了紫薯与不同种水果混合发酵酒品质和风味差异。与单一紫薯酒相比,添加水果混合发酵能减少甲醇的含量,其中Z+X酒甲醇含量最低并且总酸含量最高。Z+L酒发酵前后颜色变化最大,Z+C酒发酵前后颜色变化最小,Z+X酒光泽感更好。与市售紫薯酒相比,不同水果的添加对紫薯酒感官评分都有较明显的提升。挥发性风味物质分析显示,Z+X酒风味物质种类最多,其主要香气成分有:异戊醇、正己醇、乙酸异戊酯、丁酸异戊酯、苯乙醇等,且酯类物质相对于Z酒增加了17种,赋予其显著的果香和花香特征。此外,Z+C酒的多酚、黄酮、花色苷含量与Z酒较为接近,且Z+C酒具有较强的抗氧化能力。综上,香蕉与紫薯混合发酵,可显著改善紫薯酒理化特征和感官品质,尤其增加其风味物质种类和浓度。紫薯与脐橙混合发酵酒具有较高的抗氧化功能活性。该研究为具有特色风味的紫薯混合果蔬酒加工及产品开发提供了理论基础和新思路。
[1] 谭属琼, 谢勇武.紫甘薯与甘薯营养成分分析与比较[J].食品工业, 2016, 37(6):276-278.TAN S Q, XIE Y W.Analysis and comparison of purple sweet potato and sweet potato nutrition ingredient[J].Food Industry, 2016, 37(6):276-278.
[2] 陈彩云, 王若宇, 张家乐, 等.紫薯花青素通过调节p53-p21Waf1/Cip1信号通路对辐射致造血干/祖细胞衰老的保护作用[J].食品科学, 2023, 44(21):131-136.CHEN C Y, WANG R Y, ZHANG J L, et al.Protective effect of Solanum tuberosum anthocyanin against radiation-induced hematopoietic stem/progenitor cell senescence via the p53-p21Waf1/Cip1 pathway[J].Food Science, 2023, 44(21):131-136.
[3] SUN Q, DU M, NAVARRE D A, et al.Effect of cooking methods on bioactivity of polyphenols in purple potatoes[J].Antioxidants, 2021, 10(8):1176.
[4] SUN J, CHEN H, KAN J, et al.Anti-inflammatory properties and gut microbiota modulation of an alkali-soluble polysaccharide from purple sweet potato in DSS-induced colitis mice[J].International Journal of Biological Macromolecules, 2020, 153:708-722.
[5] 向欣, 吴正云, 王尤强, 等.添加桑葚辅料发酵对紫薯酒中花青素含量和风味的影响[J].食品工业, 2023, 44(1):111-114.XIANG X, WU Z Y, WANG Y Q, et al.Effects of fermentation adding mulberry as excipient on anthocyanin content and flavor in purple potato wine[J].The Food Industry, 2023, 44(1):111-114.
[6] 王玉霞, 李兵, 朱谦丽, 等.添加不同水果的柑橘果酒酿造与品质分析[J].食品工业科技, 2019, 40(2):124-130.WANG Y X, LI B, ZHU Q L, et al.Brewing and quality analysis of citrus wines with different fruits[J].Science and Technology of Food Industry, 2019, 40(2):124-130.
[7] 郭浩然, 郑心怡, 张静, 等.桑葚酒中花青素含量的测定方法优化[J].食品工业科技, 2020, 41(9):255-259.GUO H R, ZHENG X Y, ZHANG J, et al.Optimization of determination method of anthocyanin content in mulberry wine[J].Science and Technology of Food Industry, 2020, 41(9):255-259.
[8] 芮蓬. 金果梨紫薯发酵果饮工艺研究[D].洛阳:河南科技大学, 2022.RUI P.Study on the technology of fermented fruit drink of Jinguo Pear and purple sweet potato[D].Luoyang:Henan University of Science and Technology, 2022.
[9] KRISHNAN J G, PADMAJA G, MOORTHY S N, et al.Effect of pre-soaking treatments on the nutritional profile and browning index of sweet potato and yam flours[J].Innovative Food Science &Emerging Technologies, 2010, 11(2):387-393.
[10] 魏晓庆, 刘小敏, 谢翔云, 等.椰肉陈酿生产豉香型白酒的研究[J].食品与发酵工业, 2021, 47(12):210-215.WEI X Q, LIU X M, XIE X Y, et al.Aging process of Chi flavor Baijiu steeping with coconut meat[J].Food and Fermentation Industries, 2021, 47(12):210-215.
[11] 冯莉梅, 邬应龙.紫薯:猕猴桃复合果酒的制备及香气成分分析[J].食品工业科技, 2016, 37(23):206-210;215.FENG L M, WU Y L.Preparation and analysis of aroma components of purple sweet potato-kiwi composite wine[J].Science and Technology of Food Industry, 2016, 37(23):206-210;215.
[12] KILANI S, BEN AMMAR R, BOUHLEL I, et al.Investigation of extracts from (Tunisian) Cyperus rotundus as antimutagens and radical scavengers[J].Environmental Toxicology and Pharmacology, 2005, 20(3):478-484.
[13] 郭晨晨, 王鑫涛, 劳凤仙, 等.不同酿酒酵母对槜李果酒发酵及挥发性香气成分的影响[J].中国酿造, 2023, 42(10):114-121.GUO C C, WANG X T, LAO F X, et al.Effect of different Saccharomyces cerevisiae on fermentation and volatile aroma components of plum wine[J].China Brewing, 2023, 42(10):114-121.
[14] MASLOV BANDI L, ŽULJ M M, FRUK G, et al.The profile of organic acids and polyphenols in apple wines fermented with different yeast strains[J].Journal of Food Science and Technology, 2019, 56(2):599-606.
L, ŽULJ M M, FRUK G, et al.The profile of organic acids and polyphenols in apple wines fermented with different yeast strains[J].Journal of Food Science and Technology, 2019, 56(2):599-606.
[15] LIANG Z C, LIN X Z, HE Z G, et al.Dynamic changes of total acid and bacterial communities during the traditional fermentation of Hong Qu glutinous rice wine[J].Electronic Journal of Biotechnology, 2020, 43:23-31.
[16] 李睿祎, 常馨佳, 梁艳英, 等.过滤方式对桑葚酒品质的影响[J].中国酿造, 2024, 43(2):160-166.LI R Y, CHANG X J, LIANG Y Y, et al.Effect of filtration methods on the quality of mulberry wine[J].China Brewing, 2024, 43(2):160-166.
[17] 姜绍通, 罗志刚, 潘丽军.甘薯中多酚氧化酶活性的测定及褐变控制[J].食品科学, 2001, 22(3):19-22.JIANG S T, LUO Z G, PAN L J.Study on assay and browning inhibitory control of polyphenol oxidase activities of sweet potato[J].Food Science, 2001, 22(3):19-22.
[18] WU J H, CHEN R Y, LI X B, et al.Comprehensive identification of key compounds in different quality grades of soy sauce-aroma type Baijiu by HS-SPME-GC-MS coupled with electronic nose[J].Frontiers in Nutrition, 2023, 10:1132527.
[19] 张文昊, 陈新军, 孙雪楠, 等.天山北麓玛纳斯小产区四种干红葡萄酒香气物质特征分析[J].食品与发酵工业, 2025, 51(8):299-306.ZHANG W H, CHEN X J, SUN X N, et al.Characterization of aroma substances of four dry red wines from Manas region in northern foot of Tianshan Mountains[J].Food and Fermentation Industries, 2025, 51(8):299-306.
[20] CHEN L H, LI D N, HAO D L, et al.Study on chemical compositions, sensory properties, and volatile compounds of banana wine[J].Journal of Food Processing and Preservation, 2020, 44(12):e14924.
[21] HANAFY S M, ABD EL-SHAFEA Y M, SALEH W D, et al.Chemical profiling, in vitro antimicrobial and antioxidant activities of pomegranate, orange and banana peel-extracts against pathogenic microorganisms[J].Journal of Genetic Engineering and Biotechnology, 2021, 19(1):80.
[22] 赵宁, 魏新元, 樊明涛, 等.发酵方法及品种对猕猴桃酒多酚和抗氧化性的影响[J].食品科学, 2017, 38(21):86-92.ZHAO N, WEI X Y, FAN M T, et al.Effect of fermentation methods and cultivars on polyphenols and antioxidant activity of kiwi wines[J].Food Science, 2017, 38(21):86-92.
[23] 江梦影, 赵一鸣, 荆旻歌, 等.黑米酒糟添加量对馒头品质及生理活性的影响[J].食品工业科技, 2024, 45(13):116-123.JIANG M Y, ZHAO Y M, JING M G, et al.Effect of black rice spent grain addition on quality and physiological activity of steamed bread[J].Science and Technology of Food Industry, 2024, 45(13):116-123.
[24] SAKURAI S, KAWAKAMI Y, KUROKI M, et al.Structure-antioxidant activity (oxygen radical absorbance capacity) relationships of phenolic compounds[J].Structural Chemistry, 2022, 33(4):1055-1062.
[25] 陈黄曌, 常永瑶, 赵佳慧, 等.刺葡萄酒用种质筛选及其发酵过程中活性物质变化研究[J].食品与发酵工业, 2024, 50(11):69-75.CHEN H Z, CHANG Y Y, ZHAO J H, et al.Selection of Vitis davidii germplasm for spine wine and active substances changes during fermentation process[J].Food and Fermentation Industries, 2024, 50(11):69-75.
[26] 牛广财, 朱丹, 王军, 等.沙棘酒清除自由基作用的研究[J].中国食品学报, 2010, 10(1):36-41.NIU G C, ZHU D, WANG J, et al.Study on the scavenging effects on free radical by sea buckthorn wine[J].Journal of Chinese Institute of Food Science and Technology, 2010, 10(1):36-41.
[27] 王鹤霖. 蓝莓籽瓜果酒酿造工艺优化及其抗氧化功能研究[J].食品工业科技, 2016, 37(19):232-236;243.WANG H L.Research of process optimization and antioxidant activities of blueberry and seed melon wine[J].Science and Technology of Food Industry, 2016, 37(19):232-236;243.