番茄属于茄科番茄属,营养丰富,含有多种人体所需的维生素,由于其风味独特,既可以直接生食又可以加工为番茄酱或制成番茄罐头等产品。番茄罐头是番茄原料经一系列的处理后装入容器,密封、灭菌而制成的一种罐藏食品。番茄罐头生产过程中关键控制点主要包含3方面[1]:第1个控制点就是原料的选择,应选择无伤痕和未受到微生物污染的番茄果实,对霉烂或其他不合格的番茄以及杂物尽可能的剔除[2];第2个关键控制点是番茄的加工过程,对已进入仓库的番茄应尽快进行清洗处理,减少受到自然环境微生物的侵害可能性[3-4],并对清洗后的番茄原料再次进行挑选,对不符合生产要求的番茄再次剔除,同时严格按照安全生产手册操作,减少从业人员将腐败微生物带入到番茄罐头生产过程的风险;第3个关键控制点是杀菌效果,虽然番茄罐头属于酸性食品,绝大部分致病微生物很难存活,但对于霉菌和酵母等腐败菌来说,在酸性条件下依然可以引起番茄罐头的胀罐变质[5-6],因此,探究合适的杀菌方式,既能降低产品的微生物污染风险,又不会引起番茄罐头口感发生较大变化,是影响番茄罐头品质的重要关键控制点[7-8]。
通常情况下,罐藏食品腐败变质主要由于食品中混入了酵母菌和霉菌等[9]。国外有研究对桶装浓缩番茄酱在贮藏过程中的微生物群落变化情况进行了分析,发现番茄酱中若含有酵母菌、乳酸菌和霉菌等,则会对番茄酱品质产生影响[10];尼日利亚市场上的番茄中也分离出埃希氏菌属、假单胞菌属、青霉菌和酵母菌等污染菌[11]。胡习祯等[9]发现若罐藏食品热杀菌不充分或密封不良,会导致部分酵母菌残留在食品中,残留的酵母菌在番茄等具有适宜酸度的食品中可以迅速繁殖,而罐藏食品因酵母菌引起的腐败变质多发生在酸性或高酸性条件下,因此若番茄罐头中含有酵母菌便会增加产品腐败变质的风险。黄玲等[12]也从胀袋番茄酱中分离出了季也蒙假丝酵母(Candida guiliermondii)和丛生孢丝酵母(Trichosporn pullulans)。因此,本研究拟采用高通量测序技术,对收集到的不同生产时间和不同阶段的番茄罐头样品真菌内转录间隔区(internal transcribed spacer, ITS)基因进行测序,全面解析番茄罐头生产过程中真菌群落结构的变化和关键物种差异;采用纯培养技术,结合多相鉴定技术,对番茄罐头的生产过程中的真菌进行大规模的分离与鉴定,确定分离菌株的准确的分类学地位;通过回接实验和菌株分型分析,确定番茄罐头生产加工过程中的关键腐败真菌及其来源,建立腐败真菌的溯源分析流程,为番茄罐头生产过程中腐败微生物的控制和产品品质提升奠定基础。
1 材料与方法
1.1 材料与试剂
0.85%生理盐水,北京君立康科技发展有限责任公司;厌氧产气袋,日本三菱化学公司;溶菌酶,天根生化科技(北京)有限公司;真菌基因组DNA提取试剂盒、酵母菌基因组DNA提取试剂盒、基因组DNA纯化试剂盒,美国OMEGA生物技术公司;土壤提取试剂盒,德国QIAGEN公司;dNTPs、Taq DNA聚合酶、DNA Marker、琼脂糖,北京全式金生物技术有限公司;厌氧盒,日本三菱化学公司;其他试剂均为国产或进口分析纯。
孟加拉红琼脂培养基(g/L):蛋白胨 5.0、葡萄糖 10.0、KH2PO4 1.0、MgSO4(无水) 0.5、琼脂 20.0、孟加拉红 0.033、氯霉素 0.1。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基(g/L):马铃薯浸出粉 12.0、葡萄糖 20.0、琼脂 14.0。
麦芽浸粉琼脂(malt extract agar,MEA)培养基(g/L):蛋白胨 0.78、麦芽糖 12.75、糊精 2.75、丙三醇 2.35、琼脂 15.0。
1.2 仪器与设备
HG-50高压灭菌锅,日本平山制作所株式会社;移液器(2.5 μL、100 μL、1 mL、5 mL),德国Eppendorf公司;AC2-4S1生物安全柜,新加坡艺思高科技有限公司;BHG-8082型恒温培养箱,上海一恒科学仪器有限公司;LX-165T2R医用离心机,青岛海特生物医疗有限公司;基质辅助激光解吸电离飞行时间质谱仪(matrix-assisted laser desorption/ionization time of flight mass spectrometry, MALDI-TOF MS),德国Bruker Daltonik公司;全自动革兰氏染色仪,青岛澜澈生物科技有限公司;ECLIPSE 80i光学显微镜,尼康仪器(上海)有限公司。
1.3 实验方法
1.3.1 样品采集
对番茄罐头的生产工艺流程进行全面分析,包括番茄存放、清洗、去蒂、烫皮、切丁、杀菌、冷却和包装等生产工艺,具体流程见图1。本研究对棉拭子涂抹法对番茄罐头不同生产时间和不同生产阶段进行采样,采样点包括正常原料(ZCYL)、裂口原料(LKYL)、原料传送带(YL)、清洗水(QXS)、清洗后传送带(QXH)、去蒂传送带(QT)、去蒂后传送带(QTH)、烫皮西红柿(TP)、去皮后传送带(QPH)、切块前传送带(QKQ)、切块前传送带外侧(QKQW)、切块后样品(QKH)、空罐(KG)、罐装后样品(GZH)、预热后样品(YRH)、灭菌前样品(MJQ)和灭菌后产品(MJH);采样时间包括7月、8月和9月,其中9月份样品又分为热水冲洗前和热水冲洗后的样品,热水冲洗后样品采集方式为:使用80 ℃热水对从原料传送到切丁装罐的所有传送带进行全面冲洗,冲洗后立即进行采样,即为冲洗后样品。
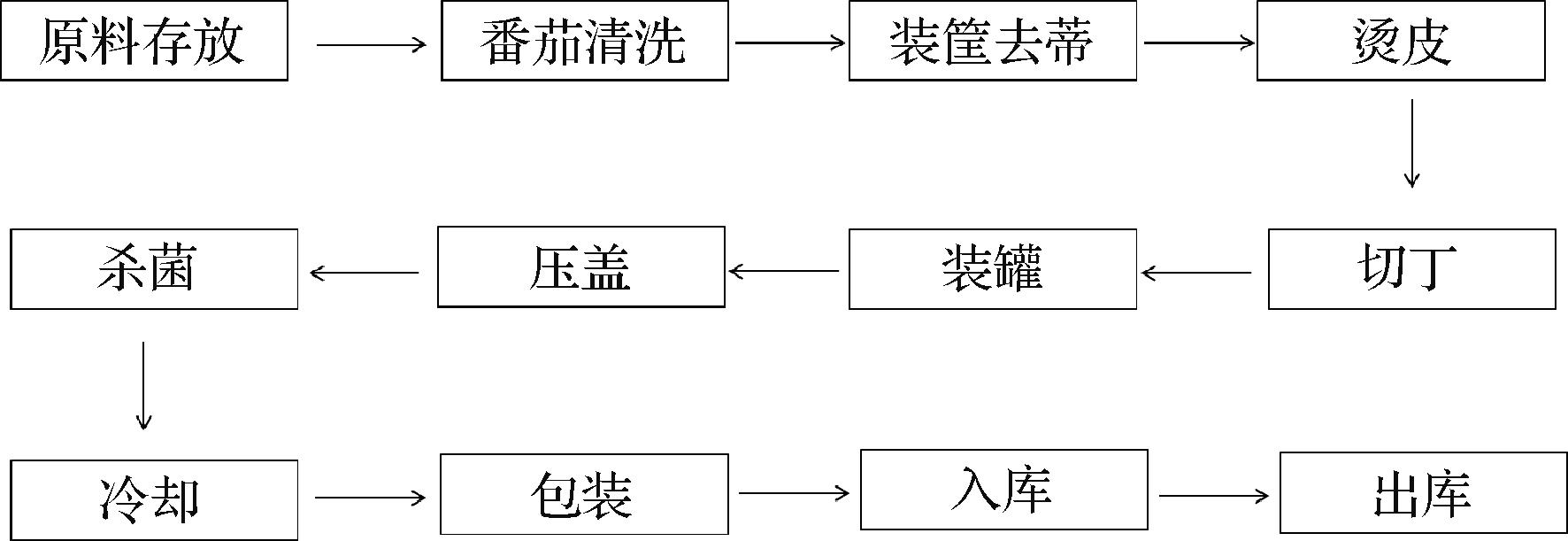
图1 番茄罐头生产工艺流程图
Fig.1 Canned tomato production process flow chart
1.3.2 番茄罐头的生产过程中真菌的分离与鉴定
利用梯度稀释平板法结合平板划线法等纯培养技术,采用孟加拉红琼脂培养基、PDA培养基和MEA培养基对番茄罐头的生产过程中真菌进行大规模的分离筛选;采用MALDI-TOF MS快速鉴定系统,结合分子生物学技术对筛选得到的真菌进行鉴定,确定分离菌株准确的分类学地位。
1.3.2.1 真菌的分离纯化
利用纯培养技术,采用孟加拉红琼脂培养基对番茄罐头生产过程中的酵母菌和丝状真菌进行分离筛选,并使用PDA和MEA对分离出的菌株进行纯化。具体操作方法如下:在生物安全柜中分别称取25 g采集的样品于225 mL无菌生理盐水中,充分混匀制备成1∶10样品稀释液,吸取1 mL稀释液加入9 mL无菌生理盐水,充分混匀制备成1∶100样品稀释液,重复上述操作对样品进行梯度稀释,取2~3个合适浓度的稀释液分别涂布于孟加拉红琼脂培养基28 ℃培养3~5 d。从培养完成的平板上选取菌落形态不同的单菌落,在PDA培养基和MEA培养基平板上四区划线分纯,28 ℃培养3~5 d。重复上述操作对分离菌株进行纯化2次,根据菌落形态和镜检确认,将纯化后的分离菌株编号并转移至含15%无菌甘油的甘油管中,-80 ℃冰箱保藏备用。
1.3.2.2 真菌的鉴定
使用MALDI-TOF MS鉴定系统,对分离筛选得到的真菌菌株进行鉴定,确定菌株的分类学地位。根据《基质辅助激光解析电离飞行时间质谱鉴别微生物方法通则》中规定的甲酸提取法,获得分离菌株的蛋白样品,使用MALDI-TOF MS鉴定系统采集核糖体蛋白指纹图谱,通过与指纹图谱数据库进行比对分析,实现分离菌株的快速鉴定。
对于采用MALDI-TOF MS鉴定系统无法鉴定的菌株,则采用分子生物学技术,通过核糖体翻译间隔基因序列(ITS rDNA)和核糖体 rDNA 大亚基基因序列(26S rDNA)测序进一步确定分离菌株的分类学地位。对于丝状真菌使用真菌基因组DNA提取试剂盒提取分离丝状真菌的基因组DNA,对于酵母类真菌使用酵母菌基因组DNA 提取试剂盒提取分离酵母的基因组DNA,作为PCR扩增的模板;ITS5(5′-GGAAGTAAAAGTCGTAACAAGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)作为ITS rDNA基因的扩增引物,NL1(5′-GCAT-ATCAATAAGCGGAGGAAAAG-3′)和NL4(5′-GGTCCGTGTTTCAAGACGG-3′)作为26S rDNA基因的扩增引物。PCR 反应体系如下:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 45 s,72 ℃ 45 s,共 35 个循环;72 ℃ 10 min。扩增产物经1%琼脂糖电泳检测后,送至北京诺赛基因组研究中心有限公司完成测序。将测序结果在 GenBank 数据库中进行 BLAST 比对,搜索同源序列,以 97%序列相似性作为种水平鉴定的判定标准。
1.4 番茄罐头的生产过程中真菌群落结构分析
1.4.1 宏基因组DNA的提取、PCR扩增及测序
采用土壤提取试剂盒DNeasy PowerSoil Pro Kit提取番茄生产过程中采集样品的宏基因组DNA。使用Cycle-pure Kit对提取得到的粗DNA进行纯化,以满足后续建库的要求。取质量合格的基因组DNA样品30 ng,使用ITS1基因通用引物its1(5′-CTTGGTCATTTAGGAAGTAA-3′)和its2(5′-GCTGCGTTCTTCATCGATGC-3′)进行PCR扩增。使用Agencourt AMPure XP磁珠对PCR扩增产物进行纯化,完成文库的构建。使用Agilent 2100 Bioanalyzer对构建的文库进行质控分析,质控合格后,选择MGISEQ-2000高通量测序平台进行扩增子测序。
1.4.2 数据分析
扩增子测序数据分析主要包括原始数据的过滤、Tag拼接、操作分类单元(operational taxonomic unit, OTU)物种注释、Alpha多样性分析和Beta多样性分析等。使用iTools Fqtools fqcheck(v0.25)对下机的测序数据进行质控,利用cutadapt (v2.6)和readfq(v1.0)软件去除原始序列中的接头与引物、低质量reads、含N reads和低复杂度reads,得到高质量的Clean Data。使用Usearch(v7.0.109 0)方法进行聚类分析,按照最小匹配长度 为15 bp,重叠区域允许错配率为 0.1的要求,使用FLASH(v1.2.11)软件进行拼接,得到高变区的Tags。再利用软件USEARCH(v7.0.1090)将拼接好的Tags聚类为OTU,并得到每个样品的OTU的丰度统计表。通过 RDP classifer 软件将 OTU 代表序列与UNITE数据库(v 8.2 2020-02-20)比对进行物种注释,置信度阈值设置为 0.6,去除没有注释结果的 OTU以及注释结果不属于分析项目中的物种,并在界、门、纲、目、科、属和种水平上统计分析各样品中的真菌物种的组成。使用mothur(v.1.31.2)进行样品Alpha多样性指数分析,主要包括Chao、Shannon和Coverage指数,共同表征样品的细菌群落结构的丰富度和多样性。使用QIIME(v1.80)软件分析各物种在样品中的含量,进而计算出不同样品间的Beta 多样性值。选取丰度排名前10的真菌物种,利用R(v3.4.1)软件和Kruskal-Wallis(KW)检验分析真菌物种在每个分组中的平均相对丰度以及差异显著性,探究不同分析样品的关键微生物。
1.5 番茄罐头的生产过程中腐败真菌的溯源分析
1.5.1 腐败真菌的菌株分型
采用随机扩增多态性 DNA法(random amplified polymorphic DNA,RAPD)对生产过程中潜在的腐败菌进行菌株分型。该方法以基因组 DNA 为模板,选择单一的随机引物进行PCR扩增,通过琼脂糖电泳检测扩增产物来反映基因组的多态性,从而实现待测菌株的分型。本研究收集生产过程中不同生产阶段分离的热带假丝酵母(Candida tropicalis)共20株,使用酵母基因组DNA提取试剂盒提取热带假丝酵母的基因组DNA,以引物S6(5′-TGCTCTGCCC-3′)作为随机引物进行PCR扩增。PCR 反应体系如下:95 ℃ 5 min;95 ℃ 50 s,38 ℃ 50 s,72 ℃ 90 s,共 45 个循环;72 ℃ 10 min。使用1.5%琼脂糖凝胶对扩增产物进行电泳检测,根据电泳图中扩增条带出现的位置来判断待测菌株是否为同一株,从而实现菌株分型。
1.5.2 腐败真菌的回接实验
选取不同生产时间(7、8、9月)分离的3株热带假丝酵母菌进行腐败真菌回接实验。吸取 100 μL甘油管冻存液转接至5 mL麦芽浸粉肉汤中,28 ℃振荡培养至菌液OD600达到0.6时取出,按照2%的接种量接种于50 g新鲜去皮的番茄中,拧紧蓝盖瓶盖,28 ℃静止培养,分别培养24、48、72 h后观察蓝盖瓶内产气情况,并取样测定番茄的pH值。
1.6 腐败真菌的生产控制
综合分析番茄罐头生产过程中真菌的群落结构,真菌的分离筛选情况以及回接实验结果,发现腐败真菌主要来源于番茄罐头原料以及灭菌前与番茄原料直接接触生产过程中的真菌生物量积累。本研究对番茄罐头生产过程中的腐败真菌进行生产控制,通过优化生产工艺,增加热水清洗程序,使用80 ℃热水对从原料传送到切丁装罐的所有传送带进行全面冲洗,冲洗后立即进行采样,即为冲洗后样品。使用GB 4789.15—2016《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》对冲洗前后样品中的真菌进行计数,并通过比较热水冲洗先后真菌数量变化来评价腐败真菌。
2 结果与分析
2.1 番茄罐头的生产过程中真菌群落结构分析
利用MGISEQ-2000测序平台对番茄罐头不同生产时间和不同生产阶段的样品进行高通量测序,解析番茄罐头生产过程中的真菌群落结构。测序结果表明,7月份、8月份、9月份以及9月份冲洗后采集的46个样品共获得2 766 689条Tags,除8月份裂口样品LKYL_8(7 597 Tags)和冲洗后原料传送带YL_QX9(26 308 Tags)外,样品的Tags数目在45 706~64 916。46个样品共获得5 236 OTUs,物种累积曲线趋于平稳,每个样品的OTUs数目在27~365。
2.1.1 番茄罐头生产过程中真菌的组成和丰度分析
本研究分别采集了7月份、8月份、9月份以及9月份冲洗后这4个时间段的番茄罐头生产过程不同阶段的样品用于真菌群落结构分析。由于ITS rRNA基因使用引物its1和its2进行扩增的产物片段长度仅有600 bp,在属水平上对真菌物种注释较为准确,因此本研究主要在属水平上分析真菌的群落结构。样品中真菌物种组成和相对丰度分析结果表明(图2),随着生产时间的变化以及清洗生产线的影响,7月份、8月份、9月份以及9月份冲洗后的样品表现出不同的真菌群落结构特征。生产开始的7月份样品中真菌物种相对丰度超过10%的菌属包括丝孢酵母属(Trichosporon)、未知真菌属(Fungi_gen_Incertae_sedis)、毕赤酵母属(Pichia)、长西氏酵母属(Naganishia)、Apiotrichum、刺盘孢属(Colletotrichum)、皮状新丝孢酵母属(Cutaneotrichosporon)和马拉色菌属(Malassezia)。整体上看,生产过程中不同采样点的真菌物种组成和丰度差别较大,但过程中相衔接的采样点也表现出一定的相似,其中切块前后的样品QKQ_7和QKH_7中丝孢酵母属的丰度分别达到94%和78%;裂口样品(LKYL_7)和正常样品(ZCYL_7)以毕赤酵母属为主,丰度分别为55%和22%;Apiotrichum属是去蒂后传送带(QTH_7)、去皮后传送带(QPH_7)和清洗水(QXS_7)中的主要菌属,丰度在18%~38%;罐装预热后产品(YRH_7)和灭菌(MJH_7)中长西氏酵母属是主要真菌,其丰度分别为17%和30%;刺盘孢属、皮状新丝孢酵母属和马拉色菌属分别仅主要存在于去蒂传送带、清洗水和灭菌前产品中,丰度分别为 29%、27%和14%,详细结果见图2-a。

a-7月份样品;b-8月份样品;c-9月份样品;d-9月份清洗后样品
图2 番茄罐头不同生产时间和不同生产阶段样品的真菌种类和丰度
Fig.2 Fungal species and abundance of canned tomato samples at different production times and different production stages
随着番茄罐头的持续生产,环境温度的持续升高以及微生物的不断积累,8月份样品真菌群落结构发生改变,其中最大的变化就是假丝酵母属菌(Candida)种逐渐成为生产过程中优势真菌类群,其丰度超过1%的有10个采样点,占比为77%,其中丰度超过10%的样品包括去皮后传送带(QPH_8)、切块前传送带(QKQ_8)、烫皮西红柿(TP_8)、切块后产品(QKH_8)、灭菌前产品(MJQ_8)、罐装后产品(GZH_8)和去蒂传送带(QT_8),去皮后传送带(QPH_8)样品中的假丝酵母属菌株的占比最高,达到90%。8月份样品中出现了不同于7月份样品的优势菌属,Saprochaete属主要存在于去蒂后传送带、灭菌前产品和去蒂传送带,其丰度分别为52%、23%和22%;棒孢酵母属(Clavispora)、囊泡线黑粉菌属(Cystofilobasidium)、线黑粉菌属(Filobasidium)和维希尼克氏酵母属(Vishniacozyma)分别是罐装后产品中的优势真菌、原料传送带和裂口原料中的优势真菌。9月份样品真菌群落结构与8月份样品较为相似,假丝酵母属菌种仍然是生产过程中优势真菌类群,其丰度超过1%的有9个采样点,占比达到82%,其中丰度超过10%的样品有7个,去皮后传送带(QPH_9)、烫皮西红柿(TP_9)和切块后产品(QKH_9)中假丝酵母属菌种丰度均超过了90%;此外,威克汉姆酵母属(Wickerhamomyces)菌种是9月份样品不同于其他2个月的特有优势真菌,其在去蒂后传送带(QTH_9)样品中的丰度为67%。
为了降低番茄罐头生产线中微生物的负载,本研究在9月份样品采样后,使用80 ℃热水对从原料传送到切丁装罐的所有传送带进行了全面清洗,冲洗后立即进行采样,作为9月份冲洗后样品。该样品真菌群落结构分析结果表明,冲洗后的样品中优势真菌更为集中,主要分布于假丝酵母属菌、Apiotrichum和丝孢酵母属。采样的9个样品中假丝酵母属菌种丰度均超过了1%,丰度超过10%的样品有6个,占比67%,其中清洗后的去皮后传送带(QPH_QX9)样品中假丝酵母属菌种丰度最高,达到97%;Apiotrichum菌种在冲洗后的原料传送带、清洗后传送带、去蒂传送带、去蒂后传送带和清洗水样品中的占比超过10%,丰度分别为37%、95%、14%、36%和52%。此外,冲洗后的去蒂传送带(QT_QX9)、切块前传送带外侧(QKQW_QX9)和切块后产品(QKH_QX9)样品中丝孢酵母属菌种为优势真菌,丰度分别为61%、36%和14%。
2.1.2 番茄罐头生产过程中真菌多样性研究
使用mothur软件对番茄生产过程中样品的真菌群落结构的Alpha多样性进行分析,来表征番茄生产过程各阶段的物种多样性。本研究主要比较不同季节以及冲洗前后样品的Chao指数和Shannon指数差异来探究生产时间和生产工艺优化对真菌群落结构多样性的影响。其中,Chao指数主要用于估计样品中的物种总数,该指数越大,表示样品中真菌群落的丰富度越高;Shannon指数主要用于反映真菌群落的多样性,该指数越大,表示样品中真菌物种多样性越高。多样性分析结果表明(图3-a),7月份样品、8月份样品、9月份样品和9月份冲洗后样品的Chao指数在28~401,物种总数的中位数随着生产的进行以及工艺的改变呈现下降的趋势,其中7月份样品Chao指数的波动最大,9月份清洗后样品的Chao指数的波动最小。4个样品的Shannon指数在0.11~2.81,其中9月份样品Shannon指数波动最大,9月份清洗后样品的Shannon指数的波动最小。随着生产的进行,Shannon指数整体上呈现下降趋势,表明随着生产的进行,腐败微生物逐渐集中在优势真菌上。此外,虽然9月份冲洗后样品的中位数高于9月份样品,但是整体波动小于9月份样品,推测冲洗后立即采样,样品中还存在着热水处理后的死亡的真菌,导致其多样性增加(图3-b)。
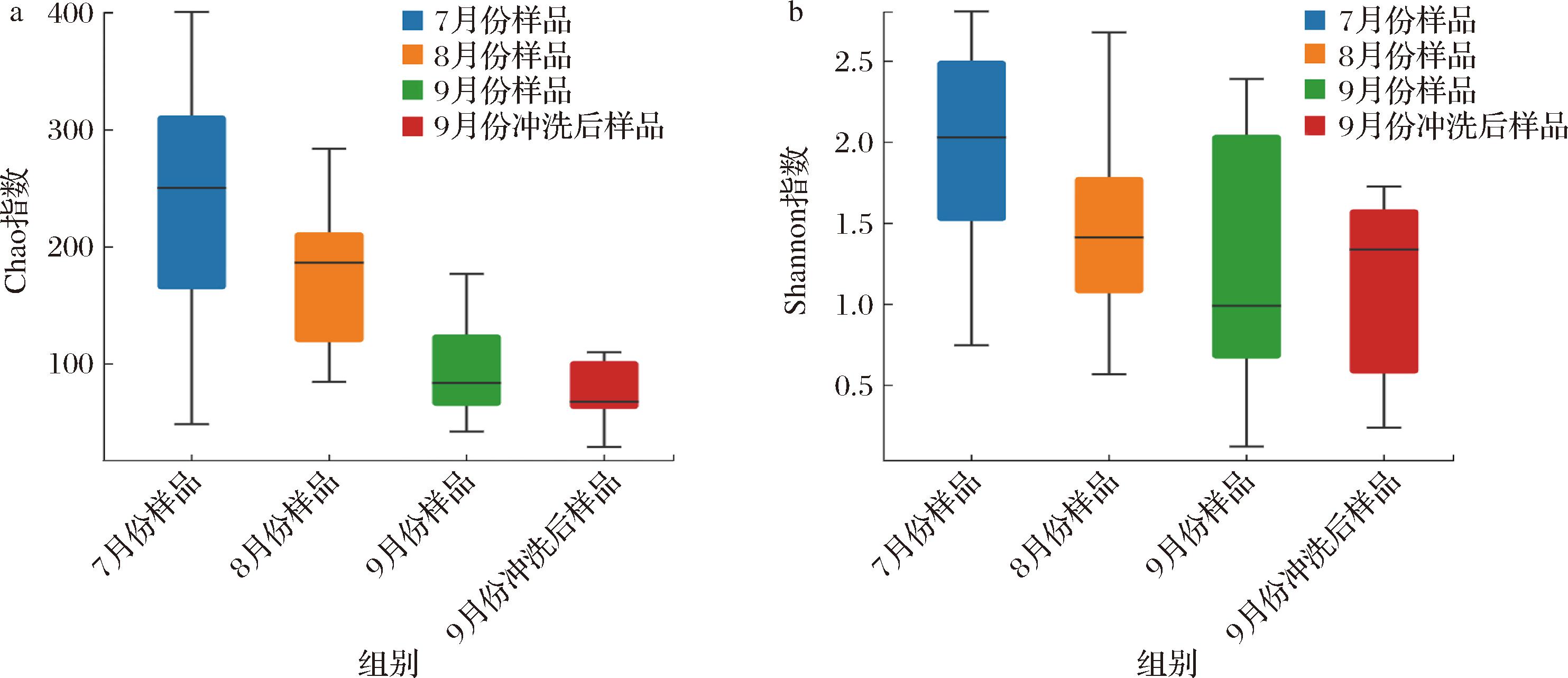
a-Chao指数;b-Shannon指数
图3 番茄罐头不同生产时间和不同生产阶段样品的真菌多样性指数比较
Fig.3 Comparison of bacterial fungal diversity index of canned tomato samples at different production times and different production stages
2.1.3 番茄罐头生产过程中关键真菌分析
为了探究番茄罐头生产过程中关键真菌,本研究选取丰度高的主要真菌物种,利用R软件分析真菌物种在每组中的平均相对丰度以及差异显著性,来分析不同生产时间和生产工艺的样品中的关键微生物。分析结果表明,假丝酵母属、未知真菌属(Fungi_gen_Incertae_sedis)、长西氏酵母属和威克汉姆酵母属是不同样品中有差异的关键微生物。其中,假丝酵母属是8月份样品,9月份样品和9月份清洗后样品中的关键真菌,远高于7月份样品中;未知真菌属(Fungi_gen_Incertae_sedis)和长西氏酵母属是7月份样品中的关键真菌,丰度远高于其他3个样品;而威克汉姆酵母属仅是9月份样品的优势真菌(图4-a)。
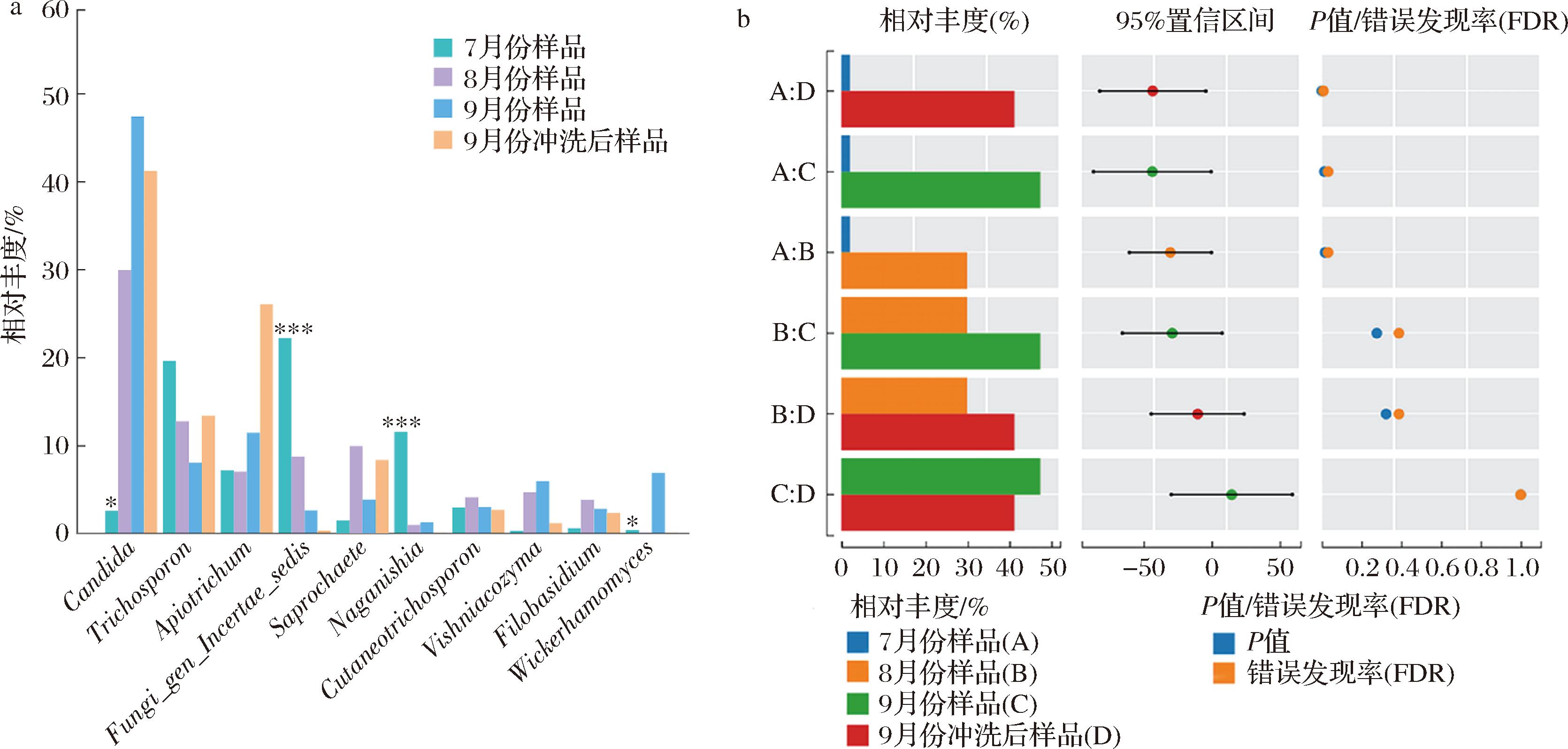
a-关键真菌分析;b-假丝酵母分析
图4 番茄罐头不同生产时间和不同生产阶段样品的关键真菌及假丝酵母分析
Fig.4 Analysis of key fungi and Candida sp.of canned tomato samples at different production times and different production stages
注:*表示即7月份样品与8月份样品、7月份样品与9月份样品、7月份样品与9月份清洗后样品两两相比的显著性差异;*代表P值<0.05,**代表P值<0.01,***代表P值<0.001。
本研究进一步探究了假丝酵母属菌种在不同样品中分布情况(图4-b),8月份样品、9月份样品和9月份冲洗后样品中的假丝酵母属丰度均显著高于7月份样品。其中,9月份样品中的假丝酵母属丰度最高,占比47.3%;9月份冲洗后样品和8月份样品中假丝酵母属的占比分别为41.2%和29.9%。上述结果表明,随着生产时间的延长,番茄生产过程中的假丝酵母属菌种是逐渐积累的,9月份丰度达到最高,这与番茄制品出现胀罐现象的频次正相关;工艺优化调整后,增加热水清洗的工序能够在一定程度上降低假丝酵母属的丰度。此外,虽然9月份冲洗后样品中假丝酵母属的丰度为41.2%,但是经热水冲洗后,推测番茄制品生产过程的假丝酵母属大部分都会死亡,生产传送带上仅有假丝酵母属菌种DNA残留存在,这需要通过后续的可培养结果进行验证。
2.2 番茄罐头的生产过程中真菌分离结果
本研究从番茄罐头生产过程中的样品中共分离筛选得到19个属72株真菌(表1),主要包括假丝酵母属、毕赤酵母属、有孢汉逊酵母(Hanseniaspora)、酵母属(Saccharomyces)、地霉菌属(Geotrichum)、Saprochaete和Apiotrichum等。从分离的种类来看,从番茄罐头不同生产阶段共分离得到了20株热带假丝酵母,占比27.8%,在裂口原料、冲洗后清洗后传送带、去蒂传送带、冲洗后去蒂后传送带、烫皮西红柿、去皮后传送带、冲洗后去皮后传送带、切块前传送带、冲洗后切块前传送带、切块前传送带外侧、冲洗后切块前传送带外侧、切块后样品和冲洗后切块后等样品中均有检出,且具有较高的丰度,因此推测热带假丝酵母是导致番茄罐头胀罐的潜在优势腐败菌,这与高通量测序分析的结果是一致的。此外,毕赤酵母属和有孢汉逊酵母属菌种也是检出率较高的真菌,分别占比9.7%和6.9%,其中毕赤酵母属主要分布于裂口原料、冲洗后去蒂传送带、去皮后传送带和清洗水等4个位点,而有孢汉逊酵母属主要分布于裂口原料、冲洗后清洗后传送带和冲洗后原料传送带等3个位点。
表1 番茄罐头不同生产时间和不同生产阶段样品真菌分离结果
Table 1 Fungal isolation results of canned tomato samples at different production times and different production stages
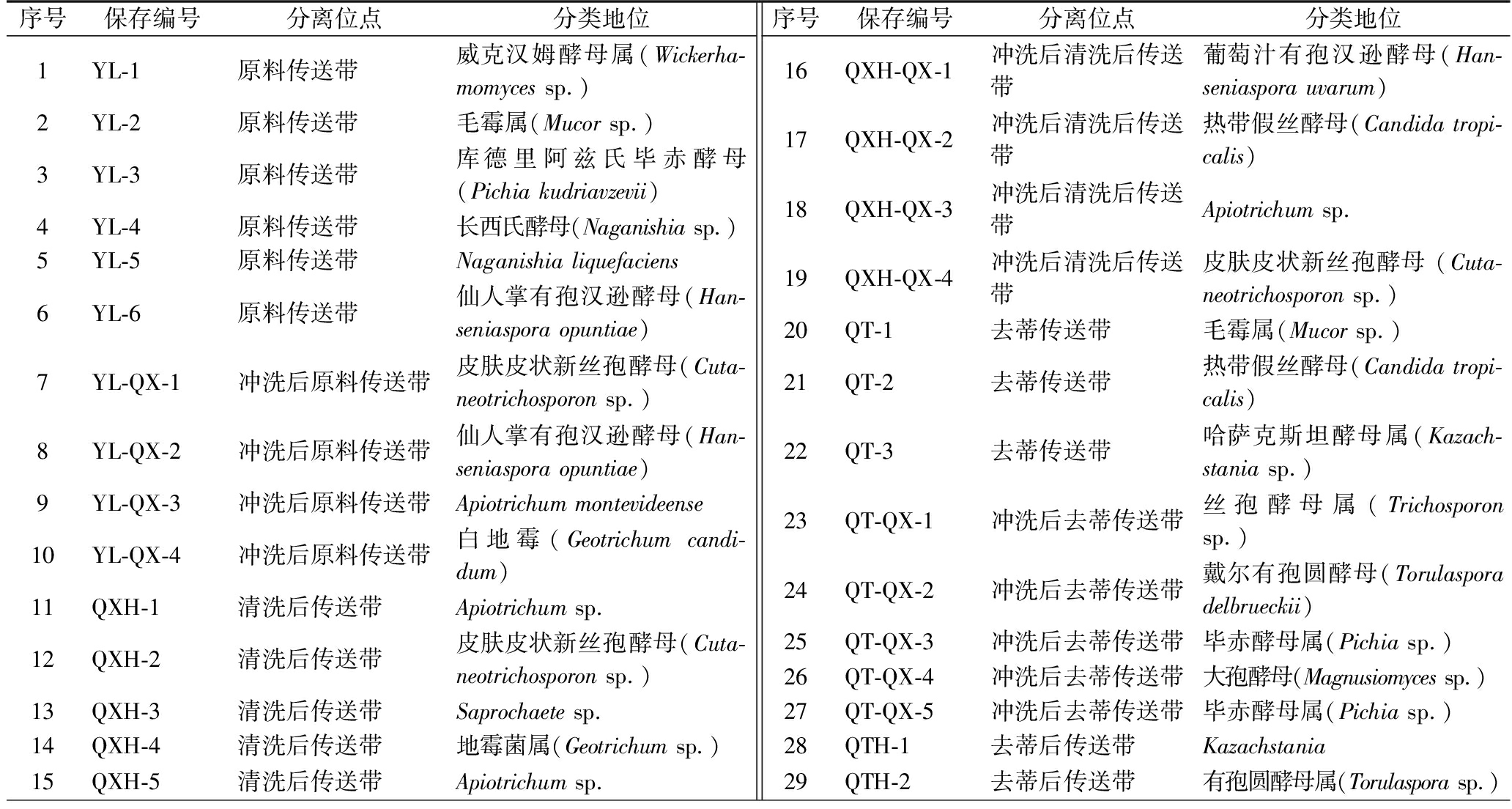
序号保存编号分离位点分类地位序号保存编号分离位点分类地位1YL-1原料传送带威克汉姆酵母属(Wickerha-momyces sp.)2YL-2原料传送带毛霉属(Mucor sp.)3YL-3原料传送带库德里阿兹氏毕赤酵母(Pichia kudriavzevii)4YL-4原料传送带长西氏酵母(Naganishia sp.)5YL-5原料传送带Naganishia liquefaciens6YL-6原料传送带仙人掌有孢汉逊酵母(Han-seniaspora opuntiae)7YL-QX-1冲洗后原料传送带皮肤皮状新丝孢酵母(Cuta-neotrichosporon sp.)8YL-QX-2冲洗后原料传送带仙人掌有孢汉逊酵母(Han-seniaspora opuntiae)9YL-QX-3冲洗后原料传送带Apiotrichum montevideense10YL-QX-4冲洗后原料传送带白地霉(Geotrichum candi-dum)11QXH-1清洗后传送带Apiotrichum sp.12QXH-2清洗后传送带皮肤皮状新丝孢酵母(Cuta-neotrichosporon sp.)13QXH-3清洗后传送带Saprochaete sp.14QXH-4清洗后传送带地霉菌属(Geotrichum sp.)15QXH-5清洗后传送带Apiotrichum sp.16QXH-QX-1冲洗后清洗后传送带葡萄汁有孢汉逊酵母(Han-seniaspora uvarum)17QXH-QX-2冲洗后清洗后传送带热带假丝酵母(Candida tropi-calis)18QXH-QX-3冲洗后清洗后传送带Apiotrichum sp.19QXH-QX-4冲洗后清洗后传送带皮肤皮状新丝孢酵母 (Cuta-neotrichosporon sp.)20QT-1去蒂传送带毛霉属(Mucor sp.)21QT-2去蒂传送带热带假丝酵母(Candida tropi-calis)22QT-3去蒂传送带哈萨克斯坦酵母属(Kazach-stania sp.)23QT-QX-1冲洗后去蒂传送带丝孢酵母属(Trichosporon sp.)24QT-QX-2冲洗后去蒂传送带戴尔有孢圆酵母(Torulaspora delbrueckii)25QT-QX-3冲洗后去蒂传送带毕赤酵母属(Pichia sp.)26QT-QX-4冲洗后去蒂传送带大孢酵母(Magnusiomyces sp.)27QT-QX-5冲洗后去蒂传送带毕赤酵母属(Pichia sp.)28QTH-1去蒂后传送带Kazachstania29QTH-2去蒂后传送带有孢圆酵母属(Torulaspora sp.)
续表1

序号保存编号分离位点分类地位序号保存编号分离位点分类地位30QTH-QX-1冲洗后去蒂后传送带热带假丝酵母(Candida tropicalis)31QTH-QX-2冲洗后去蒂后传送带Saprochaete sp.32QTH-QX-3冲洗后去蒂后传送带哈萨克斯坦酵母属(Kaz-achstania sp.)33QTH-QX-4冲洗后去蒂后传送带Kazachstania34QPH-1去皮后传送带热带假丝酵母(Candida tropicalis)35QPH-2去皮后传送带毕赤酵母属(Pichia sp.)36QPH-QX-2冲洗后去皮后传送带热带假丝酵母(Candida tropicalis)37QKQ-1切块前传送带热带假丝酵母(Candida tropicalis)38QKQ-2切块前传送带热带假丝酵母(Candida tropicalis)39QKQ-3切块前传送带酿酒酵母(Saccharomyces cerevisiae)40QKQ-QX-1冲洗后切块前传送带热带假丝酵母(Candida tropicalis)41QKQ-QX-2冲洗后切块前传送带酿酒酵母(Saccharomyces cerevisiae )42QKQ-QX-3冲洗后切块前传送带酿酒酵母(Saccharomyces cerevisiae )43QKQW-1切块前传送带外侧大孢酵母属 (Magnusio-myces sp.)44QKQW-2切块前传送带外侧热带假丝酵母(Candida tropicalis)45QKQW-3切块前传送带外侧热带假丝酵母(Candida tropicalis)46QKQW-4切块前传送带外侧热带假丝酵母(Candida tropicalis )47QKQW-5切块前传送带外侧Saprochaete sp.48QKQW-6切块前传送带外侧热带假丝酵母(Candida tropicalis)49QKQW-QX-1冲洗后切块前传送带外侧Saprochaete sp.50QKQW-QX-2冲洗后切块前传送带外侧热带假丝酵母(Candida tropicalis)51QKQW-QX-3冲洗后切块前传送带外侧酿酒酵母(Saccharomyces cerevisiae)52QKQW-QX-4冲洗后切块前传送带外侧Trichosporon coremiiforme53QXS-1清洗水毕赤酵母属(Pichia sp.)54QXS-2清洗水Meyerozyma sp.55QXS-3清洗水白地霉(Geotrichum candi-dum)56QXS-4清洗水地霉菌属(Geotrichum sp.)57QXS-5清洗水克鲁维毕赤酵母(Pichia kluyveri)58QKH-1切块后样品热带假丝酵母(Candida tropicalis)59QKH-2切块后样品热带假丝酵母(Candida tropicalis)60QKH-3切块后样品双足囊菌属 (Dipodascus sp.)61QKH-QX-1冲洗后切块后样品Trichosporon coremiiforme62QKH-QX-2冲洗后切块后样品热带假丝酵母(Candida tropicalis)63QKH-QX-4冲洗后切块后样品热带假丝酵母(Candida tropicalis)64TP-1烫皮西红柿Cystobasidium minutum65TP-2烫皮西红柿热带假丝酵母(Candida tropicalis)66TP-3烫皮西红柿热带假丝酵母(Candida tropicalis)67TP-6烫皮西红柿孢圆酵母(Torulaspora sp.)68LKYL-1裂口原料巨大线黑粉菌(Filobasidi-um magnum)69LKYL-2裂口原料毕赤酵母属(Pichia sp.)70LKYL-3裂口原料热带假丝酵母(Candida tropicalis)71LKYL-4裂口原料葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)72LKYL-6裂口原料仙人掌有孢汉逊酵母(Hanseniaspora opuntiae)
从不同采样位点来看,原料传送带(包括原料传送带和冲洗后原料传送带)位点分离到菌种种类较多,共有9种,主要包括有孢汉逊酵母;烫皮西红柿位点分离到菌种种类较少,共有3种,主要包括热带假丝酵母。推测由于原料传送带是该工艺第一步,番茄还未经过任何处理,自身携带的微生物较丰富,造成原料传送带分离到的微生物种类最多;由于烫皮西红柿采样位点是刚刚经过高温烫洗的西红柿,部分微生物被高温水冲走或杀死,造成该位点所分离的微生物种类最少。
比较热水冲洗前后真菌分离的情况发现,清洗后分离得到的真菌种类有所降低,冲洗前样品共分离得到44株真菌,主要集中在假丝酵母属,分布在去蒂传送带、去皮后传送带、切块前传送带、切块前传送带外侧和切块后样品等位置;而冲洗后样品共分离得到28株真菌,主要仍集中在假丝酵母属,主要分布在清洗后传送带、去蒂后传送带、去皮后传送带、切块前传送带和切块后样品等位置。
2.3 番茄罐头的生产过程中腐败真菌的溯源分析结果及控制
综合分析非培养和可培养的实验结果发现,热带假丝酵母是番茄罐头生产过程中的优势真菌,并且该菌种的检出率随着番茄罐头的持续生产而逐渐增加。由于热带假丝酵母是一种常见的条件致病菌,能够引起食品腐败变质,推测该菌种是引起番茄罐头腐败变质和胀罐的潜在腐败真菌。
2.3.1 热带假丝酵母的菌株分型结果
本研究以上述分离的20株热带假丝酵母为研究对象,利用S6作为随机引物进行RAPD扩增来进行热带假丝酵母的分型。琼脂糖凝胶电泳检测结果表明(图5),分离的20株热带假丝酵母可分为2种株型,分离于切块前传送带外侧样品的热带假丝酵母QKQW-2扩增的条带明显区别于其他菌株,单独为一种株型;其余19株热带假丝酵母扩增的条带一致,为同一株型,是引起番茄罐头腐败变质和胀罐的潜在腐败真菌。
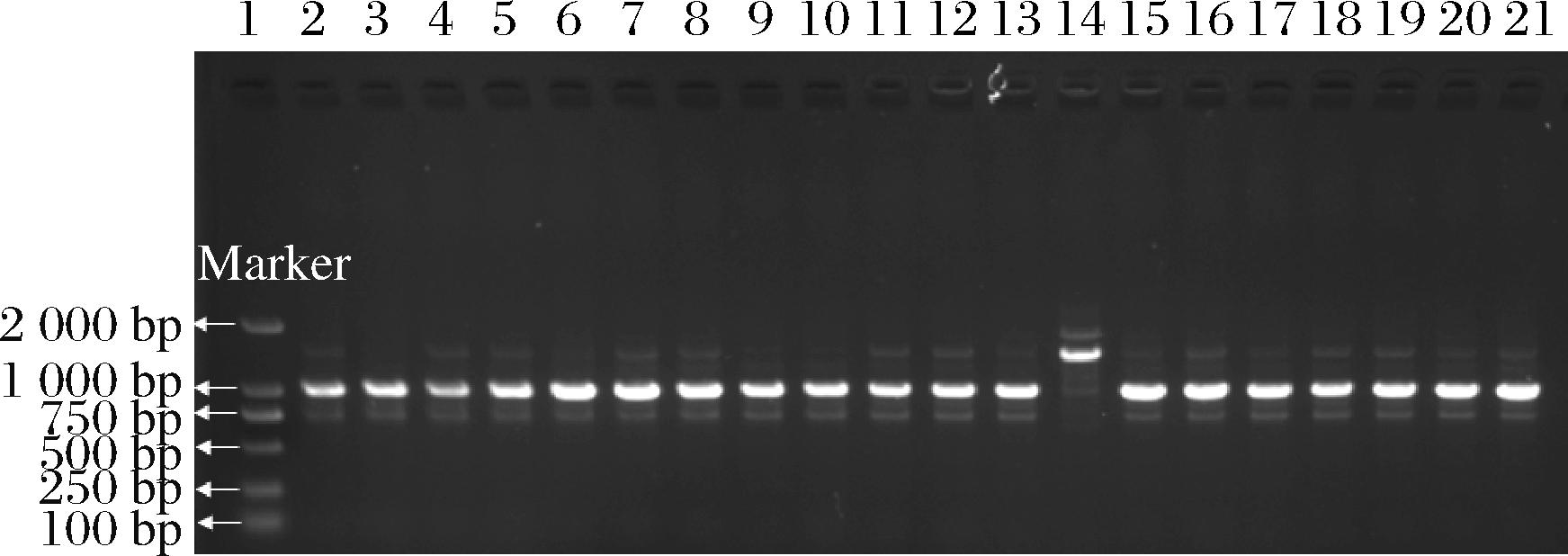
1,Marker;2, TP-2;3, QDH-QX-1;4, QKH-QX-2;5, QXH-QX-2;6, QD-2;7, QPH-1;8, LKYL-3;9, QPH-QX-2;10, QKQ-1;11, QKQ-2;12, QKQ-QX-1;13, QKQW-6;14, QKQW-2;15, QKQW-3;16, QKQW-4; 17, QKQW-QX-2;18, QXS-1;19, QKH-2;20, QKH-QX-4;21, TP-3。
图5 二十株热带假丝酵母RAPD分型结果
Fig.5 RAPD results of twenty C.tropicalis
2.3.2 热带假丝酵母回接实验结果
选取3株分离于不同生产阶段的同一型的热带假丝酵母接种于番茄种进行回接实验,通过与不接种的番茄比较产气产酸情况来确定该菌株是否是引起腐败变质和胀罐腐败真菌。如图6所示,接种热带假丝酵母的番茄在培养24 h已经开始出现产气现象,且样品开始变黄,而产酸情况不太明显;在培养48 h后产气最多,能够在广口瓶中观察到明显的大气泡,并且pH值平均下降0.19,其中样品1下降幅度最大,pH值下降了0.27;培养72 h后虽然产酸产气能力下降,但是仍然能观察到密集的小气泡且pH值依然有所下降,而不接种热带假丝酵母的番茄对照组一直未观察到产气泡的现象,pH值维持在4.20~4.30,未发现明显改变,这表明热带假丝酵母能够代谢番茄中的营养物质产生大量的气体和少量酸,是造成番茄罐头胀罐变质的腐败真菌。

a-培养24 h;b-培养48 h;c-培养72 h
图6 热带假丝酵母回接实验结果
Fig.6 Reinoculation experiment results of C.tropicalis
2.3.3 腐败真菌的生产控制实验结果
采用80 ℃热水对从原料传送到切丁装罐的所有传送带进行全面清洗。如表2所示,实验结果表明,清洗前原料传送带、清洗后传送带、去蒂传送带、去蒂后传送带、去皮后传送带和切块前传送带样品中的霉菌和酵母菌总数在2.0×105~7.2×106 CFU/mL,说明生产过程中存在着大量的真菌积累,冲洗后相应采样位置的霉菌和酵母菌总数均有下降,在4.8×104~1.1×105 CFU/mL,其中原料传送带冲洗前后霉菌和酵母菌总数下降最多,达到4.7 lg CFU/mL;冲洗后传送带洗前后霉菌和酵母菌总数下降最少,仅为0.6 lg CFU/mL。
表2 冲洗前后霉菌和酵母菌总数
Table 2 Total moulds and yeasts before and after cleaning

取样位置霉菌和酵母菌总数/(CFU/mL)冲洗前冲洗后lg(冲洗前-冲洗后)原料传送带5.5×1051.1×1014.7清洗后传送带2.0×1054.8×1040.6去蒂传送带7.3×1056.4×1032.1去蒂后传送带7.2×1064.4×1042.2去皮后传送带4.7×1066.7×1023.8切块前传送带3.1×1053.8×1022.9
3 讨论与结论
真菌群落结构变化结果表明,随着番茄罐头生产持续进行,采集的样品中的物种总数和多样性整体上呈现出下降的趋势,这表明生产过程中的微生物逐渐集中在优势真菌上。生产开始的7月份样品中真菌物种相对丰度超过10%的菌属主要包括丝孢酵母属和毕赤酵母属等在内的8个属,随着番茄罐头的持续生产,外界条件的不断变化以及优势微生物的不断积累,8月份和9月份样品真菌群落结构发生较大的改变,假丝酵母属菌种逐渐成为生产过程中优势真菌类群,在上述2个月收集的其丰度超过1%的样品占比分别为77%和82%,甚至在一些样品中其丰度超过了90%,因此,推测假丝酵母是潜在的优势腐败真菌,分布于整个生产过程中。可培养的结果也证明了这一点,在全部分离得到的19个属72株真菌中,热带假丝酵母共20株,占比27.8%,并且广泛的分布于裂口原料、清洗后传送带、去蒂传送带、去蒂后传送带、烫皮西红柿、去皮后传送带、切块前传送带、切块前传送带外侧和切块后样品等不同的生产阶段,且具有较高的丰度,进一步证明了热带假丝酵母是导致番茄罐头胀罐变质的潜在的优势腐败菌。热带假丝酵母常分离自乳制品、果蔬及土壤中,具有丰富的水解酶系,能够合成木糖还原酶和木糖醇脱氢酶,这2种酶的存在可以催化木糖生成乙醇[13-16];可以利用玉米芯和秸秆的水解液产生有价值的生物产品[17];该菌株还具有氧化烷烃的能力,因此是生产石油蛋白质的重要菌种[18-20]。并且该菌株具有两型性,是条件致病菌,当其为酵母形态时,对人体危害较小,但当其为菌丝状态时,可以通过侵害人体黏膜组织,导致人体患病,尤其是个体患有血液系统方面的恶性肿瘤或免疫功能低下时受到侵害,会造成较为严重的感染[21-24];目前对热带假丝酵母的研究主要集中在其能够用于制造生物制品和在临床上具有致病性的方面,对该菌株致腐能力的研究报道较少。为研究热带假丝酵母的致腐能力,本研究对该菌株进行了回接实验,结果表明,番茄样品中接种热带假丝酵母24 h后,观察到有明显的气泡,并伴随着产生少量酸;在接种48 h后产气量达到最大,产酸逐渐增加;接种72 h后虽然产酸产气能力下降,但是仍然能观察到密集的小气泡,不接种热带假丝酵母的番茄对照组一直未观察到产气泡的现象,pH值未观察到明显改变,这表明热带假丝酵母确实是造成番茄罐头胀罐变质的腐败真菌。张祁等[25]研究发现,在发酵乳生产过程中,对生产车间环境中的污染菌进行检测,发现鉴定结果酵母类污染菌主要包含热带假丝酵母和中间假丝酵母(Candida intermedia);对胀包产品的微生物种类进行分析,发现污染的酵母菌主要为中间假丝酵母和热带假丝酵母,证明热带假丝酵母是引起发酵乳胀包的酵母菌之一,与本研究热带假丝酵母是造成番茄罐头胀罐变质的腐败真菌的结果一致。而本研究的RAPD溯源分析结果表明,除传送带外侧样品的QKQW-2外,其余19株确定分离出的热带假丝酵母皆是同一株型,分布于裂口原料、清洗后传送带、去蒂传送带、去蒂后传送带、烫皮西红柿、去皮后传送带、切块前传送带、切块前传送带外侧和切块后等样品,这表明造成番茄罐头腐败变质的真菌广泛存在于整个生产过程中,增加了番茄罐头变质的风险。
综合分析番茄罐头不同生产时间和生产阶段的真菌的群落结构和关键物种的差异,优势菌种的分离筛选情况,优势真菌的回接验证以及RAPD溯源分析的结果,不仅确定了热带假丝酵母是引起番茄罐头腐败变质的主要真菌,而且发现腐败真菌主要来源于番茄罐头原料以及灭菌前与番茄原料直接接触的生产过程中的真菌生物量积累。而热水清洗程序实验结果表明,增加热水清洗程序能显著降低生产过程中的腐败真菌的积累,有助于全面提升番茄罐头的品质。
为了持续提升新疆番茄罐头的品质,加强生产过程中腐败微生物的控制,本研究建立了一套适合于番茄罐头生产过程中腐败微生物溯源分析的策略。综合运用高通量测序技术和纯培养分离技术,全面解析番茄罐头生产过程中真菌群落结构的变化,大规模的分离筛选生产过程中的优势真菌,探究潜在的关键真菌;通过优势真菌的回接实验和菌株分型分析,确定热带假丝酵母是番茄罐头生产加工过程中的关键腐败真菌,广泛存在于整个生产过程中。此外,本研究还优化了生产工艺,增加热水清洗程序,显著降低生产过程中的腐败真菌的积累,为番茄罐头生产过程中腐败微生物的控制和产品品质提升奠定基础。
[1] 程明才. 水果类罐头在生产中产品质量控制措施探讨[J].食品安全导刊, 2015(6):59-61.CHENG M C.Discussion on product quality control measures of canned fruits in production[J].China Food Safety Magazine, 2015(6):59-61.
[2] 侯慧波, 张春玲, 蒋永衡.新疆番茄酱的加工工艺及品质控制[J].农产品加工学刊, 2010(11):55-57.HOU H B, ZHANG C L, JIANG Y H.Processing technology and quality control of tomato paste in Xinjiang[J].Farm Products Processing, 2010(11):55-57.
[3] 王帅. 新疆加工番茄生长及加工过程污染霉菌的分类与鉴定[D].乌鲁木齐:新疆农业大学, 2011.WANG S.Classification and identification of contamination fungi from growth and processing of tomato[D].Urumqi:Xinjiang Agricultural University, 2011.
[4] 李静, 马自强, 柴岳, 等.新疆特色番茄制品深加工工艺技术研究[J].现代食品, 2023, 29(20):124-126.LI J, MA Z Q, CHAI Y, et al.Research on deep processing technology of Xinjiang characteristic tomato products[J].Modern Food, 2023, 29(20):124-126.
[5] 罗雪云, 刘宏道.食品卫生微生物检测标准手册[M].北京:中国标准出版社, 1995.LUO X Y, LIU H D.Handbook of Microbiological Testing Criteria for Food Hygiene[M].Beijing:Standards Press of China, 1995.
[6] 闫国宏, 傅力, 古丽娜孜.疑似胀袋番茄酱中几种微生物的检测研究[J].食品科技, 2007, 32(12):187-189.YAN G H, FU L, GU L.Study on examination of several species microbiology in doubtful swollen bag tomato paste[J].Food Science and Technology, 2007, 32(12):187-189.
[7] 杜红利, 刘畅.罐头制品中微生物检测方法[J].肉类工业, 2008(11):40-42.DU H L, LIU C.Detection method of microorganisms in canned products[J].Meat Industry, 2008(11):40-42.
[8] 王强. 玻璃瓶装番茄酱罐头杀菌条件的探讨[J].食品工业, 2010, 31(6):53-55.WANG Q.Study on sterilization conditions for canned tomato sauce in glass[J].The Food Industry, 2010, 31(6):53-55.
[9] 胡习祯, 杨玉新.微波杀菌技术在番茄制品中的应用[J].农产品加工, 2015(5):40-42.HU X Z, YANG Y X.The application of microwave sterilization in tomato products[J].Farm Products Processing, 2015(5):40-42.
[10] BJORKROTH K J, KORKEALA H J.Lactobacillus fructivorans spoilage of tomato ketchup[J].Journal of Food Protection, 1997, 60(5):505-509.
[11] EFIUVWEVWERE B J O, UWANOGHO G U.Effects of packaging materials following ethanol and benomyl treatments on chemical and microbiological changes in tomato (Lycopersicon esculentum) fruits[J].Journal of the Science of Food and Agriculture, 1990, 52(3):393-402.
[12] 黄玲, 黄忠梅, 吴海文.胀袋番茄酱中分离出季也蒙假丝酵母和丛生丝孢酵母[J].中国食品卫生杂志, 2006, 18(6):547-548.HUANG L, HUANG Z M, WU H W.Candida jejuni and Trichosporon fasciculata were separated from tomato paste in expanded bags[J].Chinese Journal of Food Hygiene, 2006, 18(6):547-548.
[13] 常江, 刘熙, 柳增善, 等.乳品中热带假丝酵母菌的双抗夹心ELISA快速检测方法[J].食品工业科技, 2016, 37(24):63-68.CHANG J, LIU X, LIU Z S, et al.A double-antibody sandwich ELISA for detection of Candida tropicalis in dairy product[J].Science and Technology of Food Industry, 2016, 37(24):63-68.
[14] 肖凯夫, 郭晟, 庞一林, 等.产碱性脂肪酶热带假丝酵母LYSC-3的筛选、鉴定及发酵条件的优化[J].食品工业科技, 2011, 32(3):218-220.XIAO K F, GUO S, PANG Y L, et al.Screening, identification of Candida tropicalis LYSC-3 excreting lipase and optimization of fermenting conditions[J].Science and Technology of Food Industry, 2011, 32(3):218-220.
[15] ZHANG C, QIN J F, DAI Y W, et al.Atmospheric and room temperature plasma (ARTP) mutagenesis enables xylitol over-production with yeast Candida tropicalis[J].Journal of Biotechnology, 2019, 296:7-13.
[16] TIZAZU B Z, ROY K, MOHOLKAR V S.Ultrasonic enhancement of xylitol production from sugarcane bagasse using immobilized Candida tropicalis MTCC 184[J].Bioresource Technology, 2018, 268:247-258.
[17] 金庭苇. 热带假丝酵母的固定化及其在秸秆基木糖醇发酵中应用的研究[D].长春:吉林农业大学, 2023.JIN T W.Immobilisation of Candida tropicalis and its application in straw based xylitol fermentation[D].Changchun:Jilin Agricultural University, 2023.
[18] HAHN-H GERDAL B, JEPPSSON H, SKOOG K, et al.Biochemistry and physiology of xylose fermentation by yeasts[J].Enzyme and Microbial Technology, 1994, 16(11):933-943.
GERDAL B, JEPPSSON H, SKOOG K, et al.Biochemistry and physiology of xylose fermentation by yeasts[J].Enzyme and Microbial Technology, 1994, 16(11):933-943.
[19] 黄炜. 玉米芯半纤维素水解液发酵生产木糖醇的研究[D].杭州:浙江大学, 2004.HUANG W.Study on the xylitol fermentation from corn cob hemicellulosic hydrolysate[D].Hangzhou:Zhejiang University, 2004.
[20] 金怡, 王震, 吕喆, 等.热带假丝酵母用未脱毒汽爆玉米秸秆产乙醇研究[J].太阳能学报, 2014, 35(5):899-903.JIN Y, WANG Z, LYU Z, et al.Ethanol production from undetoxified steam-exploded corn stover using Candida tropicalis[J].Acta Energiae Solaris Sinica, 2014, 35(5):899-903.
[21] DE ALBUQUERQUE T L, DA SILVA I J, DE MACEDO G R, et al.Biotechnological production of xylitol from lignocellulosic wastes:A review[J].Process Biochemistry, 2014, 49(11):1779-1789.
[22] 傅帅, 马明博, 倪润滋, 等.牛瘤胃产蛋氨酸热带假丝酵母菌的分离鉴定及发酵条件优化[J].饲料研究, 2022, 45(3):73-79.FU S, MA M B, NI R Z, et al.Isolation and identification of Candida tropical producing methionine from bovine rumen and optimization of fermentation conditions[J].Feed Research, 2022, 45(3):73-79.
[23] 罗云, 王瑜敏, 罗盛.热带假丝酵母菌感染临床检验调查[J].浙江临床医学, 2018(2):336-338.LUO Y, WANG Y M, LUO S.Clinical investigation of Candida tropicalis infection[J].Zhejiang Clinical Medical Journal, 2018(2):336-338.
[24] 镇雪莹, 张爱荣, 娄峻.假丝酵母性血流感染患者的病原学特点与发生病亡的危险因素分析[J].抗感染药学, 2022, 19(7):970-973.ZHEN X Y, ZHANG A R, LOU J.Etiological characteristics and risk factors of death in patients with Candida bloodstream infection[J].Anti-Infection Pharmacy, 2022, 19(7):970-973.
[25] 张祁, 裴晓燕, 黄小平.发酵乳霉菌酵母污染和控制的研究进展[J].食品安全质量检测学报, 2019, 10(5):1133-1137.ZHANG Q, PEI X Y, HUANG X P.Research progress of contamination and control of moulds and yeasts in fermented milk[J].Journal of Food Safety &Quality, 2019, 10(5):1133-1137.