黑茶,也称后发酵茶,是我国六大茶类中最具特色的茶叶产品。其加工过程包含杀青、揉捻、渥堆与干燥等工艺环节。渥堆工艺独具特色,对黑茶色、香、味的形成具有决定性作用[1-2]。
在传统黑茶的生产过程中,所使用的成熟原料往往存在氟含量较高的现象,这一问题引发了饮用安全方面的担忧,对黑茶产业的持续发展构成不利影响[3]。氟元素在人体中扮演着不可或缺的角色,适量摄入氟元素对人体的健康具有正面影响[4],如氟可通过与骨骼、牙釉质中的羟磷灰石进行离子替代,生成更稳定的氟化磷灰石,显著增强骨骼强度和预防龋齿[5]。然而氟摄入过量易致氟中毒[6],其毒副作用不容忽视[7]。申秀英等[8]的研究认为氟摄入过量会直接影响人体中枢系统,对人类智力和脑功能发育产生较严重的负面影响。此外,氟元素对人体健康构成的威胁不仅限于神经系统,还会影响骨骼系统和呼吸、消化系统的正常功能,进而引发心血管问题等全身性健康风险。在氟中毒所致疾病中,只有氟斑牙是唯一可通过水源更替(如更换饮用水源)得到一定程度缓解的病症,而其他相关疾病则因其复杂性而难以通过常规治疗手段完全恢复[9]。因此为预防氟给人体带来的危害,需要从各个角度(如茶叶饮用等)严格控制人体对氟的摄入。
在黑茶的渥堆制备过程中,微生物扮演着至关重要的角色,它们对黑茶品质的形成起着关键性的作用[10]。微生物群分泌出多种胞外酶,通过酶促反应,对多种有机物质进行水解转化,从而赋予黑茶独特的风味特征[11]。张亚等[10]认为黑茶渥堆的本质在于微生物的大量生长繁殖及其产生的湿热作用和酶促作用带来茶叶品质成分的转化。渥堆分渥堆前期、初期、中期和后期,在此过程中微生物数量发生有规律的变化,渥堆初期细菌数量快速增加,堆温上升;渥堆中期和后期,堆温继续上升,真菌数量大量增加,细菌数量受抑制出现减少趋势[12]。温琼英等[13]的研究揭示了在黑茶渥堆过程中,假丝酵母、黑曲霉等优势微生物通过分泌蛋白酶、多酚氧化酶等多种酶系,影响茶叶中各种化学组分的转化、形成。课题组前期的研究也表明,黑茶渥堆过程中微生物的生长确实能显著影响茶叶的主要品质成分的改变,但对氟元素在茶叶中的总含量影响甚微,至于黑茶渥堆过程微生物的生长是否影响氟的存在形态变化及氟的存在形态变化与微生物种群变化间的相关性有待进一步的研究。
本研究在分析黑茶渥堆过程氟的存在形态变化的同时,运用高通量测序技术揭示黑茶渥堆不同阶段真菌与细菌的群落多样性,采用相关性分析手段,探讨黑茶不同渥堆阶段微生物种群变化与氟存在形态变化的相关性,为黑茶渥堆科学利用微生物优化氟的存在形态提供理论依据。
1 材料与方法
1.1 材料与试剂
本实验茶叶由湖北洞庄茶叶有限责任公司提供;葡萄糖标准品(纯度98%),上海麦克林生化科技股份有限公司;醋酸钠、盐酸羟胺、硝酸、醋酸铵、NaOH、HCl、NaHCO3,国药集团化学试剂有限公司;蛋白胨、牛肉膏(生物试剂),北京奥博星生物技术有限责任公司;琼脂,中国Biosharp公司;孟加拉红培养基,青岛高科园海博生物技术有限公司。
1.2 仪器与设备
氟离子选择电极,上海仪电科学仪器股份有限公司;磁力搅拌器,常州国华电器有限公司;AB204-S电子天平(精度为0.000 1 g),上海双旭电子有限公司;BT20R台式高速冷冻离心机,湖南柏威科学仪器有限公司;HSY-26D电热恒温水浴锅,上海跃进医疗器械有限公司;CHA-S气浴恒温振荡器,常州金坛良友仪器公司;DHG-903385电热恒温鼓风干燥机、SPX-80B5H-II生化培养箱,上海新苗医疗器械制造有限公司;SW-CJ-2FD超净工作台,苏州安泰空气技术有限公司。
1.3 实验方法
1.3.1 样品采集
以一芽五叶至一芽六叶晒青毛茶为渥堆原料,经过洒水处理后,置于室内环境进行自然渥堆发酵,渥堆时间为49 d。采取渥堆初始原料为对照,编号为W-0,渥堆过程中每周取样1次,编号分别为W-1~W-7。7周渥堆后进行陈化处理,陈化1月后取样编号为C-1。
1.3.2 氟含量的测定
茶样总氟含量测定参考朱晓静[14]的碱熔法。
各形态氟的提取与含量的测定参照朱晓静[14]的方法。
1.3.3 微生物培养与计数
参照GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》测定微生物菌落总数,将茶样浸泡液稀释至10-4、10-5后分别涂布平板(细菌采用牛肉膏蛋白胨培养基,37 ℃倒置培养;真菌用孟加拉红培养基,28 ℃正置培养),每组设置3个重复,待长出菌落后开始计数。
1.3.4 不同渥堆黑茶样品高通量测序分析
利用DNeasy Power Soil Kit 试剂盒提取茶样中细菌总DNA。以标准细菌16S V3V4(a)作为引物;前引物序列为:ACTCCTACGGGAGGCAGCA;后引物序列为:GGACTACHVGGGTWTCTAAT[15]。对总DNA进行PCR扩增,扩增体系(25 μL):5×反应缓冲液和5×保真GC缓冲液各5 μL、2.5 mmol/L dNTP 2 μL、前后引物(10 μmol/L)各1 μL、DNA模板2 μL、ddH2O 8.75 μL、Q5超保真DNA聚合酶0.25 μL。扩增参数:98 ℃预变性2 min,98 ℃变性15 s,55 ℃退火30 s,72 ℃延伸30 s,最后72 ℃延伸5 min,10 ℃下保持30个循环。PCR扩增产物经2%(质量分数)琼脂糖凝胶电泳检测后进行测序,测序平台为Novaseq-PE250(美国Illumina公司)。
根据真菌内转录间隔区(internal transcribed spacer,ITS)序列特征,根据常用ITS测序鉴定引物确定前端引物:5′-CTTGGTCATTTAGAGGAAGTAA-3′、后端引物:5′-GCTGCGTTCTTCATCGATGC-3′[16]。PCR扩增程序:98 ℃预变性2 min;98 ℃变性30 s,50 ℃退火30 s,72 ℃延伸60 s,30个循环,72 ℃稳定延伸5 min。最后将经琼脂糖凝胶电泳检测得到的PCR产物进行高通量测序,测序平台为Novaseq-PE250(美国Illumina公司)。
1.4 统计分析
理化成分和微生物数量利用Excel 2016和用Origin 2021作图,测序数据用QIIME计算Alpha多样性分析(包括Simpson指数、Shannon指数和Observed species),以表征细菌、真菌群落结构的丰富度和多样性。通过Origin软件对氟存在形态变化与微生物种群数量变化之间的Spearman相关性进行分析。
2 结果与分析
2.1 黑茶渥堆过程中不同形态氟的含量分析
如表1所示,总体来看,渥堆茶样中水溶性氟>有机束缚态氟>可交换性氟>铁锰结合氟>残渣态氟。水溶性氟含量在W-2时达到最高值,为44.65 mg/kg,在达到最高值后出现下降,然后上升又下降,在陈化后达到最低值。可交换性氟含量的最高值出现在渥堆起点,随后整体出现下降的趋势,同样也是在陈化后达到最低值。铁锰结合氟在渥堆过程中整体呈现上升的趋势,没有在陈化后达到最低值,在W-2达到最低值,为3.42 mg/kg,在渥堆前期氟含量偏低,渥堆时间到中期和后期,氟含量显著上升,在W-5达到最高值,为7.96 mg/kg。有机束缚态氟在渥堆起点就达到最高值,为15.21 mg/kg,在W-2下降到最低值9.32 mg/kg,在W-3开始上升,之后出现下降,在渥堆结束后上升幅度大,陈化后又略微下降。残渣态氟是所有氟形态中含量最低的,残渣态氟在W-3达到最高值,为2.18 mg/kg,之后出现下降在W-7降到最低值,为0.35 mg/kg。总氟含量在W-2达到最大值为66.17 mg/kg,在W-7达到最低值,为57.01 mg/kg,整个渥堆过程中呈现波动的升降趋势。
表1 黑茶渥堆过程中不同形态氟含量的变化 单位:mg/kg
Table1 Changes of fluorine content in various forms during the pile-fermentation of dark tea
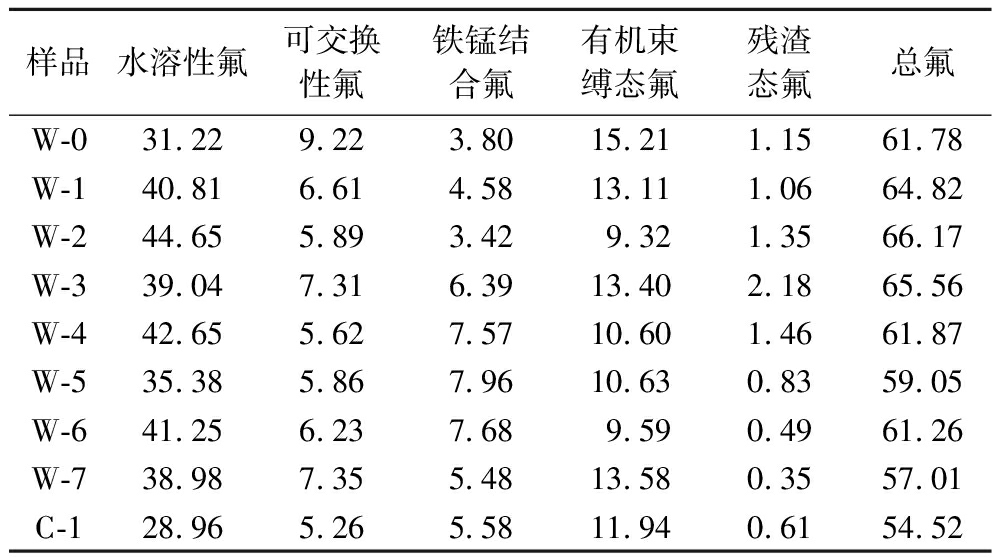
样品水溶性氟可交换性氟铁锰结合氟有机束缚态氟残渣态氟总氟W-031.229.223.8015.211.1561.78W-140.816.614.5813.111.0664.82W-244.655.893.429.321.3566.17W-339.047.316.3913.402.1865.56W-442.655.627.5710.601.4661.87W-535.385.867.9610.630.8359.05W-641.256.237.689.590.4961.26W-738.987.355.4813.580.3557.01C-128.965.265.5811.940.6154.52
2.2 黑茶渥堆过程中微生物多样性分析
2.2.1 黑茶渥堆过程中真菌和细菌数量相关性分析
在渥堆的发酵过程中,真菌的数量呈现一种显著的增长态势(图1)。具体而言,在W-4阶段,真菌的数量减少到一个较低水平,具体数值为0.42×108 CFU/g。随后,在W-7阶段,真菌数量急剧增加,达到了最高值,即7.57×108 CFU/g。然而,在渥堆过程结束并进入陈化阶段C-1时,真菌的数量则呈现出下降趋势。
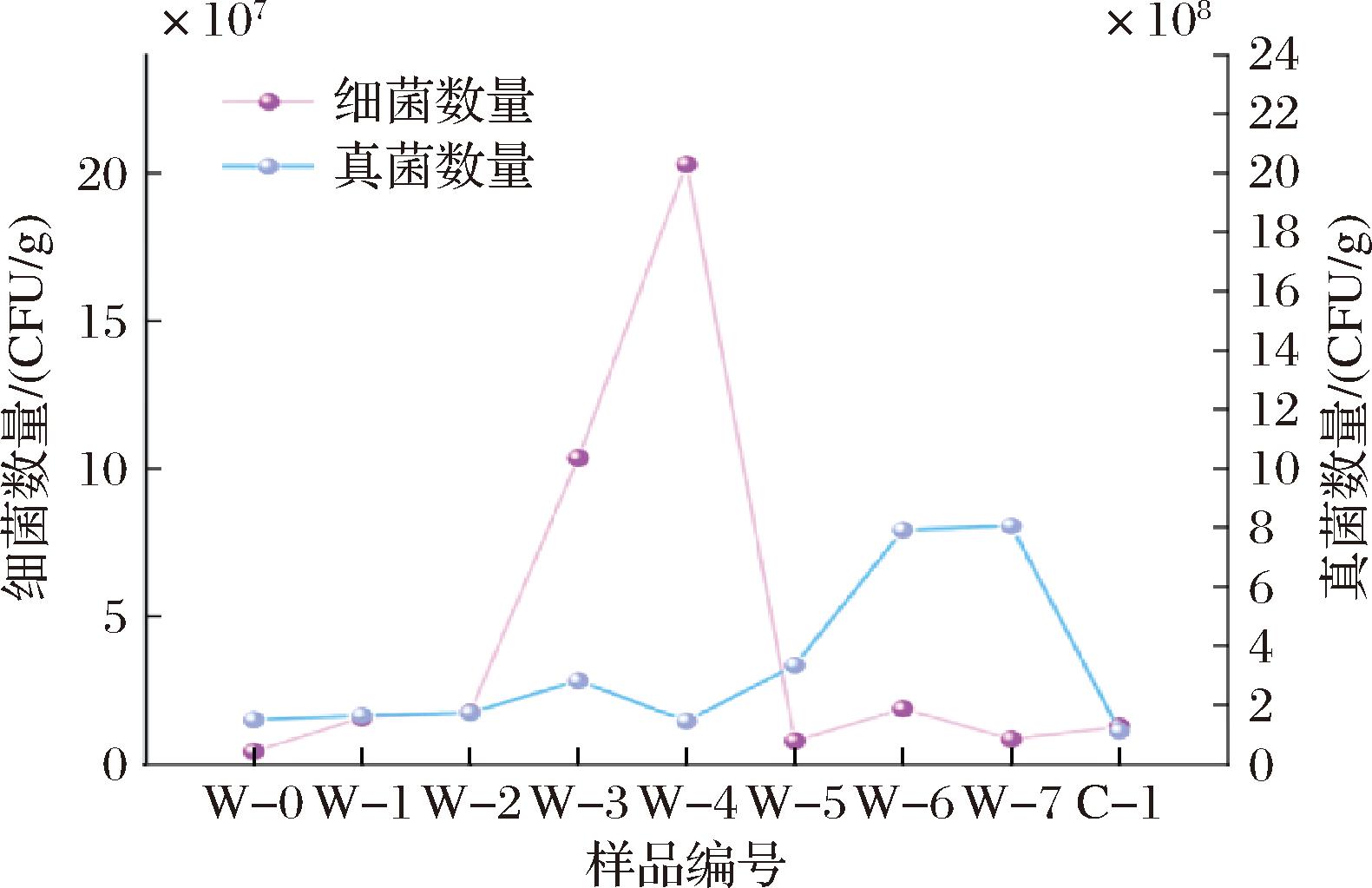
图1 黑茶渥堆过程中微生物数量变化
Fig.1 Changes of microbial population during the pile-fermentation of dark tea
细菌数量(图1)在W-0~W-2,细菌数量增长迟缓。然而,当到达W-3时,细菌数量急剧上升。在W-4时,细菌数量达到峰值,即2.03×109 CFU/g。此后,在W-5时刻,细菌数量迅速减少。在随后的渥堆过程中,细菌数量持续下降。
在整个渥堆过程中,真菌数量在前中期变化不明显,主要在后期增长,细菌数量在中期增长,在后期降低。在渥堆的起始阶段,由于实施了洒水措施,渥堆温度的增速受到了明显的抑制,导致从W-1到W-2的阶段内,微生物的生长态势和数量变化均不显著。然而,随着渥堆进入中期,微生物的活跃度显著提升,推动了渥堆温度的稳步上升,这一变化又反过来刺激了微生物的代谢活力,最终导致细菌的数量逐步增多[17]。细菌和真菌的数量在渥堆过程中存在此消彼长的规律[15]。
2.2.2 黑茶渥堆过程中真菌和细菌α-多样性分析
α-多样性是指在特定区域反映物种丰富度、多样性和均匀度的指标。Observed species用来衡量物种丰富度,Shannon和Simpson用来衡量物种多样性。Observed species指数越大,说明群落的丰富度越高,Shannon和Simpson指数越大,说明群落的多样性越高。真菌多样性指数分析见表2,茶样中,Observed species、Shannon和Simpson指数均在渥堆最开始就处于最高水平,后续渥堆过程中一直降低,说明真菌数量在渥堆最开始活性最高,随着渥堆的时间,逐渐丧失了活性,但在W-4和C-1时,Observed species、Shannon和Simpson指数升高,说明在渥堆中期和陈化后,真菌再次活跃起来。
表2 真菌α-多样性指数分析
Table 2 Analysis of fungal α-diversity indices
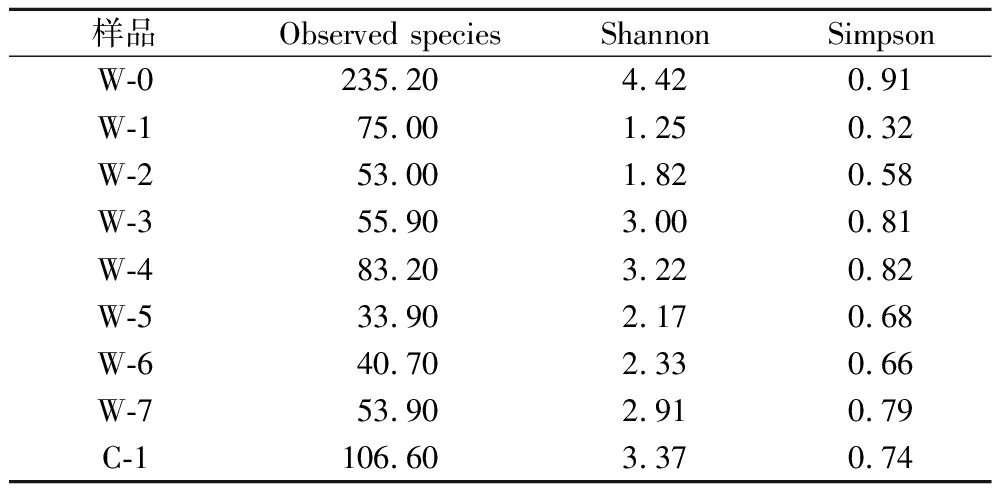
样品Observed speciesShannonSimpsonW-0235.20 4.42 0.91 W-175.00 1.25 0.32 W-253.00 1.82 0.58 W-355.90 3.00 0.81 W-483.20 3.22 0.82 W-533.90 2.17 0.68 W-640.70 2.33 0.66 W-753.90 2.91 0.79 C-1106.60 3.37 0.74
细菌多样性指数分析见表3,与真菌Observed species指数对比,细菌的Observed species指数是远高于真菌的。在渥堆过程中,细菌的Observed species指数呈现动态波动。具体而言,在W-4阶段,Observed species、Shannon以及Simpson指数均攀升至峰值,这一结果表明此时细菌的多样性和丰富性达到了最高点。然而,自W-5阶段起,这些指数均开始呈现下降趋势,这一现象暗示着随着渥堆过程的深入,细菌的活性逐渐减弱,数量上的优势逐渐丧失。
表3 细菌α-多样性指数分析
Table 3 Analysis of bacterial α-diversity indices
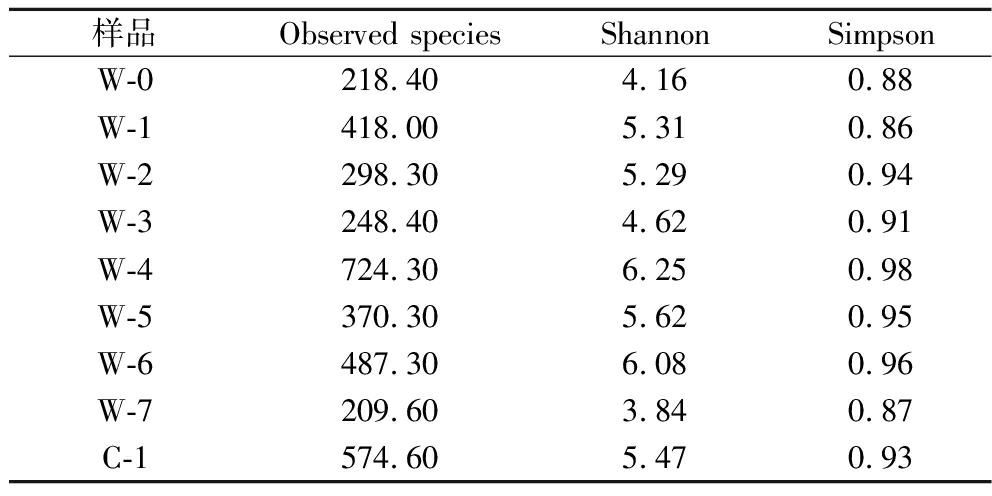
样品Observed speciesShannonSimpsonW-0218.40 4.16 0.88 W-1418.00 5.31 0.86 W-2298.30 5.29 0.94 W-3248.40 4.62 0.91 W-4724.30 6.25 0.98 W-5370.30 5.62 0.95 W-6487.30 6.08 0.96 W-7209.60 3.84 0.87 C-1574.60 5.47 0.93
2.2.3 黑茶渥堆过程中真菌和细菌β-多样性分析
按照97%相似性非重复序列进行操作分类单元(operational taxonomic unit,OTU)聚类,绘制Venn图。Venn图能够有效地揭示多组或多个样本之间OTU的共有和独特分布情况,为统计分析提供直观依据。如图2所示,不同渥堆阶段茶样中的真菌群落OTU数目分别是180、31、20、12、21、4、10、12、56,共有OTU为7个,表明真菌群落的OTU数目在渥堆起点达到最大值之后,在W-1迅速降低,随后一直处于降低的范围中,在C-1时又略微升高,但没有W-0时高,说明茶叶渥堆过程中真菌种类在渥堆起点多样性高。
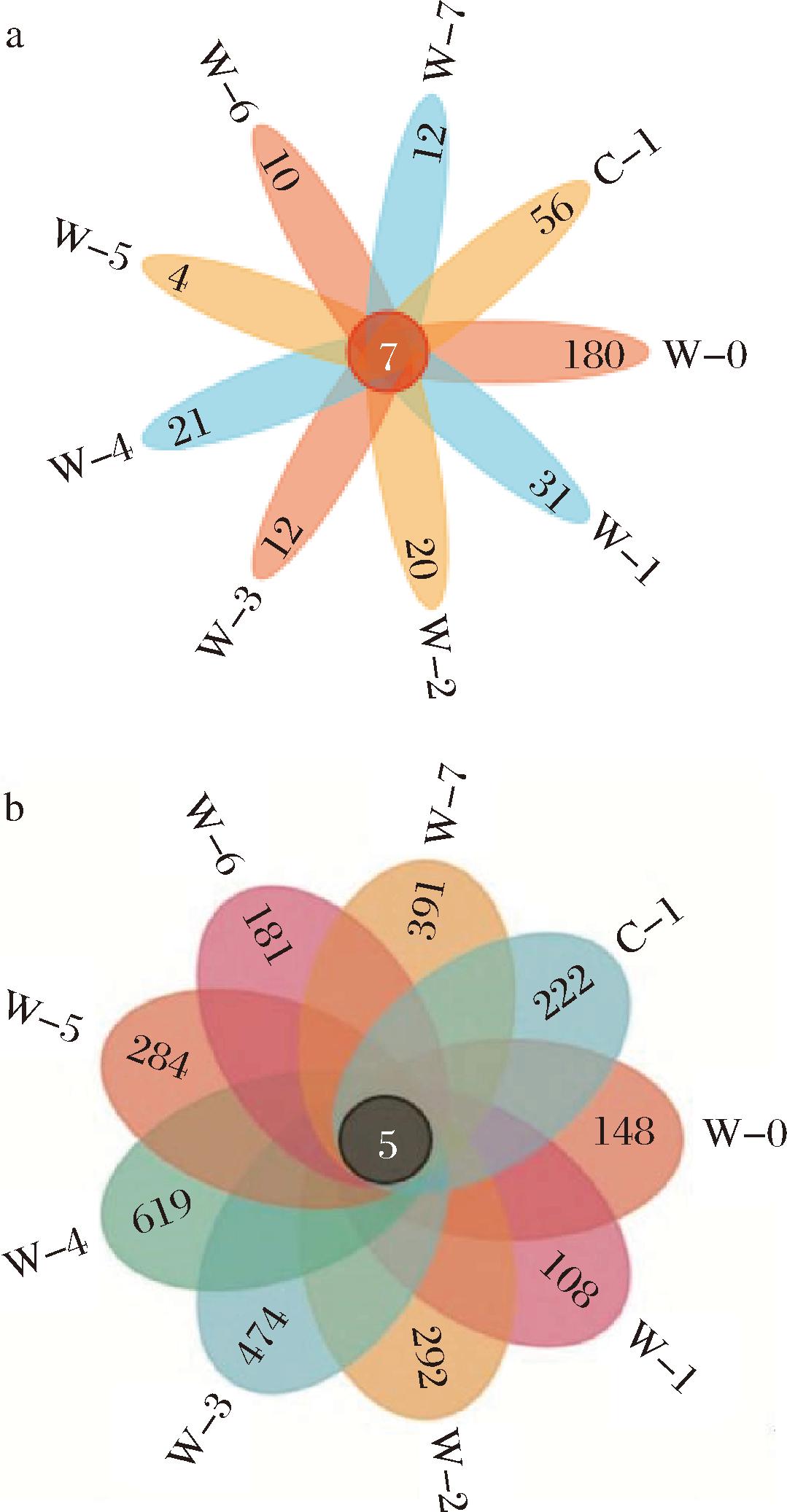
a-真菌;b-细菌
图2 黑茶渥堆过程中微生物群落OTU分布Venn图
Fig.2 Venn diagram of OTU distribution of microbial communities during the pile-fermentation of dark tea
不同渥堆阶段茶样的细菌群落OTU数目(图2-b)分别是148、108、292、474、619、284、181、391、222,共有OTU为5个,与真菌群落OTU数目相比,细菌群落OTU数目要丰富很多。细菌群落的OTU数目先减少,随后又增加在W-4时达到最高,之后在W-5急剧下降,说明黑茶渥堆过程中细菌种类比较波动,在渥堆中期数量最多。
2.2.4 黑茶渥堆过程真菌种群多样性
根据分类学分析结果,绘制群落组成柱状图,可以得知不同渥堆时间的黑茶在各分类水平上的物种组成情况,包括优势物种信息和各优势物种的相对丰度。
除掉未分类的真菌外,如图3-a所示,黑茶渥堆过程中的茶样共检测出4个真菌门,分别为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、毛霉菌门(Mucoromycota)、被孢霉门(Mortierellomycota),绝对优势门为Ascomycota,它贯穿发酵中的每个时间段,相对丰度为78.29%~99.99%,这与邓俊琳等[18]对藏茶发酵过程中真菌群落结构一致,其他门在黑茶渥堆过程中的相对丰度微乎其微。

a-门水平;b-属水平
图3 黑茶渥堆过程中真菌群落结构多样性
Fig.3 Diversities of fungal community structure during the pile-fermentation of dark tea
在属水平上,黑茶渥堆过程中真菌群落结构图如图3-b所示。优势菌属为曲霉菌(Aspergillus),其贯穿渥堆始终,相对丰度为1.90%~66.26%,在C-1时达到最大值,在W-5降到最低值。在W-0阶段,优势菌属为未分类菌属;在W-1阶段,罗萨氏菌属(Rasamsonia)为优势菌属,相对丰度为83.12%,随后在W-2急剧降低;在W-2阶段,嗜热属(Thermomyces)为优势菌属,相对丰度为61.08%;在W-3和W-4阶段,Aspergillus为优势菌属,相对丰度为30.45%和43.09%,随后在W-7和C-1阶段上升,为那2个时期的优势菌属,相对丰度分别为61.80%和66.26%;在W-5和W-6阶段,毕赤酵母属(Pichia)为这2个时期的优势菌属,相对丰度分别为62.01%和75.91%,之后急剧下降。
为了深入剖析渥堆过程中不同茶样间物种组成的差异,基于属水平前20位物种的平均丰度数据绘制了热图。如图4所示,茶样W-0显示出最低的物种数量,而茶样W-6则呈现出最多的物种数量,为其余的由高到低依次是W-5、W-3、W-4、W-2、W-1、C-1、W-7。由图4可知,Aspergillus为渥堆前期的优势菌属,Rasamsonia、Thermomyces、丝衣霉属(Byssochlamys)、Pichia等为渥堆中期的优势菌属,Aspergillus为渥堆后期的优势菌属,再次说明Aspergillus为黑茶渥堆过程中的绝对优势菌属,这与白亚妮等[19]对茯茶加工过程真菌群落结构分析相对一致。
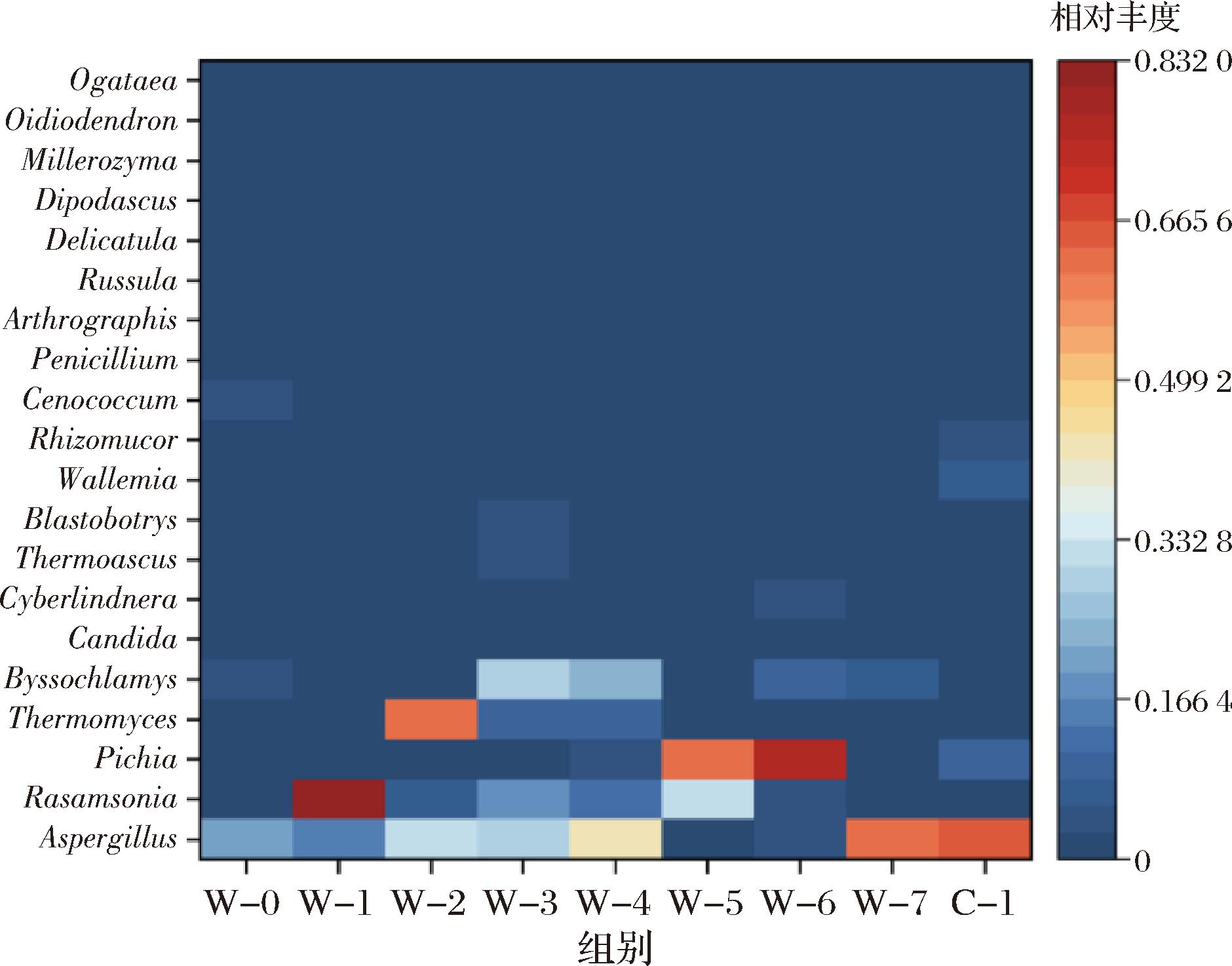
图4 黑茶渥堆过程中真菌种群组成热图(属水平)
Fig.4 Heat map of fungal population composition during the pile-fermentation of dark tea (at genus level)
2.2.5 黑茶渥堆过程中细菌多样性
除未分类的细菌外,如图5-a所示,黑茶渥堆过程中的茶样共检测出10个细菌门。绝对优势门为变形菌门(Proteobacteria),相对丰度为16.87%~90.99%。厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)在茶叶渥堆过程的占比也比较大,分别为1.68%~58.69%、1.04%~49.54,这与周金萍[20]在布朗酸茶发酵过程中细菌群落结构一致。在W-2阶段,蓝细菌门(Cyanobacteria)的相对丰度为42.86%,而在其他阶段的相对丰度几乎为0,与之相似的还有拟杆菌门(Bacteroidetes),在W-4阶段的相对丰度为20.69%,在其他阶段的相对丰度也几乎为0,说明这2种菌门在渥堆中期占主导作用。
a-门水平;b-属水平
图5 黑茶渥堆过程中细菌群落多样性
Fig.5 Diversity of bacterial communities during the pile-fermentation of dark tea
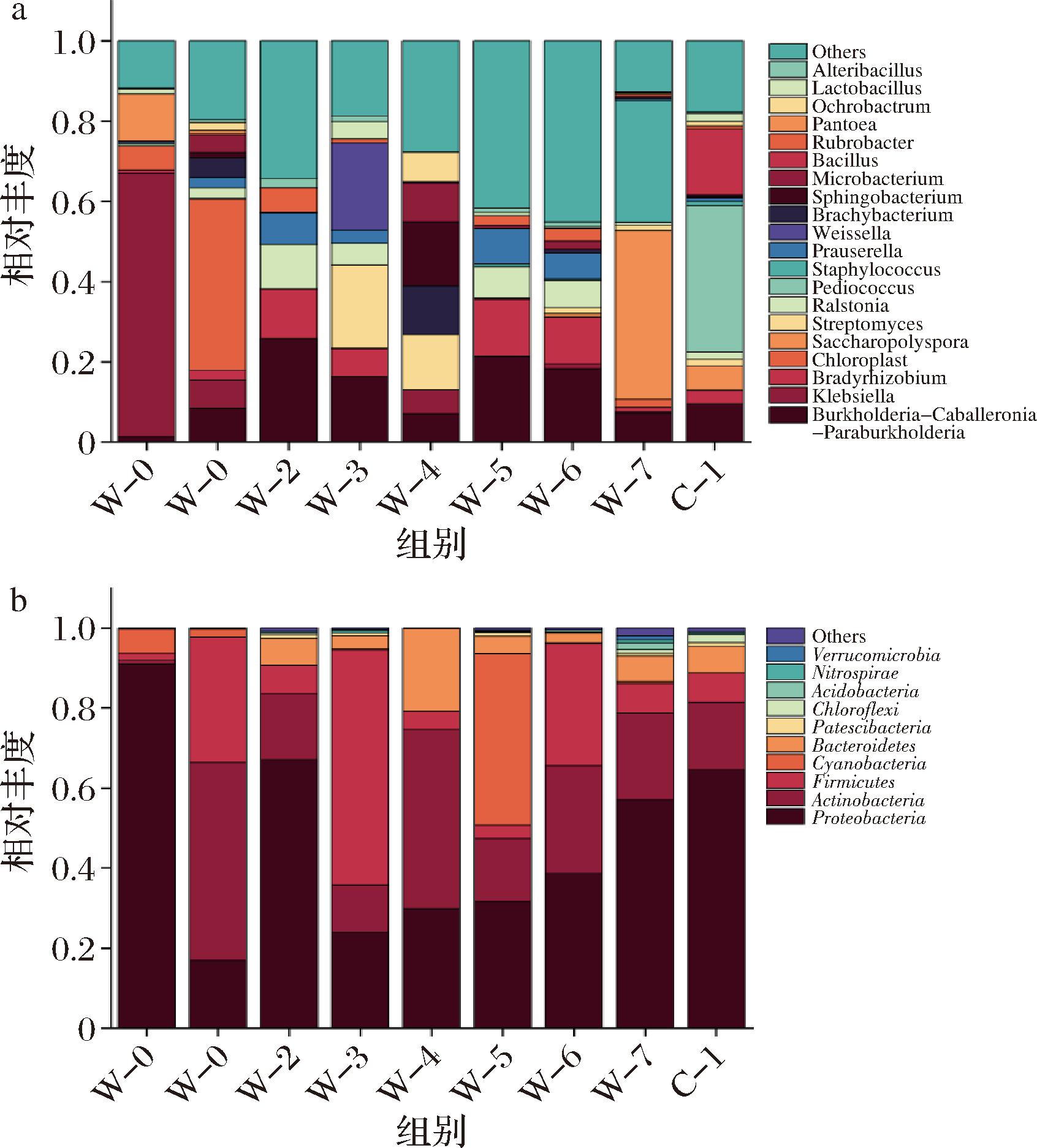
在属水平上,黑茶渥堆过程中细菌群落结构图如图5-b所示。卡氏伯克霍尔德菌属(Burkholderia-Caballeronia-Paraburkholderia)是贯穿渥堆始终的优势属,其相对丰度为1.25%~25.81%。在W-0阶段,Klebsiella为渥堆前期的优势属,其相对丰度为65.86%,在此阶段之后急剧下降;在W-1阶段,叶绿体属(Chloroplast)为优势属,相对丰度为42.70%,随后几乎不参与整个渥堆过程中;在W-2阶段,Burkholderia-Caballeronia-Paraburkholderia为优势属,其相对丰度为25.81%,是其相对丰度最高的阶段;在W-3阶段链霉菌属(Streptomyces)、魏斯氏菌属(Weissella)占优势,相对丰度分别为20.74%和21.72%;在W-4阶段,鞘氨醇杆菌属(Sphingobacterium)占优势,相对丰度为15.99%;在W-5阶段,慢生型根瘤菌属(Bradyrhizobium)和普氏菌属(Prauserella)占有较高的比例,相对丰度为14.12%和8.90%;在W-6阶段,Bradyrhizobium为优势属,相对丰度为11.67%;在W-7阶段,糖多孢菌属(Saccharopolyspora)和葡萄球菌属(Staphylococcus)占有较高的比例,相对丰度为42.10%和30.35%;在C-1阶段,片球菌属(Pediococcus)为优势属,为这一时期的独有优势菌属,相对丰度为36.46%。
通过筛选相对丰度前20的菌属,构建热图来直观展示不同菌属的分布情况。从图6中可以明显观察到,W-5和W-6样本中的物种数量相对较少,而W-0样本则表现出最多的物种数量,其余由高到低分别是W-7、C-1、W-3、W-4、W-1、W-2。渥堆前期的优势属为克雷伯氏菌属(Klebsiella)、泛菌属(Pantoea),渥堆中后期的优势属为Chloroplast、Burkholderia-Caballeronia-Paraburkholderia、Streptomyces、Pediococcus、Staphylococcus、Saccharopolyspora、芽孢杆菌属(Bacillus)等,这与前人[21-22]的研究结果有一定相似性。
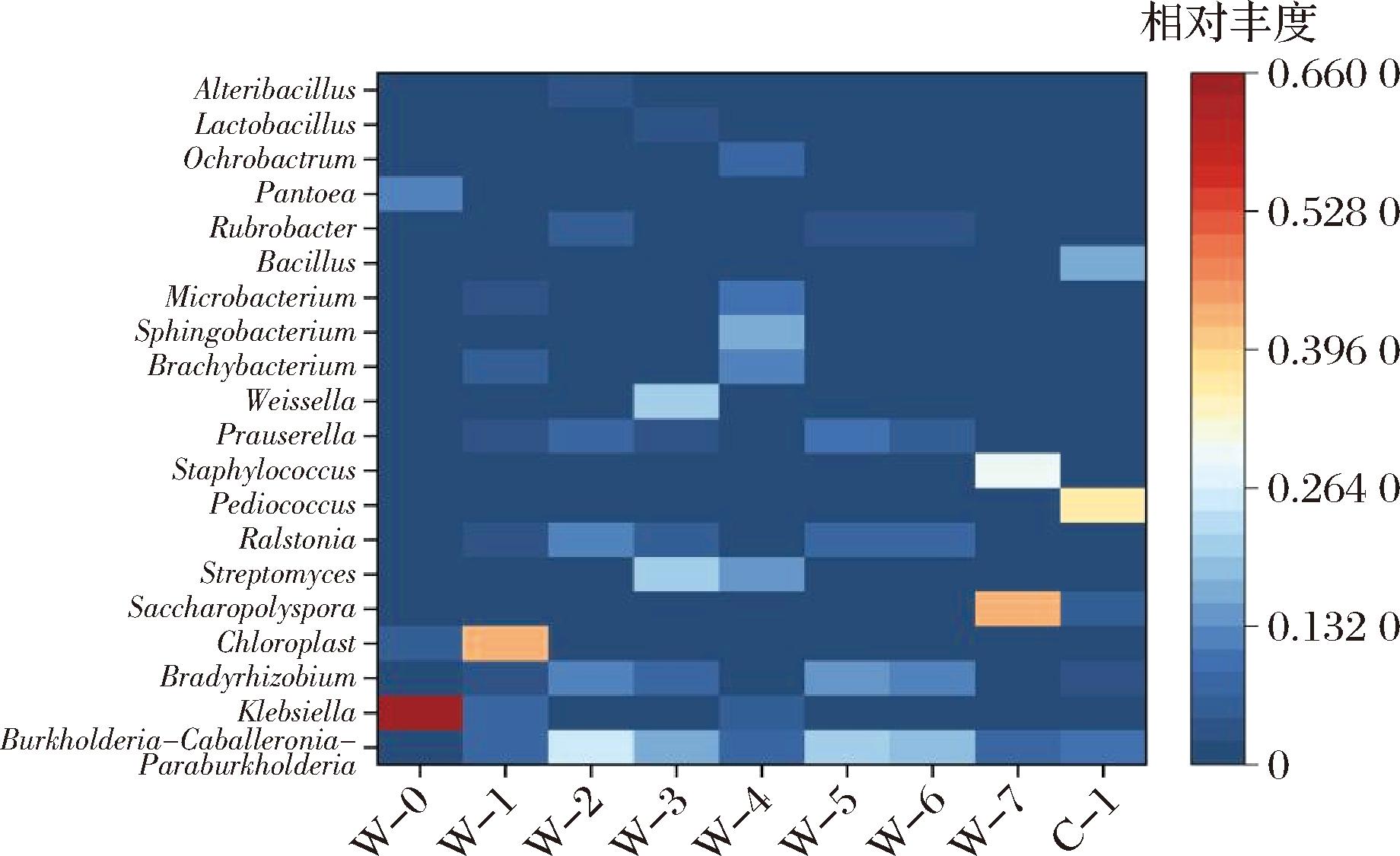
图6 黑茶渥堆过程中细菌种群组成热图
Fig.6 Heat map of bacterial population composition during the pile-fermentation of dark tea
2.3 黑茶渥堆过程中微生物种群与不同形态氟相关性分析
2.3.1 黑茶渥堆过程中真菌种群与不同形态氟相关性分析
将黑茶渥堆过程中不同形态氟含量与相对丰度前20的真菌属进行相关性分析。由图7可知,总氟与Thermomyces、粉状米勒氏酵母属(Millerozyma)、嗜热子囊菌属(Thermoascus)、Blastobotrys、Byssochlamys、Rasamsonia呈正相关性,但是相关性不强,其中与Thermomyces的相关性最为显著,相关系数为0.53,与Wallemia有较强的负相关性,相关系数为-0.65;残渣态氟与Millerozyma、Thermoascus、Byssochlamys和Blastobotrys呈强正相关性,相关系数为0.78、0.74、0.62、0.72,与Cyberlindnera和Pichia存在较强负相关性,相关系数为-0.48、-0.43;有机束缚态氟与粉枝孢属(Oidiodendron)、Delicatula、红菇属(Russula)、土生空团菌属(Cenococcum)、Arthrographis呈较强正相关性,相关系数为0.61、0.61、0.61、0.61、0.63,与Cyberlindnera和Pichia有较强负相关性,相关系数为-0.58、-0.54;铁锰结合氟与Pichia和Cyberlindnera呈较强正相关性,相关系数为0.69、0.60,与Thermomyces、Cenococcum、Russula、Delicatula和Oidiodendron存在一定负相关性,相关系数为-0.48、-0.45、-0.45、-0.45、-0.45;可交换性氟与Oidiodendron、Delicatula、Russula、Cenococcum呈强正相关性,相关系数均为0.81,与Cyberlindnera、Wallemia和Rhizomucor有一定负相关性,相关系数为-0.41、-0.41、-0.38;水溶性氟含量整体与细菌群落的负相关性很强,与Penicillium的负相关性最为显著,相关系数为-0.88,与Wallemia和Rhizomucor有较强负相关性,相关系数为-0.65、-0.60,与Cenococcum、Russula、Delicatula和Oidiodendron存在一定负相关性,相关系数均为-0.49。

图7 黑茶渥堆过程中真菌群落与不同形态氟含量相关性
Fig.7 Correlation between fungal communities and fluorine content in different existing forms during the pile-fermentation of dark tea
2.3.2 黑茶渥堆过程中细菌群落与氟含量相关性分析
由图8可知,总氟与Alteribacillus有较强的正相关性,相关系数为0.58,与Bacillus、Pediococcus和Saccharopolyspora有较强的负相关性,相关系数为-0.65、-0.65、-0.51;残渣态氟与Streptomyces和Weissella呈强正相关性,相关系数为0.77、0.74,与Saccharopolyspora有较强负相关性,相关系数为-0.52;有机束缚态氟与Klebsiella和Pantoea存在较强正相关性,相关系数为0.61、0.63,与Burkholderia-Caballeronia-Paraburkholderia、Bradyrhizobium、罗尔斯顿菌属(Ralstonia)、Prauserella和红色杆菌属(Rubrobacter)呈强负相关,相关系数为-0.75、-0.67、-0.66、-0.66、-0.71;铁锰结合氟与Pantoea和Klebsiella存在一定的负相关性,相关系数为-0.47、-0.44;可交换性氟含量与Pantoea和Klebsiella呈强正相关性,相关系数为0.81、0.80,与Burkholderia-Caballeronia-Paraburkholderia存在一定负相关性,相关系数为-0.51;水溶性氟与Bacillus和Pediococcus存在较强的负相关性,相关系数均为-0.65,与Pantoea存在一定负相关性,相关系数为-0.48。
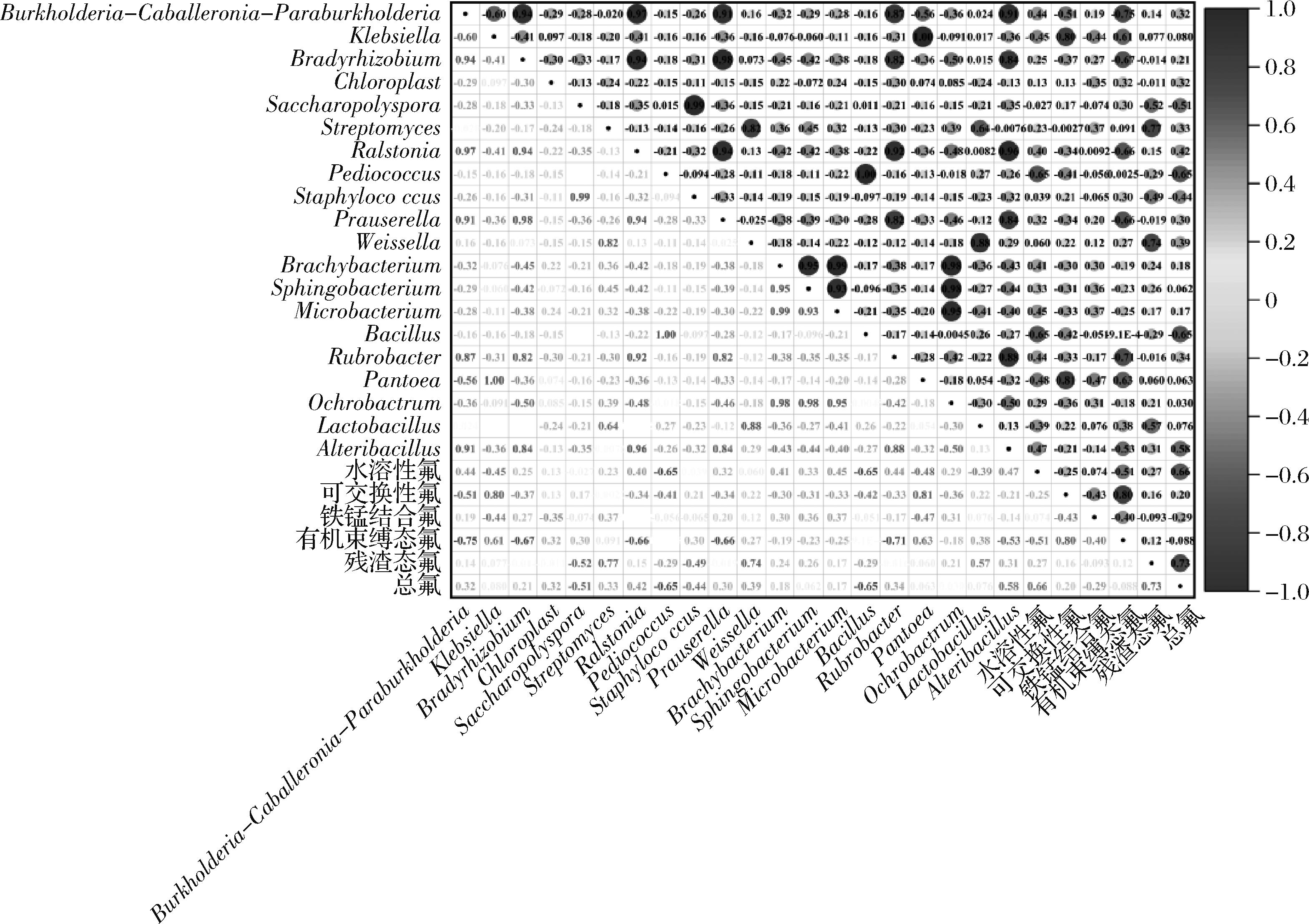
图8 黑茶渥堆过程中细菌群落与不同形态氟含量相关性
Fig.8 Correlation between bacterial communities and fluorine content in different existing forms during the pile-fermentation of dark tea
3 结论与讨论
本试验通过高通量测序技术,分析黑茶渥堆过程中真菌和细菌的多样性,并结合黑茶在渥堆过程中氟含量的变化,揭示黑茶渥堆过程中的微生物和氟含量之间的相关性。在渥堆过程中,水溶性氟和铁锰结合氟的含量呈现上升趋势,而其他形态的氟则呈现下降趋势,这可能是由于渥堆过程中的微生物活动和化学反应导致了氟的形态转化。在陈化后,铁锰结合氟和残渣态氟的含量略有上升,而其他形态的氟则继续下降。
渥堆过程中的黑茶由于含有充足的水分及合适的温度,致使其营养富足,非常利于微生物的生长。因其阶段的不同,微生物变化特点各异。对广东普洱茶渥堆中微生物分析,细菌在渥堆早期数量较多,以后逐渐下降,到后期其数量极少;放线菌则在早期数量变化不大,而到后期稍有增多;而霉菌渥堆早期占绝对优势,中后期则渐让位于酵母菌[23]。对湖南黑毛茶渥堆过程中微生物变化进行研究,细菌数量从渥堆一开始至渥堆18 h,呈迅速增加趋势,在渥堆30 h后细菌数目最大,渥堆后期细菌数量则略有下降,而真菌数量则随着渥堆时间的延长而增加,在渥堆末期真菌数量有所下降[24]。对四川康砖茶的微生物研究,发现渥堆前期,细菌大量繁殖,随后霉菌(主要是黑曲霉)迅速繁殖,呈稳中有降趋势,渥堆后期,细菌和霉菌的数量明显下降;而酵母菌则在整个渥堆过程中变化不大[25]。各种黑茶因其生产工艺的差异,渥堆过程中微生物种类及数量也存在差异,使其品质特征也呈现差异。本研究中,黑茶渥堆过程中微生物多样性分析结果显示,在渥堆初期(W-0),真菌的多样性和丰富度最高,Ascomycota为绝对优势门,这与邓俊琳等[18]对藏茶发酵过程中真菌群落结构一致;而在渥堆中期(W-4),细菌的多样性和丰富度达到最高,Proteobacteria为绝对优势门,在属水平上的优势属为Burkholderia-Caballeronia-Paraburkholderia,这与周金萍[20]在布朗酸茶发酵过程中细菌群落结构一致。此外,真菌和细菌在每个渥堆阶段的优势属的类别都有所不同,这反映了渥堆过程中微生物群落的动态变化。
目前,氟对黑茶中微生物生长繁殖的影响鲜有研究报道,吕毅[26]通过在不同NaF浓度环境中培养冠突散囊菌时发现,低质量浓度(45~226 mg/L)的氟离子对菌落的生长有一定促进作用,随氟离子质量浓度(272~451 mg/L)的增加,促进作用消失,更高的氟离子浓度会抑制菌体生长。本研究中,黑茶渥堆过程中真菌群落与氟含量相关性分析结果显示,真菌群落与黑茶中不同形态的氟含量存在显著的相关性。其中Wallemia和Rhizomucor与总氟含量之间的负相关性最为显著,而Millerozyma与残渣态氟呈正相关,Arthrographis与有机束缚态氟呈正相关,Cyberlindnera和Pichia与铁锰结合氟的相关性为正,Oidiodendron、Delicatula、Russula、Cenococcum与可交换氟呈正相关,这些微生物可能在促进可交换氟的形成过程中起到关键作用。Thermomyces和Blastobotrys在渥堆中期显示出对各形态氟含量正相关性最强,渥堆前期Bacillus和Pediococcus与总氟呈现较强的负相关性,Streptomyces和Weissella与残渣态氟呈正相关Burkholderia-Caballeronia-Paraburkholderia和Bradyrhizobium与有机束缚态氟含量呈负相关,Pantoea和Klebsiella与铁锰结合氟含量呈负相关。
本研究阐释了在渥堆过程中茶叶氟的存在形态以及其与微生物种群的相关性,对茶叶渥堆工序的把握和优化具有指导意义。此外,结果为理解茶叶渥堆过程中微生物群落与各形态氟的含量之间的关系提供了重要依据,也为茶叶加工过程中氟含量的调控提供了新思路,但茶叶渥堆过程中微生物群落结构变化的机制以及不同微生物对茶叶品质的具体影响,还有待进一步研究。
[1] 王增盛, 施兆鹏, 刘仲华, 等.论黑茶品质及风味形成机理[J].茶叶科学, 1991, 11(S1):1-9.WANG Z S, SHI Z P, LIU Z H, et al.Discussion on the mechanism of quality and flavour formation of dark green tea[J].Journal of Tea Science, 1991, 11(S1):1-9.
[2] 齐桂年, 田鸿, 刘爱玲, 等.四川黑茶品质化学成分的研究[J].茶叶科学, 2004, 24(4):266-269.QI G N, TIAN H, LIU A L, et al.Studies on the quality chemical components in Sichuan brick tea[J].Journal of Tea Science, 2004, 24(4):266-269.
[3] 李玉川, 董晨, 陈玉琼, 等.优质黑茶渥堆工艺优化[J].中国茶叶加工, 2023(1):10-16;21.LI Y C, DONG C, CHEN Y Q, et al.Pile-fermentation optimization of high-quality dark tea[J].China Tea Processing, 2023(1):10-16;21.
[4] WHO (World Health Organization).Environmental health criteria 227:Fluorides[S].Geneva WHO,2002:1-251.
[5] GARC A-PÉREZ A, IRIGOYEN-CAMACHO M E, BORGES-Y
A-PÉREZ A, IRIGOYEN-CAMACHO M E, BORGES-Y
 EZ A.Fluorosis and dental caries in Mexican schoolchildren residing in areas with different water fluoride concentrations and receiving fluoridated salt[J].Caries Research, 2013, 47(4):299-308.
EZ A.Fluorosis and dental caries in Mexican schoolchildren residing in areas with different water fluoride concentrations and receiving fluoridated salt[J].Caries Research, 2013, 47(4):299-308.
[6] 生命元素(19)—氟[J].青年科学,2004,(10):33.The element of life (19)—fluorine[J].Science for Youth, 2004(10):33.
[7] RICH C, ENSINCK J.Effect of sodium fluoride on calcium metabolism of human beings[J].Nature, 1961, 191(4784):184-185.
[8] 申秀英, 章子贵, 许晓路.碘氟联用对大鼠脑细胞膜磷脂和脂肪酸组成的影响[J].卫生研究, 2004, 33(2):158-161.SHEN X Y, ZHANG Z G, XU X L.Influence of combined iodine and fluoride on phospholipid and fatty acid composition in brain cells of rats[J].Journal of Hygiene Research, 2004, 33(2):158-161.
[9] 沙济琴, 郑达贤.福建茶树鲜叶含氟量的研究[J].茶叶科学, 1994, 14(1):37-42.SHA J Q, ZHENG D X.Study on fluorine content in fresh leaves of tea trees in Fujian[J].Journal of Tea Science, 1994, 14(1):37-42.
[10] 张亚, 黄亚亚, 梁艳, 等.黑茶渥堆工艺研究进展[J].食品与机械, 2017, 33(3):216-220.ZHANG Y, HUANG Y Y, LIANG Y, et al.Research progress on pile-fermentation of dark tea[J].Food &Machinery, 2017, 33(3):216-220.
[11] 王银诚, 袁海波, 江用文.黑茶品质成分及加工研究进展[J].中国农学通报, 2016, 32(22):194-199.WANG Y C, YUAN H B, JIANG Y W.Advances in quality components and process of dark tea[J].Chinese Agricultural Science Bulletin, 2016, 32(22):194-199.
[12] 黄双凤, 方寒寒, 朱旗.微生物与黑毛茶品质形成关系的研究现状[J].福建茶叶, 2009, 31(2):10-11;13.HUANG S F, FANG H H, ZHU Q.Research status of the relationship between microorganisms and the formation of black tea quality[J].Tea in Fujian, 2009, 31(2):10-11;13.
[13] 温琼英, 刘素纯.黑茶渥堆(堆积发酵)过程中微生物种群的变化[J].茶叶科学, 1991, 11(S1):10-16.WEN Q Y, LIU S C.Variation of the microorganism groups during the pile-fermentation of dark green tea[J].Journal of Tea Science, 1991, 11(S1):10-16.
[14] 朱晓静.茶多糖氟测定方法及多糖与氟结合方式的初步研究[D].武汉:华中农业大学,2017.ZHU X J.Determination method of fluoride in tea polysaccharides and preliminary study on the combination mode of polysaccharides fluoride[D].Wuhan:Huazhong Agricultural University, 2017.
[15] 罗燕, 唐玉雪, 文敏, 等.青砖茶渥堆过程中理化特性及细菌多样性分析[J].食品安全质量检测学报, 2022, 13(16):5128-5136.LUO Y, TANG Y X, WEN M, et al.Analysis of physicochemical property and bacterial diversity during the pile-fermentation of Qingzhuan tea[J].Journal of Food Safety &Quality, 2022, 13(16):5128-5136.
[16] 代真林,汪娅婷,姚秀英,等.玉米大豆间作模式对玉米根际土壤微生物群落特征、玉米产量及病害的影响[J].云南农业大学学报(自然科学),2020,35(5):756-764.DAI Z L, WANG Y T, YAO X Y, et al.Effects of maize-soybean intercropping on the characteristics of rhizosphere soil microbial community, yield and diseases of maize[J].Journal of Yunnan Agricultural University (Natural Science), 2020, 35(5):756-764.
[17] 郑云华.四川康砖茶渥堆过程中菌群与氟含量分析及优势微生物鉴定[D].雅安:四川农业大学,2012.ZHENG Y H.Analysis of microbial community and fluoride content during the fermentation of Sichuan Kangzhuan tea and identification of dominant microorganisms[J].Ya’an:Sichuan Agricultural University, 2012.
[18] 邓俊琳, 何扬航, 陈建, 等.基于Illumina Miseq高通量测序技术探究藏茶发酵过程中微生物菌群变化[J].茶叶通讯, 2023, 50(1):104-113.DENG J L, HE Y H, CHEN J, et al.Analysis of microbial flora changes during fermentation of Tibetan tea by Illumina MiSeq high-throughput sequencing technology[J].Journal of Tea Communication, 2023, 50(1):104-113.
[19] 白亚妮, 冯璞阳, 秦涛, 等.基于PacBio三代测序的茯茶加工过程真菌群落分析[J].中国茶叶加工, 2023(1):63-68.BAI Y N, FENG P Y, QIN T, et al.Analysis of fungal community of fu tea based on the three-generation PacBio sequencing technology[J].China Tea Processing, 2023(1):63-68.
[20] 周金萍.布朗酸茶发酵过程中微生物菌群和品质变化研究[D].昆明:云南农业大学,2023.ZHOU J P.Study on the microbial community and quality changes during the fermentation of Brown Acid Tea[D].Kunming:Yunnan Agricultural University,2023.
[21] 张欣, 姚粟, 白飞荣, 等.基于高通量测序和可培养方法的勐海发酵普洱茶细菌多样性分析[J].食品与发酵工业, 2018, 44(9):15-21.ZHANG X, YAO S, BAI F R, et al.Analysis on bacterial diversity in Menhai fermented Pu-erh tea by high throughput sequencing and culture method[J].Food and Fermentation Industries, 2018, 44(9):15-21.
[22] 严宽, 李翔宇, 张建, 等.四川黑茶渥堆发酵不同时期细菌群落结构与多样性[J].宜宾学院学报, 2023, 23(12):38-43.YAN K, LI X Y, ZHANG J, et al.Bacterial community structure and diversity in different periods of Sichuan dark tea[J].Journal of Yibin University, 2023, 23(12):38-43.
[23] 何国藩, 林月婵, 徐福祥.广东普洱茶渥堆中细胞组织的显微变化及微生物分析[J].茶叶科学, 1987, 7(2):54-57.HE G F, LIN Y C, XU F X.Microscopic changes and microbial analysis of cell tissue in pile fermentation of Guangdong Pu’er tea[J].Journal of Tea Science, 1987, 7(2):54-57.
[24] 陈文峰, 屠幼英, 吴媛媛, 等.黑茶紧压茶浸提物对胰蛋白酶活性的影响[J].中国茶叶, 2002, 24(3):16-17.CHEN W F, TU Y Y, WU Y Y, et al.Influence of extracts of compressed tea on the trypsin activity[J].China Tea, 2002, 24(3):16-17.
[25] 付润华, 齐桂年.四川康砖茶的微生物研究[J].江苏农业科学, 2008, 36(5):231-234.FU R H, QI G N.Microbial study on Sichuan Kangzhuan tea[J].Jiangsu Agricultural Sciences, 2008, 36(5):231-234.
[26] 吕毅.氟与茶叶品质化学和微生物学的研究[D].杭州:浙江大学,2004.LYU Y.Studies on fluorine and tea quality:Chemistry and microbiology[D].Hangzhou:Zhejiang University, 2004.