甜菊糖是一种低热量、高甜度的增添剂替代品,其甜度约为蔗糖的200~300倍[1-2]。有研究表明甜菊糖苷还具有一定的降血糖作用,是一种极具开发价值和健康推崇的天然甜味剂[3]。但是目前批准使用的甜菊糖苷提取物口感存在明显的缺陷。其中代表性化合物莱鲍迪苷A(rebaudioside A)是从甜叶菊中提取的低热量甜味剂,被认为是蔗糖的理想替代品,但是其食用后令人不愉快的后苦味限制了其在食品添加剂领域的发展[4]。因此寻找并制备口感更好的甜菊糖苷类单体化合物具有迫切的需求和广阔的市场前景。莱鲍迪苷D(rebaudioside D)同样从甜菊糖中提取获得,因其热量低、甜度高、口感好的优势从众多天然甜味剂中脱颖而出,具有很大的市场潜力[5-7]。但是莱鲍迪苷D在甜菊糖中含量极低,约为甜菊糖干重的0.2%,且莱鲍迪苷D提取和纯化困难,合成工艺复杂,以量大的莱鲍迪苷A为底物,酶法制备莱鲍迪苷D是目前获得莱鲍迪苷D的主要途径[8]。
酶法催化莱鲍迪苷A转化为莱鲍迪苷D的研究众多[9-11],已经基本实现了从莱鲍迪苷A到莱鲍迪苷D的大量高效转化,但是将莱鲍迪苷类化合物从复杂的酶催化体系中提取分离纯化的研究鲜有报道。美国食品药品监督管理局(Food and Drug Administration,FDA)认定纯度不低于95%的甜菊糖苷可以作为甜味剂使用[12]。酶催化莱鲍迪苷A转化为莱鲍迪苷D的体系中成分复杂,包括但不限于粗酶、色素、磷酸盐、蔗糖及果糖等成分,如何实现从复杂体系中精准识别并富集莱鲍迪苷A和D,获得纯度>95%的莱鲍迪苷D是本研究的主要目的。目前常用的纯化莱鲍迪苷类化合物的方法包括重结晶法、高效液相色谱法等由于对样品的要求和成本高不适合大规模工业化生产[13-14]。因此开发高效、成本低、易于工业化生产的分离方法尤为重要。吸附树脂法因稳定的物化性质、较好的选择性以及较大的吸附量等优点被广泛应用,有望成为从酶催化体系中提取分离莱鲍迪苷D的潜在选择[15-16]。
目前大孔树脂在甜菊糖纯化方面的研究包括2个方向,一方面富集甜菊糖,获得高纯度的甜菊糖苷。另一方面利用甜菊糖各组分吸附选择性差异,分离不同的甜菊糖苷[17-18]。但是由于不同甜菊糖苷类化合物之间母核相同,结构近似,只通过简单的大孔树脂柱色谱很难实现不同组分之间的完全分离,因此本研究采取数根大孔树脂柱串联连续分离的方式以期提高莱鲍迪苷D的分离效果[19]。最终本研究以3种大孔树脂为填料,考察了其对甜菊糖苷吸附与解吸附的能力和分离莱鲍迪苷D的能力,并通过将柱色谱改良为连续柱色谱,进一步实现了纯度>95%的莱鲍迪苷D的连续富集分离。
1 材料与方法
1.1 材料与试剂
K2HPO4、KH2PO4,天津市科密欧化学试剂有限公司;蔗糖,市售;尿苷-5′-二磷酸二钠盐(uridine-5′-diphosphate disodium salt, UDP),北京普西唐生物科技有限公司;糖基转移酶UGT91C1突变体,铭诚惠众(江苏)药物研究有限公司自研专利技术[20];绿豆来源的蔗糖合酶SUS(BAA01108.1)基因序列,Genbank;LX-T28大孔树脂、LX-T83大孔树脂、LX-T05大孔树脂,西安蓝晓科技新材料股份有限公司;莱鲍迪苷A,甘肃普华甜菊糖开发有限公司;乙醇,上海泰坦科技股份有限公司。
1.2 设备
纯化水设备,南京帅博机械设备厂;DZF-6020B烘箱,上海仪昕科学仪器有限公司;真空泵,温岭市挺威真空设备有限公司;ME2002/02电子天平,METLLER TOLEDO公司;AutoPre25D-M402纯化设备,苏州英赛斯智能科技有限公司。
1.3 HPLC检测方法
本次实验样品中莱鲍迪苷A和莱鲍迪苷D的浓度与纯度均采用HPLC法检测。采用Waters 2695分析检测系统,DAD紫外检测器,色谱柱(250 mm×4.6 mm,5 μm;艾驰明科技TCM,C18),柱温30 ℃,在210 nm处检测样品峰。分析方法采用国标规定的关于检测甜菊糖苷的方法,流动相:A相为添加了10 mmol的Na2HPO4的水溶液(pH 2.6),B相为乙腈,洗脱梯度如表1所示。
表1 莱鲍迪苷HPLC检测流动相洗脱梯度
Table 1 HPLC elution gradient for the detection of Rebaudioside
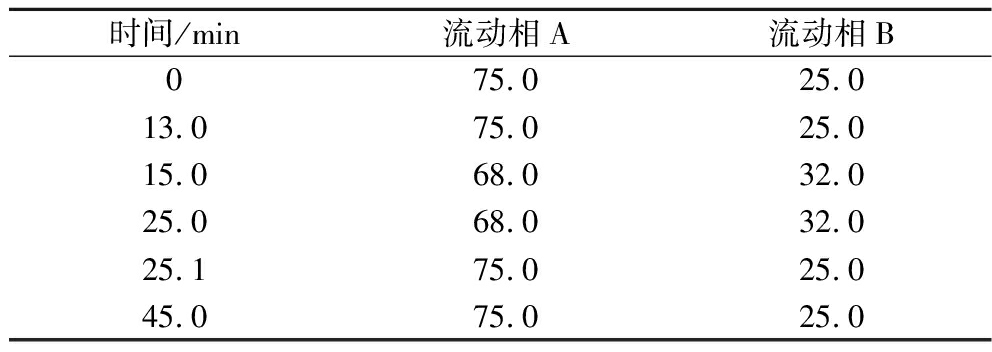
时间/min流动相A流动相B075.025.013.075.025.015.068.032.025.068.032.025.175.025.045.075.025.0
标准曲线的建立:配制不同浓度的莱鲍迪苷A与莱鲍迪苷D标准品建立标准曲线,其中莱鲍迪苷D:y=(5 517.4x+31.28)×1 000;莱鲍迪苷A:y=(5 248.9x-85.43)×1 000。x为莱鲍迪苷的浓度(mmol/L);y为HPLC中检测到的莱鲍迪苷的峰面积。
1.4 莱鲍迪苷A转莱鲍迪苷D的酶催化体系的构建
参考相关专利与文献[9, 11, 20],本试验通过在商业化酵母菌毕赤酵母宿主菌X33中表达得到蔗糖合酶与糖基转移酶粗酶液。以100 mmol/L的磷酸钾缓冲液(pH=8),300 mmol/L的蔗糖,2 mmol/L的UDP,10 g/L的莱鲍迪苷A与2 g/L的粗酶液构建酶催化体系。在此酶催化体系下莱鲍迪苷A的转化率约为70%,后续以此酶催化体系的反应液做为提取分离方法开发的供试液。
1.5 树脂吸附与动态解吸附试验
根据文献调研选择吸附材料进行动态吸附与解吸附试验。
动态吸附试验:取莱鲍迪苷A转莱鲍迪苷D的酶催化体系反应液,离心除去不溶性蛋白,HPLC检测离心上清液中莱鲍迪苷A与莱鲍迪苷D的浓度。3种大孔树脂(LX-T28、LX-T81、LX-T05)按照说明书活化后装柱,使用恒流泵以10 mL/min的流速将上清液泵入色谱柱中,以200 mL/瓶手动收集流穿液,并检测每瓶流穿液中莱鲍迪苷A与莱鲍迪苷D的浓度。至流穿液中莱鲍迪苷D浓度与反应液浓度相当时停止载样,此时树脂柱的载样量为最大载样量。
解吸附试验:用纯化水将达到最大载样量树脂中残留的样品洗出后更换高浓度乙醇动态解吸附,分别使用体积分数50%、60%、70%、80%、90%和100%乙醇对吸附的莱鲍迪苷D进行解吸附。HPLC检测至流出液中莱鲍迪苷D的浓度为0时统计流出液的体积并计算流出液中莱鲍迪苷D的量。
1.6 连续柱色谱分离试验
1.6.1 柱色谱洗脱梯度的筛选
大孔树脂装柱,以配备DAD紫外检测器的AutoPrep25D-M402制备液相控制反应上清液以15 mL/min的流速上样,上样量为最大载样量的一半。制备液相色谱检测波长为210 nm,洗脱流速为10 mL/min。上样结束使用纯化水洗脱2个柱体积将柱子中的反应上清液母液冲出柱子。随后将流动相从100%纯化水在120 min的时间内加大乙醇的比例至100%乙醇对莱鲍迪苷A和D进行梯度洗脱,收集并检测洗脱出的具有紫外吸收的组分。通过对收集组分进行HPLC检测得到将莱鲍迪苷D从树脂柱上洗脱的初始乙醇浓度。如使用T28做为填料时得到的初始乙醇体积分数为30%,后续以1%的梯度递减(递减不超过5个百分比)分别进行等度洗脱寻找最佳的洗脱梯度,即使用30%、29%、28%、27%、26%分别进行等度洗脱以确定具有最佳洗脱效果的乙醇浓度。
1.6.2 莱鲍迪苷D的连续柱色谱分离方法
在传统的单一柱色谱法无法实现莱鲍迪苷A与莱鲍迪苷D的完全分离时,必然需要对分离方法进行改进。目前使用最多的方法是对柱色谱处理过的莱鲍迪苷A与莱鲍迪苷D混合物进行重结晶,但是重结晶必然伴随工艺步骤的增多与样品在母液的残留。为了降本增效,简化莱鲍迪苷A与莱鲍迪苷D的纯化过程,更适应工业化生产。本研究对单一的柱色谱法进行改进,将柱子分成可拆卸的3部分(图1),柱1为载样部分,柱2为保留莱鲍迪苷A部分,柱3为保留莱鲍迪苷D部分。
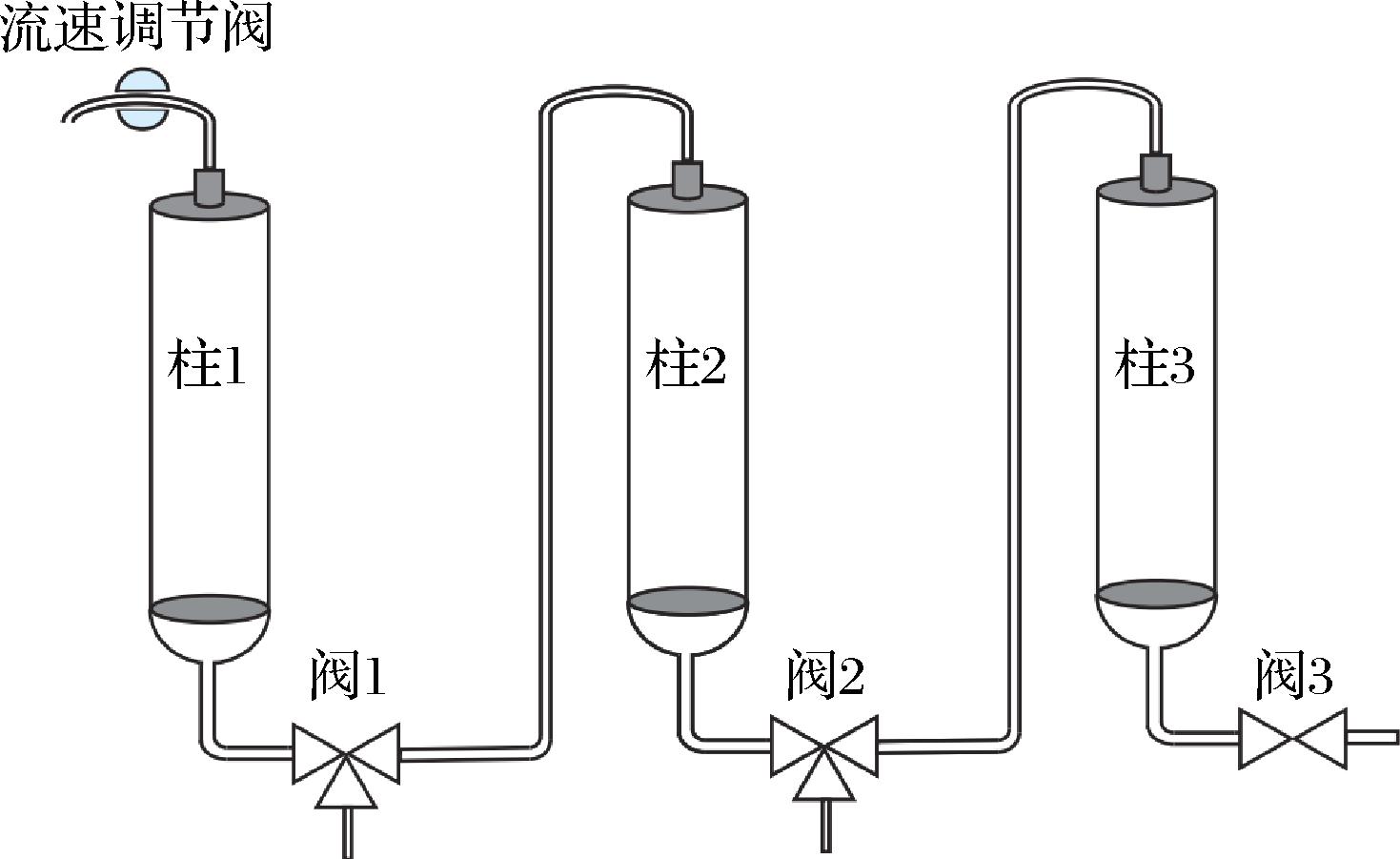
柱1-载样部分;柱2-保留莱鲍迪苷A部分;柱3-保留莱鲍迪苷D部分。
图1 连续柱色谱装置示意图
Fig.1 Diagram of tandem column chromatography device
如图1所示,3根色谱柱之间以三通阀连接,上样时不连通后2根色谱柱,上样至流穿液中检测到莱鲍迪苷D时为止(约为最大载样量的一半)。载样结束后连通柱2和柱3色谱柱,以确定好的乙醇浓度进行等度洗脱,流速为50 mL/min。通过阀2取样对样品进行定性检测,当流出液中开始出现莱鲍迪苷A时停止洗脱,此时柱3中为高纯度的莱鲍迪苷D。转换柱2与柱3间的三通阀,直接使用70%乙醇洗脱柱3即可得到高纯度的莱鲍迪苷D。莱鲍迪苷D洗脱结束,连通阀2继续30%乙醇等度洗脱,通过阀2检测流出液几乎全部为莱鲍迪苷A时结束。此时柱2中全部为高纯度的莱鲍迪苷A,柱3中为未完全分离的莱鲍迪苷A与莱鲍迪苷D。将柱2与柱3分别洗脱即可回收高纯度莱鲍迪苷A与少量混合物。
1.7 莱鲍迪苷D的回收实验
将收集到的高纯度莱鲍迪苷D洗脱液减压浓缩后于65 ℃干燥箱中烘干至恒重,分别取少量样品配制成1 mg/mL的溶液进行HPLC检测,测定产品的纯度。对烘干样品进行称重计算莱鲍迪苷D的收率。
2 结果与分析
2.1 酶催化反应液中莱鲍迪苷含量确定
2.1.1 酶催化体系构建
本试验合成30 L莱鲍迪苷A转莱鲍迪苷D的反应液用于后续的提取分离研究,体系成分为蔗糖2 053.8 g、UDP 12.12 g、莱鲍迪苷A 618.56 g、蔗糖合酶粗酶液1.69 L、糖基转移酶粗酶液3.39 L,pH=8的磷酸盐缓冲液补充体系至30 L,该体系在45 ℃下反应22 h。
2.1.2 酶催化体系构建
取上述酶催化体系反应液1 mL稀释至10 mL,0.22 μm滤膜过滤,进样20 μL。HPLC检测样品中莱鲍迪苷A与莱鲍迪苷D的峰面积,根据标准曲线计算反应液中莱鲍迪苷的浓度可知酶催化体系反应液最终质量浓度为莱鲍迪苷D 6.89 g/L,莱鲍迪苷A 3.10 g/L(见表2)。
表2 酶催化反应液中莱鲍迪苷D与莱鲍迪苷A的浓度
Table 2 The concentrations of Rebaudioside A and D in enzyme-catalyzed reaction solution

指标莱鲍迪苷D莱鲍迪苷A峰面积浓度/(mmol/L)质量浓度/(g/L)峰面积浓度/(mmol/L)质量浓度/(g/L)数值3 368 8886.116.891 691 2303.213.10
2.2 三种树脂对酶催化体系中莱鲍迪苷D的吸附与解吸附能力的测评
能否将莱鲍迪苷A与D从复杂的酶催化体系中富集是选择填料的最重要指标。本研究通过文献调研选择了3种对甜菊糖核心骨架贝壳杉烯有特异性吸附能力的苯乙烯-二乙烯苯骨架大孔树脂LX-T28、LX-T81和LX-T05。3种树脂各1 000 g装柱,以10 mL/min的流速向其中载入酶催化反应液,统计流穿液中莱鲍迪苷D的浓度与载入反应液的量的关系,统计结果见图2。
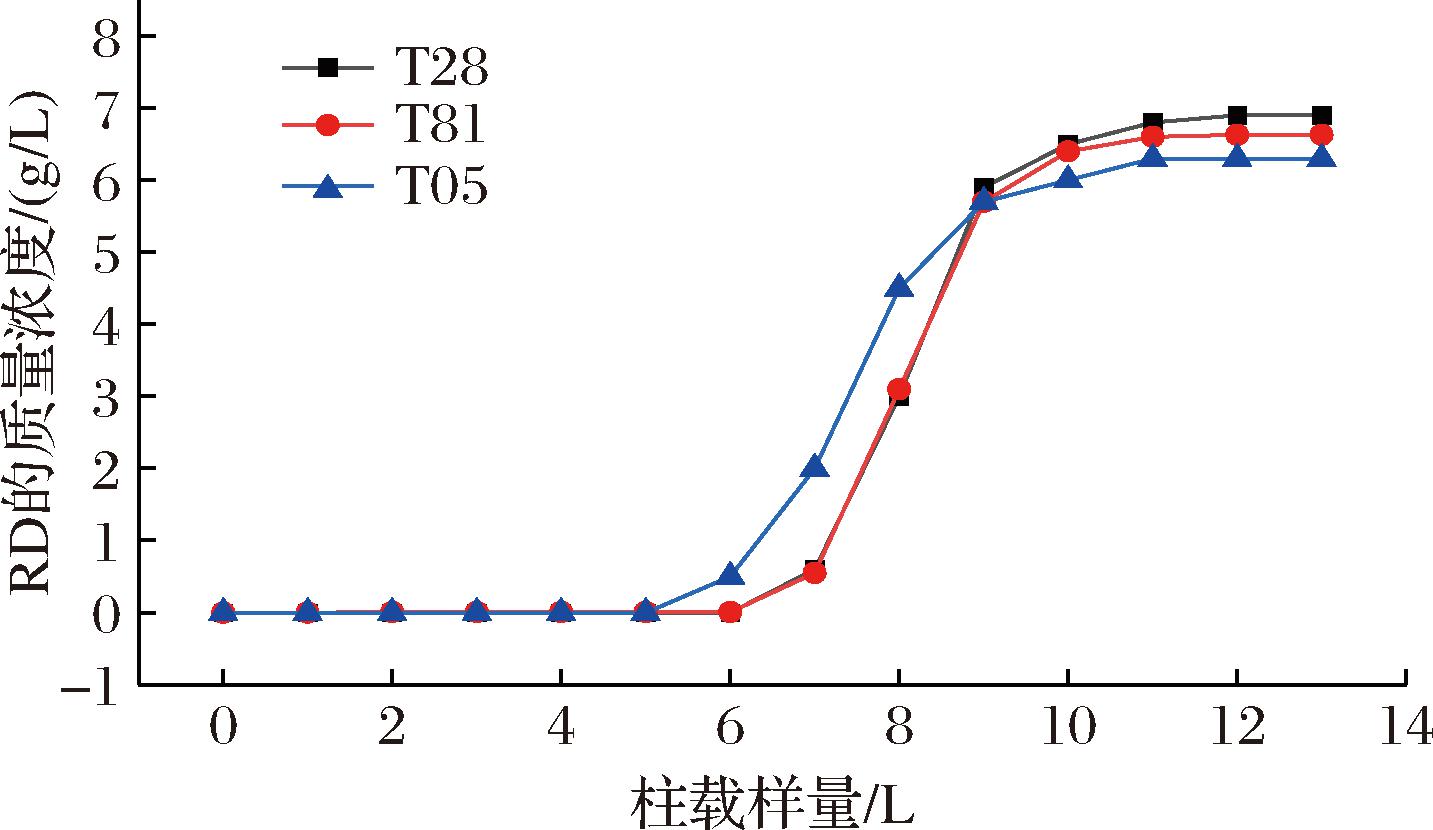
图2 流穿液中莱鲍迪苷D的浓度与柱载样量关系图
Fig.2 Relationship between Rebaudioside D concentration in eluate and the sample loading volume to the column
由图2可知,单从3种树脂对莱鲍迪苷D的载样量来说,3种树脂对莱鲍迪苷D的吸附能力相差不大。3种树脂对酶催化反应液的最大载样量为11~12 L,对莱鲍迪苷D的载样量为75~80 g/kg。
实际生产中,除了载样量之外莱鲍迪苷D的动态解离能力也是考察树脂之间性能的重要指标。载样结束后分别使用不同体积分数乙醇(50%、60%、70%、80%、90%、100%)对莱鲍迪苷D进行解吸附,通过HPLC检测统计了3种树脂吸附的莱鲍迪苷D完全解离时需要的解吸附剂的量与莱鲍迪苷D的解吸附率。
由图3可知,在不同的乙醇体积分数下将莱鲍迪苷D从树脂上完全解吸附所需要的乙醇的量有所差别。100%乙醇解吸附所需洗脱液的量最少,但是所需乙醇的量却不是最低。通过计算洗脱液的量与洗脱液中乙醇的体积分数可知在70%乙醇为洗脱液时所需的乙醇的量最少且3种树脂均符合这一规律。因此从节约成本考虑70%乙醇是最好的洗脱剂。
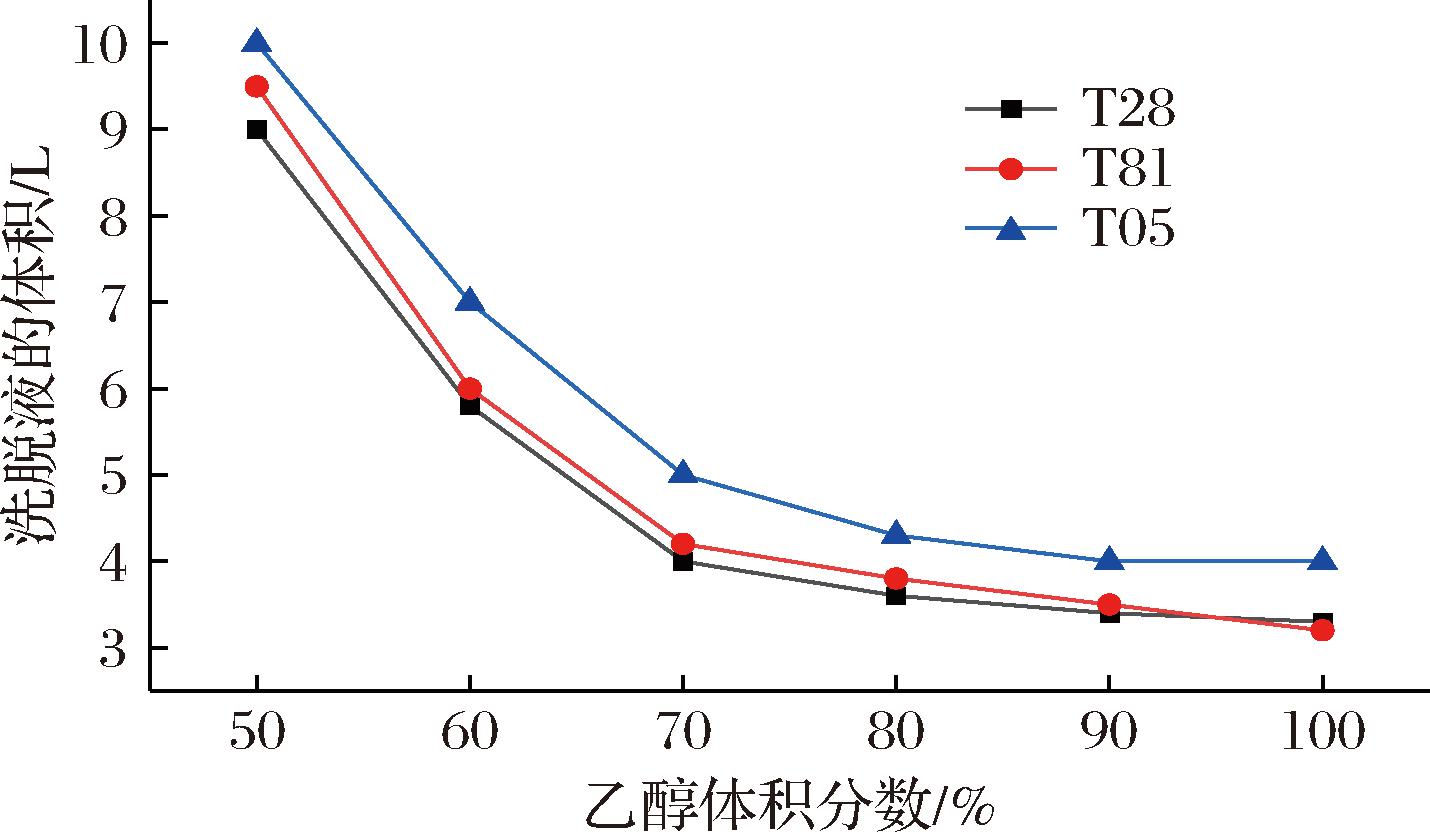
图3 乙醇体积分数与所需解吸附剂量的关系
Fig.3 The relationship between ethanol concentration and the amount of the required desorption agent
由图4可知,在3种树脂以不同体积分数乙醇解吸附时,解吸附率有略微的升高,但是提高不明显。对比3种树脂的整体解吸附率可知,T28与T81树脂的解吸附率明显较T05高,以T28与T81做树脂可以一定程度上减少莱鲍迪苷D的损失。
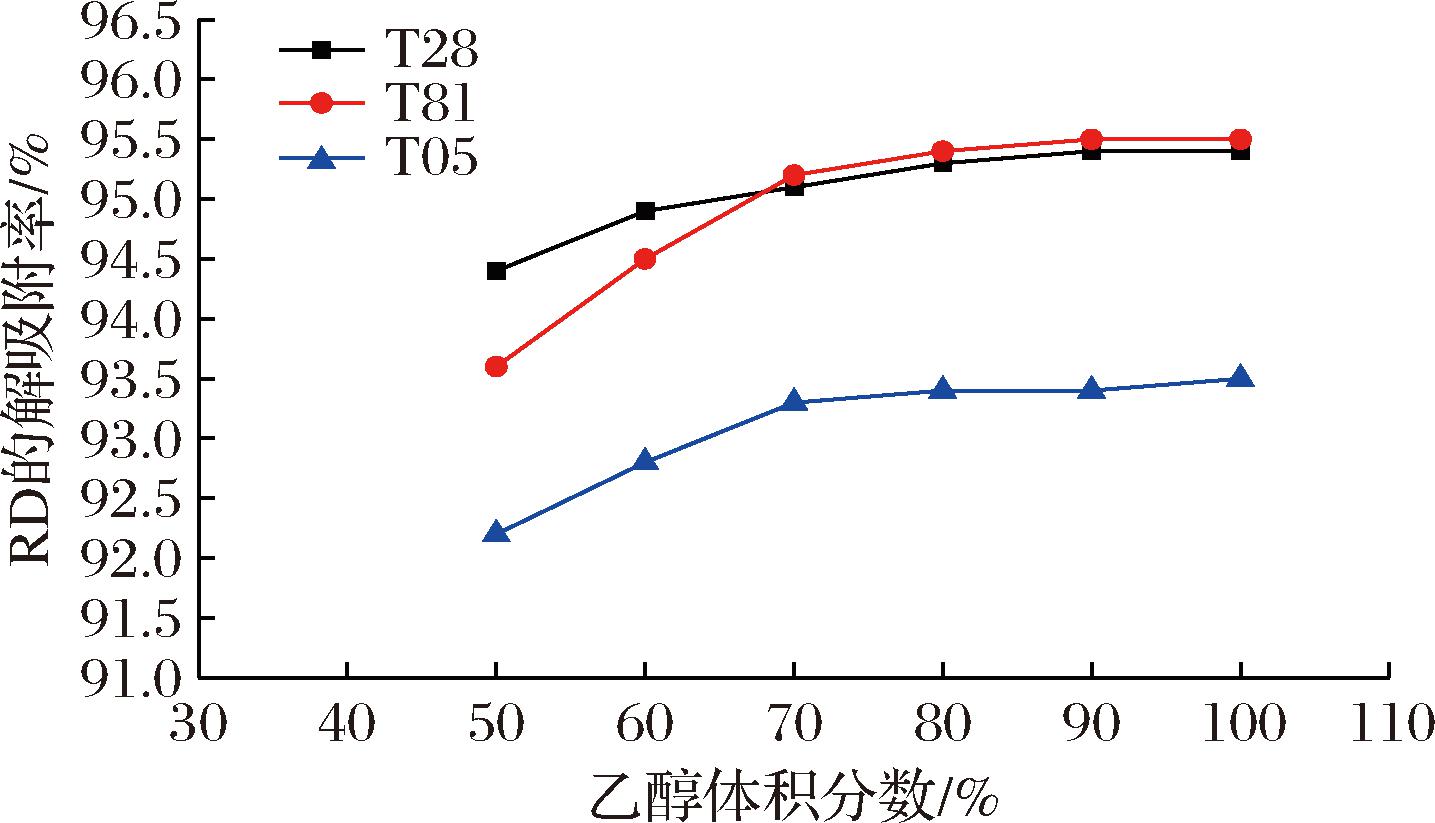
图4 莱鲍迪苷D在3种树脂上的解吸附率对比
Fig.4 Comparison of desorption rate of Rebaudioside D on three resins
从吸附效果来看,3种树脂差别不大,载样量均为75~80 g/kg。从解吸附来看T28与T81树脂效果较T05树脂略好,解吸率约为95%,解吸附时溶剂选择则以70%乙醇为佳。
2.3 莱鲍迪苷D等度洗脱梯度与莱鲍迪苷D回收率的确定
本研究通过对树脂吸附的莱鲍迪苷A、莱鲍迪苷D进行梯度洗脱发现,莱鲍迪苷A、莱鲍迪苷D在一定程度上可以分离。因此通过选择合适的乙醇体积分数有望实现莱鲍迪苷A、莱鲍迪苷D在树脂柱上的有效分离。
称取100 g T28与100 g T81分别装柱,最大理论载样量一半的反应液(0.55 L)以10 mL/min的流速上样。上样结束AutoPrep25D-M402制备液相控制流动相从100%纯水在3 h内升高乙醇比例至100%,DAD检测器实时检测莱鲍迪苷D出峰时流动相的比例以及莱鲍迪苷D在T28和T81的分离效果。试验表明,以T28为填料时莱鲍迪苷D在30%乙醇时开始出峰(图5),于37%乙醇时基本出峰结束,分离效果较好,能够实现与莱鲍迪苷A的基本分离。以T81为填料时将莱鲍迪苷D洗脱出的初始乙醇体积分数为35%(图6),于38%乙醇时与莱鲍迪苷A存在较大量的交叉,这与图3和图4所示的T81树脂对莱鲍迪苷D的吸附能力较强,同时在较低乙醇体积分数下莱鲍迪苷D在T81树脂上不易解离有关。
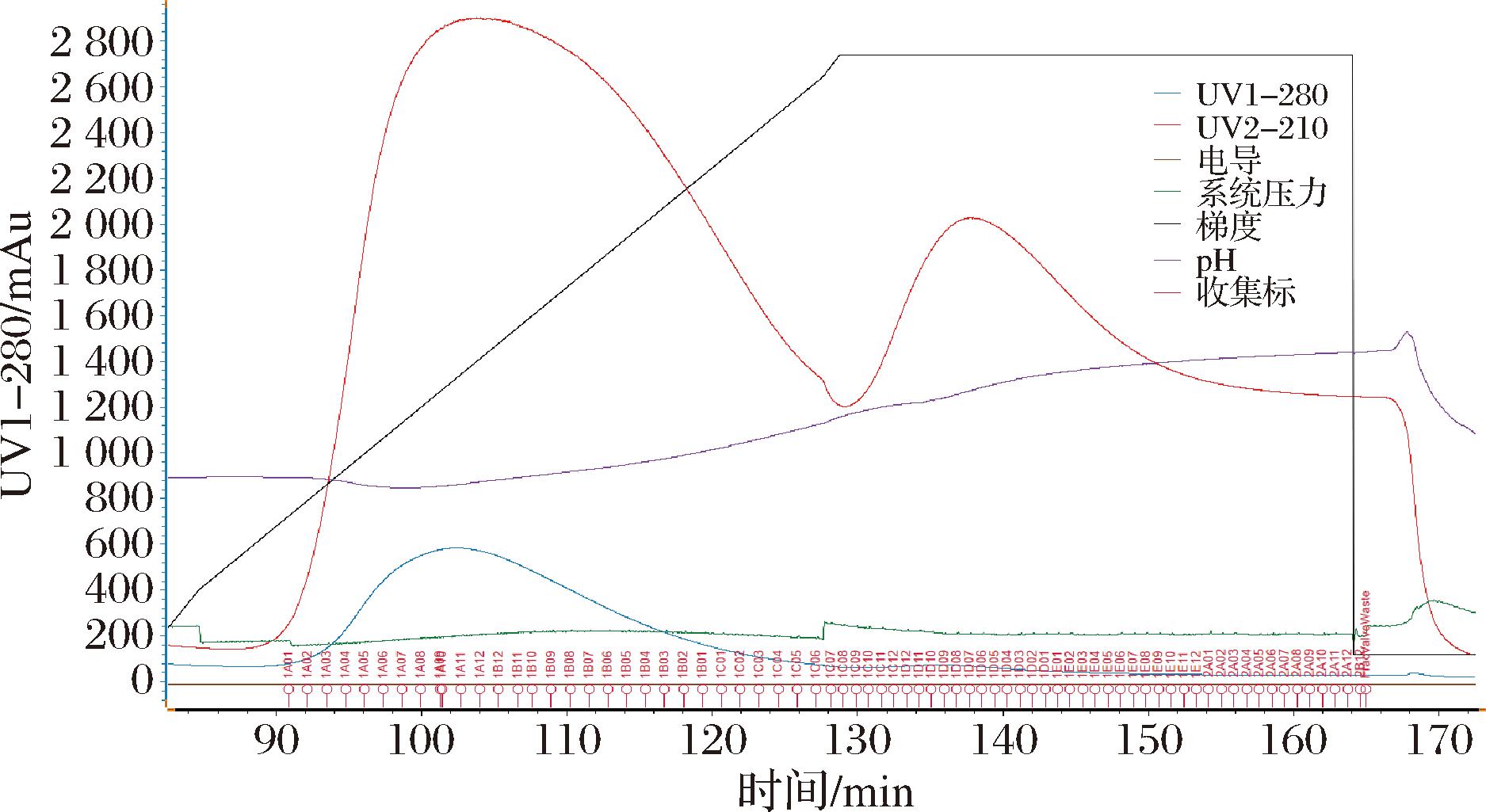
图5 以T28为填料时莱鲍迪苷D的梯度洗脱图
Fig.5 Elution profile of Rebaudioside D with T28 as packing material
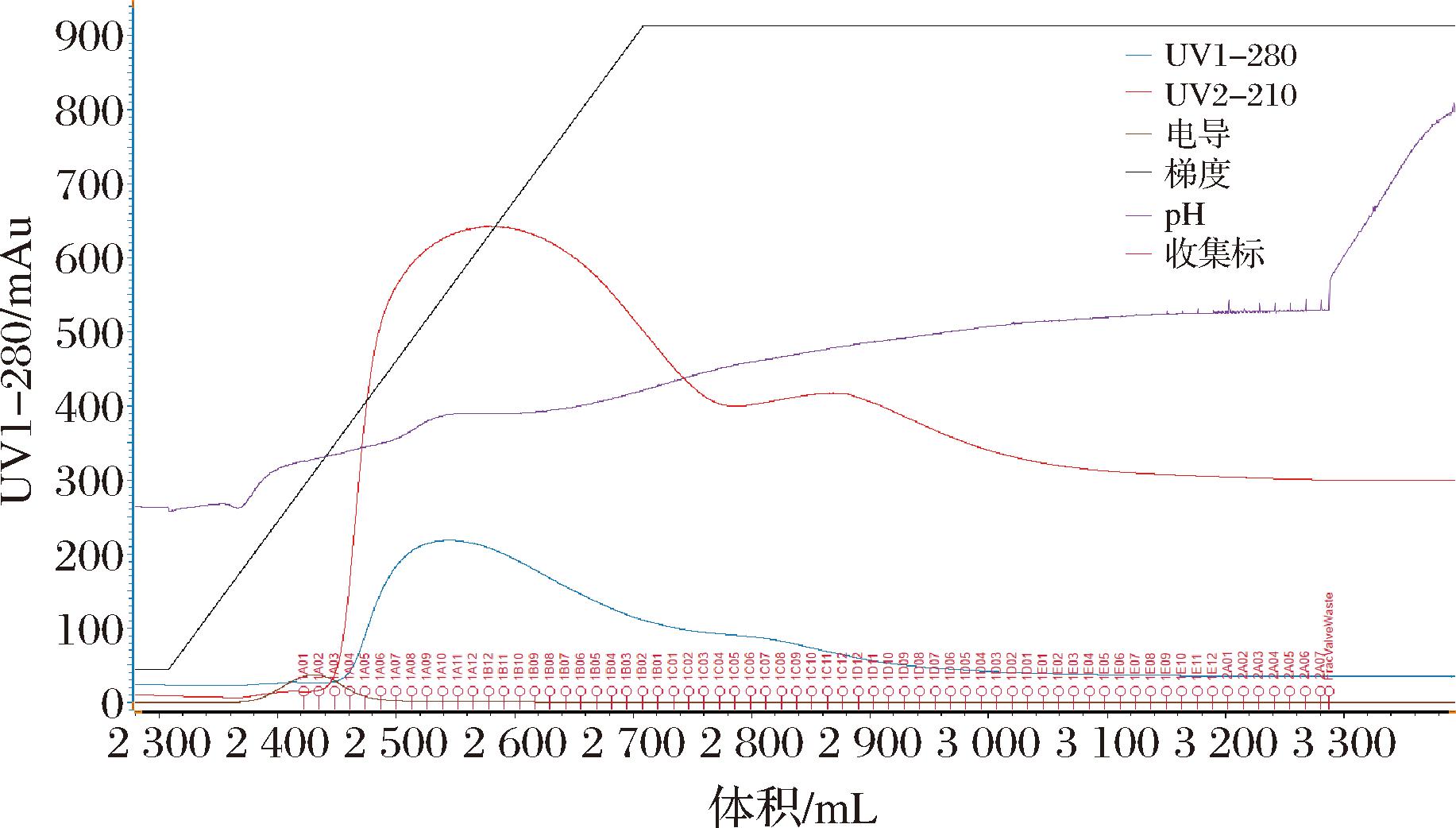
图6 以T81为填料时莱鲍迪苷的梯度洗脱图
Fig.6 Elution profile of Rebaudioside D with T81 as packing material
根据梯度洗脱结果,本研究后续对2种树脂在不同乙醇体积分数下的等度洗脱效果进行了考察。T28树脂考察了26%、27%、28%、29%与30%的乙醇时莱鲍迪苷D的分离效果,T81树脂考察了31%、32%、33%、34%、35%的乙醇等度洗脱时莱鲍迪苷D的分离效果。2种树脂分别100 g装柱,0.55 L反应液(含莱鲍迪苷D 3.79 g)上柱,流速10 mL/min,上样结束后使用纯化水将柱中残留反应液冲出。以三柱串联的连续柱色谱法对样品莱鲍迪苷D进行分离,待图1所示装置中阀门2检测到流出液中出现莱鲍迪苷A时关闭阀门2,断开柱2与柱3的联系,使用70%乙醇对柱3进行解吸附,减压浓缩烘干得到高纯度莱鲍迪苷D(莱鲍迪苷D纯度>95%)。对比不同乙醇体积分数下所得莱鲍迪苷D的量即可确定等度洗脱所需的最佳乙醇体积分数。因此我们根据不同乙醇体积分数洗脱下莱鲍迪苷D回收率的差异进行了如下统计(图7)。
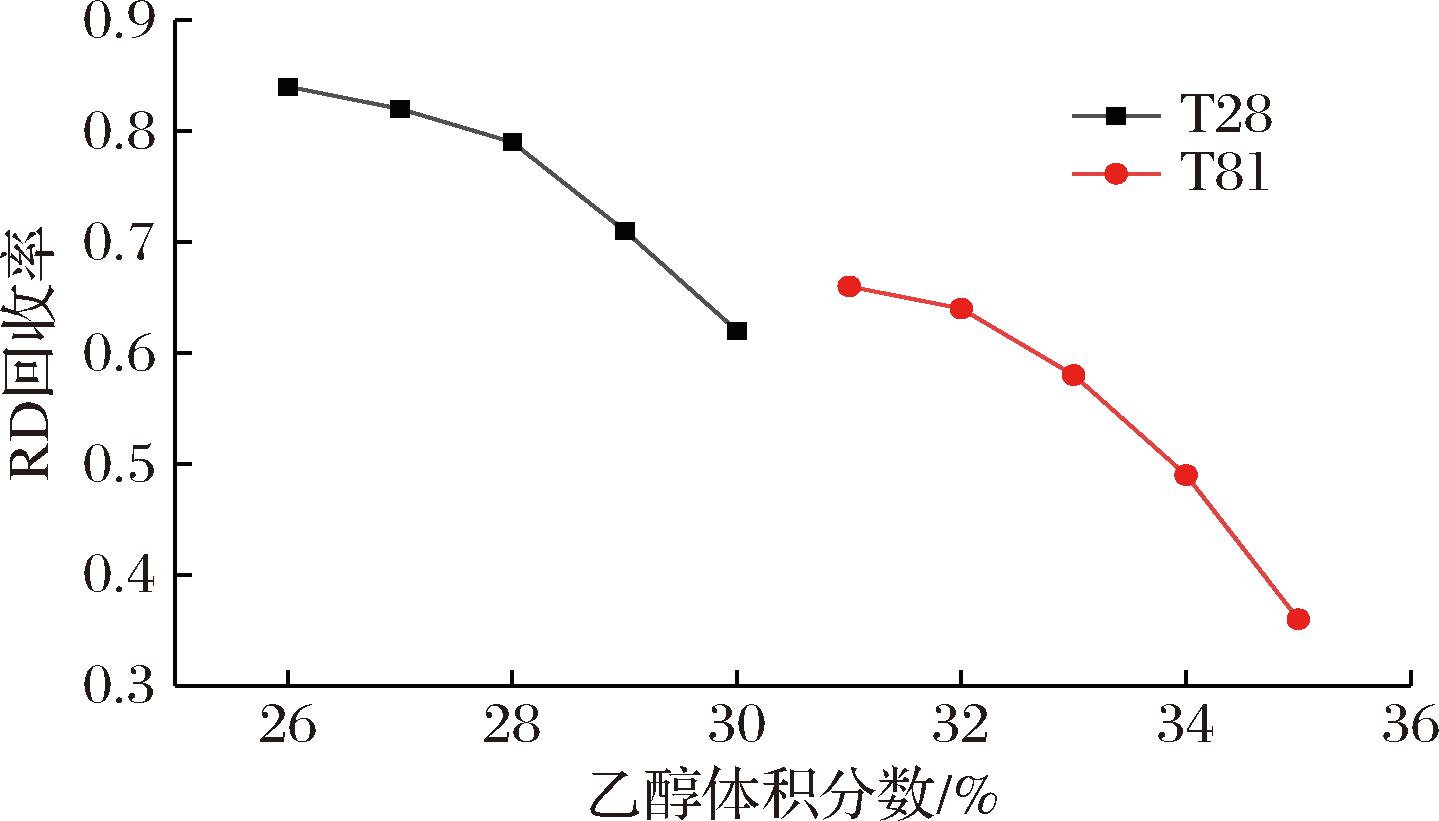
图7 乙醇洗脱体积分数与莱鲍迪苷D回收率的关系图
Fig.7 Relationship of ethanol concentration required for elution and Rebaudioside D recovery rate
如图7所示,对比莱鲍迪苷D在T28树脂与T81树脂上的回收率可以明显看出,T28树脂对莱鲍迪苷D的分离效果更好。从不同洗脱梯度下莱鲍迪苷D的回收率趋势来看,在一定范围内莱鲍迪苷D的回收率随乙醇体积分数的升高而降低。对于T28树脂来说以26%乙醇做为洗脱剂莱鲍迪苷D回收率最高。
在实际操作中我们发现虽然莱鲍迪苷D回收率随乙醇体积分数降低而略有提高,但是乙醇洗脱液的用量随乙醇体积分数的降低而急剧升高。为了节省物料成本与时间成本,必须平衡乙醇体积分数、乙醇用量与莱鲍迪苷D回收率之间的关系。因此我们统计了在T28树脂上达到最大莱鲍迪苷D回收率时乙醇体积分数与用量的关系。
如图8所示,洗脱液体积分数为26%时洗脱液用量最大,高达40 L。随着洗脱液体积分数的升高其用量也大幅度下降。在洗脱液体积分数为28%时,其用量开始趋于平缓。结合洗脱液体积分数与莱鲍迪苷D回收率趋势图同样在28%乙醇体积分数时莱鲍迪苷D回收率开始下降明显。因此综合考虑洗脱液体积分数、用量与莱鲍迪苷D回收率的关系,最后选择28%的乙醇体积分数做为最佳的洗脱浓度。
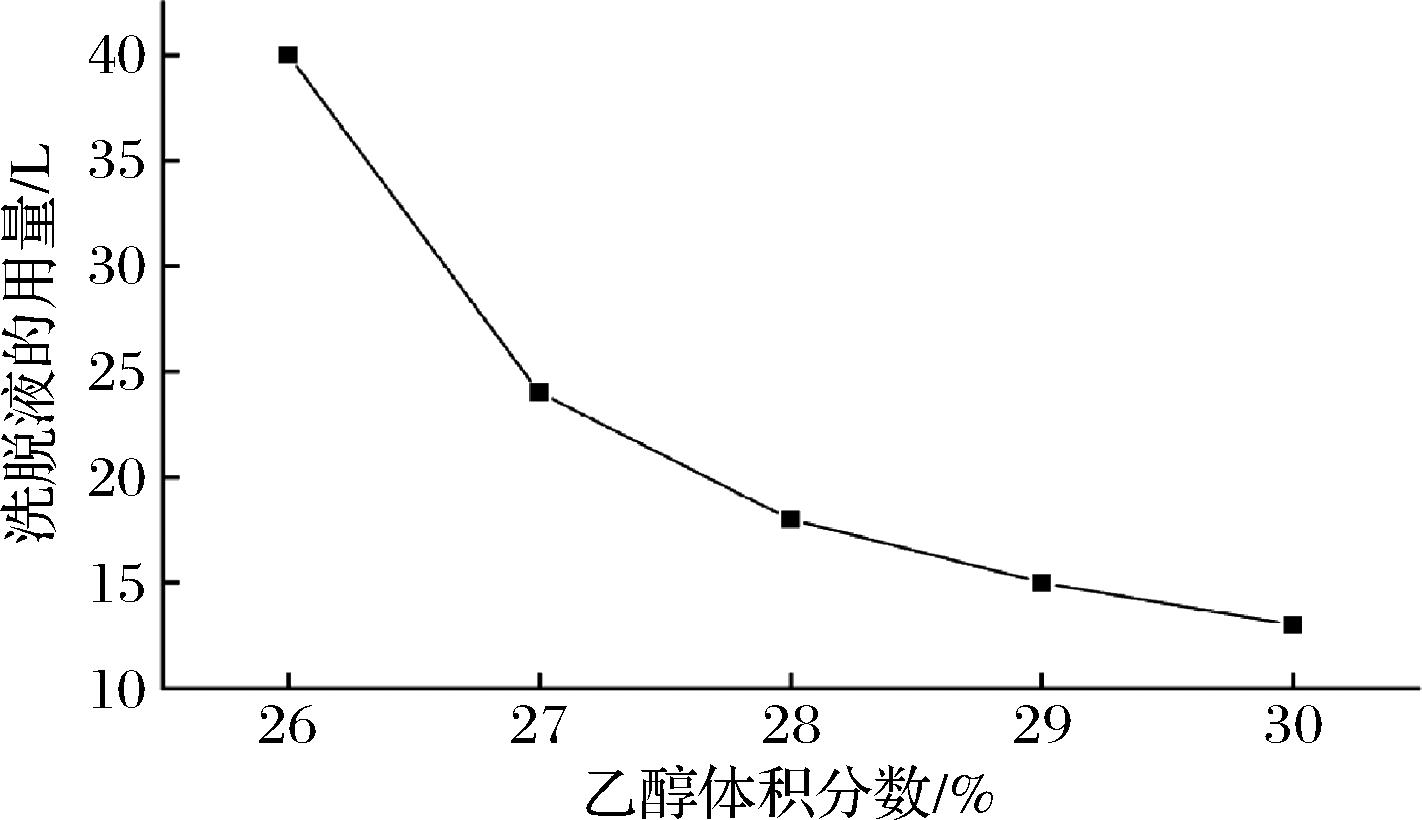
图8 洗脱液体积分数与洗脱液用量的关系
Fig.8 Relationship between eluent concentration and eluent dosage
本研究通过对莱鲍迪苷D的分离试验表明以T28树脂为填料,28%乙醇为等度洗脱液时综合效果最好,洗脱液用量18 L,莱鲍迪苷D回收率为79%。
3 结论
本文以莱鲍迪苷A转莱鲍迪苷D的酶催化体系反应液为研究对象,旨在解决酶法生产莱鲍迪苷的富集与纯化问题。通过调研相关文献,结合实际处理酶反应液的经验,本研究选取的苯乙烯-二苯乙烯为骨架的3种大孔树脂均有从复杂酶反应体系中富集莱鲍迪苷的能力。通过3种树脂对莱鲍迪苷D的吸附能力,解吸附能力以及分离能力的考察,选出了性能最优的LX-T28大孔树脂,对莱鲍迪苷D的最大吸附量为79.2 g/kg,解吸附率为95.2%,回收率为79%。得到的莱鲍迪苷D纯度>95%,达到了FDA认证的甜菊糖苷做为甜味剂使用的标准,成功实现了从酶催化体系中连续富集与纯化莱鲍迪苷D的目的,为酶法生产莱鲍迪苷提供了后处理方案。此外,本研究采用连续柱色谱法分离莱鲍迪苷D,莱鲍迪苷D保留在柱3中为高体积分数乙醇洗脱得到,所需减压浓缩的洗脱液体积大大减少,与传统单柱色谱法分离需要减压浓缩大量低体积分数乙醇相比,成本显著降低。本研究成功实现了酶法生产莱鲍迪苷D的连续富集与分离,成本低廉,方法简单,为酶法生产莱鲍迪苷实现工业化提供了有效的后处理方案。
[1] MOORADIAN A D, SMITH M, TOKUDA M.The role of artificial and natural sweeteners in reducing the consumption of table sugar:A narrative review[J].Clinical Nutrition ESPEN, 2017, 18:1-8.
[2] ZHOU X, GONG M Y, LYU X Q, et al.Metabolic engineering for the synthesis of steviol glycosides:Current status and future prospects[J].Applied Microbiology and Biotechnology, 2021, 105(13):5367-5381.
[3] MYINT K Z, CHEN J M, ZHOU Z Y, et al.Structural dependence of antidiabetic effect of steviol glycosides and their metabolites on streptozotocin-induced diabetic mice[J].Journal of the Science of Food and Agriculture, 2020, 100(10):3841-3849.
[4] CEUNEN S, GEUNS J M C.Steviol glycosides:Chemical diversity, metabolism, and function[J].Journal of Natural Products, 2013, 76(6):1201-1228.
[5] SARAIVA A, CARRASCOSA C, RAHEEM D, et al.Natural sweeteners:The relevance of food naturalness for consumers, food security aspects, sustainability and health impacts[J].International Journal of Environmental Research and Public Health, 2020, 17(17):6285.
[6] PETIT E, JACQUES A, DAYDÉ J, et al.UGT76G1 polymorphism in Stevia rebaudiana:New variants for steviol glycosides conjugation[J].Plant Physiology and Biochemistry, 2019, 135:563-569.
[7] PRAKASH I, MARKOSYAN A, BUNDERS C.Development of next generation stevia sweetener:Rebaudioside M[J].Foods, 2014, 3(1):162-175.
[8] OLSSON K, CARLSEN S, SEMMLER A, et al.Microbial production of next-generation stevia sweeteners[J].Microbial Cell Factories, 2016, 15(1):207.
[9] LIN M, WANG F, ZHU Y S.Modeled structure-based computational redesign of a glycosyltransferase for the synthesis of rebaudioside D from rebaudioside A[J].Biochemical Engineering Journal, 2020, 159:107626.
[10] XU Y M, WANG X L, ZHANG C Y, et al.De novo biosynthesis of rubusoside and rebaudiosides in engineered yeasts[J].Nature Communications, 2022, 13:3040.
[11] WANG Z Y, HONG J F, MA S Y, et al.Heterologous expression of EUGT11 from Oryza sativa in Pichia pastoris for highly efficient one-pot production of rebaudioside D from rebaudioside A[J].International Journal of Biological Macromolecules, 2020, 163:1669-1676.
[12] PERRIER J D, MIHALOV J J, CARLSON S J.FDA regulatory approach to steviol glycosides[J].Food and Chemical Toxicology, 2018,122:132-142.
[13] 钱凯, 宋明军, 李洁莉, 等.高效液相色谱-示差折光法测定甜菊糖中莱鲍迪苷A的含量[J].食品工业科技, 2012, 33(20):64-65;69.QIAN K, SONG M J, LI J L, et al.Separation and identification of rebaudioside A in stevia by high performance liquid chromatography-refractive index detector[J].Science and Technology of Food Industry, 2012, 33(20):64-65;69.
[14] 赵宏宇. 莱鲍迪苷A 的结晶工艺及其结晶热力学研究[D].无锡:江南大学,2012.ZHAO H Y.Research on the crystallization process and thermodynamics of rebaudioside A[D].Wuxi:Jiangnan University, 2012.
[15] 何海芬, 阎杰, 陈颂怡.甜菊糖苷的柱色谱法纯化[J].食品与发酵工业, 2013, 39(9):121-124.HE H F, YAN J, CHEN S Y.Purification of steviosides by column chromatograph[J].Food and Fermentation Industries, 2013, 39(9):121-124.
[16] CHEN Z B, WEI X L, LI J, et al.Preparative separation of Rebaudiana A from commercialized steviol glycosides by macroporous adsorption resins mixed bed[J].Separation and Purification Technology, 2012, 89:22-30.
[17] LIU Y X, HUA X, WANG M M, et al.Purification of the mother liquor sugar from industrial stevia production through one-step adsorption by non-polar macroporous resin[J].Food Chemistry, 2019, 274:337-344.
[18] ANVARI M, KHAYATI G.Separation and purification of rebaudioside A from extract of Stevia rebaudiana leaves by macroporous adsorption resins[J].Polish Journal of Chemical Technology, 2016, 18(1):127-132.
[19] MAHAJAN E, GEORGE A, WOLK B.Improving affinity chromatography resin efficiency using semi-continuous chromatography[J].Journal of Chromatography A, 2012, 1227:154-162.
[20] 张明义,窦培冲,平千, 等.一种糖基转移酶UGT91C1突变体及其应:中国,CN 117431229A[P].2024-01-23.ZHANG M Y, DOU P C, PING Q.A mutant of glycosyltransferase UGT91C1 and its application:China, CN 117431229A[P].2024-01-23.