生命体耗氧活动产生的自由基是细胞代谢中不可或缺的能量传递介质。在正常情况下,自由基的活动范围被限制在细胞内,参与细胞生长、信号传递、抑制病毒和细菌等调节活动。然而,由于自由基的化学性质非常活泼,过量的自由基会导致氧化应激,损伤细胞和组织,引起或加重糖尿病、心血管疾病、阿尔兹海默症和炎症等多种疾病[1]。因此,减少自由基带来的氧化损伤是预防与治疗疾病的关键之一[2]。植物多糖可以通过清除生物体内过量自由基,增强抗氧化酶活性,达到抑制脂质过氧化,保护细胞与组织等作用[3],是天然的、安全的优异抗氧化剂。
罗汉果[Siraitia grosvenorii (Swingle) C.Jeffrey]是葫芦科多年生藤本植物的果实,富含三萜皂苷、多糖、黄酮、氨基酸等成分,具有清热润肺、润肠通便的功效[4]。研究发现,多糖作为罗汉果的重要活性成分,具有免疫调节、抗糖尿病肾病、抗氧化的作用,逐渐成为行业关注的热点[5-7]。ZHU等[8]提取纯化的罗汉果多糖(Siraitia grosvenorii polysaccharides, SGPs)(分子质量1.93×103 kDa)可降低H2O2诱导的PC12细胞的活性氧(reactive oxygen species,ROS)生成,以及PC12细胞的凋亡率和坏死率。GONG等[9]研究发现,罗汉果多糖SGP-1-1的抗氧化及降血糖活性与多糖的结构间接相关。
果实采收后,部分新鲜罗汉果用于罗汉果甜苷的提取,其余果实则经干燥加工后贮藏。之前的研究[10]发现,不同干燥处理会显著影响罗汉果果实中总糖含量及其抗炎活性。众所周知,多糖复杂的大分子结构易受多种因素的影响,其中,原材料的干燥加工会影响多糖组分的理化性质,如单糖组成、分子质量、微观形态等,进而引起生物活性差异。目前,罗汉果的干燥加工主要有热风干燥、冷冻干燥、真空干燥、微波干燥、真空-微波干燥等方式。热风干燥是通过连续流动的热风对固体进行干燥,水分蒸发较快、操作简单,但干燥过程中的较高温度可能会引起多糖理化性质的改变,如LIU等[11]研究发现,热风干燥促进了中性多糖中的α-构型,同时降低了酸性多糖中的β-构型,这种变化提高了香菇多糖的免疫增强活性。真空干燥适用于热敏性物料,可以减少多糖在干燥过程中的氧化反应,但易破坏物料微观结构[12]。微波干燥通过微波将水分汽化,氧化程度低,干燥时间短,不影响被干燥物料的色、香、味和组织结构。如FU等[13]通过提取对不同干燥方式处理的枇杷叶多糖进行提取发现,微波干燥所得的枇杷叶多糖分子质量小,未甲基化半乳糖醛酸含量高,对α-淀粉酶和α-葡萄糖苷酶有较强的抑制作用,并具有显著的抗氧化活性。由于干燥方法对多糖的影响不同,适合的干燥方法对控制多糖的理化特性和生物活性至关重要。因此,本文采用热风干燥、真空干燥、微波干燥的方法处理成熟的新鲜罗汉果,通过水提醇沉法提取多糖,分析各多糖提取率、理化性质及抗氧化活性差异,为罗汉果干燥加工和功能产品开发提供参考。
1 材料与方法
1.1 材料与试剂
新鲜罗汉果购自桂林市永福县,经卢凤来副研究员鉴定为葫芦科植物罗汉果的果实。干燥果委托林中仙罗汉果有限公司加工。
对照品D-甘露糖(批号MUST-23012802,质量分数99.52%)、DL-阿拉伯糖(批号MUST-22022819,质量分数98.25%)、D-核糖(批号MUST-23021307,质量分数98.00%)、D-葡萄糖醛酸(批号MUST-23021309,质量分数98.00%)、D-无水葡萄糖(批号MUST-22030214,质量分数99.61%)、D-半乳糖(批号MUST-22061105,质量分数98.00%)、鼠李糖(批号MUST-22061104,质量分数99.00%),成都曼思特生物科技有限公司;D-(+)半乳糖醛酸(批号M13IB214977,质量分数98.00%),上海源叶生物科技有限公司;葡聚糖分子质量标准品(批号140637~646-201203),中国食品药品检定研究院;其他试剂均为分析纯级别。
1.2 仪器与设备
FDU-2110冷冻干燥机,日本EYELA东京理化公司;SW00101-4N40超滤实验设备,厦门同舟纵横厦门流体技术有限公司;Avance 500 MHz超导核磁共振波谱仪,德国Bruker公司;LC-2030C型液相色谱仪、UV-2600i紫外-可见分光光度计,日本岛津公司;Spectrum Two傅里叶变换红外光谱仪,美国Perkin Elmer公司;EVO 18扫描电子显微镜,德国ZEISS公司。
1.3 方法
1.3.1 罗汉果的干燥参数
a)热风干燥:电鼓风干燥箱,70 ℃,干燥至含水率为12%。
b)微波干燥:真空微波干燥仪,45 ℃,90 kW,真空度66 Pa,干燥至含水率为12%。
c)真空干燥:真空干燥箱,抽真空至50 Pa,程序升温至60 ℃,干燥至含水率为12%。
1.3.2 多糖的提取
分别称取罗汉果样品500 g,粉碎,8 L乙醇(80%,体积分数,下同)回流提取2 h。残渣自然风干,料液比1∶20(g∶mL)加入纯水,于70 ℃下提取2 h。提取液离心(4 200 r/min,10 min),取上清液,下层沉淀重复提取1次。合并2次上清液,超滤(截留分子质量150 Da)后旋转蒸发仪浓缩至1 L。加入3 L乙醇(95%)于4 ℃静置过夜,离心去除上清液。向沉淀物中加入300 mL纯水复溶,Sevage法除蛋白后进行二次醇沉。所得沉淀经冷冻干燥后分别得到新鲜罗汉果多糖(F-SGP)、热风干燥罗汉果多糖(H-SGP)、真空干燥罗汉果多糖(V-SGP)及微波干燥罗汉果多糖(M-SGP)。多糖得率计算如公式(1)所示:
多糖得率![]()
(1)
式中:m1,罗汉果多糖的质量,g;m2,罗汉果的质量,g。
1.3.3 分子质量及化学成分分析
采用凝胶色谱法(gel permeation chromatography,GPC)测定SGPs(2 mg/mL)的分子质量[7]。葡聚糖标准品(D2、D4、D6、D7、D8、D2000)用于分子质量测定,以保留时间为横坐标(X),lg Mw为纵坐标(Y),绘制标准曲线Y=-0.272 8X+9.523 7(R2=0.995 1),根据标准曲线计算多糖相对分子质量。
采用考马斯亮蓝法[14]测定SGPs中蛋白质含量,以蛋白质量浓度为横坐标(X),吸光度为纵坐标(Y)绘制标准曲线Y=8.648 7X+0.028 8(R2=0.991),根据标准曲线计算SGPs中蛋白质含量。
采用间羟基联苯法[15]测定SGPs中糖醛酸含量,以半乳糖醛酸质量浓度为横坐标(X),吸光度为纵坐标(Y)绘制标准曲线Y=0.021X+0.020 7(R2=0.995 7),根据标准曲线计算SGPs中糖醛酸含量。
1.3.4 单糖组成
称取1.5 mg多糖溶于3 mL三氟乙酸(2 mol/L),110 ℃水解5 h,加入3 mL甲醇,减压蒸发除去多余的三氟乙酸,加1.5 mL超纯水复溶,采用PMP柱前衍生法测定单糖组成[7]。HPLC检测:TC-C18色谱柱(250 mm×4.6 mm,5 μm),流动相为乙腈-磷酸缓冲液(17∶83,体积比)(pH=7.1),柱温30 ℃,流速1 mL/min,检测波长254 nm,进样量50 μL。
1.3.5 紫外及红外光谱
配制1 mg/mL SGPs溶液,200~400 nm范围内测定紫外吸光度。
称取干燥多糖2 mg与150 mg KBr混合研磨,压片,4 000~500 cm-1波数范围内扫描,根据峰面积计算酯化度(degree of esterification, DE),计算如公式(2)所示[2]:
(2)
式中:A1747、A1611,样品在1 747、1 611 cm-1附近处的峰面积。
1.3.6 核磁共振
称取干燥的SGPs各25 mg,溶解于600 μL D2O中,分析1H NMR和13C NMR。
1.3.7 微观结构观察
采用扫描电子显微镜对SGPs的表面微观结构进行观察。
1.3.8 刚果红实验
配制0.5 mg/mL多糖溶液和50 μmol/L刚果红溶液,等体积混匀后加入适量NaOH溶液(1 mol/L),使其NaOH溶液终浓度依次为0、0.1、0.2、0.3、0.4、0.5 mol/L,室温避光放置15 min,在400~600 nm范围内检测最大吸收波长。
1.3.9 抗氧化活性
1.3.9.1 DPPH自由基清除
参照HOU等[16]的方法并稍作修改。分别准确移取200 μL不同质量浓度(1、2、4、8、16 mg/mL)的多糖溶液和200 μL 0.3 mmo/L DPPH-无水乙醇溶液混匀,37 ℃避光反应30 min后在517 nm处测定吸光度值,维生素C作为阳性对照,清除率计算如公式(3)所示:
DPPH自由基清除率![]()
(3)
式中:A0,DPPH溶液的吸光度;A1,样品与DPPH溶液混合的吸光度;A2,样品的吸光度。
1.3.9.2 ABTS阳离子自由基清除
移取1.408 mL K2SO8溶液(140 mmol/L)与80 mL ABTS(7 mmol/L)溶液混匀,室温暗处静置12 h,蒸馏水稀释至734 nm处测得吸光度值稳定在0.70~0.75。移取20 μL不同质量浓度的多糖溶液(0.2、0.4、0.8、1.6、3.2 mg/mL)和200 μL ABTS溶液混匀,37 ℃避光反应30 min,734 nm处测定吸光度值。维生素C作为阳性对照,清除率按公式(4)计算:
ABTS阳离子自由基清除率![]()
(4)
式中:A3,ABTS溶液吸光度;A4,样品与ABTS混合液吸光度;A5,样品吸光度。
1.3.9.3 羟自由基清除
将2 mmol/L的FeSO4与1 mmol/L的H2O2混匀,室温避光反应3 h得羟自由基溶液。移取1.8 mL羟自由基溶液于试管中,加入200 μL不同质量浓度的多糖溶液(0.1、0.2、0.5、1、2、4 mg/mL),室温避光反应1 h后,加入2 mL水杨酸乙醇溶液(5 mmol/L),37 ℃水浴10 min,510 nm处测吸光度值。维生素C作为阳性对照,清除率按公式(5)计算:
羟自由基清除率![]()
(5)
式中:A6,不含样品溶液的吸光度;A7,样品溶液的吸光度。
1.4 统计学分析
每组数据重复测定3次,以“平均值±标准差”表示结果,Graphgad Prism 9.5进行统计分析,Origin 2021和Adobe Illustrator进行数据绘图,SPSS 22进行相关性分析。
2 结果与讨论
2.1 罗汉果多糖的提取
干燥方式影响SGPs的提取率和蛋白质含量。其中,H-SGP的提取率显著(P<0.05)高于鲜果及其他干燥果,达到(1.93±0.08)%。M-SGP的提取率最低,为(0.95±0.06)%,F-SGP和V-SGP的提取率分别为(1.30±0.05)%和(1.23±0.04)%。4个SGPs的蛋白质含量分别为(0.20±0.003)%(F-SGP),(0.33±0.001)%(H-SGP),(0.08±0.035)%(V-SGP)和(0.09±0.003)%(M-SGP),在0.08%~0.33%之间,样品纯度较高。H-SGP的提取率较高,可能是热风干燥过程中的高温促进了多糖的热降解,增加透过细胞壁的低分子质量多糖,更易被溶媒介质提取。V-SGP和M-SGP的蛋白质含量低,可能是真空干燥中产生的压力差膨胀作用,和微波干燥过程的膨化效应破坏了蛋白质的结构,引起可溶性蛋白含量降低[17]。
2.2 分子质量的测定
如图1所示,F-SGP和M-SGP的分子质量分布相似,由2部分组成,平均分子质量分别为1 340、367 kDa。V-SGP分子质量分布较均一,为1 200 kDa。H-SGP则由4个部分组成,分别为1 420、385、94.7、2.05 kDa,表明热风干燥过程中的高温可能促进SGPs的热降解,低分子质量组分的比重增加,使得分子质量分布范围变广。YAN等[18]发现高温干燥会显著降低苦瓜多糖的相对分子质量。
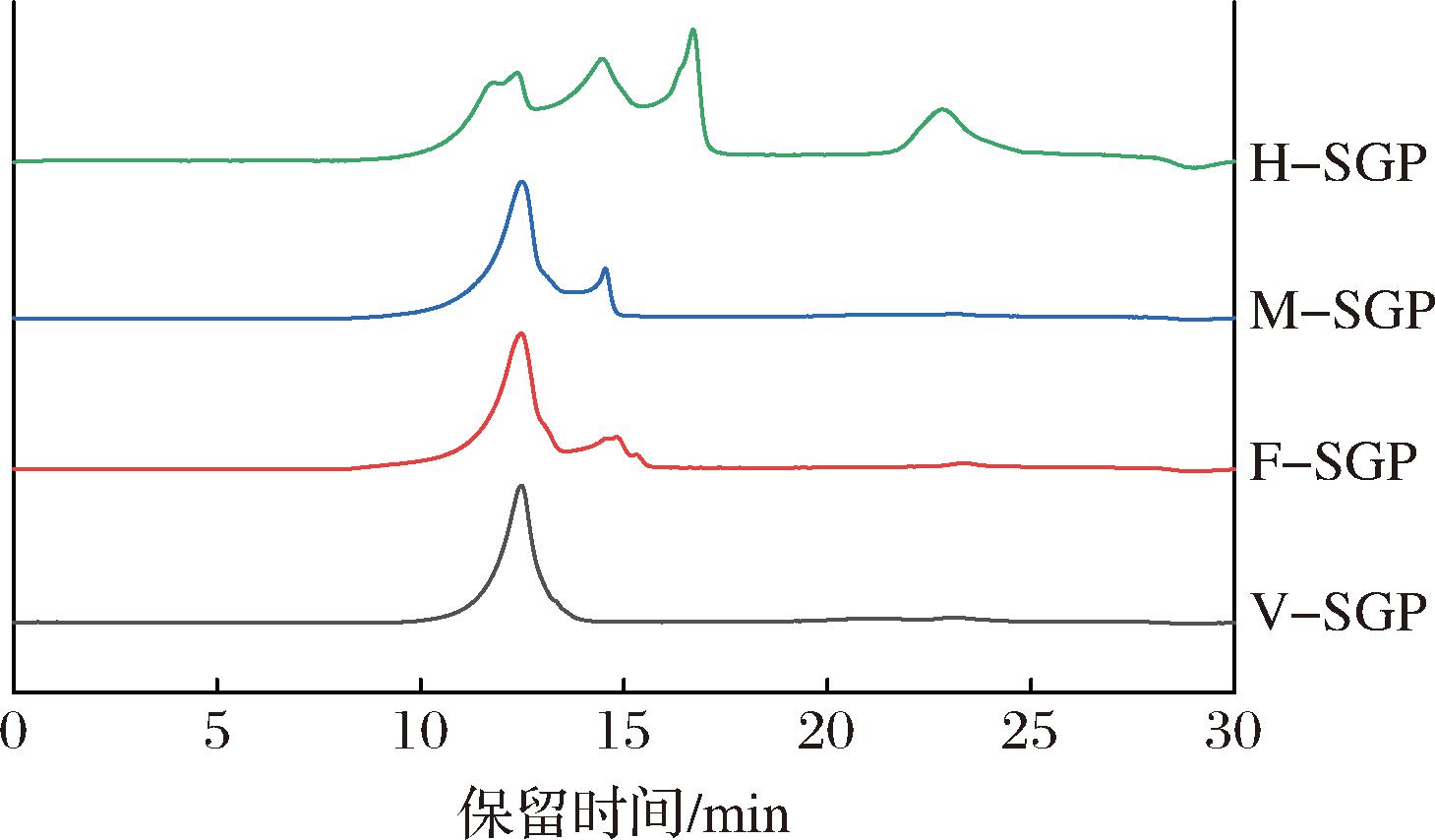
图1 四个SGPs的HPGPC图谱
Fig.1 HPGPC chromatography of the four SGPs
2.3 化学组成
F-SGP、H-SGP、V-SGP和M-SGP的糖醛酸含量分别为(52.43±3.58)%、(23.87±0.90)%、(62.99±2.41)%和(55.15±1.95)%,表明4个SGPs都是酸性多糖。H-SGP较低的糖醛酸含量可能是热风干燥的高温环境对糖醛酸造成了破环[19]。如图2所示,4个SGPs均由甘露糖(Man)、鼠李糖(Rha)、葡萄糖醛酸(GluA)、半乳糖醛酸(GalA)、葡萄糖(Glu)、半乳糖(Gal)和阿拉伯糖(Ara)组成,单糖摩尔比分别为0.36∶1.18∶0.25∶21.12∶8.24∶3.23∶2.49(F-SGP)、0.35∶0.59∶0.30∶7.76∶3.23∶1.73∶1.41(H-SGP)、0.50∶1.38∶0.32∶32.07∶6.24∶4.42∶3.06(V-SGP)和0.46∶1.32∶0.28∶25.25∶2.07∶3.66∶2.89(M-SGP)。GalA在4个SGPs中的比例最高,摩尔百分比分别为57.28%(F-SGP)、50.49%(H-SGP)、66.83%(V-SGP)和70.28%(M-SGP),表明这4个SGPs均为果胶型多糖。果胶多糖的同型半乳糖醛酸聚糖(homogalacturonan,HG)结构域是由GalA通过α-1,4糖苷键连接而成的线性均聚物,I型鼠李半乳糖醛酸聚糖(type I rhamngalacturonan,RG-I)结构域主要由Rha和GalA残基交替形成主链,其侧链由半乳聚糖、阿拉伯聚糖和阿拉伯半乳聚糖3种聚合物组成。根据HG(%)=GalA-Rha及RG-Ι(%)=2Rha+Gal+Ara[20]计算4个SGPs的RG-I和HG结构域占比分别为21.91%和54.08%(F-SGP)、37.86%和46.65%(H-SGP)、21.34%和63.95%(V-SGP)、25.57%和66.61%(M-SGP)。由此可见,微波干燥与真空干燥果中提取的罗汉果多糖的HG结构占比更高,而热风干燥则提高了RG-I结构域的比例,说明干燥方式虽然对SGPs的单糖组成无影响,但显著影响单糖的比例和结构。
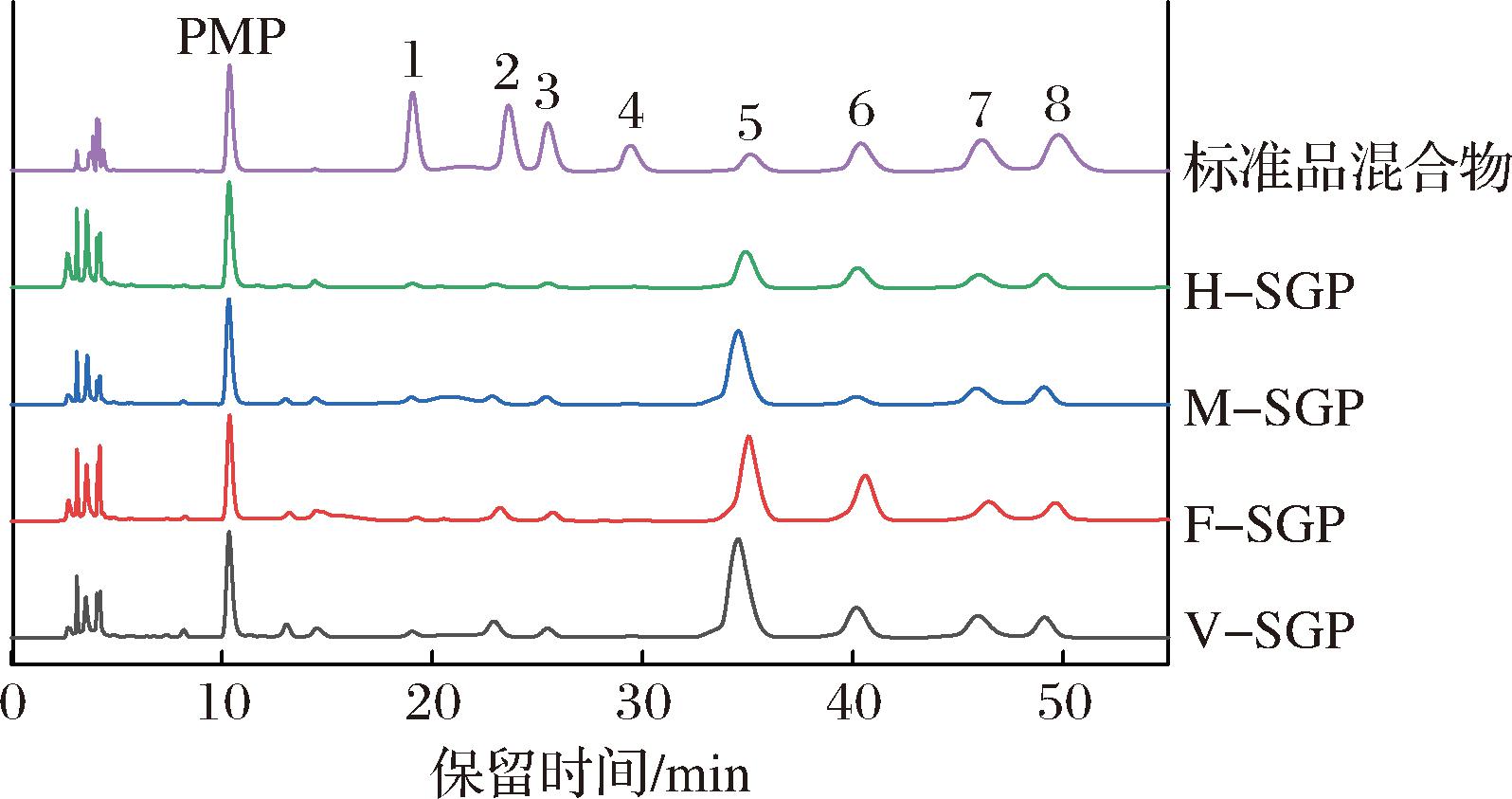
图2 SGPs的单糖组成HPLC图
Fig.2 HPLC of monosaccharide compositions of SGPs
注:峰1~8分别是甘露糖、核糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖。
2.4 紫外可见光谱和红外光谱
如图3-a所示,4个SGPs在260、280 nm处无明显紫外吸收峰,表明提取的多糖基本不含核酸和蛋白质,纯度较高,这与蛋白含量的检测结果一致。如图3-b所示,4个SGPs在4 000~500 cm-1波数范围内显示出相似的多糖吸收峰。其中,3 414 cm-1是羟基(O—H)振动吸收峰,2 936 cm-1为游离糖C—H伸缩振动吸收峰,1 747 cm-1为酯化羧基的伸缩振动,表明酸性多糖发生了酯化,而1 610 cm-1的吸收峰为羰基(C![]() O)的不对称伸缩振动,表明SGPs中存在糖醛酸,与所测单糖组成相符。1 413 cm-1处可能为C—H伸缩振动或O—H变形振动,1 233 cm-1吸收峰为C—H的弯曲振动吸收峰,1 105、1 017 cm-1处的吸收峰表明存在吡喃糖环[21]。832 cm-1附近的吸收峰表明存在α型糖苷键。果胶多糖可以根据酯化程度的不同,分为高酯化果胶(DE>50%)和低酯化果胶(DE<50%),可通过红外光谱图中1 747 cm-1附近处酯化羧基伸缩振动信号与1 610 cm-1附近处的游离羰基伸缩振动信号之间的峰面积比值来量化酯化程度[22]。F-SGP、H-SGP、M-SGP和V-SGP的DE分别为48.49%、37.66%、42.38%和48.74%,均小于50%,属于低酯化果胶。H-SGP的DE最低,可能是烘干过程中的较高温度导致半乳糖醛酸链的脱酯化[23]。
O)的不对称伸缩振动,表明SGPs中存在糖醛酸,与所测单糖组成相符。1 413 cm-1处可能为C—H伸缩振动或O—H变形振动,1 233 cm-1吸收峰为C—H的弯曲振动吸收峰,1 105、1 017 cm-1处的吸收峰表明存在吡喃糖环[21]。832 cm-1附近的吸收峰表明存在α型糖苷键。果胶多糖可以根据酯化程度的不同,分为高酯化果胶(DE>50%)和低酯化果胶(DE<50%),可通过红外光谱图中1 747 cm-1附近处酯化羧基伸缩振动信号与1 610 cm-1附近处的游离羰基伸缩振动信号之间的峰面积比值来量化酯化程度[22]。F-SGP、H-SGP、M-SGP和V-SGP的DE分别为48.49%、37.66%、42.38%和48.74%,均小于50%,属于低酯化果胶。H-SGP的DE最低,可能是烘干过程中的较高温度导致半乳糖醛酸链的脱酯化[23]。
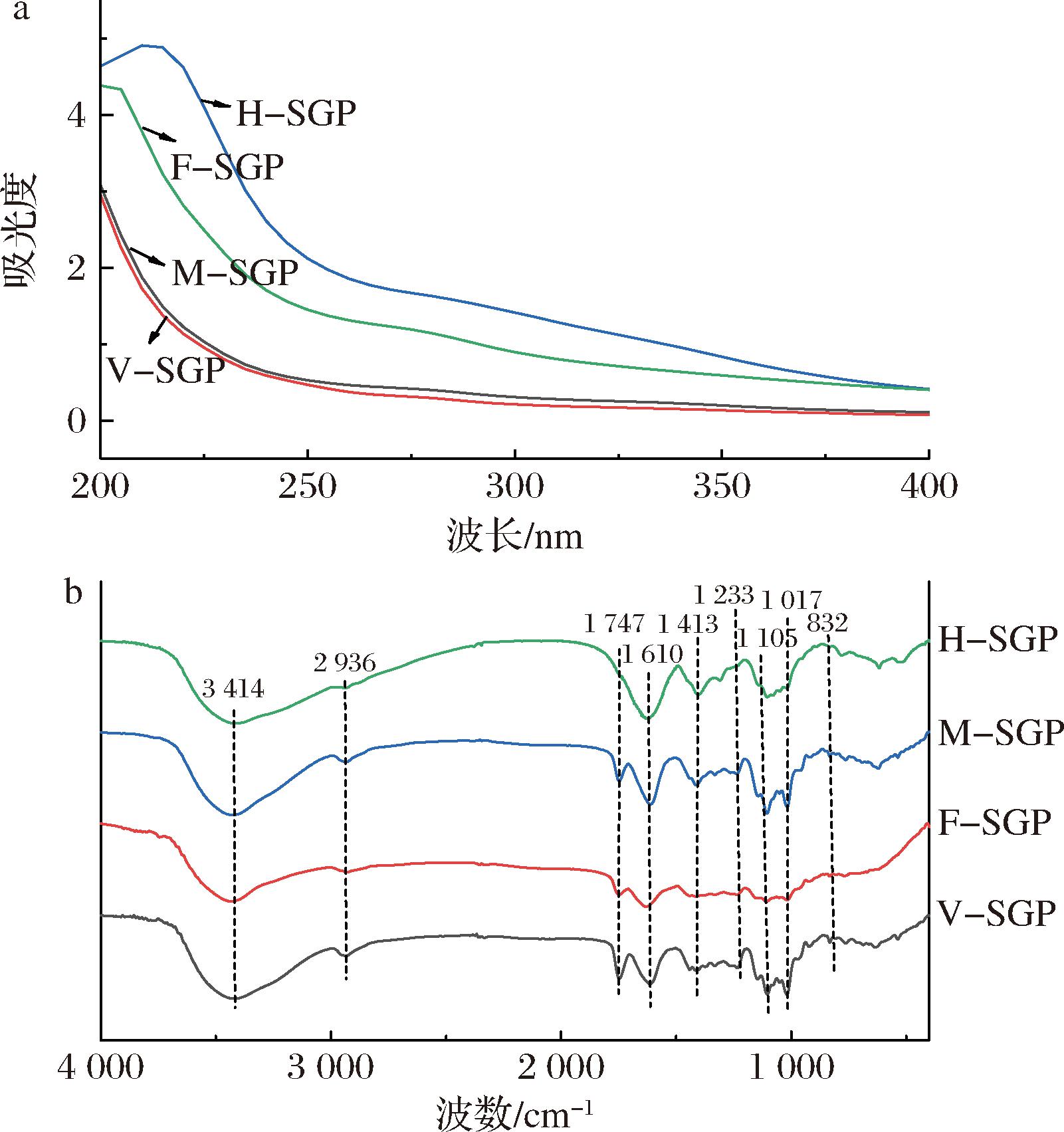
a-紫外光谱;b-红外光谱
图3 SGPs的紫外光谱与红外光谱
Fig.3 UV spectra and FT-IR spectra of SGPs
2.5 核磁共振分析
糖环中异头氢通常出现δ 4.0~5.5 ppm,异头碳出现在δ 95~110 ppm,其中1H NMR和13C NMR在δ 4.8~5.5 ppm和δ 95~102 ppm为α-糖苷键,δ 4.0~4.8 ppm和δ 102~110 ppm为β-糖苷键[24]。如图4所示,4个SGPs的1H NMR信号集中在δ 3.0~5.5 ppm,13C NMR信号集中在δ 60~110 ppm,是多糖的典型信号。在F-SGP的NMR中有2个明显的α型异头氢(5.06、4.95 ppm)和2个异头碳(99.24、97.53 ppm),根据其单糖组成和相关文献推断δ 4.95/97.53 ppm可能为α-Glcp的异头信号,δ 5.06/99.24 ppm可能是α-GalpA的异头信号,而δ 3.77/52.88 ppm为酯化的甲基信号,δ 1.10/16.80 ppm为鼠李糖信号峰[25-27]。在H-SGP中有1个异头氢δ 5.05 ppm和一个异头碳δ 95.97 ppm,推测δ 5.05 ppm可能为α-GalpA的异头氢信号,δ 1.10/16.73 ppm为鼠李糖信号。在M-SGP中有2个α型异头氢(5.05、4.93 ppm)和1个异头碳(100.24 ppm),推测δ 5.05 ppm可能为α-GalpA的异头氢信号,δ 4.93/100.24 ppm可能为α-D-Galp的异头信号[28],δ 170.67 ppm处为半乳糖醛酸信号。V-SGP中有2个α型异头氢(5.06、4.94 ppm)和2个的异头碳信号(100.40、99.47 ppm),推测δ 5.06/99.47 ppm可能为α-GalpA的异头信号,δ 4.94/100.40 ppm可能为α-D-Galp的异头信号,而δ 3.77/52.88 ppm为羧基甲酯化信号,δ 1.15/16.80 ppm为鼠李糖信号,δ 170.51 ppm处为半乳糖醛酸信号。4种方式提取的多糖谱图在δ 82-84 ppm处均未见信号,表明不含有呋喃糖,这与红外光谱分析的结果相符。由于SGPs分子质量大,粗多糖结构复杂,一维核磁谱图峰的堆叠严重,从谱图中仅能获得部分信息。
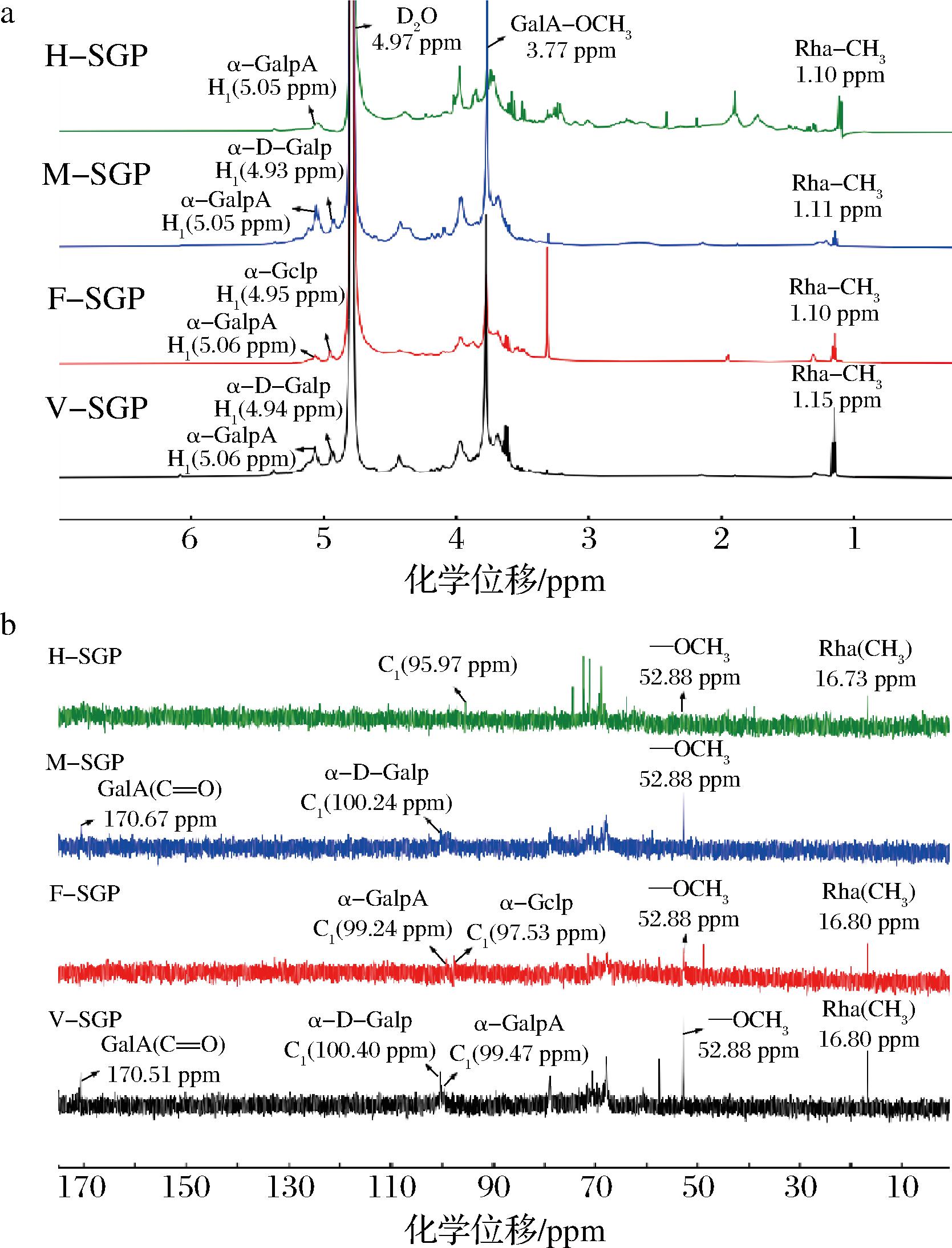
a-1H NMR;b-13C NMR
图4 SGPs的1H NMR和13C NMR
Fig.4 1H NMR and 13C NMR of the four SGPs
2.6 微观结构
如图5所示,干燥方式会影响罗汉果多糖的微观结构。F-SGP呈现不规则片状结构,厚片边缘较锋利,片状表面较粗糙,带有一些碎屑;V-SGP呈现不规则致密的片状结构,表面有褶皱,可能与真空干燥过程中内部压强较低有关;H-SGP呈现大小不一的带孔块状结构,块状表面类似鱼鳞状,孔洞周边存在细小裂纹,可能由于热风干燥过程中,温度梯度和流动水分的相反运动阻碍了罗汉果中水分的向外扩散,使其多糖内部结构发生不可逆性裂解和破坏,从而导致表面粗糙且塌陷出现孔洞结构[29];M-SGP呈现不规则致密的带孔片且边缘不规则卷曲结构,则是由于罗汉果内部吸收微波能量并剧烈移动,分子间相互作用破坏了内部结构,导致大孔洞的出现[30]。

a-×50 F-SGP;b-×50 V-SGP;c-×50 H-SGP;d-×50 M-SGP;e-×200 F-SGP;f-×200 V-SGP;g-×200 H-SGP;h-×200 M-SGP
图5 四个SGPs的扫描电镜图
Fig.5 SEM of four SGPs
2.7 刚果红实验
碱性条件下,具有三股螺旋构象的多糖能与刚果红染色剂形成络合物,使得λmax发生红移,而当三股螺旋解链后,多糖-刚果红络合物的λmax值会降低。如图6所示,F-SGP和H-SGP多糖与刚果红溶液混匀后,随着NaOH浓度(0~0.4 mol/L)的增加,λmax逐渐增加,而当NaOH浓度高于0.4 mol/L时,多糖溶液的最大吸收波长不再增加,提示F-SGP和H-SGP可能具有三股螺旋构象。M-SGP和V-SGP多糖与刚果红溶液混匀后,λmax发生轻微红移,这可能是由于罗汉果多糖分子质量较大,在水溶液中呈现无规则卷曲构象。但随着NaOH溶液浓度的增加,M-SGP和V-SGP的λmax值持续减小,表明M-SGP和V-SGP不含三股螺旋结构。
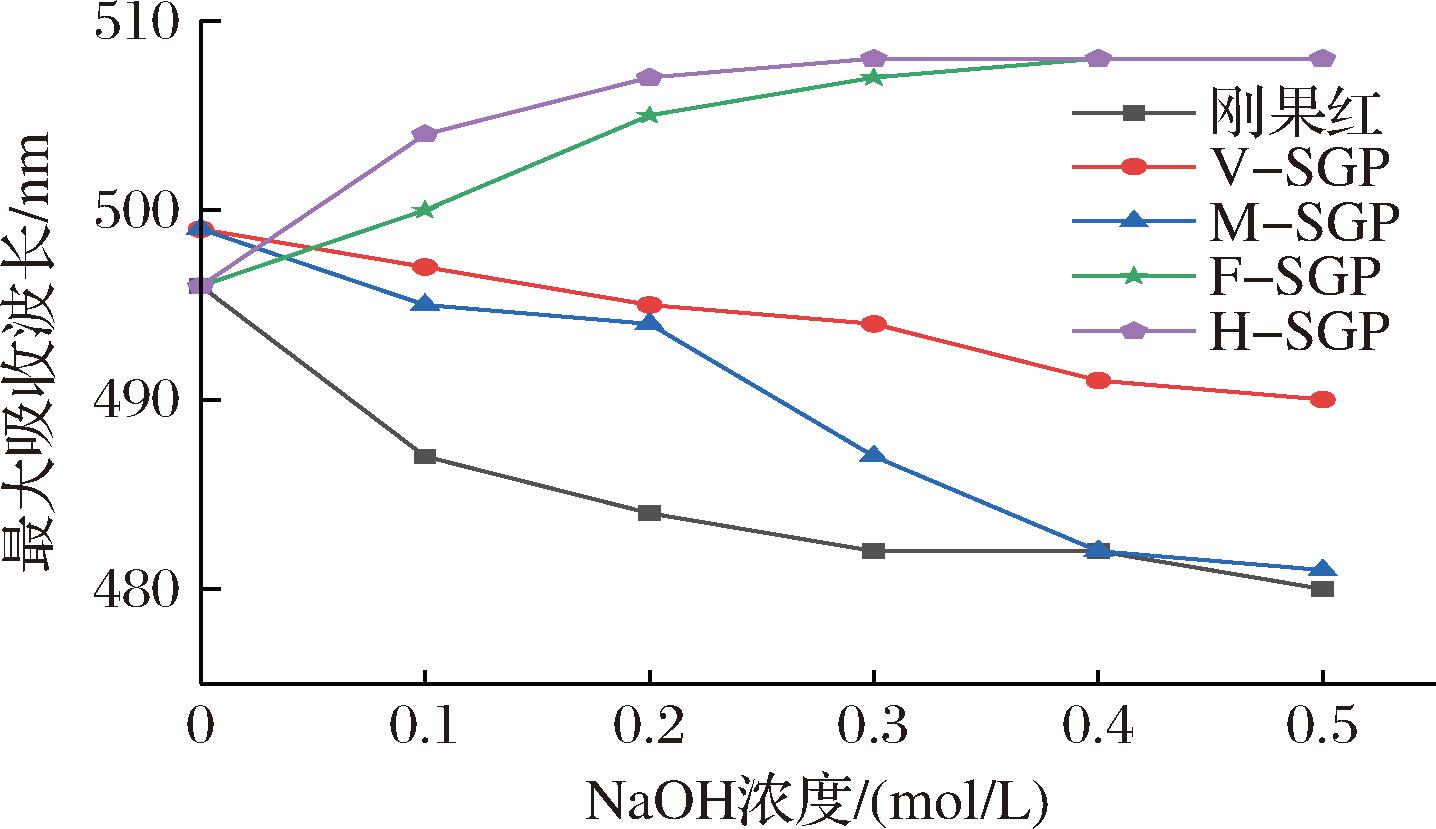
图6 刚果红检测
Fig.6 Congo red experiment
2.8 抗氧化活性
植物源多糖,特别是中草药多糖,因其良好的抗氧化活性和低毒性成为广泛认可的天然抗氧化剂[31]。然而,不同物料来源的多糖具有不同的理化特征,可能导致抗氧化活性的差异。因此,评估和比较不同干燥加工的罗汉果多糖的抗氧化活性有助于开发基于罗汉果的天然抗氧化剂。DPPH自由基和ABTS阳离子自由基清除活性已被广泛用于评估多糖的抗氧化能力。羟自由基是生物体内的一种非常重要的活性氧,对细胞膜具有很强的穿透力,其与细胞内的蛋白质、核酸、脂质等生物大分子发生反应会引起细胞毒性反应。因此,抗氧化剂对DPPH、ABTS阳离子及羟自由基的清除能力是评价抗氧化剂活性的重要指标。
2.8.1 DPPH自由基清除率
如图7-a所示,4个多糖对DPPH自由基均有良好的清除能力,且呈现浓度正相关性。当多糖溶液质量浓度达到8 mg/mL之后,H-SGP和M-SGP对DPPH自由基的清除率增长速度逐渐平缓,而F-SGP和V-SGP对DPPH自由基的清除率依旧显著增加。F-SGP、H-SGP、M-SGP和V-SGP清除DPPH自由基的EC50分别4.47、1.19、4.26、5.67 mg/mL,表明H-SGP对DPPH自由基的清除能力强于其他3个多糖。多糖的抗氧化活性与其分子质量有关,大分子多糖难以跨越多重细胞膜障碍进体内发挥生物学活性,小分子多糖有更多的羟基基团能与自由基结合表现出更强的还原力。YANG等[32]从人参中分离得到5个分子质量在4.81~109 kDa范围的多糖(ZP1、ZP2、ZP3、ZP4、ZP5),其中分子质量最小的ZP5多糖(4.81 kDa)对DPPH自由基的清除能力最强。在本实验中与F-SGP、M-SGP和V-SGP相比,H-SGP的分子质量分布范围更广,低分子质量片段较多,对DPPH自由基的清除能力也最强。
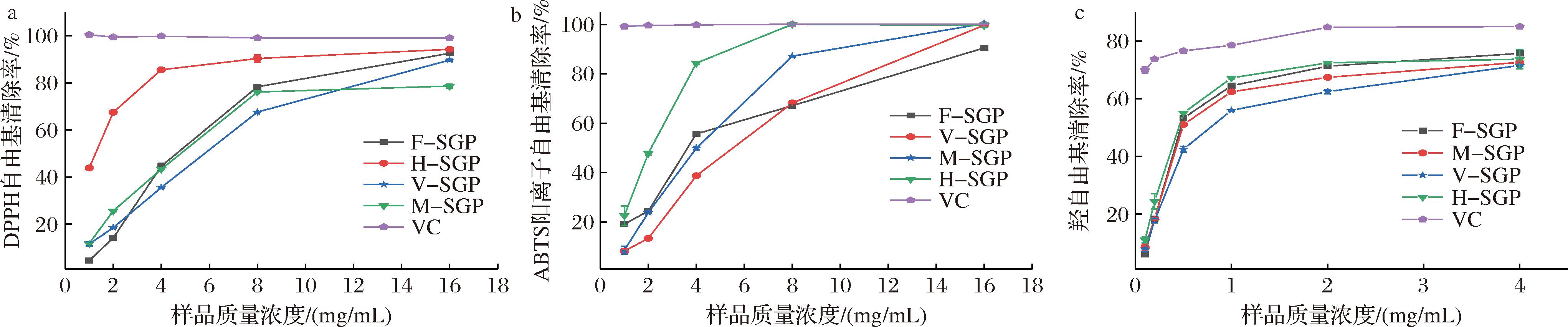
a-DPPH自由基清除率;b-ABTS阳离子自由基清除率;c-羟自由基清除率
图7 SGPs对DPPH、ABTS阳离子以及羟自由基的清除能力
Fig.7 Scavenging abilities of SGPs to DPPH, ABTS cation free, and hydroxyl free radicals
2.8.2 ABTS阳离子自由基清除率
如图7-b所示,4个多糖对ABTS阳离子自由基均呈现较好的清除能力,且随着浓度的递增,清除率也随之增加。当多糖质量浓度达到8 mg/mL时,对ABTS的清除能力依次为H-SGP(100.10%)>M-SGP(87.20%)>V-SGP(68.23%)>F-SGP(67.15%),其中H-SGP对ABTS阳离子自由基的清除效果接近阳性对照维生素C。4个SGPs ABTS阳离子自由基的清除率EC50值分别为3.85 mg/mL(F-SGP)、5.46 mg/mL(V-SGP)、3.76 mg/mL(M-SGP)、1.95 mg/mL(H-SGP),说明H-SGP对ABTS阳离子自由基的清除能力最强,V-SGP作用最弱。多糖的抗氧活性与其酯化程度也有一定关系,DE越低表明含未酯化的半乳糖醛酸数量越多,与自由基的结合能力就越强。YUAN等[33]探究干燥方式对秋葵多糖结构及活性影响的实验中发现,与微波干燥和冷冻干燥处理的秋葵相比,热风干燥秋葵提取的多糖(polysaccharide from hot air driying okra fruits, OPP-H)对ABTS阳离子自由基清除能力更强,其原因是OPP-H的DE更低。在本实验中4种多糖的酯化程度:V-SGP(48.74%)>F-SGP(48.49%)>M-SGP(42.38%)>H-SGP(37.66%),H-SGP酯化程度最低,对ABTS阳离子自由基清除能力也最强。
2.8.3 羟自由基清除率
如图7-c所示,4个多糖对羟自由基的清除率随着多糖质量浓度增加而升高,其EC50值分别为0.49 mg/mL(F-SGP)、0.43 mg/mL(H-SGP)、0.53 mg/mL(M-SGP)、0.75 mg/mL(V-SGP)。在2 mg/mL质量浓度下,SGPs对羟自由基的清除率分别为71.28%(F-SGP)、72.47%(H-SGP)、67.44%(M-SGP)和62.47%(V-SGP),表明H-SGP对羟自由基的清除能力略强。多糖的抗氧活性与蛋白含量也有一定关系,蛋白质中的胺基基团能进行裂解与自由基稳定的结合。陈欢等[34]发现,与热风干燥和真空干燥相比,冷冻干燥得到的川芎多糖蛋白质含量最高,对羟自由基的清除能力最强。在本实验中H-SGP的蛋白质含量最高,达到(0.33±0.001)%,对羟自由基的清除效果最优。
2.9 相关性分析
运用SPSS中Spearman相关系数检验分析,进一步探究所得罗汉果多糖结构与抗氧化活性之间的关系,结果如表1所示。SGPs对羟自由基、DPPH自由基及ABTS阳离子自由基的清除能力与单糖比例、蛋白含量、结构域占比、DE的Spearman相关系数均较高。DPPH自由基与ABTS阳离子自由基的EC50值与单糖Man、GlcA、Glc、Gal和Ara的摩尔质量百分比、蛋白含量以及RG-I结构域占比呈负相关(-0.410~-0.973);但与GalA的百分比、DE值以及HG结构域占比呈正相关(0.399~0.801)。其中,SGPs对DPPH自由基的清除能力与Man和GlcA的百分含量及RG-I结构域占比显著相关(P<0.05)。羟自由基的EC50值与Man、GlcA、Glc、蛋白含量及RG-I结构域占比呈负相关(-0.364~-0.920),而与GalA、DE及HG结构域占比呈正相关(0.660~0.854)。在4个SGPs中,H-SGP的Man、GlcA、蛋白及RG-I结构域的百分含量均最高,抗氧化活性也最强。这些结果表明,干燥方式引起的罗汉果多糖的抗氧化活性差异与多糖自身的结构相关,是多种结构因素共同作用的结果。
表1 Spearman相关系数分析
Table 1 Spearman correlation analysis
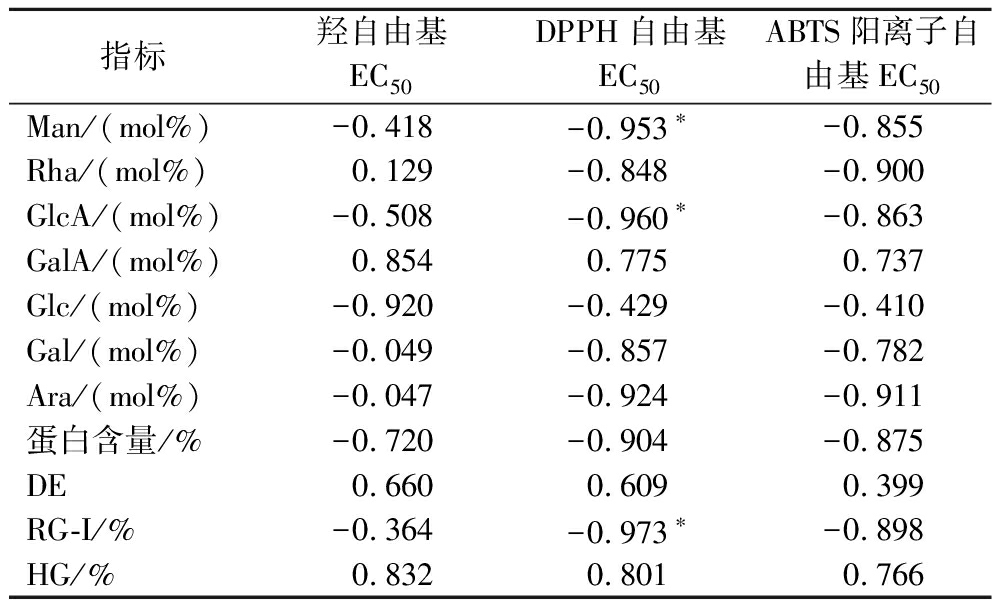
指标羟自由基EC50DPPH自由基EC50ABTS阳离子自由基EC50Man/(mol%)-0.418-0.953∗-0.855Rha/(mol%)0.129-0.848-0.900GlcA/(mol%)-0.508-0.960∗-0.863GalA/(mol%)0.8540.7750.737Glc/(mol%)-0.920-0.429-0.410Gal/(mol%)-0.049-0.857-0.782Ara/(mol%)-0.047-0.924-0.911蛋白含量/%-0.720-0.904-0.875DE0.6600.6090.399RG-I/%-0.364-0.973∗-0.898HG/%0.8320.8010.766
注:*双侧显著相关(P<0.05)。
3 结论
本研究采用水提醇沉法新鲜及不同干燥处理的罗汉果的多糖组分进行提取,通过多光谱检测解析多糖结构,并比较其抗氧化活性。结果表明,所得4个罗汉果多糖为果胶型多糖,以HG结构域为主,并包含RG-I结构域。单糖组成相同,均由甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖7种单糖构成,但单糖比例、分子质量分布和微观结构存在显著差异。其中,H-SGP的提取率和蛋白质含量最高,但糖醛酸含量和DE都较低,且分子质量分布更广泛。自由基清除实验发现,4个多糖表现出良好的抗氧化活性。其中,H-SGP对DPPH自由基、ABTS阳离子自由基和羟自由基的清除能力最强,EC50分别为1.19、1.95、0.43 mg/mL。多糖的抗氧化能力与其化学性质、分子质量、单糖组成、DE、蛋白含量等诸多因素密切相关。在本实验中,从热风干燥罗汉果中提取的多糖H-SGP的抗氧化能力最强,这可能是其单糖组成、较多的低分子质量组分、较高的蛋白质含量以及较低的DE共同作用的结果。综上可见,罗汉果的干燥方式显著影响其多糖组分的提取率、理化特征和抗氧化活性,而热风干燥罗汉果的多糖具有更优异的抗氧化能力,可为罗汉果的干燥加工和后续的功能产品开发提供参考。
[1] BRIEGER K, SCHIAVONE S, MILLER F J Jr, et al.Reactive oxygen species:From health to disease[J].Swiss Medical Weekly, 2012, 142:w13659.
[2] WU D T, LIU W, HAN Q H, et al.Physicochemical characteristics and antioxidant activities of non-starch polysaccharides from different kiwifruits[J].International Journal of Biological Macromolecules, 2019, 136:891-900.
[3] FERNANDES P A R, COIMBRA M A.The antioxidant activity of polysaccharides:A structure-function relationship overview[J].Carbohydrate Polymers, 2023, 314:120965.
[4] 李皓翔, 范卫锋, 郑依玲, 等.罗汉果的本草考证[J].时珍国医国药, 2020, 31(6):1376-1379.LI H X, FAN W F, ZHENG Y L, et al.Textual research on herbal medicine of Siraitia grosvenorii[J].Lishizhen Medicine and Materia Medica Research, 2020, 31(6):1376-1379.
[5] 张立娟. 罗汉果多糖的提取、结构分析及抗氧化活性研究[D].天津:天津科技大学, 2019.ZHANG L J.Extracting, structure analysis and antioxidant activity of a polysaccharide from Siraitia grosvenorii[D].Tianjin:Tianjin University of Science and Technology, 2019.
[6] GONG P, CUI D D, GUO Y X, et al.A novel polysaccharide obtained from Siraitia grosvenorii alleviates inflammatory responses in a diabetic nephropathy mouse model via the TLR4-NF-κB pathway[J].Food &Function, 2021, 12(19):9054-9065.
[7] 张巧铃, 蒋小华, 张洁, 等.罗汉果干果多糖的分离纯化、结构表征及其体外免疫调节活性[J].食品科学, 2025, 46(4):10-20.ZHANG Q L, JIANG X H, ZHANG J, et al.Isolation, purification and structural characterization of polysaccharides from dried Siraitia grosuenorii fruits and their immunodulatory activity in vitro[J].Food Science, 2025, 46(4):10-20.
[8] ZHU Y M, PAN L C, ZHANG L J, et al.Chemical structure and antioxidant activity of a polysaccharide from Siraitia grosvenorii[J].International Journal of Biological Macromolecules, 2020, 165:1900-1910.
[9] GONG P, GUO Y X, CHEN X F, et al.Structural characteristics, antioxidant and hypoglycemic activities of polysaccharide from Siraitia grosvenorii[J].Molecules, 2022, 27(13):4192.
[10] 方秀云, 韦玉璐, 卢凤来, 等.干燥处理对罗汉果抗炎活性及功能成分的影响[J].食品与发酵工业, 2025, 51(5):291-298;370.FANG X Y, WEI Y L, LU F L, et al.Effects of drying methods on anti-inflammatory activity and functional components of Siraitia grosvenorii[J].Food and Fermentation Industries, 2025, 51(5):291-298;370.
[11] LIU Y, LUO M L, LIU F, et al.Effects of freeze drying and hot-air drying on the physicochemical properties and bioactivities of polysaccharides from Lentinula edodes[J].International Journal of Biological Macromolecules, 2020, 145:476-483.
[12] WANG Y, LI X, ZHAO P, et al.Physicochemical characterizations of polysaccharides from Angelica sinensis Radix under different drying methods for various applications[J].International Journal of Biological Macromolecules, 2019, 121:381-389.
[13] FU Y, FENG K L, WEI S Y, et al.Comparison of structural characteristics and bioactivities of polysaccharides from loquat leaves prepared by different drying techniques[J].International Journal of Biological Macromolecules, 2020, 145:611-619.
[14] CHEN J C, LI L, ZHANG X, et al.Structural characteristics and antioxidant and hypoglycemic activities of a heteropolysaccharide from Anemarrhena asphodeloides Bunge[J].International Journal of Biological Macromolecules, 2023, 236:123843.
[15] 乔艳艳, 蒋洪洲, 李冬男, 等.蓝莓多糖的结构解析、抗氧化及抗菌活性[J].食品科学, 2024, 45(21):94-103.QIAO Y Y, JIANG H Z, LI D N, et al.Structural characterization, antioxidant and antibacterial activities of polysaccharides from blueberry[J].Food Science, 2024, 45(21):94-103.
[16] HOU S T, ZHANG D F, YU D M, et al.Effect of different drying methods on the quality of Oudemansiella raphanipes[J].Foods, 2024, 13(7):1087.
[17] 胡方洋, 陈金玉, 王轻, 等.不同干燥方式对苦荞蛋白功能性质的影响[J].食品科技, 2020, 45(1):103-108.HU F Y, CHEN J Y, WANG Q, et al.Effects of different drying methods on functional properties of Tartary buckwheat protein[J].Food Science and Technology, 2020, 45(1):103-108.
[18] YAN J K, WU L X, QIAO Z R, et al.Effect of different drying methods on the product quality and bioactive polysaccharides of bitter gourd (Momordica charantia L.) slices[J].Food Chemistry, 2019, 271:588-596.
[19] HUANG L L, QIAO F, PENG G, et al.Effect of two drying methods on antioxidant activity and hypoglycemic action of polysaccharides in three cultivars of lychee pulp[J].Drying Technology, 2017, 35(16):1994-2001.
[20] ZHU M Q, HUANG R M, WEN P, et al.Structural characterization and immunological activity of pectin polysaccharide from kiwano (Cucumis metuliferus) peels[J].Carbohydrate Polymers, 2021, 254:117371.
[21] LI C, ZHANG Y, ZHAO C H, et al.Physicochemical characterization, antioxidative and immunoregulatory activity of polysaccharides from the flower of Hylocereus undatus (Haw.) Britton et Rose[J].International Journal of Biological Macromolecules, 2023, 251:126408.
[22] 干鸿翔, 杨笑妮, 谢凡, 等.脐橙皮果胶的提取、结构特征及流变特性[J].食品与发酵工业, 2025, 51(7):276-285.GAN H X, YANG X N, XIE F, et al.Extraction, structural characterization and rheological properties of pectin from navel orange peels[J].Food and Fermentation Industries, 2025, 51(7):276-285.
[23] FU Y, LI F, DING Y, et al.Polysaccharides from loquat (Eriobotrya japonica) leaves:Impacts of extraction methods on their physicochemical characteristics and biological activities[J].International Journal of Biological Macromolecules, 2020, 146:508-517.
[24] LI Y M, GUO X X, ZHONG R F, et al.Structure characterization and biological activities evaluation of two hetero-polysaccharides from Lepista nuda: Cell antioxidant, anticancer and immune-modulatory activities[J].International Journal of Biological Macromolecules, 2023, 244:125204.
[25] TANG W, LIU D, WANG J Q, et al.Isolation and structure characterization of a low methyl-esterified pectin from the tuber of Dioscorea opposita Thunb[J].Food Chemistry, 2021, 359:129899.
[26] JIANG S, WANG Q B, WANG Z B, et al.Ultrasound-assisted polysaccharide extraction from Fritillaria ussuriensis Maxim.and its structural characterization, antioxidant and immunological activity[J].Ultrasonics Sonochemistry, 2024, 103:106800.
[27] GAN T S, FENG C, LAN H B, et al.Comparison of the structure and immunomodulatory activity of polysaccharides from fresh and dried Longan[J].Journal of Functional Foods, 2021, 76:104323.
[28] YU Y, NIE J N, ZHAO B, et al.Structure characterization and anti-fatigue activity of an acidic polysaccharide from Panax ginseng C.A.Meyer[J].Journal of Ethnopharmacology, 2023, 301:115831.
[29] AN K J, WU J J, XIAO H W, et al.Effect of various drying methods on the physicochemical characterizations, antioxidant activities and hypoglycemic activities of lychee (Litchi chinensis Sonn.) pulp polysaccharides[J].International Journal of Biological Macromolecules, 2022, 220:510-519.
[30] YANG D, WU G C, LI P Y, et al.Effect of microwave heating and vacuum oven drying of potato strips on oil uptake during deep-fat frying[J].Food Research International, 2020, 137:109338.
[31] 武晓艳, 叶钰怡, 任文凯, 等.植物多糖研究进展:功能活性及潜在机制[J].中国科学:生命科学, 2023, 53(6):808-824.WU X Y, YE Y Y, REN W K, et al.Research progress of plant polysaccharides:Functional activities and potential mechanisms[J].Scientia Sinica (Vitae), 2023, 53(6):808-824.
[32] YANG X L, WANG R F, ZHANG S P, et al.Polysaccharides from Panax japonicus C.A.Meyer and their antioxidant activities[J].Carbohydrate Polymers, 2014, 101:386-391.
[33] YUAN Q, HE Y, XIANG P Y, et al.Influences of different drying methods on the structural characteristics and multiple bioactivities of polysaccharides from okra (Abelmoschus esculentus)[J].International Journal of Biological Macromolecules, 2020, 147:1053-1063.
[34] 陈欢, 姜媛媛, 徐峰, 等.不同干燥方式对川芎多糖理化性质及抗氧化活性的影响[J].中成药, 2021, 43(1):173-177.CHEN H, JIANG Y Y, XU F, et al.Effects of different drying methods on physicochemical properties and antioxidant activity of Chuanxiong polysaccharide[J].Chinese Traditional Patent Medicine, 2021, 43(1):173-177.