我国作为豆制品消耗大国,每年约有4 400万t湿豆渣产生。豆渣中富含蛋白质、膳食纤维、异黄酮等营养物质[1-2],但水分和蛋白质含量较高,口感较差且易腐败变质,使其在食品加工中的利用率较低[3-5]。固态发酵是利用微生物在固体培养基上进行生物转化,提升各类基质的营养价值和功能特性。通过杏鲍菇的固态发酵处理,可以生成多种活性物质和复杂酶系,从而改善豆渣口感,提升营养价值及产品的生物活性,为其综合利用提供新途径并提供数据支持[6]。
豆渣固态发酵培养杏鲍菇的最适条件为培养温度28 ℃,含水量70%以及菌种接种量10%[7],碳氮比在30∶1~60∶1范围内[8-9]。豆渣培养杏鲍菇菌丝体培养基的优化配方为添加质量分数为2%的蔗糖,质量分数为0.1%的尿素[10]。杏鲍菇发酵豆渣,主要涉及固态发酵产酶[11]、固态发酵豆渣产生功能物质[12]、固态发酵豆渣提升抗氧化物质含量[13]、液态发酵提高可溶性膳食纤维[14]等。提高豆渣营养成分与抗氧化活性的主要研究包括:豆渣的酵母代谢[15]、酿酒酵母对豆渣进行固态发酵[16]、灵芝菌丝体固态发酵[17]、米根霉和少孢根霉发酵豆渣[18]。应用方面主要为豆渣杏鲍菇菌丝曲奇饼干的配方优化[19]和利用聚γ-谷氨酸产生菌固态发酵豆渣作为饲料添加剂[20]。关于杏鲍菇在固态发酵豆渣过程中营养成分和抗氧化活性变化的研究在文献中未见报道。
营养成分的转化与利用和抗氧化活性物质是影响豆渣利用率的重要因素,其决定着豆渣的营养价值和口感。利用杏鲍菇固态发酵豆渣,测定发酵过程中氨基酸态氮、粗脂肪、可溶性蛋白、还原糖等营养成分与抗氧化活性,评估杏鲍菇在发酵豆渣及资源化利用中的潜力和应用前景,为豆渣综合利用与杏鲍菇产品开发奠定基础。
1 材料与方法
1.1 材料与试剂
杏鲍菇菌种,四川省农业科学院;豆渣,宜宾市珙县圣浦食品生产有限公司;蛋白胨、琼脂粉、酵母膏、维生素E、马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基(均为生物试剂),北京奥博星生物技术有限责任公司;KH2PO4、苯酚、95%乙醇(体积分数,下同)、无水乙醇、甲醛溶液、石油醚、NaOH、NaNO2、Al(NO3)3、H3PO4、K2S2O8、HCl(均为分析纯),成都市科隆化学品有限公司;MgSO4、葡萄糖(均为分析纯),陕西乐尔东化工有限公司;3,5-二硝基水杨酸、考马斯亮蓝G-250、结晶牛血清蛋白(均为分析纯),上海展云化工有限公司;DPPH、ABTS(均为分析纯),合肥博美生物科技有限责任公司。
杏鲍菇液体培养基(g/L):葡萄糖30、酵母粉4、KH2PO4 2.5、MgSO4 1、蛋白胨0.5、维生素B1 1。
豆渣培养基:将豆渣装入上下口径及整体尺寸一致的培养瓶中,向豆渣中加入蒸馏水调节其水分含量,121 ℃灭菌20 min[7],放置于超净工作台备用。
1.2 仪器与设备
PHS-3C pH计,上海雷磁仪器公司;BWS-10恒温水浴锅,上海一恒科学仪器有限公司;N-1300旋转蒸发仪,上海爱明仪器有限公司;JA2003分析天平,上海舜宇恒平科学仪器有限公司;SW-CJ-2FD超净工作台,苏州安泰空气技术有限公司;YXQ-75G高压蒸汽灭菌锅,上海东亚压力容器制造有限公司;LYZ-211B恒温摇床,上海龙跃仪器设备有限公司;H-1600W离心机,湖南湘仪实验室仪器开发有限公司;LG-5A真空冷冻干燥机,上海市离心机械研究所有限公司;UV-1500紫外分光光度计,上海美析仪器有限公司。
1.3 实验方法
1.3.1 菌种活化和扩大培养
在无菌条件下,将灭菌后的PDA培养基加入到试管约1/3处,待其冷却凝固成斜面后接入杏鲍菇母种。接种完成后调整培养温度为28 ℃,培养4~6 d菌种即可长满斜面,挑选出生长旺盛的活化菌种等待下一步扩大培养。
三角瓶中分别加入150 mL配制好的杏鲍菇液体培养基,灭菌后冷却备用。在无菌条件下接种活化完成的杏鲍菇菌种,于28 ℃、转速120 r/min的恒温摇床中培养5~7 d[7],选择生长旺盛的扩培菌种备用。
1.3.2 理化指标测定
1.3.2.1 可溶性蛋白含量测定
将1 g豆渣杏鲍菇研磨至无颗粒状后放入烧杯中,加入25 mL pH 9.0 硼酸-氢氧化钠缓冲液,室温下使用超声波清洗器提取1 h,4 ℃、8 000×g离心15 min,取上清液置于25 mL容量瓶中加入蒸馏水定容得待测液。分析方法参照SB/T 10170—2007《腐乳》。
1.3.2.2 氨基酸态氮含量测定
参照GB 5009.235—2016《食品安全国家标准 食品中氨基酸态氮的测定》。
1.3.2.3 粗脂肪含量的测定
参照GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》。
1.3.2.4 总黄酮含量测定
运用分光光度法测定总黄酮含量[21]。
1.3.2.5 还原糖含量的测定
参照GB 5009.7—2016《食品安全国家标准 食品中还原糖的测定》。
1.3.2.6 氨基酸含量测定
参照GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》。分别计算甜味氨基酸(苏氨酸、丙氨酸、甘氨酸、脯氨酸和丝氨酸)、苦味氨基酸(异亮氨酸、亮氨酸、缬氨酸、蛋氨酸、苯丙氨酸、精氨酸和组氨酸)、鲜味氨基酸(谷氨酸和天冬氨酸)、无味氨基酸(胱氨酸、酪氨酸和赖氨酸)的含量[22]。
1.3.3 抗氧化活性测定
1.3.3.1 杏鲍菇固态发酵豆渣样品醇提物的制备
杏鲍菇固态发酵豆渣样品与体积分数为70%乙醇以固液比1∶10(g∶mL)混合,振荡提取4 h,纱布过滤取滤液备用。过滤后的豆渣杏鲍菇用上述条件再提取2次,合并滤液。使用旋转蒸发仪在75 ℃、压强为350 Pa的条件下浓缩后,用冻干的方法得到粉末,即得杏鲍菇固态发酵豆渣样品醇提物。
1.3.3.2 ABTS阳离子自由基和DPPH自由基清除能力的测定
参照GB/T 39100—2020《多肽抗氧化性测定 DPPH和ABTS法》的方法并稍作调整。
DPPH自由基清除能力测定方法:50 μL 0.2 mmol/L DPPH-乙醇溶液中,分别加入不同浓度的豆渣杏鲍菇固态发酵醇提物100 μL振荡摇匀,避光室温反应30 min,于517 nm波长处测定样品组吸光度值。以维生素C在同一条件下测定为阳性对照。DPPH自由基清除率计算如公式(1)所示:
(1)
式中:P,DPPH自由基清除率;As,待测溶液与DPPH溶液混合液的吸光度值;Ac,待测溶液与无水乙醇溶液混合液的吸光度值;Ab,DPPH溶液与样品溶剂混合液的吸光度值。
以待测溶液浓度为横坐标,以清除率为纵坐标,建立线性方程,计算DPPH自由基半抑制浓度。
ABTS阳离子自由基清除能力测定方法:分别配制7 mmol/L ABTS和140 mmol/L K2S2O8溶液,按体积比625∶11混合后室温避光反应12 h,制得ABTS反应液,用0.01 mol/L磷酸缓冲液稀释反应液直至溶液在734 nm下的吸光值为0.70±0.02,得到ABTS工作液。
将50 μL 50 mg/mL的杏鲍菇固态发酵豆渣样品醇提物和200 μL ABTS工作液充分混合,避光反应6 min后,在734 nm处测定吸光值。
在相同条件下测定不同质量浓度的Trolox的吸光度,以Trolox的质量浓度为横坐标,吸光值为纵坐标,绘制标准曲线,根据Trolox标准曲线方程计算样品ABTS阳离子自由基清除能力。同时以提取溶液代替样品反应为空白,维生素C为阳性对照。
1.4 数据统计与分析
实验数据均为3次重复实验所得的平均值,结果表示为“平均值±标准差”。实验数据采用Excel 2021软件制图,采用SPSS 26.0软件分析显著性。
2 结果与分析
2.1 豆渣杏鲍菇固态发酵过程中理化指标变化
2.1.1 氨基酸态氮、可溶性蛋白含量的变化
如图1所示,未发酵的豆渣样品中氨基酸态氮的含量较低,为(1.144±0.078) mg/g,发酵过程中氨基酸态氮含量在发酵前8 d显著提升,在第8天样品中氨基酸态氮含量达到峰值(5.383±0.050) mg/g,但第10天缓慢降至(5.256±0.047) mg/g。在杏鲍菇发酵过程中利用豆渣中的碳源和氮源生长,产生大量的代谢产物从而使豆渣中氨基酸态氮含量上升[14]。
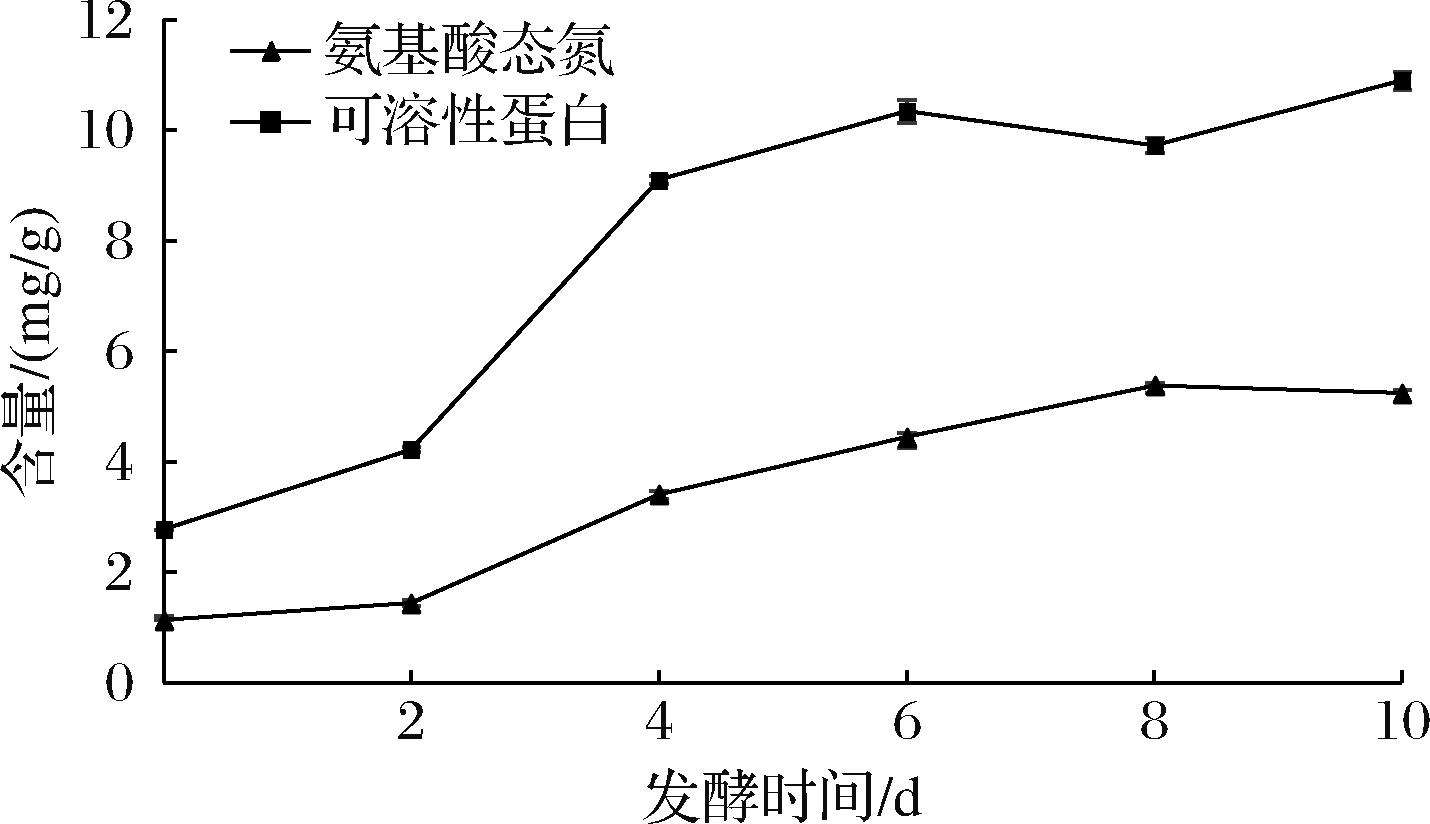
图1 发酵过程中氨基酸态氮与可溶性蛋白含量的变化
Fig.1 Changes of amino acid nitrogen and soluble protein content during fermentation
未发酵的豆渣样品中可溶性蛋白含量为(2.786±0.004) mg/g,在发酵过程前期显著升高,在第6天达(10.350±0.208) mg/g,但第8天时含量降至(9.724±0.142) mg/g,于第10天达峰值(10.899±0.167) mg/g。造成可溶性蛋白含量变化的原因是发酵过程中豆渣中的蛋白质被分解为分子质量较小的多肽和氨基酸,提升了蛋白质的溶解性,可溶性蛋白含量在发酵期间总体呈现上升趋势。与利用米根霉、少孢根霉对豆渣进行发酵后豆渣中可溶性蛋白质含量变化一致[18]。
2.1.2 还原糖含量的变化
如图2所示,在发酵第0~4天,从发酵前的(5.906±0.018) mg/g升至(46.663±0.020) mg/g,大分子碳水化合物作为碳源诱导产生大量胞外酶,将纤维素等大分子多糖降解为小分子糖,还原糖含量显著提高[11]。
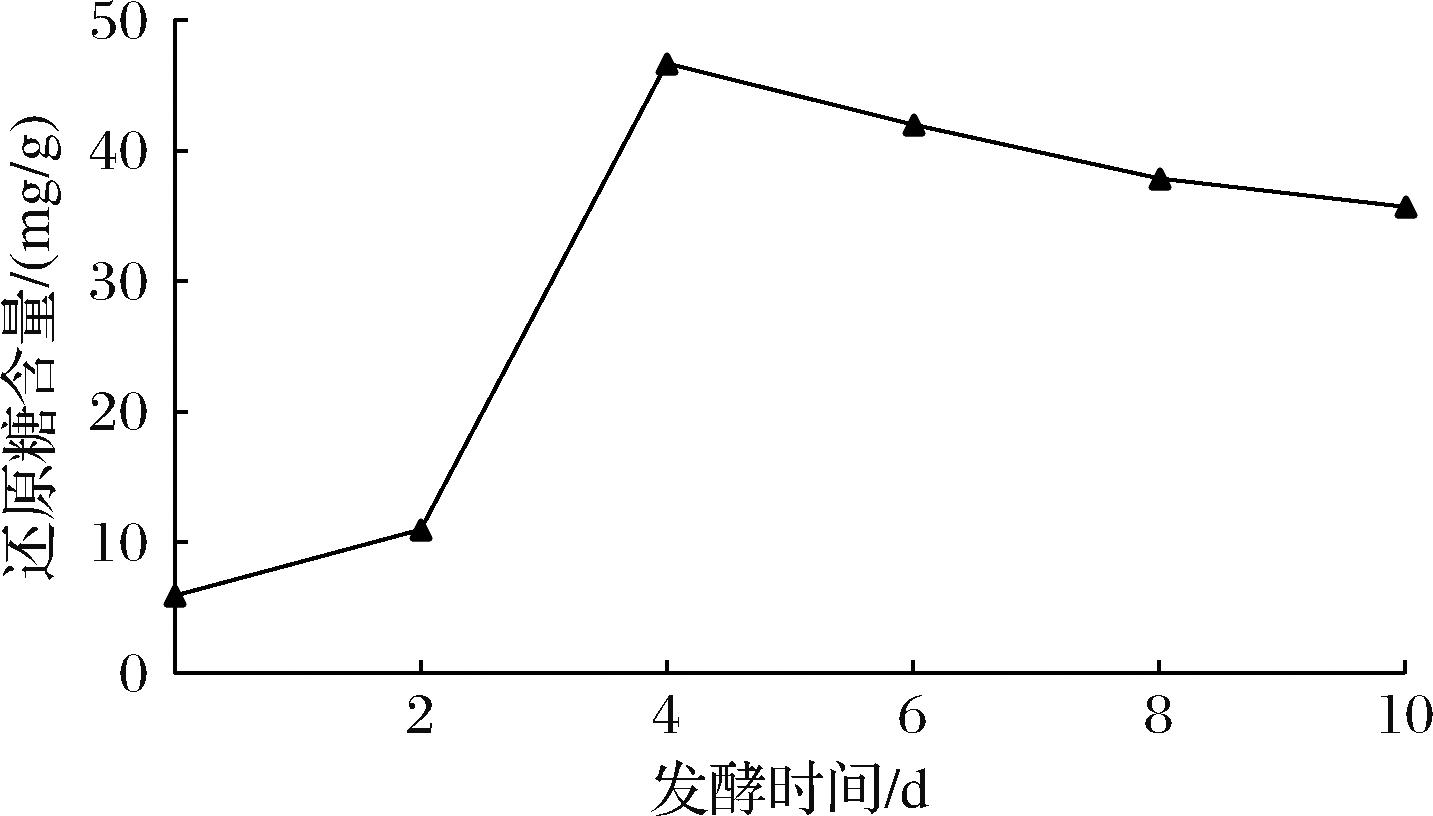
图2 发酵过程中还原糖含量变化
Fig.2 Changes of reducing sugar content during fermentation
发酵中后期的4~10 d还原糖含量逐渐减少,下降至10 d的(35.714±0.341) mg/g,此阶段杏鲍菇生长繁殖所需的还原糖含量高于大分子碳水化合物分解产生的量,部分还原糖被杏鲍菇持续消耗用于生长[23],还原糖含量逐渐减少。豆渣杏鲍菇因大分子物质的分解,口感得以改善,更适用于食品生产。
2.1.3 粗脂肪含量的变化
如图3所示,豆渣杏鲍菇发酵后粗脂肪含量显著低于未发酵组(P<0.05),2~4 d下降最为显著。未发酵时粗脂肪含量为(15.166±0.025) g/100 g,发酵10 d后降至(9.782±0.093) g/100 g,下降了35.50%,有助于改善豆腥味。粗脂肪含量降低的原因是由于发酵过程中杏鲍菇产生脂肪酶,豆渣中的脂肪作为碳源被菌体利用,将脂肪降解为甘油和脂肪酸等小分子物质,使粗脂肪含量呈下降趋势,有助于豆渣中豆腥味的改善。与利用灵芝菌丝体固态发酵豆渣中豆渣的粗脂肪含量变化一致[17]。
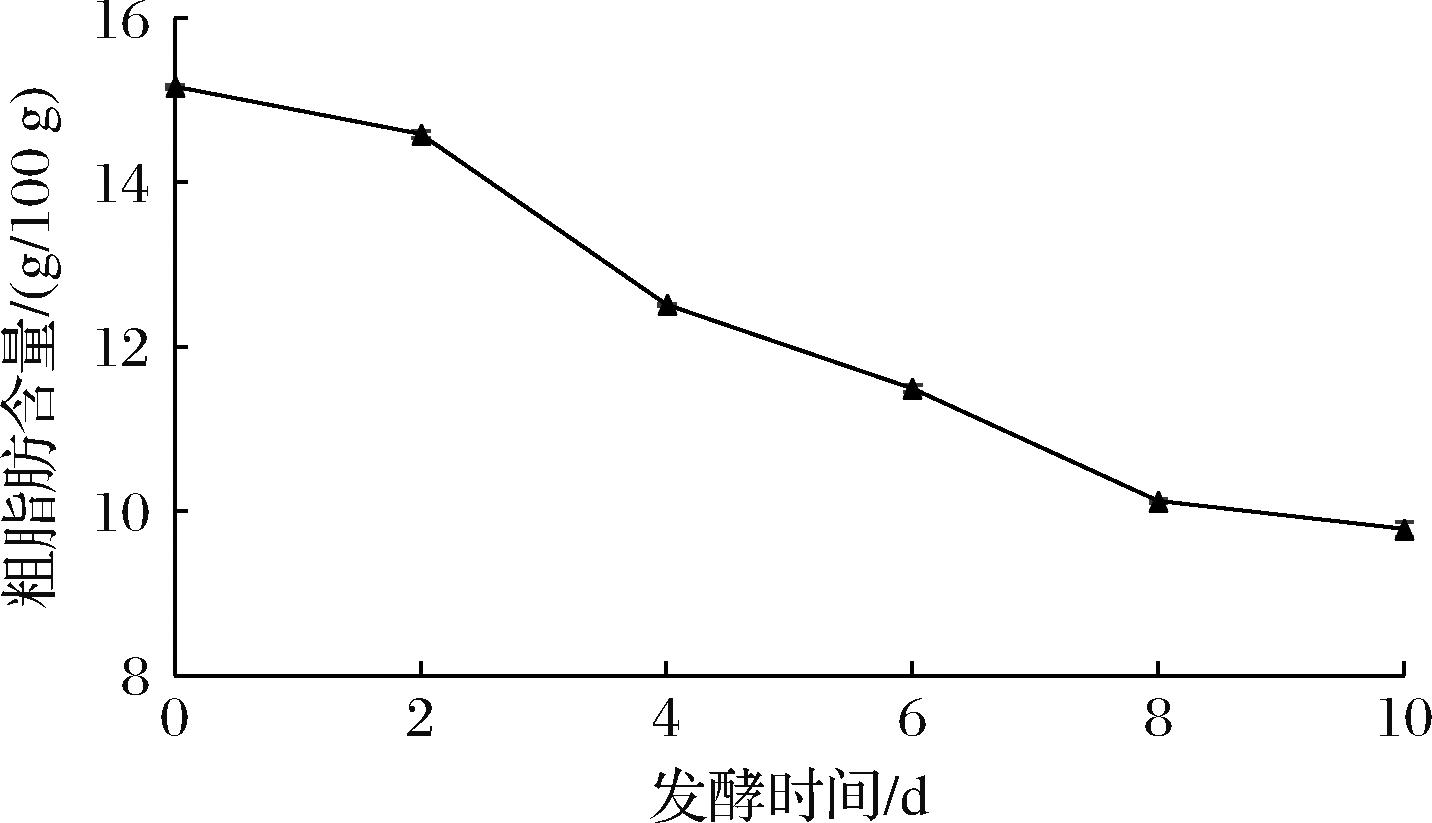
图3 发酵过程中粗脂肪含量的变化
Fig.3 Changes of crude fat content during fermentation
2.1.4 总黄酮含量的变化
如图4所示,总黄酮含量在整个发酵过程中总体呈上升趋势,在2~4 d显著提升。未发酵时总黄酮含量为(0.031±0.004) mg/g,在4 d达峰值(0.066±0.002) mg/g,第6天下降至(0.052±0.001) mg/g,此后略有上升,10 d的含量为(0.057±0.001) mg/g。发酵前期因为杏鲍菇可以利用自身酶系合成黄酮类物质,后期可能因发酵时间过长、培养基营养不足等原因导致细胞衰亡,其产酶性能下降,引起产生的黄酮量减少[24]。
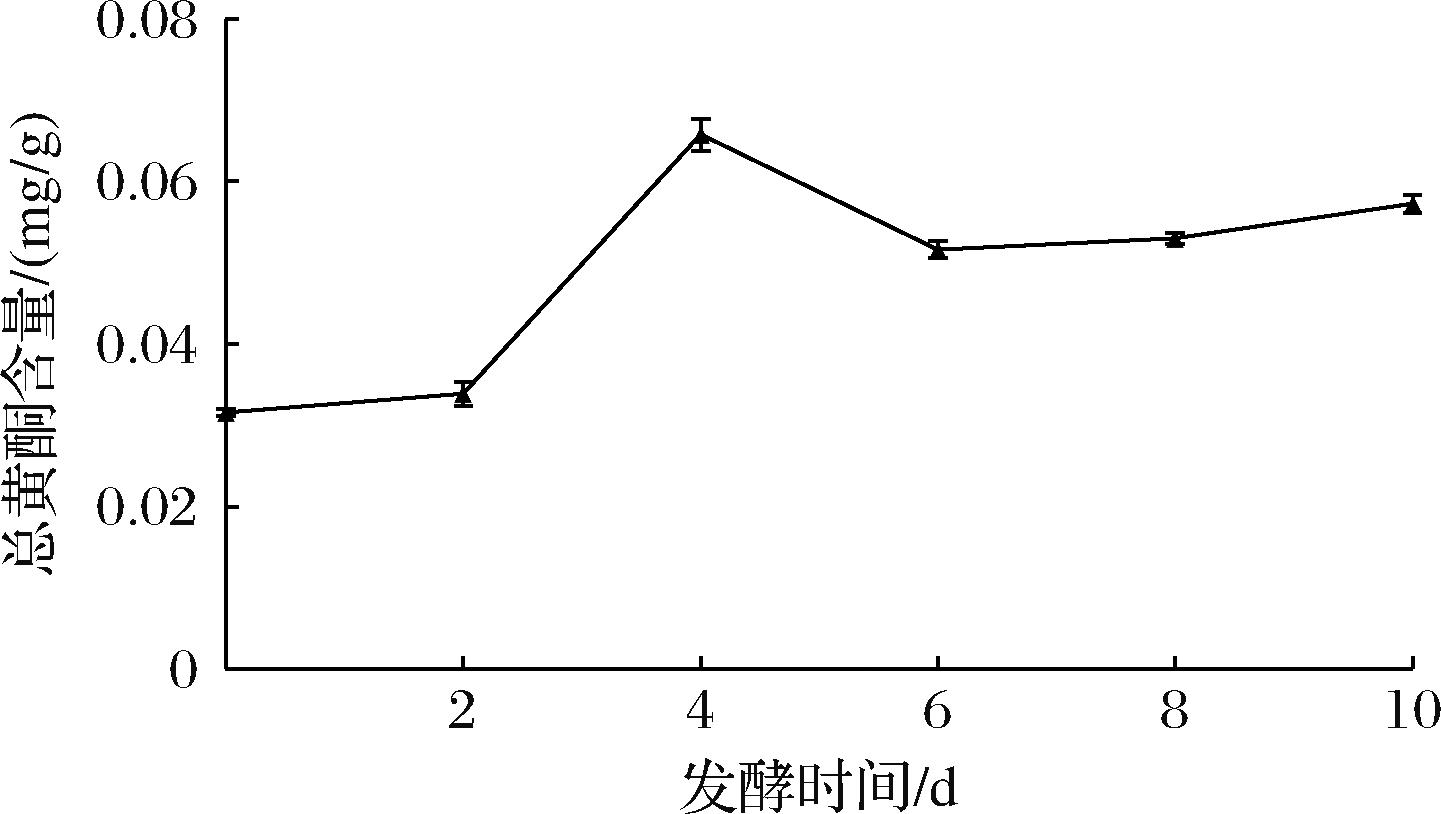
图4 发酵过程中总黄酮含量变化
Fig.4 Changes in total flavonoid content during fermentation
2.1.5 氨基酸含量变化
如表1所示,氨基酸总量在整个发酵过程中呈上升趋势,豆渣在未发酵时,总氨基酸的含量为(12.424±0.046) mg/g,后续发酵过程中氨基酸含量持续上升,发酵第10天升至最大值(17.144±0.174) mg/g,提升了约1.38倍。发酵时间对丙氨酸、甘氨酸、酪氨酸、缬氨酸(P<0.01)的含量影响极其显著;发酵时间对赖氨酸、天冬氨酸、组氨酸、苏氨酸、蛋氨酸、亮氨酸、苯丙氨酸、丝氨酸、异亮氨酸(0.01<P<0.05)有显著影响,都随发酵时间的变化而上升。相比之下,精氨酸、胱氨酸、谷氨酸、脯氨酸(P>0.05)的含量变化不显著,随发酵时间无明显改变。
表1 豆渣杏鲍菇固态发酵过程中氨基酸含量 单位:mg/g
Table1 Amino acid content in the fermentation of soybean residue and king oyster mushroom

氨基酸0 d2 d4 d6 d8 d10 d天冬氨酸Asp1.431±0.000f1.781±0.007e1.835±0.006d2.010±0.014c2.054±0.009b2.150±0.028a苏氨酸Thr0.638±0.001d0.756±0.004c0.774±0.002c0.904±0.005b0.953±0.008a0.979±0.026a丝氨酸Ser0.729±0.010e0.880±0.007d0.936±0.003c0.992±0.005b1.036±0.011ab1.044±0.044a谷氨酸Glu2.164±0.003d2.582±0.007c2.827±0.014b2.677±0.025b2.706±0.017a2.837±0.040a甘氨酸Gly0.703±0.008f0.846±0.008e0.885±0.004d0.975 ±0.007c1.001±0.002b1.052±0.011a丙氨酸Ala0.648±0.002d0.838±0.006c0.827±0.001c1.034±0.012b1.032±0.007b1.095±0.021a胱氨酸Cys0.142±0.001c0.147±0.005c0.193±0.000c0.148±0.005c0.166±0.001b0.147±0.010a缬氨酸Val0.707±0.004e0.879±0.002d0.874±0.004d1.060±0.011c1.099±0.009b1.182±0.007a蛋氨酸Met0.112±0.006d0.148±0.000c0.138±0.005b0.172±0.001a0.174±0.005a0.180±0.001a异亮氨酸Ile0.558±0.013d0.736±0.006c0.739±0.002c0.835±0.013b0.828±0.005b0.860±0.009a亮氨酸Leu1.031±0.007c1.207±0.007b1.308±0.011a1.318±0.019a1.296±0.001a1.313±0.010a酪氨酸Tyr0.362±0.009d0.394±0.009d0.456±0.001c0.524±0.024b0.574±0.010ab0.554±0.032a苯丙氨酸Phe0.669±0.002e0.803±0.000d0.848±0.004c0.894±0.015b0.873±0.003a0.896±0.003a赖氨酸Lys0.635±0.005e0.705±0.003d0.848±0.011c0.851±0.001c0.914±0.006b0.996±0.018a组氨酸His0.395±0.001e0.446±0.001d0.491±0.006c0.463±0.001c0.469±0.001b0.508±0.005a精氨酸Arg0.699±0.007f0.490±0.000e0.935±0.003d0.437±0.001c0.392±0.002b0.405±0.006a脯氨酸Pro0.801±0.022d0.938±0.021c1.011±0.032b0.938±0.000b0.884± 0.012b0.945±0.016a总量Total12.424±0.046f15.925±0.069e14.576±0.039d16.231±0.058c16.449±0.058b17.144±0.174a
注:同行不同小写字母表示差异显著(P<0.05)(下同)。
杏鲍菇固态发酵豆渣的过程中,不同的氨基酸由于在发酵过程中作用不同,含量变化也不尽相同。在发酵过程中,蛋白酶水解豆渣中的蛋白质生成氨基酸,氨基酸含量上升,后期随着杏鲍菇菌体的快速生长,氨基酸被菌体利用,含量趋于平稳[14],利用杏鲍菇固态发酵豆渣可以有效提升氨基酸的含量。
对于甘氨酸、酪氨酸、丙氨酸、缬氨酸,由于其P<0.01,这在统计学上表明,固态发酵过程对这几种氨基酸含量的影响极其显著。发酵时间对其含量改变作用显著,且固态发酵极大提升了其含量。
赖氨酸、天冬氨酸、组氨酸、苏氨酸、蛋氨酸、亮氨酸、苯丙氨酸、丝氨酸、异亮氨酸以及氨基酸总量,其P值在0.01~0.05,揭示出固态发酵过程中氨基酸含量随发酵时间有显著影响,可有效地提高这几种氨基酸的含量。
相比之下,精氨酸、胱氨酸、谷氨酸、脯氨酸P>0.05,意味着其含量变化随发酵时间无显著改变,固态发酵对这些氨基酸的提升作用不显著。
2.1.6 呈味氨基酸含量变化
甜味、苦味、鲜味、无味这4类呈味氨基酸[22]含量在固态发酵过程中呈现出上升趋势,即表明氨基酸在影响豆渣杏鲍菇风味的过程中持续发挥着重要作用。具体而言,在发酵第10天的含量中,占比最高的氨基酸主要集中在甜味、苦味以及鲜味3类,合计占总呈味氨基酸的29.83%、31.17%、29.11%。
如表2所示,未经发酵时甜味氨基酸含量为(3.519±0.004) mg/g,在发酵过程中含量持续上升,在发酵10 d含量达到了(5.115±0.084) mg/g。未经发酵时苦味氨基酸含量为(4.180±0.021) mg/g,在后续发酵过程中含量持续上升至发酵第4天时的(5.333±0.019) mg/g,此后下降至发酵第8天时的(5.131±0.006) mg/g。未经发酵时鲜味氨基酸含量为(3.595±0.003) mg/g,后续发酵过程中含量持续上升至发酵第10天时的(4.991±0.048) mg/g。未经发酵时无味氨基酸含量为(1.138±0.010) mg/g,到发酵第10天时其含量达到了(1.697±0.003) mg/g。经蛋白酶的水解作用,各类氨基酸含量都发生了不同的变化,苯丙氨酸、缬氨酸等疏水性氨基酸是主要的苦味氨基酸,其中脯氨酸起主导作用[22]。鲜味氨基酸主要取决于谷氨酸和天门冬胺酸[22],其含量上升,使豆渣的总体味感变得更加柔和、浓厚。
表2 发酵过程中呈味氨基酸含量 单位:mg/g
Table2 Taste amino acid content during fermentation

氨基酸0 d2 d4 d6 d8 d10 d甜味氨基酸3.519±0.004e4.258±0.033d4.434±0.023c4.842±0.013b4.906±0.029b5.115±0.084a苦味氨基酸4.180±0.021e4.709±0.007d5.333±0.019c5.180±0.020b5.131±0.004a5.344±0.006a鲜味氨基酸3.595±0.003e4.363±0.010d4.661±0.014c4.687±0.028c4.759±0.018b4.991±0.048a无味氨基酸1.138±0.010f1.246±0.008e1.497±0.007d1.523±0.020c1.653±0.001b1.697±0.003a
2.2 不同发酵时间杏鲍菇固态发酵豆渣样品醇提物抗氧化活性变化
2.2.1 DPPH自由基清除能力变化
如图5所示,在0~6 d期间,清除50% DPPH自由基所需浓度从发酵前的(10.249±0.197) mg/g大幅下降至(4.280±0.072) mg/g,豆渣杏鲍菇发酵样品的抗氧化活性表现出显著提升(P<0.05),抗氧化活性的提高是由于发酵过程中总酚、异黄酮等生物活性成分含量的显著增加[18]。在6~10 d的发酵过程中,抗氧化活性的变化未显示出统计学上的显著差异(P>0.05),可能是在此期间总酚、异黄酮等生物活性成分含量的变化不明显。
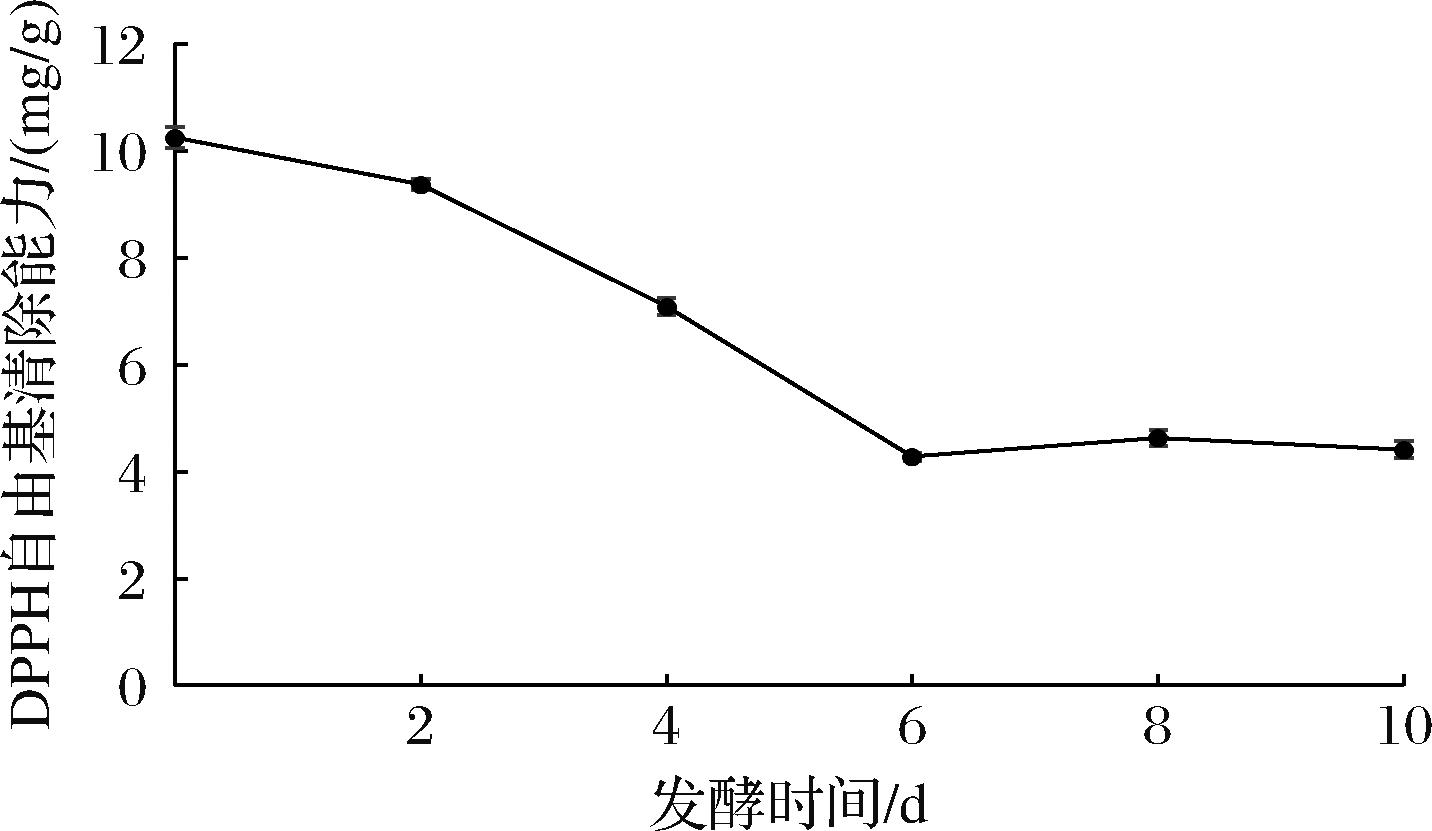
图5 发酵过程中DPPH自由基清除能力变化
Fig.5 Changes in DPPH free radical scavenging ability during fermentation
2.2.2 ABTS阳离子自由基清除能力变化
如图6所示,杏鲍菇固态发酵豆渣的ABTS阳离子自由基清除能力随发酵时间的变化而变化,在0~6 d,杏鲍菇固态发酵豆渣样品醇提物的ABTS阳离子自由基清除能力显著提升(P<0.05),从0 d的(101.964±0.156) mg Trolox/100 g变化到第6天的(319.751±1.156) mg Trolox/100 g,相对于未发酵前ABTS阳离子自由基清除能力显著增加了约214%。在第10天时可能会使ABTS阳离子自由基清除能力达到最强。6~10 d期间,ABTS阳离子抗氧化活性呈波动变化,第10天 ABTS阳离子自由基清除能力达最大值(339.119±0.203) mg Trolox/100 g。这是由于在杏鲍菇固态发酵豆渣过程产生了总酚、黄酮、异黄酮等生物活性物质[25],使得豆渣杏鲍菇发酵样品的抗氧化活性增强。
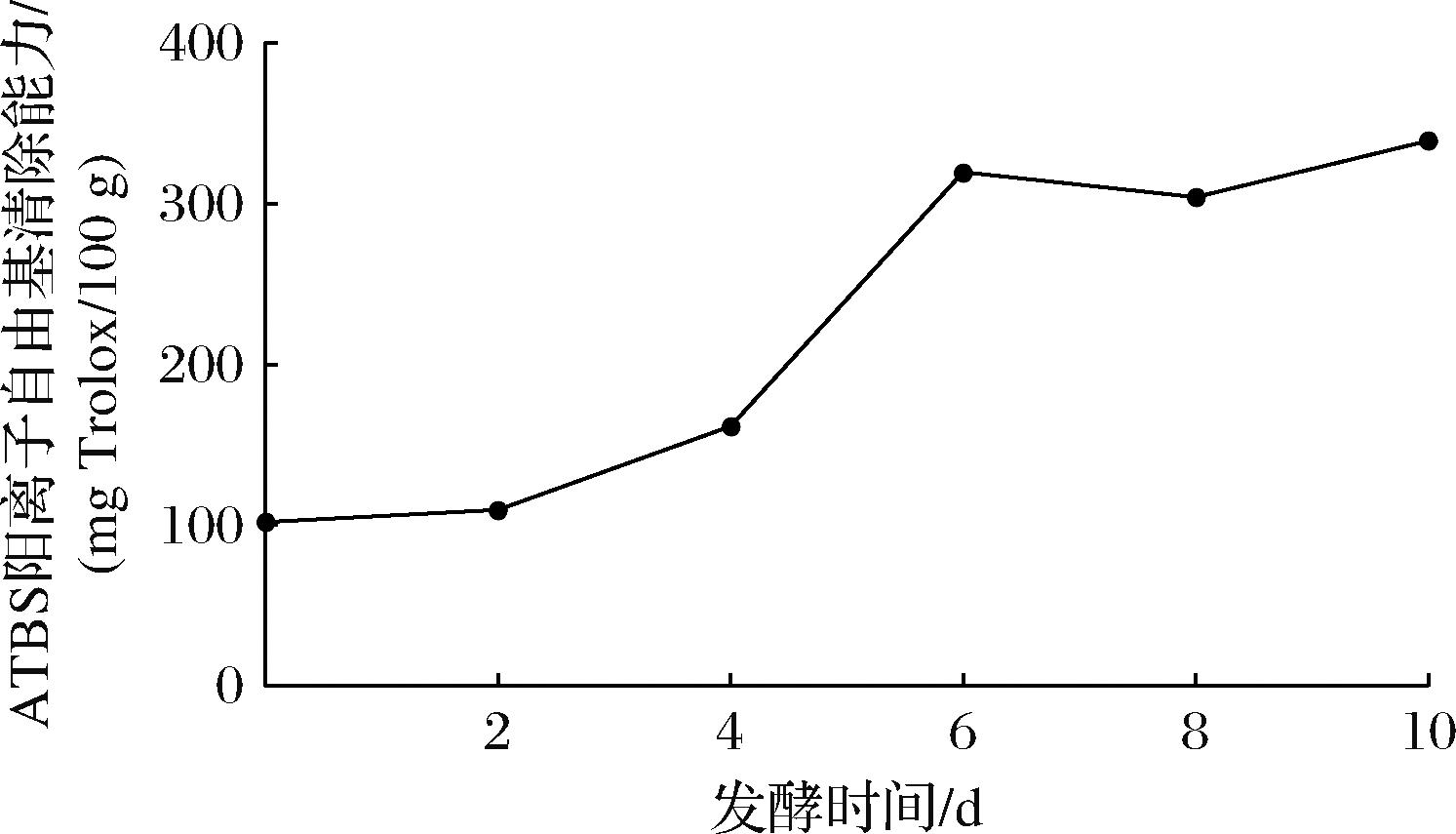
图6 发酵过程中ABTS阳离子自由基清除能力变化
Fig.6 Changes in ABTS cation free radical removal capacity during fermentation
3 结论
杏鲍菇的固态发酵过程对豆渣的营养成分有显著提升作用,经过发酵处理后,豆渣中的可溶性蛋白质含量增加了3.91倍,超过了米根霉的2.16倍、少孢根霉2.26倍,与灵芝菌丝体的3.90倍相近。可溶性蛋白质的增加不仅改善了豆渣的口感和质地,也为豆渣提供了更多的营养价值和功能性质。
通过杏鲍菇的固态发酵,豆渣的抗氧化能力显著提升。本研究发现,豆渣醇提物对ABTS阳离子自由基的清除能力增加了3.32倍,这一数值远超少孢根霉发酵后的1.36倍及米根霉发酵后的1.48倍,充分彰显了杏鲍菇在强化豆渣抗氧化活性方面卓越的效果。抗氧化能力的增强意味着豆渣中的营养成分得到了更好的保留和提升,对于豆渣的综合利用价值有着重要的推动作用。
在杏鲍菇固态发酵豆渣过程中,随着时间的推移,豆渣杏鲍菇中的氨基酸态氮含量、可溶性蛋白含量、还原糖含量、总黄酮含量、总氨基酸含量随时间延长显著增加,呈味氨基酸及抗氧化活性显著上升,粗脂肪显著下降,提高了发酵豆渣的理化指标与抗氧化活性。杏鲍菇作为一种具有较高营养价值的食用菌,其在固态发酵豆渣过程中展现了其独特的优势,为豆渣固态发酵提供了新的可能性。这不仅为改善豆渣的品质提供了新的思路和方法,也为发掘其更多利用功能提供了基础。
[1] VONG W C, LIU S Q.Biovalorisation of okara (soybean residue) for food and nutrition[J].Trends in Food Science &Technology, 2016, 52:139-147.
[2] COLLETTI A, ATTROVIO A, BOFFA L, et al.Valorisation of by-products from soybean (Glycine max (L.) merr.) processing[J].Molecules, 2020, 25(9):2129.
[3] 张文珍, 喻哲昊, 刘建军, 等.豆渣和饲料桑混合发酵物在产蛋后期蛋鸡饲料中的应用研究[J].现代农业科技, 2022(17):183-185.ZHANG W Z, YU Z H, LIU J J, et al.Application of mixed fermented products of soybean dregs and feed mulberry in feed of laying hens at later laying stage[J].Modern Agricultural Science and Technology, 2022(17):183-185.
[4] 李晓惠, 任仙娥, 杨锋, 等.水力空化对大豆分离蛋白钙致凝胶行为的影响[J].中国调味品, 2022, 47(8):1-5.LI X H, REN X E, YANG F, et al.Effect of hydrodynamic cavitation on calcium induced gelation behavior of soy protein isolate[J].China Condiment, 2022, 47(8):1-5.
[5] 封晓毓, 王艳聪, 陆维鹏, 等.豆渣在食品中开发利用研究进展[J].饮料工业, 2023, 26(3):65-71.FENG X Y, WANG Y C, LU W P, et al.Progress of processing and application of soybean residue in food industry[J].Beverage Industry, 2023, 26(3):65-71.
[6] 李静. 豆渣的综合利用研究进展[J].粮食与食品工业, 2022, 29(2):28-32.LI J.Research progress on comprehensive utilization of bean dregs[J].Cereal &Food Industry, 2022, 29(2):28-32.
[7] 袁华伟, 陶涛, 周敏, 等.豆渣固态发酵培养杏鲍菇菌丝体[J].宜宾学院学报, 2018, 18(12):65-69.YUAN H W, TAO T, ZHOU M, et al.Solid state fermentation of soybean residue to cultivate Pleurotus eryngii mycelia[J].Journal of Yibin University, 2018, 18(12):65-69.
[8] LI L J, CAO X N, HUANG J W, et al.Effect of Pleurotus eryngii mycelial fermentation on the composition and antioxidant properties of Tartary buckwheat[J].Heliyon, 2024, 10(4):e25980.
[9] 戴云娇, 王龙梅, 蒋智芳, 等.不同碳氮比培养料栽培杏鲍菇比较试验[J].食用菌, 2015, 37(1):28-29.DAI Y J, WANG L M, JIANG Z F, et al.Comparative experiment on cultivating Pleurotus eryngii with different C/N ratios[J].Edible Fungi, 2015, 37(1):28-29.
[10] 袁华伟, 陶涛, 周敏, 等.豆渣培养杏鲍菇菌丝体培养基配方的优化[J].食用菌, 2020, 42(6):29-31;40.YUAN H W, TAO T, ZHOU M, et al.Optimization of culture medium for mycelium of Pleurotus eryngii with soybean dregs[J].Edible Fungi, 2020, 42(6):29-31;40.
[11] XU X, LIU T, KONG X Q, et al.Effects of sawdust dosage on the diversity and community structure of bacteria associated with the hyphae of Pleurotus eryngii[J].The Journal of Applied Ecology, 2020, 31(10):3547-3553.
[12] ZHOU R L, REN Z Q, YE J, et al.Fermented soybean dregs by Neurospora crassa:A traditional prebiotic food[J].Applied Biochemistry and Biotechnology, 2019, 189(2):608-625.
[13] 吴永祥, 吴丽萍, 朴银美, 等.药(食)真菌发酵豆渣的主要功能物质及生物活性变化[J].食品与发酵工业, 2020, 46(15):100-106.WU Y X, WU L P, PIAO Y M, et al.Changes of main functional substances and biological activities of okara fermented with medicinal and edible fungi[J].Food and Fermentation Industries, 2020, 46(15):100-106.
[14] 赵哲, 杨润强, 顾振新.食用菌液态发酵产酶特性及其对豆渣中膳食纤维含量的影响[J].食品与发酵工业, 2016, 42(2):108-113.ZHAO Z, YANG R Q, GU Z X.Enzymes produced by liquid state fermentation of edible fungi and their effects on the main nutrients of soybean okara[J].Food and Fermentation Industries, 2016, 42(2):108-113.
[15] VONG W C, HUA X Y, LIU S Q.Solid-state fermentation with Rhizopus oligosporus and Yarrowia lipolytica improved nutritional and flavour properties of okara[J].LWT, 2018, 90:316-322.
[16] QUEIROZ SANTOS V A, NASCIMENTO C G, SCHMIDT C A P, et al.Solid-state fermentation of soybean okara:Isoflavones biotransformation, antioxidant activity and enhancement of nutritional quality[J].LWT, 2018, 92:509-515.
[17] 申春莉, 李曼, 沙见宇, 等.灵芝菌丝体固态发酵豆渣的营养成分变化[J].食品与发酵工业, 2019, 45(12):114-119.SHEN C L, LI M, SHA J Y, et al.Nutrient changes in solid-state fermented okara with Ganoderma lucidum[J].Food and Fermentation Industries, 2019, 45(12):114-119.
[18] 管瑛, 汪瑨芃, 李文, 等.豆渣固态发酵过程中主要营养成分及抗氧化特性变化[J].食品科学, 2016, 37(21):189-194.GUAN Y, WANG J P, LI W, et al.Changes in major nutritional components and antioxidant activity of fermented okara[J].Food Science, 2016, 37(21):189-194.
[19] 袁华伟, 魏溢, 赵余, 等.豆渣杏鲍菇菌丝曲奇饼干的配方优化[J].新疆农业科学, 2022, 59(9):2240-2246.YUAN H W, WEI Y, ZHAO Y, et al.Formulation optimization of cookie with okara Pleurotus eryngii mycelium[J].Xinjiang Agricultural Sciences, 2022, 59(9):2240-2246.
[20] JIANG K, TANG B, WANG Q, et al.The bio-processing of soybean dregs by solid state fermentation using a poly γ-glutamic acid producing strain and its effect as feed additive[J].Bioresource Technology, 2019, 291:121841.
[21] 刘仙俊, 张慧珍, 王潇潇, 等.5种豆类中总多酚、总黄酮含量及抗氧化活性比较研究[J].食品研究与开发, 2020, 41(7):52-57.LIU X J, ZHANG H Z, WANG X X, et al.Comparative study on total polyphenols, total flavonoids and antioxidant activity in five kinds of legumes[J].Food Research and Development, 2020, 41(7):52-57.
[22] 庄金达. 四种牛肝菌特征风味物质和鲜味肽鉴定及其呈味机制研究[D].上海:上海应用技术大学,2021.ZHUANG J D.Study on identification of characteristic flavor compounds and umami peptides of four boletus and its taste mechanism[D].Shanghai:Shanghai Institute of Technology, 2021.
[23] 郑润敏, 戴易祎, 谢其辉, 等.生浆豆渣混菌发酵过程中的营养品质和功能特性变化规律[J].食品与发酵工业, 2023, 49(2):173-180.ZHENG R M, DAI Y Y, XIE Q H, et al.Changes in nutritional quality and functional characteristics of raw pulp okara during mixed fermentation[J].Food and Fermentation Industries, 2023, 49(2):173-180.
[24] 何恩铭, 李惠华, 常强, 等.超声波法提取豆渣中大豆异黄酮的工艺研究[J].大豆科学, 2011, 30(4):680-682.HE E M, LI H H, CHANG Q, et al.A preliminary study on extraction of soybean isoflavones from soybean dregs by ultrasound method[J].Soybean Science, 2011, 30(4):680-682.
[25] 张杉杉, 涂传海, 肖愈, 等.蛹虫草固态发酵豆渣的功能性成分与抗氧化活性[J].食品工业科技, 2017, 38(24):69-74.ZHANG S S, TU C H, XIAO Y, et al.Functional components and antioxidant activity of okara fermented by Cordyceps militaris[J].Science and Technology of Food Industry, 2017, 38(24):69-74.