随着全球食品工业的快速发展,食品原料的多样性和功能性引起了广泛关注。在肉制品加工过程中,猪血作为副产物产生的量相当可观,每年猪血副产品的产量约为150万t[1]。然而,目前猪血的利用率较低,大多被加工成饲料或血豆腐等低附加值产品,未能充分发挥其潜在的高营养价值[2]。猪血清白蛋白(porcine serum albumin,PSA)作为猪血中的重要蛋白质成分,约占血清总蛋白质的60%左右[3],具有良好的营养特性和功能性,其分子结构与牛血清白蛋白(bovine serum albumin,BSA)相似,分子质量约为67 kDa,具有较好的溶解性和稳定性。这些特性使得PSA在食品加工中具有潜在的应用价值,如作为起泡剂或是脂肪替代物[4]。然而,天然状态下PSA的乳化性和抗氧化能力相对有限,无法达到某些食品应用中对功能特性的高需求,尤其是在改善食品质量稳定性和延长货架期方面。这些局限性限制了PSA在高附加值食品中的广泛应用。
近年来,食品工业对天然抗氧化剂和功能性乳化剂的需求显著增加。在此背景下,酚类改性蛋白逐渐成为研究焦点,已有大量研究表明亲水性多酚与蛋白质的结合可调节蛋白质表面亲水-疏水基团的平衡,同时抑制它们的自聚集倾向,从而提高乳化活性(emulsification activity index,EAI)[5]。茶多酚类物质,尤其是表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG),因其典型的多羟基酚类亲水结构,受到了广泛关注。EGCG容易与蛋白质分子发生多种相互作用(如氢键、疏水相互作用和静电作用等)而结合,这些相互作用可以显著改变蛋白质的理化性质[6]。ZHOU等[7]用大豆分离蛋白与EGCG反应形成的复合物抗氧化活性显著提高,修饰后的复合物可以作为高效的抗氧化剂和潜在的乳化剂在乳剂食品体系中应用。李璐璐等[8]的研究指出,EGCG与汉麻蛋白结合后,形成的乳剂液滴尺寸更小,物理稳定性显著改善,复合物具备了更优良的乳化能力和乳化稳定性(emulsifying stability index,ESI)。焦瑶瑶等[9]发现茶多酚的添加可以改变牛乳蛋白的构象,进而改善牛乳蛋白的凝胶特性、乳化性及抗氧化活性。以上研究表明,EGCG与不同蛋白质的结合可以显著改善其乳化和抗氧化特性,拓宽其在功能性食品中的应用潜力[10]。因此,探索PSA与EGCG结合后结构及功能特性的变化具有重要的理论意义和应用前景。
本研究以PSA为研究对象,结合EGCG,通过单因素试验与响应面优化法,系统优化其复合工艺,并对其结构特性EAI、抗氧化性能、溶解性等进行了全面分析。本研究不仅为猪血蛋白质的高值化利用提供了新的研究方向,还为功能性食品的开发奠定了科学基础。
1 材料与方法
1.1 材料与试剂
新鲜猪血(含3.8%柠檬酸钠抗凝剂),正大食品有限公司;BSA(纯度>97%),上海谱振生物科技有限公司;(NH4)2SO4(分析纯),天津德恩化学试剂有限公司;透析袋(分子质量8 000~14 000),国药集团化学试剂有限公司;KBr(光谱纯)、溴酚蓝(分析纯),天津市科密欧化学试剂有限公司;柠檬酸-Na2HPO4缓冲液(0.02 mol/L,pH 7.4),北京雷根生物科技有限公司;DPPH(纯度>97.0%),上海蓝季生物有限公司;ABTS(纯度≥98.0%),上海源叶生物科技有限公司。
1.2 仪器与设备
TD5Z低速中等容量离心机,金坛区金城春兰实验仪器厂;XW-80A涡旋振荡器,上海沪西分析仪器厂有限公司;EM-30Plus型扫描电子显微镜,日本岛津公司;BeNano 90 zeta纳米粒度仪,丹东百特仪器有限公司;BBA124S电子分析天平,上海舜宇恒平科学仪器有限公司;VERTEX70型傅里叶红外光谱仪,德国Bruker公司;UV-2600型紫外可见分光光度计,昆山市超声仪器有限公司。
1.3 实验方法
1.3.1 PSA的提取
采用盐析法[(NH4)2SO4]提取PSA,将新鲜猪血与抗凝剂(3.8%柠檬酸钠)混合均匀后,静置2 h后以3 500 r/min离心15 min,取上清液,加入一定量饱和(NH4)2SO4溶液(终浓度为80%),混合均匀并调节pH至5,于4 ℃静置40 min后以3 000 r/min离心20 min,取下层沉淀,使用pH为7.4的柠檬酸-Na2HPO4缓冲液透析48 h。透析脱盐后冷冻干燥得PSA粉末。
1.3.2 制备EGCG-PSA复合物的单因素试验
参考李金铭[11]的方法制备多酚-蛋白复合物。用二次蒸馏水制备一定量的PSA(0.2 mg/mL)和EGCG(0.1 mg/mL)溶液,在PSA与EGCG的浓度比(PSA∶EGCG)1∶1、pH 6、反应温度40 ℃、反应时间40 min条件下,分别对不同PSA与EGCG的浓度比例(2∶1、1.5∶1、1∶1、1∶1.5、1∶2)、不同pH(4、5、6、7、8)、不同温度(20、30、40、50、60 ℃)和不同反应时间(20、30、40、50、60 min)进行单因素试验,并以EAI为指标,确定EGCG-PSA复合物制备的较优工艺水平。
1.3.3 制备EGCG-PSA的响应面优化试验
1.3.3.1 响应面试验设计
根据PSA与EGCG比例、反应温度、反应时间和pH等4个因素对EGCG-PSA复合物乳化性影响的单因素试验结果,以EAI为响应值设计4元3次通体旋转组合,设立29个试验点,试验因素水平见表1。
表1 响应面试验因素水平表
Table 1 Factors and levels of response surface experiment
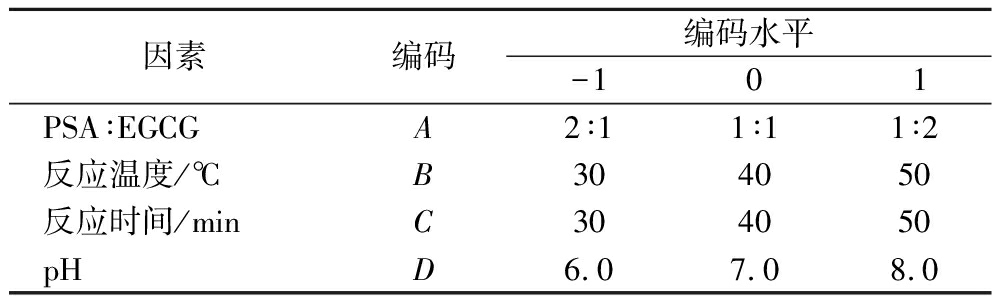
因素编码编码水平-101PSA∶EGCGA2∶11∶11∶2反应温度/℃B304050反应时间/minC304050pHD6.07.08.0
1.3.3.2 响应面试验分析
应用Design-Expert 8.0.6.1软件对试验数据进行回归分析,得到EGCG-PSA复合物的EAI对PSA与EGCG浓度比、pH、反应温度及时间4个因素的回归模型,并对模型进行回归方差分析显著性检验,绘制不同影响因素的响应曲面图和等高线图,获取EGCG-PSA复合物制备的最佳工艺条件,并进行试验验证。
1.3.4 EGCG-PSA的结构表征
1.3.4.1 扫描电镜
在扫描电子显微镜样品台上,用离子溅射机喷洒金原子涂层,加速电压为5 kV,通过调节聚焦和倍数使视野清晰、蛋白结构完整,选择具有代表性的区域进行拍摄,放大倍数为2 000。
1.3.4.2 粒径、聚合物分散指数(polydispersity index, PDI)及zeta电位的测定
粒径、PDI和zeta电位的测定参考张燕鹏等[12]的方法并略作修改。PSA溶液于25 ℃、8 000 r/min离心15 min,然后将PSA和EGCG-PSA复合物溶液的质量浓度调节至0.2 mg/mL。
1.3.4.3 傅里叶变换红外光谱
二级结构的测定参考ROY等[13]的方法并略作改动。将1 mg的PSA和EGCG-PSA复合物样品分别与99 mg KBr混合磨粉并压制成片。利用傅里叶变换红外光谱仪进行全波段扫描,设置扫描次数为32,测量波数4 000~500 cm-1,分辨率4 cm-1。
1.3.5 EGCG-PSA的功能特性
1.3.5.1 溶解度
参照黄子林等[14]的方法并略作修改。将一定量EGCG-PSA复合物溶液于4 ℃、9 400 r/min离心20 min,用微量凯氏定氮法测定上清液的蛋白质含量,并计算蛋白溶出率(溶出蛋白质量与总蛋白质量的比值),以此测定蛋白溶解度。
1.3.5.2 表面疏水性
参照贾娜等[15]的方法并略作修改。取1 mL 5 mg/mL 的EGCG-PSA复合物溶液与200 μL 1 mg/mL的溴酚蓝(溶于去离子水)于室温下搅拌10 min,然后4 ℃、6 000 r/min离心15 min,取上清液稀释10倍后用紫外分光光度计在595 nm波长处测量吸光度。
1.3.5.3 浊度
参考张雨萌[16]的方法并略作修改。准确配制0.5 mg/mL的PSA和0.25 mg/mL的EGCG,分别按照2∶1、1.5∶1、1∶1、1∶1.5、1∶2的比例,在pH 7、40 ℃条件下反应4 h。
1.3.5.4 EAI和ESI
根据赵新如等[17]的方法进行,将制得的新鲜乳液于500 nm波长处测定吸光度,测定其乳化性。
1.3.5.5 起泡性(foamability,FAI)
参考解长远等[18]的方法并略作修改。制备10 mL 0.01 g/mL的PSA和EGCG-PSA复合物溶液。FAI和泡沫稳定性(foam stability,FSI)按公式(1)、公式(2)计算:
(1)
(2)
式中:H0,起始高度,cm;H1,10 000 r/min均质2 min后的高度,cm;H2,静置10 min后再次记录高度,cm。
1.3.5.6 抗氧化性
参照刘晶等[19]的方法略作修改。分别将5 mL PSA(2 mg/mL)和EGCG-PSA复合物(2 mg/mL)与5 mL DPPH溶液(100 μmol/L)混合均匀,暗室孵育30 min,于517 nm处测得吸光度,DPPH自由基清除率按公式(3)计算:
DPPH自由基清除率![]()
(3)
式中:AD,加DPPH不加样品的吸光度;AE,加样品和DPPH的吸光度。
参照杨文清等[20]的方法略作修改。用50 μL 2 mg/mL待测样品与950 μL ABTS试剂混合,黑暗条件下静置2 h,并在734 nm处测量上清液的吸光度,以PSA作为对照组,ABTS阳离子自由基的清除率按公式(4)计算:
ABTS阳离子自由基清除率![]()
(4)
式中:A0,含ABTS不加样品的吸光度;Ai,含样品和ABTS的吸光度。
1.4 数据处理
每组样品重复3次试验,数据以“平均值±标准差”表示。使用Design-Expert 8.0.6.1软件进行响应面试验设计及其结果分析。使用OMNIC和PeakFit 4.0软件分析傅里叶变换中远红外光谱。采用SPSS软件对数据进行方差分析,采用Origin 9.0软件作图,不同小写字母表示样本间存在显著差异(P<0.05)。
2 结果与分析
2.1 单因素条件对EGCG-PSA复合物EAI的影响
如图1-a~图1-d所示,EGCG-PSA EAI均呈先增加后减小的趋势。在一定EGCG比例范围内,浓度较高的EGCG能够提供充足的活化羟基,增强与PSA结合的疏水相互作用[21],当PSA与EGCG的比例为1∶1时,体系EAI为(1.76±0.11) m2/g高于其余各组(图1-a)。pH通过溶液中氢供体数量来影响EGCG与PSA间的氢键作用进而影响EGCG-PSA的EAI,在pH为6.0时,EGCG-PSA复合物的EAI为(1.81±0.06) m2/g,达到最大值(图1-b)。但pH过高,碱性过强,PSA结构会被破坏,氢原子受体位点减少从而导致结合作用减弱[22]。反应温度会影响蛋白质空间结构,在低温加热的过程中蛋白质部分化学键发生断裂,PSA分子构型逐渐展开,原先被包裹在球状分子内部的疏水性基团开始逐渐暴露出来,改变了颗粒表面疏水基团和亲水基团的比例,从而提高EGCG-PSA复合物EAI,当加热到40 ℃时,EGCG-PSA复合物的EAI达到最大(图1-c)。但温度的继续升高可能会导致分子热聚集现象的存在,限制复合物在界面展开,降低EAI[23]。反应时间对PSA和EGCG之间相互作用产生影响,当反应时间为40 min时,EGCG-PSA复合物的EAI为(1.70±0.11) m2/g,达到最大值。PSA和EGCG之间的作用十分复杂,其包含共价作用及非共价作用力等,随着时间的延长可能会使PSA和EGCG之间非共价作用力逐渐显示出不稳定性[11],EAI降低。
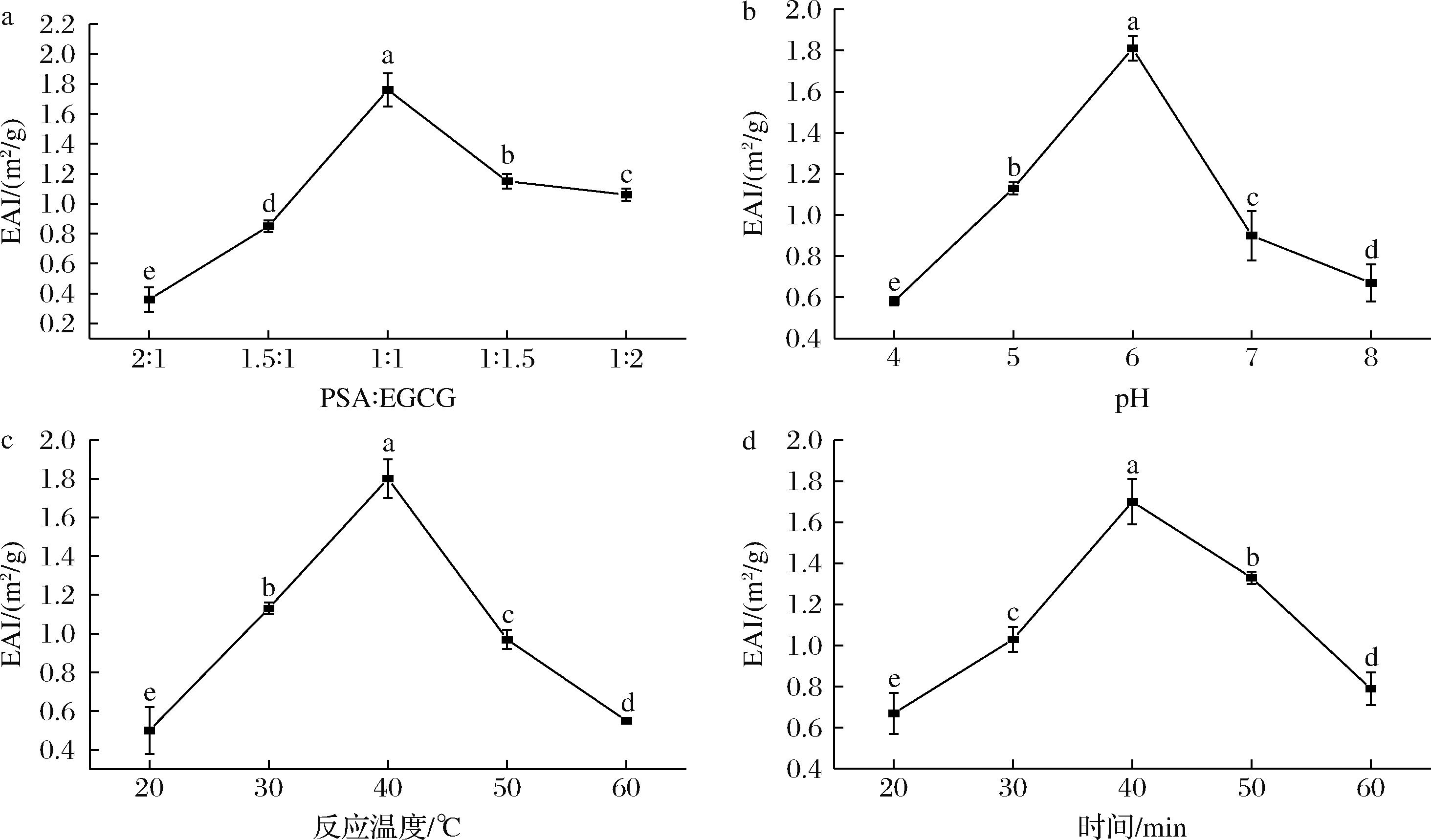
a-PSA∶EGCG;b-pH;c-反应温度;d-反应时间
图1 不同单因素条件对EGCG-PSA EAI的影响
Fig.1 Effect of different univariate conditions on the EAI of EGCG-PSA
注:不同的小写字母表示样本之间存在显著性差异(P<0.05)。
2.2 响应面试验
2.2.1 响应面设计及结果
基于2.1节单因素的试验结果,以EGCG-PSA复合物的EAI为响应值,进行响应面试验设计,对EGCG-PSA复合物的工艺制备条件进行优化,其试验设计方案及结果如表2所示。
表2 响应面试验设计方案及结果
Table 2 Response surface experimental design scheme and results
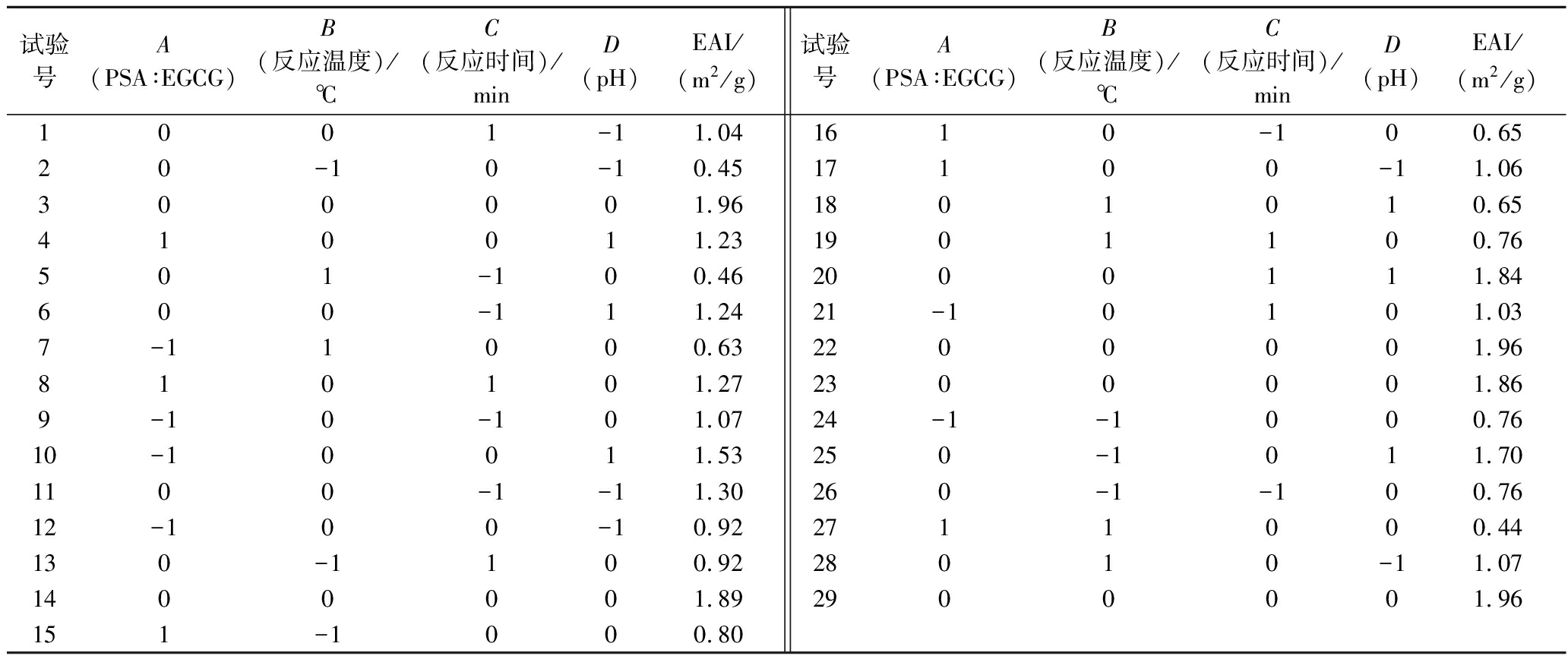
试验号A(PSA∶EGCG)B(反应温度)/℃C(反应时间)/minD(pH)EAI/(m2/g)试验号A(PSA∶EGCG)B(反应温度)/℃C(反应时间)/minD(pH)EAI/(m2/g)1001-11.0420-10-10.45300001.96410011.23501-100.46600-111.247-11000.63810101.279-10-101.0710-10011.531100-1-11.3012-100-10.92130-1100.921400001.89151-1000.801610-100.6517100-11.061801010.651901100.762000111.8421-10101.032200001.962300001.8624-1-1000.76250-1011.70260-1-100.762711000.4428010-11.072900001.96
2.2.2 回归模型的方差及显著性分析
对表2中的试验数据进行多元回归拟合,得到自变量PSA∶EGCG(A)、反应温度(B)、反应时间(C)、pH(D)与EGCG-PSA复合物EAI(Y)之间的回归方程为:Y=-36.84+7.20A+0.89B+0.12C+3.94D-0.01AB+0.03AC-0.25AD+3.74BC-0.04BD+0.02CD-3.02A2-7.71B2-4.02C2-0.19D2。
由表3可知,模型P<0.000 1,达到极显著水平,失拟项为0.586 4,差异不显著(P>0.05),说明EGCG-PSA的EAI(Y)模型的拟合度较高,误差较小。EAI(Y)回归模型的相关系数R2=0.995 9,校正决定系数![]() 差异极显著(P<0.01),进一步说明该模型具有较好的可信度,可以较好的反应各个因素与EGCG-PSA复合物EAI的关系变化,并对其进行分析。根据表3中F值的大小,可以得出对EGCG-PSA的EAI影响大小的顺序为:pH(D)>反应时间(C)>反应温度(B)>PSA∶EGCG比例(A)。
差异极显著(P<0.01),进一步说明该模型具有较好的可信度,可以较好的反应各个因素与EGCG-PSA复合物EAI的关系变化,并对其进行分析。根据表3中F值的大小,可以得出对EGCG-PSA的EAI影响大小的顺序为:pH(D)>反应时间(C)>反应温度(B)>PSA∶EGCG比例(A)。
表3 EGCG-PSA EAI的方差分析表
Table 3 Variance analysis table of the EAI of EGCG-PSA
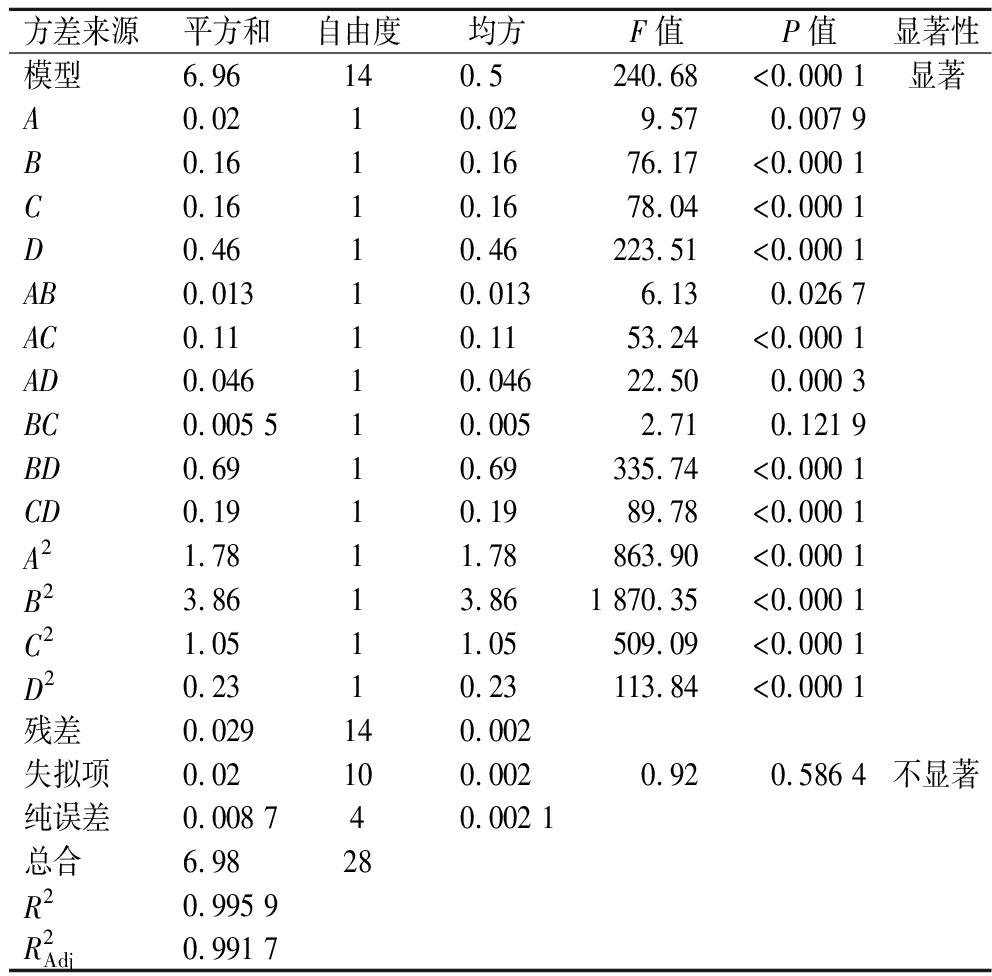
方差来源平方和自由度均方F值P值显著性模型6.96 140.5 240.68<0.000 1显著A0.0210.029.570.007 9B0.1610.1676.17<0.000 1C0.1610.1678.04<0.000 1D0.4610.46223.51<0.000 1AB0.01310.0136.130.026 7AC0.1110.1153.24<0.000 1AD0.04610.04622.500.000 3BC0.005 510.0052.710.121 9BD0.6910.69335.74<0.000 1CD0.1910.1989.78<0.000 1A21.7811.78863.90<0.000 1B23.8613.861 870.35<0.000 1C21.0511.05509.09<0.000 1D20.2310.23113.84<0.000 1残差0.029140.002失拟项0.02100.0020.920.586 4不显著纯误差0.008 740.002 1总合6.9828R20.995 9R2Adj0.991 7
注:P<0.01,影响极显著;P<0.05,影响显著。
2.2.3 响应面试验交互作用结果分析
通过Design-Expert 8.0.6.1软件深入分析了各个因素之间的交互作用,并由此生成响应面图与等高线图2和图3所示。回归模型的显著性检验表明对于EGCG-PSA复合物的EAI,一次项A(PSA∶EGCG)、B(反应温度)、C(反应时间)、D(pH)的影响极为显著(P<0.01),而交互项AB的影响也是极显著的(P<0.01)。此外,AC、AD、BD和CD的影响是显著的(P<0.05),而BC的影响则不显著。至于二次项,它们对EGCG-PSA复合物的EAI都有极显著的影响(P<0.01)。EGCG-PSA复合物的EAI与各个因素之间的关系并非简单的线性联系。实际上,随着反应因素的变化,EGCG-PSA复合物EAI表现出一种先上升后下降的趋势。此外,响应面坡度越陡峭,响应值对各因素变化的反应就越灵敏。
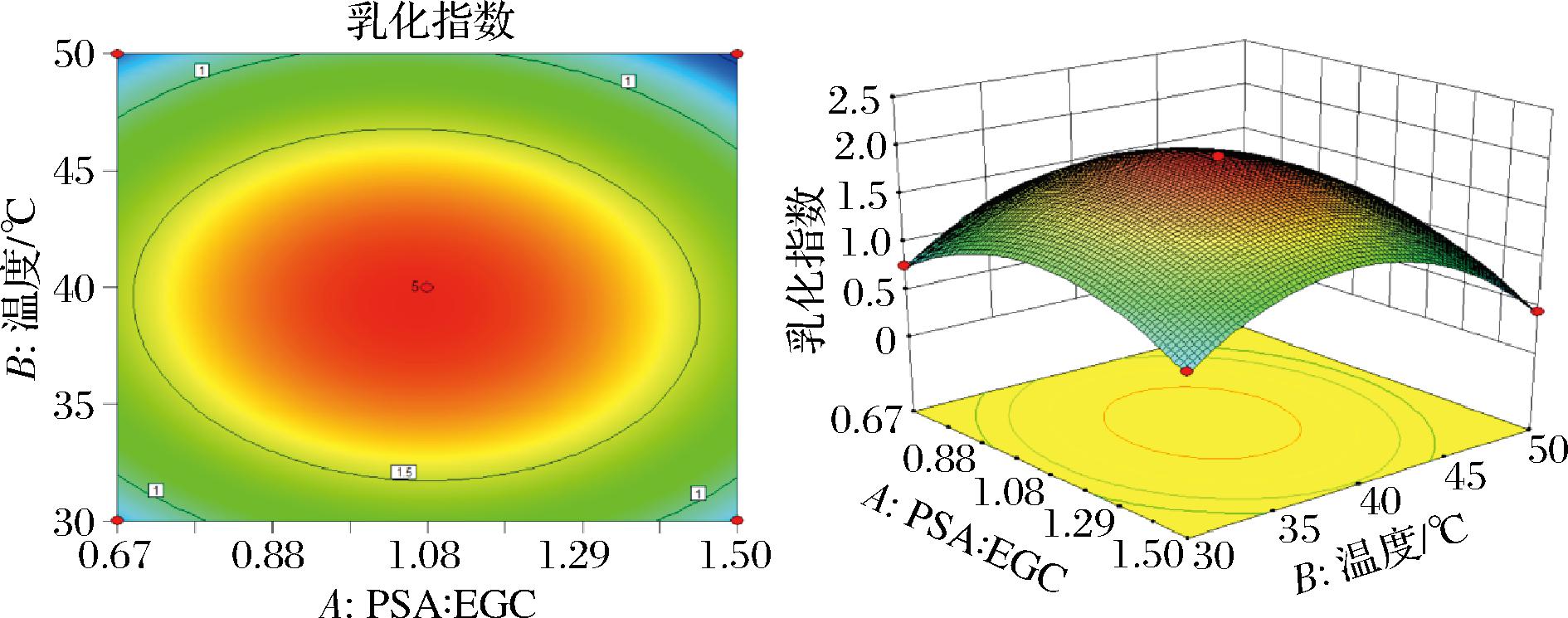
图2 EGCG与PSA浓度比例与温度对EGCG-PSA EAI的影响
Fig.2 Effect of ratio versus temperature on the EAI of EGCG-PSA
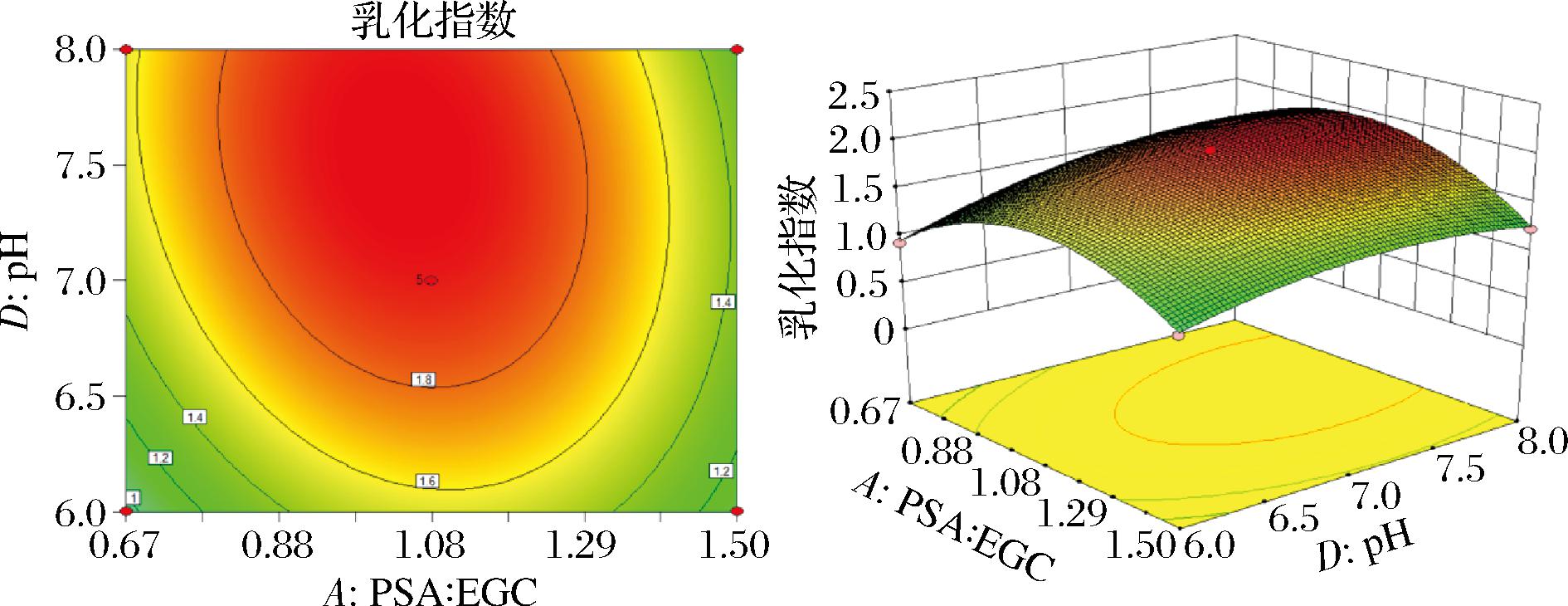
图3 EGCG与PSA浓度比例与pH对EGCG-PSA EAI的影响
Fig.3 Effect of ratio versus pH on the EAI of EGCG-PSA
2.2.4 响应面试验验证
根据响应面优化结果,通过回归模型预测得到EGCG-PSA复合物的最佳制备工艺参数为PSA∶EGCG 1∶1.22、pH 7.73、反应温度38.02 ℃、反应时间45.75 min,此时EAI为1.99 m2/g。考虑到实际操作,将制备工艺条件调整为PSA∶EGCG 1∶1、pH 8、反应温度40 ℃、反应时间45 min,验证试验重复3次,得到该条件下EGCG-PSA复合物的EAI,相对误差为1.13%,与理论值较为接近。
2.3 结构表征
2.3.1 扫描电镜
为了探究EGCG-PSA复合物表面微观结构的变化,使用扫描电镜观察样品。由图4可见,PSA呈现颗粒和片状结构,表面光滑且结构致密,而EGCG-PSA复合物是表面粗糙不光滑的颗粒物,结构较为松散。这表明EGCG的引入改变了PSA的微观结构。这种结构变化可能与EGCG能够调节PSA分子间的相互作用,改变PSA分子的自组装有关[23]。

a-PSA;b-EGCG-PSA
图4 PSA与EGCG-PSA的扫描电镜图(2 000×)
Fig.4 Scanning electron microscopy of PSA and EGCG-PSA (2 000×)
2.3.2 粒径、PDI和zeta电位分析
粒径大小是直观表征颗粒大小的指标,如表4所示,与EGCG结合后,PSA的粒径、PDI和zeta电位显著减小(P<0.05)至(168.65±0.81) nm、(0.17±0.01)、(-20.48±0.22) mV。这可能是因为EGCG通过非共价结合诱导了复合物的尺寸减小,同时增强了静电斥力和颗粒的负电性,从而稳定了复合物结构并防止颗粒大规模聚集。数据表明,EGCG的加入有效保持了颗粒间的距离,减少了蛋白质的自聚集倾向,使EGCG-PSA复合物分散性良好,溶液趋于稳定。这与CHANG等[24]的研究结果一致,即随着阿魏酸浓度的增加,卵清蛋白-阿魏酸复合物的粒径在一定范围内减小,而PDI和zeta电位也出现相应变化。具体来说,在高浓度阿魏酸条件下,阿魏酸通过其去质子化产生的高负电荷密度,结合蛋白质上的阳离子位点,从而降低复合物的正电荷,增加其负电性,并显著提高分散稳定性。类似地,本研究中EGCG的多羟基结构赋予其与PSA结合后更强的负电性和较低的PDI值,使得复合物在溶液中更加稳定并防止聚集。
表4 PSA与EGCG-PSA的粒径、PDI和zeta电位
Table 4 Particle size, PDI, and zeta potentials of PSA versus EGCG-PSA

样品粒径/nmPDIzeta电位/mVPSA208.94±0.35a0.22±0.06a-9.08±0.45aEGCG-PSA168.65±0.81b0.17±0.01b-20.48±0.22b
注:不同小写字母表示组间差异显著(P<0.05)(下同)。
2.3.3 傅里叶红外光谱
如图5所示,PSA峰的位置和面积与EGCG-PSA复合物不同,波长从1 656.15 cm-1略微蓝移至1 653.58 cm-1,这表明了EGCG-PSA复合物中C—N共价键的伸缩振动现象,由此可推断EGCG与PSA之间能够通过C—N共价键产生相互作用。在酰胺II带(3 500~3 200 cm-1)中,EGCG-PSA复合物的峰形变宽,表明EGCG-PSA复合物中形成了新的氢键并增加了分子间的缔合作用。这表明了EGCG-PSA复合物的产生。这与CHENG等[25]对乳清蛋白浓缩物与槲皮素结合研究中的结果一致,在乳清蛋白浓缩物与槲皮素的复合物中,酰胺I和酰胺II带分别从1 656、1 539 cm-1蓝移至1 651、1 535 cm-1,表明肽键的C![]() O基团、N—H键和C—N键参与了复合物的形成。类似地,本研究中的EGCG-PSA复合物在酰胺I和酰胺II带的变化同样表明了EGCG与PSA分子间的氢键和共价作用,EGCG分子中羟基与PSA的氨基结合,导致了光谱中吸收峰的微小移位,反映了PSA分子结构的改变和复合物的生成。此外,EGCG-PSA复合物的光谱曲线在1 600~1 063 cm-1和825~736 cm-1处均出现新的吸收峰,这也表明了EGCG的引入导致了PSA结构的重新排列和EGCG-PSA复合物的形成。
O基团、N—H键和C—N键参与了复合物的形成。类似地,本研究中的EGCG-PSA复合物在酰胺I和酰胺II带的变化同样表明了EGCG与PSA分子间的氢键和共价作用,EGCG分子中羟基与PSA的氨基结合,导致了光谱中吸收峰的微小移位,反映了PSA分子结构的改变和复合物的生成。此外,EGCG-PSA复合物的光谱曲线在1 600~1 063 cm-1和825~736 cm-1处均出现新的吸收峰,这也表明了EGCG的引入导致了PSA结构的重新排列和EGCG-PSA复合物的形成。
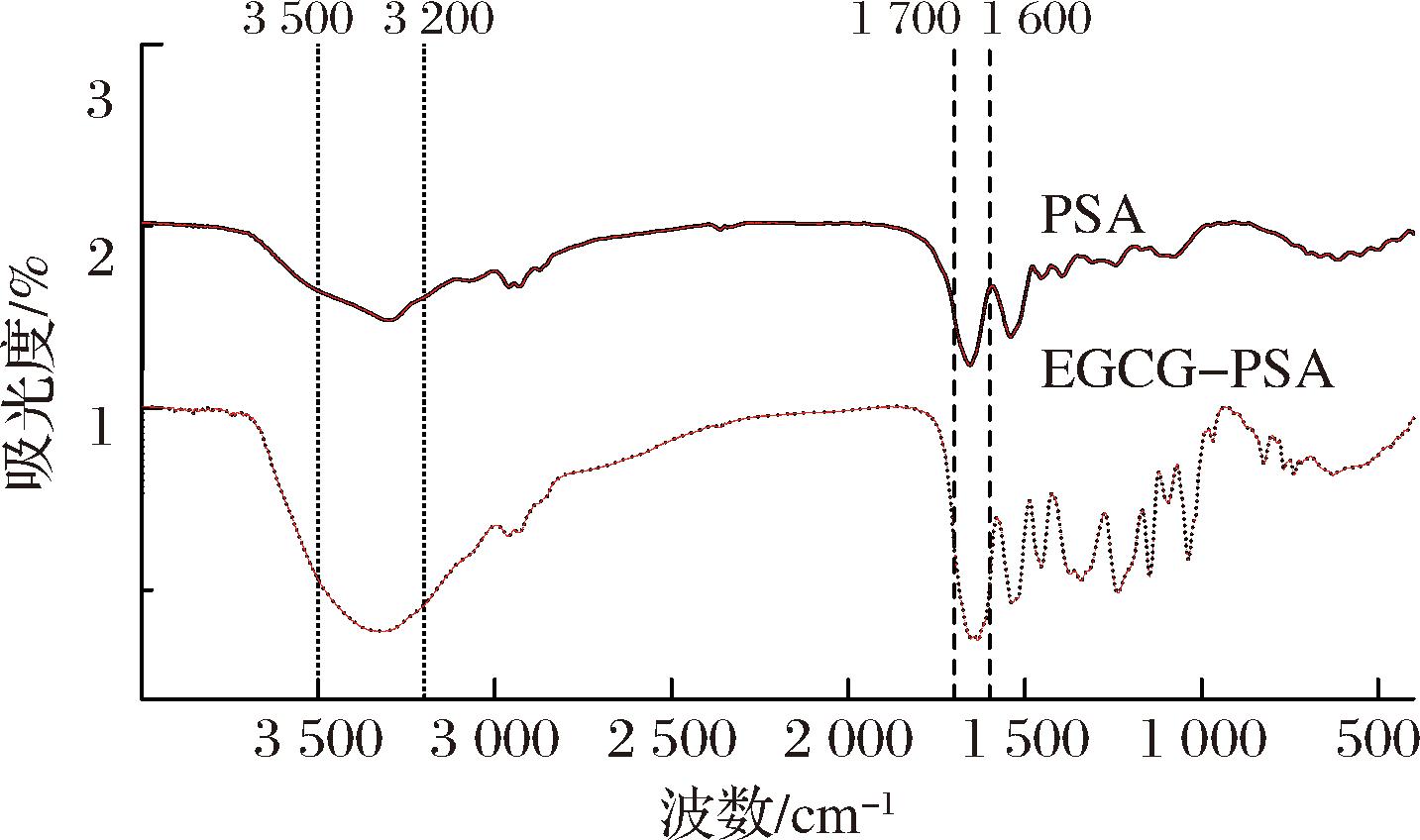
图5 PSA与EGCG-PSA复合物的傅里叶变换红外光谱图
Fig.5 Fourier transform infrared spectra of PSA and EGCG-PSA complexes
表5为PSA及EGCG-PSA复合物的酰胺I带(1 700~1 600 cm-1)二级结构组成比例。由表可知,与PSA相比,EGCG-PSA复合物二级结构中的α-螺旋由(20.88±0.44)%增加至(21.14±0.57)%,β-折叠由(19.39±0.41)%增加至(33.87±0.41)%,β-转角由(41.23±0.64)%减少至(27.60±2.28)%,无规则卷曲由(18.50±0.41)%减少至(17.38±0.41)%(P<0.05),这与LIU等[26]对WIP-EGCG的研究结果一致。α-螺旋的增加,说明PSA分子内氢键增多,结构聚集,表明EGCG的引入促进PSA分子内新的氢键形成,推测新的氢键可能为EGCG的酚羟基与PSA中的羰基结合导致氢键的重排所致;β-折叠结构的增加,说明PSA分子间氢键增多、分子伸展;β-转角含量减少,表明PSA蛋白分子更加分散;无规则卷曲结构降低,可能是由于EGCG与PSA形成了球状复合物。EGCG的羟基与PSA的氨基结合后形成氢键,这一过程导致氨基中的N—H键键能发生变化,进而引起蛋白分子内部氢键的变化,最终导致PSA二级结构的变化。
表5 PSA与EGCG-PSA的酰胺Ⅰ带二级结构组成 单位:%
Table 5 Composition of secondary structure of PSA and EGCG-PSA in amide I band
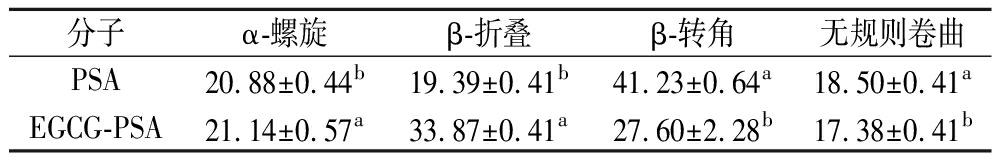
分子α-螺旋β-折叠β-转角无规则卷曲PSA20.88±0.44b19.39±0.41b41.23±0.64a18.50±0.41aEGCG-PSA21.14±0.57a33.87±0.41a27.60±2.28b17.38±0.41b
2.4 功能特性
2.4.1 溶解性、浊度与表面疏水性分析
溶解性直观地反映了蛋白的亲水性,表面疏水性值反映了蛋白质表面疏水区域的暴露程度,浊度表明溶液中颗粒的聚集程度。由表6可知,相较于PSA,EGCG-PSA的溶解度升高了6.55%(P<0.05),这可能是由于EGCG促使PSA本身的结构展开,使原本隐藏的亲水基团暴露出来;也可能是EGCG与PSA结合后改变了其构象,EGCG与PSA上暴露的疏水氨基酸侧链结合后增加了PSA亲水性。EGCG具有的芳香环结构包含多个羟基,可以与PSA肽骨架的酰胺碳基形成强氢键,与PSA结合后,更多的羟基会附着在PSA上,形成一个更亲水的环境,从而提高了溶解性。EGCG-PSA复合物的表面疏水性降低了15.26%(P<0.05),这可能是因为EGCG增加了羟基、羧基等极性基团的数量,使PSA周围环境的极性发生变化,降低了表面疏水性。此外,EGCG与PSA游离的疏水氨基酸残基发生反应,使疏水残基减少导致疏水性降低[23]。这与黄国等[27]的研究类似,EGCG与PSA相互作用降低了蛋白质的表面疏水性。结果还表明,表面疏水力是主要的结合力之一。另外相较于PSA,EGCG-PSA复合物的浊度增加了7.54%(P<0.05),这可能是由于EGCG的加入,两个EGCG-PSA复合物形成二聚体。随着连接的进行,体系中的网状结构逐渐增多,产生较大的聚集体,进一步增强光散射强度。
表6 PSA与EGCG-PSA的溶解度、浊度和表面疏水性的变化 单位:%
Table 6 Solubility, turbidity, and surface hydrophobicity in PSA and EGCG-PSA
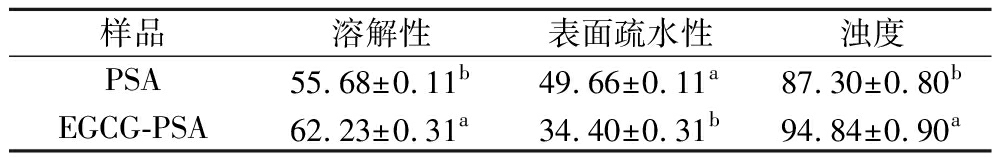
样品溶解性表面疏水性浊度PSA55.68±0.11b49.66±0.11a87.30±0.80bEGCG-PSA62.23±0.31a34.40±0.31b94.84±0.90a
2.4.2 EAI及ESI分析
ESI指形成的乳液保持稳定而不发生絮凝或分层的能力,而EAI指蛋白质或其他乳化剂在新形成的液滴表面的吸附能力,这降低了油相和水相之间的界面张力,稳定了乳液[28-29]。由图6可知,与PSA相比,EGCG-PSA复合物的EAI和ESI分别提高了54.16 m2/g和49.41%,EGCG的加入改变了PSA之间的相互作用,使得PSA结构中的大量疏水基团暴露出来,EGCG-PSA复合物在一定程度上增加了液滴之间的空间屏障和静电排斥,界面层的形成导致乳液滴尺寸减小,导致油-水界面的界面张力降低,阻止了液滴的聚集,从而提高了PSA的EAI与ESI[30]。EAI的改善是由于蛋白质柔性结构含量的增加,这使得蛋白质分子在油水界面上更有效地展开和重排。ESI与表面电荷有关,EGCG的引入导致液滴间的静电排斥力增强,提高了乳液的稳定性。此外,也有研究表明乳化性与粒径相关,如WANG等[31]发现α-乳清蛋白与EGCG的复合物乳液粒径减小,从而提高了其EAI;CUI等[32]的研究发现芦丁可以降低大豆分离蛋白水包油型乳液的粒径和界面张力,同时提高其EAI和ESI。
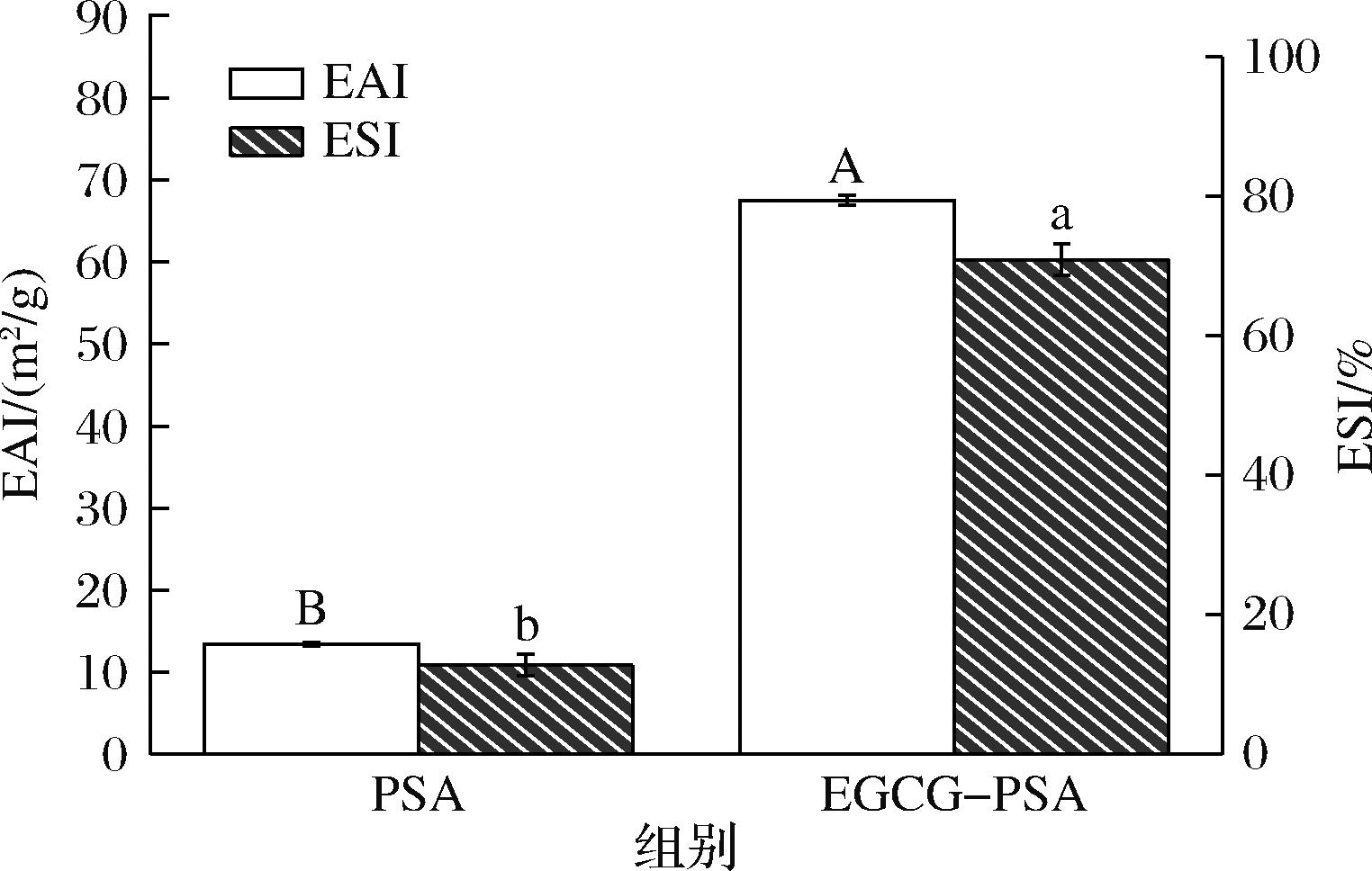
图6 PSA与EGCG-PSA的EAI与ESI
Fig.6 EAI and ESI of PSA and EGCG-PSA
注:不同大小写字母分别表示同一指标组间差异显著(P<0.05)(下同)。
2.4.3 FAI和FSI分析
表面活性、分子的灵活性和疏水性对于蛋白质的泡沫形成起着重要作用。如图7所示,当与EGCG反应后,PSA的FAI能得到显著提高,FAI和FSI分别提高了10%和20%(P<0.05)。这可能是由于EGCG-PSA复合物溶解度的增加和分子结构的改变,允许更多的蛋白质分子转移到空气-水界面,从而提高了蛋白质的分子灵活性。EGCG-PSA复合物比PSA具有更高的发泡能力,因此具有更高的内在黏度。虽然EGCG与PSA疏水性基团的结合会限制PSA分子在界面的展开和嵌入,以及蛋白质分子间的相互作用,EGCG可以在PSA分子之间发挥交联作用,通过非共价或共价作用力形成较厚的蛋白质吸附层,这有利于诱导分离和聚结过程的延迟,减缓气泡的运动从而增加FSI[33]。
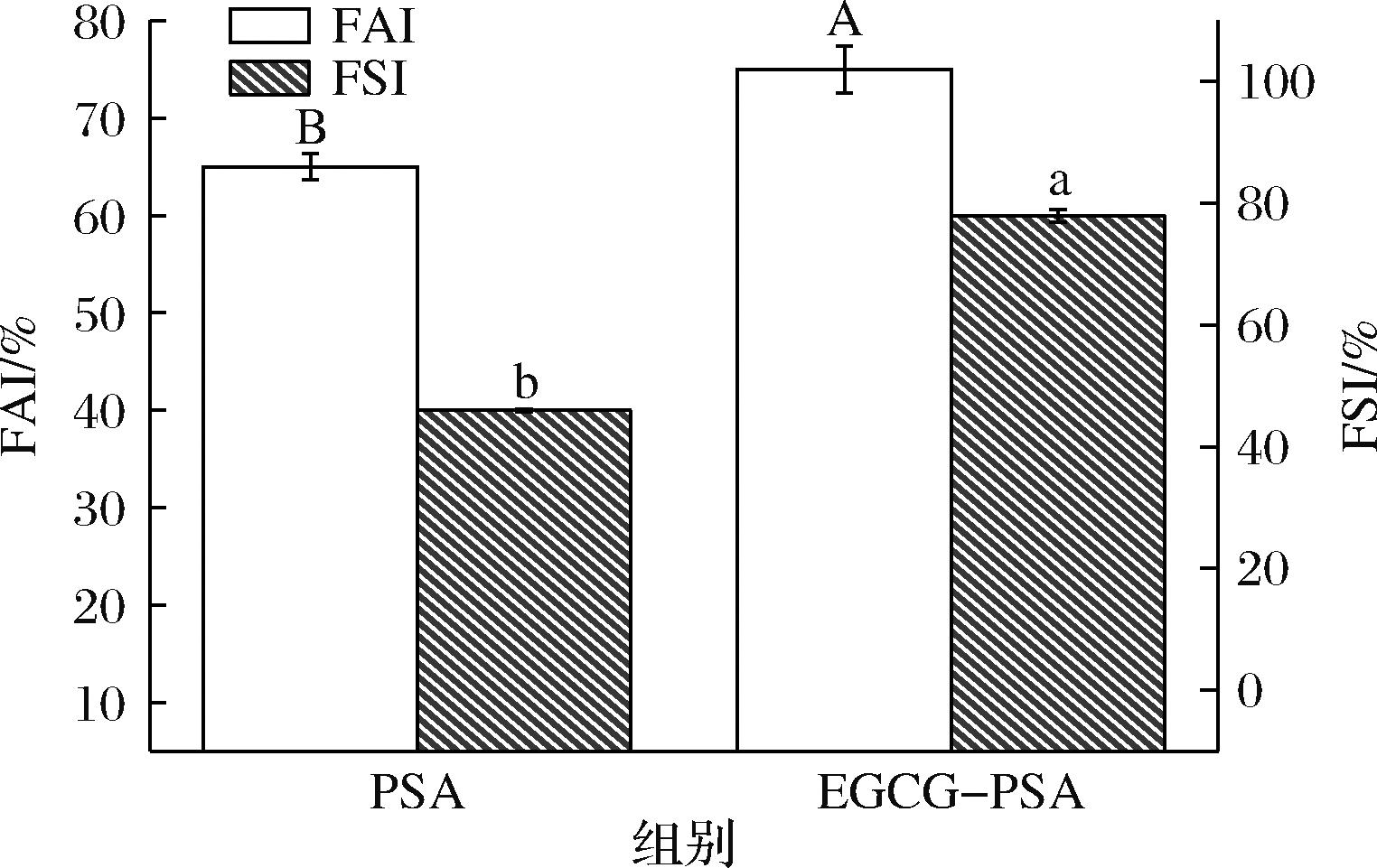
图7 PSA与EGCG-PSA的FAI和FSI
Fig.7 FAI and FSI of PSA versus EGCG-PSA
2.4.4 抗氧化性分析
由图8可知,与PSA相比,EGCG-PSA复合物的ABTS阳离子自由基清除率显著增加了28.60%(P<0.05)。这说明EGCG与PSA的结合能够使其抗氧化性稳定表达。这与它们的溶解度高度正相关。当抗氧化物质EGCG存在时,ABTS阳离子的生成会受到抑制。因此,EGCG-PSA复合物具有更高的自由基清除率。也有部分原因是PSA上的一些反应位点在结合后可能被暴露,增加了EGCG-PSA复合物的抗氧化性[23]。EGCG-PSA复合物的DPPH自由基清除率显著增加了31.30%(P<0.05)。这可能是由于蛋白质表面的羟基数目的增多,通过酚羟基和自体基团的反应,可以生成稳定的半醌化合物。半醌化合物将未成对的电子捐赠给DPPH自由基,使其从自由基状态转化为稳定的分子状态,电子转移后,DPPH自由基被还原,从而终止自由基链式反应。这一过程有助于提升其抗氧化能力[34]。复合物中含有EGCG,与PSA非共价结合,这种结合态使得多酚更加稳定,使EGCG-PSA具有较高的抗氧化性。
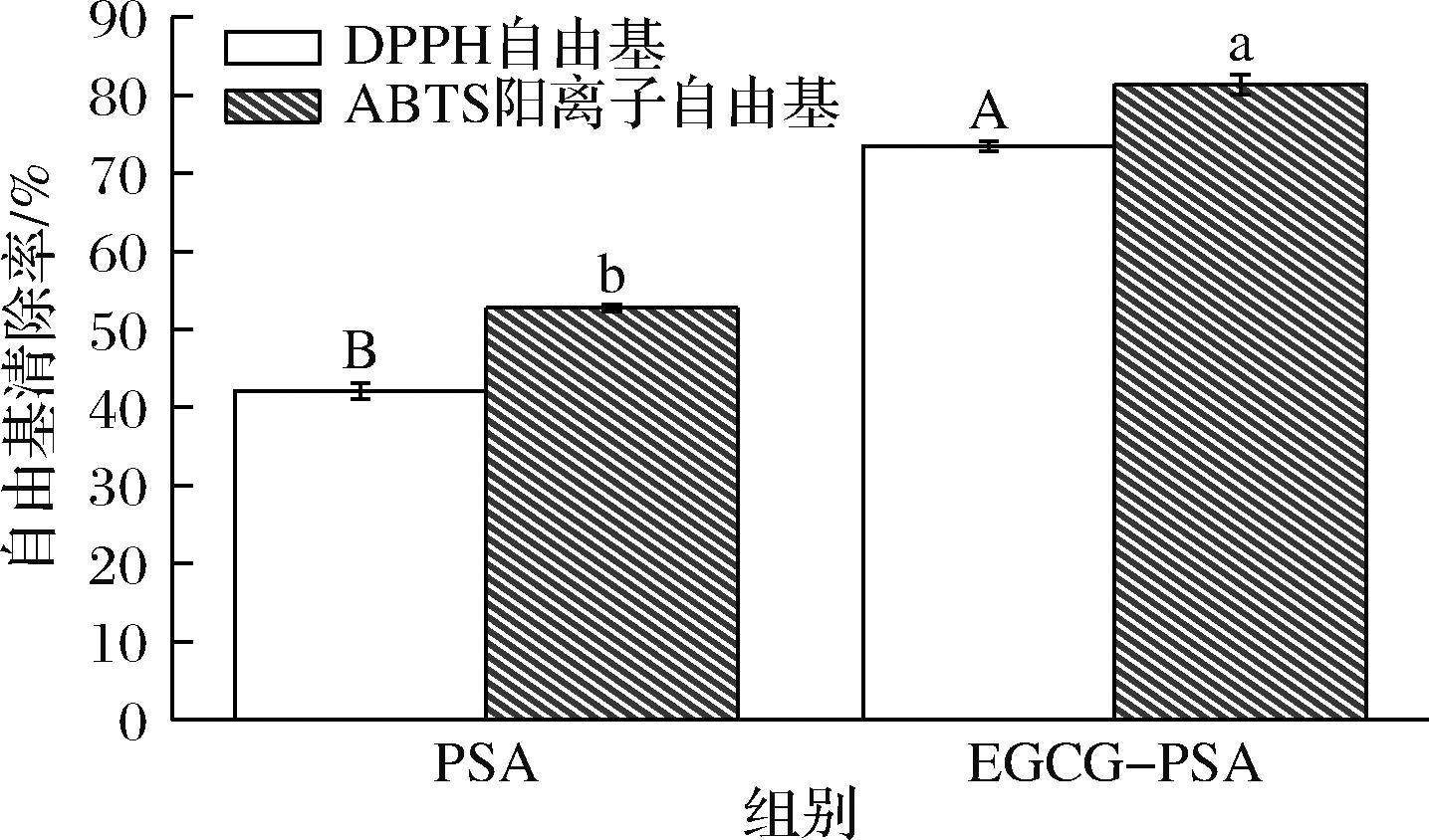
图8 PSA与EGCG-PSA的DPPH和ABTS阳离子自由基清除能力
Fig.8 DPPH and ABTS cationic radical scavenging ability of PSA versus EGCG-PSA
3 结论
本研究通过单因素试验和响应面法优化了EGCG-PSA复合物的制备工艺,并对其结构与功能特性进行了详细分析。结果表明,制备复合物的最佳工艺为PSA∶EGCG 1∶1、pH 8、反应温度40 ℃、反应时间45 min。EGCG的加入显著改善了PSA的溶解性、浊度、EAI和ESI、FAI和FSI,降低了其表面疏水性(P<0.05)。在最优工艺条件下制备的EGCG-PSA复合物对DPPH自由基清除率和ABTS阳离子自由基清除率分别增加了31.30%和28.60%(P<0.05)。这些功能的有利改变归因于PSA与多酚结合后结构的变化。EGCG能够抑制PSA的大规模聚集形成更大的聚集体。傅里叶红外光谱和扫描电镜结果显示,EGCG的引入改变了PSA的空间构象和微观结构。这些变化都促进了蛋白质的稳定性提升,增强了PSA的功能性应用潜力。本研究证明了EGCG对PSA功能特性的显著改善,特别是在食品工业应用中的潜在价值,为猪血资源的高值化利用提供了新思路。但本研究仅对EGCG-PSA复合物的结构变化进行了初步探究,未来的研究将通过多光谱法与分子对接研究EGCG与PSA相互作用机制,并扩展其在其他功能性食品中的应用。
[1] LIU L L, GUO J F, WANG Z, et al.Effect of interaction between catechin and glycated porcine hemoglobin on its antioxidant functional and structural properties[J].LWT, 2023, 182:114868.
[2] 李滢, 张远红, 董浩, 等.动物血液蛋白质及活性肽开发研究进展[J].食品安全质量检测学报, 2023, 14(7):39-47.LI Y, ZHANG Y H, DONG H, et al.Advances in the development of animal blood protein and bioactive peptides[J].Journal of Food Safety &Quality, 2023, 14(7):39-47.
[3] MAHMUD A H, SALAHUDDIN N M, MD JANI A M, et al.A voltammetric immunosensor based on a nanoporous alumina millirod for detection of porcine serum albumin[J].Food Chemistry, 2023, 411:135493.
[4] 管勤昊, 汤丽华, 张亮亮, 等.多酚类化合物结构对其与蛋白相互作用影响研究进展[J].食品研究与开发, 2023, 44(23):182-190.GUAN Q H, TANG L H, ZHANG L L, et al.Structure-activity relationships of polyphenols interacting with proteins[J].Food Research and Development, 2023, 44(23):182-190.
[5] 张雪春, 茹月蓉, 程群, 等.八种多酚与核桃蛋白相互作用的研究[J].食品与发酵工业, 2022, 48(12):97-104.ZHANG X C, RU Y R, CHENG Q, et al.Studies of interaction between eight polyphenols and walnut protein[J].Food and Fermentation Industries, 2022, 48(12):97-104.
[6] KAREFYLLAKIS D, SALAKOU S, BITTER J H, et al.Covalent bonding of chlorogenic acid induces structural modifications on sunflower proteins[J].ChemPhysChem, 2018, 19(4):459-468.
[7] ZHOU S D, LIN Y F, XU X, et al.Effect of non-covalent and covalent complexation of (-)-epigallocatechin gallate with soybean protein isolate on protein structure and in vitro digestion characteristics[J].Food Chemistry, 2020, 309:125718.
[8] 李璐璐, 杨杨, 马春敏, 等.汉麻蛋白与EGCG复合物的制备及应用[J].包装与食品机械, 2024, 42(5):24-33.LI L L, YANG Y, MA C M, et al.The preparation and application of hemp protein and EGCG complex[J].Packaging and Food Machinery, 2024, 42(5):24-33.
[9] 焦瑶瑶, 张卫兵, 杨敏, 等.茶多酚与牛乳蛋白相互作用对乳制品功能特性和生物学效应影响的研究进展[J].乳业科学与技术, 2018, 41(6):42-47.JIAO Y Y, ZHANG W B, YANG M, et al.Advances in research on effects of interaction between tea polyphenols and milk proteins on functional properties and bioavailability of dairy products[J].Journal of Dairy Science and Technology, 2018, 41(6):42-47.
[10] TIAN C, FENG Y C, CHEN T H, et al.EGCG restores keratinocyte autophagy to promote diabetic wound healing through the AMPK/ULK1 pathway[J].Frontiers in Bioscience, 2023, 28(12):324.
[11] 李金铭. 基于共价修饰的鸡蛋蛋白-儿茶素复合物制备及应用[D].长春:吉林大学, 2022.LI J M.Fabrication and application of egg protein-catechins conjugates based on covalent modification[D].Changchun:Jilin University, 2022.
[12] 张燕鹏, 张曼君, 刁云春, 等.复合米糠蛋白-卵白蛋白的起泡特性及相关机理分析[J].食品科学, 2022, 43(12):81-86.ZHANG Y P, ZHANG M J, DIAO Y C, et al.Foaming characteristics and underlying mechanism of rice bran protein-ovalbumin mixtures[J].Food Science, 2022, 43(12):81-86.
[13] ROY D, DUTTA S, MAITY S S, et al.Spectroscopic and docking studies of the binding of two stereoisomeric antioxidant catechins to serum albumins[J].Journal of Luminescence, 2012, 132(6):1364-1375.
[14] 黄子林, 陈思蕊, 孔祥珍, 等.核桃衣多酚改性对植物蛋白溶解性和抗氧化活性的影响[J].中国油脂, 2023, 48(4):112-118.HUANG Z L, CHEN S R, KONG X Z, et al.Effect of walnut pellicle polyphenols modification on solubility and antioxidant activity of vegetable protein[J].China Oils and Fats, 2023, 48(4):112-118.
[15] 贾娜, 林世文, 王乐田, 等.没食子酸诱导肌原纤维蛋白巯基含量和表面疏水性变化对蛋白凝胶特性的影响[J].食品科学, 2020, 41(22):1-7.JIA N, LIN S W, WANG L T, et al.Effects of changes in sulfhydryl content and surface hydrophobicity of myofibrillar protein induced by gallic acid on its gel properties[J].Food Science, 2020, 41(22):1-7.
[16] 张雨萌. 果胶—乳清蛋白共混体系对多酚稳定性的影响机制[D].杨凌:西北农林科技大学, 2019.ZHANG Y M.Effects of pectin-whey protein blends on the stability of polyphenols[D].Yangling:Northwest A&F University, 2019.
[17] 赵新如, 程建明, 薛峰.限制性酶解修饰对郁李仁分离蛋白结构和功能特性的影响[J].南京中医药大学学报, 2023, 39(9):888-894.ZHAO X R, CHENG J M, XUE F.Effects of restrictive enzymatic hydrolysis modification on structure and functional properties of plum seed protein isolates[J].Journal of Nanjing University of Traditional Chinese Medicine, 2023, 39(9):888-894.
[18] 解长远, 王中江, 郭增旺, 等.射流空化对大豆11S球蛋白结构和功能特性的影响[J].食品科学, 2020, 41(9):57-65.XIE C Y, WANG Z J, GUO Z W, et al.Effect of jet cavitation on the structure and functional properties of soybean 11S globulin[J].Food Science, 2020, 41(9):57-65.
[19] 刘晶, 胡晓, 杨贤庆, 等.龙须菜蛋白质的提取及其酶解产物的抗氧化特性[J].浙江农业学报, 2022, 34(5):1061-1072.LIU J, HU X, YANG X Q, et al.Extraction and antioxidant activity of enzymolysis products of Gracilaria lemaneiformis protein[J].Acta Agriculturae Zhejiangensis, 2022, 34(5):1061-1072.
[20] 杨文清, 罗凯, 陈耀兵.山桐子蛋白提取工艺优化及功能特性研究[J].中国粮油学报, 2024, 39(3):89-97.YANG W Q, LUO K, CHEN Y B.Optimization of extraction process and functional properties of Idesia polycarpa Maxim.protein[J].Journal of the Chinese Cereals and Oils, 2024, 39(3):89-97.
[21] 席冠鹏. 多酚对β-伴大豆球蛋白免疫特性及功能性的影响研究[D].郑州:河南工业大学, 2023.XI G P.Study on the effect of polyphenols onimmune characteristics and functional properties of β-conglycinin[D].Zhengzhou:Henan University of Technology, 2023.
[22] 杨杨, 王梦桔, 王悦, 等.罗望子种仁球蛋白-EGCG共价复合物的制备及其在乳化香肠中的应用[J].食品科学, 2023, 44(4):64-70.YANG Y, WANG M J, WANG Y, et al.Preparation of tamarind seed globulin-EGCG covalent complex and its application in emulsified sausages[J].Food Science, 2023, 44(4):64-70.
[23] ZHAO Q, YU X J, ZHOU C S, et al.Effects of collagen and casein with phenolic compounds interactions on protein in vitro digestion and antioxidation[J].LWT, 2020, 124:109192.
[24] CHANG K F, LIU J B, JIANG W, et al.Ferulic acid-ovalbumin protein nanoparticles:Structure and foaming behavior[J].Food Research International, 2020, 136:109311.
[25] CHENG J J, DUDU O E, ZHANG J, et al.Impact of binding interaction modes between whey protein concentrate and quercetin on protein structural and functional characteristics[J].Food Hydrocolloids, 2023, 142:108787.
[26] LIU X J, SONG Q B, LI X, et al.Effects of different dietary polyphenols on conformational changes and functional properties of protein-polyphenol covalent complexes[J].Food Chemistry, 2021, 361:130071.
[27] 黄国, 田泽鹏, 薛丽莹, 等.EGCG与β-伴大豆球蛋白/大豆球蛋白相互作用对蛋白质结构的影响[J].食品科学, 2022, 43(12):1-9.HUANG G, TIAN Z P, XUE L Y, et al.Effect of interaction between EGCG and soy β-conglycinin/glycinin on protein structure[J].Food Science, 2022, 43(12):1-9.
[28] CHAILANGKA A, SEESURIYACHAN P, WANGTUEAI S, et al.Cricket protein conjugated with different degrees of polymerization saccharides by Maillard reaction as a novel functional ingredient[J].Food Chemistry, 2022, 395:133594.
[29] 王丹. 紫苏蛋白接枝改性及其乳液递送系统构建研究[D].太原:中北大学, 2023.WANG D.Study on graft modification of perilla protein and construction of its emulsion delivery systems[D].Taiyuan:North University of China, 2023.
[30] 魏骊霏. 枣渣结合态多酚的提取及对核桃清蛋白共价改性的研究[D].阿拉尔:塔里木大学, 2023.WEI L F.Study on extraction of jujube residue bound polyphenols and covalent modification of walnut albumin[D].Alaer:Tarim University, 2023.
[31] WANG X Y, ZHANG J, LEI F, et al.Covalent complexation and functional evaluation of (-)-epigallocatechin gallate and α-lactalbumin[J].Food Chemistry, 2014, 150:341-347.
[32] CUI Z M, KONG X Z, CHEN Y M, et al.Effects of rutin incorporation on the physical and oxidative stability of soy protein-stabilized emulsions[J].Food Hydrocolloids, 2014, 41:1-9.
[33] 曹艳芸. 乳清蛋白与多酚在中性pH条件下的相互作用对蛋白功能性质的影响研究[D].无锡:江南大学, 2017.CAO Y Y.Functionality modification of whey proteins induced by the binding with phytophenlics at neutural pH[D].Wuxi:Jiangnan University, 2017.
[34] 张晓歌. 乳清蛋白/豌豆蛋白与多酚类互作及运载体系制备[D].长春:吉林大学, 2023.ZHANG X G.Interaction of whey protein/pea protein with polyphenols and preparation of delivery system[D].Changchun:Jilin University, 2023.