肌原纤维蛋白(myofibrillar proteins, MPs)是肌肉组织中一种重要的结构蛋白,约占肌肉总蛋白含量的55%~60%[1]。MPs对肉糜类制品的保水性、质构、感官等特性起着重要作用,改善MPs凝胶特性对肉糜类制品的生产具有重要意义。外源添加物常常被作为改善MPs凝胶特性的手段之一,曹涓泉等[2]发现圆苞车前子壳粉可以改善MPs的凝胶特性及蛋白结构;曹云刚等[3]研究发现适量添加苹果膳食纤维对猪肉MPs的凝胶特性具有积极影响。
竹叶在我国具有悠久的食用和药用历史,近年的研究表明竹叶富含多种活性物质,如黄酮类化合物(包括东方苷、异东方苷等);酚酸(包括对香豆酸、咖啡酸等[4])。目前对竹叶产品的开发主要是集中于一些竹叶抗氧化物和竹叶黄酮,竹叶抗氧化物于2004年已被列为食品添加剂,竹叶黄酮于2014年被批准为“新食品原料”。除多种活性物质外,竹叶中还含有多种碳水化合物,如纤维素、半纤维素等,研究发现[5],竹叶中膳食纤维含量高达70%。竹纤维素除具有多种健康益处外,这些纤维还因其具有增稠、胶凝和保水能力被认为是增强食品结构性能的潜在成分,对食品的感官特性具有积极影响[6],研究发现[7],添加竹笋膳食纤维后的猪肉糜凝胶特性和保水性均得到改善。竹纤维产品,如Jelucel® BF、Nutriloid® Bamboo Fiber等已被应用于食品中,在增加产品的纤维含量的同时赋予了产品健康的特性,因此竹纤维被广泛用作无麸质产品的纤维来源[8]。与其他纤维相比,竹纤维具有来源广泛、价格低廉等特点。
竹叶粉(bamboo leaf powder, BLP)是受抹茶粉的工艺启发制得的一种超微粉末。四川省卫健委于2022年7月正式印发DBS51/010—2022《食品安全地方标准 竹叶粉》,首次在全国范围内明确了BLP的定义以及作为普通食品原料应用于各类食品的相关标准。王东霞等[9]已对BLP的食用安全性进行评价,确保其作为食品原料的安全性。付诗尧等[10]已将BLP创新应用于蛋糕、酸奶和牛轧糖中,黄李成[11]将BLP添加于戚风蛋糕中,这些创新竹食品在赋予产品绿色健康概念的同时,使产品具有良好品质和清香风味。但目前将BLP添加于肉制品的研究报道还很少见。
本研究所用BLP是由新鲜慈竹叶制成的超微粉末,将BLP添加于MPs中,考察了MPs的流变学特性、凝胶特性、蛋白结构和微观结构的变化,为创新型肉糜制品的开发和凝胶品质调控技术提供理论依据,同时有利于扩大竹叶的使用范围,提升竹资源经济价值。
1 材料与方法
1.1 材料与仪器
新鲜猪肉,雅安市浙联优选超市;鲜慈竹叶,摘自雅安市碧峰峡镇;ZnSO4、NaCl、MgCl2、EDTA、Na2HPO4、NaH2PO4、尿素、KBr、β-巯基乙醇,成都市科隆化学品有限公司;牛血清蛋白标准品,上海源叶生物科技有限公司;5×SDS-PAGE上样缓冲液,上海碧云天生物技术有限公司;彩色预染蛋白质Marker,南京建成生物工程研究所;SDS-PAGE凝胶,金斯瑞生物科技股份有限公司。
高能纳米冲击磨,秦皇岛市太极环纳米制品有限公司;2000马尔文激光粒度仪,英国马尔文仪器有限公司;高速均质乳化机,常州越新仪器制造有限公司;旋转流变仪,美国TA仪器公司;傅里叶红外光谱仪,赛默飞世尔科技有限公司;TA-XT plus型物性分析仪,美国TA公司;SU8020高分辨率发射扫描电镜,日立高新技术集团;UV-1800PC紫外分光光度计,上海美谱达仪器有限公司;Power PacTM HV电泳仪,美国Bio-Rad公司。
1.2 实验方法
1.2.1 BLP的制备
参考付诗尧[5]的方法制备BLP。选取新鲜翠绿的竹叶,清洗后使用质量分数为0.5%的ZnSO4溶液进行烫漂护色,置于80 ℃烘箱中烘干,初步粉碎后置于高能纳米冲击磨中进行超微粉碎,得到BLP。BLP粒径测定结果为d(0.9):47.58 μm。
1.2.2 BLP的主要成分的测定
参考GB 5009.3—2016《食品安全国家标准 食品中水分的测定》,GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》,GB 5009.88—2023《食品安全国家标准 食品中膳食纤维的测定》分别测定BLP的水分、蛋白质和膳食纤维含量。
1.2.3 MPs的提取
参照王子凌等[12]的方法,将肉糜与提取缓冲液(0.1 mol/L NaCl、2 mmol/L MgCl2、1 mmol/L EDTA、6.1 mmol/L Na2HPO4和3.9 mmol/L NaH2PO4, pH 7.0)(1∶4,g∶mL)混合匀浆(10 000 r/min, 30 s)后离心(6 000 r/min, 15 min, 4 ℃),重复3次。再将沉淀用0.1 mol/L NaCl溶液(1∶4,g∶mL)洗涤,并以相同的条件离心3次。最后一次离心之前,将悬浮液用三层纱布过滤,得到MPs,4 ℃储存备用(48 h内使用完)。
1.2.4 蛋白质含量的测定
采用双缩脲法测定蛋白质含量,以牛血清蛋白作为标准蛋白,制作蛋白质的标准曲线,通过实验测定的牛血清蛋白标准曲线为:y=0.051 8x+0.003 2,R2=0.999 8。
1.2.5 BLP- MPs复合溶胶/凝胶的制备
将MPs溶于50 mmol/L磷酸盐缓冲液(0.6 mol/L NaCl, pH 6.0)中匀浆得到MPs溶液,调节蛋白浓度至70 mg/mL,分别添加MPs质量分数0.5%、1%、1.5%、2.0%和2.5%的BLP,不添加BLP为空白对照组,均质至BLP在蛋白溶解中分布均匀,得到BLP-MPs复合溶胶。
取一部分蛋白溶胶置于离心管中,振荡去除气泡后于水浴锅中,以1 ℃/min的速率从室温逐渐加热至80 ℃,保存30 min,取出冷却后在4 ℃冰箱中保存备用,得到BLP-MPs复合凝胶。
1.2.6 流变特性的测定
参考周扬[13]的方法,稍作改动。将蛋白溶液(40 mg/mL)置于流变仪平台上,将圆形板转子(pp-50),平板间隙设为1 mm,以0.1 Hz的固定频率和2%的应变进行动态温度扫描测试,温度为20~80 ℃,用硅油密封以避免水分蒸发。平衡3 min后进行测试,连续记录储能模量(G′),损耗模量(G″)。
1.2.7 蛋白质溶解度的测定
参考周亚军等[14]方法,稍做修改。将蛋白溶胶溶液调整为5 mg/mL,将蛋白溶液在4 ℃、6 000 r/min条件下离心15 min。用考马斯法测定蛋白质含量,溶解度按公式(1)计算。
溶解度![]()
(1)
1.2.8 保水性的测定
称取凝胶质量记为m1,用双层滤纸包裹放入装有脱脂棉球的离心管中,于4 ℃下4 000 r/min离心15 min,离心完成后剥去表面滤纸,称取样品质量记为m2。持水性(water holding capacity,WHC)按公式(2)计算。
(2)
1.2.9 凝胶强度的测定
参考孔云菲[15]的方法,做适当修改,将凝胶切成大小均一的圆柱体,探头型号选择P/5s,测定蛋白凝胶强度。
1.2.10 蛋白质结构的测定
将蛋白凝胶冷冻干燥后使用红外光谱仪扫描,并使用Omnicv.8.0软件和Peak Fit v.4.12软件对酰胺I区(1 600~1 700 cm-1)进行去卷积、拟合计算其二级结构相对含量。
1.2.11 化学作用力的测定
参考文献[16]稍作修改,准确称取样品2.0 g,分别加入10 mL 0.05 mol/L NaCl溶液(S0),0.6 mol/L NaCl溶液(S1),0.6 mol/L NaCl溶液+1.5 mol/L尿素(S2),0.6 mol/L NaCl溶液+8 mol/L尿素(S3),0.6 mol/L NaCl溶液+8 mol/L尿素+0.6 mol/L β-巯基乙醇(S4),采用均质机匀浆(8 000 r/min,1 min),匀浆后在4℃下静置120 min,6 000 r/min离心15 min后采用考马斯法测定上清液的蛋白质含量。各化学键含量按公式(3)~公式(6)计算:
离子键=S1-S0
(3)
氢键=S2-S1
(4)
疏水相互作用=S3-S2
(5)
二硫键=S4-S3
(6)
1.2.12 SDS-PAGE测定
参考文献[17],并稍作修改。将蛋白溶胶溶液浓度调节至5 mg/mL和冻干后的蛋白凝胶粉末调节至蛋白浓度为1 mg/mL,使用SDS-PAGE分析MPs组成。
1.2.13 凝胶微观结构观察
将凝胶样品切成规则一致的小块,经固定、洗涤、脱水、干燥后对样品进行喷金,在扫描电镜下观察并拍照。
1.3 数据处理
所有实验独立进行3次,数据以“平均值±标准偏差”表示,利用SPSS 27进行数据分析,利用Origin 2024软件进行作图。
2 结果与分析
2.1 BLP主要成分分析
竹叶粉主要含(8.02±0.11)%的水分,(16.80±0.34)%的蛋白质,(41.91±3.61)%的不溶性膳食纤维和(29.4±5.95)%的可溶性膳食纤维。
2.2 流变特性分析
G′用于描述凝胶形成过程中的弹性特征,G″用于描述凝胶形成过程中的黏性特征。如图1所示,在加热过程中G′始终大于G″,表示MPs溶液体系在加热过程中偏向于弹性固体特征。
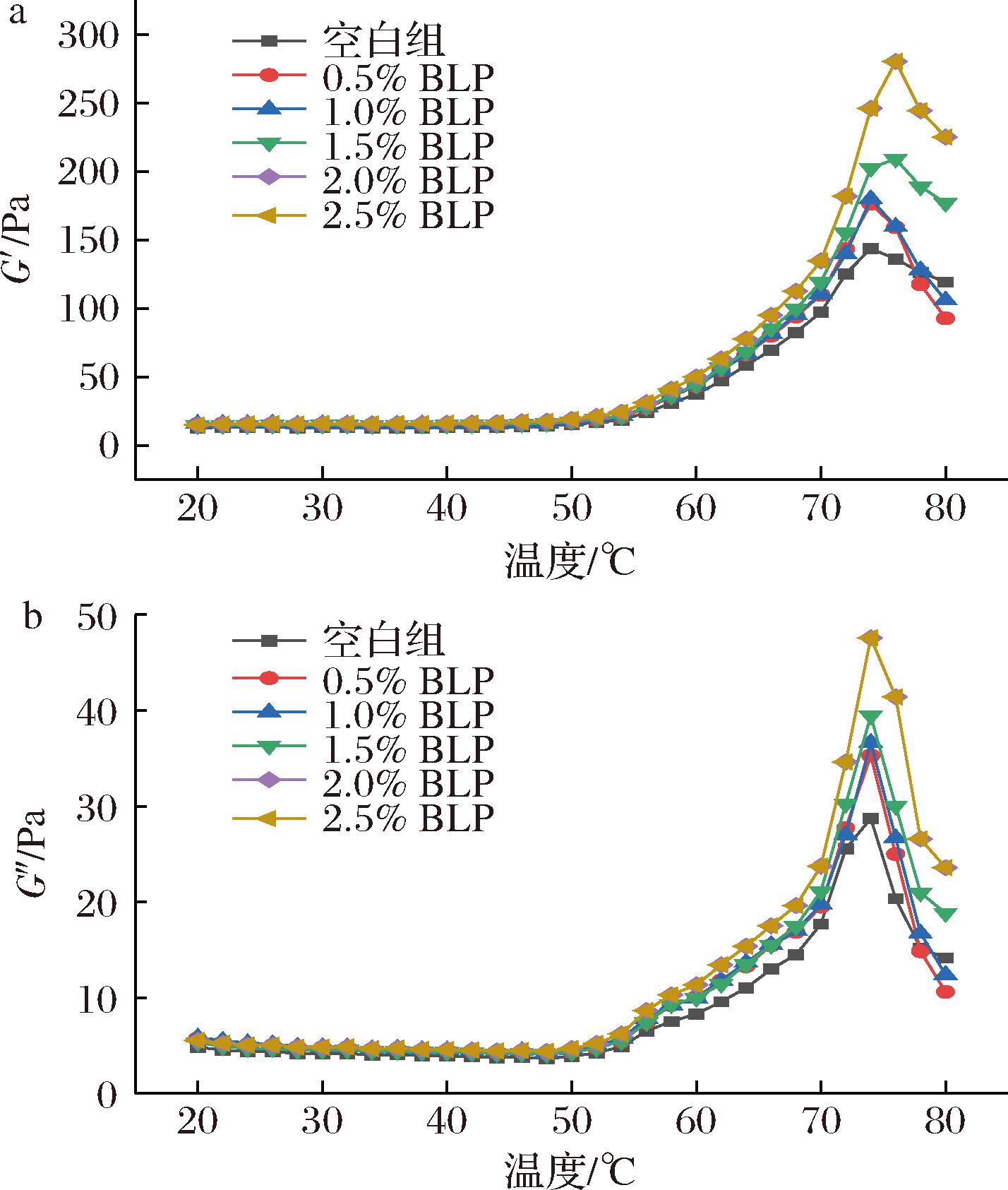
a-G′;b-G″
图1 溶胶样品加热(20~80 ℃)过程中的G′、G″
Fig.1 G′, G″ of the sols subjected to heating (from 20 to 80 ℃)
如图1-a所示,所有实验组的G′都有类似升温曲线,可以通过肌球蛋白结构的逐步变化和相互作用来解释。在26~38 ℃时,MPs的蛋白质链断裂导致蛋白质结构松散,弹性降低,G′有轻微下降;在40 ℃时,G′有轻微波动上升,肌球蛋白头部在此时交联形成凝胶网络;在温度达到54 ℃时,G′迅速上升,此时,MPs达到变性温度,蛋白质分子重新聚集并交联形成三维凝胶网络,此典型的MPs变化趋势与姜奕祺[18]的研究结果一致。在加热过程中,添加BLP的处理组的G′值都明显高于空白对照组,随着BLP添加量的增加,G′值持续增大,这表明BLP的添加可以有效增强复合凝胶的弹性。
如图1-b所示,G″和G′曲线相似,在20~48 ℃时,G″缓慢减小,此时MPs溶液的黏度缓慢降低;当加热到48 ℃时,G″显著上升,蛋白质变形,形成凝胶结构。在此过程中同样发现添加BLP组的G″较空白组更大。
不同添加量的BLP均提高了MPs的G′和G″值,其原因可能是BLP中富含的膳食纤维具有多孔性使其具有较高的结合水能力,导致蛋白质脱水并与其产生相互作用,BLP促进了凝胶网络的形成,从而形成更黏稠的复合体系。刘俊雅[7]和ZHUANG等[19]添加竹笋膳食纤维和甘蔗膳食纤维也得到了同样的结果。
2.3 蛋白质溶解度分析
溶解度是蛋白质的基本性质,能反映蛋白质变性和聚集的变化程度,蛋白质的其他功能特性严重依赖于良好的溶解性。BLP添加量0.5%~1.5%时,MPs的溶解度有轻微上升,但影响不显著(P>0.05)。在2%和2.5% BLP添加量下,BLP的加入显著提高了蛋白质的溶解性(P<0.05)(图2)。这与CHOI等[20]研究结果一致,在添加米糠膳食纤维之后,MPs溶解度提高。
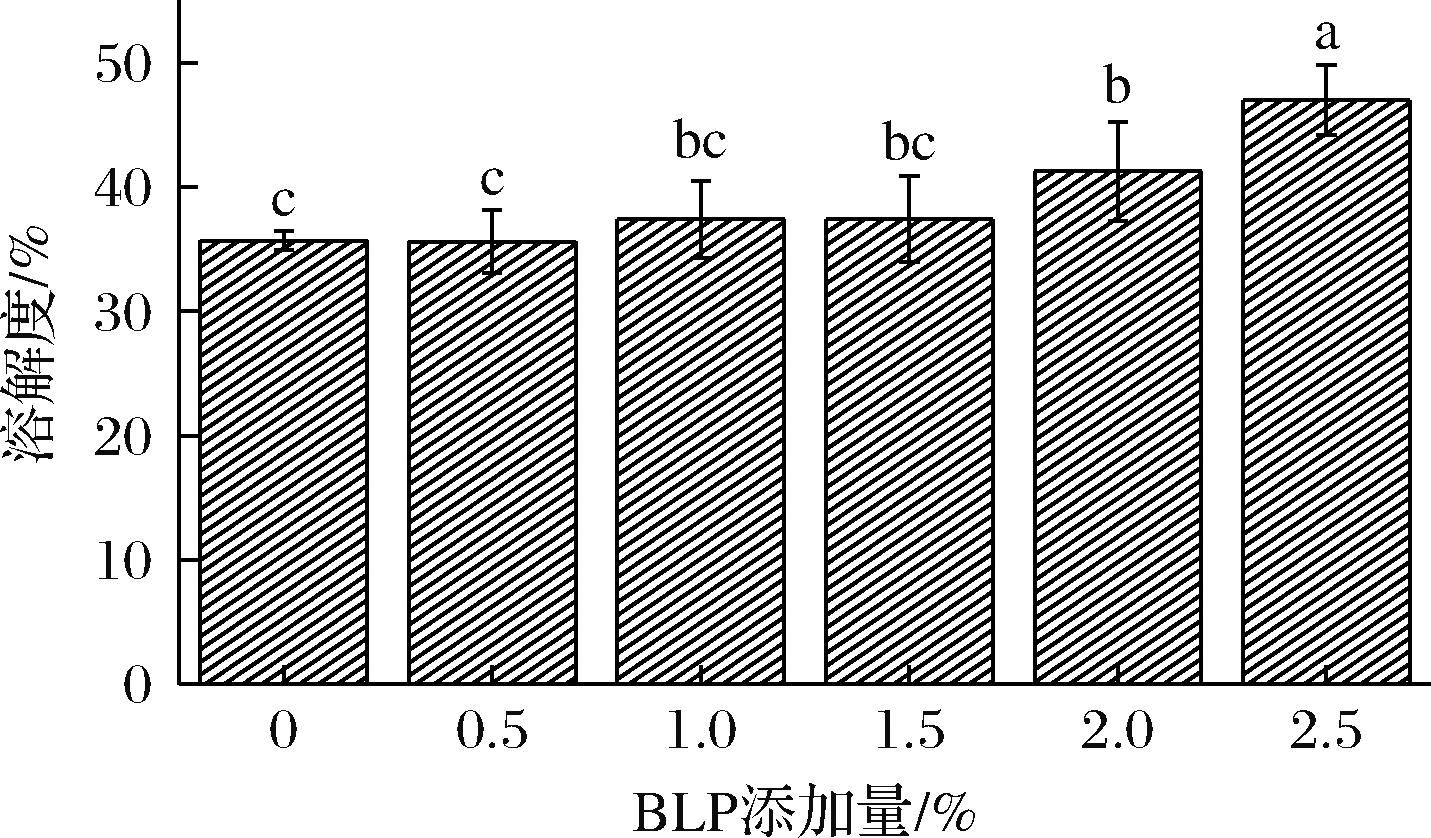
图2 BLP添加量对MPs溶解度的影响
Fig.2 Effect of BLP addition on myofibrillar protein solubility
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.4 凝胶强度和WHC分析
凝胶强度反映了MPs热诱导凝胶化过程中蛋白质的聚集交联程度,WHC在评估肉制品的产量和质量中具有至关重要的作用。如图3所示,空白组的凝胶强度和WHC仅为25.05 g和54.50%,当BLP添加量增加至2.5%,凝胶强度WHC分别提高到46.12 g,63.09%,与空白组相比具有显著性差异(P<0.05),与对照组相比,添加BLP可以显著增强MPs凝胶强度和WHC。推测可能是由于BLP中的膳食纤维的亲水性基团可以吸收水分,通过非活性作用填充到蛋白质网络中形成而更加致密的网络结构,且纤维也可导致蛋白质和水分子发生物理缠结和形成规则的3D凝胶网络[21]。有研究[7]发现膳食纤维的多聚糖成分可以有效地结合水,增加MPs的活性基团数目,使蛋白质分子间的相互作用力发生变化,促进蛋白质之间发生交联反应,形成更稳定的凝胶结构。由此推测BLP中的膳食纤维是增强凝胶强度和WHC的主要原因。BLP改善凝胶保水性示意如图4所示。
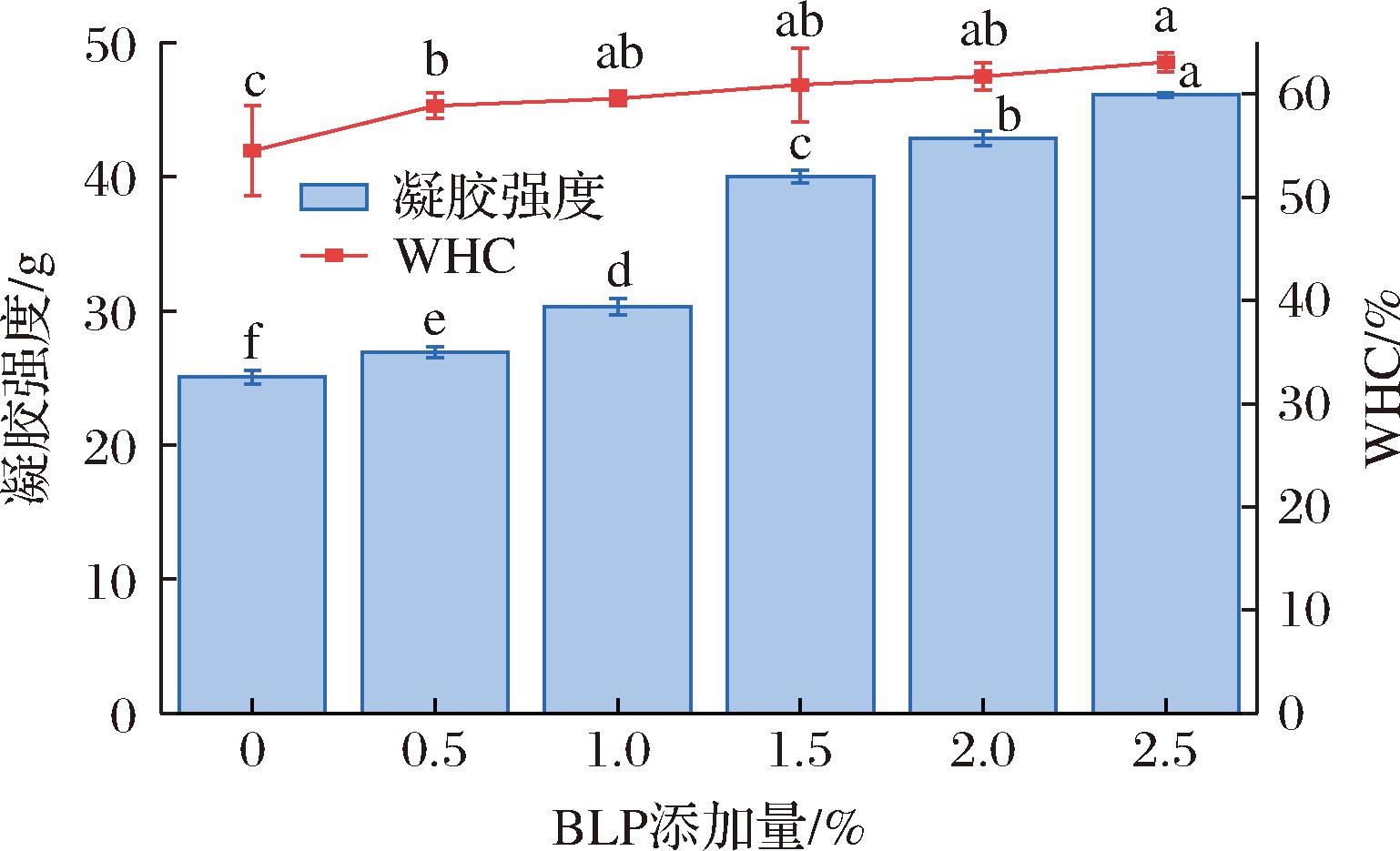
图3 BLP添加量对MPs凝胶强度和持水力的影响
Fig.3 Effect of BLP addition on myofibrillar protein gel strength and water-holding capacity
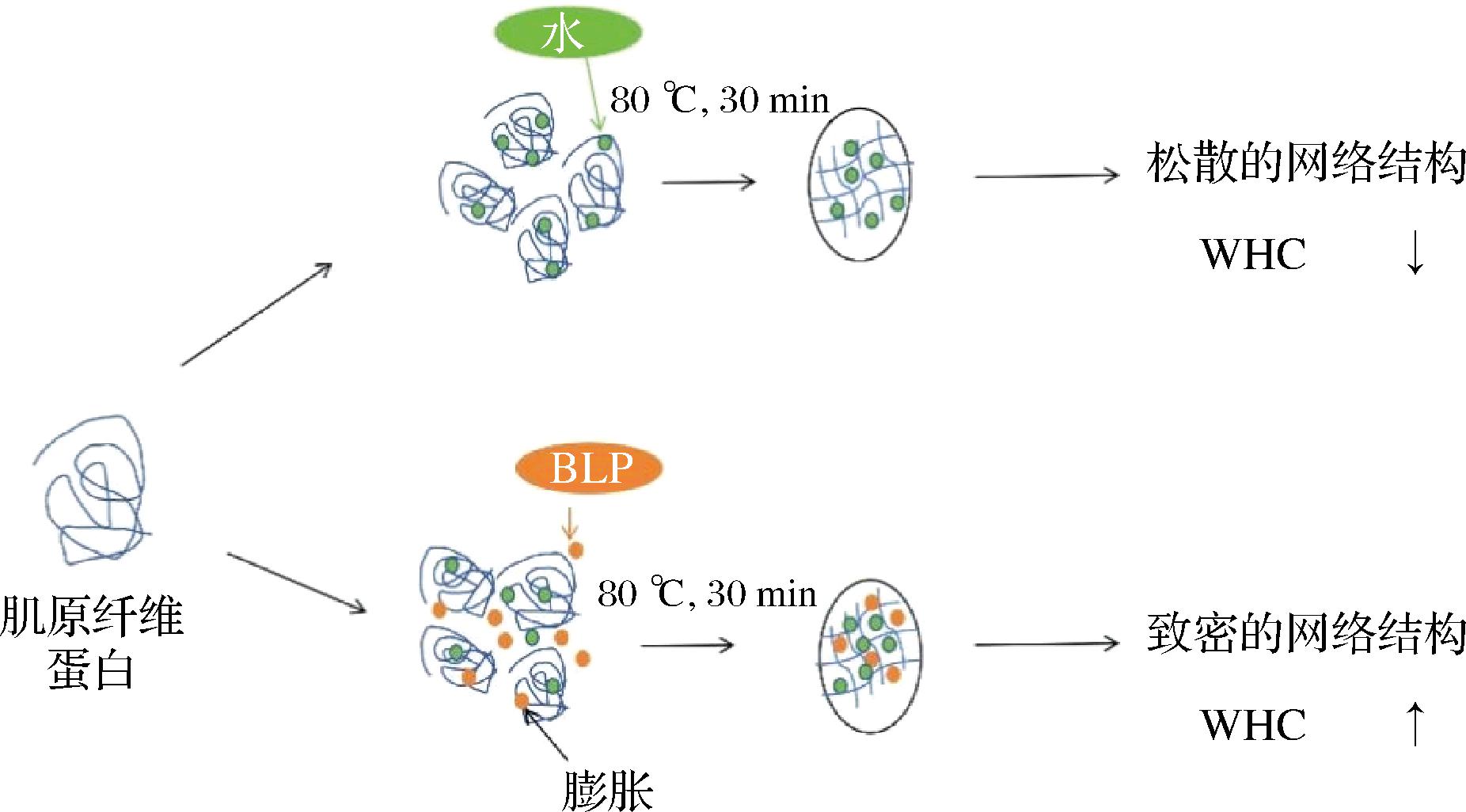
图4 BLP改善凝胶保水性的示意图[22]
Fig.4 Schematic diagram of BLP improving the water retention of gel[22]
2.5 蛋白质结构分析
由图5可以看出,MPs的峰值出现在3 286、2 925、1 654、1 098 cm-1处。3 286 cm-1为酰胺A带的特征吸收峰,随着BLP的添加,酰胺A带的强度逐渐增强,此处的吸收峰主要是由纤维素和半纤维素的—OH拉伸振动引起的;1 654 cm-1处出现的峰是由于纤维素和半纤维素中C—O键的对称和不对称伸缩振动引起的;1 098 cm-1附近代表半纤维素中醚键(C—O—C)的特征峰,这3个峰都是竹叶膳食纤维的特征吸收峰[23]。2 925 cm-1吸收区域为糖类甲基和亚甲基上C—H的吸收峰[24]。红外光谱图吸收峰强度的变化表明BLP和MPs之间的相互作用影响了蛋白质结构。
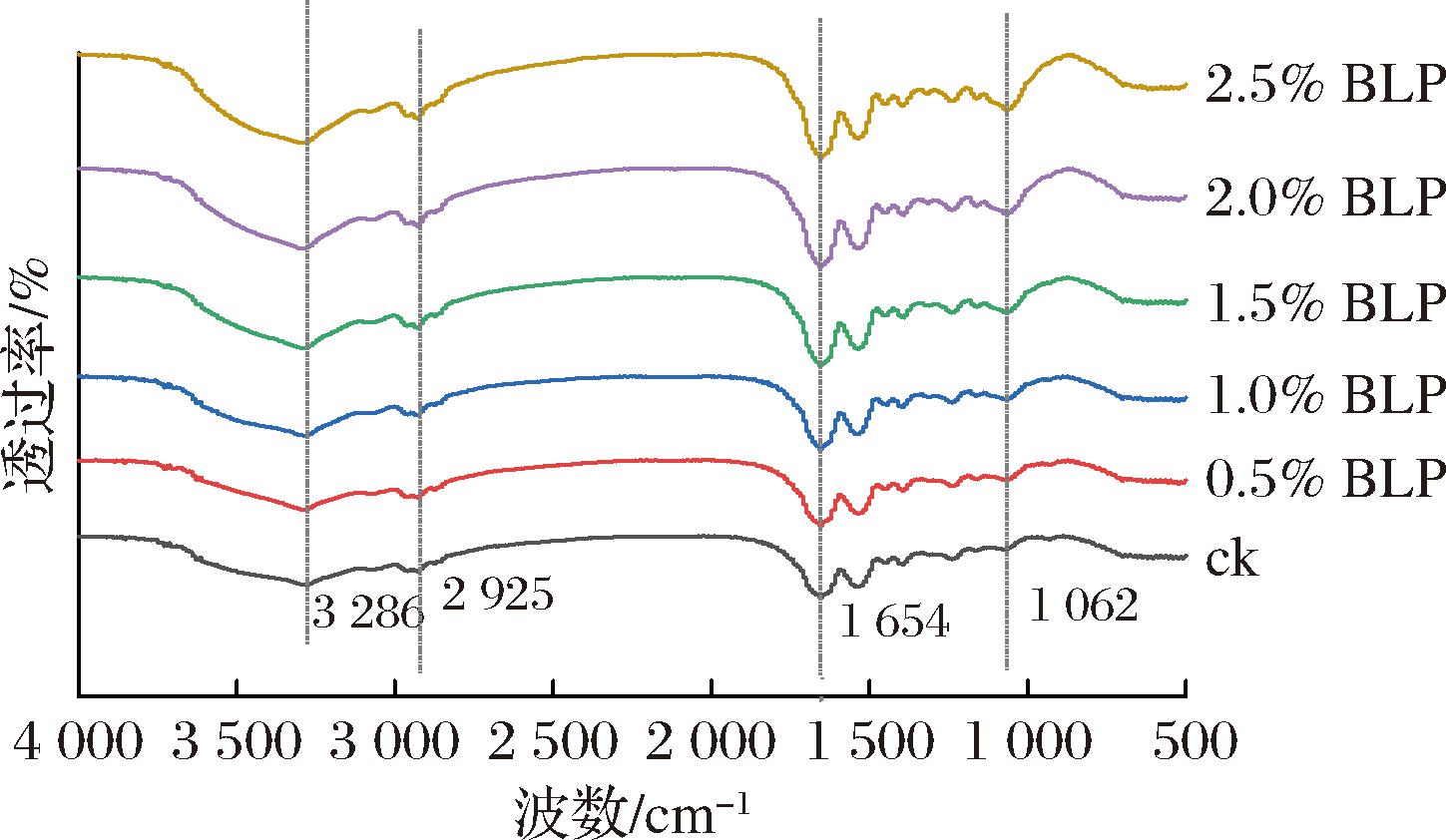
图5 不同BLP添加量的MPs的红外光谱图
Fig.5 Infrared spectra of myofibrillar proteins with different amounts of BLP addition
酰胺I带(1 600 cm-1和1 700 cm-1)是红外光谱中用来分析蛋白质二级结构的部分,包括α-螺旋、β-折叠、β-转角和无规则卷曲。不同BLP添加量对MPs二级结构相对含量的影响如图6所示。与纯MPs凝胶相比,BLP-MPs凝胶具有更多的β-折叠展开和α-螺旋形成。当添加2.5%的BLP时,α-螺旋含量由26.74%提高到28.05%,β-折叠含量由28.70%降低到26.75% (P<0.05)。无规则卷曲含量由28.87%增加到29.44%(P<0.05),有轻微提高,β-转角在BLP添加量为0.5%~2%时无显著变化(P>0.05)。研究表明[25]MPs的凝胶特性与β-折叠的比例呈正相关,而与α-螺旋的比例呈负相关,本研究结果与上述研究结果有所不同。LU等[21]同样发现添加膳食纤维的凝胶具有更多的β-折叠展开和α-螺旋形成,与本研究结果一致,推测其原因可能是BLP可以通过改变α-螺旋和β-折叠的含量来修饰MPs结构,从而影响蛋白质分子的重排和聚集;另一种可能是BLP增加了链内氨基酸之间的静电相互作用和氢键,促进了MPs凝胶中α-螺旋结构的稳定,从而增加了凝胶结构的致密性。
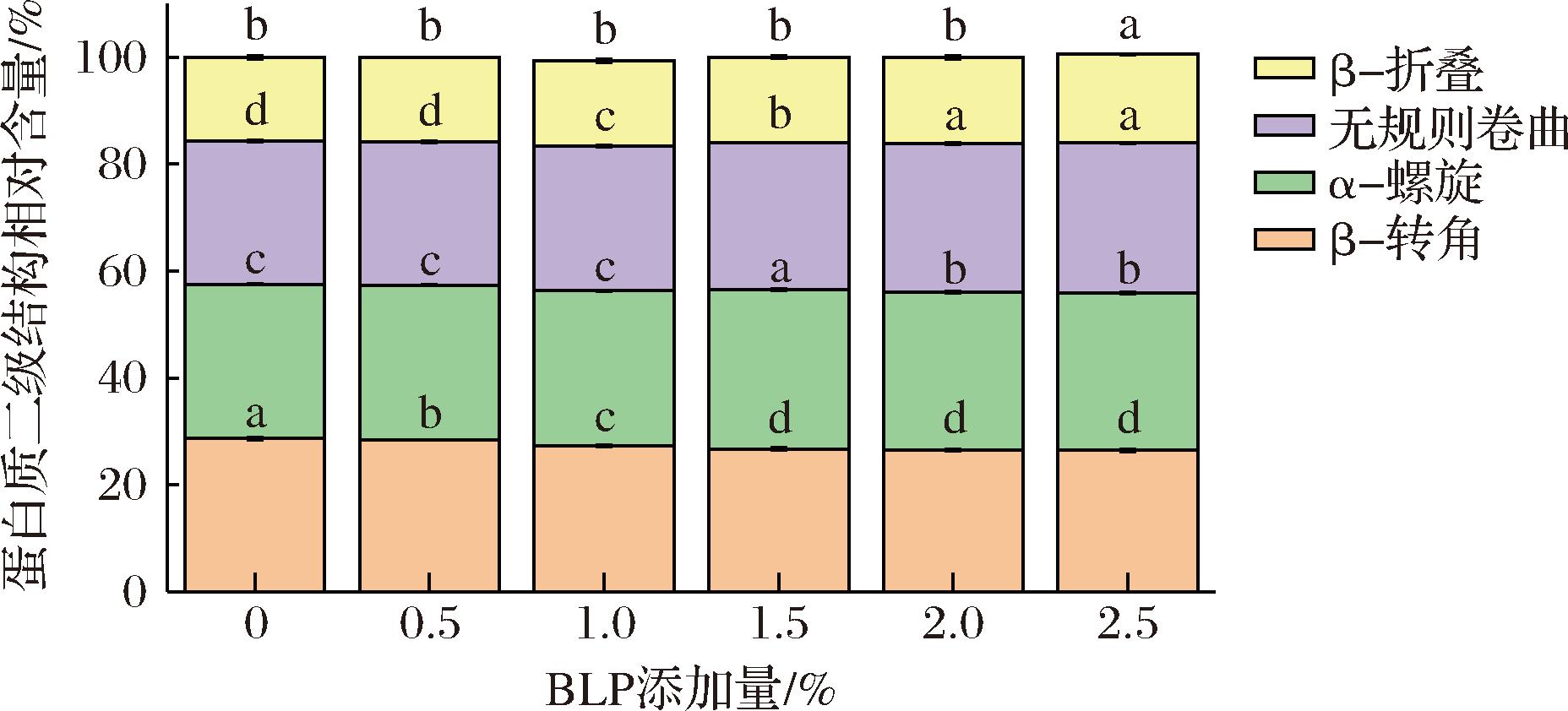
图6 BLP添加量对MPs二级结构的影响
Fig.6 Effect of BLP addition on the secondary structure of myofibrillar protein
2.6 化学作用力分析
由图7可知,MPs凝胶中二硫键和疏水相互作用是形成凝胶最主要的化学作用力,氢键和离子键在化学作用力中的所占比例较小,结果与WANG等[26]研究结果一致。与对照组相比,BLP的添加可以增加凝胶中离子键和氢键的含量。研究认为[27],离子键和氢键有助于稳定α-螺旋结构,这与蛋白质二级结构测定中α-螺旋含量增加的结果一致。CAO等[28]发现氢键含量越高凝胶强度越高,与凝胶强度的结果一致,同样周凤超等[29]也认为氢键含量的升高可以使鱼糜凝胶中水分子的流动性降低,使凝胶网络结构更加致密。较空白组,BLP添加组的二硫键含量也升高,可能是由于蛋白质之间的交联作用促进了二硫键的形成[1]。
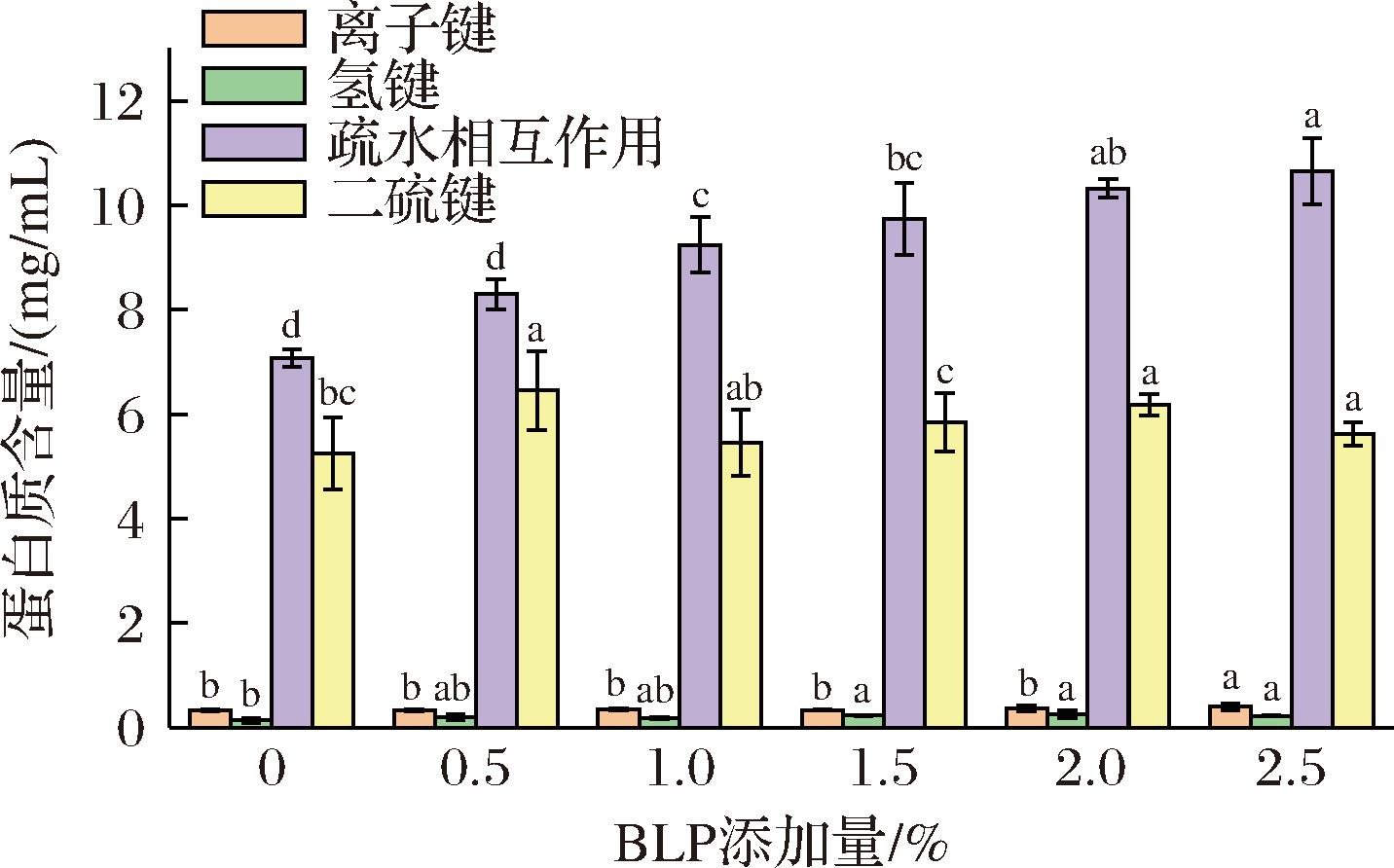
图7 BLP添加量对MPs凝胶化学作用力的影响
Fig.7 Effect of BLP addition on the chemical force of myofibrillar protein gel
2.7 SDS-PAGE分析
如图8所示,在蛋白溶胶的电泳条带图中肌球蛋白重链条带(MHC,220 kDa),副肌球蛋白(100 kDa),肌动蛋白(45 kDa),原肌球蛋白(36 kDa)和肌球蛋白轻链(MLC,15~25 kDa)均被观察到,这些是组成MPs的主要蛋白[17]。
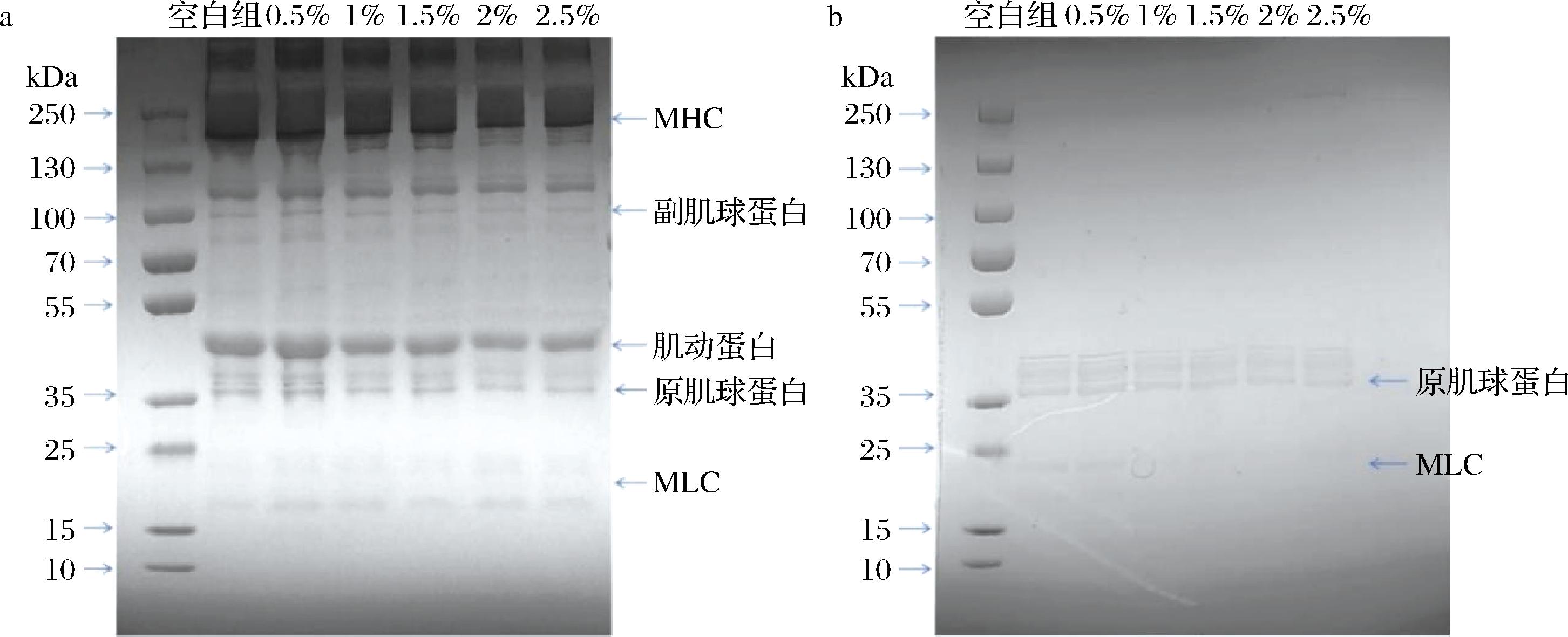
a-MPs溶胶;b-MPs经热诱导后凝胶
图8 MPs的电泳图
Fig.8 SDS-PAGE patterns of myofibrillar protein
如图8-a所示,添加BLP并未改变MPs的组成成分。刘俊雅[7]和CHOI等[20]同样发现添加膳食纤维对电泳图中的蛋白条带没有明显的影响,他们认为即使添加膳食纤维,加热过程仍然是导致肌球蛋白重链变性和凝胶网络聚合的主要因素。与MPs溶胶溶液样品相比,热诱导凝胶中肌球蛋白重链和肌动蛋白的强度带几乎消失,而主要的强度带是原肌球蛋白以及肌球蛋白轻链(相对强度接近20 kDa)。研究认为[30],肌球蛋白重链是热处理后排出水中存在的主要蛋白质,热处理过程中肌球蛋白重链发生了变性,参与了凝胶的形成,这与ZHUANG等[19]的研究结构一致。
2.8 微观结构分析
纯MPs和BLP-MPs复合凝胶样品的微观形貌如图9所示。扫描电镜图像(5 000×)显示,纯MPs溶液在热诱导凝胶化过程中渗出的水分子会形成大量相互连接的水通道,不利于三维凝胶网络的构建,凝胶框架呈簇状的松散状态,折叠结构在加热过程中没有充分的交联并未形成致密的三维网络结构[31]。在添加BLP的照片中观察到由许多不规则杆状蛋白交联的凝胶框架和凝胶结构中的空隙,此时复合凝胶蛋白质交联,蛋白结构变得致密。凝胶的均匀致密结构提高了凝胶的持水能力和凝胶强度,电镜结果证实了BLP改善了MPs凝胶的三维网络结构。

图9 BLP添加量对MPs微观结构的影响
Fig.9 Effect of BLP addition on myofibrillar protein microstructure
3 结论
本研究表明,BLP对MPs的凝胶特性和微观性能有良好的影响。纯MPs凝胶的WHC值和凝胶强度值较低,微观结构较差。在添加BLP之后,动态流变学结果显示,BLP的添加增加了蛋白溶液的G′和G″,使MPs溶液形成更黏稠的复合体系。WHC和凝胶强度测定结果显示,添加BLP后凝胶WHC值和凝胶显著提高。红外光谱分析表明,BLP和MPs分子之间的相互作用影响了蛋白质结构。蛋白质二级结构显示,BLP促进MP二级结构α-螺旋的形成。此外,化学力结果进一步支持了上述结论,BLP增加了MPs凝胶离子键和氢键含量,有利于α-螺旋结构的稳定。扫描电镜结果显示,BLP的加入使原本呈松散状态的凝胶网络结构更加致密。BLP中的膳食纤维是改善MPs凝胶特性的主要因素,膳食纤维的亲水性基团可以吸收水分,然后通过非活性作用填充蛋白质网络,有助于MPs溶胶经热诱导后形成更稳定的凝胶。综上所述,添加0.5%~2.5% BLP可有效改善猪肉MPs的凝胶性能。研究结果对提高竹叶高附加值资源,开发健康的创新型凝胶肉制品具有一定的参考价值。
[1] 唐丽. 热处理对猪肉肌原纤维蛋白和挥发性风味化合物的影响及其相互作用研究[D].成都:成都大学, 2024.TANG L.Study on the effects of heat treatment on pork myofibrillar protein and volatile flavor compounds and their interactio[D].Chengdu:Chengdu University, 2024.
[2] 曹涓泉, 李心悦, 徐静, 等.圆苞车前子壳粉对鸡肉肌原纤维蛋白凝胶特性和蛋白结构的影响[J].食品工业科技, 2023, 44(17):100-107.CAO J Q, LI X Y, XU J, et al.Effects of psyllium husk powder on gel properties and protein structure of chicken myofibrillar protein[J].Science and Technology of Food Industry, 2023, 44(17):100-107.
[3] 曹云刚, 王凡, 艾娜丝, 等.苹果膳食纤维对猪肉肌原纤维蛋白凝胶性能的影响[J].农业机械学报, 2020, 51(7):365-371.CAO Y G, WANG F, AI N S, et al.Effect of apple dietary fiber on gel properties of porcine myofibrillar protein[J].Transactions of the Chinese Society for Agricultural Machinery, 2020, 51(7):365-371.
[4] ANDRESSA ALMEIDA FARIAS C, RODRIGUES DOS REIS A, RODRIGUES DE MORAIS D, et al.Phenolic diversity and antioxidant potential of different varieties of bamboo leaves using LC-ESI-QTOF-MS/MS and LC-ESI-QqQ-MS/MS[J].Food Research International, 2024, 179:114025.
[5] 付诗尧. 抹竹的研究与开发[D].杭州:浙江大学, 2018.FU S Y.Research and development of matzhu[D].Hangzhou:Zhejiang University, 2018.
[6] ZHU N, ZANG M W, WANG S W, et al.Modulating the structure of lamb myofibrillar protein gel influenced by psyllium husk powder at different NaCl concentrations:Effect of intermolecular interactions[J].Food Chemistry, 2022, 397:133852.
[7] 刘俊雅. 竹笋膳食纤维对猪肉糜凝胶特性影响及机理研究[D].郑州:郑州轻工业大学, 2019.LIU J Y.Studies and effects of bamboo shoots dietary fiber on the gel properties of pork meat batters[D].Zhengzhou:Zhengzhou University of Light Industry, 2019.
[8] SILVA M F, MENIS-HENRIQUE M E, FELISBERTO M H, et al.Bamboo as an eco-friendly material for food and biotechnology industries[J].Current Opinion in Food Science, 2020, 33:124-130.
[9] 王东霞, 谢静华, 袁亚, 等.竹叶粉的食用安全性评价[J].中国食品卫生杂志, 2023, 35(5):717-722.WANG D X, XIE J H, YUAN Y, et al.Food safety assessment of bamboo leaf powder[J].Chinese Journal of Food Hygiene, 2023, 35(5):717-722.
[10] 付诗尧, 陈亮, 张艳雯, 等.抹竹在食品工业中的应用研究[J].食品与生物技术学报, 2019, 38(8):60-70.FU S Y, CHEN L, ZHANG Y W, et al.Study on application of matzhu(bamboo-leaf superfine powder) in food industry[J].Journal of Food Science and Biotechnology, 2019, 38(8):60-70.
[11] 黄李成. 抹竹对戚风蛋糕品质和储藏稳定性的影响及机理研究[D].广州:华南理工大学, 2023.HUANG L C, Research on the effects and mechanism of matzhu on the quality and storage stability of chiffon cake[D].Guangzhou:South China University of Technology, 2023.
[12] 王子凌, 熊可心, 蒋景淳, 等.高强度超声处理时间对克氏原螯虾肌原纤维蛋白理化性质的影响[J].食品科学, 2023, 44(23):13-20.WANG Z L, XIONG K X, JIANG J C, et al.Effect of high-intensity ultrasonic treatment time on physicochemical properties of myofibrillar protein from Procambarus clarkii[J].Food Science, 2023, 44(23):13-20.
[13] 周扬. 圆苞车前子壳粉对肌原纤维蛋白凝胶和乳化特性影响[D].重庆:西南大学, 2021.ZHOU Y.Effects of psyllium husk powder on the gel and emulsification properties of myofibrillar protein[D].Chongqing:Southwest University, 2021.
[14] 周亚军, 张漫漫, 李宗坪, 等.腌制方式对腌制过程中山黑猪肉肌原纤维蛋白特性及其叉烧肉食用品质的影响[J].食品科学, 2023, 44(23):86-94.ZHOU Y J, ZHANG M M, LI Z P, et al.Effect of curing method on myofibrillar protein characteristics of mountain black pork during curing process and eating quality of barbecued pork[J].Food Science, 2023, 44(23):86-94.
[15] 孔云菲. 鹰嘴豆蛋白复合鱼糜凝胶的制备及加工贮藏对其品质的影响[D].镇江:江苏大学, 2023.KONG Y F.Preparation of chickpea protein-surimi hybrid gel and effects ofprocessing and storage on its quality[D].Zhenjiang:Jiangsu University, 2023.
[16] 刘莹, 傅宝尚, 姜鹏飞, 等.羟丙基木薯淀粉对南极磷虾混合虾糜3D打印特性及凝胶特性的影响[J].食品与发酵工业, 2022, 48(21):180-187.LIU Y, FU B S, JIANG P F, et al.Effects of hydroxypropyl cassava starch on 3D printing and gel properties of Antarctic krill mixed shrimp surimi[J].Food and Fermentation Industries, 2022, 48(21):180-187.
[17] 陈寒霜露. 槲皮素和不同氯化钠添加量对牦牛肉饼肌原纤维蛋白氧化及功能特性的影响研究[D].成都:西南民族大学, 2023.CHEN H S L.Impact of quercetin and different nacl additions on myofibrillar protein oxidation and functional properties of yak meat patties[D].Chengdu:Southwest Minzu University, 2023.
[18] 姜奕祺. 藜麦粉对肌原纤维蛋白凝胶特性的影响及其在低脂香肠中的应用研究[D].泰安:山东农业大学, 2023.JIANG Y Q.Effect of quinoa powder on the properties of myofibrllar protein gel and its application in fat-reduced sausage[D].Tai’an:Shandong Agricultural University, 2023
[19] ZHUANG X B, ZHANG W G, LIU R, et al.Improved gel functionality of myofibrillar proteins incorporation with sugarcane dietary fiber[J].Food Research International, 2017, 100:586-594.
[20] CHOI Y S, CHOI J H, HAN D J, et al.Effects of rice bran fiber on heat-induced gel prepared with pork salt-soluble meat proteins in model system[J].Meat Science, 2011, 88(1):59-66.
[21] LU W W, WU D, WANG L M, et al.Insoluble dietary fibers from Lentinus edodes stipes improve the gel properties of pork myofibrillar protein:A water distribution, microstructure and intermolecular interactions study[J].Food Chemistry, 2023, 411:135386.
[22] XU Y, YAN H M, XU W P, et al.The effect of water-insoluble dietary fiber from star anise on water retention of minced meat gels[J].Food Research International, 2022, 157:111425.
[23] 金书涵, 崔蓬勃, 姚雨馨, 等.竹叶可溶性膳食纤维的高效提取及其结构、功能特性分析[J].食品与发酵工业, 2025, 51(5):203-210.JIN S H, CUI P B, YAO Y X, et al.Efficient extraction of soluble dietary fiber from bamboo leaves and analysis of its structure and function[J].Food and Fermentation Industries, 2025, 51(5):203-210.
[24] 王淑玉, 何大柃, 张建才, 等.动态高压微射流对山楂果渣膳食纤维理化和结构特性的影响[J].食品科学, 2024, 45(17):174-182.WANG S Y, HE D L, ZHANG J C, et al.Effect of dynamic high-pressure microjet on physicochemical and structural properties of dietary fiber from hawthorn pomace[J].Food Science, 2024, 45(17):174-182.
[25] 栗俊广, 张旭玥, 王昱, 等.脱乙酰魔芋葡甘聚糖对猪肉肌原纤维蛋白结构及凝胶特性的影响[J].食品科学, 2023, 44(2):26-31.LI J G, ZHANG X Y, WANG Y, et al.Effect of deacetylated konjac glucomannan on the structure and gel properties of pork myofibrillar protein[J].Food Science, 2023, 44(2):26-31.
[26] WANG X, XIA M Q, ZHOU Y H, et al.Gel properties of myofibrillar proteins heated at different heating rates under a low-frequency magnetic field[J].Food Chemistry, 2020, 321:126728.
[27] WANG L M, WANG X, MA J, et al.Effects of radio frequency heating on water distribution and structural properties of grass carp myofibrillar protein gel[J].Food Chemistry, 2021, 343:128557.
[28] CAO H W, FAN D M, JIAO X D, et al.Effects of microwave combined with conduction heating on surimi quality and morphology[J].Journal of Food Engineering, 2018, 228:1-11.
[29] 周凤超, 江文婷, 田韩, 等.海带全粉对鲢鱼糜凝胶理化、流变特性及蛋白结构的影响[J].食品工业科技, 2025, 46(4):50-58.ZHOU F C, JIANG W T, TIAN H, et al.Effect of Laminaria japonica powder on physicochemical properties, rheological properties and protein structure of silver carp surimi gel[J].Science and Technology of Food Industry, 2025, 46(4):50-58.
[30] DEFREITAS Z, SEBRANEK J G, OLSON D G, et al.Carrageenan effects on salt-soluble meat proteins in model systems[J].Journal of Food Science, 1997, 62(3):539-543.
[31] 庄昕波, 陈银基, 周光宏.改性甘蔗膳食纤维对猪肉肌原纤维蛋白凝胶特性的影响[J].中国农业科学, 2021, 54(15):3320-3330.ZHUANG X B, CHEN Y J, ZHOU G H.The mechanism of myofibrillar protein gel functionality influenced by modified sugarcane dietary fiber[J].Scientia Agricultura Sinica, 2021, 54(15):3320-3330.