益生菌有助于维持宿主肠道微生态的平衡,同时抑制病原菌的生长,从而提升宿主的整体健康水平。罗伊氏粘液乳杆菌(Limosilactobacillus reuteri)属于革兰氏阳性菌,是肠道益生菌的一种[1],它在维护肠道健康[2]、增强免疫力[3]、调节炎症[4]等方面发挥着重要作用。基于这些益生功能,罗伊氏粘液乳杆菌在保健食品、乳制品生产以及医药领域得到了广泛应用,不仅作为益生菌制剂帮助维护肠道健康和提升免疫力[5],还可用于食品防腐,提高产品货架期[6]。其作为一种益生菌,在人类和动物健康领域具有重要的潜力和价值。
随着研究的深入,罗伊氏粘液乳杆菌应用范围和效果可能会得到进一步的扩展和确认。但其在生产和应用中不可避免的面临着多种环境胁迫,其会对罗伊氏粘液乳杆菌的正常生长、代谢和繁殖造成影响,降低其活性和存活率[7]。环境胁迫包括酸胁迫、渗透压胁迫、热胁迫、冷胁迫、氧胁迫、营养胁迫等,乳酸菌在面临不同的环境胁迫时会激活一系列的应激反应机制来增强其生存能力[8]。而了解其反应机制有助于改进乳酸菌发酵条件、菌种改良以及提高其在食品和生物医学中的应用[9]。
碳源是乳酸菌生长必不可少的成分之一,其对乳酸菌的生长和代谢活动具有显著影响[10]。而不同的碳源不仅影响乳酸菌的生长和生物量积累,还影响其代谢途径和产物的形成[11-12]。了解碳源对乳酸菌的多方面影响有助于优化其生产和应用。本研究以罗伊氏粘液乳杆菌AR673为研究对象,以pH、温度、碳浓度、胆盐浓度等为胁迫条件,通过测定不同环境下AR673的生长曲线以及最大生物量来探究其对胁迫环境的响应;并通过改变碳源种类和浓度,研究AR673的营养摄取情况,以期为后续的工业生产及功能研究提供发酵基础。
1 材料与方法
1.1 材料与试剂
罗伊氏粘液乳杆菌(Limosilactobacillus reuteri)AR673,由上海理工大学健康科学与工程学院实验室保藏。
MRS培养基(g/L):牛肉浸出粉10,酪蛋白胨10,酵母浸出粉5,葡萄糖20,三水乙酸钠8.3,柠檬酸氢二铵2,KH2PO4 2,MgSO4·7H2O 0.58,MnSO4·H2O 0.25。固体培养基添加琼脂粉15~20 g/L。115 ℃灭菌20 min。
1.2 仪器与设备
DU-800 分光光度计,美国贝克曼库尔特公司;BPH-G082型精密恒温培养箱,上海一恒科学仪器有限公司;Bioscreen C全自动生长曲线分析仪,芬兰 Oy Growth Curves Ab 公司;Spectra Max i3x型酶标仪,奥地利美谷分子仪器有限公司。
1.3 实验方法
1.3.1 菌株复苏与培养
将于-80 ℃保藏的罗伊氏粘液乳杆菌AR673在MRS固体培养基进行划线,在37 ℃恒温厌氧培养箱中培养24 h后,挑取单菌落于MRS液体培养基中,于37 ℃恒温培养箱中培养16~18 h,连续培养2代以增强菌株活力。
1.3.2 不同碳源的利用情况测定
分别以果糖、阿拉伯糖、乳糖、蔗糖、麦芽糖、葡聚糖为碳源代替葡萄糖配制不同的培养基。将过夜培养的AR673以2%(体积分数,下同)的接种量接种于含不同碳源的培养基中,吸取200 μL于培养板中,以未接菌的液体培养基作参比,以接菌的MRS作为阳性对照,于37 ℃静置培养48 h,每30 min测定培养液600 nm处的吸光度值,并进行记录。每个样设置3个平行,将全自动生长曲线分析仪测得的结果进行处理,以时间为横坐标,OD600值为纵坐标,得到AR673在不同碳源培养下的生长曲线。将培养48 h后的菌液按苯酚-硫酸法测定总糖[13],葡萄糖标准曲线如图1所示。
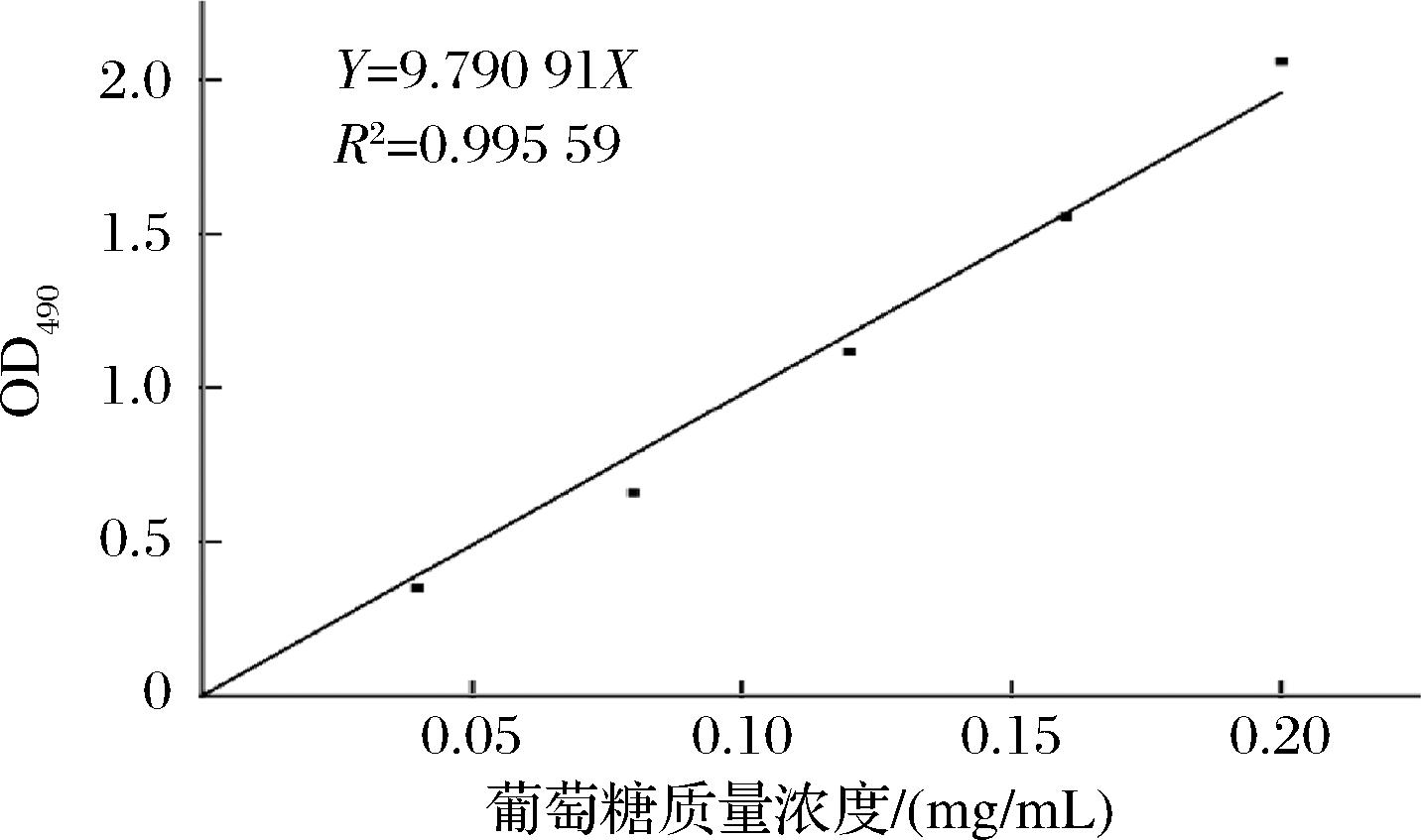
图1 总糖标准曲线
Fig.1 Standard curve of total sugar
1.3.3 环境耐受能力测定
1.3.3.1 不同pH的耐受能力测定
将活化好的罗伊氏粘液乳杆菌AR673按2%接种量分别接种到pH值为2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0的MRS液体培养基中,以未调节pH的MRS培养基为对照组,按照1.3.2节的方法进行吸光度的测定。以时间为横坐标,OD600值为纵坐标,得到AR673在不同pH环境下的生长曲线。
1.3.3.2 不同碳浓度耐受能力测定
将活化好的罗伊氏粘液乳杆菌AR673按2%接种量分别接种到葡萄糖质量浓度为5、10、20、30、50 g/L的MRS液体培养基中,按照1.3.2节的方法进行吸光度的测定。以时间为横坐标,OD600值为纵坐标,得到AR673在不同碳质量浓度下的生长曲线。
1.3.3.3 不同温度耐受能力测定
将活化好的罗伊氏粘液乳杆菌AR673按2%接种量接种到MRS液体培养基中,分别置于37、40、42 ℃培养箱中静置培养,分别在2、4、8、12、16、24 h取样,用紫外分光光度计于600 nm下进行吸光度的测定。以时间为横坐标,OD600值为纵坐标,得到AR673在不同温度下的生长曲线。
1.3.3.4 不同胆盐浓度耐受能力测定
将活化好的罗伊氏粘液乳杆菌AR673按2%接种量分别接种到含有1、2、3 g/L牛胆粉的MRS液体培养基中,不添加胆盐(O)为对照组,按照1.3.2节的方法进行吸光度的测定。以时间为横坐标,OD600值为纵坐标,得到AR673在不同胆盐浓度下的生长曲线。
1.3.4 最大生物量的测定
将罗伊氏粘液乳杆菌AR673在不同碳源(果糖、阿拉伯糖、乳糖、蔗糖、麦芽糖、葡聚糖、葡萄糖)、不同pH值条件(2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、对照)、不同碳质量浓度(5、10、20 g/L)、不同温度(37、40、42 ℃)以及不同胆盐质量浓度(0、1、2、3 g/L)条件下于50 mL液体培养基中培养48 h,将发酵液适当稀释后取200 μL于96孔板中,以未接菌的液体培养基作参比,置于酶标仪中测定600 nm处的吸光度值。该吸光度值即为其不同培养条件下的最大生物量。
1.3.5 最大比生长速率的计算
采用已有的Logistic生长动力学模型,公式(1)来描述AR673的发酵生长特性,并根据全自动生长曲线仪测得的数据计算模型最大比生长速率μm和最大生物量Xm。
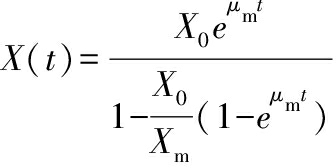
(1)
式中:X,菌体生物量;μm,最大比生长速率,h-1;t,时间,h;X0,初始生物量;Xm,最大生物量。
1.4 数据处理
使用Excel软件进行数据整理,SPSS Statistics 25软件进行单因素方差分析,显著水平P<0.05,所有实验重复3次。使用Origin 2024b进行非线性曲线拟合及绘图。
2 结果与分析
2.1 不同碳源对AR673生长情况的影响
图2-a为AR673在不同碳源生长情况下的生长曲线图,相对于葡聚糖、果糖和阿拉伯糖,AR673对其他4种糖表现出营养偏好;图2-b为AR673在不同碳源培养下的最大生物量,其他碳源的最大生物量与葡萄糖为碳源时相比存在显著差异,其中乳糖和麦芽糖作为碳源时最大生物量(2.06±0.018和2.28±0.035)明显高于以葡萄糖作为碳源时的最大生物量(1.75±0.02)。
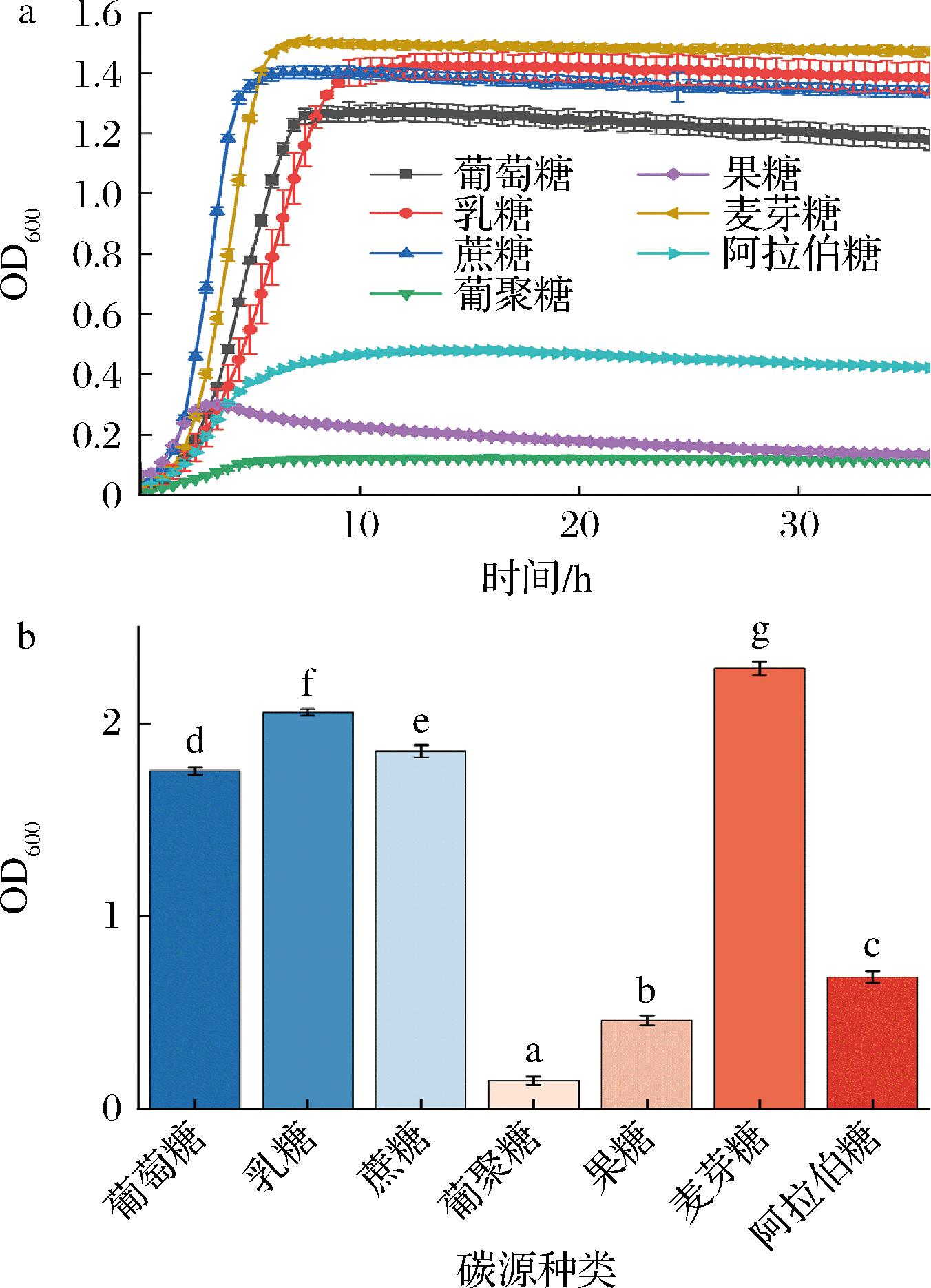
a-生长曲线图;b-最大生物量
图2 不同碳源培养对AR673生长的影响
Fig.2 Effects of different carbon sources on the growth of AR673
注:不同小写字母表示显著性差异(P<0.05)(下同)。
由表1可知,最大比生长速率为果糖>蔗糖>麦芽糖>葡萄糖>阿拉伯糖>葡聚糖>乳糖,且拟合的最大生物量与图2-a相一致。最大比生长速率表示微生物在一定培养条件下的最大生长速率,由其可知在AR673表现出营养偏好的4种碳源中,蔗糖最先达到平稳期,其次为麦芽糖和葡萄糖,最后为乳糖。
表1 不同碳源下AR673生长动力学模型拟合参数
Table 1 Fitting parameters of growth kinetic model for AR673 under different carbon sources

碳源种类最大生物量Xm最大比生长速率μm/h葡萄糖1.21±0.004 61.08±0.061乳糖1.41±0.002 70.77±0.018蔗糖1.36±0.003 01.64±0.069葡聚糖0.12±0.000 40.92±0.050果糖0.17±0.005 22.54±2.070麦芽糖1.47±0.002 61.34±0.040阿拉伯糖0.44±0.002 70.94±0.081
如表2所示,AR673对碳源的利用情况依次为葡萄糖>乳糖>蔗糖>麦芽糖>阿拉伯糖>葡聚糖>果糖,其中葡萄糖利用率为97.91%,乳糖利用率为92.21%,蔗糖利用率为89.76%,麦芽糖利用率为88.01%。综上,AR673对葡萄糖、乳糖、蔗糖和麦芽糖表现出营养偏好,且对葡萄糖的利用率最高。
表2 发酵上清液总糖含量的测定
Table 2 Determination of total sugar content in fermentation supernatant
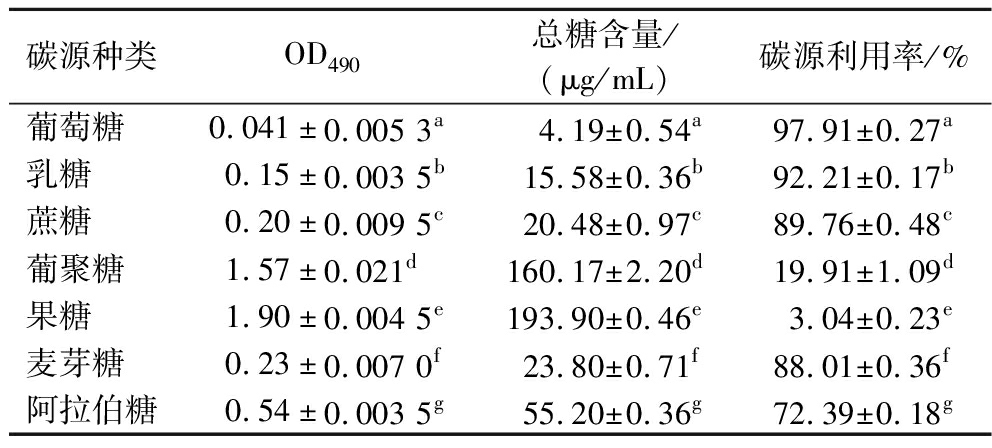
碳源种类OD490总糖含量/(μg/mL)碳源利用率/%葡萄糖0.041±0.005 3a 4.19±0.54a97.91±0.27a乳糖0.15±0.003 5b15.58±0.36b92.21±0.17b蔗糖0.20±0.009 5c20.48±0.97c89.76±0.48c葡聚糖1.57±0.021d160.17±2.20d19.91±1.09d果糖1.90±0.004 5e193.90±0.46e3.04±0.23e麦芽糖0.23±0.007 0f23.80±0.71f88.01±0.36f阿拉伯糖0.54±0.003 5g55.20±0.36g72.39±0.18g
注:同列不同字母代表显著性差异(P<0.05)。
2.2 不同pH对AR673生长情况的影响
由图3-a可知,与对照相比,在pH 2.0和pH 3.0条件下AR673几乎不生长,在pH 4.0~9.0条件下有明显的生长,表明AR673的pH耐受范围在4.0~9.0。由图3-b可知,AR673在pH 4.0和pH 6.0时最大生物量(1.64±0.027和1.63±0.032)相比于其他pH条件较高,且与对照相比无显著差异;pH 5.0和pH 7.0时最大生物量(1.30±0.027和1.31±0.063)次之。
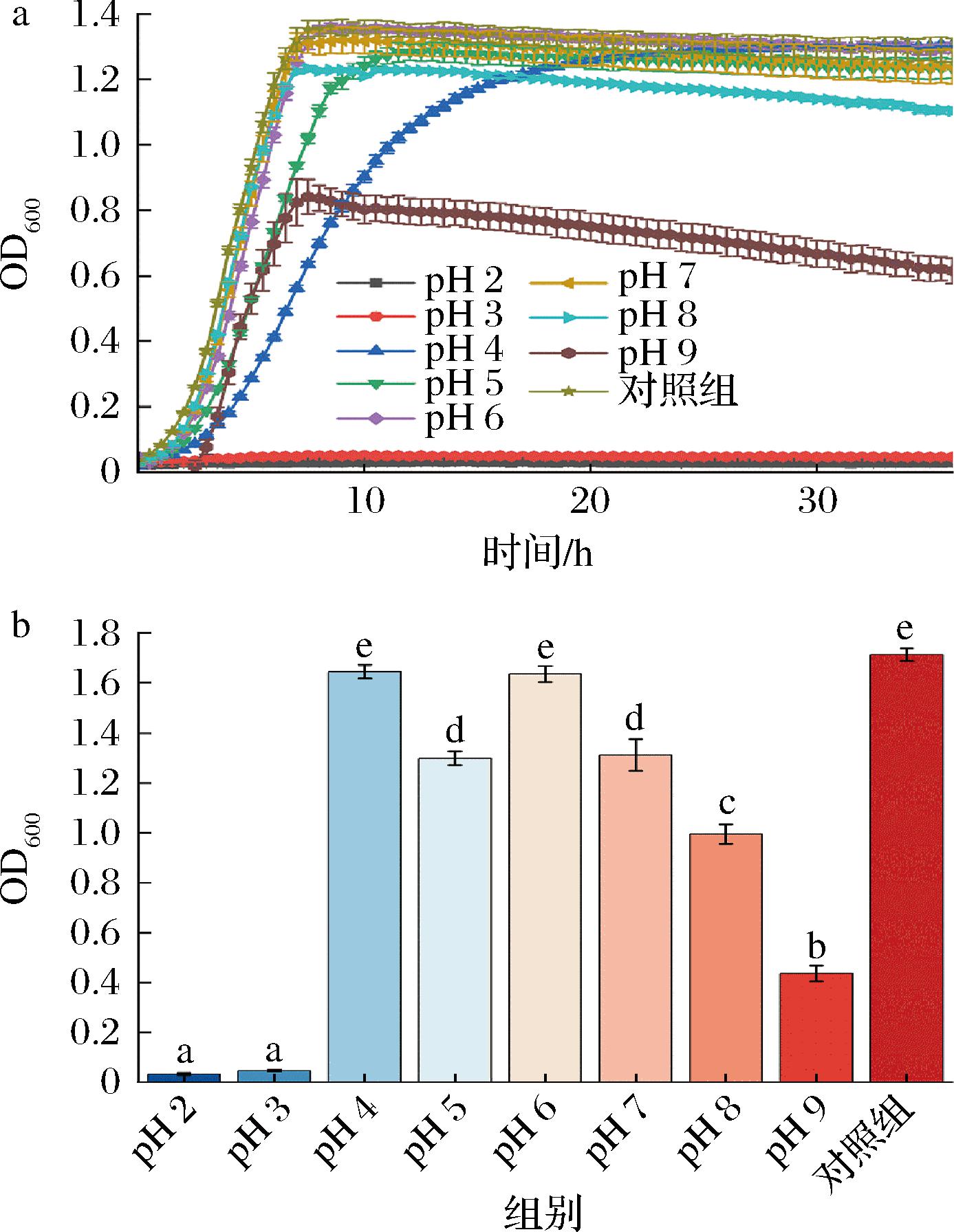
a-生长曲线图:b-最大生物量
图3 不同pH条件对AR673生长的影响
Fig.3 Effects of different pH conditions on the growth of AR673
由表3可知拟合的最大生物量与图3-a生长曲线图最大生物量相一致,且在pH 4.0~7.0最大比生长速率依次增加。结果表明AR673在中性至弱酸性条件下生长最为旺盛。
表3 不同pH下AR673生长动力学模型拟合参数
Table 3 Fitting parameters of growth kinetic model for AR673 at different pH
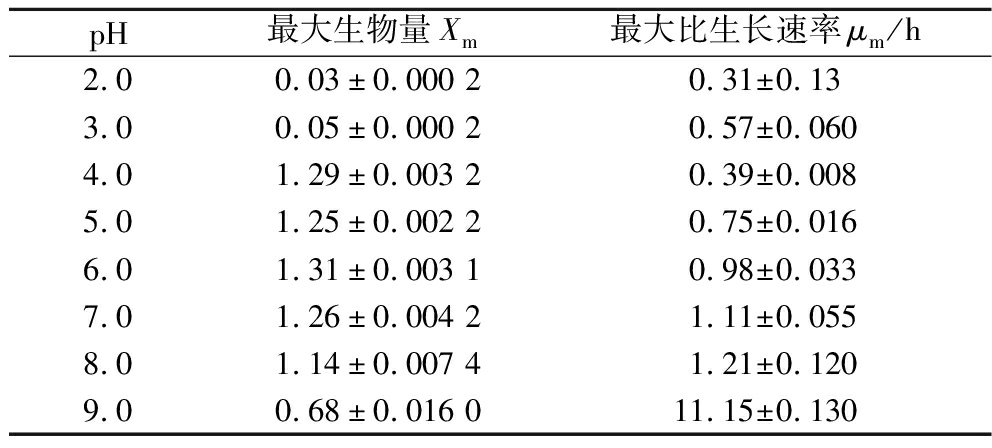
pH最大生物量Xm最大比生长速率μm/h2.00.03±0.000 20.31±0.133.00.05±0.000 20.57±0.0604.01.29±0.003 20.39±0.0085.01.25±0.002 20.75±0.0166.01.31±0.003 10.98±0.0337.01.26±0.004 21.11±0.0558.01.14±0.007 41.21±0.1209.00.68±0.016 011.15±0.130
2.3 不同碳源浓度对AR673生长情况的影响
由图4、表4可知,碳源质量浓度在5 g/L和10 g/L时,AR673虽然最先达到平稳期但其最大生物量远低于其他浓度,而碳源质量浓度在30 g/L和50 g/L时,AR673虽然得到最大生物量(2.29±0.015和2.30±0.052),但其最大比生长速率较碳源质量浓度为20 g/L时低(表4)。表明AR673在碳源浓度较低时生长受到抑制,但具有一定的耐受性,而较高的碳源浓度适宜AR673的生长。
表4 不同碳源质量浓度下AR673生长动力学模型拟合参数
Table 4 Fitting parameters of growth kinetic model for AR673 under different carbon sources concentrations

碳源质量浓度/(g/L)最大生物量Xm最大比生长速率μm/h50.53±0.013 02.14±1.120100.84±0.014 01.73±0.570201.31±0.003 11.01±0.034301.41±0.001 40.85±0.011501.41±0.002 20.67±0.012
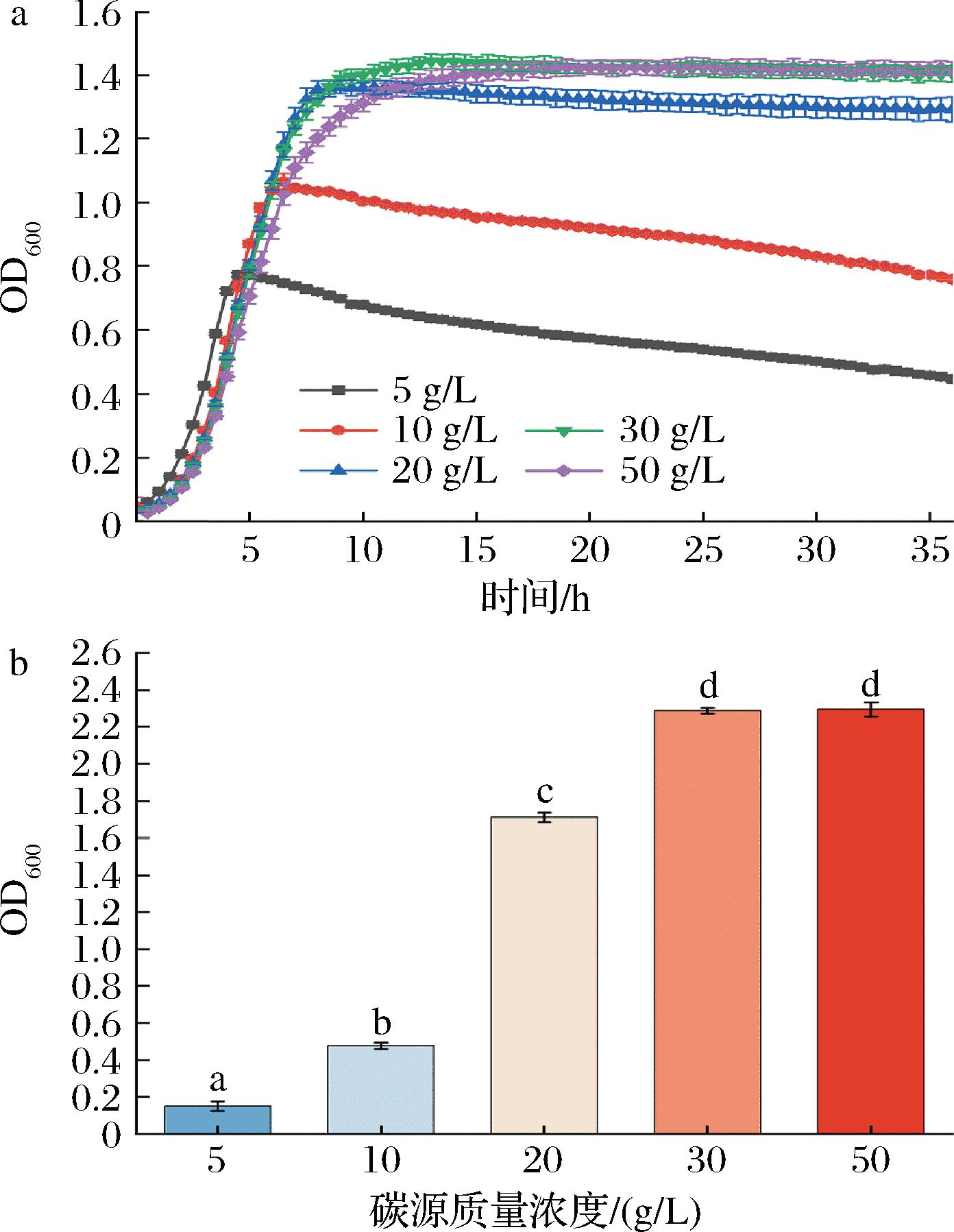
a-生长曲线图:b-最大生物量
图4 不同碳源质量浓度对AR673生长的影响
Fig.4 Effects of different concentration of carbon sources on the growth of AR673
2.4 不同温度对AR673生长情况的影响
如图5所示,37 ℃培养下,AR673达到稳定期后获得最大生物量(2.01±0.031),由生长曲线图及其模型拟合参数(表5)可知,在42 ℃培养下,AR673最先达到平稳期。
表5 不同温度下AR673生长动力学模型拟合参数
Table 5 Fitting parameters of growth kinetic model for AR673 at different temperatures

温度/℃最大生物量Xm最大比生长速率μm/h371.15±0.0340.66±0.097401.14±0.0130.69±0.050421.12±0.0130.75±0.062
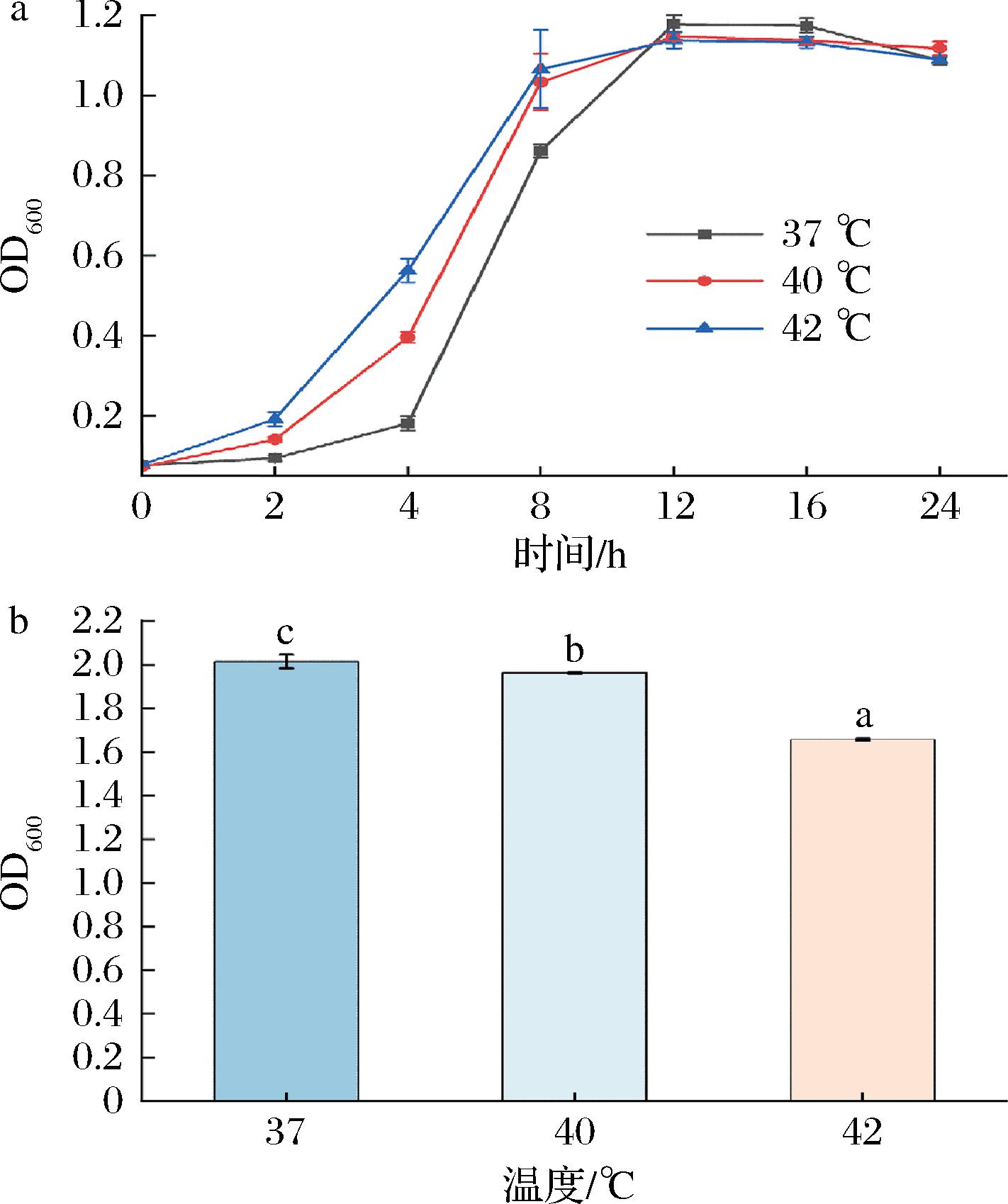
a-生长曲线图:b-最大生物量
图5 不同温度对AR673生长的影响
Fig.5 Effects of different temperatures on the growth of AR673
2.5 不同胆盐质量浓度对AR673生长情况的影响
如图6、表6所示,添加了不同质量浓度的胆盐后AR673生长速率变缓,且达到稳定期后生物累积量较空白对照减少。对达到稳定期后的生物累积量进行差异性分析发现添加质量浓度为2、3 g/L的胆盐后其最大生物量与空白对照无显著差异,表明AR673具有一定的胆盐耐受性。
表6 不同胆盐质量浓度下AR673生长动力学模型拟合参数
Table 6 Fitting parameters of growth kinetic model for AR673 under different bile salt concentrations
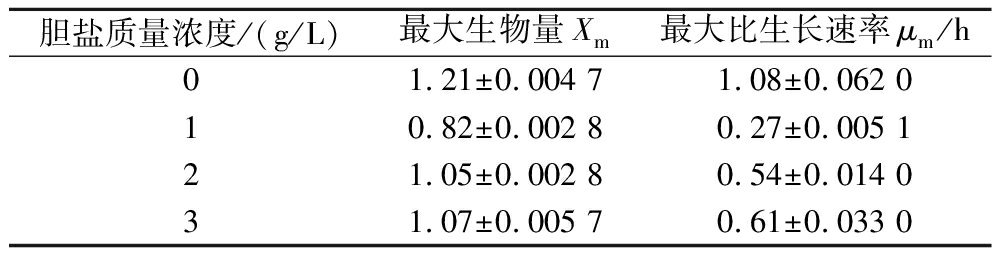
胆盐质量浓度/(g/L)最大生物量Xm最大比生长速率μm/h01.21±0.004 71.08±0.062 010.82±0.002 80.27±0.005 121.05±0.002 80.54±0.014 031.07±0.005 70.61±0.033 0
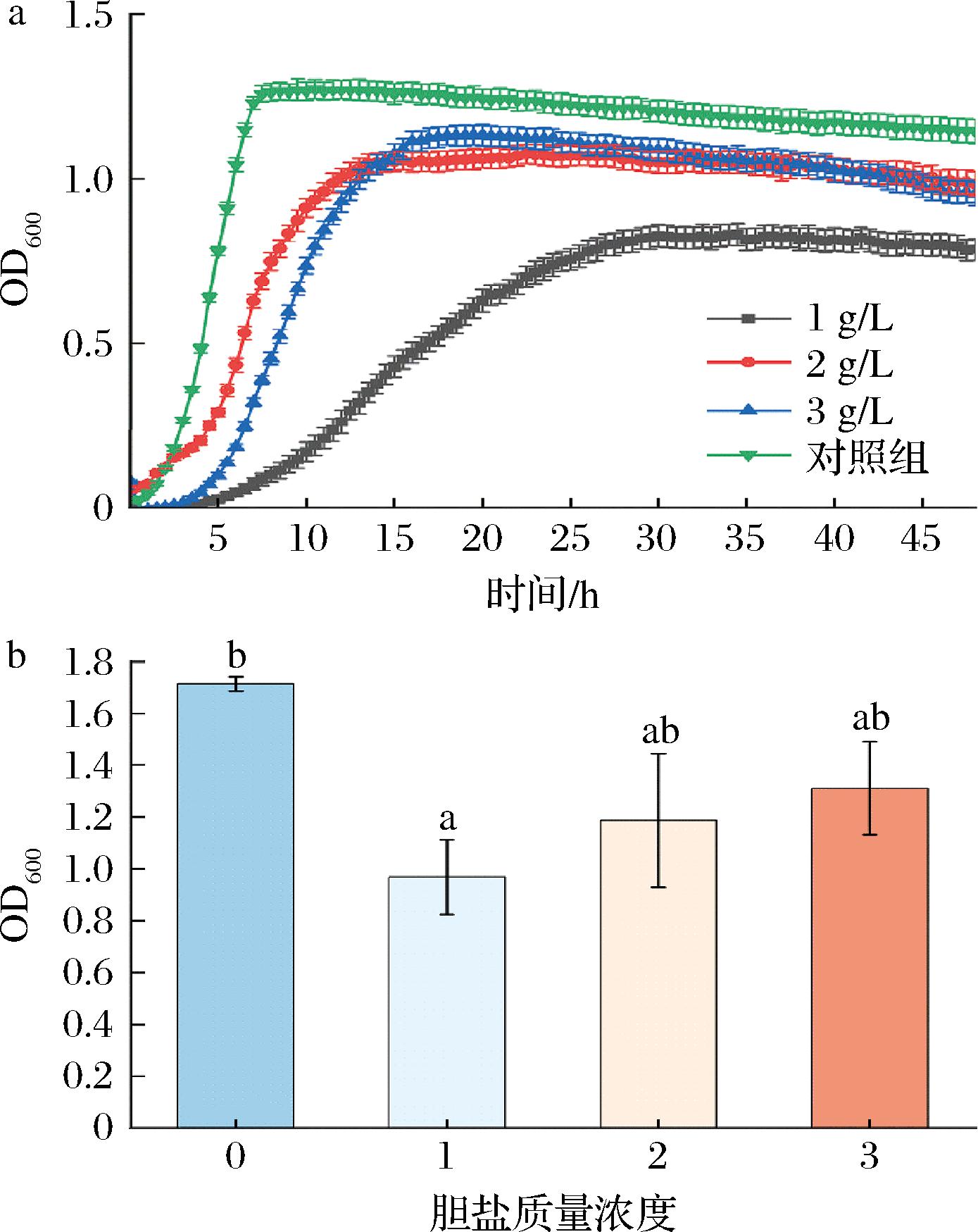
a-生长曲线图:b-最大生物量
图6 不同胆盐质量浓度对AR673生长的影响
Fig.6 Effects of different bile salt concentrations on the growth of AR673
3 讨论与结论
乳酸菌作为一种能够发酵乳糖产生乳酸的微生物,其在自然界中广泛存在。乳酸菌不仅对人体健康具有显著的益处,其独特的益生特性也使得乳酸菌被广泛应用于食品工业、医药、饲料和精细化工等多个领域。然而乳酸菌在生产和应用过程中经常面临着各种环境胁迫。
乳酸菌可发酵产生乳酸从而降低生长环境的pH,而pH的变化会影响菌体的发酵能力及其代谢产物的产生[14]。胆盐耐受能力是检验乳酸菌在人体肠道中能否存活的指标之一,也是被作为乳酸菌益生性能的重要评价指标之一,其具有杀菌作用,不仅会破坏细胞壁,还会使DNA氧化受损[15]。吕嘉枥等[16]研究乳酸菌生长的最适pH值范围在5.0~7.0,且高酸环境下会抑制乳酸菌的生长。罗伊氏粘液乳杆菌AR673在pH 2.0和pH 3.0时几乎不生长,在pH 4.0~9.0能生长,且在pH 4.0和pH 6.0时AR673的生物累积量最大,分别达到1.64±0.027和1.63±0.032,表明AR673具有较强的pH耐受性,且在中性至弱酸性条件下生长最为旺盛。AR673在胆盐质量浓度为2 g/L和3 g/L时最大生物量与空白对照无显著差异,而在1 g/L时最大生物量显著降低,表明在一定范围内,提高胆盐质量浓度有利于AR673生物量积累,推测适当压力可提高AR673细胞活力。有研究表明乳酸菌可产生胆盐水解酶水解胆盐,从而改变胆盐特性,使得乳酸菌具有一定的胆盐耐受性[17]。王国宏[18]研究表明唾液乳杆菌可通过表达特定的胆盐抗性基因来抵抗肠道中的胆盐胁迫。表明AR673对胆盐的耐受性可能与其自身的胆盐抗性基因有关。
菌体细胞均有最适生长温度,温度太高会引起蛋白的降解,进而引起核糖体和RNA等一些大分子物质的不稳定,并且细胞膜流动性也会发生改变[19]。研究表明,乳酸菌的最适生长温度一般在30~45 ℃[20]。刘栋等[21]研究发现罗伊氏粘液乳杆菌LT018的最佳培养温度为37 ℃。AR673在37 ℃环境下达到稳定期后生物累积量最高,达到2.01±0.031,而在40 ℃和42 ℃时最大生物量略低,表明AR673对温度具有一定的耐受性,且其最适生长温度为37 ℃。
细菌在繁殖的过程中,如果不能及时补给营养物质,便会导致菌体进入饥饿状态,从而引发营养胁迫现象。而导致乳酸菌产生营养胁迫的主要原因包括碳源胁迫、磷酸盐胁迫、氮源胁迫,而碳源胁迫会使其能量耗尽[22]。AR673在葡萄糖质量浓度较低(5、10 g/L)时能生长但受到抑制,提高葡萄糖浓度有利于生物量积累,当葡萄糖质量浓度达到50 g/L时,AR673最大生物量达到2.30±0.052。表明AR673对碳源胁迫具有一定的耐受性,碳源质量浓度低时AR673可能受碳源限制从而生长受到抑制,而高质量浓度碳源可能会对细胞造成渗透压胁迫或者其他形式的代谢负担。
不同碳源对乳酸菌生长和生物量积累的影响显著。乳酸菌能够利用多种碳源,包括葡萄糖、乳糖、半乳糖、麦芽糖、甘露糖、阿拉伯糖、蔗糖和果糖等[23]。每种乳酸菌对碳源的偏好不同,例如,某些菌株可能优先利用葡萄糖,而其他菌株可能更偏好乳糖或半乳糖[24]。这种偏好性对于食品工业中的发酵过程至关重要,因为它可以影响发酵产品的味道、质地和保质期。AR673对葡萄糖的利用率最高(97.91%),表明它能够有效地利用葡萄糖作为碳源进行生长,与许多乳酸菌的特性相符。葡萄糖是自然界中最常见的糖类,也是许多微生物首选的碳源。乳糖和蔗糖的利用率也相对较高,分别为92.21%和89.76%,表明AR673能够适应多种碳源环境。在乳制品发酵中,乳糖是主要的碳源,因此AR673的这一特性可能使其在乳制品工业中具有潜在的应用价值。
罗伊氏粘液乳杆菌作为益生菌,对人体健康具有多种益处,其除了能调节肠道菌群平衡、抑制有害菌增殖、促进有益菌群生长、增强免疫力、调节炎症因子之外,还可以作为益生菌制剂和添加剂等广泛应用于食品工业。本研究探讨了AR673在不同环境下的耐受能力以及对不同碳源的利用情况,结果显示AR673对多种碳源有良好的利用能力,且对pH、温度、碳质量浓度、胆盐质量浓度等胁迫环境具有一定的耐受性。本研究为罗伊氏粘液乳杆菌的环境耐受性研究和发酵生产优化提供了数据基础,同时为该菌株在益生菌应用和食品工业中的潜在用途提供了科学依据。
[1] SINGH T P, KAUR G, MALIK R K, et al.Characterization of intestinal Lactobacillus reuteri strains as potential probiotics[J].Probiotics and Antimicrobial Proteins, 2012, 4(1):47-58.
[2] 庞洁, 周娜, 刘鹏, 等.罗伊氏乳杆菌的益生功能[J].中国生物工程杂志, 2011, 31(5):131-137.PANG J, ZHOU N, LIU P, et al.Beneficial effects of Lactobacillus reuteri to human and animals[J].China Biotechnology, 2011, 31(5):131-137.
[3] 黄金秀, 王琪, 肖融, 等.罗伊氏乳杆菌调节仔猪肠道黏膜免疫功能的研究进展[J].动物营养学报, 2020, 32(6):2454-2459.HUANG J X, WANG Q, XIAO R, et al.Research advance in regulation of intestinal mucosal immune in piglets by Lactobacillus reuteri[J].Chinese Journal of Animal Nutrition, 2020, 32(6):2454-2459.
[4] 李少慧, 张英春, 张兰威, 等.乳酸菌及其代谢产物对肠道炎症的调控作用研究进展[J].食品工业科技, 2014, 35(18):366-369.LI S H, ZHANG Y C, ZHANG L W, et al.Rescarch progress in lactic acid bacteria and its metabolites regulation on intestinal inflammation[J].Science and Technology of Food Industry, 2014, 35(18):366-369.
[5] CHEN C, LI H J.The inhibitory effect of gut microbiota and its metabolites on colorectal cancer[J].Journal of Microbiology and Biotechnology, 2020, 30(11):1607-1613.
[6] SPINLER J K, TAWEECHOTIPATR M, ROGNERUD C L, et al.Human-derived probiotic Lactobacillus reuteri demonstrate antimicrobial activities targeting diverse enteric bacterial pathogens[J].Anaerobe, 2008, 14(3):166-171.
[7] NGUYEN P T, NGUYEN H T.Environmental stress for improving the functionality of lactic acid bacteria in malolactic fermentation[J].The Microbe, 2024, 4:100138.
[8] 陈霞, 杨振泉, 黄玉军, 等.乳酸菌环境胁迫应激的分子调控机制研究进展[J].中国乳品工业, 2011, 39(1):34-37; 58.CHEN X, YANG Z Q, HUANG Y J, et al.Research on the molecular mechanism of lactic acid bacteria’s responses to environmental stress[J].China Dairy Industry, 2011, 39(1):34-37; 58.
[9] 尤元丽. 提高乳酸菌环境胁迫抗性的研究[D].合肥:安徽农业大学, 2015.YOU Y L.Study on improving the environmental stress resistance of lactic acid bacteria[D].Hefei:Anhui Agricultural University, 2015.
[10] PETRUT S, RUSU E, TUDORACHE I S, et al.Influence of various carbon sources on growth and biomass accumulation of some lactic acid bacteria strains[J].Revista de Chimie, 2019, 70(7):2434-2438.
[11] 王佳, 郑诗琪, 冯鑫, 等.植物乳植杆菌AR113利用碳源情况研究[J].食品与发酵工业, 2023, 49(11):1-6.WANG J, ZHENG S Q, FENG X, et al.Research of carbon source utilization by Lactiplantibacillus plantarum AR113[J].Food and Fermentation Industries, 2023, 49(11):1-6.
[12] 汤立, 李雪平.碳源对乳酸菌生长的影响[J].中国饲料添加剂, 2020(10):41-42.TANG L, LI X P.The effects of carbon sources on the growth of lactic acid bacteria[J].China Feed Additive, 2020(10):41-42.
[13] 杨勇. 黄麻链霉菌AUH-1的分离筛选及其拮抗植物病原真菌的活性评价和作用机理研究[D].南昌:江西农业大学,2019.YANG Y.Isolation and screening of Streptomyces corchorusii AUH-1 and study on its activity evaluation and antagonistic mechanism against phytopathogenie fungi[D].Nanchang:Jiangxi Agricultural University, 2019.
[14] 吴重德, 黄钧, 周荣清.调控乳酸菌酸胁迫抗性研究进展[J].微生物学报, 2014, 54(7):721-727.WU C D, HUANG J, ZHOU R Q.Regulating acid stress resistance of lactic acid bacteria-a review[J].Acta Microbiologica Sinica, 2014, 54(7):721-727.
[15] 骆海龙, 张安杰, 邱雪梅, 等.肠道细菌适应胆盐胁迫的机制研究进展[J].湖北医药学院学报, 2020, 39(5):510-515.LUO H L, ZHANG A J, QIU X M, et al.Research progress on the mechanism of intestinal bacteria adapting to bile salt stress[J].Journal of Hubei University of Medicine, 2020, 39(5):510-515.
[16] 吕嘉枥, 伍金金, 周冰洋, 等.酸和盐胁迫对乳酸菌活性的影响[J].中国酿造, 2020, 39(10):90-95.LYU J L, WU J J, ZHOU B Y, et al.Effect of acid and salt stress on lactic acid bacteria growth[J].China Brewing, 2020, 39(10):90-95.
[17] 赵亚荣, 张文羿, 孙天松.乳酸菌环境胁迫应答分子机制研究进展[J].中国乳品工业, 2014, 42(4):42-45.ZHAO Y R, ZHANG W Y, SUN T S.Research on the molecular mechanisms of lactic acid bacteria responding to environmental stress[J].China Dairy Industry, 2014, 42(4):42-45.
[18] 王国宏. 唾液乳杆菌Ren抗胆盐胁迫反应机制及转录因子TF0225在胆盐胁迫应激中的作用[D].北京:中国农业大学, 2015.WANG G H.The bile stress response mechanism and the functional role of transcription factor TF0225 in bile stress response in Lactobacillus salivarius Ren[D].Beijing:China Agricultural University, 2015.
[19] MOON S, HAM S, JEONG J, et al.Temperature matters:Bacterial response to temperature change[J].Journal of Microbiology, 2023, 61(3):343-357.
[20] 陈梓琦, 汪彩云, 李紫宁, 等.乳酸菌的生长特性及其功能性质与应用综述[J].农产品加工, 2020(12):80-83.CHEN Z Q, WANG C Y, LI Z N, et al.A review of the growth characteristics, functional properties and applications of lactic acid bacteria[J].Farm Products Processing, 2020(12):80-83.
[21] 刘栋, 胡亚民, 刘洪吉, 等.罗伊氏乳杆菌LT018高密度培养生长因素的研究[J].食品工业科技, 2016, 37(21):144-149.LIU D, HU Y M, LIU H J, et al.Research of growth factors in high cell-density culture of Lactobacillus reuteri LT018[J].Science and Technology of Food Industry, 2016, 37(21):144-149.
[22] GUAN N Z, LI J H, SHIN H D, et al.Microbial response to environmental stresses:From fundamental mechanisms to practical applications[J].Applied Microbiology and Biotechnology, 2017, 101(10):3991-4008.
[23] WANG Y Q, WU J T, LYU M X, et al.Metabolism characteristics of lactic acid bacteria and the expanding applications in food industry[J].Frontiers in Bioengineering and Biotechnology, 2021, 9:612285.
[24] 徐洪伟, 鞠红梅, 孙琪, 等.小分子肽产生菌培养基碳源与氮源的优化[J].中国卫生检验杂志, 2011, 21(8):1931-1932; 1935.XU H W, JU H M, SUN Q, et al.Optimization of carbon sources and nitrogen sources in ferment culture medium of bacterium producing small molecular antibacterial peptides[J].Chinese Journal of Health Laboratory Technology, 2011, 21(8):1931-1932; 1935.