继粮食、蔬菜、油料、果树后,食用菌是中国农业种植中的第五大产业。食用菌在中国的产量约占全球产量78%以上,属全球领先[1]。其中,双孢菇味道鲜美,肉质肥厚,热量低,是高蛋白和低脂肪的绿色健康食品,对人类健康有益[2]。双孢菇的营养价值和研究价值极为可观,双孢菇蛋白质(Agaricus bisporus protein,ABP)作为一种优质蛋白具有极大的开发潜力。双孢菇中蛋白质含量高,氨基酸种类丰富,然而天然蛋白由于疏水氨基酸较多,导致溶解度较低,限制了其在食品领域中的加工应用。对蛋白质进行修饰处理可在一定程度上提高其功能特性(如溶解度)[3]。蛋白质的改性方法有化学改性、物理改性、酶法改性以及复合改性,其中化学改性效率高、成本低、操作简易且应用范围广。常见的化学改性有脱酰胺、磷酸化、酰基化、糖基化,其中脱酰胺是将谷氨酰胺和天冬酰胺残基的酰胺基团转化为蛋白质内的羧基[4],从而改变蛋白质表面的电荷分布,减少分子间和分子内氢键,形成新共价键的过程,是一种安全的改性方法。孟俊龙等[5]采用脱酰胺法对刺芹侧耳蛋白进行修饰处理,结果显示酸法脱酰胺可以有效改善蛋白的功能性质和体外消化水平。磷酸化被认为是植物蛋白的一种有效化学修饰方法,其原理是将磷酸基团引入蛋白质的一级序列,通过磷酸基团的加入,蛋白质的负电荷和水合作用增加,其功能性质也会得到改善[6]。
本研究旨在通过对提取出的蛋白质进行脱酰胺和磷酸化修饰处理,解析其结构、理化性质和功能特性,为提高ABP在食品领域的深入研究和应用提供一定的思路和理论依据。
1 材料和方法
1.1 材料和仪器
双孢菇(As2796),君途生鲜专营店;EDTA,国药集团化学试剂有限公司;三聚磷酸钠,上海麦克林生化科技股份有限公司;CuSO4,阿拉丁试剂(上海)有限公司;KCl,上海源叶生物科技有限公司;5,5′-二硫代双-(2-硝基苯甲酸)[5,5′-Dithiobis-(2-nitrobenzoic acid),DTNB],合肥千盛生物科技有限公司;3 500 Da透析袋,Biosharp生物科技有限公司。化学药剂均为分析纯。
BP301S 电子分析天平,深华生物技术有限公司;PHS-3C pH计,上海雷磁科学仪器;Eppendorf 高速离心机,德国Eppendorf有限责任公司;CHRIST ALPHA 2-4 LD 真空冷冻干燥机,德国Pfeiffer Vacuum公司;μQuant 酶标仪,山东博科生物产业有限公司;Nicolet iS 10 傅里叶变换红外光谱仪,赛默飞世尔科技有限公司;800Y 手提式高速粉碎机,永康市铂欧五金制品有限公司;DF-101S 集热式恒温加热磁力搅拌器,上海予华仪器设备有限公司;MS 2000激光衍射粒度分布分析仪,马尔文仪器有限公司。
1.2 实验方法
1.2.1 ABP的提取
参考马德坤等[7]的方法提取ABP。将蒸馏水与双孢菇脱脂粉按照25∶1(mL∶g)的液料比进行混合,用2 mol/L NaOH溶液调节pH值至11,69 ℃提取64 min并在273 W超声波处理,4 ℃、8 000 r/min离心30 min,得到上清液和沉淀,用2 mol/L的HCl溶液调节上清液的pH值为4.3,在4 ℃静置12 h,8 000 r/min离心30 min后得到蛋白沉淀,将沉淀进行真空冷冻干燥可得到ABP。提取条件通过响应面优化得到,详见电子版增强出版附件(https://doi.org/10.13995/j.cnki.11-1802/ts.041460)。
1.2.2 ABP的改性处理
1.2.2.1 脱酰胺改性
参考LI等[8]的方法对ABP进行脱酰胺处理得到脱酰胺改性蛋白(deamidated Agaricus bisporus protein, d-ABP)。准确称取5 g蛋白质粉末,将其分散于100 mL 0.3 mol/L的酸溶液中,磁力搅拌30 min后,于85 ℃水浴锅中反应3 h。反应结束后快速冷却至室温,调pH至中性,采用截留分子质量3 500 Da透析袋在4 ℃条件下透析48 h,于-40 ℃冷冻干燥得到d-ABP。
1.2.2.2 磷酸化改性
参考李娇等[9]的方法对ABP进行磷酸化改性得到磷酸化改性蛋白(phosphorylated Agaricus bisporus protein, p-ABP)。准确称取3 g三聚磷酸钠溶于pH 7的0.05 mol/L PBS中,调节pH值为9,得到三聚磷酸钠溶液,然后边搅拌边加入5 g蛋白质,25 ℃搅拌反应1.5 h,调pH值为7后,8 000 r/min离心20 min,取沉淀,将沉淀冷冻干燥后得到p-ABP。
1.2.3 粒径分析
参考SUN等[10]的方法,使用激光衍射粒度分布分析仪测量蛋白样品的粒度。将每个蛋白质样品分散在去离子水中,配制质量分数0.1%的样品,使蛋白质颗粒在水中均匀分散,然后根据颗粒散射的激光衍射分析蛋白质颗粒。
1.2.4 巯基和二硫键含量
参考SHEN等[11]的方法测定。取3 mL 5 mg/mL的蛋白质溶液加入27 mL 0.05 mol/L的PBS,加入3 mL 10 mmol/L DTNB溶液,室温下避光反应30 min,在412 nm处测定吸光度。总巯基含量、游离巯基含量、二硫键含量分别按公式(1)~公式(3)计算:
(1)
(2)
(3)
式中:TSH,总巯基含量,mmol/L;A,412 nm处吸光度值;D,稀释倍数;C,蛋白质质量浓度,mg/mL;FSH,游离巯基含量,mmol/L;SS,二硫键含量,mmol/L。
1.2.5 表面疏水性(surface hydrophobicity, SH)
参考ZHANG等[12]的方法测定。用PBS配制蛋白溶液5 mg/mL,室温条件下,将1 mL样品和200 mL 1 mg/mL溴酚蓝溶液装入离心管中,振荡10 min后,8 000 r/min离心10 min。取1 mL上清液与9 mL PBS混合并稀释10倍,置于595 nm波长下测定吸光度,用磷酸盐缓冲液代替空白,按公式(4)计算表面疏水性:
(4)
式中:SH,表面疏水性,由溴酚蓝结合量表示,μg;A空白,空白样品吸光度值;A样品,样品吸光度值。
1.2.6 傅立叶红外光谱(Fourier transform infrared spectroscopy, FTIR)分析
参考XIE等[13]的方法,将蛋白质样品与KBr以质量比1∶100在研钵中充分研磨,压片,以 KBr为背景。参数设置:分辨率4 cm-1,迭代32次,在400~4 000 cm-1波数下进行蛋白质的FTIR分析,使用PeakFit 4.12对红外数据进行分峰拟合处理,经过残差、二阶导数和解卷积计算得到蛋白质二级结构含量值。
1.2.7 溶解度
参考YANG等[14]的方法,将蛋白质样品分散在蒸馏水中,室温下磁力充分搅拌,使用1 mol/L HCl或NaOH溶液将蛋白质分散体分别调节至不同的pH,用磁力搅拌器搅拌30 min,8 000 r/min离心15 min得到上清液。上清液通过适当稀释后采用Bradford蛋白质定量测定法在595 nm处进行测定。蛋白质溶解度计算如公式(5)所示:
(5)
式中:S,蛋白质溶解度,g/g;c1,上清液的蛋白质含量,g;c2,样品中的蛋白质含量,g。
1.2.8 乳化性和乳化稳定性
乳化性和乳化稳定性使用比浊法测定[15]。将0.3 g蛋白质样品分散在30 mL PBS(0.2 mol/L,pH 7)中。然后,将分散体的pH值调节至3~10。将7 mL大豆油和21 mL蛋白质溶液混合并均质化(10 000 r/min,2 min,25 ℃)。均质结束后,从离心管底部取出等分的乳液(50 μL),并与SDS 溶液(0.1%,5 mL)充分混合,涡旋3 s,在500 nm波长下测定吸光度(A0)。乳化性能的计算如公式(6)、公式(7)所示:
乳化性![]()
(6)
乳化稳定性![]()
(7)
式中:A0,均质后测定的吸光值;DF,稀释倍数,100;c,稀释前样品蛋白质浓度;φ,乳液的油相体积分数,0.25;EAI10,10 min后蛋白质的乳化性,m2/g;ESI0,0 min时蛋白质的乳化性,m2/g。
1.2.9 起泡性及起泡稳定性
参考MALOMO等[16]方法测定。将蛋白质样品(0.15 g)分散在15 mL去离子水中,并用HCl或NaOH溶液调节pH值范围为3~10。使用均质器将分散体均质化(10 000 r/min,2 min,25 ℃),并在10 min时记录其体积。起泡性能的计算如公式(8)、公式(9)所示:
起泡性![]()
(8)
起泡稳定性![]()
(9)
式中:V0,初始泡沫体积,mL;V1,记时开始时泡沫体积,mL;V2,10 min时泡沫体积,mL。
1.3 数据处理
所有试验均重复3次进行,数据表示为“平均值±标准差”。使用软件SPSS 26进行方差分析(analysis of variance,ANOVA),采用图基法对数据进行显著性分析,P<0.05。利用Origin 2021、OMNIC、Peakfit 4.12等软件进行绘图。
2 结果与分析
2.1 结构分析
如表1所示,脱酰胺处理的ABP均值粒径(42.11 mm)显著低于对照组ABP均值粒径(62.37 mm),而磷酸化ABP均值粒径与对照组无显著差异。脱酰胺处理使蛋白质分子出现抗聚集现象,蛋白质分子链伸展,蛋白质局部疏水性改变,并通过破坏蛋白质的疏水作用影响其空间结构,从而影响蛋白质的粒径[17]。
表1 双孢菇蛋白粒径、巯基含量及表面疏水性
Table 1 Particle size, sulfhydryl content, and surface hydrophobicity of ABP
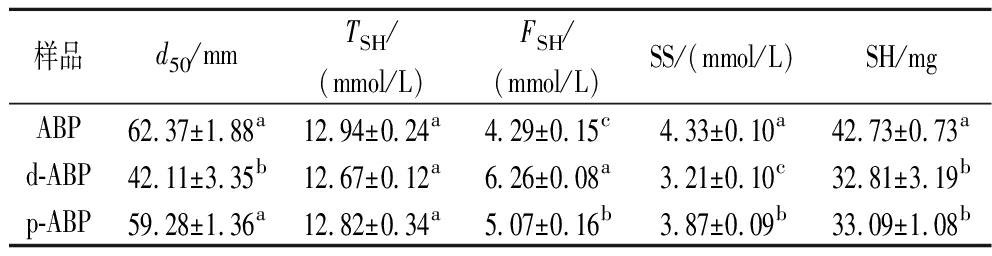
样品d50/mmTSH/(mmol/L)FSH/(mmol/L)SS/(mmol/L)SH/mgABP62.37±1.88a12.94±0.24a4.29±0.15c4.33±0.10a42.73±0.73ad-ABP42.11±3.35b12.67±0.12a6.26±0.08a3.21±0.10c32.81±3.19bp-ABP59.28±1.36a12.82±0.34a5.07±0.16b3.87±0.09b33.09±1.08b
注:不同小写字母表示同列数据差异显著(P<0.05)(下同)。
ABP总巯基含量经过改性处理后无显著性差异变化,而游离巯基含量经过改性处理后显著增加,二硫键含量显著降低。二硫键可以保持蛋白质构象稳定,二硫键断裂会导致蛋白质结构展开,分子内的巯基暴露[18]。游离巯基含量的增加可以提高蛋白质的溶解度,影响蛋白质的结构和性质[19]。脱酰胺和磷酸化处理后ABP表面疏水性均降低,与未处理组有显著性差异。脱酰胺反应会使疏水的酰胺基团形成亲水性的羧基,进而降低蛋白质的表面疏水性,而磷酸化改性可以降低蛋白质表面疏水残基含量,增加亲水基团含量,表现为蛋白质表面疏水性降低[20-21]。
2.2 FTIR
FTIR可用于分析蛋白质的官能团和二级结构[22]。由图1可知,磷酸化处理后酰胺A区振动减弱,羟基含量明显降低,而O—H、N—H拉伸振动可能会引起该区特征吸收峰变化,磷酸基团的加入也会导致—OH拉伸振动的变形[23]。1 631 cm-1可能为谷氨酰胺吸收峰,脱酰胺处理组该峰向右偏移,说明脱酰胺可能会引起谷氨酰胺侧链之间氢键的变化[24]。酰胺I的特征吸收峰(1 700~1 600 cm-1)是由C![]() O和C—N的拉伸引起的,其中出现在1 600~1 640 cm-1波段的为β-折叠、出现在1 640~1 650 cm-1波段的为无规则卷曲、出现在1 650~1 660 cm-1波段的为α-螺旋、出现在1 660~1 700 cm-1波段的为β-转角,通常可以反映蛋白质的二级结构[25]。磷酸化处理的蛋白质在894 cm-1左右产生尖锐的吸收峰,该峰由P—O拉伸振动产生,为PO43-基团的特征吸收峰[26],表明三聚磷酸钠与ABP分子发生反应,ABP分子结合了磷酸基团。
O和C—N的拉伸引起的,其中出现在1 600~1 640 cm-1波段的为β-折叠、出现在1 640~1 650 cm-1波段的为无规则卷曲、出现在1 650~1 660 cm-1波段的为α-螺旋、出现在1 660~1 700 cm-1波段的为β-转角,通常可以反映蛋白质的二级结构[25]。磷酸化处理的蛋白质在894 cm-1左右产生尖锐的吸收峰,该峰由P—O拉伸振动产生,为PO43-基团的特征吸收峰[26],表明三聚磷酸钠与ABP分子发生反应,ABP分子结合了磷酸基团。
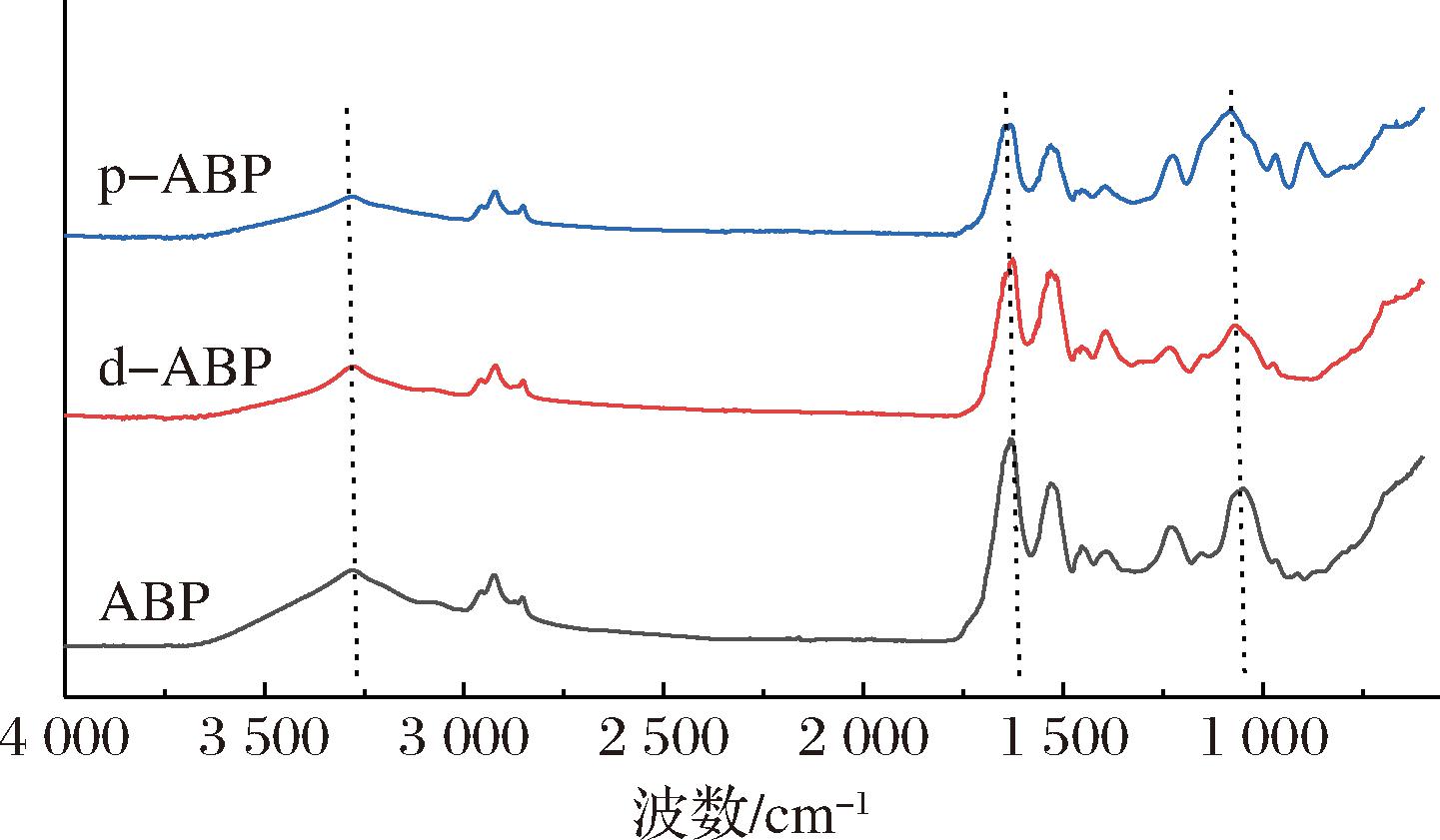
图1 傅里叶红外光谱图
Fig.1 FTIR pattern
拟合计算出二级结构含量如表2所示。β-折叠是有序的蛋白质结构,其含量高表明蛋白质稳定性好,α-螺旋、β-转角是无序的蛋白质结构,较易发生改变,其含量高表明蛋白质的结构相对灵活[27]。由结果可知,脱酰胺和磷酸化处理的蛋白质β-折叠含量降低,说明蛋白质的稳定性下降。脱酰胺和磷酸化处理的蛋白α-螺旋含量增加,说明改性处理使ABP结构相对灵活,且磷酸化处理结果较未处理组有显著性差异,原因是磷酸化处理过程中的—OH和—COOH在一定程度上会破坏β-折叠结构,并与α-螺旋和β-转角之间互相转化[28]。
表2 双孢菇蛋白质二级结构组成
Table 2 Secondary structure composition of ABP

组别α-螺旋/%β-折叠/%β-转角/%无规则卷曲/%ABP13.52±0.15b44.17±1.11a27.53±1.01b14.79±0.05bd-ABP14.73±1.23ab43.44±1.19a26.68±0.28b15.64±0.63bp-ABP16.01±0.01a36.62±0.05b30.42±0.05a16.95±0.01a
2.3 溶解度
如图2-a所示,脱酰胺和磷酸化处理均提高了ABP的溶解度,且溶解度随pH增加而不断增加。在脱酰胺的过程中盐酸释放的H+会作用于天门冬酰胺和谷氨酰胺基团生成羧基,静电斥力增强,氢键作用力减弱,蛋白质结构展开,粒径减小,不溶性高分子质量共聚体的形成减少,从而使蛋白质的溶解度增加[29]。磷酸基团易溶于水,亲水的磷酸基团会与水分子形成氢键,增加蛋白质的水合作用,且引入磷酸基团后蛋白的电负性增加,更易分散于水中[30]。

a-溶解度;b-乳化性;c-乳化稳定性;d-起泡性;e-起泡稳定性
图2 双孢菇蛋白质的功能性质
Fig.2 Functional properties of ABP
注:不同小写字母表示组间数据差异显著(P<0.05)。
2.4 乳化性和乳化稳定性
如图2-b和图2-c所示,脱酰胺和磷酸化改性明显提高了ABP的乳化性和乳化稳定性,且随pH增加而不断增加,与溶解度趋势一致。脱酰胺和磷酸化处理可以改变蛋白质亲水和疏水氨基酸的含量,使蛋白质表面疏水性降低,这在一定程度上可以阻止乳化液滴的聚集絮凝,促进蛋白质分子和油表面的相互作用,从而提高蛋白质的乳化性质[31]。磷酸化处理蛋白质更容易在两相界面吸附扩散,加快油水界面成膜速率,带负电荷的磷酸基团可以增强液滴之间的静电斥力,防止液滴聚集在一起,所以磷酸化提高ABP乳化性质效果更显著[32]。
2.5 起泡性和起泡稳定性
如图2-d和图2-e所示,ABP起泡性和起泡稳定性在pH 3~10范围内呈现出先降低后增加的趋势,与溶解度趋势一致。蛋白质的起泡性和起泡稳定性在pH 4时最低,这是因为蛋白质在等电点附近会产生大量沉淀,蛋白质与水结合减少,因此只有少量泡沫形成,此时蛋白质的稳定性也较低。脱酰胺处理蛋白较未处理组变化显著,因为脱酰胺导致蛋白质发生水解,表面疏水性降低,蛋白质或多肽的净电荷增加[33],进而使蛋白质的起泡性和起泡稳定性增加。
3 结论
本文探究了脱酰胺和磷酸化处理对ABP的结构和功能性质的影响,经过脱酰胺和磷酸化处理,蛋白质二级结构含量发生改变,d-ABP、p-ABP的均值粒径变小,表现为d-ABP [1] DE CIANNI R, PIPPINATO L, MANCUSO T.A systematic review on drivers influencing consumption of edible mushrooms and innovative mushroom-containing products[J].Appetite, 2023, 182:106454. [2] FUNDA A, NADHIM O M, ALI S M.The nutritional and medical benefits of Agaricus bisporus:A review[J].Journal of Microbiology, Biotechnology and Food Sciences, 2017, 7(3):281-286. [3] AKHARUME F U, ALUKO R E, ADEDEJI A A.Modification of plant proteins for improved functionality:A review[J].Comprehensive Reviews in Food Science and Food Safety, 2021, 20(1):198-224. [4] CAO S L, ZHENG W Y, CHEN Z P, et al.Highly efficient deamidation of wheat gluten by glucose-citric acid-based natural deep eutectic solvent:A potential effective reaction media[J].Journal of Agricultural and Food Chemistry, 2021, 69(11):3452-3465. [5] 孟俊龙, 史瑞婕, 常明昌, 等.酸法脱酰胺修饰对刺芹侧耳蛋白质消化性和功能特性的影响[J].菌物学报, 2019, 38(7):1120-1129.MENG J L, SHI R J, CHANG M C, et al.Effects of acid deamidation modification on digestibility and functional properties of Pleurotus eryngii protein[J].Mycosystema, 2019, 38(7):1120-1129. [6] NIKBAKHT NASRABADI M, SEDAGHAT DOOST A, MEZZENGA R.Modification approaches of plant-based proteins to improve their techno-functionality and use in food products[J].Food Hydrocolloids, 2021, 118:106789. [7] 马德坤, 王汝华, 吕筱, 等.亚麻籽蛋白特性及营养价值分析[J].食品科学, 2022, 43(6):257-264.MA D K, WANG R H, LÜ X, et al.Physicochemical and functional properties and nutritional value of flaxseed protein[J].Food Science, 2022, 43(6):257-264. [8] LI L, YAO P.High dispersity, stability and bioaccessibility of curcumin by assembling with deamidated zein peptide[J].Food Chemistry, 2020, 319:126577. [9] 李娇, 梁雅琪, 王景雪, 等.白酒糟醇溶蛋白的磷酸化改性及功能性质[J].食品工业科技, 2023, 44(9):60-67.LI J, LIANG Y Q, WANG J X, et al.Phosphorylated modification and functional properties of prolamin from Baijiu distiller’s grains[J].Science and Technology of Food Industry, 2023, 44(9):60-67. [10] SUN M Y, MA P P, CHEN C S, et al.Physiochemical characteristics, morphology, and lubricating properties of size-specific whey protein particles by acid or ion aggregation[J].International Journal of Biological Macromolecules, 2023, 252:126346. [11] SHEN Y T, TANG X, LI Y H.Drying methods affect physicochemical and functional properties of quinoa protein isolate[J].Food Chemistry, 2021, 339:127823. [12] ZHANG F, JIANG S S, FENG X, et al.Physicochemical state and in vitro digestibility of heat treated water-soluble protein from Pacific oyster (Crassostrea gigas)[J].Food Bioscience, 2020, 34:100528. [13] XIE D F, DENG F H, SHU J X, et al.Impact of the frying temperature on protein structures and physico-chemical characteristics of fried surimi[J].International Journal of Food Science &Technology, 2022, 57(7):4211-4221. [14] YANG Y R, WU W K, HSIAO J T, et al.Combination of chemical modifications improves rice protein solubility[J].Journal of Cereal Science, 2024, 118:103939. [15] LIU Y P, HUANG C X, WANG J J, et al.Improving rehydration of egg white powder through modifying its physicochemistry properties by ultrasound-assisted glutaminase deamidation[J].Food Hydrocolloids, 2022, 133:107950. [16] MALOMO S A, ALUKO R E.A comparative study of the structural and functional properties of isolated hemp seed (Cannabis sativa L.) albumin and globulin fractions[J].Food Hydrocolloids, 2015, 43:743-752. [17] WANG Y Y, WANG C Y, WANG S T, et al.Physicochemical properties and antioxidant activities of tree peony (Paeonia suffruticosa Andr.) seed protein hydrolysates obtained with different proteases[J].Food Chemistry, 2021, 345:128765. [18] YAN S Z, XU J W, ZHANG S, et al.Effects of flexibility and surface hydrophobicity on emulsifying properties:Ultrasound-treated soybean protein isolate[J].LWT, 2021, 142:110881. [19] LIU F F, LI Y Q, WANG C Y, et al.Impact of pH on the physicochemical and rheological properties of mung bean (Vigna radiata L.) protein[J].Process Biochemistry, 2021, 111:274-284. [20] LI Y, ZHANG Z, ABBASPOURRAD A.Improving solubility and functional properties of phycocyanin under acidic conditions by glutaminase deamidation and succinylation[J].Food Hydrocolloids, 2022, 133:107994. [21] HU S, ZHU S L, LUO J, et al.Effect of extrusion on physicochemical properties and antioxidant potential of protein isolate derived from Baijiu vinasse[J].Food Chemistry, 2022, 384:132527. [22] LIU F F, LI Y Q, SUN G J, et al.Influence of ultrasound treatment on the physicochemical and antioxidant properties of mung bean protein hydrolysate[J].Ultrasonics Sonochemistry, 2022, 84:105964. [23] LEMOS P V F, OPRETZKA L C F, SANTOS ALMEIDA L, et al.Preparation and characterization of C-phycocyanin coated with STMP/STPP cross-linked starches from different botanical sources[J].International Journal of Biological Macromolecules, 2020, 159:739-750. [24] 龚燕丹. 脱酰胺耦合美拉德修饰大米蛋白的制备、功能性质及结构表征[D].杭州:浙江工业大学, 2015.GONG Y D.Preparation, functionality and structure of rice protein modified with deamidation and maillard reaction[D].Hangzhou:Zhejiang University of Technology, 2015. [25] DAS D, PANESAR P S, SAINI C S.pH shifting treatment of ultrasonically extracted soybean meal protein isolate:Effect on functional, structural, morphological and thermal properties[J].Process Biochemistry, 2022, 120:227-238. [26] XIONG Z Y, ZHANG M J, MA M H.Emulsifying properties of ovalbumin:Improvement and mechanism by phosphorylation in the presence of sodium tripolyphosphate[J].Food Hydrocolloids, 2016, 60:29-37. [27] SHI W Y, XIE H X, OUYANG K F, et al.Enhancing the solubility and emulsion properties of rice protein by deamidation of citric acid-based natural deep eutectic solvents[J].Food Research International, 2024, 175:113762. [28] GENG X P, CUI B, LI Y, et al.Preparation and characterization of ovalbumin and carboxymethyl cellulose conjugates via glycosylation[J].Food Hydrocolloids, 2014, 37:86-92. [29] FANG L Y, XIANG H, SUN-WATERHOUSE D, et al.Enhancing the usability of pea protein isolate in food applications through modifying its structural and sensory properties via deamidation by glutaminase[J].Journal of Agricultural and Food Chemistry, 2020, 68(6):1691-1697. [30] CHEN J Y, REN Y X, ZHANG K S, et al.Site-specific incorporation of sodium tripolyphosphate into myofibrillar protein from mantis shrimp (Oratosquilla oratoria) promotes protein crosslinking and gel network formation[J].Food Chemistry, 2020, 312:126113. [31] 董世荣, 王丽, 高昂, 等.脱酰胺对玉米醇溶蛋白乳化特性和结构的影响[J].食品与发酵工业, 2020, 46(17):67-72.DONG S R, WANG L, GAO A, et al.The effect of deamidation on the emulsifying properties and structure of zein[J].Food and Fermentation Industries, 2020, 46(17):67-72. [32] XIONG W F, WANG Y T, ZHANG C L, et al.High intensity ultrasound modified ovalbumin:Structure, interface and gelation properties[J].Ultrasonics Sonochemistry, 2016, 31:302-309. [33] MEENMANEE S, RATTANANUKROM A, THAIPHANIT S, et al.Improvement of solubility, foaming, and emulsification properties of coconut (Cocos nucifera L.) protein by non-enzymatic deamidation[J].LWT, 2022, 153:112493.